ii
EFFECT OF BREWING PROCESS AND IN VITRO DIGESTING
CONDITION ON BLACK TEA (
Camellia sinensis
) ANTI-LIPASE
ACTIVITY
Mohammad Iqbal Bijaksana1,2, Endang Prangdimurti1,3 1)
Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO BOX 220, Bogor, West Java, Indonesia
2)
E-mail: mohammad.iqbal.bijaksana@gmail.com,3)E-mail: e_prangdimurti@yahoo.com
ABSTRACT
Recently, obesity has become a global problem that occurs not only in developed but also in developing country. One of the options to prevent obesity is by controlling bodyweight, which can be done by inhibiting the action of pancreatic lipase (anti-lipase) and resulted in reducing the absorbed lipid. Black tea is one of the food products that have anti-lipase activity. This study aims to determine the effect of time (5, 10, and 15 minutes) and temperature (70, 85, and 100 oC) of black tea brewing and in vitro digestion on lipase inhibition. The research method is divided into two stages, black tea brewing and in vitro gastrointestinal pH simulation. Beside anti-lipase activity, black tea extract is analyzed for the total phenol and condensed tannin level. The results showed that the brewing temperature, time, and the combination of them both influence the level of lipase inhibition, total phenol, and condensed tannin. Simulation of gastrointestinal pH on the extract caused decrease of lipase inhibition, total phenol, and condensed tannin level. The highest value of lipase inhibition by black tea extracts after subjected to gastrointestinal pH simulation, which show an overview of inhibition that actually occur in the small intestine, are black tea brewed at 70 °C for 5 minutes (47.91%) and 10 minutes (46.38%), and 100 oC for 15 minutes (54.23%). The activity of lipase was estimated to be inhibited by phenolic compound and condensed tannin in temperature of 70 oC brewed tea. Meanwhile, when brewed at 85 oC and 100 o
C, only condensed tannin positively correlated with lipase inhibition. Based on overall results, it can be concluded that in order to reduce the absorption of lipids is advisable to drink black tea which is brewed at 70 °C for 5 min and 10 minutes, or 100 oC for 15 minutes.
iii
MOHAMMAD IQBAL BIJAKSANA. F24080083. Pengaruh Suhu dan Waktu Penyeduhan Teh Hitam (Camellia sinensis) serta Proses Pencernaan In Vitro terhadap Aktivitas Inhibisi Lipase. Di bawah bimbingan Endang Prangdimurti. 2012.RINGKASAN
Obesitas merupakan penyakit malnutrisi yang telah menjadi permasalahan global dengan lebih dari 1/3 orang kelebihan berat badan di dunia mengalami obesitas. Di Indonesia, sekitar 50% wanita dan 30% pria dewasa mengalami kelebihan berat badan dengan masing-masing 20 dan 10 persennya menderita obesitas. Obesitas merupakan suatu keadaan dimana tubuh menyimpan energi dalam bentuk lemak secara berlebihan yang biasa ditandai dengan Indeks Massa Tubuh (IMT) lebih dari 30 kg/m2. Obesitas dapat memicu terjadinya penyakit-penyakit degeneratif seperti penyakit kardiovaskular, stroke, kanker, diabetes mellitus II, dan hipertensi.
Senyawa bioaktif pada tanaman telah banyak dilaporkan memiliki efek positif terhadap kesehatan. Karena secara alami berasal dari tanaman, senyawa tersebut lebih aman dikonsumsi, efek samping yang ditimbulkan relatif rendah, mudah didapat, dan biasanya murah. Teh merupakan tanaman yang biasa dijadikan minuman dengan cara menyeduh pucuk daunnya dengan air panas pada suhu dan waktu yang bervariasi. Teh mengandung banyak komponen bioaktif yang dilaporkan dapat mencegah obesitas dengan cara menghambat enzim penting pemecah lipid, yaitu lipase. Penelitian ini bertujuan untuk mengetahui pengaruh waktu dan suhu penyeduhan teh hitam serta proses pencernaan secara in vitro terhadap penghambatan aktivitas enzim lipase sebagai salah satu upaya untuk mengurangi penyerapan lipid.
Metode penelitian terbagi atas 2 tahap yaitu pembuatan ekstrak teh hitam dan pengujian pengaruh simulasi pH pencernaan in vitro. Pembuatan ekstrak teh hitam dilakukan dengan menyeduh bubuk teh hitam menggunakan air panas pada suhu awal dan waktu penyeduhan yang berbeda, yaitu suhu 70oC, 85oC, dan 100oC selama 5, 10, dan 15 menit sehingga dihasilkan sembilan ekstrak awal yang berbeda. Sebagian ekstrak awal teh diberi perlakuan simulasi pH pencernaan dengan cara diubah pH nya menjadi pH 2 agar menyerupai pH lambung dan didiamkan selama 30 menit kemudian diubah lagi pH nya menjadi pH 6.8 agar menyerupai pH usus halus. Ekstrak awal yang telah melalui simulasi pH pencernaan disebut sebagai ekstrak teh simulasi pH pencernaan. Selanjutnya, baik terhadap ekstrak teh awal maupun ekstrak teh simulasi pH pencernaan, dilakukan beberapa analisis, yaitu pengukuran pH, analisis total fenol, analisis kadar tanin terkondensasi, analisis inhibisi enzim lipase.
iv
70oC selama 10 menit (46.38%), dan 100oC selama 15 menit (54.23%), namun masih lebih rendah dari Orlistat (62.00%).Ekstrak teh hitam yang dihasilkan mengandung jumlah total fenol berkisar 35.50-43.51 mg GAE/g berat kering. Total fenol tertinggi diperoleh dari ekstrak teh yang diseduh pada suhu 100oC selama 5 dan 15 menit, yaitu sebesar 43.51 dan 42.22 mg GAE/g berat kering. Kandungan kadar tanin terkondensasi pada ekstrak teh hitam yang dihasilkan adalah sebesar 0.352-0.429 g LE/100 g berat kering. Ekstrak hasil penyeduhan 100oC 15 menit menghasilkan kadar tanin terkondensasi tertinggi dan berbeda nyata dari ekstrak lainnya, yaitu 0.429 g LE/100 g berat kering. Berdasarkan uji korelasi, komponen fenolik dan tanin terkondensasi diduga memiliki peran dalam menghambat enzim lipase pada perlakuan suhu awal penyeduhan 70oC, sedangkan pada perlakuan suhu awal penyeduhan 85oC dan 100oC diduga yang berperan adalah tanin terkondensasi.
Berdasarkan hasil penelitian ini, dapat disimpulkan bahwa untuk menurunkan asupan kalori lemak maka disarankan meminum teh hitam yang diseduh pada suhu awal 70oC selama 5 menit dan 10 menit, atau 100oC selama 15 menit. Kondisi penyeduhan tersebut merupakan kondisi paling baik dalam menghambat aktivitas enzim lipase secara in vitro.
1
I.
PENDAHULUAN
A.
Latar Belakang
Dewasa ini, obesitas sudah menjadi suatu permasalahan global yang terjadi baik di negara maju maupun berkembang, termasuk Indonesia. Sebuah penelitian pada tahun 2007 menunjukkan bahwa sekitar 50% wanita dan 30% pria dewasa Indonesia mengalami kelebihan berat badan dengan masing-masing 20 dan 10 persennya menderita obesitas (Romling dan Qaim 2011). Permasalahan tersebut sangat memprihatinkan mengingat obesitas merupakan salah satu penyebab utama munculnya penyakit degeneratif seperti penyakit kardiovaskular, stroke, kanker, diabetes mellitus II, dan hipertensi (National Institutes of Health 1998). Penelitian yang dilakukan oleh World Health Organization (2003) menyatakan bahwa Indeks Massa Tubuh lebih dari 21 kg/m2 berkontribusi sebesar 58% terhadap resiko diabetes, 21% jantung koroner, dan 8-42% kanker, dimana Indeks Massa Tubuh penderita obesitas biasanya lebih dari 30 kg/m2 (National Institutes of Health 1998). Secara ekonomi, lebih dari 6% dari seluruh biaya kesehatan di beberapa negara berkembang dilaporkan terpakai untuk pengobatan obesitas. Secara umum, obesitas dapat disebabkan oleh pola makan seperti konsumsi karbohidrat atau lemak yang berlebihan, kurangnya aktivitas fisik, faktor genetik, maupun kondisi sosial-ekonomi. Meskipun demikian, sebagian besar penyebab obesitas yaitu tidak seimbangnya asupan energi atau kalori dengan aktivitas pemakaian kalori sehingga terjadi penimbunan kalori dalam bentuk lipid tubuh (Romling dan Qaim 2011). Tidak seimbangnya metabolisme energi tersebut ditambah asupan lipid yang berlebih dapat sangat beresiko menimbulkan obesitas. Dalam tubuh, lipid dari bahan pangan diserap dengan terlebih dahulu dipecah dengan katalisis enzim lipase pankreas. Tanpa dikatalisis oleh enzim lipase pankreas, reaksi hidrolisis lipid tidak akan terjadi dan lipid tidak dapat diserap ke dalam darah. Oleh karena itu untuk menekan dan mengontrol naiknya berat badan, akan sangat efektif untuk menurunkan penyerapan lipid dengan cara menginhibisi kerja lipase atau antilipase. Salah satu produk pangan yang diketahui memiliki aktivitas antilipase yaitu teh. Gondoin et al. (2010) mengatakan bahwa teh putih, teh hijau, dan teh hitam yang diseduh dengan air mendidih memiliki daya inhibisi terhadap enzim lipase.
Jenis teh yang biasa dikonsumsi oleh masyarakat Indonesia adalah teh hitam. Teh hitam biasa dikonsumsi dengan proses penyeduhan dimana pada daerah bahkan keluarga yang berbeda memiliki kebiasan penyeduhan teh yang berbeda pula. Proses penyeduhan diduga akan berpengaruh terhadap manfaat teh dalam kaitannya dengan aktivitas antilipase. Berdasarkan hal tersebut, penelitian ini dilakukan untuk menentukan proses penyeduhan teh hitam terbaik terhadap aktivitas penghambatan pencernaan lipid. Penelitian juga dilakukan untuk mengetahui pengaruh kondisi pencernaan secara in vitro terhadap kemampuan ekstrak teh hitam dalam penghambatan pencernaan lipid.
B.
Tujuan
2
II.
TINJAUAN PUSTAKA
A.
Teh Hitam
Kata teh berasal dari Cina. Masyarakat Cina daerah Amoy menyebut teh dengan tay sementara masyarakat daerah Kanton menyebutnya cha. Nama ini kemudian menyebar ke mancanegara dengan penyebutan yang sedikit berbeda. Orang Inggris menyebutnya tea, di daerah Spanyol diucapkan te, dan di Jerman teh disebut dengan tee. Keanekaragaman nama tersebut menunjukkan bahwa teh sudah banyak dikenal di dunia. Teh, minuman yang paling banyak dikonsumsi di dunia setelah air, diproduksi dari daun tanaman teh (Camelia sinensis). Daun teh yang diambil biasanya adalah dua sampai tiga pucuk daun yang paling ujung (terminal leaves) beserta batang muda (growing apex) kemudian diperlakukan dengan proses pengolahan tertentu (Setiawati dan Nasikun 1991). Pucuk daun teh dapat dilihat pada Gambar 1. Tanaman teh (Camelia sinensis) tumbuh dengan baik pada kondisi beriklim hangat dan lembab dengan curah hujan yang cukup tinggi dan juga terdapat banyak paparan sinar matahari, tanah berasam rendah serta drainasi tanah yang baik (Wan et al. 2009). Kusumaningrum (2008) juga menyatakan bahwa tanaman teh dapat tumbuh dengan optimum di daerah pegunungan beriklim sejuk dengan ketinggian lebih dari 1800 meter di atas permukaan laut. Pertumbuhan tanaman teh yang baik akan menghasilkan produk teh dengan kualitas yang tinggi, dimana akan berbeda-beda sesuai dengan teknik budidaya teh dan kondisi lingkungan, seperti jenis tanah, ketinggian, dan iklim dari perkebunan teh tersebut.
Gambar 1 Pucuk daun teh (Yadi 2009)
3
Daun teh segarPelayuan
Penggulungan
Fermentasi penuh
Pengeringan
Daun teh hitam kering Daun teh segar
Pelayuan
Penggulungan
Fermentasi sebagian
Penyangraian
Pengeringan
Daun teh Oolong kering Daun teh segar
Pelayuan
Penyangraian
Penggulungan
Pengeringan
Daun teh hijau kering
Tabel 1. Klasifikasi tanaman teh
Kingdom Plantae
Divisi Spermatophyta (tumbuhan biji) Sub divisi Angiospermae (tumbuhan biji terbuka) Kelas Dicotiledoneae (tumbuhan biji belah) Sub kelas Dialypetalae
Ordo (bangsa) Guttiferales (Clusiales) Familia (suku) Camelliaceae (Tehaceae) Genus (marga) Camelia
Spesies (jenis) Camelia sinensis Sumber: Tuminah (2004)
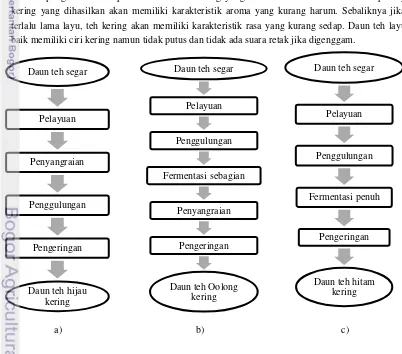
Teh hitam merupakan salah satu jenis teh yang namanya diambil dari warnanya yang hitam atau gelap akibat fermentasi sempurna dari daun teh segar. Secara ringkas, pengolahan daun teh menjadi teh hitam dapat dilihat pada Gambar 2 bagian c. Setelah dipanen dan dibersihkan, daun teh segar dilayukan agar tidak putus saat penggulungan dan proses kimia berlangsung dengan baik saat fermentasi (Adisewojo 1982). Pelayuan daun teh biasanya dilakukan pada ruangan bersuhu 30-40oC selama 16-20 jam untuk mengurangi kadar air dari 70-85% menjadi 55-65% (Ullah 1991). Pelayuan terjadi karena air-air dalam daun secara perlahan akan menguap dan lambat laun daun akan menjadi layu. Proses pelayuan akan berpengaruh terhadap kualitas dari teh kering yang dihasilkan. Jika daun terlalu cepat layu, teh kering yang dihasilkan akan memiliki karakteristik aroma yang kurang harum. Sebaliknya jika daun terlalu lama layu, teh kering akan memiliki karakteristik rasa yang kurang sedap. Daun teh layu yang baik memiliki ciri kering namun tidak putus dan tidak ada suara retak jika digenggam.
a) b) c)
4
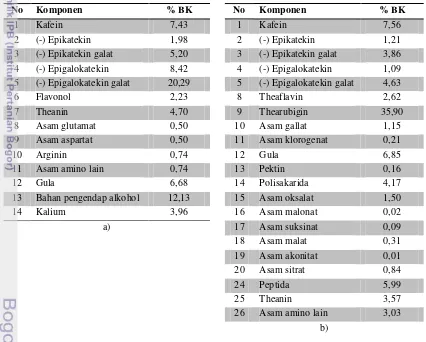
Proses selanjutnya adalah penggulungan yang dilakukan dengan tujuan memecahkan sel-sel daun, mengeluarkan cairan sel, dan merusak jaringan daun yang menyebabkan unsur-unsur di dalamnya termasuk polifenol dan enzim bergabung menjadi satu (Aji 2011). Penggulungan juga memengaruhi hasil teh seduhan yang dihasilkan. Daun yang terlalu lama digulung akan menghasilkan teh kering yang sangat pekat, kental, namun aromanya kurang harum (Adisewojo 1982). Setelah penggulungan, daun teh kemudian melalui proses fermentasi. Fermentasi atau pemeraman daun teh merupakan proses oksidasi enzimatik komponen polifenol dalam teh sehingga terjadi perubahan warna dan karakteristik teh. Pada akhir fermentasi,warna teh akan berubah menjadi kecoklatan. Selain perubahan warna juga terjadi perubahan aroma daun menjadi harum teh. Proses ini berlangsung selama 1-5 jam dengan suhu optimal 25-32oC (Panuju 2008). Proses terakhir pengolahan teh hitam adalah pengeringan yang dilakukan untuk menghentikan aktivitas enzim dan mengurangi kandungan air hingga 5% basis basah (Adisewojo 1982).Tabel 2. Komposisi senyawa dalam; a) teh hijau dan b) teh hitam (Graham di dalam Liss 1984)
No Komponen % BK No Komponen % BK
1 Kafein 7,43 1 Kafein 7,56
2 (-) Epikatekin 1,98 2 (-) Epikatekin 1,21 3 (-) Epikatekin galat 5,20 3 (-) Epikatekin galat 3,86 4 (-) Epigalokatekin 8,42 4 (-) Epigalokatekin 1,09 5 (-) Epigalokatekin galat 20,29 5 (-) Epigalokatekin galat 4,63
6 Flavonol 2,23 8 Theaflavin 2,62
7 Theanin 4,70 9 Thearubigin 35,90
8 Asam glutamat 0,50 10 Asam gallat 1,15 9 Asam aspartat 0,50 11 Asam klorogenat 0,21
10 Arginin 0,74 12 Gula 6,85
11 Asam amino lain 0,74 13 Pektin 0,16
12 Gula 6,68 14 Polisakarida 4,17
13 Bahan pengendap alkohol 12,13 15 Asam oksalat 1,50
14 Kalium 3,96 16 Asam malonat 0,02
a) 17 Asam suksinat 0,09
18 Asam malat 0,31 19 Asam akonitat 0,01 20 Asam sitrat 0,84
24 Peptida 5,99
25 Theanin 3,57
26 Asam amino lain 3,03 b)
5
bioaktif yang terkandung dalam minuman teh. Komponen-komponen bioaktif teh hijau dan teh hitam dapat dilihat pada Tabel 2. Komponen bioaktif di dalam teh terdiri dari flavonoid yang didominasi oleh katekin, senyawa alkaloid, saponin (triterpenoid saponin), asam organik, dan pigmen. Beberapa jenis alkaloid dalam teh yaitu kafein, theobromin, dan theofilin yang totalnya berkisar 3-4% (Wong et al. 2009).Selama fermentasi, reaksi enzimatik akan bertanggung jawab terhadap pengembangan karakteristik warna dan flavor dari tiap jenis teh, terutama teh hitam. Fermentasi enzimatis teh hitam akan menghasilkan pembentuk warna dan pigmen yang khas, yaitu theaflavin, thearubigin, dan theasinensis. Substrat dari enzim polifenol oksidase selama fermentasi terdiri dari katekol dan grup pyrogallol, dan produk oksidasi primernya adalah o-quinon yang diikuti oleh kondensasi menjadi senyawa polimer yaitu theaflavin dan thearubigin (Ullah 1991). Theaflavin terbentuk melalui reaksi oksidasi berpasangan antara katekin jenis katekol (epikatekin dan epikatekin galat) dan katekin jenis pyrogallol (epigalokatekin dan epigaloketekin galat) (Tanaka et al 2009). Oleh karena itu, kandungan katekin, meliputi katekol (epikatekin (EC) dan epikatekin galat (ECG)) serta pyrogallol (epigalokatekin (EGC) dan epigalokatekin galat (EGCG)) pada teh hitam jauh lebih rendah daripada teh hijau. Fermentasi asam-asam amino dan lipid pada daun teh segar juga akan menghasilkan komponen-komponen volatil yang akan mempengaruhi flavor teh, mengurangi rasa pahit, meningkatkan rasa sepat, serta menghasilkan senyawa dan flavor kompleks lainnya termasuk asam organik (Balentine & Paerau-Robinson di dalam Mazza & Oomah 1998). Jika dilihat pada Tabel 2, asam organik pada teh hitam terdapat dalam konsentrasi dan jenis lebih beragam daripada teh hijau yang disebabkan oleh proses fermentasi.
Theaflavin dan thearubigin merupakan senyawa-senyawa berpigmen golongan polifenol yang dihasilkan selama fermentasi dan berperan dalam warna khas teh hitam. Pigmen-pigmen tersebut termasuk ke dalam senyawa bioaktif karena dilaporkan memiliki efek positif bagi kesehatan. Selain berpengaruh terhadap penampakan, senyawa-senyawa tersebut juga berkontribusi terhadap aroma dan karakteristik teh hitam. Selama fermentasi, kandungan katekin dari daun teh segar akan berkurang sebesar 85% (Balentine & Paerau-Robinson di dalam Mazza & Oomah 1998) dimana hanya sekitar 10 persennya yang merupakan kelompok theaflavin. Sisanya berubah menjadi produk larut air yang disebut thearubigin yang berkontribusi sebesar 23% dari 100-200 mg daun teh hitam kering.
Tabel 3. Prekursor dan kadar theaflavin pada teh hitam
Prekusor Jenis Theaflavin Kadar (% BK)
EC + EGC TF 0,2-0,3
EC + EGCG TF-3-G 1,0-1,5
ECG + EGC TF-3‘-G 1,0-1,5
ECG + EGCG TF-3,3‘-G 0,6-1,2
Sumber: Wan et al. (2009)
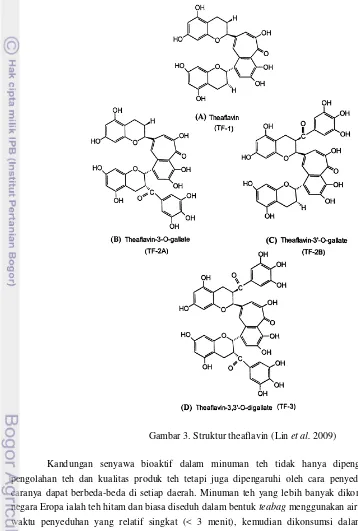
Theaflavin merupakan senyawa berwarna merah atau oranye dalam larutan dan berkontribusi terhadap kecerahan dan rasa minuman teh (Balentine & Paerau-Robinson di dalam Mazza & Oomah 1998). Terdapat empat jenis utama theflavin, yaitu theaflavin (TF), theaflavin 3 gallat (TF-3-G),
6
Total theaflavin dan thearubigin pada teh hitam masing-masing 3-6% dan 12-18% basis kering (Wong et al. 2009). Selain itu, adanya kondensasi berpasangan antara dua jenis galokatekin, yaitu epigalokatekin galat (EGCG) dan epigalokatekin (EGC), akan membentuk dimer kuinon lain, terutama dehidrotheasinensis yang akan dikonversi menjadi theasisnensis apabila dikeringkan atau dipanaskan (Wan et al. 2009).Gambar 3. Struktur theaflavin (Lin et al. 2009)
7
Astill et al. (2001) menyatakan bahwa perbedaan cara penyeduhan teh dapat memengaruhi komposisi senyawa kimia yang terdapat pada produk akhir minuman teh. Cara penyeduhan yang dimaksud adalah jumlah teh dan air yang digunakan (konsentrasi teh), ukuran dan bentuk teh, jumlah pengadukan, suhu penyeduhan, waktu penyeduhan, dan penambahan bahan lain seperti gula atau susu. Dalam penelitiannya, Astill et al. (2001) menyeduh teh dalam bentuk teabag (1.5-3.125 g/bag) menggunakan air mendidih, lalu disaring vakum menggunakan glass crucible no.1. Hasil penelitiannya menunjukkan bahwa total padatan terlarut yang terekstrak semakin meningkat seiring meningkatnya konsentrasi teh. Akan tetapi, proses ekstraksi akan berlangsung secara efisien pada konsentrasi teh yang rendah. Sementara itu, total padatan terlarut terekstrak dengan cepat pada menit pertama penyeduhan, kemudian secara bertahap menurun seiring dengan meningkatnya waktu penyeduhan.Astill et al. (2001) juga meneliti mengenai perbedaan komposisi komponen terekstrak antara teh hitam dan teh hijau. Hasil penelitiannya menunjukkan bahwa rata-rata konsentrasi padatan terlarut (2997 mg/L), total polifenol (992 mg/L), dan kafein (241 mg/L) teh hitam lebih besar dari pada teh hijau (1790, 591, dan 114 mg/L). Hasil surveinya terhadap 23 produk teh di Negara-negara Eropa menunjukkan bahwa teh hitam direkomendasikan untuk diseduh pada konsentrasi yang lebih tinggi (10-13.3 g/L) daripada teh hijau (7.5-10 g/L). Suhu penyeduhan yang direkomendasikan untuk menyeduh teh hitam juga lebih tinggi (100oC) daripada teh hijau (75-90oC). Selain itu, ekstraksi dari komponen polifenol dan kafein akan berbeda antara teh dalam bentuk daun dan teabag. Ekstraksi akan lebih efisien apabila teh masih berada dalam bentuk daun dan semakin kecilnya ukuran partikel teh.
B.
Lipid
Salah satu kelompok senyawa organik yang terdapat dalam tumbuhan, hewan, atau manusia ialah lipid. Lipid, lipida, atau lemak merupakan salah satu komponen gizi yang secara umum dibutuhkan oleh manusia sebagai cadangan energi, komponen struktural membran sel, alat angkut vitamin larut lemak, pemelihara suhu tubuh, dan pensinyalan molekul (Michelle et al. 1993; Gurr et al. 2002; Almatsier 2006). Lipid didefinisikan berdasarkan sifat fisiknya terutama sifat kelarutan, bukan berdasarkan struktur kimianya. Kata lipid digunakan oleh ahli biokimia untuk menggolongkan senyawa-senyawa heterogen yang tidak larut dalam air tetapi larut dalam satu atau lebih dari satu pelarut organik misalnya eter, aseton, kloroform, benzena (Gurr et al. 2002). Lipid dapat diklasifikasikan berdasarkan komposisi kimianya, yaitu lipid sederhana, lipid majemuk, dan lipid turunan; serta berdasarkan fungsi biologisnya, yaitu lemak simpanan dan lemak struktural. Lemak simpanan terdiri dari trigliserida yang disimpan di dalam depot-depot di dalam jaringan baik tumbuh-tumbuhan, hewan, ataupun manusia. Lemak tersebut merupakan simpanan energi paling utama di dalam tubuh. Lemak struktural terutama terdiri atas fosfolipida dan kolesterol yang merupakan struktural paling penting di dalam tubuh setelah protein (Almatsier 2006; Wahle et al. 2003).
8
mengkonversi lipid menjadi turunan yang lebih polar sehingga mudah berinteraksi dengan air dan mudah diserap oleh tubuh. Penyerapan hasil pencernaan lipid yang sebagian besar adalah asam lemak (70%) dan sebagian lagi monogliserida (20%) terjadi di dalam usus kecil (Poedjiadi 1994).Hasil penyerapan lipid akan langsung digunakan sebagai sumber energi atau disimpan oleh tubuh di dalam jaringan adipose sebagai cadangan energi. Meskipun lipid dibutuhkan oleh tubuh, konsumsi lipid yang berlebihan dapat merugikan tubuh karena selain asupan-asupan lipid esensial, tubuh juga dapat mensintesis lipid dari metabolisme karbohidrat (Michelle et al. 1993). Lemak simpanan di dalam tubuh tidak hanya berasal dari konsumsi lipid melainkan juga dari konsumsi karbohidrat dan protein. Selain itu, menurut Almatsier (2006), tubuh mempunyai kapasitas tidak terhingga untuk menyimpan lipid. Oleh karena itu, jika lemak simpanan berlebih di dalam tubuh maka resiko terhadap kelebihan berat badan akan meningkat yang kemudian pada akhirnya akan berdampak pada obesitas. Hal tersebut tentunya akan sangat merugikan tubuh, mengingat bahwa obesitas memiliki asosiasi atau hubungan yang sangat erat dengan munculnya penyakit kronis dan gangguan fungi fisiologis seperti penyakit kardiovaskuler, hipertensi, diabetes mellitus, dan kanker.
C.
Lipase
Enzim merupakan unit fungsional dari metabolisme sel, yang bekerja dengan urut-urutan yang teratur. Enzim mengkatalisis ratusan reaksi bertahap yang menguraikan molekul nutrien, reaksi yang menyimpan dan mengubah energi kimiawi, dan reaksi pembuatan makromolekul sel dari prekusor sederhana (Lehninger 1993). Enzim lipase (Triasilgliserol asilhidolase, EC 3.2.1.20) merupakan enzim utama dalam pencernaan lipid. Berdasarkan nomenklatur dari International Union of Biochemistry, enzim lipase berfungsi mengkatalisis trigliserida menjadi digliserida dan asam lemak (Gambar 4).
Gambar 4. Reaksi pemecahan trigliserida (Muchlas 2010)
Meskipun demikian, reaksi tersebut belum lengkap karena lipase juga akan menghidrolisis digliserida lebih lanjut sehingga akan didapatkan produk akhir berupa satu molekul gliserol dan tiga molekul asam lemak (Winarno 2010; Macrae 1983). Struktur enzim lipase dapat dilhat pada Gambar 5.
Gambar 5. Enzim lipase pankreas (Institute of Molecular Biotechnology 2005)
Didalam tubuh, enzim lipase mampu menghidrolisis lemak makanan yang dikonsumsi hingga 50-70%. Aktifitas lipase dapat diketahui dengan mengetahui habisnya substrat atau timbulnya produk
9
hidrolisa asam lemak bebas. Substrat, suhu, dan pH lingkungan sangat memengaruhi lipase dalam mencapai aktifitas yang optimal. Lipase dari pankreas misalnya mempunyai pH optimal antara 8 dan 9, tetapi dapat menurun menjadi antara 6-7 apabila substratnya berbeda. Suhu optimal lipase pada umumnya berkisar antara 30 dan 40oC. Keaktifan optimal lipase tergantung juga dari senyawa pengemulsi yang digunakan dan kandungan garam dalam substrat (Winarno 2010).Sumber utama enzim lipase adalah dari pankreas yang dikeluarkan melalui dinding usus halus. Enzim ini diproduksi dalam sel acinar pankreas dan dialirkan ke dalam usus duodenum. Lipase dari pankreas babi paling banyak telah dipelajari dan digunakan dalam beberapa penelitian. Hal ini mungkin karena pankreas babi mengandung lipase yang tinggi, sekitar 2.5 persen dari jumlah protein dalam pankreas. Selain itu, lipase juga dapat diperoleh dari sumber lain, misalnya susu, biji-bijian, kacang-kacangan, dan juga mikroba.
D.
Antilipase
Penghambatan aktivitas enzim oleh beberapa jenis molekul kecil dan ion-ion sangat penting karena merupakan mekanisme pengendalian kerja enzim secara biologis. Winarno (2010) membagi jenis penghambatan enzim berdasarkan sifat kestabilan penghambatannya, yaitu penghambatan tidak stabil (reversible) dan penghambatan stabil (irreversible). Penghambatan reversible disebut juga dengan penghambatan dapat balik, sedangkan penghambatan irreversible disebut juga dengan penghambatan tidak dapat balik (Lehninger 1993).
Dalam pengikatannya yang irreversible, senyawa penghambat (inhibitor) akan terikat secara kovalen pada lokasi aktif enzim sehingga disosiasi antara enzim dengan substrat terjadi sangat lambat (Winarno 2010). Lehninger (1993) menyatakan bahwa penghambat irreversible dapat juga diartikan sebagai golongan yang beraksi dengan atau merusak suatu gugus fungsional pada molekul enzim yang penting bagi aktivitas katalitiknya. Selain itu, Poedjiadi (2005) menambahkan bahwa hambatan irreversible ini dapat terjadi karena inhibitor bereaksi tidak reversible dengan bagian tertentu pada enzim, sehingga mengakibatkan berubahnya bentuk enzim dan menyebabkan aktivitas katalitiknya menurun. Salah satu contoh penghambatan irreversible adalah penghambatan yang dilakukan oleh senyawa diisoprofilfluorofosfat (DFP) terhadap enzim asetilkolinesterase yang penting dalam transmisi impuls syaraf.
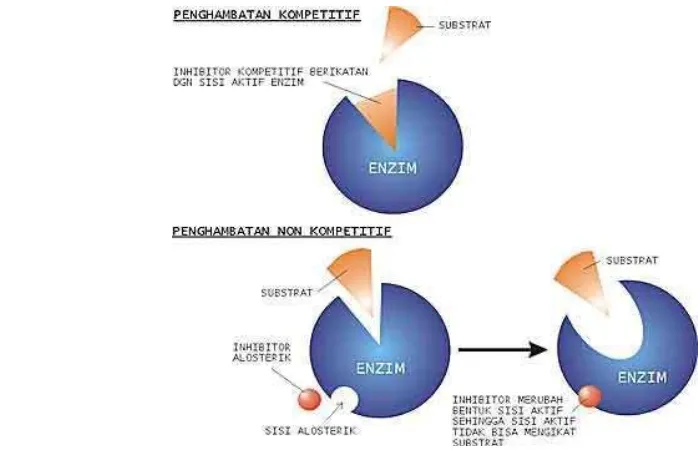
Penghambatan reversible merupakan penghambatan yang bersifat sementara. Penghambatan tersebut dapat dibagi menjadi dua golongan, yaitu penghambatan kompetitif dan penghambatan nonkompetitif. Penghambatan kompetitif adalah penghambatan yang dilakukan oleh senyawa yang mirip dengan substrat dan dapat terikat pada lokasi aktif enzim membentuk kompleks enzim inhibitor (Winarno 2010; Lehninger 1993; Poedjiadi 2005). Dengan cara ini maka inhibitor akan bersaing dengan substrat untuk masuk ke lokasi aktif enzim. Penghambat kompetitif biasanya menyerupai substrat normal pada struktur tiga dimensinya. Contoh penghambatan kompetitif adalah asam malonat, oksalat, dan oksaloasetat yang menghambat kerja enzim suksinat dehidrogenase dalam reaksi dehidrogenasi asam suksinat. Ketiga senyawa penghambat tersebut memiliki struktur yang mirip dengan asam suksinat.
10
permukaan enzim lain. Akibatnya reaksi enzimatik masih berlangsung, tetapi turn over number-nya menurun. Turn over number merupakan banyaknya molekul substrat yang diubah menjadi produk per satuan waktu. Perbedaan kedua jenis penghambatan ini diilustrasikan melalui Gambar 6. Contoh inhibitor nonkompetitif yang banyak dikenal ialah ion-ion logam berat (Cu++, Hg++ dan Ag+) yang dapat berhubungan dengan gugus –SH yang terdapat pada sistein dalam enzim (Poedjiadi 2005).Gambar 6. Ilustrasi perbedaan penghambatan kompetitif dengan nonkompetitif (Muchlas 2010)
Penghambatan terhadap enzim yang berperan dalam hidrolisis lemak dari makanan akan mengurangi penyerapan lemak dan energi yang berlebihan sehingga dapat mencegah tubuh mengalami kelebihan berat badan ataupun obesitas. Salah satu obat yang telah terbukti dapat menghambat kerja enzim lipase adalah Orlistat. Orlistat atau dikenal juga dengan Tetrahydrolipstatin, Xenical, Alli, Orlipastat, (-)-Tetrahydrolipstatin, Orlipastatum [INN-Latin], THLP, Orlipastatum, memiliki rumus molekul C29H53NO5dan berat molekul 495.73482 (PubChem 2005). Orlistat merupakan turunan lipofilik terhidrogenasi dari lipstatin, senyawa kimia yang diisolasi dari mikroba Streptomyces toxytricini (Guerciolini 1997; Hadvary et al.1991). Sjostrom et al. (2000) menyatakan bahwa penggunaan Orlistat diikuti dengan pola makan sehat akan memberikan hasil penurunan berat badan 70% lebih besar daripada hanya sekedar diet saja. Rissanen et al. (1999) juga menyatakan bahwa dengan Orlistat, seseorang dapat menurunkan berat badan rata-rata sekitar 14.5% dari berat tubuh awal. Selain itu, penelitian tentang Orlistat menunjukkan bahwa 2 kali lebih banyak penderita kegemukan yang mengkonsumsi Orlistat, mencapai 10% penurunan berat badan dibandingkan mereka yang diet saja (Krempf et al. 2001). Dalam penelitiannya, Sjostrom et al. (2000) menyatakan bahwa Orlistat menghambat enzim lipase secara irreversible dengan cara membentuk suatu ikatan kovalen pada bagian serine yang aktif dari lipase pankreas dan lipase lambung (Gambar 7).
11
aburaviensis), dan vibralacton (Boreostereum vibrans) memiliki aktivitas penghambatan enzim lipase yang potensial (Tucci et al.2010).Gambar 7. Mekanisme penghambatan Orlistat (Carriere et al. 2001)
Di sisi lain, industri pharmaceutical telah banyak menggunakan kapang dan fungi sebagai sumber antilipase, beberapa diantaranya ialah Candida antartica, Candida rogusa, Gestrichum candidum, Humicola lanuginose, dan Pseudomonas glumae (Weber et al.1997). Tanin dari alga Phaeopyta, toxin caulerpenyne dari alga Caulerpa taxifolia, karotenoid dari Undaria pinnatifidaaiai dan Sargassum fulvellum merupakan beberapa contoh pangan hasil laut yang potensial menghambat aktivitas enzim lipase (Bitou et al. 1999; Matsumoto et al. 2010).
Tabel 4. Berbagai macam senyawa antilipase dari ekstrak tanaman
Komponen Tanaman Sumber
Flavonoid Lesser galangal, dandelion, dan kiwi, jati belanda
Polyphenol Kacang tanah, mangga, alfalfa, bunga lotus, dan kotala himbutu Proanthocyanidin Noname Herba, cinnamon, coklat, anggur
Saponin Horse chestnut, bearberry, marlberry, oat, kopi, yam, gingseng, sessiloside, cape jasmine, burningbush, apel, balsampear,
zaitun,doraji, soapberry, pincus hion, tomat, jahe, jati belanda, dan bangle
Triterpen Salvia, lidah buaya, birch, potmarigold, lemon balm, dan oregano Trigonellin T. foenum-graecum
Hydroxycitric acid Garcinia Cambodia Tanin Areca catechu escin saponin A. turbinata escins chakasaponin I, II, & III Teh china
Sumber: Garza et al. (2011); Bhutani dan Gohil (2010); Tucci et al. (2010); Tanaka et al. (2009); Silitonga (2008)
Tanaman merupakan sumber antilipase yang paling banyak dieksplorasi saat ini. Beberapa tanaman yang mengandung komponen antilipase adalah anggur (Vitis vinifera), jahe (Zingiber
Sisi aktif lipase
12
officinale), ginseng (Panax japonicus), kencur atau galangal (Alpinia officinarum), daun jati belanda (Guazuma ulmifolia Lamk), bangle (Zingiber purpureum), asam gelugur (Garcina artroviridis), kemuning (Murraya paniculata) dan juga teh (Camellia sinensis). Pengujian potensi berbagai sumber antilipase tersebut umumnya dilakukan dengan metode enzimatis, baik secara in vivo dengan menggunakan hewan percobaan maupun secara in vitro. Beberapa senyawa antilipase yang berasal dari ekstrak tanaman dapat dilihat pada Tabel 4.Tabel 5. Beberapa senyawa antilipase dari teh Sumber Komponen bioaktif Sitasi
Teh hijau Flavan-3-ol Gondoin et al. (2010) Strictinin Gondoin et al. (2010) epigallocatechin gallate
(EGCG) Tucci et al.(2010) epigallocatechin (EGC) Tucci et al.(2010) epicatechin gallate (ECG) Tucci et al.(2010) epicatechin (EC) Tucci et al.(2010) Teh oolong Flavan-3-ol Nakai et al.(2005) Proanthocyanidin Nakai et al.(2005) Chalcan-Flavan Dimer Nakai et al.(2005) Oolonghomobisflavans Nakai et al.(2005) Theasinensin Nakai et al.(2005) Theaflavin Nakai et al.(2005) Strictinin Nakai et al.(2005)
Theasaponin E1 & E2 Tucci et al.(2010); Han et al.(1999)
Teh hitam
Polymer-like oxidation
products Kusano et al. (2008) Epigallocatechin 3-O-gallate Kusano et al. (2008) Theaflavin 3-O-gallate Kusano et al. (2008) Theaflavin 3,3'-di-O-gallate Kusano et al. (2008) Procyanidin-B-4 Kusano et al. (2008) Procyanidin-B-3 Kusano et al. (2008) Theasinensin A Kusano et al. (2008) Galloyl oolongtheanin Kusano et al. (2008)
13
III.
METODOLOGI PENELITIAN
A.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah teh hitam yang diperoleh dari PT Perkebunan Nusantara VIII Gunung Mas Bogor grade BP1 (Broken Pekoe 1). Bahan-bahan yang digunakan untuk menganalisis daya inhibisi enzim lipase antara lain enzim lipase pankreas babi tipe II (Sigma L3126), p-nitrofenil laurat (pNP laurat), Tris buffer pH 8.2, sodium asetat, Triton X-100. Bahan-bahan yang diperlukan untuk mengukur total fenol dan kadar tanin antara lain Folin Ciocalteu 50%, etanol 95%, Na2CO3 5%, asam galat 250 mg/L, butanol-HCl (95:5 v/v), reagen Ferric (2% ferric ammonium sulfat di dalam HCl 2N), dan akuades serta HCl 11.96 N dan NaOH 10 N diperlukan untuk menetapkan pH simulasi proses pencernaan in vitro.
Peralatan yang digunakan dalam penelitian ini antara lain neraca analitik, sentrifus, penyaring vakum, waterbath, pH meter, spektrofotometer, penangas air, gelas piala, tabung reaksi, tabung sentrifugasi, kuvet, alat vortex, pipet morh, pipet tetes, mikropipet, gelas ukur, termometer, sudip, gelas pengaduk, gelas arloji, corong, kertas saring Whatman No.41, dan kain saring.
B.
Metode Penelitian
Penelitian ini terbagi atas 2 tahap yaitu pembuatan ekstrak teh hitam dan pengujian pengaruh simulasi pH pencernaan in vitro. Pembuatan ekstrak teh hitam dilakukan dengan menyeduh bubuk teh hitam dengan menggunakan air panas dengan suhu dan waktu penyeduhan yang berbeda. Ekstrak teh hitam hasil penyeduhan kemudian diberi perlakuan simulasi pH pencernaan in vitro dan tanpa perlakuan (ekstrak teh awal). Ekstrak awal yang diberi perlakuan simulasi pH pencernaan diubah pH-nya menyerupai pH lambung (pH 2) dan didiamkan selama 30 menit kemudian dinaikkan menjadi pH 6.8 seperti pH usus halus. Baik terhadap ekstrak teh awal maupun ekstrak teh simulasi pH pencernaan, dilakukan beberapa analisis, yaitu pengukuran pH, analisis total fenol, analisis kadar tanin terkondensasi, analisis inhibisi enzim lipase. Masing-masing analisis dilakukan sebanyak dua ulangan dan duplo. Diagram alir penelitian ini dapat dilihat pada Gambar 8.
Gambar 8. Diagram alir penelitian Ekstraksi teh hitam
Suhu awal penyeduhan : 70,85, 100 ºC Waktu penyeduhan : 5, 10, 15 menit
Ekstrak teh hitam (ekstrak awal)
Analisis Pengukuran pH
Total Fenol Kadar Tanin Inhibisi enzim lipase
Ekstrak terpilih
14
1.
Pembuatan Ekstrak Teh Awal
Teh hitam diblender kering sampai menghasilkan partikel halus (30 mesh) yang homogen. Konsentrasi teh hitam dibuat sama, yaitu 0.02 g/ml (2 gram teh dilarutkan dengan 100 ml air). Teh diseduh dengan kombinasi suhu dan waktu penyeduhan yang berbeda. Suhu awal air yang digunakan untuk menyeduh yaitu 70oC, 85oC, dan 100oC, sedangkan waktu penyeduhan yaitu, 5, 10, dan 15 menit. Larutan teh tersebut disaring dengan kain saring (batis) 2 lapis, disentrifus pada 3500 selama 10 menit, dan disaring kembali dengan penyaringan vakum menggunakan kertas saring Whatman No. 41. Volume ekstrak kemudian ditepatkan ke volume awal (100 ml) dengan penambahan akuades. Diagram alir proses ekstraksi teh hitam dapat dilihat pada Gambar 9.
Gambar 9. Diagram alir proses ekstraksi teh hitam
2.
Pengujian Pengaruh Simulasi pH Pencernaan
In Vitro
Pada pengujian ini, ekstrak teh akan melalui proses simulasi pencernaan secara in vitro dengan mengubah nilai pH sesuai dengan pH saluran pencernaan, yaitu lambung dan usus halus. Ekstrak teh awal pertama-tama diukur pH nya sehingga didapat pH ekstrak awal. Kemudian ekstrak diubah pH nya sesuai pH lambung yaitu pH 2 dengan menggunakan kurang lebih 3 hingga 4 pipet tetes HCl 11.98 N dan didiamkan selama 30 menit. Setelah itu, pH ekstrak diubah kembali mengikuti pH usus halus, yaitu 6.8 dengan penambahan NaOH 10 N (± 10-11 tetes).
3.
Analisis
a.
Total Fenol Metode Folin Ciocalteu
Analisis total polifenol dilakukan mengikuti prosedur Strycharz dan Shetty (2002) dengan modifikasi sesuai Zega (2010). Standar yang digunakan adalah asam galat yang merupakan salah satu senyawa asam fenolat terbanyak dalam teh. Prinsip dari metode ini adalah reduksi dari reagen fosfomolibdat (MoO42-) dan fosfotungtat (WO42-) oleh komponen fenol sehingga terbentuk kompleks
2 gram teh hitam diseduh dengan 100 ml air bersuhu awal 70o, 85o, atau 100oC
Penyeduhan selama 5, 10, dan 15 menit
Penyaringan dengan kain saring
Sentrifuse 3500 rpm 10 menit
Penyaringan dengan penyaring vakum
Penepatan volume sampai 100 ml dengan akuades
15
molybdenum-blue berwarna biru yang dapat terukur secara spektrofotometri sinar tampak pada panjang gelombang 725 nm.Larutan standar asam galat dibuat pada berbagai konsentrasi, yaitu 50, 100, 150, 200, dan 250 ppm. Pengujian ini menggunakan reagen Folin Ciocalteu 50% dan pereaksi Na2CO3 5%. Pertama-tama, larutan standar atau ekstrak teh sebanyak 0.5 ml dilarutkan bersama 2.5 ml reagen Folin Ciocalteu, 0.5 ml etanol, dan 2.5 ml akuades di dalam tabung reaksi. Setelah itu, larutan didiamkan selama 5 menit dalam ruang gelap dan kemudian ditambahkan 0.5 ml peraksi Na2CO3, dan diinkubasi kembali dalam ruang gelap selama 1 jam. Setelah inkubasi, larutan divorteks dan diukur absorbansinya pada panjang gelombang 725 nm menggunakan spektrofotometer.
b.
Kadar Tanin Terkondensasi
Pengujian ini dilakukan mengikuti prosedur Porter et al. (1986). Metode pengukuran kadar tanin terkondensasi didasarkan atas reaksi pembentukan warna dari kompleks tanin dengan ion Fe3+, yang kemudian diukur absorbansinya dengan menggunakan spektrofotometer pada panjang gelombang 500 nm. Peraksi yangdigunakan dalam uji ini terdiri dari Butanol-HCl (butanol-HCl (37%), 95:5 v/v) dan reagen ferric (2% ferric ammonium sulfat dalam 2N HCl).
Ekstrak teh sebanyak 0.5 ml dilarutkan bersama 3 ml butanol-HCl dan 0.1 ml reagen ferric di dalam tabung reaksi bertutup, lalu divortex. Kemudian tabung reaksi tersebut dipanaskan di dalam waterbath pada suhu air mendidih selama 60 menit. Setelah itu, tabung reaksi didinginkan hingga mencapai suhu ruang dan kemudian diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm.
Tanin terkondensasi (% berat kering) sebagai Leucocyanidin Equivalent (LE) akan dihitung berdasarkan rumus:
(A 550nm x 78.26 x pengenceran)/(% berat kering)
Rumus tersebut mengasumsikan bahwa E1% paling efektif dari leucocyanidin pada panjang gelombang 550 nm menggunakan kuvet dengan tebal 1 cm adalah 460 (Porter et al. 1986).
c.
Inhibisi Enzim Lipase
Pengujian ini dilakukan mengikuti prosedur Mc Dougall et al. (2009) untuk mengetahui aktivitas penghambatan enzim lipase yang berasal dari pankreas babi tipe II (Sigma L3126). Pemecahan substrat p-nitrofenil laurat menjadi p-nitrofenil berwarna kuning dan laurat oleh enzim lipase (Gambar 10). Aktivitas penghambatan diukur berdasarkan jumlah p-nitrofenil yang dihasilkan dengan mengukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 410 nm. Kontrol positif yang digunakan pada pengujian ini adalah Orlistat 1.2 mg/ml yang diperoleh pelarutan 1 tablet xenical (120 mg orlistat) dalam 100 ml aquades.
Gambar 10. Reaksi hidrolisis pNp Laurat (Mc Dougall et al. 2009)
16
laurat (pNP laurat) sebagai substrat. Stok substrat diperoleh dengan cara melarutkan 0.08% (b/v) pNP laurat dalam 5mM sodium asetat (pH 5.0) yang mengandung 1% triton X-100 dan dipanaskan pada air mendidih selama 1 menit agar dihasilkan larutan yang sempurna kemudian didinginkan pada suhu ruang.Campuran pereaksi terdiri dari blanko, kontrol A, kontrol B, dan sampel atau kontrol positif. Kontrol A digunakan untuk mengetahui absorbansi dari pNp (produk hidrolisis berwarna kuning) ketika reaksi berlangsung optimal tanpa adanya senyawa penghambat dari ekstrak teh hitam, sedangkan sampel digunakan untuk mengetahui absorbansi dari pNp ketika reaksi berlangsung dengan adanya senyawa penghambat dari ekstrak teh hitam. Blanko digunakan untuk mengetahui absorbansi dari substrat awal tanpa adanya ekstrak teh hitam sedangkan kontrol B digunakan untuk mengetahui absorbansi dari substrat awal ditambah ekstrak teh hitam. Tabel 6 menunjukkan kombinasi jumlah ekstrak atau orlistat, buffer Tris, dan enzim yang diberikan pada blanko, kontrol A, kontrol B, dan sampel atau kontrol positif (Orlistat). Masing-masing campuran reaksi diinkubasi pada 37oC selama 2 jam. Reaksi dihentikan dengan memasukkan campuran reaksi ke dalam penangas air suhu 100oC selama 5 menit. Selanjutnya aquades ditambahkan pada campuran reaksi kemudian agar padatan dalam larutan tidak mengganggu pembacaan absorbansi, larutan disentrifugasi pada 4000 rpm selama 15 menit dan dibaca menggunakan spektrofotometer pada panjang gelombang 410 nm.
Tabel 6. Komposisi larutan pereaksi uji inhibisi enzim lipase Larutan Blanko Kontrol A Kontrol B Sampel
Ekstrak (μL) - - 50 50
Buffer (μL) 400 400 400 400
Enzim (μL) - 150 - 150
Substrat
p-Nitrofenil laurat(μL)
450 450 450 450
Aquades (μL) 4150 4000 4100 3950
Sumber: McDougall et al. 2009 modifikasi
Aktivitas inhibisi sampel dihitung menggunakan rumus sebagai berikut:
% inhibisi =
Keterangan: A1 = Absorbansi kontrol A - Absorbansi blanko A2 = Absorbansi sampel - Absorbansi kontrol B
d.
Analisis Statistik
17
IV.
HASIL DAN PEMBAHASAN
A.
Ekstraksi Teh Hitam
Ekstraksi merupakan suatu proses penyarian zat-zat aktif pada tanaman yang bertujuan untuk menarik komponen kimia yang ada dengan menggunakan pelarut tertentu. Proses ekstraksi teh dilakukan dengan cara penyeduhan. Penyarian zat-zat aktif dari dalam matriks teh hitam akan berlangsung melalui proses difusi. Menurut Astill et al. (2001), perbedaan cara penyeduhan teh dapat memengaruhi komposisi senyawa kimia yang terdapat pada produk akhir minuman teh. Hasil penelitiannya menunjukkan bahwa total padatan terlarut seperti komponen polifenol dan kafein akan semakin meningkat seiring meningkatnya konsentrasi teh, padatan terlarut terekstrak dengan cepat pada menit pertama penyeduhan tetapi menurun secara bertahap dengan meningkatnya waktu penyeduhan, dan suhu penyeduhan yang direkomendasikan untuk menyeduh teh hitam adalah 100oC, lebih tinggi daripada teh hijau (75-90oC). Komposisi senyawa kimia minuman teh akan berpengaruh langsung terhadap kualitas minuman teh dan manfaat kesehatan yang dihasilkan. Hal ini didukung pula oleh Madsuda di dalam Ho et al. (2009) yang menyatakan bahwa perbedaan cara penyeduhan teh akan memengaruhi flavor dan cita rasa yang terbentuk.
Suhu penyeduhan dan waktu penyeduhan merupakan dua faktor yang sangat menentukan komposisi senyawa kimia yang terekstrak dari teh hitam. Oleh karena itu, kedua faktor tersebut dijadikan perlakuan dalam penelitian ini. Perlakuan penyeduhan yang dilakukan ialah penyeduhan teh hitam pada suhu awal 70oC, 85oC, dan 100oC dengan waktu penyeduhan masing-masing 5, 10, dan 15 menit. Konsentrasi teh yang digunakan adalah 0,02 g/ml (2 gram teh ditambah 100 ml air) pada semua perlakuan penyeduhan. Konsentrasi 0,02 g/ml dipilih sesuai dengan saran penyajian teh dengan tujuan mendapatkan cita rasa dan manfaat dari teh (Pettigrew 2009; Laresolo 2007). Walaupun demikian, konsentrasi tersebut tidaklah bersifat mutlak karena setiap orang memiliki selera yang berbeda terhadap cita rasa dan tujuan yang berbeda pula ketika mengkonsumsi teh. Disisi lain, Gondoin et al. (2010) menyatakan bahwa diperlukan konsentrasi yang lebih tinggi dari 0,01 g/ml untuk mendapatkan daya penghambatan teh hitam terhadap enzim lipase pankreas.
Variasi suhu penyeduhan didasarkan atas kebiasaan masyarakat dalam menyeduh teh sehari-hari. Pada umumnya, masyarakat menggunakan air mendidih untuk menyeduh teh dimana suhu air mendidih adalah sekitar 100oC. Suhu penyeduhan 70oC diperoleh dari kebiasaan masyarakat kota yang sering menggunakan air panas yang berasal dari dispenser untuk menyeduh teh dimana suhu air tersebut adalah sekitar 70oC. Suhu penyeduhan 85oC dipilih sebagai suhu antara suhu 70oC dan 100oC. Sementara itu, waktu penyeduhan divariasikan untuk mendapatkan komposisi komponen bioaktif terekstrak yang mungkin memiliki kemampuan yang berbeda dalam menghambat enzim lipase. Menurut Astill et al. (2001), senyawa-senyawa kimia seperti polifenol, kafein, tanin, dan theaflavin meningkat jumlahnya dengan cepat hingga batas tertentu dan menurun secara bertahap seiring meningkatnya suhu dan waktu penyeduhan teh hitam.
18
Salah satu tujuan dari penelitian ini adalah mengetahui pengaruh kondisi pencernaan secara in vitro terhadap kemampuan ekstrak teh hitam dalam penghambatan pencernaan lipid. Oleh karena itu, ekstrak teh hitam awal diberikan perlakuan simulasi proses pencernaan dengan cara mengubah nilai pH sesuai dengan kondisi saluran pencernaan. Makanan pertama-tama akan dicerna di mulut kemudian masuk ke lambung melalui kerongkongan. Kondisi di dalam lambung sangat asam, yaitu sekitar pH 1-2. Seberapa lama makanan berada di dalam tergantung dari jenis makanan dan jumlah yang dimakan. Aryani (2011) menyatakan bahwa diperlukan waktu sekitar 30 menit untuk makanan cair atau minuman mengalir dari lambung ke usus kecil. Miller (1998) juga menambahkan bahwa waktu yang diperlukan lambung untuk mencerna minuman adalah sekitar 30 menit. Setelah keluar dari lambung, makanan setengah cair yang memiliki pH sekitar netral akan bercampur dengan enzim-enzim pencernaan yang diproduksi oleh pankreas (Siregar 2004), seperti enzim lipase yang merupakan enzim pencernaan lipid. Berdasarkan hal tersebut, maka ekstrak teh hitam yang merupakan cairan atau minuman tersebut diubah pH nya sesuai dengan pH lambung dan didiamkan selama 30 menit, setelah itu diubah lagi pH larutannya menjadi sekitar pH 6.8 sesuai dengan kondisi usus halus.Ekstrak awal yang telah melalui simulasi pH pencernaan disebut ekstrak simulasi pH pencernaan. Berdasarkan data pH awal pada Tabel 7, ekstrak awal teh hitam memiliki pH sekitar 5, mendekati netral. Oleh karena itu, diperkirakan ekstrak teh hitam akan bercampur dengan enzim-enzim pencernaan termasuk lipase di dalam usus.
Tabel 7. Suhu akhir penyeduhan dan pH ekstrak awal
Perlakuan
Rata-rata pH awal
Rata-rata Suhu akhir
(Co) Suhu
(oC)
Waktu (menit)
70 5 5,02 ± 0,06 59,50 70 10 5,10 ± 0,08 52,50 70 15 5,20 ± 0,04 49,50 85 5 5,07 ± 0,00 65,00 85 10 5,15 ± 0,01 58,50 85 15 5,14 ± 0,00 51,00 100 5 5,14 ± 0,00 70,00 100 10 5,19 ± 0,01 59,50 100 15 4,90 ± 0,01 56,00
B.
Nilai pH Ekstrak Awal Teh Hitam
Teh hitam yang diekstrak dengan suhu dan waktu yang berbeda kemudian diukur derajat keasamannya menggunakan pH meter disebut sebagai pH ekstrak awal. Data hasil pengukuran pH ekstrak awal teh hitam dapat dilihat pada Tabel 7. Analisis statistik menunjukkan bahwa faktor suhu penyeduhan tidak berpengaruh terhadap nilai pH awal ekstrak teh (p>0.05), sedangkan waktu penyeduhan dan interaksi suhu dan waktu memiliki pengaruh (p<0.05) terhadap nilai pH ekstrak awal teh hitam (Lampiran 1 dan Lampiran 2).
19
mengikat protein. Nilai pH lingkungan yang mendekati titik isoelektrik protein (enzim) akan memberikan peluang yang lebih besar bagi senyawa tanin untuk berikatan dengan protein tersebut (Kawamoto et al. 1997).C.
Inhibisi Enzim Lipase
1.
Inhibisi Enzim Lipase Awal
Inhibisi enzim lipase pada ekstrak awal dilakukan untuk melihat kemampuan ekstrak teh hitam pada kondisi awal dalam menghambat aktivitas enzim lipase. Ekstrak teh awal merupakan ekstrak teh yang belum melalui proses pencernaan in vitro. Nilai inhibisi ekstrak awal digunakan sebagai pembanding bagi ekstrak simulasi pH pencernaan, sehingga dapat diketahui apakah proses pencernaan memiliki pengaruh terhadap kemampuan teh hitam dalam menghambat enzim lipase. Hasil penelitian menunjukkan ekstrak teh hitam yang diberi berbagai perlakuan suhu dan waktu penyeduhan memiliki daya inhibisi yang berbeda-beda terhadap enzim lipase, yaitu berkisar antara 14.77-63.21%. Masing-masing ekstrak teh beserta daya inhibisinya: ekstrak 70oC 5 menit (62.44%), 70oC 10 menit (54.99%), 70oC 15 menit (22.87%), 85oC 5 menit (33.33%), 85oC 10 menit (48.73%), 85oC 15 menit (54.85%), 100oC 5 menit (14.77%), 100oC 10 menit (44.91%), dan 100oC 15 menit (63.21%) (Gambar 11).
Gondoin et al. (2010), dengan metode yang sama dengan Mc Dougall et al. (2009), meneliti bahwa 2 gram teh hitam yang diseduh menggunakan 200 ml air mendidih selama 15 menit memiliki daya inhibisi terhadap enzim lipase pankreas. Namun, nilai inhibisi teh hitam lebih kecil dari teh putih dan teh hijau yang diseduh dengan konsentrasi dan cara yang sama. Kusano et al. (2008) menambahakan bahwa teh hitam memiliki daya inhibisi terhadap enzim lipase sekitar 40%-80%, tergantung dari pelarut yang digunakan. Teh hitam diekstrak menggunakan air dingin lalu dengan aseton, kemudian ekstrak aseton difraksionasi menjadi eter aseton (EtOAc), n-BuOH, fase air, dan endapan kental. Daya inhibisi lipase yang dihasilkan oleh tiap ekstrak berbeda-beda yaitu ekstrak EtOAc (47.7%), n-BuOH (46.8%), fase air (28.3%), dan endapan kental (61.1%). Metode pengujian yang digunakan dalam penelitian ini mengikuti metode yang dilakukan oleh Han et al. (2005) dengan glyceryl trioleat digunakan sebagai substrat.
Hasil analisis statistik ekstrak awal teh hitam menunjukkan bahwa faktor suhu, waktu, dan interaksi keduanya memiliki pengaruh yang signifikan (p< 0.05) terhadap daya inhibisi enzim lipase (Lampiran 4). Selanjutnya, analisis statistik dilanjutkan dengan melibatkan Orlistat menggunakan uji faktorial dimana hasilnya adalah ekstrak awal teh hitam pada semua perlakuan memiliki daya inhibisi yang berbeda secara signifikan (p<0.05) dan lebih rendah jika dibandingkan Orlistat (Lampiran 7). Hasil uji lanjut Duncan menunjukkan bahwa ekstrak teh penyeduhan 70oC 5 menit dan 100oC 15 menit memiliki daya inhibisi enzim lipase yang tidak berbeda nyata (p>0.05) dan merupakan ekstrak dengan daya inhibisi tertinggi jika dibandingkan ekstrak lainnya (Lampiran 7). Berdasarkan hasil tersebut, diduga bahwa senyawa atau komponen bioaktif yang berperan dalam menghambat aktivitas enzim lipase berbeda pada kedua ekstrak tersebut. Astill et al. (2001) menyebutkan bahwa perbedaan suhu dan waktu saat menyeduh teh dapat memengaruhi komposisi senyawa kimia yang terekstrak pada produk akhir minuman teh.
20
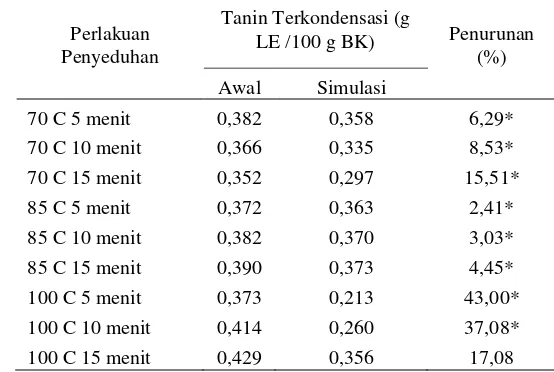
didominasi oleh epikatekin (1.21%), epikatekin galat (3.86%), dan epigalokatekin galat (4.63%) (Graham di dalam Liss 1984). Ketiga senyawa tersebut memiliki kemampuan menghambat aktivitas enzim lipase (Tucci et al.2010; Kusano et al.2008; Nakai et al.2005) dan juga tidak tahan panas (Hukmah 2007). Cheong et al.(2005) menambahkan bahwa waktu penyeduhan teh yang semakin lama akan menyebabkan dekomposisi senyawa epikatekin, epikatekin galat, dan epigalokatekin galat.Disisi lain, daya penghambatan enzim lipase pada ekstrak teh penyeduhan 100oC 15 menit diduga dihasilkan oleh suatu komponen bioaktif yang terekstrak mulai dari suhu sekitar 85oC hingga 100oC dan tahan terhadap panas karena daya inhibisi ekstrak 85oC dan 100oC cenderung meningkat seiring bertambahnya suhu dan waktu penyeduhan. Salah satu senyawa yang terdapat pada ekstrak teh hitam dan diduga sebagai senyawa tersebut adalah tanin. Senyawa tanin baik tanin terkondensasi maupun tanin terhidrolisis memiliki kemampuan menghambat aktivitas enzim lipase (Gondoin et al.2010; Kusano et al. 2008; Nakai et al. 2005) dan juga tahan terhadap panas (Clydesdale dan Francis 1976). Pettigrew (2009) menyatakan bahwa kadar tanin akan meningkat seiring semakin lamanya waktu penyeduhan teh.
Kusano et al.(2008) menemukan bahwa senyawa polimer hasil oksidasi atau polymer-like oxidation product (POPs) dan galloyl oolongtheanin pada teh hitam juga berperan dalam menghambat aktivitas enzim lipase pankreas. Senyawa polimer hasil oksidasi yang dimaksud adalah theaflavin, theasisnensis, dan thearubigin. Penelitian secara in vivo yaitu pemberian ekstrak teh hitam kepada tikus menunjukkan terjadinya penurunan berat badan tikus, dengan
21
Keterangan: Nilai yang diikuti oleh huruf yang berbeda menunjukkan inhibisi yang berbeda nyata (p<0.05) dengan uji lanjut Duncan
Gambar 11. Nilai inhibisi enzim lipase dari ekstrak teh hitam
2.
Inhibisi Enzim Lipase Setelah Melewati Simulasi pH Pencernaan
Kesembilan ekstrak teh setelah melalui simulasi pH sistem pencernaan mengalami penurunan kemampuan inhibisi enzim lipase, daya inhibisinya menjadi sekitar 6.83-54.23% (Gambar 11). Masing-masing ekstrak teh setelah melalui simulasi pH sistem pencernaan memiliki daya inhibisi yang berbeda, yaitu ekstrak 70oC 5 menit (47.92%), 70oC 10 menit (46.38%), 70oC 15 menit (17.46%), 85oC 5 menit (10.42%), 85oC 10 menit (28.66%), 85oC 15 menit (24.24%), 100oC 5 menit (6.83%), 100oC 10 menit (21.17%), dan 100oC 15 menit (54.23%) (Gambar 11). Hal yang sama terjadi pula pada Orlistat sebagai kontrol positif yaitu menurun menjadi sebesar 62.00% (Gambar 11). Kondisi ini dapat menggambarkan daya inhibisi teh hitam terhadap enzim lipase pankreas yang bekerja di usus halus.
Hasil analisis statistik menunjukkan bahwa setelah mengalami simulasi pH pencernaan secara in vitro, daya inhibisi ekstrak teh hitam pada semua perlakuan memiliki daya inhibisi yang berbeda secara signifikan (p<0.05) dan lebih rendah jika dibandingkan Orlistat (Lampiran 7). Hasil uji lanjut Duncan menunjukkan bahwa ekstrak teh penyeduhan 70oC 5 menit, 70oC 10 menit dan 100oC 15 menit memiliki daya inhibisi enzim lipase yang tidak berbeda nyata (p>0.05) dan merupakan ekstrak dengan daya inhibisi tertinggi jika dibandingkan ekstrak lainnya (Lampiran 7). Hasil tersebut mengindikasikan bahwa adanya kemungkinan pengaruh simulasi pH pencernaan terhadap kemampuan ekstrak teh hitam dalam menghambat aktivitas enzim lipase.
Uji T-Test dua berpasangan dilakukan untuk mengetahui apakah ada perbedaaan yang signifikan antara daya inhibisi ekstrak awal teh dengan daya inhibisi ekstrak teh setelah melalui simulasi pH pencernaan in vitro. Uji T-Test dua berpasangan dilakukan antara ekstrak awal dengan ekstrak setelah simulasi pH pencernaan pada setiap perlakuan penyeduhan. Hasil uji T-Test dua berpasangan dapat dilihat pada Lampiran 19 sampai Lampiran 27. Ekstrak teh awal yang mengalami penurunan daya inhibisi secara signifikan (p<0.05) setelah melewati simulasi pH
F E B C DE E A D F G e e bc ab d cd a cd e f 0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00 80,00 90,00
70 C 5 menit
70 C 10 menit
70 C 15 menit
85 C 5 menit
85 C 10 menit
85 C 15 menit
100 C 5 menit 100 C 10 menit 100 C 15 menit Orlistat In h ib isi Li p ase (% ) Perlakuan Penyeduhan
22
pencernaan adalah teh yang diseduh pada perlakuan 70oC 5 menit, 70oC 10 menit, 85oC 5 menit, 85oC 10 menit, 85oC 15 menit, 100oC 5 menit, dan 100oC 10 menit (Tabel 8). Hasil tersebut menunjukkan bahwa senyawa atau komponen bioaktif yang memiliki kemampuan menghambat enzim lipase peka terhadap perubahan pH. Disisi lain, ekstrak teh awal yang diseduh pada kondisi 70oC 15 menit dan 100oC 15 menit juga mengalami penurunan daya inhibisi setelah melewati simulasi pH pencernaan akan tetapi penurunannya tidak signifikan (p>0.05) (Tabel 8). Hal ini mungkin disebabkan oleh perubahan pH kurang memberi pengaruh terhadap kemampuan komponen bioaktif dalam menghambat enzim lipase.Tabel 8. Penurunan daya inhibisi lipase ekstrak teh hitam dan Orlistat setelah melalui simulasi pH pencernaan
Perlakuan Penyeduhan
Daya Inhibisi (%) Penurunan (%) Awal Simulasi
70o C 5 menit 62,44 47,92 14,52* 70o C 10 menit 54,99 46,38 8,61* 70o C 15 menit 22,87 17,46 5,40 85o C 5 menit 33,33 10,42 22,91* 85o C 10 menit 48,73 28,66 20,07* 85o C 15 menit 54,85 24,24 30,60* 100o C 5 menit 14,77 6,83 7,94* 100o C 10 menit 44,91 21,17 23,74* 100o C 15 menit 63,21 54,23 8,98 Orlistat
71,64
62,00
9,64*
Keterangan: * penurunan signifikan (p<0.05)
Namun, pada umumnya daya inhibisi enzim lipase pada semua ekstrak mengalami penurunan setelah melalui simulasi pH pencernaan. Hal tersebut menunjukkan bahwa kemampuan komponen bioaktif dalam menghambat enzim lipase menjadi menurun akibat terjadinya perubahan pH yang mungkin menyebabkan degradasi atau perubahan struktur molekul. Beberapa senyawa yang sebelumnya telah diduga sebagai komponen antilipase seperti senyawa polifenol dan theaflavin ternyata memiliki kepekaan terhadap perubahan pH. Setiap senyawa polifenol memiliki kestabilan yang berbeda-beda terhadap perubahan pH sehingga akan sangat memengaruhi kemampuannya dalam menghambat aktivitas enzim. Lee et al. (2005) menambahkan bahwa theaflavin stabil pada kondisi pH dibawah 6.5, namun terdegradasi secara perlahan pada pH 7.0-7.5 dan pada pH 9 terdegradasi dengan cepat.
23
D.
Total Fenol
Analisis total fenol dilakukan pada ekstrak teh awal maupun ekstrak teh setelah simulasi pH pencernaan dengan tujuan untuk mengetahui hubungan antara keberadaan senyawa fenolik dengan daya inhibisi enzim lipase pada teh hitam. Komponen fenolik di dalam pangan khususnya tumbuhan merupakan komponen hasil metabolisme sekunder dari phenylalanine atau tyrosine (Shahidi dan Ho 2005). Komponen tersebut dikategorikan sebagai senyawa yang paling sedikit memiliki satu cincin aromatik dengan satu atau lebih gugus hidroksil (Crozier 2003). Senyawa yang termasuk ke dalam komponen fenolik sangat beragam, mulai dari senyawa yang sederhana, berbobot molekul rendah, bercincin aromatik tunggal hingga senyawa yang kompleks seperti tanin. Senyawa yang mengandung banyak gugus fenolik disebut sebagai polifenol. Oleh karena itu, hasil analisis total fenol akan mewakili secara kasar jumlah komponen polifenol pada ekstrak.
Daun teh mengandung polifenol sebanyak 20-30% berat kering (Duthie dan Crozier 2003). Sudah banyak penelitian yang melaporkan bahwa senyawa polifenol memiliki andil dalam menghambat aktivitas enzim. Pembentukan kompleks protein-fenol disebabkan salah satunya oleh adanya ikatan hydrogen antara gugus hidroksil fenolik dengan gugus NH- dan CO- pada protein dan juga terjadinya ikatan kovalen dan hidrofobik pada reaksi tersebut (Haslam et al. 1999 diacu dalam Ali 2002). Kompleks protein-fenol ada yang bersifat dapat balik atau tidak dapat balik. Polifenol teroksidasi berinteraksi lebih kuat dengan protein (Siebert 1999 diacu dalam Ali 2002) dan dapat berinteraksi dengan asam amino yang dapat menghambat aktivitas enzim (Milic et al. 1968 diacu dalam Ali 2002).
Langkah awal dalam analisis total fenol ialah membuat kurva standar asam galat dengan cara memplotkan beberapa absorbansi dengan konsentrasi asam galat yang sudah ditentukan (Lampiran 8). Setelah didapatkan kurva standar maka akan diperoleh pula persamaan garis regresi linernya, yaitu y = 0.005x + 0.0031 dengan R2 = 0.9996. Kurva standar asam galat dapat dilihat pada Lampiran 8. Selanjutnya, nilai absorbansi dari analisis total fenol baik ekstrak teh awal maupun ekstrak teh simulasi pH pencernaan akan diplotkan ke dalam persamaan tersebut sehingga didapatkan konsentrasi total fenol dari masing-masing ekstrak. Hasil analisis total fenol dinyatakan sebagai Asam Galat Ekuivalen (GAE).
1.
Total Fenol Awal
Analisis total fenol pada ekstrak awal dilakukan untuk mengetahui kandungan senyawa fenolik di dalam teh hitam yang diekstrak dengan kombinasi suhu dan waktu penyeduhan yang berbeda. Hasil penelitian menunjukkan ekstrak teh hitam yang diberi berbagai perlakuan suhu dan waktu penyeduhan mengandung komponen polifenol dengan jumlah yang berbeda-beda (35.50-43.51 mg GAE/g berat kering). Masing-masing ekstrak teh beserta total fenolnya (dalam mg GAE/g berat kering): ekstrak 70oC 5 menit (39.12), 70oC 10 menit (39.00), 70oC 15 menit (36.02), 85oC 5 menit (40.00), 85oC 10 menit (35.50), 85oC 15 menit (37.43), 100oC 5 menit (43.51), 100oC 10 menit (41.67), dan 100oC 15 menit (42.22) (Gambar 12). Hal ini menunjukkan bahwa terdapat 39.12 mg komponen fenolik dalam 1 gram teh hitam (contohnya pada teh penyeduhan 70oC 5 menit), dan seterusnya. Moraes de Souza et al. (2008) meneliti bahwa kandungan komponen fenolik pada teh hitam sebesar 35-40 mg GAE/g sedangkan Lambert et al. (2005) melaporkan bahwa teh hitam mengandung komponen fenolik sebesar 30-40% berat kering. Perbedaan kandungan fenol dipengaruhi oleh varietas, unsur hara dalam tanah, musim, serta proses pengolahan pasca panen.
24
(2001), dimana perbedaan cara penyeduhan teh dapat memengaruhi komposisi senyawa kimia yang terdapat pada produk akhir minuman teh, termasuk komponen fenolik.Faktor-faktor yang memengaruhi ekstraksi komponen polifenol dari teh, diantaranya jenis pelarut, pH, suhu, jumlah tahap ekstraksi, ukuran dan bentuk partikel teh. Escribano dan Santos (2002) menyatakan bahwa suhu tinggi pelarut dapat meningkatkan efisiensi dari proses ekstraksi karena panas dapat meningkatkan permeabilitas dinding sel, meningkatkan kelarutan dan difusi dari senyawa yang diekstrak, dan mengurangi viskositas pelarut, namun suhu yang terlalu tinggi dapat mendegradasi senyawa polifenol. Harbourne et al. (2009) menambahkan bahwa penurunan total fenol pada suhu tinggi dikarenakan adanya penguapan komponen volatil fenol, penguraian senyawa fenol, dan penggabungan senyawa fenol tertentu dengan komponen lain. Marostica Jr et al. (2010) mengatakan bahwa beberapa komponen fenolik sensitif terhadap panas (thermosensitive). Cheong et al.(2005) meneliti tentang stabilitas panas pada senyawa fenolik dan melaporkan bahwa kadar epikatekin dan epigalokatekin galat menurun seiring dengan kenaikan suhu sedangkan epikatekin galat meningkat jumlahnya, dengan penggunaan suhu 60, 80, dan 100°C dengan waktu 0-300 menit.
Keterangan: Nilai yang diikuti oleh huruf yang berbeda menunjukkan nilai total fenol yang berbeda nyata (p< 0.05) dengan uji lanjut Duncan
Gambar 12. Nilai total fenol dari ekstrak teh hitam
CD CD AB DE
A BC
G EF FG
b cd a de bc cd g ef f 0,00 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00 45,00 50,00
70 C 5 menit
70 C 10 menit
70 C 15 menit
85 C 5 menit
85 C 10 menit
85 C 15 menit
100 C 5 menit
100 C 10 menit
100 C 15 menit To tal Fen o l ( m g G A E /g B K ) Perlakuan Penyeduhan
25
2.
Total Fenol Setelah Melewati Simulasi pH Pencernaan
Kesembilan ekstrak teh setelah melalui simulasi pH sistem pencernaan mengalami penurunan nilai total fenol, nilai total fenolnya menjadi sekitar 31.32-41.77 mg GAE/ g berat kering (Gambar 12). Masing-masing ekstrak teh setelah melalui simulasi pH sistem pencernaan memiliki kandungan total fenol (dalam mg GAE/ g berat kering) yang berbeda, yaitu ekstrak 70oC 5 menit (33.78), 70oC 10 menit (36.67), 70oC 15 menit (31.32), 85oC 5 menit (37.08), 85oC 10 menit (35.07), 85oC 15 menit (35.79), 100oC 5 menit (41.77), 100oC 10 menit (38.45), dan 100oC 15 menit (39.00) (Gambar 12). Hal ini mengindikasikan bahwa perubahan pH pada simulasi pencernaan yaitu pH 2 selama 30 menit lalu menjadi pH 6.8 memberikan efek penurunan kandungan komponen fenol dalam ekstrak teh hitam.
Analisis T-Test dua berpasangan dilakukan untuk mengetahui apakah ada perbedaaan yang signifikan antara kandungan total fenol ekstrak awal teh dengan kandungan total fenol ekstrak teh setelah melalui simulasi pH pencernaan in vitro. Analisis T-Test dua berpasangan dilakukan antara ekstrak awal dengan ekstrak setelah simulasi pH pencernaan pada setiap perlakuan penyeduhan. Hasil uji T-Test dua berpasangan dapat dilihat pada Lampiran 19 sampai Lampiran 27. Ekstrak teh awal yang mengalami penurunan nilai total fenol secara signifikan (p<0.05) setelah melewati simulasi pH pencernaan adalah teh yang diseduh pada perlakuan 70oC 5 menit, 70oC 10 menit, 70oC 15 menit, 85oC 5 menit, 85oC 15 menit, dan 100oC 10 menit (Tabel 9). Hasil tersebut menunjukkan bahwa komponen fenolik yang terkandung di dalam ekstrak teh peka terhadap perubahan pH. Disisi lain, ekstrak teh awal yang diseduh pada kondisi 85oC 10 menit, 100oC 5 menit, dan 100oC 15 menit juga mengalami penurunan nilai total fenol setelah melewati simulasi pH pencernaan akan tetapi penurunannya tidak signifikan (p>0.05) (Tabel 9). Hal ini mungkin disebabkan oleh perubahan pH kurang memberi pengaruh terhadap beberapa komponen fenolik tertentu. Namun, pada umumnya nilai total fenol pada semua ekstrak mengalami penurunan setelah melalui simulasi pH pencernaan. Hal tersebut menunjukkan bahwa kandungan fenolik pada ekstrak teh mengalami penurunan akibat terjadinya perubahan pH yang mungkin menyebabkan degradasi atau perubahan struktur molekul.
Tabel 9. Penurunan total fenol ekstrak teh hitam setelah melalui simulasi pH pencernaan
Perlakuan Penyeduhan
Total Fenol (mg GAE/g BK) Penurunan (%) Awal Simulasi
70 C 5 menit 39,122 33,783 13,65* 70 C 10 menit 39,008 36,668 6,00* 70 C 15 menit 36,022 31,329 13,03* 85 C 5 menit 40,003 37,084 7,30* 85 C 10 menit 35,498 35,074 1,19 85 C 15 menit 37,434 35,793 4,38* 100 C 5 menit 43,513 41,771 4,00 100 C 10 menit 41,670 38,449 7,73* 100 C 15 menit 42,222 39,001 7,63 Keterangan: * penurunan signifikan (p<0.05)
26
ketidakstabilannya bersifat tidak dapat balik, polifenol jenis asam klorogenat stabil pada pH asam, serta polifenol jenis katekin, epigalokatekin, asam ferulat, rutin, dan asam trans sinamat cenderung tahan degradasi akibat perubahan pH. Perbedaan tersebut dipengaruhi kekuatan resonansi dalam menstabilkan ion fenoksida dan quinon pada senyawa polifenol tersebut. Selain itu, komponen fenolik hasil oksidasi selama fermentasi daun teh menjadi teh hitam seperti theaflavin akan stabil pada kondisi pH dibawah 6.5, namun terdegradasi secara perlahan pada pH 7.0-7.5 dan secara cepat pada pH 9 (Lee et al. 2005). Berdasarkan hal tersebut, komponen-komponen fenolik yang terdapat pada teh hitam memiliki kestabilan terhadap kondisi pH yang berbeda-beda sehingga penurunan kandungan fenolik pada setiap ekstrak setelah melewati simulasi pH sistem pencernaan akan berbeda-beda pula.3.
Korelasi Total Fenol Dengan Inhibisi Enzim Lipase
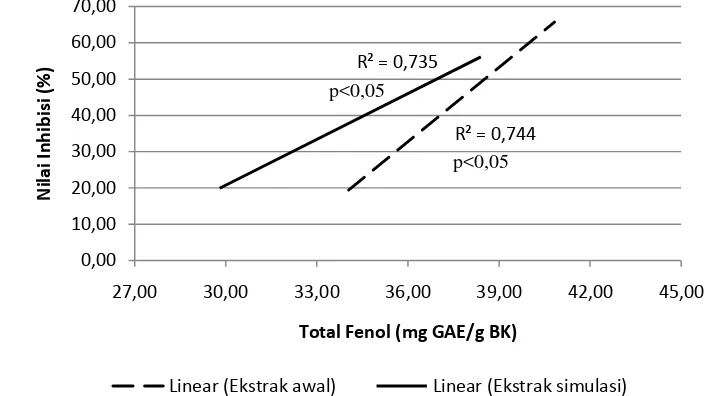
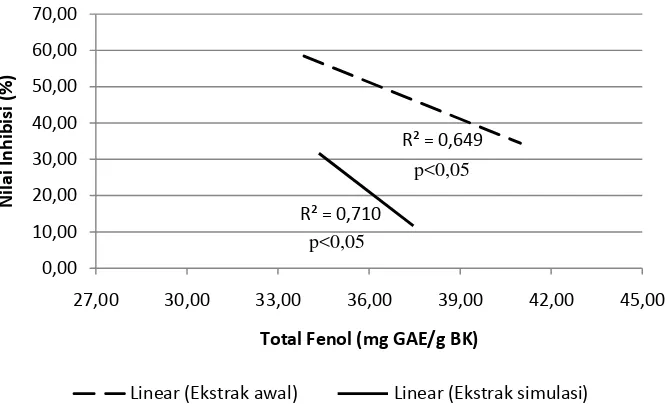
Korelasi dari dua percobaan yang berbeda dapat diketahui dengan menggunakan analisis korelasi bivariate. Analisis korelasi antara komponen fenolik dengan inhibisi enzim lipase dilakukan berdasarkan suhu penyeduhan, karena diduga komponen fenolik terekstrak pada setiap suhu penyeduhan berbeda-beda. Astill et al. (2001) menyatakan bahwa suhu penyeduhan lebih menentukan kompenen fenolik terekstrak pada minuman teh daripada waktu penyeduhan.
Hasil analisis pada suhu penyeduhan 70oC menunjukkan adanya korelasi positif antara kandungan komponen fenolik teh hitam baik pada ekstrak awal (0.744) maupun setelah melewati simulasi pH pencernaan (0.735) yang signifikan (p<0.05) dengan daya inhibisi enzim lipase (Lampiran 29). Pada suhu penyeduhan 85oC, hasil analisis menunjukkan adanya korelasi negatif antara kandungan komponen fenolik baik pada ekstrak awal (-0.649) maupun setelah melewati simulasi pH pencernaan (-0.710) yang signifikan (p<0.05) dengan daya inhibisi enzim lipase (Lampiran 30). Pada suhu penyeduhan 100oC, hasil analisis menunjukkan tidak adanya korelasi (p>0.05) antara kandungan komponen fenolik baik ekstrak awal maupun setelah melewati simulasi pH pencernaan dengan daya inhibisi enzim lipase (Lam