18
III. METODOLOGI PENELITIAN
3.1 BAHAN DAN ALAT
Bahan-bahan yang digunakan meliputi tahu dari pasar, bahan untuk solubilisasi, bahan untuk analisis metode Kjeldahl dan metode Bradford, dan bahan untuk analisis elektroforesis SDS-PAGE. Bahan untuk solubilisasi adalah 0,2 M tris, 0,2 M HCl, dan 2-mercaptoethanol. Bahan untuk analisis kadar protein metode Kjeldahl yaitu K2SO4, HgO, H2SO4 pekat, NaOH-5% Na2S2O3, H3BO3,
indikator metilen red-metilen blue, dan HCl. Bahan untuk analisis metode Bradford adalah coomassie brilliant blue G-250, etanol 95%, asam fosforat 85%, dan bovine serum albumin (BSA). Untuk analisis elektroforesis SDS-PAGE, bahan yang digunakan adalah akrilamid, N,N‘-metilen bisakrilamid, amonium persulfat (APS), sodium dodecyl sulfate (SDS), tetrametil-etilendiamin (TEMED), tris base, glisin, HCl, gliserol, bromphenol blue, 2-mercaptoethanol, coomassie brilliant blue R-250, methanol, asam asetat glasial, akuades, standar weight molecular protein (LMW).
Alat-alat yang digunakan adalah perangkat alat elektroforesis, tabung Eppendorf, mikropipet,
sentrifuge, gelas piala, timbangan analitik, pH meter, labu takar, gelas ukur, hot plate, sudip, sarung tangan, spektrofotometer, kuvet, pipet, pengaduk vortex, labu Kjeldahl, perangkat alat destruksi, perangkat alat destilasi, biuret, oven, cawan alumunium, desikator, dan perangkat alat analisis tekstur.
3.2 METODE
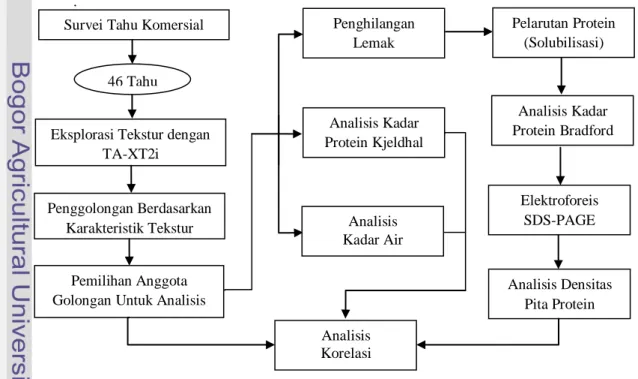
Secara umum penelitian ini bertujuan mencari korelasi antara beberapa faktor dan profil tekstur. Beberapa faktor yang dimaksud adalah kadar protein, kadar air dan pita protein, sedangkan profil tekstur yang dimaksud adalah elastisitas dan daya kunyah (chewiness). Bagan alir pelaksanaan penelitian disajikan pada Gambar 6.
.
Gambar 6. Diagram alir tahap penelitian 46 Tahu
Eksplorasi Tekstur dengan TA-XT2i Penghilangan Lemak Analisis Kadar Protein Kjeldhal Analisis Kadar Air Pelarutan Protein (Solubilisasi) Analisis Kadar Protein Bradford Elektroforeis SDS-PAGE Analisis Densitas Pita Protein Penggolongan Berdasarkan Karakteristik Tekstur Pemilihan Anggota Golongan Untuk Analisis
Analisis Korelasi Survei Tahu Komersial
19 Penelitian dimulai dengan survei tahu yang terdapat di pasaran. Lalu profil tekstur tahu tersebut dianalisis dengan menggunakan alat Texture Analyzer. Protein dari tahu yang telah dikelompokkan dan dipilih sesuai dengan nilai profil teksturnya kemudian diekstraksi menggunakan metode solubilisasi dengan menghilangkan lemaknya terlebih dahulu. Protein yang didapatkan dari metode solubilisasi tersebut dianalisis konsenstrasinya melalui metode Bradford dengan menggunakan alat spektrofotometer. Setelah itu dilakukan analaisis elektroforesis metode SDS-Page untuk mendapatkan pita protein. Terakhir dilakukan analisis korelasi untuk menjawab apakah keragaman dalam tekstur dapat dijelaskan oleh keragaman densitas pita protein.
Tahu juga dianalisis proteinnya menggunakan metode Kjeldhal untuk mengetahui pengaruh kadar protein terhadap tekstur tahu. Tahu yang digunakan dalam analisis ini bukanlah tahu yang telah dihilangkan lemaknya. Kemudian kadar air juga dianalisis untuk mengetahui pengaruh kadar air terhadap tekstur tahu.
3.2.1
Survei Tahu Komersial
Survei tahu komersial bertujuan mencari jenis dan merek tahu apa saja yang dijual di pasar Indonesia, khususnya area Bogor. Survei dilakukan dengan cara mengunjungi satu per satu pasar yang tersebar di wilayah Bogor. Pasar yang dipilih untuk disurvei adalah hypermarket dan supermarket. Semua tahu yang ditemukan dicatat, apapun jenis dan mereknya, kemudian dimasukkan ke dalam daftar tahu yang dianalisis. Setelah survei selesai, tahu kemudian dibeli untuk dianalisis karakteristik teksturnya. Pembelian dilakukan dengan membawa kotak dan tas pendingin yang telah diisikan dengan es batu, guna menghindari terjadinya perubahan pada tahu, baik secara fisik maupun secara kimia. Tahu kemudian dibawa ke laboratorium untuk dianalisis. Tahu yang tidak hendak dianalisis pada hari yang sama dengan pembelian, harus disimpan di dalam lemari es.
3.2.2
Eksplorasi Tekstur Tahu Secara Objektif
Tekstur tahu dianalisis dengan menggunakan alat Texture Analyzer TA-XT2i yang telah dilengkapi dengan sistem komputerisasi. Pengukuran dengan metode Texture Profile Analysis
dilakukan dengan terlebih dahulu memilih setting Texture Profile Analysis pada program Texture Analyzer. Sampel kemudian ditempatkan pada wadah uji dan dilakukan pengukuran tekstur melalui pemberian gaya tekan (compression) sebanyak dua kali yang merupakan simulasi dari proses pengunyahan di dalam mulut. Dimensi sampel yang diukur menggunakan Texture Analyzer
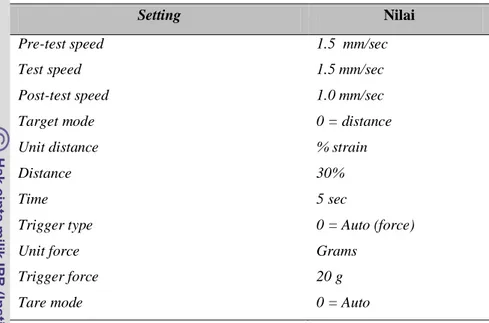
diusahakan dibuat sama yaitu bertebal 2.5 cm dan berdiameter 3 cm. Output hasil pengukuran berupa grafik kemudian dianalisis untuk menghitung parameter rheologi yang diinginkan. Setting yang dipilih dalam analisis profil tekstur ini dapat dilihat pada Tabel 5.
Hasil grafik yang didapat kemudian dianalisis parameternya melalui perhitungan yang masing-masing profil tekstur memiliki perhitungannya sendiri. Pembacaan grafik dibantu dengan menggunakan program Texture Exponent Lite 4.0.7.0 dari Visual Components Incorporation (http://www.stablemicrosystems.com). Melalui program ini didapatlah nilai titik tertinggi dari puncak kurva pertama, luas area puncak kurva 1 dan luas area puncak kurva 2, serta waktu yang digunakan saat penekanan pertama dan penekanan kedua. Setelah didapatkan nilai-nilai tersebut, lalu dihitung parameter profil teksturnya. Parameter profil tekstur yang dihitung adalah kekerasan, elastisitas, daya kunyah, kohesivitas, dan kelengketan (gumminess). Cara perhitungan untuk masing-masing parameter dapat dilihat pada Tabel 6.
20 Tabel 5. Setting TA-XT2i untuk pengukuran TPA curd
Tabel 6. Cara perhitungan parameter reologi tahu
Parameter Cara Perhitungan
Kekerasan Titik tertinggi pada kurva pertama
Elastisitas L2 L1 Daya kohesif A2 A1 Kelengketan A2 A1× Kekerasan Daya kunyah L2 L1× Kelengketan
Keterangan: L1 = waktu penekanan pertama L2 = waktu penekanan kedua A1 = luas area kurva pertama A2 = luas area kurva kedua
Parameter reologi tekstur tahu yang diteliti lebih jauh adalah elastisitas dan daya kunyah. Nilai RSD perlu dihitung untuk mendapatkan nilai yang terbaik. Setelah itu dilakukan eliminasi tahu berdasarkan nilai RSD tersebut. Nilai RSD yang dipilih adalah nilai yang jumlahnya kurang dari 10%. Setelah pengeliminasian menggunakan nilai RSD, pengelompokkan tahu perlu dilakukan, untuk mengurangi jumlah tahu yang akan dianalisis, sehingga tidak akan membuang waktu dan biaya. Pengelompokkan ini dilakukan dengan metode analisis beda nyata (ANOVA) menggunakan program SPSS 13.0. Pengelompokkan didasarkan pada perbedaan nyata (p=0.05) nilai elastisitas dan daya
Setting Nilai
Pre-test speed 1.5 mm/sec
Test speed 1.5 mm/sec
Post-test speed 1.0 mm/sec
Target mode 0 = distance
Unit distance % strain
Distance 30%
Time 5 sec
Trigger type 0 = Auto (force)
Unit force Grams
Trigger force 20 g
21 kunyah di antara tahu-tahu yang dianalisis. Masing-masing kelompok yang didapat berisi tahu-tahu yang tidak berbeda nyata nilai elastisitas dan daya kunyahnya, namun berbeda nyata dengan tahu-tahu di kelompok lain. Satu tahu dari masing-masing kelompok diambil untuk menjadi representatif bagi kelompoknya.
Rancangan untuk eksplorasi tekstur ini menggunakan rancangan acak lengkap dengan satu faktor dan dua kali ulangan. Faktor yang digunakan adalah merek tahu komersial. Model matematika untuk rancangan eksplorasi ini adalah:
Yij = µ+ αi + εi
Di mana: Y = respon pada eksplorasi α ke-i, ulangan ke-j µ = pengaruh rata-rata sebenarnya
α = pengaruh merek sampel tahu komersial ε = pengaruh acak (galat pada perlakuan ke i) i = 1, 2, 3,….., 46
3.2.3
Analisis Kadar Air Metode Oven (SNI, 1992 yang Dimodifikasi)
Sejumlah sampel (1-2 g) dimasukkan ke dalam cawan yang telah diketahui beratnya. Cawan kemudian dimasukkan ke dalam oven bersuhu 105oC hingga diperoleh berat yang konstan. Perhitungan kadar air dilakukan berdasarkan berat basah dengan menggunakan rumus :
Kadar air (%bb)=(a − b)
c × 100%
Di mana : a = berat cawan dan sampel awal (g) b = berat cawan dan sampel akhir (g) c = berat sampel awal (g)
3.2.4
Analisis Kadar Protein Metode Kjeldhal (AOAC, 1995)
Sejumlah sampel (100-250 mg) ditimbang ke dalam labu Kjeldahl. Kemudian ditambahkan 1.9 ± 0.1 g K2SO4 , 40 ± 10 mg HgO dan 2 ± 0.1 ml H2SO4. Sampel dididihkan selama 1-1.5 jam dengan
kenaikan suhu secara bertahap sampai cairan menjadi jernih, lalu didinginkan. Sejumlah kecil akuades diteteskan secara perlahan lewat dinding labu kemudian labu digoyang pelan agar kristal yang terbentuk larut kembali. Isi labu kemudian dipindahkan ke dalam alat destilasi dan labu dibilas 5-6 kali dengan 1-2 ml akuades. Langkah selanjutnya adalah penambahan 8-10 ml larutan 60% NaOH-5% Na2S2O3 ke dalam alat destilasi. Erlenmeyer yang berisi 5 ml H3BO3 dan 2 tetes indikator metilen
red-metilen blue diletakkan di bawah kondensor dengan kondisi ujung kondensor terendam di bawah larutan H3BO3. Destilasi dilakukan hingga diperoleh destilat sebanyak ± 15 ml. Destilat yang
diperoleh selanjutnya diencerkan hingga ± 50 ml dan dititrasi dengan HCl terstandar sampai terjadi perubahan warna menjadi abu-abu. Perhitungan kadar protein dilakukan dengan rumus :
% N = ml HCl − ml blanko
22
Kadar protein g
100g bahan basah = % N × Faktor Konversi
3.2.5
Tahap Penghilangan Lemak
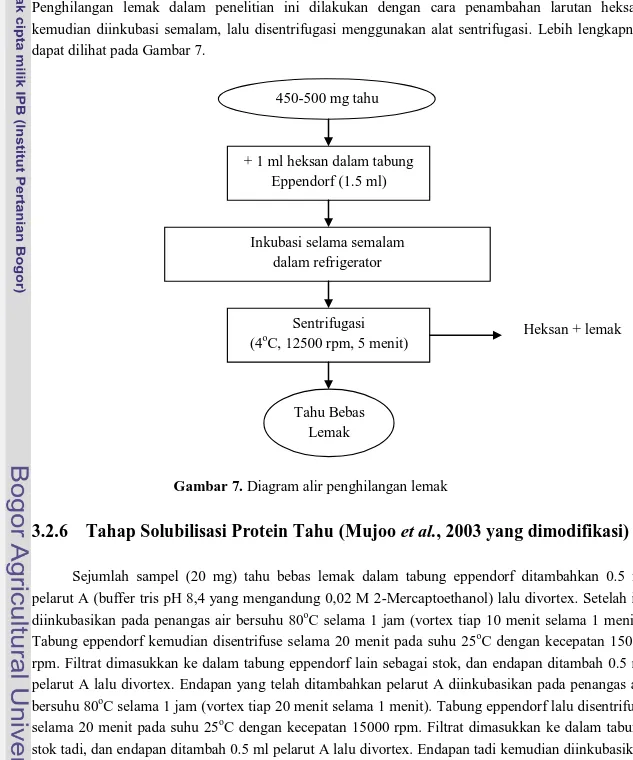
Lemak tahu komersial yang akan dianalisis proteinnya dengan metode Bradford, harus dihilangkan terlebih dahulu lemaknya. Penghilangan lemak ini dilakukan karena lemak dapat mengganggu proses solubilisasi protein yang ditujukan untuk analisis menggunakan metode elektroforesis SDS-PAGE. Lemak tahu dihilangkan dengan menggunakan larutan non polar. Penghilangan lemak dalam penelitian ini dilakukan dengan cara penambahan larutan heksan, kemudian diinkubasi semalam, lalu disentrifugasi menggunakan alat sentrifugasi. Lebih lengkapnya dapat dilihat pada Gambar 7.
Gambar 7. Diagram alir penghilangan lemak
3.2.6
Tahap Solubilisasi Protein Tahu (Mujoo
et al.
, 2003 yang dimodifikasi)
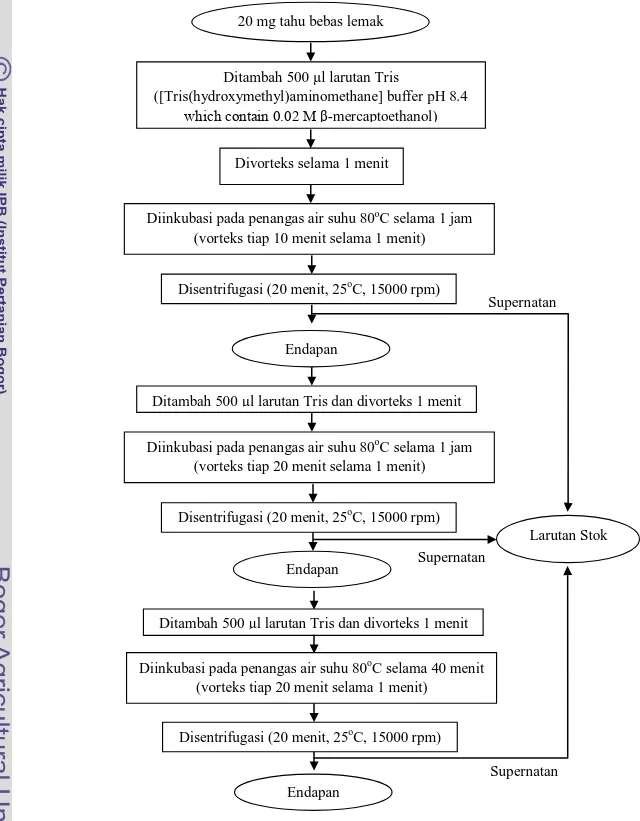
Sejumlah sampel (20 mg) tahu bebas lemak dalam tabung eppendorf ditambahkan 0.5 ml pelarut A (buffer tris pH 8,4 yang mengandung 0,02 M 2-Mercaptoethanol) lalu divortex. Setelah itu diinkubasikan pada penangas air bersuhu 80oC selama 1 jam (vortex tiap 10 menit selama 1 menit). Tabung eppendorf kemudian disentrifuse selama 20 menit pada suhu 25oC dengan kecepatan 15000 rpm. Filtrat dimasukkan ke dalam tabung eppendorf lain sebagai stok, dan endapan ditambah 0.5 ml pelarut A lalu divortex. Endapan yang telah ditambahkan pelarut A diinkubasikan pada penangas air bersuhu 80oC selama 1 jam (vortex tiap 20 menit selama 1 menit). Tabung eppendorf lalu disentrifuse selama 20 menit pada suhu 25oC dengan kecepatan 15000 rpm. Filtrat dimasukkan ke dalam tabung stok tadi, dan endapan ditambah 0.5 ml pelarut A lalu divortex. Endapan tadi kemudian diinkubasikan pada penangas air bersuhu 80oC selama 40 menit (vortex tiap 20 menit selama 1 menit). Endapan450-500 mg tahu
+ 1 ml heksan dalam tabung Eppendorf (1.5 ml)
Inkubasi selama semalam dalam refrigerator Sentrifugasi (4oC, 12500 rpm, 5 menit) Tahu Bebas Lemak Heksan + lemak
23 yang telah diinkubasi kemudian disentrifuse selama 20 menit pada suhu 25oC dengan kecepatan 15000 rpm. Filtrat dimasukkan ke dalam tabung stok. Lebih lengkapnya dapat dilihat pada Gambar 8.
Supernatan
Supernatan
Supernatan
Gambar 8. Diagram alir ekstraksi protein modifikasi Mujoo et al. (2003) 20 mg tahu bebas lemak
Ditambah 500 µl larutan Tris
([Tris(hydroxymethyl)aminomethane] buffer pH 8.4 which contain 0.02 M β-mercaptoethanol)
Divorteks selama 1 menit
Diinkubasi pada penangas air suhu 80oC selama 1 jam (vorteks tiap 10 menit selama 1 menit)
Disentrifugasi (20 menit, 25oC, 15000 rpm)
Endapan
Ditambah 500 µl larutan Tris dan divorteks 1 menit
Diinkubasi pada penangas air suhu 80oC selama 1 jam (vorteks tiap 20 menit selama 1 menit)
Disentrifugasi (20 menit, 25oC, 15000 rpm)
Endapan
Ditambah 500 µl larutan Tris dan divorteks 1 menit
Diinkubasi pada penangas air suhu 80oC selama 40 menit (vorteks tiap 20 menit selama 1 menit)
Disentrifugasi (20 menit, 25oC, 15000 rpm)
Endapan
24
3.2.7
Analisis Kadar Protein Metode Bradford (Bradford, 1976)
a. Preparasi pereaksi Bradford
Sebanyak 100 mg pewarna CBB G-250 dilarutkan ke dalam 50 ml etanol 95%. Selanjutnya ditambahkan 100 ml asam fosforat 85% dan ditepatkan hingga 1 L dengan menggunakan akuades. Larutan kemudian disaring menggunakan kertas Whatman No.1 dan disimpan dalam botol gelap.
b. Pembentukan kurva standar
Sebanyak 100 µl larutan BSA (100-1000 µg/ml) dipipet ke dalam tabung reaksi berukuran 1.2 x 10 cm. Tabung reaksi lalu ditambahkan 5 ml pereaksi Bradford. Larutan kemudian divorteks dan diukur secara spektrofotometri pada λ = 595 nm setelah 5 menit. Pembuatan blanko dilakukan dengan cara yang sama, hanya saja larutan BSA diganti dengan akuades. Sebanyak 100 ul akuades ditambahkan 5 ml perekasi Bradford dan diukur dengan cara yang sama. Kurva standar yang diperoleh digunakan untuk mengukur konsentrasi sampel.
c. Pengukuran sampel
Sebanyak 100 ul sampel dipipet ke dalam tabung reaksi berukuran 1.2 x 10 cm. Kemudian ditambahkan 5 ml pereaksi Bradford. Larutan kemudian divorteks dan diukur secara spektrofotometri pada λ = 595 nm setelah 5 menit.
3.2.8
Analisis SDS-
Polyacrylamide Gel Electrophoresis
(Bollag dan Edelstein,
1991)
Analisis SDS-PAGE dilakukan menggunakan gel akrilamid dengan konsentrasi separating gel
12% dan stacking gel 5%. Sampel yang dielektroforesis merupakan supernatan protein hasil ekstraksi protein dari sampel tahu. Tahapan yang dilakukan dalam analisis SDS-PAGE adalah 1) pembuatan
separating gel; 2) pembuatan stacking gel; 3) preparasi dan injeksi sampel; 4) running SDS-PAGE; 5) pewarnaan gel; 6) destaining gel; dan 7) penentuan berat molekul protein-protein yang terpisahkan. Pembuatan larutan stok dan larutan kerja untuk analisis SDS-PAGE dapat dilihat pada Lampiran 1.
a. Pembuatan separating gel
Dua lempengan kaca (mini slab) yang akan digunakan sebagai cetakan gel dirangkai sesuai dengan petunjuk pemakaian. Sebanyak 4 ml larutan A dipipet ke dalam gelas piala, kemudian ditambahkan 2.5 ml larutan B dan 3.5 ml akua-biodestilat. Campuran tersebut kemudian diaduk perlahan dengan menggoyangkan gelas piala. Selanjutnya, sebanyak 50 µl APS 10% dan 5 µl TEMED ditambahkan ke dalam campuran dan diaduk kembali dengan perlahan. Campuran dimasukkan ke dalam lempengan kaca (mini slab) dengan menggunakan mikropipet sampai sekitar 1 cm dari atas lempengan dan diusahakan agar tidak terdapat gelembung udara pada lempengan kaca tersebut. Bagian yang tidak diisi gel diberi akuades untuk meratakan gel yang terbentuk. Gel kemudian dibiarkan mengalami polimerisasi selama 30 - 60 menit.
b. Pembuatan stacking gel
Air akuades dibuang dari atas separating gel dan dikeringkan dengan menggunakan tisu. Akua-biodestilat, larutan A, dan larutan C masing-masing sebanyak 2.3 ml, 0.67 ml, dan 1.0 ml dicampurkan ke dalam gelas piala dan diaduk perlahan dengan menggoyangkan gelas piala. Selanjutnya, sebanyak 30 µl APS 10% dan 5 µl TEMED ditambahkan ke dalam campuran dan
25 diaduk kembali dengan perlahan. Campuran dimasukkan ke dalam mini slab, kemudian sisir dimasukkan dengan cepat tanpa menimbulkan gelembung udara. Stacking gel dibiarkan mengalami polimerisasi selama 30-60 menit. Setelah gel berpolimerisasi, sisir diangkat dari atas gel dengan perlahan dan slab ditempatkan ke dalam wadah elektroforesis. Buffer elektroforesis dimasukkan ke wadah elektroforesis di bagian dalam dan luar agar gel terendam.
c. Preparasi dan injeksi sampel
Sebanyak 40 µl sampel dimasukkan ke dalam tabung Eppendorf dan ditambahkan 10 µl buffer sampel. Tabung kemudian dipanaskan selama 5 menit dalam air mendidih 100 oC. Sampel kemudian siap diinjeksikan ke dalam sumur menggunakan mikropipet. Mikropipet dibilas menggunakan akuades setiap kali ingin memasukkan sampel lain. Pada salah satu sumur, ditempatkan sebanyak 7 µl protein marker.
d. Running SDS-PAGE
Katup elektroda dipasang dengan arus mengalir ke anoda. Sumber listrik dinyalakan dan dijaga konstan pada 70 V. Running dilakukan selama 180 menit sampai migrasi dye tersisa sekitar 0.5 cm dari dasar. Setelah selesai, aliran listrik dimatikan dan katup elektroda dilepaskan, lalu plat gel dipindahkan dari elektroda.
e. Pewarnaan gel
Gel diangkat dari slab dan dipindahkan ke dalam wadah tertutup yang telah berisi pewarna coomassie brilliant blue (kurang lebih 20 ml). Wadah tertutup tersebut kemudian digoyang-goyangkan sesekaliselama 5-10 menit.
f. Destaining gel
Gel diangkat dan dicuci menggunakan akuades beberapa kali. Larutan penghilang warna ditambahkan (destaining solution) dan digoyangkan sesekali hingga latar belakang pita protein menjadi terang. Selanjutnya, larutan penghilang warna dibuang dan gel siap dianalisis.
g. Penentuan berat molekul protein yang terpisahkan
Berat molekul protein sampel dapat dihitung dari persamaan regresi antara mobilitas relatif protein marker (penanda protein) dan logaritma dari berat molekul marker yang telah diketahui. Mobilitas relatif protein dihitung dengan membandingkan jarak migrasi protein, diukur dari garis awal separating gel sampai ujung pita protein, dan jarak migrasi tracking dye. Mobilitas relatif tersebut dirumuskan sebagai:
Rf = Jarak migrasi protein Jarak migrasi tracking dye
3.2.9
Analisis Densitas Pita Protein
Gel yang didapat dari tahap SDS-PAGE, kemudian didokumentasikan dalam bentuk gambar digital menggunakan alat Gel Doc (Bio-Rad). Densitas pita protein yang terlihat dalam gel tersebut kemudian dianalisis menggunakan perangkat lunak ImageJ 1.42q dari Wayne Rasband, National Institutes of Health, USA (http://rsb.info.nih.gov/ij). Melalui perangkat lunak ini, pita protein yang terdapat pada gel elektroforesis dikonversi menjadi grafik. Luas area di bawah grafik merupakan densitas pita protein. Gambar 9 menunjukkan contoh hasil berupa grafik yang didapatkan dari ImageJ 1.42q. Penentuan luas wilayah di bawah grafik juga ditentukan dengan menggunakan software ImageJ 1.42q ini. Rasio luas masing-masing wilayah di bawah grafik terhadap total luas wilayah satu sampel dikalikan dengan seratus persen adalah persentase dari subunit protein atau polipeptida. Persentase ini merupakan nilai komposisi subunit atau polipeptida suatu sampel.
26 Gambar 9. Grafik hasil dari ImageJ 1.42q yang disejajarkan dengan pita dari gel elektroforesis
Contoh perhitungan untuk penentuan komposisi subunit atau polipeptida 7S dan 11S bedasarkan grafik pada Gambar 9 adalah sebagai berikut:
Diketahui luas wilayah di bawah kurva (L):
L1= 3111.94; L2= 959.34; L3= 5721.15; L4= 3033.52; L5= 334.26 Luas total (Lt) = L1 + L2 + L3 + L4 + L5 = 13160.21
Persentase subunit atau polipeptida: α' & α = L1Lt × 100% = 23.65% β = L2Lt × 100% = 7.29% Asam (A1, A2, A3, A4) = L3 Lt × 100% = 43.47% Basa = L4Lt × 100% = 23.05% A5 = L5 Lt × 100% = 2.54%
3.2.10
Korelasi antara Tekstur dengan Densitas Pita Protein
Korelasi antara tekstur dengan persentase densitas protein dilakukan untuk mengetahui apakah terdapat hubungan yang nyata antara persentase densitas pita protein dan tingkat elastisitas atau daya kunyah tahu dari masing-masing kelompok. Korelasi dilakukan dengan menggunakan korelasi Pearson yang terdapat pada program SPSS 13.0.
α' & α β Asam (A1, A2, A3, A3) Basa A5 1 2 3 4 5