3. METODE PENELITIAN
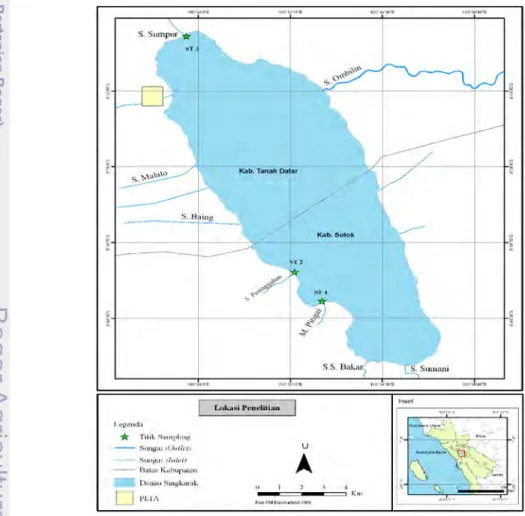
3.1. Lokasi dan Waktu PenelitianPenelitian ini dilakukan di Danau Singkarak, Provinsi Sumatera Barat (Gambar 2). Untuk keperluan penelitian ini ditentukan 3 (tiga) stasiun pengambilan contoh ikan (Gambar 2) yaitu: stasiun I di daerah Muara Pingai terletak di bagian barat daya Danau Singkarak, stasiun II di daerah muara Sungai Paninggahan juga perairan yang berada di sebelah barat daya Danau Singkarak (di barat laut Stasiun I), dan stasiun III di daerah muara Sungai Sumpur yaitu daerah yang mewakili ikan bilih yang hidup di bagian utara Danau Singkarak. Foto kondisi umum stasiun lokasi pengambilan contoh ikan bilih dan tumbuhan air yang ditemukan disajikan pada Lampiran 2.
Kegiatan penelitian berlangsung dari bulan Maret - Mei 2009 yang meliputi penentuan stasiun pengamatan, pengambilan contoh ikan, dan karakteristik lingkungan perairan (fisika, kimia dan biologi) di setiap lokasi pengambilan contoh, serta analisis contoh. Analisis terhadap ikan contoh dilakukan di Laboratorium Balai Benih Ikan (BBI) Sungai Janiah, Kabupaten Solok; Laboratorium Biomakro-2, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2. Alat dan Bahan
Alat dan bahan yang digunakan untuk penelitian kebiasaan makanan ikan bilih seperti tertera pada Tabel 3.
Tabel 3. Alat dan bahan serta kegunaannya dalam penelitian
Jenis Kegunaan
Alat
1. Jala lempar dan jaring insang atau jaring ”langli” (gillnet) dengan ukuran mata jaring 0,5 – 0,75
inchi.
Menangkap ikan bilih
2. Penggaris (ketelitian 0,1 cm) Mengukur panjang total ikan dan panjang usus ikan
3. Timbangan digital Precisa XT 220 A (ketelitian 0,01 gr)
Menimbang berat ikan, berat lambung ikan, berat isi lambung.
4. Stoples plastik besar Menyimpan ikan contoh
5. Alat bedah 1 set Membedah ikan
6. Botol film Wadah untuk mengawetkan organ
pencernaan
7. Gelas ukur (10 ml) Mengukur volume pengenceran isi organ pencernaan
8. Cawan petri dan pipet tetes Wadah pengenceran organisme makanan
9. Mikroskop binokuler, Sadwick Rafter Counting Cell (SRCC) , dan penutup
Pencacahan organisme makanan ikan
10. Buku identifikasi ikan dan plankton
Panduan identifikasi ikan dan organisme makanan
11. Tissue Pembersih
12. Plankton net No. 25 Mengambil sampel plankton
Tabel 3. (lanjutan)
Jenis Kegunaan
Bahan
1. Ikan bilih (Mystacoleucus padangensis)
Objek penelitian
2. Plankton Objek penunjang penelitian
3. Larutan formalin konsentrasi 10% dan 4%
Mengawetkan ikan dan alat pencernaan ikan
4. Lugol Mengawetkan plankton
5. Aquades Pengenceran isi lambung dan usus,
pembersih
3.3. Pengumpulan Data
Penelitian ini menggunakan data primer dan data sekunder. Data primer adalah data ikan contoh, hasil pengukuran panjang dan berat ikan, hasil identifikasi pakan alami, analisa kebiasaan makanan ikan, kelimpahan plankton, dan kualitas air Danau Singkarak (Tabel 3). Selanjutnya data sekunder terdiri atas keadaan umum dan karakteristik Danau Singkarak, peta lokasi, dan pustaka yang dijadikan sebagai acuan dalam penelitian ini.
3.3.1. Pengambilan ikan contoh di lapangan
Stasiun pengambilan contoh ikan ditentukan berdasarkan hasil survei pendahuluan dengan memperhatikan keberadaan ikan bilih dan daerah penangkapannya di Danau Singkarak, perbedaan kondisi habitat dan karakteristik morfologi perairan, berada di sekitar sungai yang menjadi inlet danau, aksesibilitas, dan kondisi cuaca ke lokasi yang direncanakan sebelumnya.
Menurut Purnomo et al.(2003) dan informasi dari masyarakat di sekitar Danau Singkarak, bahwa ikan bilih banyak di tangkap di sekitar muara Sungai Pingai, Paninggahan dan Sumpur. Daerah penangkapan lainnya adalah di beberapa lokasi perairan litoral danau dan bagian tengah, namun produksi hasil tangkapan relatif rendah. Hal ini mengingat bahwa ikan bilih banyak beruaya dari danau ke ketiga sungai tersebut.
Pengambilan ikan contoh pada masing-masing stasiun dilakukan satu kali untuk setiap stasiun pengamatan (satu kali perminggu selama dua bulan penelitian di
lapang), yaitu pada pagi hari (06.00-09.00 WIB). Penangkapan ikan menggunakan alat tangkap berupa jala lempar dan jaring langli. Foto alat tangkap ikan bilih dapat dilihat pada Lampiran 3. Ikan contoh diambil secara acak di setiap stasiun sekitar 10 ekor dari hasil tangkapan kemudian diawetkan dengan menggunakan formalin 10%, sedangkan usus ikan contoh menggunakan formalin 4%. Jumlah keseluruhan ikan contoh dari tiga stasiun pengamatan adalah 300 ekor. 105 ekor ikan contoh secara proporsional sekitar 30-40% mewakili ukuran yang ada di setiap stasiun digunakan dalam analisis makanan.
3.3.2. Pengamatan dan pengukuran parameter kualitas air
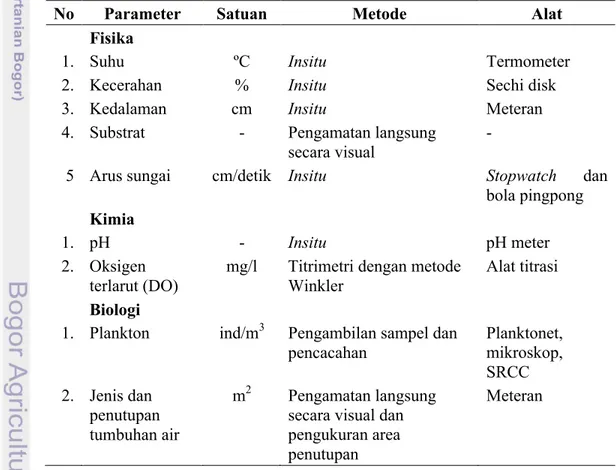
Beberapa parameter karakteristik lingkungan perairan yang diamati dan atau diukur di setiap stasiun pengambilan ikan contoh disajikan dalam Tabel 4.
Tabel 4. Parameter karakteristik lingkungan perairan yang diamati/ diukur, metode dan alat pengukurannya
No Parameter Satuan Metode Alat
Fisika
1. Suhu ºC Insitu Termometer
2. Kecerahan % Insitu Sechi disk
3. Kedalaman cm Insitu Meteran
4. Substrat - Pengamatan langsung
secara visual
-5 Arus sungai cm/detik Insitu Stopwatch dan
bola pingpong Kimia
1. pH - Insitu pH meter
2. Oksigen terlarut (DO)
mg/l Titrimetri dengan metode Winkler
Alat titrasi Biologi
1. Plankton ind/m3 Pengambilan sampel dan pencacahan Planktonet, mikroskop, SRCC 2. Jenis dan penutupan tumbuhan air m2 Pengamatan langsung secara visual dan pengukuran area penutupan
Pengamatan/ pengukuran kualitas air dilakukan satu kali di beberapa titik substasiun (kiri, kanan, dan tengah muara sungai).Pengukuran suhu, kecerahan, pH, dan oksigen terlarut (Dissolved oxygen, DO) dilakukan secara langsung di lapangan (in situ). Jenis dan kelimpahan plankton diketahui setelah pencacahan dan identifikasi di laboratorium dengan menggunakan buku Prescott (1961), Belcher dan Swale (1978) dan Nedham and Nedham (1963).
3.3.3. Pengamatan plankton
Pengambilan contoh plankton di lapangan dilakukan dengan mengambil air dengan volume lebih kurang 10 liter disetiap stasiun pengamatan, kemudian air disaring dengan menggunakan plankton net yang mempunyai ukuran 50 µm. Mengingat stasiun pengamatan mempunyai kedalam air < 10 m, maka penyaringan dilakukan secara horizontal di lapisan permukaan. Plankton konsentrat hasil penyaringan di tempat dalam botol koleksi (botol film), selanjutnya dipreservasi menggunakan Lugol dan dibawa ke laboratorium. Di laboratorium, plankton diamati di bawah mikroskop dengan perbesaran 10x10 dan pencacahannya menggunakan metode sensus.
Estimasi persentase volume dengan metode sensus dapat digunakan untuk menduga volume yang sesungguhnya. Hal ini dilakukan karena volume sebenarnya tidak dapat diukur langsung. Data estimasi volume nantinya akan digunakan sebagai dasar untuk menghitung indeks bagian terbesar (Index of Preponderance) suatu jenis makanan yang dimanfaatkan oleh ikan. Penggunaan metode ini adalah pada saat mengamati organisme di bawah mikroskop dalam satu kali sensus. Dengan teknik tersebut, maka total persentase volume masing-masing organisme yang teramati adalah 100%.
3.3.4. Pengamatan ikan contoh di laboratorium 3.3.4.1. Pengukuran panjang total dan berat ikan bilih
Pengukuran panjang total ikan dilakukan dari ujung kepala terdepan sampai ujung sirip ekor terbelakang dengan menggunakan penggaris (ketelitian 0,1 cm). Berat ikan ditimbang menggunakan timbangan digital dengan tingkat ketelitian 0,01 gr.
3.3.4.2. Analisis isi lambung (lambung palsu) ikan bilih
Ikan bilih contoh yang telah diawetkan di dalam larutan formalin 10% dibedah dengan menggunakan gunting bedah, dimulai dari anus menuju bagian depan yakni bagian atas perut hingga ke bagian operculum, kemudian menurun ke arah dada hingga ke dasar perut. Otot di buka sehingga organ dalam lainnya akan terlihat dan jenis kelamin berdasarkan ciri seksual primer dapat ditentukan dengan melihat morfologi gonadnya.
Selanjutnya saluran pencernaan yang bermula dari bagian esofagus hingga bagian anus, dipisahkan dari organ lainnya. Saluran pencernaan ikan diukur panjangnya dengan menggunakan penggaris, kemudian ditimbang beratnya. Kemudian dimasukkan ke dalam botol sampel untuk diawetkan dengan menggunakan larutan formalin 4%. Hal ini dilakukan untuk meneliti jenis komposisi makanan yang terdapat pada sistem pencernaan. Saluran pencernaan dikeringkan dari larutan pengawet (formalin), isi lambung dan usus dikeluarkan dan dipisahkan dari daging usus melalui pengerikan dan ditimbang berat makanan, kemudian diencerkan dengan aquades sebanyak 1-5 ml.
Analisis makanan meliputi jenis dan jumlah makanan, dilakukan dengan mengambil 1 ml dari isi usus yang telah diencerkan, kemudian diletakkan di atas gelas obyek (SRCC). Selanjutnya diamati, dicacah, dan diukur volume jenis-jenis organisme makanan yang ada. Pengamatan dilakukan di bawah mikroskop dengan perbesaran 10x10, menggunakan metode sensus dengan tiga kali pengulangan.
3.4. Analisis Data 3.4.1. Makanan
3.4.1.1. Indeks kepenuhan lambung (Index of Stomach Content)
Konsumsi pakan ikan dapat mendeskripsikan aktivitas makanan ikan dengan mengatahui keadaan isi lambung. Indeks kepenuhan lambung (ISC) bertujuan untuk mengetahui persentase konsumsi pakan ikan contoh yang dievaluasi dengan menggunakan rumus menurut Sphatura & Gophen (1982) in Sulistiono (1998), yaitu:
x100 BW SCW % ISC Keterangan:
ISC = Persentase konsumsi pakan relatif (%) SCW = Berat isi lambung (gr)
BW = Berat individu ikan (gr)
3.4.1.2. Indeks bagian terbesar (Index of Preponderance)
Perhitungan Index of Preponderance (IP) merupakan gabungan dari metode frekuensi kejadian dengan metode volumetrik. Penggunaan metode frekuensi kejadian mempunyai tujuan untuk mengetahui adanya organisme secara fisik dan tidak terpengaruh oleh ukuran atau jumlahnya (tidak mengandung unsur kuantitatif). Sementara itu, metode volumetrik merupakan metode yang baik untuk penilaian kuantitatif (Effendie 1979). Dengan demikian, Index of Preponderance (Indeks Bagian Terbesar) bertujuan untuk mengetahui jenis-jenis makanan apa saja yang dimakan oleh ikan serta dapat pula mengetahui makanan utama, pelengkap, dan makanan tambahan atau makanan pengganti ikan.
Indeks ini dapat diterapkan pada ikan apabila macam makanan tersebut kejadiannya hampir konstan dengan volume yang hampir konstan pula. Menurut Natarajan & Jhingran (1961)inEffendie (1979), Index of Preponderance diperoleh dengan formula sebagai berikut:
100 x 1 i O x i V IP n i i O x i V Keterangan: IP = Index of Preponderance
Vi = Persentase volume satu macam makanan
Oi = Persentase frekuensi kejadian satu macam makanan
Untuk menganalisis kebiasaan makanan pada ikan, maka urutan makanan dibedakan dalam tiga kategori berdasarkan persentase Index of Preponderance(IP) yaitu:
IP > 40% : Makanan utama 4% < IP < 40% : Makanan pelengkap IP < 4% : Makanan tambahan
3.4.1.3. Indeks pilihan jenis makanan (Index of Electivity)
Indeks pilihan jenis makanan (Index of Electivity) merupakan metode berdasarkan pada faktor ketersediaan sumberdaya makanan. Perhitungan indeks pemilihan makanan dilakukan dengan membandingkan sumberdaya makanan yang ada pada lambung ikan dengan sumberdaya yang ada dalam perairan. Perhitungan indeks ini menggunakan metode yang dikembangkan oleh Ivlev (1961) in Krebs (1989), dengan rumus : i n i r i n i r E Keterangan:
E = Index of Electivity; nilai E berkisar antara -1 hingga +1 = Persentase organisme ke-i yang dimakan
ni = Persentase organisme ke-i di dalam perairan 3.4.1.4. Relung makanan
a. Luas relung makanan
Luas relung makanan bertujuan untuk mengetahui selektivitas ikan berdasarkan jenis kelamin atau kelompok ukuran suatu spesies ikan. Perhitungan luas relung makanan dilakukan dengan menggunakan metode Levin’s (Krebs 1989), yaitu: n c i m 1 j 2 ij P 1 ij B Keterangan:
Bij = Luas relung kelompok ukuran ikan ke-i terhadap sumberdaya makanan ke-j
Pij = Proporsi dari kelompok ukuran ikan ke-i yang berhubungan dengan sumberdaya makanan ke-j
n = Jumlah kelompok ukuran ikan ( i = 1, 2, 3, ………n) m = Jumlah sumberdaya makanan ikan (j = 1, 2, 3, ……..m)
Selanjutnya dilakukan standarisasi nilai luas relung makanan, agar nilainya berkisar antara 0 – 1. Standarisasi tersebut menggunakan rumus yang dikemukakan Hulbert (1978) in Krebs (1989), yaitu:
1 n 1 B A B Keterangan :
BA = Standarisasi luas relung Levin’s (0-1) B = Luas relung Levin’s
n = Jumlah seluruh sumberdaya yang dimanfaatkan
b. Tumpang tindih relung makanan
Nilai tumpang tindih relung makanan menunjukkan adanya kesamaan jenis makanan yang dimanfaatkan oleh ikan, baik berdasarkan jenis kelamin maupun kelompok ukuran ikan atau kelompok jenis lainnya. Perhitungan tumpang tindih relung makanan menggunakan “Simplified Morisita Index” (Horn 1666 in Krebs 1989), yaitu: n 1 i m 1 j n 1 i l 1 k 2 ik P 2 ij P n 1 i m 1 j l 1 k PijPik 2 H C Keterangan:
Ch = Indeks Morosita yang disederhanakan
Pij, Pik = Proporsi jenis organisme makanan ke-i yang digunakan oleh 2 kelompok ukuran ikan ke-j dan kelompok ukuran ikan ke-k
n = Jumlah organisme makanan m,l = Jumlah kelompok ukuran ikan
Indeks ini digunakan untuk menghitung kesamaan makanan antara ikan jantan dan betina serta antar kelompok ukuran ikan.
3.4.2. Kelimpahan plankton
Pencacahan organisme plankton dilakukan dengan menggunakan metode sensus. Jumlah individu plankton per liter air dihitung dengan menggunakan rumus yang diusulkan oleh Effendie (1979) sebagai berikut:
a A x cg V x u cg A x t V x n N
Keterangan:
N = Jumlah total fitoplankton (ind/m3)
n = Jumlah rataan individu yang teramati (ind) u = Ulangan
Vt = Volume air tersaring (ml)
Vcg = Volume air dibawah coverglass (ml) Aa = Luas satu lapang pandang (mm2) Aa = Luas coverglass (mm2)
3.4.3. Indeks keanekaragaman (H’)
Keanekaragaman jenis menunjukkan jumlah jenis organisme yang terdapat dalam suatu area. Untuk menentukan keanekaragaman plankton yang ada dalam suatu komunitas digunakan Indeks Shanon-Wiener dengan rumus sebagai berikut (Wilhm & Dorris 1968 inHawkes 1979) :
i p s i i p log2 1 H' Keterangan :
H’ = Indeks diversitas (bits per individu) pi =
N ni
ni = Jumlah individu dalam satu spesies
N = Jumlah total individu spesies yang ditemukan s = Jumlah spesies
Wilhm dan Dorris (1968) in Hawkes (1979) menggolongkan tingkat diversitas berdasarkan kepadatan plankton kedalam 3 kriteria yaitu :
H’ < 3,32 : Diversitas rendah 3,32 ≤ H’ < 9,97 : Diversitas sedang
H’ ≥ 9,97 : Diversitas tinggi
3.4.4. Indeks keseragaman (E)
Keseragaman adalah komposisi individu tiap spesies yang terdapat dalam suatu komunitas (Krebs 1989). Kisaran nilai indeks keseragaman antara 0 sampai 1. Hal ini dapat dilihat dengan membandingkan indeks keanekaragaman dengan nilai maksimumnya, seperti rumus berikut :
maks H
H' E
Keterangan:
Hmaks : Nilai indeks keseragaman maksimum (Log2 s) s : Jumlah spesies
E : Indeks keseragaman H’ : Indeks keanekaragaman
Dengan kriteria : E ~ 0 : terdapat dominansi spesies E ~ 1 : jumlah individu tiap spesies sama 3.4.5. Indeks dominansi (C)
Indeks dominansi merupakan seberapa banyak suatu organisme yang mendominansi secara ekstrim organisme lain dalam suatu ekosistem. Untuk menentukan indeks dominansi dapat digunakan rumus sebagai berikut (Simpson’s 1949 inOdum 1993) : 2 Ni n C Keterangan :
C = Nilai indeks dominansi
ni = Jumlah individu dalam satu spesies
N = Jumlah total individu spesies yang ditemukan 3.4.6. Hubungan panjang -berat
Hubungan panjang - berat menggunakan rumus Hile (1963) inEffendie (1979) yaitu sebagai berikut:
b aL W
Nilai a dan b diduga dari bentuk linear persamaan di atas yaitu : Log W = Log a + b Log L
Keterangan:
W = Berat tubuh ikan (gr) L = Panjang tubuh ikan (mm) a dan b = Konstanta
Dari persamaan tersebut dapat diketahui pola pertumbuhan panjang dan berat ikan tersebut. Nilai b yang diperoleh digunakan untuk menentukan pola pertumbuhan yang dianalisis dengan:
(1) b = 3, pertumbuhan isometrik, yaitu pola pertumbuhan panjang sama dengan pola pertumbuhan berat atau
(2) b ≠ 3, pertumbuhan allometrik, pola pertumbuhan panjang tidak sama dengan
pola pertumbuhan berat.
Jika b > 3 : allometrik positif, artinya pertambahan berat lebih dominan daripada pertambahan panjangnya.
Jika b < 3 : allometrik negatif, artinya pertambahan panjang lebih dominan daripada pertambahan berat.
Kesimpulan dari nilai b yang diperoleh ditentukan dengan menggunakan uji – t pada selang kepercayaan 95% (α= 0,05) (Steel & Torrie 1989).
(a) Hipotesis: Ho : b = 3 ( pola pertumbuhan isometrik) H1 : b ≠3 ( pola pertumbuhan allometrik)
(b)
t
hitung = b-3 / SbSb : Simpangan baku
(c) Wilayah kritis : t < -1,96 dan t < 1,96
(d) Keputusan diperoleh dengan membandingkan nilai thitung dengan ttabel
(1) apabila
t
hitung>t
tabel, maka keputusan tolak hipotesis nol (Ho)(2) apabila
t
hitung<t
tabel, maka keputusan gagal tolak hipotesis nolKeeratan hubungan antara panjang dan berat ikan ditunjukkan dengan nilai korelasi (r) yang diperoleh. Apabila nilai r mendeteksi +1 atau -1, maka hubungan kedua peubah itu kuat dan terdapat korelasi yang kuat, akan tetapi bila nilai r mendekati nol (0), maka hubungan keduanya sangat lemah atau bahkan tidak ada (Walpole 1995).
3.4.7. Faktor kondisi
Faktor kondisi (K) berdasarkan pada panjang dan berat ikan contoh. Ikan memiliki pertumbuhan yang bersifat isometrik apabila nilai b = 3, maka faktor kondisi menggunakan rumus dengan persamaan (Effendie 1979):
3 L 5 10 W K Keterangan: K = Faktor kondisi
W = Berat rata-rata ikan (gr)
L = Panjang total rata-rata ikan (mm)
Ikan yang mempunyai pertumbuhan yang bersifat allometrik apabila b ≠ 3,
maka persamaan yang digunakan adalah:
b aL W K Keterangan : K = Faktor kondisi
W = Berat rata-rata ikan (gr)
L = Panjang total rata-rata ikan (mm) a & b = Konstanta dari regresi
3.4.8. Pertumbuhan
3.4.8.1. Identifikasi kelompok ukuran
Kelompok ukuran ikan bilih diidentifikasi atau dipisahkan menggunakan metode Battacharya (Sparre dan Venemma 1999). Metode Battacharya merupakan metode pemisahan kelompok umur secara grafis. Metode ini pada dasarnya terdiri atas pemisahan sejumlah distribusi normal, masing-masing mewakili suatu kohort ikan, dari distribusi keseluruhan, dimulai dari bagian sebelah kiri dari distribusi total. Begitu distribusi normal yang pertama telah ditentukan, bagian ini disingkirkan dari distribusi total dan prosedur yang sama diulangi selama hal ini masih mungkin dilakukan untuk memisahkan distribusi-distribusi normal dari distribusi total (Sparre dan Venema 1999). Keseluruhan proses dapat dibagi ke dalam lima langkah sebagai berikut :
Langkah 1 : Menentukan suatu kemiringan yang tidak terkontaminasi (bersih dari suatu distribusi normal pada sisi kiri dari distribusi total). Langkah 2 : Menentukan distribusi normal dari kohort yang pertama dengan
Langkah 3 : Menentukan jumlah ikan per grup panjang yang menjadi bagian dari kohort pertama dan kemudian kurangkan mereka dari distribusi total.
Langkah 4 : Mengulangi proses ini untuk distribusi normal berikutnya dari kiri, sampai tidak lagi dapat ditemukan distribusi normal yang bersih.
Langkah 5 : Mengaitkan nilai rata-rata panjang dari kohort-kohort yang ditentukan dalam langkah 1 sampai langkah 4 terhadap perbedaan umur antara kohort-kohort tersebut.
3.4.8.2. Plot Ford-Walford (L∞, K) dan t0
Plot Ford-Walford merupakan salah satu metode paling sederhana dalam menduga parameter pertumbuhan L∞dan K dari persamaan von Bertalanffy dengan
interval waktu pengambilan contoh yang sama (King 1995). Berikut ini adalah persamaan pertumbuhan von Bertalanffy.
Lt= L∞(1-e[-K(t- t0)])
Keterangan :
Lt : Panjang ikan pada saat umur t (satuan waktu)
L∞ : Panjang maksimum secara teoritis (panjang asimtotik)
K : Koefisien pertumbuhan (per satuan waktu) t0 : umur teoritis pada saat panjang sama dengan nol
Penurunan plot Ford-Walford didasarkan pada persamaan pertumbuhan von Bertalanffy dengan t0 sama dengan nol, maka persamaannya menjadi sebagai berikut.
Lt = L∞(1-e[-K(t- t0)])... (1)
Lt = L∞- L∞e[-Kt]
L∞- Lt = L∞e[-Kt]... (2)
Setelah Lt+1disubtitusikan ke dalam persamaan (1) maka diperoleh perbedaan persamaan baru tersebut dengan persamaan (1) seperti berikut.
Lt+1 - Lt= L∞(1-e[-K(t+1)]) - L∞(1-e[-Kt])
= - L∞e[-K(t+1)]+ L∞e[-Kt]
Persamaan (2) disubtitusikan ke dalam persamaan (3) sehingga diperoleh persamaan sebagai berikut.
Lt+1 - Lt = (L∞- Lt) (1-e[-K])
= L∞(1-e[-K]) - Lt+ Lt e[-K]
Lt+1 = L∞(1-e[-K]) + Lt e[-K]... (4) Persamaan (4) merupakan bentuk persamaan linear dan jika Lt (sumbu x) diplotkan terhadap Lt+1 (sumbu y) maka garis lurus yang terbentuk akan memiliki kemiringan (slope) (b) = e[-K] dan intersep (a) = L∞ (1-e[-K]). Lt dan Lt+1merupakan panjang ikan pada saat t dan panjang ikan yang dipisahkan oleh interval waktu yang konstan (Pauly 1984).
Umur teoritis ikan pada saat panjang sama dengan nol dapat diduga secara terpisah menggunakan persamaan empiris Pauly (Pauly 1983 in Lelono 2007) sebagai berikut.
Log (-t0) = 0,3922 – 0,2752 (Log L∞) – 1,038 (Log K)
3.4.9. Seksualitas dan tingkat kematangan gonad (TKG)
Untuk menentukan jenis kelamin ikan dibedah dan diamati keadaan gonadnya. Selanjutnya diamati pula tanda-tanda luar (tanda seks primer) yang mungkin dapat dipakai untuk membedakan ikan bilih jantan dengan ikan betina yaitu ukuran tubuh, warna, atau tanda lainnya.
Penentuan TKG mengacu kepada modifikasi cara Cassie in Effendie 1979 in Syandri 1996. Dengan cara ini tingkat perkembangan ovari dan testis ikan bilih digolongkan menjadi lima tingkat seperti pada Tabel 5.
Tabel 5. Kriteria penilaian perkembangan ovari dan testis ikan bilih
TKG Ovari Testis
I Ovari kecil memanjang seperti benang, warna jernih dan permukaan licin
Testis kecil memanjang, warna jernih
II Ukuran ovari lebih besar, warna lebih gelap kekuningan. Telur belum terlihat dengan mata telanjang
Ukuran testis lebih besar, warna putih seperti susu, bentuk lebih jelas dari pada tingkat satu.
Tabel 5. (lanjutan)
TKG Ovari Testis
III Ovari berwarna kuning, butir-butir telur mulai kelihatan dengan mata telanjang.
Permukaan testis bagian ventral tampak berlekuk, warna semakin putih dan ukuran semakin besar. IV Ovari makin besar, butir-butir telur
berwarna kuning, mudah dipisahkan, mengisi 1/2 - 2/3 rongga perut.
Seperti pada tingkat III, berukuran lebih besar, testis semakin pejal. V Stadium pasca pemijahan, ovari
berkerut, dinding tebal, terdapat telur sisa, terutama dekat lubang pelepasan.
Testis bagian belakang kempis dan di bagian dekat saluran pelepasan masih berisi spermatozoa.