R. SlIbagio/lo, dkk. ISSN 0216 - 3128
2/9
KINETIKA
REAKSI
PROSES
ADSORPSI
CAMPURAN
URANIUM DAN MOLIBDENUM
DALAM ZEOLIT
R. Subagiono dan Dwi Biyantoro
Pusat Teknologi Akselerator dan Proses Bahan - BATAN
ABSTRAK
KINETIKA REAKSI PROSES ADSORPSI CAMPURAN URANIUM DAN MOLlBDENUM DALAM ZEOLIT. Zeolit alam Gunung Kidul. Yogyakarta dipersiapkan dengan cara dicuci menggunakan larutan HCI 0.1 M, kation-kation alkali atau alkali tanah dari zeolit alam ditukar dengan NH/ dengan memakai lamtan NH~CI 0,5 M dan dikeringkan pada suhu 200"c. Zeolit yang telah diaktifkan secara kimia tersebut digzmakan untuk memisahkan campuran uranium (U) dan molibdenum (Mo) dengan cara adsorpsi. Pemisahan campuran (U, Mo) di/akukan dengan menggunakan zeolit berukuran butir -200 +325 mesh untuk kadar U = 31.000 ppm dan Mo = 100 ppm di dalam lamtan H/';O~ 0.05 M dengan waktu pemisahan I jam. Pada kondisi ini diperoleh hasi/ ni/ai faktor pemisahan (U/Mo) = a = 0,3811. Evaluasi data hasi/ kinetika proses adsorpsi campuran U dan Mo dalam zeolit memakai pendekatan model "Langmuir-lIinshclwood" (LII), diperoleh persamaan garis lurus untuk uranium yaitu: y = -0,0835 x + 5,4804 dan molibdenum: y = -0,0152 x + 1.3482.
ABSTRACT
REACTION KINETICS OF THE SORPTION PROCESS OF URANIUM AND MOLlBDENUM MIXTURE IN THE ZEOLITE. The natural zeolite from Gunung Kidul, Yogyakarta Indonesia, which was washed by 0.1M I/CI solution. alkali or alkaline earth cations ofnall/ral zeolite was exchanged for NI/~' by using 0.5 M of N II~CI and was dried at 200 "C. This zeolite which was Chemically activated was used j(ir the separation process of uranium (U) and molibdemll1z (Mo) mixture hy sorption. nze separation of (U, Mo) lIIixture \l'lIS clOIle!hy usillg zeolite 0./ -200 1325 IIIl'shj(ir 1I 31,000 fill/n allcl A/o /f)O/i/IIII
ill
0.05 M IhSO~ solution with extraction time0/
I hour. By using this method a separationfactor of U and Mo gained \l'as (lilA/o) = a = 0,3811. The evaluation ./rOIll results 0./ the kinetics process using "Langmuir-lIinshclwood" (LlI) model approach. gained the linier regression equation for: uranium m'y = -O.rJ835 x +5..1804 and molibdenum: y = -0.0152 x+ 1.3482.PENDAHULUAN
Zeolit
banyakadalahterdapatsalahdi bumisatu jenisIndonesia.mineralPotensiyang zeolit alam di Indonesia cukup besar dan telah diketahui oleh para ahli geologi sekitar 47 lokasi (kota), terbanyak tersebar di sekitar pulau Jawa<I ).Zeolit alam selain dapat digunakan untuk bidang petemakan, perikanan, pertanian, kedokteran / kesehatan, juga dapat dimanfaatkan untuk menangani proses olah ulang bahan bakar reaktor dan limbah industri nuklir.
Di dalam bahan bakar bekas reaktor nukJir terutama jenis PWR pada umumnya masih banyak mengandung uranium (U) dan ini perIu dipisahkan dari unsur-unsur radioaktif hasil belah dari reaksi inti di dalam reaktor nuklir bila diinginkan untuk dipakai lagi. Molibdinium (Mo) adalah salah satu hasil belah yang mempunyai sifat kimia mirip dengan uranium.
Teknik pemisahan U dan Mo telah banyak dilakukan misalnya dengan cara pengendapan, ekstraksi cair-cair atau memakai resin penukar ion. Kajian kemungkinan pemanfaatan zeolit untuk memisahkan U dari Mo merupakan hal yang sangat menarik, karena zeolit alam mudah diperoleh dengan harga yang murah dan dalam jumlah yang berlimpah.
Zeolit adalah senyawa kristalin dengan struktur kerangka tiga dimensi yang berongga, kerangka tiga dimensi ini terbentuk oleh tetrahedral aluminat
(AI04t
dan silikat(Si04t.
Dalam .struktur kristal tersebut terdapat sisi aktif yang dapat menjadikan zeolit berlaku sebagai penukar kation dan sebagai adsorben yang selektif< 2, 3).Keberhasilan pemisahan antara U dan Mo menurut Tompkins, E.R <4 ) ditunjukkan oleh nilai faktor
pemisahan
FP=a= {XA/(A-XA)}/ {XB/(A-XB) (I)
220 ISSN 0216 - 3128 R. Subagiono, dkk.
Dimana A, B masing-masing adalah berat ion penukar
U
dan Mo di dalam larutan sebelum proses pemisahan dilakukan. XA, XB masing-masing adalah berat ion penukar U dan Mo di dalam padatan zeolit. Berdasarkan mekanisme tersebu.t di atas maka dilakukan pengkajian proses untuk memanfaatkan zeolit alam dalam upaya memisahkan uranium dari molibdenum, yaitu pengaruh suhu kalsinasi zeolit, keasaman larutan campuran U dan Mo, dan waktu pemisahan.Berdasarkan sifat tersebut maka zeolit diharapkan dapat digunakan sebagai adsorben memisahkan uranium dan molibdenum. Untuk mengetahui bagaimana peranan mekanisme kinetika reaksi proses adsorpsi U dan Mo dalam zeolit tersebut sangat menarik untuk dipelajari.
Dengan dikuasainya pengetahuan tentang kinetika reaksi tersebut akan banyak memberikan informasi penting seperti fenomena transport, transformasi, interaksi dan akumulasi polutan tersebut di alam Iingkungan(3,4). Informasi ini sangat penting bagi pengambil keputusan terhadap kemungkinan terjadinya kontaminasi ataupun kerusakan lingkungan yang disebabkan oleh U dan Mo, sehingga pencemarannya sedini mungkin dapat dihindari.
Untuk mencapai tujuan diatas, pada penelitian ini akan dipelajari kinetika proses adsorpsi U dan Mo. Data eksperimen proses adsorpsi yang diperoleh akan dievaluasi dengan model kinetik nonlinier "Langmuir-Hinshe/wood".
Model ini dipilih karena keungulannya dalam menerangkan proses adsorpsi logam ke dalam zeolit (LH)(4).
ko sebagai intercept dan kecepatan reaksi dapat dihitung.
TATAKERJA
Bahan
Bahan - bahan yang dipakai untuk penelitian ini adalah U02(N03)2. 6 H20, (NH4)6Mo7024' 4 H20 dan H2S04 buatan dari E. Merck digunakan untuk membuat larutan campuran ( U, Mo ), HCI dan NH4CI buatan dari E. Merck digunakan untuk proses pengaktifan zeolit alam yang diambil dari desa Suru, Gedang sari, kabupaten Gunung Kidul. Zeolit alam ini mempunyai kandungan Si02= 62,75 %, Ah03
=
13,63 %, Fe203=
2,12 %, CaO=
3,42 %, MgO=
0,87 %, Na20=
1,32 %, K20=
1,39 %. AlatDi dalam pemisahan campuran U dan Mo dengan zeolit maka untuk mendapatkan zeolit dengan ukuran tertentu digunakan pengayak HA VER EML. Larutan campuran U dan Mo dipisahkan dengan zeolit di dalam tabung plastik oleh sistem penggojok putar : R.R Mini, Karl Kolb, D-6072. Kadar U di dalam larutan hasil pemisahan ditentukan dengan spektrometer pendar sinar - X (MCA-ORTEC-7010) sedangkan kadar Mo nya ditentukan dengan spektrometer serapan nyala atom (AAS) tipe AA-300 P buatan Varian Tehtron, Austria.
Cara kerja
TEORI
Bila dibuat kurva hubungan antara In(CJCA)/(Co-CA) versus t/(Co-CA), akan didapat persamaan garis lurus dengan
kl
sebagai slope dan Model kinetik LH dapat dinyatakan :In(Co/CA) +ko=klt/(CO-CA)
(3)(Co-CA)
Untuk mengetahui bagaimana zeolit mengadsorpsi U dan Mo dapat diterangkan dengan pendekatan model kinetika non linier
"Langmuir-Hinshe/wood" (4) Model kinetika menurut
LlVENSPIEL (7, p. 64 - 68) Reaksi yang terjadi :
T. Aktifasi zeolit
Zeolit alam dari Gunung Kidul yang telah digerus berukuran antara 50 sampai 200 mesh ditimbang sebanyak I kg kemudian dimasukkan ke dalam bekerglas dan ditambahkan HCI 0, I M sebanyak I I , diaduk dan direndam selama 24 jam. Setelah itu zeolit dicuci dengan air suling dan selanjutnya direndam dengan NH4CI 0,5 M selama 24 jam. Zeolit dicuci kembali dengan air suling , selanjutnya dikalsinasi pad a suhu bervariasi sampai 800 °C selama 4 jam.
2. Kajian pengaruh sultu kalsinasi
Zeolit dengan ukuran butir -100 +200 mesh yang dipreparasi kimia di atas dikalsinasi pad a suhu' 100, 200, 300, 400, 500, 600, 700, dan 800 °c selama 4 jam, ditimbang sebanyak 5 g untuk masing-masing suhu kalsinasi dan ditambahkan 20 ml larutan campuran U
=
31.000 ppm , Mo = 100 ppm di dalam H2S04 0,05 M. Campuran zeolit dan larutan (U,Mo) diaduk menggunakan alat homogenisasi yang (2)
A+Z ko.kl ~ (ZeH)
R. Subagiono, dkk. ISSN 0216 - 3128
22/
berputar dengan kecepatan 30 rpm selama 4jam. Sete]ah itu campuran disaring untuk memisahkan fasa padat dan fasa cair atau filtratnya yang kemudian filtrat ditentukan kadar U, Mo nya dengan a]at spektrometer pendar sinar - X dan spektrometer serapan nya]a atom.
3. Kajian pengarult keasaman larulan Campurall (U,Mo)
Zeolit dengan ukuran butir -100 +200 mesh , suhu kalsinasi tertentu sebanyak 5 g ditambahkan masing-masing larutan campuran (U ,Mo) dengan U = 31.000 ppm , Mo = 100 ppm di dalam H2S04: 0,05 ; 1 ; 2 ; 3 ; 4; dan 5 M. Selanjutnya dikerjakan seperti cara kerja no.2.
4. Kajiall pellgarult ukurall butir zeolil
Zeolit hasil kalsinasi pada suhu tertentu dengan ukuran butir yang bervariasi : -50 + 100, -] 00 +200, -200 +325, -325 +400, dan -400 mesh masing-masing sebanyak 5 g ditambah 20 ml larutan campuran (U,Mo) dengan U
=
31.000 ppm, Mo=
100 ppm di dalam H2S04 dengan konsentrasi tertentu. Selanjutnya dikerjakan seperti cara kerja no. 2.5. Kajiull pellgarult wuklu pemisaltall
Zeolit dengan ukuran butir hasil kondisi optimum kajian noA yang dikalsinasi pada suhu 200 °c sebanyak 5 g ditambah 20 ml
larutan campuran (U,Mo) dengan U
=
31.000 ppm , Mo=
100 ppm di dalam H2S04 0,05 M. Masing-masing campuran zeolit dan larutan (U,Mo) diaduk menggunakan alat homogenisasi yang berputar dengan kecepatan 30 rpm selama: I, 2, 3, 4 dan 5 jam. Selanjutnya dikerjakan seperti cara kerja no.2.
6. Kajiall killelika reaksi proses adsorpsi campurall urallium dan molibdellum dalam zeolil.
Data eksperimen proses adsorpsi dievaluasi dengan model "Langmuir-Hinshelwood".
Model ini dipilih karena keunggulannya dalam menerangkan proses adsorpsi U dan Mo kedalam zeolit.
0, I M yang bertujuan menghilangkan bahan-bahan organik dan logam-Iogam pengotor yang ada pada mineral zeolit. Kedua dengan menambahkan larutan NH4CI 0,5 M bertujuan untuk mengganti ion logam yang terikat dalam zeolit pad a ikatan Si, AI dengan NH/ (sebagai kation).
Perubahan yang tampak dengan adanya perlakuan aktivasi secara kimia adalah perubahan warn a zeolit, dari coklat kehijauan menjadi coklat muda, hal ini dikarenakan unsur pengotor yang terikut telah dipisahkan.
Aktivasi secara fisis adalah kalsinasi, yaitu memanaskan zeolit yang telah melalui tahap pencucian/aktivasi kimiawi, dengan menggunakan tungku listrik, pada suhu sampai 800 (lC selama beberapa jam.
1. Pengaruh Suhu Kalsinasi Zeolit Untuk Pemisahan U, Mo
Kalsinasi terhadap zeolit bertujuan untuk meningkatkan derajat kekristalan, menguapkan molekul air yang menutupi permukaan/rongga zeolit dan menghilangkan bahan organik. Suhu kalsinasi zeolit dikaji pada penelitian ini bervariasi dari 100°C sampai 800 °c, selama 4 jam,. Larutan umpan campuran (U,Mo) yang akan dipisahkan mengandung U = 31.000 ppm dan Mo = 100 ppm, keasaman 0,05 M H2S04• Pemisahan dikerjakan dengan alat homogenisasi yang berputar 30 rpm selama 4 jam. Hasil penyerapan U, Mo dan faktor pemisahan U/Mo dapat disajikan pada tabel I.
Dari tabel 1 terlihat bahwa nilai penyerapan uranium cenderung bertambah besar dengan naiknya nilai suhu kalsinasi sedang untuk molibdenum adalah sebaliknya. Pada suhu 200°C terjadi selisih nilai yang terbesar antara penyerapan uranium dan molibdenum atau dengan kata lain nilai faktor pemisahan (U/Mo) adalah terkecil yaitu 0,4953, hal ini karena molekul air yang menutupi permukaanl rongga zeolit telah menguap, menurut Keer (5 ) pada suhu 200 °c ion amonium di dalam
zeolit rriulai terdekomposisi (deaminasi) dengan persamaan reaksi sebagai berikut :
200°C
HASIL DAN PEMBAHASAN
----+)
HAl Si06 + NH/ asam Bronsted "(4)
Aktivasi zeolit yang telah dilakukan dimaksudkan untuk meningkatkan aktivitas zeolit, baik sebagai adsorben maupun sebagai penukar kation. Pada percobaan ini dilakukan dengan 2 cara, yaitu secara kimia dan fisis.
Cara kimia dengan menambahkan bahan kimia, pertama mencuci zeolit dengan larutan HCI
Pada suhu kalsinasi lebih tinggi dari 200 (lC zeolit yang mempunyai sifat sebagai asam Bronsted akan berubah secara sempurna menjadi zeolit yang bersifat basa Bronsted dan as am Lewis dengan melepaskan air pada suhu 400 - 500°C, maka nampak pada hasil penelitian ini bahwa adanya perubahan tersebut nilai dari penyerapan uranium cenderung turun dan penyerapan molibdenum
222 ISSN 0216 - 3128 R. SuhagiOllO, dkk.
bertambah besar. Oleh karena itu untuk pemisahan campuran (U,Mo) menggunakan zeolit ini dipilih suhu pemanasan 200 DC.
Tabell. Hubungan suhu kalsinasi zeolit terhadap penyerapan dalam zeolit dan faktor pemisahan U/Mo
Umpan U = 31000 ppm, Mo = 100 ppm ; Keasaman = 0,05 M ; Waktu = 4 jam
Penyerapan dalamFaktor Suhu, DC zeolit, ppmPemisahan U Mo (a) U/Mo 100 1205052 0,5788 200 . 1161955 0,4953 300 1243453 0,5945 400 1296]51 0,6828 500 1046946 0,5922 600 1290549 0,7492 700 ] ]87045 0,77]9 800 ]305744 0,94]9
2. Pengaruh keasaman larutan umpan (U,Mo) Keasaman larutan umpan dinyatakan dalam molar H2S04. Larutan umpan campuran (U,Mo), U = 31.000 ppm dan Mo = 100 ppm dibuat dalam kondisi asam sulfat dengan konsentrasi bervariasi dari 0,05 sampai 5 M. Tujuan pembuatan tersebut adalah unsur yang akan dipisahkan mempunyai bentuk spesies yang berlainan pada tiap-tiap konsentrasi keasaman dan terjadi kompetisi dari dua unsur tersebut. Ha] ini berdasarkan sifat dari uranium dan molibdenum yaitu bahwa pada konsentrasi H2S04. rendah mereka berada dalam spesies UO/+ dan MoO/+, tetapi bila konsentrasi
H2S04. tinggi mereka berada dalam spesies
U02(S04)3 -4 dan Mo02(S04)3 -4 yang tidak dapat
dipisahkan dengan cara ini. Pada percobaan ini menggunakan zeolit dengan ukuran butiran -100 +200 mesh. yang te]ah dikalsinasi pad a suhu 200 DC. Hasil penyerapan pada pengaruh keasaman disajikan pada Tabel 2.
Pada konsentrasi keasaman 0,05 M terlihat nilai efisiensi penyerapan uranium maupun molibdenum menunjukkan hasil yang tertinggi , namun bila dilakukan pada konsentrasi keasaman yang lebih rendah (misalnya 0,00] M), maka akan terjadi sedikit endapan putih kekuning-kuningan pada larutan campuran, diperkirakan adalah endapan H2Mo04 karena U022+ sangat stabil pada pH 2 - 2,5 atau lebih rendah. Hal ini tidak dikehendaki karena pengkajian pemisahan dengan menggunakan zeolit tidak dapat dilakukan. Pada konsentrasi keasaman 0,05 MH2S04 terjadi selisih nilai yang terbesar antara efisiensi penyerapan uranium dan molibdenum dan nilai faktor
pemisahan yang terkecil yaitu 0,4953, maka pada konsentrasi keasaman 0,05 M bisa disebut sebagai konsentrasi keasaman optimum.
Penyerapan molibdenum menunjukkan cenderung turun dengan bertambah besarnya konsentrasi keasaman, hal ini dimungkinkan karena zeolit tidak stabil dengan keasaman yang makin tinggi. Untuk meningkatkan kesetabilan zeolit dalam suasana asam maka dapat dilakukan dengan jalan mengurangi kandungan aluminium dalam
struktur dasar zeolit (dealuminasi).
Tabel 2. Hubungan keasaman larutan umpan terhadap penyerapan dalam zeolit dan faktor pemisahan U/Mo
Umpan U = 31000 ppm, Mo = 100 ppm ; Suhu
=
200 DC ;Waktu=
4 jamKeasaman,
Penyerapan dalamFaktor zeolit, ppm Pemisahan M Mo(a) U/MoU 0,05 ] 16]955 0,4953 0,50 I] 14851 0,5455 1,00 1079447 0,5968 2,00 1185445 0,7489 3,00 9765 41 0,6697 4,00 9281 39 0,6633 5,00 1]07036 0,9693
3. Pengaruh Ukuran Butir Zeolit
Ukuran butir sangat berpengaruh terhadap proses penyerapan, semakin halus partikel zeolit maka akan mempunyai luas permukaan yang semakin besar, sehingga mampu menyerap lebih banyak partikel yang akan dipisahkan. Variasi ukuran butir dikerjakan dari -50 sampai -400 mesh menggunakan zeolit yang dikalsinasi dengan suhu 200 DC.Umpan larutan campuran (U,Mo), U = 3]. 000 ppm dan Mo
= ]
00 ppm, dengan keasaman0,05 M H2S04• Hasil percobaan variasi ukuran
butir dapat dilihat pada tabel 3..
Dari tabel 3 terlihat bahwa semakin kecil ukuran butir maka efisiensi penyerapan uranium maupun molibdenum akan semakin besar, hal ini karena luas permukaan dari zeolit bertambah besar, sehingga daya serapnya meningkat. Kondisi penyerapan yang optimum terjadi pad a ukuran butir -200 +325 mesh, karena pada kondisi ini terjadi selisih nilai efisiensi penyerapan uranium dan molibdenum yang terbesar serta nilai faktor pemisahan yang terkecil yaitu 0,3917.
Pad a kondisi ukuran butir -325 +400 mesh menunjukkan efisiensi penyerapan uranium maupun molibdenum yang tertinggi, namun tidak bisa diambil sebagai titik optimum karena nilai Prosiding PPI - PDIPTN 2006
Pustek Akselerator dan Proses Bahan - BATAN Yogyakarta, 10 Juli 2006
R. Subagiollo, dkk. ISSN 0216-3128 223
sclisihnya lebih kecil dibandingkan pada kondisi ukuran butir -200 + 325 mesh.
Tabel3. Hubungan ukuran butir zeolit terhadap efisiensi penyerapan U, efisiensi penyerapan Mo dan faktor pisah VIMo
tlkuran
Etisicnsi Etisicnsi
Faktnr Butir
ZcolitI'cnycrapanJ'cnycrapanJ'cmisahan
Uranium Molibdcnum (Mesh) (%)(%) U/Mo -50 +100 34,960,446354,64 -100 +200 37,48 54,76 0,4953 -200 +325 37,51 60,51 0,3917 -325 +400 41,24 63,67 0,4005 -400 47.3164,67 0,4907
4. Pengaruh waktu penyerapan
Semakin lama kontak antara fasa air yang terdiri dari larutan umpan (U,Mo) dengan fasa padat yaitu zeolit maka efisiensi penyerapan uranium maupun molibdenum akan semakin besar, akan tetapi pada suatu saat tertentu nilai faktor pemisahan akan tetap karena telah tercapai keseimbangan sistem. Larutan umpan campuran (U,Mo), U = 31.000 ppm dan Mo = 100 ppm, keasaman 0,05 M H2S04 dicampur di dalam alat homogenisasi dengan zeolit berukuran butir -200 +325 mesh, pada kecepatan putar 30 rpm selama waktu yang divariasi hingga 5 jam. Hasil yang diperoleh ditunjukkan pad a tabel 4.
Tabel 4. Hubungan waktu penyerapan terhadap penyerapan dalam zeolit dan faktor pisah VlMo
Umpan U
=
31000 ppm, Mo=
100 ppm ; Keasaman = 0,05 M ; Suhu = 200 DC Waktu, Penyerapan dalamFaktorJam
zeolit, ppmPisahan (a) U Mo
I
9883550,381 2 112000,416858 3 11538600,3992 4 11628610,3917 5 11771610,3915Seperti ditunjukkan pad a tabel 4 pemisahan campuran (U/Mo) dengan waktu pemisahan selama I jam dan seterusnya memberikan nilai faktor pemisahan yang dapat dianggap tetap, maka kondisi pemisahan yang optimum dipilih I jam dengan faktor pemisahan (U/Mo) =0,381.
5. Kecepatan reaksi adsorpsi
Percobaan kinetika "Langmuir-Hinshe/wood" (LH) dikerjakan dengan cara melakukan pengambilan cuplikan berurutan terhadap sistem uranium dan senyawa Molibdenum, menghasilkan data konsentrasi/aktivitas pada waktu tertentu. Dengan mensubstitusikan data-data percobaan kedalam persamaan
(3)
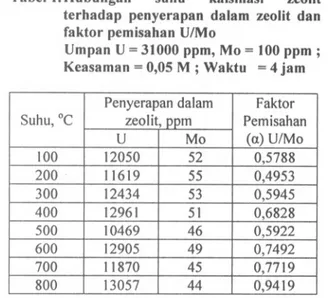
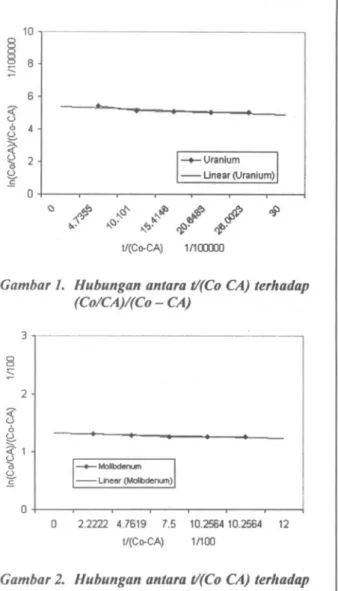
maka diperoleh kurva nilai t/(Co - CA) versus In (Co/CA)/(Co-CA).
Tabel 5. Hubungan antara In(Co/CA)/(Co - CA) sebagai fungsi dari U(Co - CA) Waklu (I) In(Co/CA /(Co - CA) I/(Co - CA)
adsorpsi,
Uranium MolibdenumMolibdenumUranium (iam) 1 5,4135 x1,328510'~4,73552,2222xx10-2x10~10·T 2 5,1417 X1,297010,101010-54,7619x 10.2XX10.510.2 3 5,0783 x1,277115,414610-57,5000X 10.2XX10-510-2 4 5,0617 X1,267420,648310.510,2564X 10-2xx10.510-2 5 5,0358 x1,267426,002310.510,2564X X10-210.5x 10-:':
Untuk menghitung nilai k, dan ko digunakan metoda kuadrat terkecil atau sering disebut regresi linier. Dengan regresi linier seperti pad a Gambar I dan 2 diperoleh persamaan :
y
=
k, (x)+
koSelanjutnya bila t/(Co - CA) versus In
(Co/CA)/(Co - CA) digambarkan, maka dapat didekati dengan garis lurus seperti tampak pad a Gambar I dan 2.
Dari hasil penelitian didapatkan nilai koefisien kecepatan reaksi orde nol (ko), koefisien kecepatan reaksi orde satu (kd, yaitu sebagai intercep dan slop dan kecepatan reaksi (rA = k,
I
ko). Hasil selengkapnya untuk nilai (ko), (kd dan rA pada reaksi uranium dan molibdenum dapat dilihat dalam Tabel 6.Dari Gambar I dan 2 didapat persamaan garis \urus :
Uranium : y
= -
0,0835 x + 5,4804 (5) Molibdenum : y = - 0,0152 x+
1,3482 (6)224 ISSN 0216 - 3128
KESIMPULAN
R. Subagiono, dkk. 6 __ Uranium -- Unear (Uranium) o t/(Co-CA) 1/1ro:roGambar J. Hubungan antara tI(CO CA) terhadap (Co/CA)/(Co - CA)
3
8
-2
I__- Line., (MoIibderun)MoHbd~ I
o I , , , , , .
i
o 2.2222 4.7619 7.5 10.256410.2564 12
t/(Co-CA) 1/100
Gambar 2. Hubungan antara tI(Co CA) terhadap (Co/CA)/(Co - CA)
Tabel 6. Koefisien reaksi dan kecepatan reaksi U dan Mo dalam zeolit
Koefisien KoefisienKecepatan Adsorbcn
reaksi reaksi ordereaksi, ordc nol
satu. mcnirl(k Ilko),
Imcnit Uranium 5,4804 - 0 0835• 1,5236. 10'" Molibdcnum 1,3432 - 0 0152- 1,1274. 10'"
Sesuai dengan model kinetika "Langmuir-Hinshelwood", reaksi mula-mula mengikuti orde nol, setelah konsentrasi tertentu mengikuti orde satu. Reaksi orde nol berarti bahwa kecepatan reaksi tidak tergantung kepada konsentrasi uranium dan molibdenum, sedangkan orde satu berarti kecepatan reaksi bergantung kepada salah satu reaktan. Mula-mula adsorpsi berjalan cepat. Setelah adsorpsi mencapai kejenuhan, adsorpsi terjadi melalui gaya tarik fisis elektrostatik, sehingga reaksi berubah lebih lambat mengikuti orde satu.
Zeolit alam dapat digunakan untuk memisahkan campuran (U,Mo) dengan cara batuan zeolit dihancurkan menjadi butiran kemudian dicuci dengan larutan HCI 0, I M, diaktitkan melalui pertukaran ion menggunakan larutan NH4CI 0,5 M dan selanjutnya dikeringkan lewat pemanasan pada suhu 200°C. Adapun pemisahan campuran (U,Mo) dilakukan dengan menggunakan zeolit berukuran butir -200 +325 mesh untuk kadar U
=
31.000 ppm dan Mo=
100 ppm di dalam larutan H2S04 0,05 M dengan waktu pemisahan I jam. Melalui cara ini diperoleh hasil faktor pemisahan (U/Mo)=
0,3811.Penelitian sesuai dengan model kinetika
Langmuir-Hinshelwood didapat persamaan
uranium: y = - 0,0835 x + 5,4804 dan molibdenum: y
= -
0,0152 x + 1,3482.UCAP AN TERIMA
KASIH
Bersama ini diucapkan terima kasih kepada Sdr. Atok Suhartanto yang telah membantu penelitian ini.
DAFT AR PUST AKA
I. HARJANTO dan SARNO, , Lempung Zeolit Dolomit dan Magnesit, Pusat Pengembangan Teknologi Mineral, Bandung (1987).
2. MINA TO, H., Zeolite: Its Natural Resources and Utilization, Ceramic Japan, 10 (1975), 941 - 957.
3. BARRER, R.M., Zeolite and Clay Minerals as Sorbents and Moleculair Sieves, Academic Press, London (1978).
4. NACHOD, F.C. and JACK SCHUBERT, Ion Exchange Technology, Academic Press Inc. Publishers, New York (1956).
5. KEER, G.T., "Chemistry of crystalline aluminosilicates VII", Thermal decomposition products of ammonium zeolite Y, J. Catal. 15 (1969), 200 - 204.
6. JIN., X., BAILEY, G.W., YU,Y.S., and LYNCH, A.T., :Kinetics of Single and Multiple Metal Ion Sorpsion Processes on Humic Subtances", Vol. 161 No.8 ( 1996), 509-520.
7. L1VENSPIEL, 0, Chemical Reaction
Engineerin, John Wiley
&
Sons, New York ( 1972).Prosiding PPI - PDIPTN 2006
Pustek Akselerator dan Proses Bahan - BATAN Yogyakarta, 10 Juli 2006
R. Subagiollo, tlkk. ISSN 0216 - 3128 225
8. BENEDICT, M., FIGFORD, T. H., AND LEVI, H. W., Nuclear Chemical Engineering,
2nd Edition, McGraw-Hili Book Company, New York (1981).
9. Biyantoro, D., SUKIRNO, dan BASUKI, K.T., "Kinetika Reaksi Proses Adsorpsi Cs-137 Dalam Asam Humat dan Senyawa Humat", Prosiding, PPI, P3TM-BA TAN, Yogyakarta (2005)127 - 133.
TANYAJAWAB
PrayitnoFenomena proses adsorpsi campuran U dan Mo dalam zeolit ?
Bagaimana cara mendeteksi bahwa uramum lebih banyak dari Mo ?
Jenis zeolit apa yang digunakan ? Kalau diganti bentonit bagaimana ?
R. Subagiono
Fenomena proses adsorpsi campuran U dan Mo dalam zeolit adalah pengambilan U atau
Mo dengan penjerapan oleh zeolit. Pada
penjerapan, zat yang dijerap menempel pada permukaan padatan, tidak sampai ke dalam padatan.
Cara mendeteksi bahwa U lebih banyak dari Mo yaitu bila nilai kecepatan reaksi U lebih besar daripada Mo.
Zeolit yang digunakan dari hasil analisis dengan menggunakan spektrometer difraksi sinar - X ternyata zeolit Gunung Kidul ini termasuk jenis campuran klinoptilolit dan mordenit.
Bisa, tetapi kapasitas adsorpsi dan
selektifitasnya tidak sama.
Tri Rusmanto
- Dalam pemisahan U dan Mo faktor apa saja yang sangat mempengaruhi, misal pH, suhu apa pengaruhnya ?
Bila digunakan untuk skala pabrik apakah dapat dilakukan tolongjelaskan
!
R. Subagiono
Dalam pemisahan U dan Mo, faktor yang
berpengaruh adalah teknologi proses aktifasi zeolit, pH atau keasaman larutan campuran (U, MoJ, ukuran butiran zeolit dan waktu
pemisahan. Pengaruh pH dari larutan
campuran terhadap proses ini yailu karena sifat dari U dan Mo yang masing-masing mempunyai bentuk spesies yang berbeda pada
kondisi keasaman tertentu maka akan
berpengaruh terhadap nilai koefisien
difusinya sehingga nilai faktor pemisahan (U, Mo) juga akan berubah. Demikian juga faktor suhu di dalam proses adsorpsi karena nilai
koefisien difusi suatu zat akan naik
bertambah besar dengan naiknya suhu, oleh karenanya dalam hal ini akan berpengaruh terhadap nilaifaktor pemisahan (U, MoJ..
Proses ini dapat dilakukan dalam skala
pabrik karena bahan-bahan yang digunakan terutama zeolitnya merupakan sumber daya alam yang melimpah sehingga dari faktor ekonomi sangat menguntungkan.
Sunardjo
Apakah yang menjadi latar belakang penggunaan bahan zeolit alam dari Gunung Kidul, sedangkan di daerah lain masih banyak ?
R. Subagiono
Yang menjadi latar belakang dari
penggunaan zeolit Gunung Kidul adalah
untuk memanfaatkan sumber daya alam lokal.