TINJAUAN PUSTAKA
Tulang
Kerangka tubuh terbentuk dari tulang rawan, tulang dan persendian. Tulang merupakan jaringan ikat khusus, karena mempunyai fungsi khusus serta komponennya terdiri dari sel-sel khusus yang berbeda dengan jaringan ikat lainnya (Astawan 2002). Tulang memiliki fungsi penting bagi tubuh yaitu melindungi dan menyokong organ-organ internal dan sebagai tempat melekatnya otot dan tendon (Price & Wilson 2006). Tulang juga berperan dalam fungsi metabolik dengan menyediakan sumber kalsium untuk memelihara keseimbangan kadar kalsium dalam darah serta menyediakan beberapa faktor pertumbuhan
(growth factor) seperti transforming growth factor (TGF-ß) yang berperan dalam
remodelling (Dellmann & Eurell 1998).
Tulang dapat dibentuk dari differensiasi jaringan ikat secara langsung atau bagian dari perubahan dan pertumbuhan tulang rawan sebelumnya. Jaringan ini memiliki kemampuan sebagai tempat penyimpanan mineral, khususnya kalsium dan hampir sebagian besar berupa kristal hidroksiapatit. Bahan tersebut yang membedakan tulang dengan jaringan ikat lainnya, termasuk tulang rawan (Samuelson 2007).
Tulang memiliki komponen seluler yang terdiri dari berbagai macam sel tulang. Sel tersebut antara lain prekursor osteogenik atau osteoprogenitor, osteoblas, osteosit dan osteoklas serta elemen hematopoetik dari sumsum tulang (Kalfas 2001). Sedangkan komponen ekstraseluler terdiri dari bahan organik dan anorganik pembentuk matriks (Samuelson 2007).
Komponen Seluler Tulang
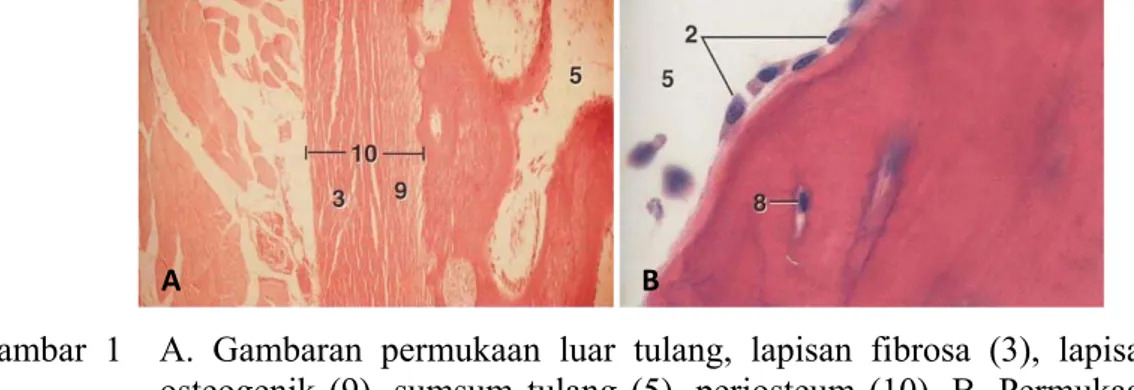
Bagian luar permukaan tulang dikelilingi oleh lapisan jaringan yang disebut periosteum, kecuali pada bagian ujung persendian sinovial (Samuelson 2007). Periosteum terdiri dari pembuluh darah, lapisan tebal jaringan ikat fibrosa (kapsul) dan stem sel atau sel osteogenik (Gambar 1A) yang akan berkembang menjadi sel osteoblas. Tulang memiliki ruang internal yaitu ruang sentral atau ruang sumsum tulang. Ruang tersebut dilapisi oleh selapis jaringan tipis yang disebut endosteum (Gambar 1B). Lapisan endosteum terdiri dari selapis sel
osteogenik dan memiliki jaringan ikat yang sangat sedikit dibandingkan dengan lapisan periosteum (Samuelson 2007).
Gambar 1 A. Gambaran permukaan luar tulang, lapisan fibrosa (3), lapisan osteogenik (9), sumsum tulang (5), periosteum (10), B. Permukaan dalam tulang, endosteum (2), osteosit (8) dengan pewarnaan Hematoksilin Eosin (HE) (Bacha & Bacha 2000)
Komponen seluler tulang terdiri dari sel osteogenik atau osteoprogenitor, osteoblas, osteosit, osteoklas, (Samuelson 2007; Dellman & Eurell 1998) dan unsur-unsur hematopoetik dari sumsum tulang (Kalfas 2001).
Sel osteogenik atau sel osteoprogenitor memiliki peranan penting dalam perkembangan dan remodelling tulang (Samuelson 2007). Sel tersebut terdapat pada lapisan periosteum, saluran Haver’s, Volkmann, dan kanalis medullaris. Sel osteoprogenitor merupakan sel primitif turunan sel mesenkimal yang dapat membentuk sel osteoblas (Mills 2007).
Osteoblas adalah sel yang bertanggung jawab untuk mensintesis, mentransfer dan mengatur komponen bahan organik matriks tulang yang disebut osteoid atau prebone (Mills 2007). Bahan organik tersebut berupa kolagen,
proteoglycans dan glycoprotein. Osteoblas berasal dari sel osteogenik yang ada
pada permukaan tulang. Bentuk osteoblas dalam keadaan metabolisme aktif cenderung lebih kuboid dan basophilic. Saat osteoblas dalam keadaan tidak aktif mensintesis osteoid, sel ini berbentuk gepeng dan bersifat kurang basophilic (Samuelson 2007).
Osteoblas yang masuk ke dalam matrik tulang maka dinamakan osteosit. Osteosit muda sebenarnya tidak benar-benar bermigrasi ke dalam matriks tulang, tetapi terisolasi di sekitar matriks, dengan demikian osteosit merupakan osteoblas dewasa yang terkapsulasi dan termineralisasi oleh matriks tulang. Sel tersebut berada pada ruang berbentuk oval atau disebut lakuna. Penjuluran dari sel-sel
osteosit akan membentuk kanalikuli. Penjuluran kanalikuli terbentuk secara radial. Antara kanalikuli tersebut saling dihubungkan dengan formasi gab junction. Koneksi filopodial gap junctions ini berfungsi sebagai ”life support line” yaitu menyediakan jalur lintasan nutrisi dan jalur lintasan sisa-sisa metabolisme dari sel ke sel lainnya (Samuelson 2007).
Osteosit memiliki ukuran yang lebih kecil dibandingkan dengan osteoblas, memiliki sedikit organel dan sitoplasma. Peranan osteosit adalah memelihara lingkungan ekstraseluler yang termineralisasi. Ketika distimulasi oleh hormon paratiroid (PTH), osteosit mampu mengeluarkan mineral berupa kalsium secara cepat dengan mensekresikan enzim hidrolase. Proses ini dikenal dengan osteolisis osteosit (Samuelson 2007).
Gambar 2 Osteoblas, osteosit, matriks tulang (Caceci 2007)
Osteoklas adalah multinukleat giant sel yang memiliki 6-50 atau lebih inti sel yang berperan dalam penyerapan dan remodelling jaringan tulang (Samuelson 2007). Ukuran diameternya sekitar 40 sampai 100µm (Dellman & Eurell 1998). Sitoplasma bersifat acidophilic, kaya akan lisosom, memiliki banyak mitokondria
dan apparatus Golgi. Osteoklas berasal dari organ sumsum tulang dan merupakan
derivat dari gabungan monosit. Pada proses pertumbuhan dan dalam remodelling tulang, osteoklas akan secara kontinyu melakukan penyerapan (osteoclasia). Proses ini merupakan hasil sekresi dari beragam material yaitu asam laktat dan asam sitrat yang memiliki pH rendah dan memfasilitasi pembebasan mineral, serta
enzim hidrolitik kuat (acid hydrolase, collagenase, dll) yang mampu mencerna matriks ekstraseluler (ECM).
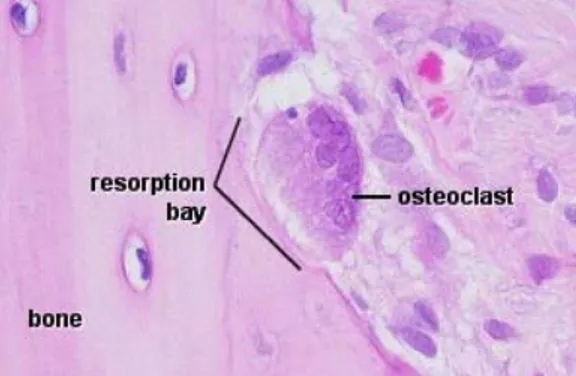
Gambar 3 Osteoklas, Howslip’ lacuna atau resorption bay (Caceci 2007) Setiap osteoklas melalui proses enzimatik kemudian mendepres bagian matriks yang disebut Howslip’s lacuna atau resorption bay (Gambar 3). Selama tulang aktif melakukan penyerapan, sel tersebut akan berkontak langsung dengan bony matrik (Samuelson 2007; Mills 2007)
Komponen Matriks Ekstraseluler Tulang
Sebagian besar komposisi tulang berupa matriks ekstraseluler, dua pertiganya adalah bahan anorganik dan sisanya merupakan bahan organik (Samuelson 2007). Sebagian besar bahan organik tersebut berupa serabut kolagen tipe I dan sejumlah kecil bahan dasar (dalam bentuk amorphous). Bahan anorganiknya berupa bahan mineral kalsium yang ditemukan dalam beberapa varian hidroksiapatit [Ca10(PO4)6(OH)2]. Bahan mineral lainnya seperti
bikarbonat, magnesium, natrium, kalium, tembaga, seng, mangan dan lainnya. Secara umum tulang tersusun oleh 30% substansi organik, 55% substansi anorganik dan 10% air (Aoki 1994)
Kristal hidroksiapatit disusun dalam tata cara yang terorganisasi dalam mengatur pembuatan serabut kolagen dan dengan gap regionya. Molekul-molekul
proteoglycan yang berjumlah sedikit memiliki komponen utama yang terdiri dari
glycosaminoglycans sulfat, chondroitin 4 sulfat dan keratin sulfat yang melekat
pada hyaluronans, dan membentuk komponen agrecans yaitu hyaloronic
Proteoglycans dalam komposisi tersebut adalah instrumen dalam inisiasi dan inhibisi (penghambat) mineralisasi tulang. Selama terjadi proses mineralisasi secara normal berlangsung, jumlah proteoglycans di dalam matriks ekstraseluler (ECM) relatif menurun. Jadi terdapat hubungan timbal balik antara jumlah
proteoglycans dan derajat mineralisasi pada pertumbuhan tulang (Samuelson
2007). Bahan dasar yang terutama terdiri dari komponen agregat tersebut, memungkinkan air untuk berkontak dengan kristal dan terjadi pertukaran ion.
Glycoprotein terdiri dari osteocalcin dan osteopontin, keduanya dapat mengikat
kristal kemudian pada bahan lain integrin termasuk protein transmembran yang berasosiasi dengan osteoblas dan osteoklas dan banyak tipe sel yang lain termasuk fibroblast. Sialoprotein adalah matrik yang mempunyai fungsi adhesif, dapat mengikat integrin dari sel pembentuk tulang dan komponen matriks tulang.
Proses mineralisasi di dalam ECM tulang tidak sepenuhnya diketahui. Secara tidak pasti mempengaruhi kehadiran vesikel matriks, dikeluarkan ke osteoid oleh osteoblas. Vesikel dipenuhi oleh kalsium dan ion fosfat dengan cyclic
adenosine monophosphate (AMP), adenosine triphosphate (ATP) dan adenosine
triphosphatase (ATPase) kemudian dua enzim lainnya yaitu alkaline phosphatase
dan pyrophosphatase, serta protein yang mengikat kalsium. Selain itu, vesikel
memiliki pompa kalsium yang memungkinkan pergerakan lebih jauh dari elemen ini ke dalam ECM. Setiap vesikel berada pada beberapa level struktur autonom yang dapat membentuk kristal hidroksiapatit di luar sitoplasma dari osteoblas dan osteosit dan di daerah ECM prebone. Sebagai kristal yang dikeluarkan dari vesikel dan ditimbun di sepanjang permukaan dekat dengan molekul kolagen, kemudian daerah tersebut menjadi mikrosenter dari lanjutan kalsifikasi dan mineralisasi setelah periode terakhir dengan berangsur-angsur kehilangan air.
Klasifikasi Tulang
Klasifikasi tulang dapat dilihat dari segi perkembangannya, konfigurasi dan pengaturannya. Berdasarkan perkembangannya, tulang dibedakan menjadi tulang dewasa (mature) dan tulang yang masih belum dewasa (immature). Tulang yang belum dewasa ada pada tulang fetus, primer, spogiosa dan postnatal. Kemudian tulang dewasa (mature) adalah tulang yang secara umum lebih kompak
dari pada tulang yang belum dewasa, tersusun dari matriks yang tertimbun oleh serabut kolagen.
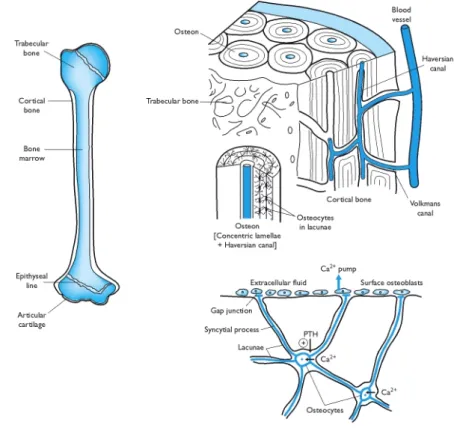
Berdasarkan konfigurasinya, tulang dibagi ke dalam dua tipe yaitu spongiosa (trabekular) dan tipe kompakta (kortikal). Tulang spongiosa terdiri dari tulang cancellous merupakan jaringan yang umumnya memiliki bentuk berlubang-lubang seperti spon. Jarak antara lubangnya (interoseus) lebih besar dari pada tulang kompakta. Tipe tulang ini sering dideskripsikan sebagai tulang yang belum dewasa (immature bone), terutama pada pertumbuhan bagian dari epifisis dan diafisis dari tulang panjang (Samuelson 2007). Tulang trabekular
(cancellous atau medullary) memiliki berat 20% dari keseluruhan massa tulang.
Didapatkan pada bagian dalam tulang dan terutama pada tulang vertebra. Terdiri dari spikula tipis tulang yang meluas dari korteks menuju ruang medula. Jaring-jaring spikula tulang terlihat sebagai garis yang muncul pada beberapa daerah yang terdapat osteoblas dan osteoklas serta sel-sel yang terlibat pada remodelling tulang. Tulang trabekula secara konstan akan disintesa dan diserap oleh elemen seluler. Tulang kompak (kortikal) menempati 80% dari keseluruhan massa tulang dan merupakan lapisan terluar (korteks) tulang. Sel tulang kortikal terdiri dari jaringan padat yang sebagian besar tersusun dari mineral tulang dan elemen matriks ekstraseluler, terpisahkan oleh penetrasi pembuluh darah dan sekumpulan osteosit yang ada di dalam tulang. Osteosit ini saling berhubungan satu sama lain dengan osteoblas pada permukaan tulang yang disebut kanalikuli dimana terjadi proses penyebarluasan osteosit seluler. Hubungan ini memungkinkan perpindahan Ca2+dari dalam tulang ke permukaan, proses ini biasa disebut osteolisis osteosit. Kepadatan tulang kortikal menghasilkan suatu kekuatan terhadap beban yang berat yang mengenai tulang-tulang panjang (Baron & Emile 2003).
Berdasarkan pengaturannya tulang padat dibedakan antara tulang lamellar dan tipe tulang osteon. Tulang lamellar terdiri dari lapisan-lapisan atau lamel-lamel tulang yang berada pada daerah periosteum dan endosteum. Sedangkan tipe tulang osteonal terdiri dari lamel-lamel yang tersusun secara silinder atau disebut osteon (Haversian sistem).
Tulang dewasa sebagian besar komponennya terdiri dari satu unit struktur yang bersifat silindris dinamakan osteon atau sistem Haversian. Setiap osteon
terdiri atas: a) matriks tulang yang berupa lamel-lamel konsentris (lamel-lamel khusus) yang mengelilingi saluran Haver’s (canalis centralis). Pada saluran ini terdapat pembuluh darah dan syaraf yang menyuplai nutrisi ke osteon; b) lakuna yang berisi osteosit, terletak pada lamel-lamel tulang; c) kanalikuli, merupakan penjuluran-penjuluran osteosit yang tersusun secara radial terhadap saluran Haver’s. Kanalikuli ini berhubungan dengan saluran Haver’s dan membantu difusi nutrisi maupun sisa metabolisme baik dari pembuluh darah ke osteosit maupun sebaliknya (Samuelson 2007; Dellmann & Eurell 1998)
Diantara osteon-osteon terdapat sisa-sisa lamel osteon sebelumnya dan dinamakan lamel-lamel interstitial. Panjang sumbu osteon sejajar atau paralel dengan sumbu tulang. Serabut kolagen tulang tersusun paralel satu dengan lainnya pada lamel-lamel khusus, sehingga potongan memanjangnya menyerupai kayu. Pada sisi luar osteon, terdapat lamel-lamel umum luar (outer circumferential
lamellae), sedangkan lamel-lamel umum dalam (inner circumferential lamellae)
terdapat disebelah dalam osteon berbatasan dengan sumsum tulang (Samuelson 2007; Dellmann & Eurell 1998).
Saluran Volkmann (perporating canal) merupakan saluran yang menghubungkan dua saluran Haver’s dan juga merupakan saluran tempat pembuluh darah dan syaraf berjalan mulai dari permukaan periosteum dan endosteum sampai mencapai saluran Haver’s (Gambar 4). Saluran ini tidak dikelilingi oleh lamel dan merupakan ciri khusus dalam identifikasi secara histologi (Samuelson 2007; Dellmann & Eurell 1998). Berikut gambaran sistem Haversian dan lamelar ditunjukkan pada Gambar 4.
Gambar 4 Struktur tulang (Lerro 2007).
Osteogenesis (Proses Pembentukan Tulang)
Osteogenesis atau proses pembentukan tulang dapat diklasifikasikan menjadi dua cara, yaitu osifikasi intramembranous dan osifikasi endokhondral. Pembentukan tulang langsung dari jaringan ikat, proses ini dinamakan osifikasi intramembranous sedangkan proses pembentukan tulang dimulai dari tulang rawan disebut osifikasi endokhondral atau osifikasi intrakartilagous (Samuelson 2007).
Osifikasi Intramembranous
Proses terjadinya osifikasi intramembranous dimulai dari vaskularisasi di jaringan ikat. Kemudian terjadi kondensasi sel-sel mesenkim ke tempat tulang yang akan dibentuk. Sel osteoprogenitor berdeferensiasi menjadi osteoblas. Sel tersebut mulai mensintesis dan mensekresikan osteoid. Komponen utama yang disekresikan oleh osteoid adalah kolagen. Selama awal osifikasi intramembrenous, osteoblas dikelilingi oleh sebagian matriks yang dimineralisasi dan berisi serabut kolagen. Osteoid banyak diproduksi, diikuti oleh mineralisasi
lengkap. Sebagian osteoblas menjadi terisolasi di lakuna dan menjadi osteosit. Sebagian kecil menjadi pusat osifikasi. Dari pusat osifikasi kemudian menyebar ke beberapa arah membentuk trabekular (Dellman & Eurell 1998).
Saat osteoblas mensintesis dan mensekresikan bahan organik matriks,
plasmalemmma buds, disebut vesikel matriks, bentuk selnya panjang dan saling
berdekatan di pinggir dengan osteoid dan dalam posisi menjepit. Vesikel matriks berisi lipid, akumulasi ion kalsium, dan memiliki ativitas alkaline phosphatase, semua ini dibutuhkan untuk menginisiasi dan memelihara mineralisasi (Samuelson 2007).
Osifikasi Endokhondral
Osifikasi endokhondral merupakan proses pertumbuhan atau pembentukan tulang yang berasal dari tulang rawan hialin atau kartilago (Mills 2007). Hampir semua tubuh awalnya tumbuh sebagai tulang rawan pada tingkat embrio, namun pertumbuhannya dilanjutkan dengan proses osifikasi endokhondral. Pada tingkat seluler, sel-sel kartilago akan berubah menjadi osteoblas kemudian osteosit. Pada osifikasi ini dikenal pusat osifikasi primer (primary center of ossification) di diafisis serta pusat osifikasi sekunder (secondary ossification center) di epifisis (Samuelson 2007; Mills 2007).
Pada diafisis, sel-sel kartilago mengalami tiga hal, yaitu hipertropi, kalsifikasi matriks serta kematian sel-selnya. Selain itu, perikhondrium akan mengalami vaskularisasi sehingga sel-sel kartilago akan berubah menjadi osteoblas. Perikhondrium yang merupakan bagian permukaan dari kartilago berubah menjadi periosteum. Pemanjangan tulang berlangsung hanya pada perbatasan antara diafisis dan epifisis (lempeng epifisis). Hal ini dikarenakan hanya sel-sel kartilago di bagian inilah yang mampu berproliferasi. Mendekati diafisis, sel-sel ini mengalami hipertropi dan matriksnya akan mengalami kalsifikasi. Osifikasi pertama kali terjadi di diafisis, yaitu pusat osifikasi primer, pada akhir masa embrionik.
Pada waktu lahir, sebagian besar diafisis telah mengalami osifikasi, sedangkan epifisis masih berupa kartilago. Osifikasi sekunder baru berlangsung pada tahun-tahun pertama usia bayi. Karena osifikasi dari dua arah, dari epifisis
dan diafisis, hanya daerah di tengah-tengah kedua daerah itulah (lempeng epifisis) yang masih berupa kartilago. Kartilago ini akan terus berproliferasi yang diikuti dengan osifikasi. Saat seluruh lempeng epifisis telah mengalami osifikasi, berarti masa pertumbuhan tulang telah berhenti.
Remodelling Tulang
Remodelling merupakan reorganisasi atau renovasi struktur tulang lama.
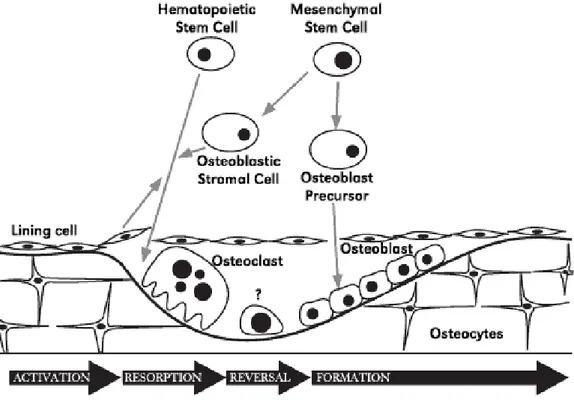
Terjadi resorpsi jaringan tulang dan deposisi simultan tulang baru pada tulang normal, kedua proses ini berada dalam keseimbangan yang dinamis (Dorland 2002). Menurut Mills (2007) remodelling adalah proses yang dinamis, pada proses ini terjadi pengurangan dan penggantian tulang baik kortikal atau tulang trabekular. Proses ini akan berlanjut sepanjang hidup untuk mempertahankan massa tulang, integritas kerangka dan fungsi kerangka. Kejadiannya sangat komplek dan sebagian dikontrol oleh sistem syaraf pusat melewati hormon (contohnya leptin) dan induksi mekanik dari kerusakan kecil. Prosesnya juga sangat bergantung pada integrasi gerakan dari osteoblas, osteosit dan osteoklas. Sel-sel tersebut secara bersamaan membentuk basic sellular unit dari tulang, pada saat dewasa resorpsi dalam remodelling tulang kira-kira terjadi sebanyak 10% dari jumlah kerangka pertahunnya (Mills 2007). Proses remodelling diawali pada permukaan bony dan tergabung dalam beberapa tahapan aktivitas sel yaitu aktivasi, resorpsi, reversal (pengembalian), dan formasi atau pembentukan tulang. Rangkaian aktivitas remodelling tersebut dapat dilihat pada Gambar 5.
Tahap aktivasi bergantung pada sel yang berdeferensiasi menjadi osteoblas, yang ada di permukaan tulang atau sumsum tulang, bertindak pada prekursor sel darah (hemapoetic cells) untuk membentuk osteoklas yang akan menyerap tulang. Proses resorpsi terjadi di bawah lapisan sel (lining sel) (Gambar 5). Setelah fase reversal, osteoblas memulai untuk pembentukan tulang baru. Sisa osteoblas di dalam tulang akan berubah menjadi osteosit. Masing-masing osteosit akan berhubungkan satu sama lain dan dihubungkan juga ke permukaan osteoblas. Fase resorpsi berakhir hanya pada beberapa minggu tetapi fase formasi terjadi lebih lambat, yaitu berlangsung selama beberapa bulan untuk melengkapinya,
sebagai lapisan yang banyak pada tulang baru dibentuk oleh berturut-turut gelombang dari osteoblas.
Gambar 5 Proses remodelling tulang ( Lerro 2007).
Proses Persembuhan Fraktur Tulang
Kerusakan pada fraktur dapat terjadi karena trauma atau tenaga fisik. Fraktur segmental adalah dua fraktur berdekatan pada satu tulang yang menyebabkan terpisahnya segmen sentral dari suplai darahnya (Price & Wilson 2006). Dalam kasus ini penggunaan bone graft mungkin diperlukan untuk memperbaiki kerusakan tersebut.
Salah satu aplikasi bone graft yaitu dengan menanamkannya pada kerusakan spinal fusion. Menurut Boden et al. (1995), proses penyatuan bone
graft di dalam spinal fusion model hampir sama dengan proses persembuhan
tulang yang terjadi dalam keadaan persembuhan fraktur.
Persembuhan fraktur akan mengembalikan jaringan yang rusak menjadi jaringan tulang yang sesuai. Hal ini dipengaruhi oleh berbagai faktor lokal maupun sistemik. Persembuhannya terjadi dalam empat tahap berbeda tetapi saling tumpang tindih, antara lain: 1. Tahap hemoragi dan tahap awal inflamasi, 2.
tahap perbaikan (pembentukan kalus) dan 3. tahap pembentukan tulang rawan dan terakhir 4. tahap remodelling (Kalfas 2001).
1. Tahap Hemoragi dan Tahap Awal Inflamasi
Saat terjadi fraktur maka pembuluh darah akan mengalami kerusakan atau ruptur dan terjadi hemoragi di dalam daerah fraktur, jika darah merembes melewati periosteum di dalam otot. Kemudian darah mengalami koagulasi dan mengisi ruang terjadinya fraktur (Cheville 2006), atau terjadi hematoma dalam ruang fraktur (Kalfas 2001). Adanya trauma pada kejadian fraktur akan menginduksi tahap inflamasi (Cheville 2006). Pada tahap ini, sel-sel peradangan seperti monosit, limfosit, sel-sel polimorfonuklear dan fibroblast menginfiltrasi tulang yang diperantarai oleh prostaglandin (Kalfas 2001). Monosit yang masuk ke dalam daerah fraktur akan bertransformasi menjadi makrofag yang memainkan peranan penting dalam persembuhan tulang (Tabel 1) (Cheville 2006). Hal ini akan menyebabkan pembentukan jaringan granulasi, pertumbuhan jaringan pembuluh darah (neovaskularisasi), dan migrasi dari sel-sel mesenkimal (Kalfas 2001). Tahap ini terjadi pada awal kerusakan yaitu satu sampai lima hari pertama setelah terjadi kerusakan.
2. Tahap Perbaikan (Pembentukan Kalus)
Tahap perbaikan fraktur diawali dengan pembentukan kalus kemudian sampai 48 jam setelah fraktur, darah yang mengendap akan diinfiltrasi oleh sel osteogenik yang ada pada lapisan periosteum, endosteum dan sumsum tulang. Sel tersebut berproliferasi di pinggir fraktur dan dengan cepat menghampiri endapan dan perbatasan area nekrotik. Kalus merupakan jaringan baru antara dua ujung fraktur yang kemudian akan berubah menjadi jaringan tulang (Dorland 2002). Awalnya, terjadi jaringan granulasi (kalus lunak) dan kemudian berubah menjadi kartilago atau tulang (kalus keras). Fase jaringan granulasi diperpanjang dan formasi jaringan tulang rawan hialin akan menyokong sampai terjadi pembentukan tulang di kalus.
3. Tahap Pembentukan Tulang Rawan
Dalam waktu satu minggu, proliferasi sel akan mulai berdeferensiasi menjadi khondroblas. Material matriks yang dilepaskan dari permukaan khondroblas yang tertimbun dalam lingkaran yang mengeliling sel. Dalam proses
kalsifikasi tulang rawan, vesikel matriks kecil keluar dengan proses enzimatik (alkaline fosfatase dan enzim untuk ATP-dependent calcium transport) yang meningkatkan konsentrasi lokal dari orthofosfat yang akan berfungsi untuk membentuk hidroksiapatit. Pada hari ke 7-10, pH di dalam kalus meningkat dan akan menyokong endapan garam kalsium.
Tulang rawan yang terbentuk keberadaannya hanya sementara dan pada akhirnya akan digantikan dengan tulang sebenarnya (woven bone) melalui tahap
remodelling, dan membutuhkan waktu untuk menjadi tulang lamellar (lamellar
bone). Matriks ekstraseluler tulang rawan mengalami kalsifikasi, kemudian menyebabkan khondrosit mati. Tulang baru terbentuk sebagai tulang rawan yang disintegrasi. Osteosit berkembang dari pluripoten mesenkim sel, fibroblast, dan deposit osteoid. Selama tahap perbaikan, fibroblast menuju stroma yang akan membantu pertumbuhan pembuluh darah (vaskular). Tahap perubahan tulang rawan menjadi tulang terjadi melalui mekanisme osifikasi endokhondral.
4. Tahap Remodelling
Persembuhan fraktur akan sempurna selama tahap remodelling. Pada tahap ini kerusakan tulang telah kembali mempunyai bentuk, struktur, dan kekuatan mekanik seperti semula. Remodelling tulang terjadi secara perlahan selama beberapa bulan bahkan tahun. Kekuatan tulang yang memadai akan dicapai dalam tiga sampai enam bulan (Kalfas 2001).
Dalam pemasangan bone graft terdapat penggabungan antara tulang dan biomaterialnya. Persembuhan ini tidak sepenuhnya mirip dengan keadaan persembuhan fraktur. Seperti pemasangan bone graft (autograft) pada prosedur cangkok tulang belakang, selama proses persembuhannya tulang dan graft digabungkan oleh proses yang terintegrasi. Tulang lama mengalami nekrosis secara perlahan dan diserap kembali dan sekaligus digantikan dengan tulang baru yang lebih baik. Proses penggabungannya disebut “creeping subtitution’’(Lane et al. 1992), sel-sel primitif mesenkim berdeferensiasi menjadi osteoblas yang tersimpan di sekitar inti osteoid dari tulang yang nekrosis. Proses dari penggantian
dan remodelling pada akhirnya akan digantikan dari tulang yang nekrosis dalam
Masa yang paling kritis dalam penyembuhan tulang adalah minggu-minggu pertama sampai minggu-minggu kedua. Pada saat ini peradangan dan revaskularisasi terjadi. Penggabungan dan remodelling tulang dari sebuah bone
graft membutuhkan sel-sel mesenkim yang memiliki akses vaskuler ke graft
untuk berdeferensiasi menjadi osteoblas dan osteoklas. Berbagai faktor sistemik dapat menghambat penyembuhan tulang, contohnya malnutrisi, diabetes, rematik arthritis, dan osteoporosis. Bone graft juga sangat dipengaruhi oleh faktor mekanikal lokal selama tahap remodelling tulang, kepadatan, geometri, ketebalan, dan orientasi trabekular tulang dapat berubah tergantung pada persyaratan mekanik dari graft.
Tabel 1 Persembuhan luka pada fraktur tulang tipe sederhana (uncomplicated)
Waktu Proses persembuhan
Immediate
1-5 hari
3-7 hari 1-4 minggu
>4 minggu
Hemoragi dan pembentukan hematoma Pembekuan darah pada perbatasan fraktur
Invasi makrofag untuk menghilangkan debris, RBC, dan fibrin Nekrosis sel osteosit pada daerah fraktur
Edema dan pengendapan fibrin pada jaringan sekitar fraktur Invasi jaringan granulasi
Proliferasi khondrosit dan osteoblas dari pinggir periosteal dan endosteal
Pembentukan provisional kalus sebagai tulang yang merupakan
penghubung oleh jaringan dan pulau-pulau granulasi dari tulang rawan
Bony kalus terbentuk oleh proses kalsifikasi, penghubung (jembatan) dari provisional kalus dari hubungan trabekula osteoid yang diproduksi oleh
osteoblas
Remodelling tulang: proses osteoclasia terus berlangsung dan
pembentukan oleh osteoblas; Penghilangan eksternal kalus; Pelekukan internal kalus untuk membentuk sumsum tulang
(Cheville 2006)
Biomaterial (Bone graft)
Bone graft merupakan bahan pengganti tulang yang digunakan dalam
perbaikan fraktur yang kompleks. Bahan ini digunakan juga untuk perbaikan kerusakan (defek) tulang karena cacat bawaan, traumatik, operasi kanker tulang dan rekontruksi kranial atau fasial. Bone graft yang sering digunakan dalam kasus-kasus tersebut adalah bahan autograft yaitu bahan cangkok tulang yang diperoleh dari individu atau spesies itu sendiri, tulang pengganti yang sering
digunakan adalah os ilium. Jaringan autograft memang merupakan jaringan yang sangat ideal untuk bone graft karena memiliki karakteristik yang sesuai dalam memicu pertumbuhan tulang seperti osteokonduktif, osteogenik dan osteoinduktif (Laurencin & Yusuf 2009). Pemanenan tulang pengganti di bagian tulang lain dapat menimbulkan komplikasi seperti inflamasi, infeksi, kerusakan kronis apabila operasi tidak dilakukan dengan baik. Selain itu, jumlah jaringan yang dapat dipanen sangat sedikit, sehingga menjadi kendala dalam ketersediaan.
Bone graft lainnya yang dapat digunakan yaitu allograft. Allograft adalah
bahan pengganti tulang yang diperoleh dari individu lain dari spesies yang sama. Sebagai alternatif dari autograft, allograft dapat diambil dari donor manusia atau kadaver. Namun penggunaannya memiliki resiko seperti adanya bahan pengawet jaringan dan perlakuan jaringan sebelum dicangkokkan mengandung bahan berbahaya seperti bahan pengawet ethylene oxide. Resiko lainnya, allograft berpotensi menjadi transmisi penyakit-penyakit infeksius dari danor ke resipien seperti hepatitis dan HIV AIDS. Sedangkan bone graft yang berasal dari hewan sering disebut xenograft. Kedua bone graft ini terkadang menimbulkan reaksi penolakan dari tubuh (Ratih et al. 2003). Sebagai alternatif lain pengganti tulang
(bone graft) juga dapat disintesis dari berbagai biomaterial, seperti hidroksiapatit,
trikalsium fosfat, hidrogel dan lain-lain.
Klasifikasi Bone Graft
Menurut (Laurencin et al. 2001), klasifikasi bone graft berdasarkan bahan dasarnya antara lain:
• Allograft-based bone graft substitutes, menggunakan allograft itu sendiri
atau dikombinasi dengan material lainnya.
• Factor-based bone graft substitutes adalah berupa faktor pertumbuhan
yang alami atau rekombinan, digunakan dengan growth factor itu sendiri atau dikombinasi dengan material lainnya, seperti transforming growth
factor-beta (TGF-beta), platelet-derived growth factor (PDGF), fibroblast
• Cell-based bone graft substitutes menggunakan sel-sel untuk membangkitkan jaringan baru, digunakan bahan ini sendiri atau ditanam ke dalam bahan pendukung matrik (contohnya, mesenchymal stem cells).
• Ceramic-based bone graft substitutes seperti kalsium fosfat, kalsium sulfat
dan bioglass, dapat digunakan dari bahan itu sendiri atau dikombinasikan.
• Polymer-based bone graft substitutes, degradable dan nondegradable
polymer, dapat digunakan dari bahan itu sendiri atau dikombinasikan
dengan material lainnya.
Dalam penelitian ini digunakan implan bone graft ceramic-based bone
graft substitutes. Bahan yang digunakan adalah hidroksiapatit (HA) dan trikalsium
fosfat (TKF). Penggunaan keramik, khususnya kalsium fosfat merupakan bagian dari komponen anorganik primer tulang yang berupa kalsium hidroksiapatit, yang termasuk ke dalam keluarga kalsium fosfat. Kalsium fosfat juga memiliki karakteristik oseokonduktif, osteointegratif (formula jaringan baru yang termineralisasi membentuk ikatan yang kuat dengan bahan implan) dan beberapa menyatakan osteoinduktif (Laurencin & Yusuf 2009). Bahan ini membutuhkan temperatur yang tinggi untuk membentuk scaffold dan mempunyai sifat rapuh.
Mineral Apatit
Komponen utama senyawa apatit adalah kalsium fosfat. Kalsium fosfat terdiri dari beberapa fase yaitu oktakalsium fosfat, dikalsium fosfat dihidrat (DKFD), trikalsium fosfat (TKF) dan hidroksiapatit (HA). Komponen mineral apatit memiliki rumus kimia M10(ZO4)6X2. Unsur pada bagian M, Z dan X dapat
digantikan dengan unsur-unsur lain, yakni sebagi berikut; M= Ca, Se, Ba, Cd, Pb, dll; Z= P, V, As, S, Si, Ge, dll; X = F, Cl, OH, O, Br, CO3, dll. Kristal apatit
mengandung banyak karbon dalam bentuk karbonat. Karbonat di dalam tubuh dapat mensubtitusi formula hidroksiapatit dengan menempati dua posisi yakni menggantikan posisi OH yang disebut sebagai apatit karbonat tipe A yang terbentuk pada suhu tinggi. Karbonat menggantikan posisi PO43- disebut apatit
karbonat tipe B yang dapat dibentuk pada suhu rendah. Kalsium fosfat (Ca-P) dapat ditemukan di alam (coralline hidroksiapatit) atau disintesa menggunakan regen kimia dengan metode presipitasi (Aoki 1994)
Hidroksiapatit
Hidroksiapatit (HA) merupakan material keramik bioaktif dengan bioafinitas tinggi, bersifat biokompatibel dan bioaktif. Bioaktif adalah kemampuan material bereaksi dengan jaringan dan menghasilkan ikatan kimia yang sangat baik sedangkan biokompatibel adalah kemampuan material untuk menyesuaikan dengan kecocokan tubuh penerima (Purnama 2006). Hidroksiapatit merupakan unsur mineral terbesar yang terdapat pada tulang dan gigi (Aoki 1991). Hidroksiapatit termasuk ke dalam senyawa kalsium fosfat yang merupakan senyawa mineral dan anggota kelompok mineral apatit dengan rumus kimia [Ca10(PO4)6(OH)2] yang mempunyai struktur heksagonal serta memiliki rasio
Ca/P sekitar 1,67 (Aoki 1991). Senyawa ini adalah salah satu dari sedikit material yang diklasifikasikan sebagai bioaktif material. Material tersebut dapat mendukung pertumbuhan tulang tanpa adanya penghancuran ketika digunakan untuk implantasi pada manusia. Hidroksiapatit dapat melekat secara biointegrasi. Implan yang terbuat dari bahan ini dapat berkontak dan menyatu secara kimiawi dengan tulang. HA dalam bentuk keramik dan kristal lambat dalam penyerapan dan pembentukan tulang, sebaliknya pada non keramik, bentuk non kristal cepat dalam penyerapan dan dalam pembentukan tulang (Reddy & Swamy 2010).
Trikalsium Fosfat
TKF merupakan salah satu jenis kalsium fosfat yang memiliki rasio Ca/P sebesar 1,50 dan memiliki struktur kimia Ca3(PO4)2 (Aoki 1991). TKF memiliki 4
polymorph yaitu α, ß, γ dan super-α. ß polymorph adalah fase bertekanan tinggi
dan super-αpolymorph dapat diobservasi pada temperatur kira-kira diatas 1500oC. Oleh karena itu, TKF polymorph yang sering digunakan dalam penelitian biokeramik adalah α dan ß-TKF (Shi 2004).
Beberapa penelitian menyatakan bahwa TKF memiliki sifat biodegradabel, walaupun sedikit berbeda dengan karakteristik material yang digunakan (Shi 2004). Strukturnya juga berupa kristal, laju biodegradasi TKF lebih baik daripada HA. Bahkan dalam penelitian yang dilakukan oleh Takatoshi (2007) menyatakan bahwa implantasi material ß-TKF ke dalam os femur kelinci menunjukkan bioresorbabel atau dapat diserap namun tidak pada HA. TKF mempunyai peranan
penting sebagai bioresorbabel keramik. Bahan ini memperlihatkan tingginya daya larut dan bioaktifitas. Hasilnya menunjukkan mikrostrutur ß-TKF berefek pada aktifitas dari sel-sel tulang dan kemudian dapat menggantikan tulang. ß-TKF dapat diterima dan digunakan di dalam tubuh atau dikenal sebagai biokompatibel, bioresorbabel material untuk perbaikan tulang yang dibentuk menjadi keramik blok, granul, atau fosfat semen (Shi 2004).
Karakteristik Implan (Bone Graft) Komposit Hidroksiapatit-Trikalsium Fosfat (HA-TKF)
Implan yang ditanamkan dalam penelitian ini merupakan kombinasi hidroksiapatit dan trikalsium fosfat. Keduanya merupakan grup kalsium fosfat namun berbeda fase. Hidroksiapatit memiliki sifat stabil namun memiliki kemampuan penyerapan yang kecil. Untuk mengimbanginya ditambahkanlah TKF (trikalsium fosfat) yang memiliki daya penyerapan lebih tinggi. Kombinasi keduanya sering disebut bifase kalsium fosfat (BKF) keramik. Bifase kalsium fosfat keramik memiliki keuggulan potensi sebagai osteokonduktif dan memiliki tingkat resorpsi optimal untuk pembentukan tulang (Xue et al. 2009)
Implan (bone graft) yang digunakan merupakan hasil pembuatan yang dilakukan oleh Nur Aisyah Nuzulia dari Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB. Bikalsium fosfat (BKF) ini merupakan hasil presipitasi material Na2HPO4.2H2O dengan butiran dari CaCl2.2H2O dengan rasio
Ca/P adalah 1,67. Hasil dari metode ini adalah bubuk BKF dan memiliki massa sebesar 1,3162 gram. Hasil karakterisasi menggunakan scanning electron
microscopy (SEM) menujukkan bahwa BKF keramik memiliki morfologi berupa
kumpulan seperti bola besar yang tebal menunjukkan terbentuknya BKF dan bola kecil yang mengelilinginya dan jumlahnya sangat banyak merupakan hidroksiapatit (Fellah 2007 diacu dalam Nuzulia 2009). Dari hasil tersebut BKF terlihat jelas dan terlihat juga pembentukan OCP yang terdiri dari piringan kecil seperti partikel di permukaan sampel (Imaizumi 2006 diacu dalam Nuzulia 2009)
Kalsium fosfat keramik juga merupakan bahan yang memiliki sifat osteokonduktif, sehingga penggunaannya dapat menjadi alternatif autogenous
spinal fusion, operasi scoliosis, dll (Saikia et al. 2008). Pemeriksaan histologi menunjukkan adanya pertumbuhan tulang baru ke dalam struktur pori-pori dari implan HA. Di dalam hasil pengamatan preparat tersebut tidak ada bukti yang meyakinkan bahwa implan terbiodegradasi meskipun terdapat histiosit,
multinukleat giant sel, osteoklas (Saikia et al. 2008). Sedangkan Levin et al
(1975) melaporkan bahwa pada percobaan menggunakan hewan model terjadi resorpsi ß-TKF secara sempurna.
Fisiologi Perbaikan Tulang dan Bone Graft (Implan)
Penggunaan bone graft untuk mencapai tujuan arthodesis (membuat kaku sendi melalui pembedahan, sehingga tidak terjadi gerakan lagi pada sendi yang bersangkutan) atau dalam pengisian tulang dipengaruhi oleh karakter anatomi, histologi dan prinsip biokimiawi. Sebagai tambahan, beberapa sifat fisiologis
bone graft (cangkok tulang) akan mempengaruhi secara langsung keberhasilan
atau kegagalan penggabungan graft. Sifat tersebut antara lain osteogenesis, osteoinduktif, dan osteokonduktif (Prolo 1990; Kalfas 2001).
Osteogenesis adalah kemampuan suatu graft untuk memproduksi tulang baru. Pada proses ini dipengaruhi oleh kehadiran sel-sel tulang di dalam graft tulang. Material osteogenik graft terdiri dari sel dengan kemampuan untuk membentuk tulang (sel osteoprogenitor) atau berpotensi untuk berdiferensiasi menjadi sel pembentuk tulang (diinduksi sel prekursor osteogenik/sel osteoprogenitor). Sel yang berpartisipasi dalam tahap awal proses persembuhan untuk menyatukan graft dengan tulang. Osteogenesis hanya ditemukan dalam properti autogenous tulang segar dan dalam sel sumsum tulang, meskipun penelitian mengenai sel dalam graft menunjukkan sangat sedikit yang ditransplantasikan dapat bertahan (Muschler et al. 1990).
Osteokonduktif adalah sifat fisik dari graft dalam menjalankan fungsi sebagai scaffold untuk mendukung dalam persembuhan tulang. Osteokonduktif memungkinkan untuk pertumbuhan neovaskularisasi dan infiltrasi sel-sel prekursor osteogenik ke dalam ruang graft. Sifat osteokonduktif ditemukan di
autograft dan allograft, demineralisasi tulang matrik, hidroksiapatit, kolagen dan
Osteoinduktif adalah kemampuan dari material graft untuk menginduksi stem sel agar dapat berdeferensiasi menjadi sel-sel tulang dewasa. Proses ini biasanya berkaitan dengan adanya faktor pertumbuhan tulang dalam material graft atau suplemen pendukung dalam graft tulang. Bone morphogenic protein (BMP) dan mineralisasi matriks tulang merupakan bahan pokok osteoinduktif (Muschler et al. 1990).
Domba sebagai Hewan Coba
Penggunaan domba dalam penelitian di bidang ortopedik semakin meningkat dalam dekade terakhir ini, meskipun anjing masih menjadi pilihan yang paling baik. Pada periode 1990-2001, sebanyak 9-12% domba digunakan dalam penelitian ortopedik yang melibatkan patah tulang, osteoporosis, bone
lengthenin, dan osteoarthritis. Pada periode 1980-1989 yang hanya digunakan
kurang lebih sebanyak 5% (Martini et al. 2001). Peningkatan penggunaannya terkait dengan isu-isu etis dan persepsi negatif masyarakat dalam penggunaan hewan kesayangan untuk penelitian medis.
Ditinjau dari segi makroskopisnya, sebagian besar literatur menyatakan bahwa anjing lebih cocok digunakan sebagai model untuk tulang manusia dilihat dari sudut pandang biologis, namun domba dewasa menawarkan keuntungan diantaranya berat tubuh domba mirip dengan manusia. Kemudian keuntungan lainnya domba memiliki dimensi tulang panjang yang sesuai untuk implantasi dan percobaan prosthesis manusia (Newman et al. 1995) yang tidak mungkin dilakukan pada spesies yang lebih kecil seperti kelinci atau anjing dengan ras kecil.
Penggunaan domba dalam eksperimental sering digunakan untuk menguji biokompatibilitas berbagai biomaterial (Hunziker 2003), hal ini dilakukan untuk mengetahui bioaktivitas yang berkaitan dengan resorpsi atau integrasi dari bahan yang ditanamkan ke dalam tulang (Hing et al. 1998). Struktur khusus dan morfologi tulang panjang pada domba sesuai dengan fungsi dan beban mekanik daerah tulang tertentu. Penggunaan domba memiliki hasil yang lebih baik daripada hewan laboratorium kecil seperti tikus karena memiliki kesamaan metabolisme tulang yang sesuai dengan manusia. Pada hasil penelitian yang
dilakukan oleh Nuss et al. (2006) juga menunjukkan bahwa pengujian dengan mengimplantasikan dengan cara membuat lubang bor pada domba terbukti dapat menjadi model hewan yang sangat baik untuk menguji biokompatibilitas biomaterial yang harus tertanam dalam tulang.
Secara histologi, struktur tulang domba dan manusia memiliki perbedaan. Struktur tulang domba didominasi oleh struktur tulang primer (osteonnya berdiameter kurang dari 100 µm) mengandung pembuluh darah sentral dan tidak memiliki cement line (deKleer 2006). Komponen tulang pada manusia struktur tulang sekunder lebih mendominasi (Pearce et al. 2007). Perbedaan lainnya terlihat dari densitas atau kepadatan dari kedua tulang. Dalam penelitian Nafei et al. (2000) melaporkan kepadatan (massa/volume, mencerminkan tingkat porositas dari tulang) dari trabekular tulang domba yang diambil dari proksimal tibia domba dewasa sebesar 0,61 g/cm3 dengan kerapatan abu 0,41 g/cm3 (massa/volume, mencerminkan tingkat mineralisasi tulang). Data tersebut lebih tinggi dibanding nilai untuk trabekular tulang femur manusia, dengan kerapatan 0,43 g/cm3 didapat kepadatan abunya sebesar 0,26 g/cm3 sehingga domba memiliki kepadatan tulang 1,5-2 kali lebih besar dari manusia (Liebschner 2004).
Perbedaan kepadatan tersebut dapat pula berbeda pada lokasi tulang yang berlainan. Sebagai contoh, Liebschner (2004) melaporkan bahwa kepadatan trabekular tulang belakang domba sebesar 60±0,16 g/cm3 berbeda dengan tulang belakang manusia yang kepadatan adalah 0,14±0,06 g/cm3. Dari segi komposisi mineral tulang, menyimpulakan bahwa selain dari tahap awal fisiologis pertumbuhan terdapat subsitusi parsial Mg2+ untuk Ca2 di trikalsium magnesium fosfat, komposisi mineral manusia dan hewan tidak menunjukkan perbedaan yang signifikan (Ravaglioli et al. 1996). Dalam hal remodelling tulang, berbagai riset melaporkan bahwa domba dan manusia memiliki pola yang sama dalam pertumbuhan tulang ke implan berpori (Pearce et al. 2007)