KARBON TETRAKLORIDA
INTISARI
Penelitian ini bertujuan untuk mengetahui efek antihepatotoksik infusa herba Mimosa pigra L. dan dosis optimumnya terhadap tikus putih jantan galur Wistar terinduksi karbon tetraklorida.
Penelitian ini bersifat eksperimental murni dengan rancangan acak lengkap pola searah. Penelitian ini menggunakan 35 tikus jantan galur Wistar, umur 2-3 bulan, dan berat 120-200 gram. Kelompok I merupakan kontrol minyak zaitun dengan pemberian sebanyak 2,0 ml/kg BB secara intraperitoneal. Kelompok II merupakan kontrol hepatotoksin karbon tetraklorida dosis 2,0 ml/kgBB secara intraperitonial. Kelompok III merupakan kontrol perlakuan yaitu pemberian infusa herba Mimosa pigra L. dosis 2,835 g/kg BB secara per oral. Kelompok IV merupakan kontrol positif silimarin dosis 25 mg/KgBB secara per oral. Kelompok V-VII merupakan kelompok perlakuan infusa herba Mimosa pigra L. dengan dosis 1,26; 1,89; dan 2,835 g/KgBB melalui rute oral. Hewan uji diberikan induksi karbon tetraklorida 2 ml/KgBB i.p. terlebih dahulu, diikuti pemberian silimarin pada kelompok kontrol positif dan infusa herba Mimosa pigra L. 6 jam kemudian pada kelompok perlakuan. Pada jam ke-24 setelah pemberian CCl4, semua kelompok diambil darahnya pada daerah
sinus orbitalis di mata tikus. Data ALT dan AST serum yang didapat, dianalisis dengan uji
solmogorov-Smirnov untuk melihat distribusi datanya kemudian dilanjutkan analisis dengan uji Mann-Whitney untuk mengetahui perbedaan aktivitas ALT dan AST serum antar kelompok.
Hasil penelitian menunjukkan adanya efek antihepatotoksik dari infusa herba Mimosa pigra L. dengan %antihepatotoksik dari peringkat dosis 1 hingga 3 secara berurutan adalah 62,5; 71,7; dan 39,9% berdsarkan serum ALT, dan berdasarkan serum AST sebesar 97,6; 98,1; dan 35,7%. Dari data pengukuran aktivitas serum ALT dan AST yang diperoleh, dosis optimum infusa herba Mimosa pigra L. adalah 1,26 g/KgBB.
The aim of study research were to prove the antihepatotoxic effect of Mimosa pigra
L. herb infusion and the optimum dose in male Wistar rats induced carbon tetrachloride. This research was purely experimental research with randomized complete direct sampling design. This research use 35 male Wistar rats, attain the age 2-3 month, and 120-200 gram weight. Group I was olive oil control by giving as much as 2 ml/KgBW intraperitoneally. Group II was carbon tetrachloride hepatotoxin control dose 2 ml/KgBW intraperitoneally. Group III was control treatment given 2.835 g/KgBW infusion of Mimosa pigra L. herb orally. Group IV was silimarin positive control given 25 mg/KgBW orally. Group V-VII were the treatment group for infusion of Mimosa pigra L. herb with dose 1.26; 1.89, and 2.835 g/KgBW orally. All animals were given carbon tetrachloride 2 ml/KgBW intraperitoneally first, followed by administration of the silymarin in the positive control group and Mimosa pigra L. herb infusion in the treatment group. At the 24th hour after administration of CCl4, all groups had blood drawn at the orbital sinus region. Data of ALT
and AST serum which were obtained were analyzed using solmogorov-Smirnov test to look at the data distribution. After that, the data were analyzed using Mann-Whitney test to determine the differences in ALT activities and AST serum in each group.
The results showed there were antihepatotoxic effects of infusion of Mimosa pigra
L. herb with %antihepatotoxic from smalest dose to largest dose was 62.5; 71.7, and 39.9% based from ALT serum and 97.6; 98.1, and 35.7% based from AST serum. From the data measurement of activities ALT and AST serum which were obtained, the most effective dose from infusion of Mimosa pigra L. herb was 1.26 g/KgBW.
EFEK ANTIHEPATOTOKSIK INFUSA HERBA
Mimosa pigra
L.
TERHADAP TIKUS PUTIH JANTAN GALUR WISTAR
TERINDUKSI KARBON TETRAKLORIDA
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Diajukan Oleh: Lukas Surya Wijaya
NIM : 108114128
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
EFEK ANTIHEPATOTOKSIK INFUSA HERBA
Mimosa pigra
L.
TERHADAP TIKUS PUTIH JANTAN GALUR WISTAR
TERINDUKSI KARBON TETRAKLORIDA
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Diajukan Oleh: Lukas Surya Wijaya
NIM : 108114128
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
PERSEMBAHAN
“i know that i am intelligent, because i know
that i know nothing”
Socrates
“The root of education is titter, tut the fruit is
sweet”
Aristoteles
vii
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas
berkat dan rahmat-Nya, sehingga penulis dapat menyelesaikan skripsi dengan
judul “Efek Antihepatotoksik Infusa Herba Mimosa pigra L. Terhadap Tikus Putih
Jantan Galur Wistar Terinduksi Karbon Tetraklorida” ini dengan baik. Skripsi ini
disusun sebagai salah satu syarat memperoleh gelar Sarjana Farmasi Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta.
Penyelesaian skripsi ini tentunya tidak lepas dari bantuan dari berbagai
pihak, baik secara langsung maupun secara tidak langsung. Oleh karena itu
penulis hendak mengucapkan terima kasih kepada :
1. Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Ipang Djunarko M.Sc., Apt., selaku Dosen Pembimbing skripsi ini
atas segala kesabaran untuk selalu membimbing, memberi motivasi, dan
memberi masukan kepada penulis dalam menyusun skripsi ini.
3. Ibu Phebe Hendra, Ph.D., Apt., selaku Dosen Penguji skripsi atas bantuan
dan masukkan kepada penulis demi kemajuan skripsi ini.
4. Bapak Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji skripsi atas
bantuan dan masukkan, kepada penulis demi kemajuan skripsi ini.
5. Ibu Rini Dwiastuti, M.Si., Apt., sebagai Kepala Laboratorium Fakultas
Farmasi terdahulu dan Ibu Dr. Sri Hartati Yuliani, M.Si., Apt., selaku
Kepala Laboratorium Fakultas Farmasi saat ini yang telah memberi izin
viii
Farmakognosi-Fitokimia dan Kimia Analisis demi terselesaikannya skripsi
ini.
6. Pak Supardjiman selaku laboran Laboratorium Farmakologi-Toksikologi,
Pak Heru selaku laboran Laboratorium Biofarmasetika-Farmakokinetika,
Pak Kayatno selaku laboran Laboratorium Biokimia, dan Pak Wagiran
selaku laboran Laboratorium Farmakognosi-Fitokimia, serta Pak Andri
selaku laboran di kebun obat, atas segala bantuan dan kerja sama selama di
laboratorium.
7. Kedua orang tua penulis yang mendanai sebagian besar penelitian untuk
menyelesaikan skripsi ini.
8. Cornelia Melinda dan Kelvin Nugroho sebagai rekan tim Mimosa pigra
dalam menjalankan penelitian yang dengan rela membantu kegiatan
penelitian penulis.
9. Teman-teman penulis, Brigitta Lynda Rakasiwi, Juana Merianti, Maria
Malida Vernandes Sasadara, Hans Gani, Angelia Rosari, Trifonia Rosa
Kurniasih, Ibu Maria Dwibudi Djumpowati, S.Si., Bapak Yohanes
Dwiatmaka, M.Si., Mbak M.R. Biri Koni Tiala, S.Farm., dan Mas Ignatius
Kuncarli, S.Farm., teman-teman FKK B, dan teman-teman Fakultas
Farmasi Universitas Sanata Dharma 2010 yang selalu memberikan
dukungan dan masukan terhadap baik penelitian maupun penyusunan
skripsi kepada penulis.
10.Pihak-Pihak lain yang turut membantu penulis namun tidak dapat
ix
Penulis menyadari bahwa setiap manusia tidak ada yang sempurna. Oleh
karena itu, penulis mengharapkan adanya kritik, saran dan masukan demi
kemajuan di masa yang akan datang. Semoga tulisan ini dapat memiliki manfaat
sekecil apapun bagi perkembangan ilmu pengetahuan khususnya di bidang
kefarmasian, serta semua pihak, baik mahasiswa, lingkungan akademis, maupun
masyarakat.
Yogyakarta, 16 Oktober 2013
x
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... ... v
PERNYATAAN KEASLIAN KARYA ... vi
xi
F. Pengukuran Alanine Transaminase dan Aspartate Transaminase 25 G. Silimarin... 27
H. Landasan Teori ... 28
I. Hipotesis ... 29
BAB III. METODE PENELITIAN... 30
xii
B.Variabel Penelitian dan Definisi Operasional ... 30
1. Variabel penelitian ... 30
5. Pembuatan larutan karbon tetraklorida dalam minyak zaitun... 35
6. Pembuatan suspensi ekstrak silimarin ... 35
7. Uji pendahuluan ... 36
8. Pengelompokan dan perlakuan hewan uji... 36
xiii
1. Penetapan dosis hepatotoksin ... 43
2. Penentuan dosis infusa herba Mimosa pigra L. ... 44
3. Penentuan dosis kontrol positif silimarin ... 44
4. Penentuan waktu pencuplikan darah ... 45
C. Efek Antihepatotoksik Infusa Herba Mimosa pigra L Terhadap Tikus Jantan Galur Wistar Terinduksi Karbon Tetraklorida ... 52
1. Kontrol negatif ... 54
2. Kontrol hepatotoksin ... 56
3. Kontrol perlakuan (infusa herba Mimosa pigra L. dosis 2,835 g/KgBB) ... ... 57
xiv
DAFTAR TABEL
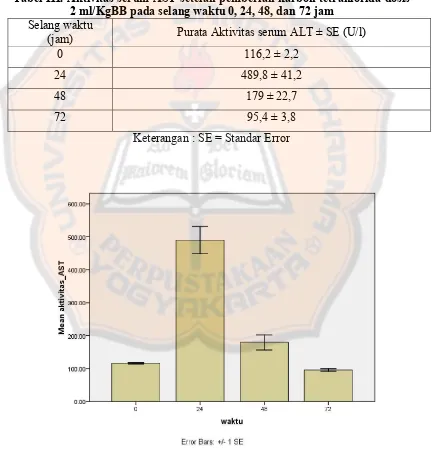
Tabel I. Aktivitas serum ALT setelah pemberian karbon tetraklorida dosis 2
ml/KgBB pada selang waktu 0, 24, 48, dan 72 jam ... 46
Tabel II. Perbedaan kenaikan aktivitas serum ALT setelah pemberian karbon
tetraklorida dosis 2 ml/KgBB pada waktu pencuplikan darah jam ke-0,
24, 48, dan 72 ...
... 48
Tabel III. Aktivitas serum AST setelah pemberian karbon tetraklorida dosis 2
ml/KgBB pada selang waktu 0, 24, 48, dan 72 jam ... 49
Tabel IV. Perbedaan kenaikan aktivitas serum AST setelah pemberian karbon
tetraklorida dosis 2 ml/KgBB pada waktu pencuplikan darah jam ke-0,
24, 48, dan 72 ...
... 51
Tabel V. Efek antihepatotoksik infusa herba Mimosa pigra L. pada dosis 1,26;
1,89; 2,835 g/KgBB terhadap aktivitas serum ALT dan AST pada tikus
putih terinduksi karbon tetraklorida ... 54
Tabel VI. Perbandingan aktivitas serum ALT jam ke-0 dengan perlakuan kontrol
negatif ...
... 55
Tabel VII. Perbandingan aktivitas serum AST jam ke-0 dengan perlakuan kontrol
negatif ...
xv
Tabel VIII. Perbandingan hasil antara seluruh kelompok kontrol terhadap
perlakuan pemberian infusa herba Mimosa pigra L. berdasarkan serum
ALT pada variasi dosis tertentu ... 62
Tabel IX. Perbandingan hasil antara seluruh kelompok kontrol terhadap perlakuan
pemberian infusa herba Mimosa pigra L. berdasarkan serum AST pada
xvi
DAFTAR GAMBAR
Gambar 1. Tanaman Mimosa pigra L ... 6
Gambar 2. Struktur Kandungan Ekstrak Metanolik Mimosa pigra L. ... 8
Gambar 3. Pembagian Zona Lobulus Hati ... 11
Gambar 4. Penampang Sel Penyusun Lobulus Hati... 12
Gambar 5. Proses Metabolisme Karbon Tetraklorida ... 22
Gambar 6. Mekanisme Pembentukan Radikal Lipid oleh Radikal CCl3 ... 23
Gambar 7. Struktur Flavonolignan pada Silimarin ... 27
Gambar 8. Diagram batang rata-tata aktivitas serum ALT sel hati tikus setelah pemberian karbon tetraklorida dosis 2 ml/KgBB pada selang waktu 0, 24, 48, dan 72 jam ... ... 47
Gambar 9. Diagram batang rata-tata aktivitas serum AST sel hati tikus setelah pemberian karbon tetraklorida dosis 2 ml/KgBB pada selang waktu 0, 24, 48, dan 72 jam ... ... 49
Gambar 10. Diagram batang rata-rata pengaruh pengaruh dosis pemberian infusa herba Mimosa pigra L. terhadap hepatotoksisitas karbon tetraklorida dilihat dari aktivitas serum ALT ... 61
xvii
Gambar 12. Diagram batang %antihepatotoksik antara kontrol minyak zaitun,
kontrol CCl4, kontrol silimarin, dan perlakuan berdasarkan aktivitas
serum ALT dan AST ...
xviii
DAFTAR LAMPIRAN
Lampiran 1. Foto infusa herba Mimosa pigra L. ... 84
Lampiran 2. Foto suspensi silimarin dalam CMC-Na 1% ... 84
Lampiran 3. Surat determinasi tanaman Mimosa pigra Ls sssssssssssssssssssssssss 85
Lampiran 4. Surat ethical clearence sssssssssssssssssssssssssssssssssssssssssssssssssssssssssss 86
Lampiran 5. Certified of analysis silimarin ... 87
Lampiran 6. Hasil analisis statistik data ALT dan AST pada uji pendahuluan
waktu pencuplikan darah hewan uji setelah induksi karbon
tetraklorida 2 mL/kgBB ...
... 88
Lampiran 7. Hasil analisis statistik data ALT dan AST pada kelompok kontrol
olive oil dosis 2 mL/kgBB ... 95
Lampiran 8. Hasil analisis statistik data kontrol minyak zaitun, kontrol CCl4,
kontrol ekstrak, kontrol silimarin, dan perlakuan pemberian infusa
herba Mimosa pigra L. dosis 1,26; 1,89 ; dan 2,835 g/KgBB 98
Lampiran 9. Perhitungan %antihepatotoksik ... 119
Lampiran 10. Perhitungan daya antihepatotoksik ... 120
xix
INTISARI
Penelitian ini bertujuan untuk mengetahui efek antihepatotoksik infusa
herba Mimosa pigra L. dan dosis optimumnya terhadap tikus putih jantan galur
Wistar terinduksi karbon tetraklorida.
Penelitian ini bersifat eksperimental murni dengan rancangan acak lengkap pola searah. Penelitian ini menggunakan 35 tikus jantan galur Wistar, umur 2-3 bulan, dan berat 120-200 gram. Kelompok I merupakan kontrol minyak zaitun dengan pemberian sebanyak 2,0 ml/kg BB secara intraperitoneal. Kelompok II merupakan kontrol hepatotoksin karbon tetraklorida dosis 2,0 ml/kgBB secara intraperitonial. Kelompok III merupakan kontrol perlakuan yaitu pemberian
infusa herba Mimosa pigra L. dosis 2,835 g/kg BB secara per oral. Kelompok IV
merupakan kontrol positif silimarin dosis 25 mg/KgBB secara per oral. Kelompok
V-VII merupakan kelompok perlakuan infusa herba Mimosa pigra L. dengan
dosis 1,26; 1,89; dan 2,835 g/KgBB melalui rute oral. Hewan uji diberikan induksi karbon tetraklorida 2 ml/KgBB i.p. terlebih dahulu, diikuti pemberian
silimarin pada kelompok kontrol positif dan infusa herba Mimosa pigra L. 6 jam
kemudian pada kelompok perlakuan. Pada jam ke-24 setelah pemberian CCl4,
semua kelompok diambil darahnya pada daerah sinus orbitalis di mata tikus. Data
ALT dan AST serum yang didapat, dianalisis dengan uji Kolmogorov-.mirnov
untuk melihat distribusi datanya kemudian dilanjutkan analisis dengan uji
Mann-Whitney untuk mengetahui perbedaan aktivitas ALT dan AST serum antar kelompok.
Hasil penelitian menunjukkan adanya efek antihepatotoksik dari infusa
herba Mimosa pigra L. dengan %antihepatotoksik dari peringkat dosis 1 hingga 3
secara berurutan adalah 62,5; 71,7; dan 39,9% berdsarkan serum ALT, dan berdasarkan serum AST sebesar 97,6; 98,1; dan 35,7%. Dari data pengukuran aktivitas serum ALT dan AST yang diperoleh, dosis optimum infusa herba Mimosa pigra L. adalah 1,26 g/KgBB.
Kata kunci : Mimosa pigra L., antihepatotoksik, karbon tetraklorida, infusa, ALT,
xx
ABSTRACT
The aim of study research were to prove the antihepatotoxic effect of Mimosa pigra L. herb infusion and the optimum dose in male Wistar rats induced carbon tetrachloride.
This research was purely experimental research with randomized complete direct sampling design. This research use 35 male Wistar rats, attain the age 2-3 month, and 120-200 gram weight. Group I was olive oil control by giving as much as 2 ml/KgBW intraperitoneally. Group II was carbon tetrachloride hepatotoxin control dose 2 ml/KgBW intraperitoneally. Group III was control
treatment given 2.835 g/KgBW infusion of Mimosa pigra L. herb orally. Group
IV was silimarin positive control given 25 mg/KgBW orally. Group V-VII were
the treatment group for infusion of Mimosa pigra L. herb with dose 1.26; 1.89,
and 2.835 g/KgBW orally. All animals were given carbon tetrachloride 2 ml/KgBW intraperitoneally first, followed by administration of the silymarin in
the positive control group and Mimosa pigra L. herb infusion in the treatment
group. At the 24th hour after administration of CCl4, all groups had blood drawn
at the orbital sinus region. Data of ALT and AST serum which were obtained
were analyzed using Kolmogorov-.mirnov test to look at the data distribution.
After that, the data were analyzed using Mann-Whitney test to determine the
differences in ALT activities and AST serum in each group.
The results showed there were antihepatotoxic effects of infusion of Mimosa pigra L. herb with %antihepatotoxic from smalest dose to largest dose was 62.5; 71.7, and 39.9% based from ALT serum and 97.6; 98.1, and 35.7% based from AST serum. From the data measurement of activities ALT and AST
serum which were obtained, the most effective dose from infusion of Mimosa
pigra L. herb was 1.26 g/KgBW.
Keywords : Mimosa pigra L., antihepatotoxic, carbon tetrachlorida, infusion,
1
BAB I PENGANTAR
A. Latar Belakang
Hati atau hepar merupakan salah satu organ yang memiliki peranan
penting dalam mendukung kelangsungan hidup manusia. Hati yang merupakan
organ terbesar dari manusia memiliki fungsi untuk memetabolisme
senyawa-senyawa yang masuk ke dalam tubuh. Selain itu, hati juga memiliki kemampuan
mendetoksifikasi senyawa-senyawa racun yang masuk ke dalam tubuh. Akan
tetapi, saat ini banyak kelainan yang dapat mengganggu kerja hati. Salah satu
kelainan yang banyak dijumpai pada organ hati adalah perlemakan hati (steatosis).
Perlemakan hati merupakan kondisi dimana terjadi penumpukan lemak
pada hati (Fransiskus, 2011). Perlemakan hati dibagi menjadi dua yaitu
perlemakan hati diperantarai alkohol dan perlemakan hati tidak diperantarai
alkohol. Perlemakan hati tidak diperantarai alkohol (NAFLD) merupakan kondisi
perlemakan hati yang banyak dijumpai di kalangan masyarakat pada negara maju.
Kondisi kronis dari NAFLD (Non-Alcoholic Fatty Liver Disease) akan berujung
pada keadaan Non-Alcoholic .teato Hepatitis (NASH) (Chalrton, 2004). Data
epidemiologi menyatakan bahwa di negara bagian barat, prevalensi NAFLD
berkisar antara 15-20%, dan 20-30% di antaranya berada pada fase NASH. Pada
penderita obesitas di negara maju, didapatkan 60% mengalami perlemakan hati
penderita diabetes melitus tipe 2, terdapat 70% pasien mengalami NAFLD dan
60% mengalami NAFLD pada penderita dislipidemia. Di Indonesia sendiri,
prevalensi NAFLD mencapai 30,6% (Sofia, Nurdjanah, dan Ratnasari, 2009).
Dari penelitian tersebut terlihat bahwa angka prevalensi perlemakan hati
pada masyarakat dunia cukup tinggi, terutama pada penderita sindrom metabolit
seperti hipertensi, diabetes, dislipidemia, dan obesitas. Pengobatan yang cukup
sering dilakukan adalah menggunakan obat-obatan herbal baik untuk mencegah
maupun menyembuhkan perlemakan hati tersebut. Data World Health
Organizaton (WHO) pada tahun 2008 menunjukkan bahwa 80% penduduk Asia
dan Afrika kerap menggunakan tanaman sebagai obat herbal dalam mengatasi
berbagai macam penyakit.
Salah satu tanaman yang memiliki potensi sebagai obat untuk kelainan
pada organ hati adalah Mimosa pigra L. Tanaman ini merupakan tanaman sejenis
putri malu yang tumbuh di beberapa tempat di Indonesia. Mimosa pigra L.
memiliki ciri khusus yaitu ukurannya yang lebih besar dari kerabatnya Mimosa
pudica L. Penelitan yang telah dilakukan menunjukkan bahwa infusa herba
Mimosa pigra L. memiliki potensi sebagai hepatoprotektif pada tikus putih yang
terinduksi parasetamol (Apriyanto, Susanti, Wijayanti, Linawati, 2000). Selain itu,
telah dilakukan penelitian yang menyatakan bahwa ekstrak metanol daun Mimosa
pigra L. mengandung senyawa yang memiliki potensi sebagai antioksidan (Lee,
2004). Penelitian terbaru juga menunjukkan bahwa ekstrak metanol daun Mimosa
pigra L. memiliki kandungan flavonoid seperti quercetin dan myricitrin yang
(DPPH) dan Poly Aromatic Hydrocarbon (Rakotomalala, Agard, Tonnerre, Tesse,
Derbre, Michalet, et al., 2013). Senyawa antioksidan merupakan senyawa yang
dapat digunakan untuk menetralkan senyawa radikal yang merupakan penyebab
perlemakan hati.
Berdasarkan penelitian yang pernah dilakukan oleh Apriyanto, dkk
(2000), peneliti ingin melihat kemampuan infusa herba Mimosa pigra L. sebagai
hepatokuratif dengan model antihepatotoksik. Selain itu, peneliti juga ingin
melihat kemampuan infusa herba Mimosa pigra L. dalam menyembuhkan
perlemakan hati dengan senyawa model yang digunakan adalah karbon
tetraklorida. Senyawa karbon tetraklorida merupakan senyawa model yang biasa
digunakan untuk membentuk perlemakan hati sehingga hasil dari penelitian ini
dapat digunakan sebagai dasar pengobatan perlemakan hati yang terjadi pada
manusia dengan menggunakan infusa herba Mimosa pigra L. Karbon tetraklorida
akan membentuk senyawa CCl3 radikal yang dapat menginisiasi pembentukan
radikal lipid sehingga terjadi penimbunan lemak pada hati.
Pada penelitian ini digunakan bentuk ekstrak berupa infusa. Hal ini
didasarkan dari penggunaan pada masyarakat yang umumnya menggunakan
metode perebusan, sehingga digunakan metode ekstraksi yang paling mendekati
dengan metode perebusan yaitu metode infundasi. Selain itu, metode infundasi
digunakan dengan pertimbangan jenis senyawa yang dituju berupa senyawa
fenolik yaitu quercetin dan myricitrin. Senyawa tersebut dapat terekstrak dari
daun Mimosa pigra L. menggunakan pelarut metanol. Metode infundasi juga
pigra L. karena senyawa fenolik juga dapat terlarut dalam air panas (Xu, Chen,
Xhang, Jiang,Ye, 2008).
1. Perumusan masalah
a. Apakah infusa herba Mimosa pigra L. memiliki efek antihepatotoksik
terhadap tikus putih jantan galur Wistar terinduksi karbon tetraklorida?
b. Berapakah dosis efektif infusa herba Mimosa pigra L. yang memberikan efek
paling optimum dalam menyembuhkan perlemakan hati pada tikus putih
jantan galur Wistar terinduksi karbon tetraklorida?
2. Keaslian penelitian
Penelitian menggunakan infusa herba Mimosa pigra L. pernah dilakukan
oleh Apriyanto, dkk. (2000) Hasil penelitian melaporkan bahwa infusa herba
Mimosa pigra L. memiliki efek hepatoprotektif pada tikus putih jantan galur
Wistar terinduksi parasetamol. Selain itu, ekstrak metanol dari daun dan batang
Mimosa pigra L. memiliki potensi sebagai antihiperglikemi dan antinociceptive
(Toma, Rahman, Jahan, Haque, Agarwala, Shelley, et als, 2012). Kemampuan
antibakteri dari Mimosa pigra L. juga pernah diuji. Hasil dari penelitian
menyatakan bahwa terdapat aktivitas antibakteri dari tanaman tersebut (Mbatchou,
Ayebila, dan Apea, 2011). Ekstrak metanol daun Mimosa pigra L. pernah juga
pernah diteliti dan terbutkti memiliki aktivitas antioksidan, antiinflamasi, dan
antihipertensi pulmonar (Rakotomalala, et al., 2013).
Sepanjang penelusuran penulis, penelitian mengenai efek
antihepatotoksik Mimosa pigra L. pada tikus putih jantan terinduksi CCl4 belum
3. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini diharapkan memberi manfaat pada pengembangan ilmu
pengetahuan khususnya di bidang kefarmasian mengenai potensi
antihepatotoksik dari infusa herba Mimosa pigra L.
b. Manfaat praktis
Penelitian ini diharapkan memberi informasi pada masyarakat mengenai dosis
optimum infusa herba Mimosa pigra L. dalam pengobatan perlemakan yang
terjadi pada hati.
B. Tujuan Penelitian 1. Tujuan umum
Secara umum, penelitian ini bertujuan untuk mengetahui potensi
antihepatotoksik dari infusa herba Mimosa pigra L. terhadap tikus putih jantan
terinduksi CCl4 berdasarkan aktivitas enzim ALT dan AST dalam darah.
2. Tujuan khusus
Secara khusus penelitian ini bertujuan untuk mengetahui dosis
antihepatotoksik infusa herba Mimosa pigra L. yang optimum dalam dalam
mengobati perlemakan hati yang terjadi pada tikus putih jantan galur Wistar
6
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Mimosa pigra L. (Putri Malu) 1. Deskripsi tanaman
Gambar 1. Tanaman Mimosa pigra L.
Mimosa pigra L. (gambar 1) merupakan tanaman semak, dengan banyak
tangkai berduri, menyebar dengan ukuran dua hingga enam meter. Mimosa pigra
L. dapat hidup hingga lima tahun. Tanaman ini dapat hidup sepanjang musim dan
memiliki tipe percabangan bipinatus. Ciri khas dari Mimosa pigra L. adalah
memiliki daun yang sensitif. Ibu batang daun dapat tumbuh hingga 18 cm,
memiliki duri sepanjang 7 mm yang terletak di sisi bawah petioles dan batang.
Tanaman ini dapat berbunga hingga mencapai seratus buah. Bunga berbentuk
bulat dengan diameter 1 cm berwarna merah muda. Mimosa pigra L. merupakan
jenis androdioseus baik bunga jantan maupun hermaprodit delapan tangkai sari
berbulu, dan berkerumun hingga 7 polong. Setiap polong berisi 8-24 biji. Biji
Mimosa pigra L. berukuran 5 x 2,4 mm dengan berat 0,09 mg. Buah masak dalam
kurun waktu 3 bulan (Binggeli, 2005).
2. Klasifikasi
Klampis air, Putri main hitam, Adiputri malu raksasa, Jerujut, Gehgeran,
Cucuk Buset, Rondo kaget, Pis kucing (Tjitrosoedirdjo, 1989).
5. Kandungan kimia
Kandungan Mimosa pigra L. yang telah diteliti antara lain alkaloid
(metode Fehling), glikosida (metode Willistatter), saponin (uji busa), steroid
(metode Liebermann-Burchard), tanin (metode FeCl3), dan terpenoid (metode
Liebermann-Burchard) (Mbatchou, et als, 2011). Hasil ini hampir sama bila
dibandingkan dengan kerabat dekatnya Mimosa pudica L. Dalam sebuah
penelitian, skrining fitokimia dari Mimosa pudica L. menunjukkan kandungan
alkaloid dengan uji Mayer, Dragendroff, dan Wagner. Selain itu ada pula
kandungan saponin yang terdeteksi dengan uji busa. Menggunakan uji Salkowski
terlihat kandungan phytosterol, serta adanya kandungan flavonoid dengan uji
gelatin dan timbal asetat (Kaur, Kumar, Shivananda, dan Kaur, 2011).
Kandungan yang terdeteksi dari ekstrak metanolik Mimosa pigra L.
antara lain : triptophan, myricitrin, dan quercetin dengan 4 jenis substituen
sakarida (gambar 2) (Rakotomalala, et al., 2013).
Gambar 2. Struktur Kandungan Ekstrak Metanolik Mimosa pigra L. (1. Triptofan, 2. Myricitrin, 3. Quercetin 3-O-hexosa, 4. Quercetin 3-O-hexosa,
6. Kegunaan
Belum banyak peneliti yang melakukan penelitian mengenai kegunaan
dari Mimosa pigra L. secara rasional. Apriyanto, dkk. (2000) pernah meneliti efek
hepatoprotektif dari infusa herba Mimosa pigra L. terhadap tikus terinduksi
parasetamol dan menyatakan adanya potensi hepatoprotektif. Secara empiris,
Mimosa pigra L. digunakan di Afrika sebagai tonik, untuk diare, gonorhea, dan
keracunan. Di Tanzania, serbuk daun dicampur air untuk meredakan bengkak.
Negara Zambia menggunakan abu dari akar Mimosa pigra L. untuk obat lepra,
selain itu rebusan akar dapat bermanfaat sebagai afrodisia serta penenang. Biji
Mimosa pigra L. dapat digunakan sebagai emetik dan ekspektoran serta masalah
pada gigi (World Agroforestry Centre, 2013). Selain itu beberapa penelitian
menyatakan bahwa ekstrak dari daun Mimosa pigra L. memiliki efek antomikroba
untuk beberapa bakteri patogen. Ekstrak metanol daun Mimosa pigra L. juga
memiliki potensi sebagai antioksidan berdasarkan penelitian yang pernah
dilakukan oleh Lee (2008). Ekstrak metanol daun Mimosa pigra L. juga memliki
aktivitas sebagai antihipertensi pulmonar, antiinflamasi, dan antioksidan
(Rakotomalala, et al., 2013).
Mimosa pigra L. memiliki kandungan antioksidan seperti kaempferol,
quercetin, dan myricitrin yang dapat menangkal radikal bebas. Penelitian terbaru
menyatakan, ekstrak metanol daun Mimosa pigra L. dapat menangkal radikal
Polycyclic Aromatic Hydrocarbon (PAH) yang merupakan penyebab utama
hipoksia pada arteri pulmonaris. Selain itu, ekstrak metanol daun Mimosa pigra L.
pembuluh darah. Triptofan yang terkandung dalam ekstrak metanol daun Mimosa
pigra L. dapat meningkatkan proliferasi sel dari jaringan yang rusak akibat
inflamasi (Rakotomalala, et al., 2013).
B. Hati 1. Anatomi dan fisiologi hati
Hati atau hepar merupakan organ terbesar dan merupakan organ paling
serbaguna yang ada dalam tubuh manusia. Sebagian besar massanya terletak pada
daerah sebelah kanan hipokondriak dan epigastrik, tetapi juga meluas pada daerah
sebelah kiri hipokondriak dan umbilikus. Hati memiliki berat rata-rata 1,5 kg.
Organ yang besar dan berwarna kemerahan ini memiliki kemampuan dalam
memetabolisme zat asing dan mensintesis berbagai substansi dalam tubuh
(Martini, 2004).
Hati menerima hampir 25% curah jantung, sekitar 1500 ml darah per
menit melalui dua sumber yaitu aliran vena dari vena porta, yang sangat penting
bagi kinerja fungsi hati dalam tubuh, dan darah arteri dari arteri hepatika yang
penting untuk oksigenasi hati dan mensuplai darah pada sistem empedu.
Pembuluh-pembuluh ini menyatu dalam hati dan aliran darah gabungan keluar
melalui vena-vena sentral (vena terminal) yang bermuara ke dalam vena hepatika
dan akhirknya ke vena kava inferior. Vena porta kemudian membawa darah vena
dari usus halus yang kaya nutrien, serta obat dan racun langsung ke hati. Vena
porta membentuk jalinan kapiler khusus yang memungkinkan setiap hepatosit (sel
Gambar 3. Pembagian Zona Lobulus Hati (McPhee, 2010)
Hati terdiri dari empat lobus dan setiap lobus terdiri dari 100.000 lobulus,
yang merupakan dasar unit fungsional dari hati. Setiap lobulus memiliki diameter
kurang lebih 1 mm. Setiap lobulus dipisahkan oleh septum interlobuler. Setiap
lobulus tersusun atas hepatosit. Hepatosit tersusun seperti jari-jari pada roda
(Martini, 2004).
Secara fisiologis, lobulus hati terbagi menjadi tiga zona (gambar 3), yaitu
zona 1, zona 2 , dan zona 3. Pembagian zona ini berdasarkan dari urutan aliran
darah yang memasuki hepatosit pada zona tersebut. Darah yang memasuki
sinusoid dari venula porta, mula-mula melalui hepatosit yang terdekat dari
pembuluh tersebut (hepatosit zona 1) dan kemudian mengalir melalui hepatosit
zona 2. Pada zona 3, merupakan daerah dimana hepatosit tersebut mengalami
merupakan hepatosit dengan paparan oksigen terbanyak dari arteri porta sehingga
heptosit tersebut merupakan tempat dalam proses glukoneogenesis dan
metabolisme oksidatif yang lain. Sedangkan pada zona 3, hepatosit akan terpapar
sedikit oksigen sehingga mengalai perubahan fungsional dan efektif untuk proses
metabolisme seperti glikolisis dan lipogensis. Hepatosit pada zona 2 merupakan
zona peralihan dengan fungsi yang berada di antara zona 1 dan 3 (McPhee, 2010).
Gambar 4. Penampang Sel Penyusun Lobulus Hati (McPhee, 2010)
Substansi parenkim hati (gambar 4) tersusun membentuk
lempeng-lempeng hepatosit yang terletak dalam suatu kerangka sel penunjang yang
dinamai sel retikuloendotelial. Lempeng hepatosit tadi umumnya hanya memiliki
ketebalan satu sel, dan setiap sel dipisahkan satu sama lain oleh ruang vaskular
yang dinamai sinusoid. Daerah sinusioid ini merupakan daerah dimana darah dari
vena hepatika bercampur dengan darah dari vena-vena sentral. Pada jaringan sel
retikuloendotelial tempat hepatosit berada, terdapat berbagai macam sel dan yang
terpenting adalah sel endotel yang membentuk dinding sinusoid, sel kupfer yang
stelata atau liposit yag berberan dalam penyimpanan lemak, metabolisme vitamin
A, terletak antara hepatosit dan sel endotel. Semua permukaan hepatosit tidaklah
sama. Salah satu sisi, permukaan apikal, membentuk dinding kanalikulis biliaris
sementra permukaan baslolateral berkontak dengan aliran darah melalui sinusoid.
Daerah antar hepatosit dipisahkan oleh tight junction yang berfungsi
mempertahankan pemisahan domain membran plasma apikal dan basolateral.
Proses-proses yang berkaitan dengan transpor dan ekskresi empedu bekerja di
membran plasma apikal. Penyerapan dan sekresi ke dalam aliran darah adalah
aktivitas yang berlangsung di membran basolateral (McPhee, 2010).
Hati memiliki kemampuan dalam mengembalikan keutuhan organya
setelah kehilangan jaringan hati yang bermakna akibat terjadi kerusakan hati.
Proses regenerasi hati akibat hepatektomi parsial memakan waktu kurang lebih 5
sampai 7 hari pada tikus. Selama regenerasi ini, hepatosit mengalami pembelahan
sebanyak satu atau dua kali, dan setelah tercapai ukuran dan volume hati
sebelumnya, hepatosit kembali kepada keadaan semula. Pembelahan sel hati ini
belum diketahui mekanismenya secara jelas. Beberapa faktor yang mempengaruhi
pembelahan sel hati antara lain hepatocyte growth factor, epidermal growth
factor, dan beberapa sitokin seperti tumor necrosis factor dan interleukin-6
(Guyton, 2008).
Hati memiliki beberapa fungsi penting dalam tubuh, antara lain :
a. Metabolisme karbohidrat
Hati akan menstabilkan kadar gula darah berkisar 90 mg/dl. Apabila terjadi
aliran darah. Hati juga mensintesis glukosa dari karbohidrat dan asam amino
(glukoneogensis). Apabila gula darah berlebih, hati akan mengubah gula tersebut
menjadi glikogen maupun lipid yang kemudian disimpan dalam sel (Martini,
2004).
b. Metabolisme lipid
Beberapa lipid yang dimetabolisme oleh hati adalah trigliserida, asam lemak, dan
kolesterol. Ketika kadar lipid dalam darah menurun, hati akan memecah lipid dari
tempat penyimpananya dan melepaskan produk pecahan lipid ke aliran darah.
Sedangkan ketika lipid dalam darah berlebih, lipid akan dibuang dari tempat
penyimpanan (Martini, 2004). Pada proses pengaturan kadar kolesterol dan
trigliserida pada tubuh, hati menyusun, mensekresikan, dan menyerap berbagai
partikel lipoprotein. Partikel VLDL (Very Low Density Lipoprotein) akan
mendistribusikan lipid ke jaringan adiposa untuk disimpan sebagai lemak atau ke
jaringan lain untuk langsung digunakan. Modifikasi terjadi pada VLDL melalui
pengurangan komponen lipid dan protein. Partikel low-density lipoproteins (LDL)
yang terbentuk kemudian dikembalikan ke sel hati akibat adanya afinitas dari
reseptor LDL. Partikel lipoprotein yang lain yaitu high-density lipoprotein (HDL)
dibentuk dan disekresikan dari hati. Partikel ini dapat membersihkan kelebihan
kolesterol dan trigliserida dari jaringan (McPhee, 2010).
c. Metabolisme asam amino
Hati dapat membuang kelebihan asam amino dari pembuluh darah. Asam amino
dapat diubah oleh hati menjadi glukosa, lipid, maupun protein (Martini, 2004).
globulin, dibentuk oleh sel hati. Hati dapat membentuk protein plasma dengan
kecepatan 15-50 gram/hari. Kehilangan banyak protein plasma dapat digantikan
dalam waktu 1 atau 2 minggu. Selain itu, hati dapat membentuk berbagai asam
amino tertentu yang secara umum disebut sebagai asam amino nonesensial.
Pemecahan protein menjadi asama amino juga dapat dilakukan oleh hati untuk
memenuhi kebutuhan energi. Proses pemecahan protein akan melewati
mekanisme deaminasi dimana terbentuk senyawa racun yaitu amonia. Hati
memiliki kemampuan mengubah amonia menjadi ureum yang kemudia
disekresikan lewat urin (Guyton, 2008).
d. Penyimpanan vitamin
Vitamin larut lemak seperti A, D, E, K, dan vitamin B12 yang diabsorbsi oleh
darah disimpan oleh hati. Ketika terjadi kekurangan vitamin-vitamin tersebut,
dilakukan pembongkaran tempat penyimpanan untuk memenuhi kebutuhan
vitamin tersebut (Martini, 2004).
e. Penyimpanan mineral
Hati mengubah besi menjadi feritin kecuali besi dalam hemoglobin. Dalam organ
hati, terdapat protein yang disebut apoferitin yang dapat bergabung dengan besi
baik pada konsentrasi tinggi maupun rendah. Kompleks besi dengan apoferitin
inilah yang disebut dengan feritin. Apoferitin dapat menyangga jumlah besi dalam
darah dengan melakukan proses pemecahan maupun pembentukan kembali
f. Inaktivasi obat
Hati dapat membuang dan memecah molekul obat yang berada dalam sirkulasi
darah. Hal ini akan mengakibatkan perubahan efek dan durasi pada obat tersebut.
Hal ini menjadi pertimbangan penting dalam pemberian obat kepada pasien
(Martini, 2004). Dalam memetabolisme obat, hati akan memebentuk senyawa
lipofilik dari obat menjadi senyawa yang lebih hidrofilik agar mudah
diekskresikan. Metabolisme obat atau disebut biotransformasi ini umumnya terdiri
dari dua fase, yaitu reaksi fase I dan reaksi fase II. Reaksi fase I melibatkan
oksidasi-reduksi dengan penambahan gugus-gugus fungsional yang mengandung
oksigen pada substrat yang akan diekskresikan. Reaksi fase II biasanya berupa
konjugasi secara kovalen obat pada suatu molekul pembawa larut air seperti asam
glukouronat atau glutation (McPhee, 2010).
g. Membentuk faktor koagulasi
Proses pembekuan darah bergantung pada faktor-faktor koagulasi. Sebagian besar
dari faktor koagulasi tersebut disintesis oleh hati, antara lain : fibrinogen,
protrombin, globulin akselerator, faktor VII, dan beberapa faktor yang lain
(Guyton, 2008).
2. Kerusakan hati
Hati rentan terhdap berbagai gangguan metabolik, toksik, mikroba,
sirkulatorik, dan neoplastik. Penyakit primer utama pada hati adalah hepatitis
virus, penyakit hati alkoholik, dan karsinoma hepatoselular. Umumnya kerusakan
Namun besarnya cadangan hati dapat menutupi dampak klinis dari kerusakan hati
dini (Kumar, 2009).
Akibat yang ditimbulkan dari kerusakan hati dapat bersifat reversibel
maupun ireversibel. Penyebab yang berasal langsung dari kerusakan akut sel
fungsional hati, terutama hepatosit, tanpa gangguan kemampuan hati untuk
melakukan regenerasi umumnya reversibel. Hati memiliki kapasitas cadangan
untuk berbagai reaksi kimia yang terjadi di dalamnya serta memiliki kemampuan
dalam melakukan regenerasi dan deferensiasi sel. Sedangkan sirosis merupakan
kerusakan hati yang irreversibel (McPhee, 2010).
Terdapat lima respon umum yang terjadi pada cedera hati. Respon umum
tersebut antara lain :
a. Degenerasi dan Akumulasi Intraseluler
Kerusakan hati akibat suatu toksin maupun peristiwa imunologis dapat
menyebabkan terjadinya pembengkakan sel-sel hati. Pembengkakan pada derajad
sedang masih bersifat reversibel. Untuk kerusakan yang lebih parah atau disebut
degenerasi balon, sel-sel hati mulai membesar dan membentuk ruang-ruang jernih
disertai menggumpalnya sitoplasma. Berbagai macam hal yang menyebabkan
inflamasi hepatosit adalah penimunan besi dan tembaga pada sel hati, perlemakan
hati, dan hepatitis C.
b. Nekrosis dan Apoptosis
Nekrosis merupakan kerusakan sel hati yang lebih parah. Pada peristiwa nekrosis,
terlihat inti sel yang lisis. Berbeda halnya dengan apoptosis, peristiwa ini
inti sel yang terfragmentasi. Nekrosis litik yang merupakan akhir dari degenerasi
balon memiliki ciri khas dimana terdapat debris sel pada daerah sekitar sel yang
rusak. Nekrosis sering terdistribusi pada daerah parenkim hati, yang mencolok
pada daerah sekitar vena hepatika terminal disebut nekrosis sentrilobulus.
Berdasarkan penyebarannya, nekrosis dibedakan menjadi dua yaitu nekrosis
submasif bila hanya terdapat seluruh sel pada lobulus hati yang mengalami
nekrosis dan nekrosis masif bila sebagian besar hati mengalami peristiwa
nekrosis.
c. Inflamasi
Kerusakan sel-sel hati dapat memicu peradangan dikarenakan adanya influks dari
sel-sel radang akut maupun kronis pada daerah tersebut hepatosit yang telah mati
tidak memicu peradangan, akan tetapi adanya sel kupfer yang menelan sel-sel
tersebut akan membentuk gumpalan sel radang.
d. Regenerasi
Hepatosit memiliki rentang usia yang panjang dan dapat berproliferasi sebagai
respon terhadapt reaksi jaringan atau kematian sel. Proliferasi sel hati ditandai
dengan menebalnya kordahepatosit dan juga disorganisasi struktur parenkim. Unit
kanalis Hering-duktulus empedu merupakan suatu kompartemen cadangan
pengganti pada cedera parenkim yang parah.
e. Fibrosis
Fibrosis merupakan peristiwa terbentuknya jaringan fibrosa akibat kerusakan
terbalikan. Dengan terbentuknya fibrosis hati akan terbagi-bagi menjadi
nodul-nodul hepatosit yang dikelilingi oleh jaringan parut.
(Kumar, 2009).
3. Perlemakan hati
Perlemakan hati menggambarkan ketidaknormalan penumpukan lipid
pada sel-sel hati, biasanya berupa trigliserida. Hal ini dikarenakan adanya
kelebihan senyawa tersebut dari asupan makanan sehingga terjadinya
ketidakseimbangan dalam proses katabolisme senyawa trigliserida. Beberapa
toksin juga dapat menyebabkan perlemakan hati dengan berbagai mekanise baik
ketika perombakanya maupun ketika terjadi sintesis lipid. Perlemakan hati
ditandai dengan meningkatnya enzim-enzim biokimia dalam darah seperti AST
(Aspartate Transaminase)dan ALT (Alanine Transaminase) (Hodgson, 2010).
Perlemakan hati dapat disebabkan oleh alkohol maupun bukan oleh
alkohol (Non-Alchoholic Fatty Liver Disease). Perlemakan hati tidak bergantung
alkohol (NAFLD) dapat disebabkan oleh berbagai macam hal salah satunya stres
oksidatif akibat radikal bebas. Radikal bebas dapat membentuk senyawa oksigen
reaktif yang dapat merusak sel-sel hati. Senyawa oksigen reaktif (ROS) dapat
meningkatkan permeabilitas membran mitokondria sehingga terjadi kebocoran
dari organela tersebut. Selain itu, ROS dapat menyebabkan kerusakan DNA pada
sel hati. Pada kasus perlemakan hati, ROS maupun senyawa radikal bebas lain
dapat memicu peroksidasi asam lemak tak jenuh menghasilkan malonilaldehid
itu, senyawa tersebut dapat berperan sebagai chemoatractan sel-sel imun sehingga
memicu terjadinya inflamasi bahkan apoptosis (Chalrton, 2004).
Perlemakan hati dapat pula dikatakan sebagai penumpukan
vesikel-vesikel lemak pada sel-sel hati. Berdasarkan ukuran vesikel-vesikelnya, perlemakan hati
dibedakan menjadi mikrovesikel dan makrovesikel (Kumar, 2009).
C. Hepatotoksin
Hepatotoksin dibedakan menjadi dua jenis, yaitu hepatotoksin
teramalkan (intrinsik) dan tak teramalkan (idiosinkratik). Hepatotoksin teramalkan
merupakan senyawa toksik pada hati yang sudah jelas akan menyebabkan
kerusakan bila ada kondisi tertentu dalam penggunaanya. Kerusakan hati akibat
hepatotoksin teramalkan terjadi pada seluruh individu yang terpapar dan memiliki
hubungan dengan dosis pemberian. Pada setiap kasus keracunan senyawa
tersebut, pola yang ditemukan hampir sama pada tiap-tiap individu seperti pada
keracunan parasetamol (Hodgson, 2011).
Hepatotoksin tak teramalkan merupakan senyawa toksik pada hati yang
berdampak bagi sebagian kecil individu. Kejadian toksisitasnya tidak sama pada
tiap-tiap individu, selain itu tidak seperti hepatotoksin teramalkan, jenis ini tidak
dipengaruhi oleh dosis. Beberapa contoh senyawa hepatotoksin tak teramalkan
D. Karbon Tetraklorida
Karbon tetraklorida merupakan senyawa yang cukup sering digunakan
sebagai senyawa model untuk melakukan perusakan pada organ hati. Karbon
tetraklorida (CCl4) akan dimetabolisme oleh sitokrom P450 menjadi senyawa
toksik pada hati yaitu radikal bebas triklorometil (∙CCl3). Radikal bebas ini akan
bereaksi dengan gugus sulfohidril seperti glutation dan gugus tiol pada protein
yang kemudian akan mengawali peroksidasi lemak tak jenuh pada membran dan
mengasilkan Reactive Oxygen .pecies (ROS) yang akan menyebabkan nekrosis
sel. Senyawa radikal bebas ini akan menyebabkan stres oksidatif yang akan
menurunkan jumlah enzim glutation S transferase (GST) dan enzim antioksidan
lainya. Hasil dari reaksi radikal bebas ini adalah penumpukan senyawa peroksida
lipid seperti hidroperoksida (LOOH) dan malonilaldehid. Senyawa intermediate
reaktif yang terbentuk selama proses metabolisme juga dapat berikatan secara
kovalen pada makromolekul jaringan sehingga menyebabkan kerusakan jaringan
tersebut (Bashandy dan AlWasel, 2011).
Karbon tetraklorida akan dimetabolisme menjadi senyawa radikal oleh
beberapa enzim sitokrom seperti CYP2E1, CYP2B1, atau CYP2B2 dan
kemungkinan CYP3A menjadi radikal triklorometil. Radikal ini dapat mengikat
molekul seluler seperti asam nukleat, protein, dan lipid. Pengikatan radikal
triklorometil dengan DNA akan mengawali terjadinya kanker hati. Radikal ini
dapat berekasi dengan oksigen membentuk radikal triklorometilperoksi (∙OOCCl3)
yang sangat reaktif. Radikal ini dapat mengawali reaksi peroksidasi lipid berantai,
lipid (LO∙) yang akhirnya akan menyebabkan kerusakan pada sel-sel hati. (Boll,
Karbon tetra klorida Cl Triklorometil radikal Triklorometil peroksi radikal
-Gambar 5. Proses Metabolisme Karbon Tetraklorida (Timbrell, 2008)
Segera setelah terpapar oleh tubuh, CCl4 akan termetabolisme (gambar 5)
dan metabolit radikalnya akan segera berikatan secara kovalen dengan jaringan
sekitar seperti pada jaringan lemak sampai pada protein subseluler. Ikatan yang
sering terjadi adalah dengan triasilgliserol dan fosfolipid khususnya dengan
bagian kepala berjenis kolin. Senyawa radikal ini kemudian dapat melakukan
peroksidasi pada lipid sehingga mengawali terjadinya steatosis. Beberapa
dengan ikatan kovalen yang terjadi. Beberapa radical scavenger dapat
menginhibisi kedua mekanisme tersebut (Weber, Boll, Stampfl, 2003).
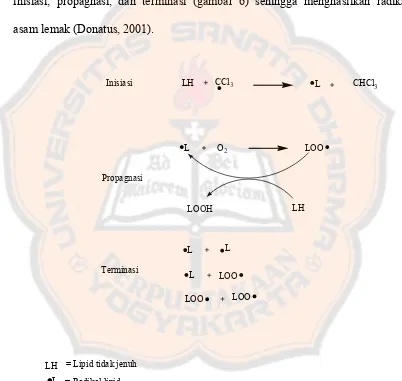
Karbon tetraklorida akan menyebabkan efek toksik dengan mekanisme
luka ekstraseluler. Pembentukan peroksida lipid terjadi dengan mekanisme
inisiasi, propagnasi, dan terminasi (gambar 6) sehingga menghasilkan radikal
asam lemak (Donatus, 2001).
Gambar 6. Mekanisme Pembentukan Radikal Lipid oleh Radikal CCl3 (Donatus, 2001)
Kerusakan hati dimulai antara enam jam setelah pemaparan CCl4 pada
dosis kecil. Nekrosis hati dengan sel-sel yang membengkak mulai terlihat. Pada
mulai terjadi perlemakan hati (steatosis) dikarenakan pada jam ke-6 ini terjadi
penumpukan CCl4 pada lemak dengan konsentrasi paling tinggi. Kerusakan terus
berlanjut hingga jam ke-12, dan setelahnya, terjadi perbaikan sel-sel hati secara
progresif dikarenakan sudah adanya regenrasi sel-sel hati yang baru (Mumtaz,
2010).
Karbon tetraklorida dapat meningkatkan kerusakan hati dengan jenis
perlemakan hati. Kerusakan hati yang dikarenakan karbon tetraklorida dapat
dilihat dari kenaikan aktivitas serum ALT dan AST yang terukur. Karbon
tetraklorida dapat meningkatkan aktivitas serum ALT sebesar 3 kali normal dan
aktivitas serum AST sebesar 4 kali normal (Zimmerman, 1999).
E. Infusa
Infusa adalah sediaan cair yang dibuat dengan mengekstraksi simplisia
nabati dengan air pada suhu 90oC selama 15 menit. Pembuatan infusa dilakukan
dengan mencampur simplisia dengan derajat halus yang sesuai dalam panci
dengan air secukupnya, kemudian dipanaskan di atas tangas air selama 15 menit
terhitung mulai suhu 90oC sambil sekali-sekali diaduk. Serkai selagi panas
melalui kain flanel, tambahkan air panas secukupnya melalui ampas hingga
volume infus yang dikehendaki (Departemen Kesehatan RI, 1995).
Secara umum, metode infundasi menggunakan air panas sebagai media
pengekstrak metabolit sekunder pada tanaman. Beberapa senyawa antioksidan
terutama senyawa polifenol dapat terekstrak menggunakan air panas. Kemampuan
hampir sama dengan kemampuan metanol. Selain antioksidan fenolik, beberapa
mineral juga dapat terekstrak dengan menggunakan air panas (Xu, et al., 2008).
F. Pengukuran Alanin Transaminass dan Aspartats Transaminass
Hati merupakan organ yang berperan dalam sintesis biokimia dan
ekskresi beberapa senyawa asing yang masuk dalam tubuh. Banyak
senyawa-senyawa kimia baik berupa enzim, protein, maupun pigmen disintesis oleh organ
ini. Senyawa-senyawa inilah yang kemudian banyak digunakan sebagai indikator
kondisi organ hati. Beberapa senyawa yang biasa digunakan adalah bilirubin,
SGOT (.erum Glutamate Oksaloacetate Transmaminase), SGPT (.erum
Glutamate Piruvate Transaminase), ALP (Alkaline Phosphatase), GGT (Gama
-Glutamil Transamidase), dan albumin (Thapa, 2007).
Kondisi stres oksidatif akibat radikal bebas akan meningkatkan
permeabilitas membran dan nekrosis sel hati (Pujar, Kashinakunti, Kalaganad,
Dambala, Doddamani, 2010). Keadaan ini akan menyebabkan enzim-enzim
intraseluler seperti SGOT dan SGPT dapat menembus membran plasma menuju
pembuluh darah dan masuk ke aliran darah. Hal ini akan menyebabkan kenaikan
jumlah enzim tersebut di dalam aliran darah sehingga dapat menandakan adanya
kerusakan pada sel-sel hati (Amacher, 1997).
Aminotransferase merupakan enzim yang paling sering digunakan
sebagai indikator spesifik kerusakan hati. Enzim ini terdiri dari dua jenis yaitu
.erum Glutamate Pyruvate Transaminase (SGPT / ALT) dan .erum Glutamate
mengkatalisis pemindahan alanin dan aspartat menjadi bagian dari gugus keton
pada asam ketoglutarat kemudian membentuk piruvat dan oksaloasetat (Thapa
dan Walia, 2007).
Enzim ALT terdapat pada sitosol dan mitokondria dalam sel hati, ginjal,
otot rangka, dan otot jantung. Jumlah ALT pada mitokondria hanya memegang
peranan kecil dalam otot dan tidak muncul pada serum darah dalam keadaan
normal. Enzim ini terutama terletak dalam sitosol sel parekim hati. Dalam
laboratorium klinis, adanya ALT dalam serum menjadi penanda yang spesifik
adanya kerusakan pada sel hati. Enzim AST juga terdapat dalam sitosol dan
mitokondiria dari sel hati, akan tetapi jumlahnya juga tinggi pada sel-sel organ
lain seperti jantung, otot, ginjal, otak, dan pankreas (Amacher, 1997).
Pada kondisi normal, jumlah baik SGOT maupun SGPT dalam darah
kurang dari 30 U/L (tergantung jenis kelamin, usia, dan ras) (Fancher, 2007).
Kenaikan 1-3 kali batas normal terjadi akibat beberapa kondisi seperti sepsis
neonatal hepatitis, artesia ekstrahepatik bilier, perlemakan hati, sirosis, NASH,
keracunan obat, adanya gangguan pada otot. Kenaikan 3-20 kali batas normal
biasanya dikarenakan hepatitis akut, hepatitis kronik, hepatitis autoimun,
obstruksi empedu akut, dan penggunaan alkohol yang berlebihan. Sedangkan
kenaikan lebih dari 20 kali batas normal (1000 U/L) dapat dikarenakan oleh
kebanyakan hepatitis kronis, dan nekrosis hati kronis yang sudah menyebar
G. Silimarin
.ilybum marianum L. merupakan tanaman keluarga Asteraceae yang
sudah dikenal lama memiliki kemampuan untuk mengatasi berbagai kelainan hati
dan empedu seperti sirosis, hepatitis, jaundice, serta beberapa hepatotoksin.
Silimarin merupakan komponen aktif yang merupakan ekstrak terstandar terdiri
dari 70-80% silimarin flavonolignan (silybum A dan B, isosilibin A dan B,
silidianin, dan silichristin) serta flavonoid (taxifolin dan quercetin), dan 20-30%
sisanya adalah fraksi yang belum diketahui (Javed, Kohli, Ali, 2011).
Silimarin merupakan campuran dari 4 flavonolignan yaitu silibin,
isosilibin, silidianin, dan silichristin (gambar 7) dengan rumus empiris C23H22O10.
Struktur silimarin memiliki kemiripan dengan hormon steroid yang memiliki
kemampuan dalam memfasilitasi sintesis protein. Silimarin tersusun dari 60-70%
silibin, 20% silichristin, 10% silidianin, dan 5% isosilibin. Silimarin juga
mengandung silipide yang merupakan silibin terkonjugasi pospatidilkolin yang
diyakini meningkatkan ketersediaan hayati dari silibin (Pradhan, Girish, 2006).
Silimarin memiliki aktifitas biologi dan farmakologi sebagai antioksidan,
regenerasi sel, dan antikanker. Silimarin juga memiliki aktifitas antidiabetik,
kardioprotektif, antiinflamasi, antifibrotik, hipolipidemia, neutropik,
neuroprotektif, dan imunomodulator. Dosis silimarin pada penggunaan orang
dewasa adalah 240 – 800 mg/hari dengan 3 dosis terbagi (Javed, et al., 2011).
H. Landasan Teori
Hati merupakan salah satu organ terpenting dalam tubuh manusia. Hati
memiliki peran metabolisme dan netralisasi racun dalam tubuh. Akan tetapi hati
rentan terhadap berbagai gangguan metabolik, toksik, mikroba, sirkulatorik, dan
neoplastik (Kumar, 2009). Kerusakan yang biasa muncul ketika ada gangguan
pada hati adalah nekrosis sel-sel hati. Nekrosis ini menyebabkan permeabilitas
dinding sel menjadi berubah dan menyebabkan kebocoran enzim-enzim
transaminase menuju aliran darah (Amacher, 1997).
Infusa herba Mimosa pigra L. memiliki potensi hepatoprotektif pada
tikus putih terinduksi parasetamol (Apriyanto, dkk., 2000). Berdasarkan penelitian
tersebut, akan dilakukan penelitian hepatokuratif dengan model antihepatotoksik
dari infusa herba Mimosa pigra L. dengan senyawa model karbon tetraklorida.
Digunakan infusa karena metode infundasi mendekati metode yang sering
digunakan oleh masyarakat yaitu perebusan, selain itu senyawa fenolik yang
diduga sebagai senyawa antioksidan dalam herba Mimosa pigra L. juga dapat
Karbon tetraklorida merupakan senyawa yang cukup sering digunakan
sebagai senyawa model untuk melakukan perusakan pada organ hati. Karbon
tetraklorida (CCl4) akan dimetabolisme oleh sitokrom p450 menjadi senyawa
toksik pada hati yaitu radikal bebas triklorometil (∙CCl3). Senyawa radikal ini
kemudian dapat mengalami reaksi lebih lanjut dengan lipid pada hati
menyebabkan terbentuknya radikal lipid seperti malonilaldehid dan
hidroperoksida yang menumpuk pada sel hati dan menyebabkan kerusakan sel
tersebut (Bashandy, et als, 2011).
Pengobatan perlemakan hati akibat radikal bebas dapat dilakukan
menggunakan antioksidan. Ekstrak metanol daun Mimosa pigra L. memiliki
potensi sebagai antioksidan secara in vitro (Lee, 2008). Ekstrak metanol daun
Mimosa pigra L. juga memiliki aktivitas antihipertensi pulmonar, serta
mengandung berbagai macam flavonoid seperti quercetin dan myricitrin sebagai
senyawa antioksidan dan triptophan sebagai agen proliferasi sel (Rakotomalala,
et al., 2013).
Efek antihepatotoksik adalah efek dari suatu senyawa dalam
menyembuhkan dan mencegah kerusakan lebih lanjut dari organ hati yang sudah
terpapar senyawa radikal bebas dalam jangka waktu tertentu.
I. Hipotesis
Infusa herba Mimosa pigra L. memiliki potensi antihepatotoksik pada
30
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian mengenai efek antihepatotoksik infusa herba Mimosa pigra L.
terhadap tikus putih jantan galur Wistar merupakan jenis penelitian eksperimental
murni dengan diberikan pelakuan terhadap sejumlah variabel penelitian.
Rancangan penelitian ini termasuk rancangan acak lengkap dengan menggunakan
pola searah.
B. Variabel Penelitian dan Definisi Operasional
Variabel-variabel yang digunakan pada percobaan ini ialah:
1. Variabel penelitian
a. Variabel utama.
1) Variabel bebas
Variasi dosis infusa herba Mimosa pigra. L.
2) Variabel tergantung
Efek antihepatotoksik infusa herba Mimosa pigra L. terhadap tikus putih
jantan galur Wistar yang terinduksi karbon tetraklorida dengan tolok ukur
kuantitatif berdasarkan peningkatan aktivitas serum ALT dan AST (U/l)
b. Variabel pengacau.
1) Variabel pengacau terkendali
Kondisi hewan uji yaitu tikus putih galur Wistar, jenis kelamin jantan, berat
badan 120-200 gram, dan usia 2-3 bulan. Pemberian infusa herba Mimosa
pigra L.dilakukan secara per oral. Bahan herba Mimosa pigra L. didapat dari
tanah lapang sekitar Dusun Krodan, Yogyakarta.
2) Variabel pengacau tidak terkendali
Kondisi patologis dan fisiologis hewan uji, kondisi herba Mimosa pigra L.
yang digunakan.
2. Definisi operasional
a. Herba Mimosa pigra L.
Herba Mimosa pigra L. adalah bagian tumbuhan di atas tanah, tidak termasuk
batang utama dan merupakan percabangan muda berwarna hijau pada
tanaman yang masih terdapat daun, polong, dan (atau) bunga.
b. Infusa herba Mimosa pigra L.
Infusa herba Mimosa pigra L. adalah infusa yang diperoleh dengan
mengekstraksi herba segar Mimosa pigra L. seberat 11,34 gram yang direbus
dalam 50 ml aquadest selama 15 menit pada suhu 90oC.
c. Efek antihepatotoksik
Efek antihepatotoksik adalah efek Infusa Herba Mimosa pigra L pada dosis
tertentu (dosis I : 1,26 g/KgBB, dosis II : 1,89 g/KgBB, dan dosis III : 2,835
g/KgBB) dalam menyembuhkan kerusakan sel-sel hati pada jangka waktu 6
C. Bahan Penelitian 1. Bahan utama
a. Hewan uji
Hewan uji yang digunakan berupa tikus putih jantan galur Wistar, umur 2-3 bulan
dengan berat badan berkisar antara 120-200 gram yang diperoleh dari
Laboratorium Imono Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
b. Bahan uji
Bahan uji berupa infusa herba Mimosa pigra L. yang didapat di tanah lapang
sekitar Dusun Krodan, Yogyakarta yang diambil pada pagi hari sekitar pukul
07.00 WIB.
c. Silimarin (Naturex France, distributor PT Megasetia Agung Kimia) sebagai
kontrol positif
2. Bahan kimia
a. Aquades sebagai pelarut infusa diperoleh dari Laboratorium Farmakognosi
Fitokimia Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
b. Bahan hepatotoksin yang digunakan yaitu karbon tetraklorida (Merck),
berupa cairan, tidak berwarna, berbau khas yang diperoleh dari Laboratorium
Kimia Analisis Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
c. Bahan pelarut karbon tetraklorida dan kontrol negatif adalah minyak zaitun
(Filippo Berio) yang berupa cairan yang dibeli dari swalayan (Indogrosir, Jalan
d. CMC-Na sebagai pensuspensi silimarin, berupa serbuk berwarna putih yang
diperoleh dari laboratorium Farmakologi-Toksikologi Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
e. Blangko pengujian ALT dan AST menggunakan aqua bidestilata (PT.
Ikapharmindo Putramas, Jakarta) yang diperoleh dari Laboratorium Kimia
Analisis Instrumental Fakultas Farmasi Universitas Sanata Dharma..
f. Bahan untuk mengukur aktivitas serum ALT dan AST berupa reagen ALT
dan AST merk Dia.ys.
A. Serum ALT
Reagen serum yang digunakan adalah reagen serum ALT Dia.ys.
Komposisi dan konsentrasi dari reagen serum ALT adalah sebagai
berikut:
R1: TRIS pH 7,15 140 mmol/L L-Alanine 700 mmol/L
LDH (lactatedehydrogenase) 2300 U/L
R2: 2-Oxoglutarate 85 mmol/L
NADH 1 mmol/L Pyridoxal-5-phosphate
FS: Good’s buffer pH 9,6 100 mmol/L
Pyridoxal-5-phosphate 13 mmol/L
B. Serum AST
Reagen serum yang digunakan adalah reagen serum AST Dia.ys.
Komposisi dan konsentrasi dari reagen serum AST adalah sebagai
berikut:
R1: TRIS pH 7,65 110 mmol/L L-Aspartate 320 mmol/L
R2: 2-Oxoglutarate 65 mmol/L NADH 1mmol/L
Pyridoxal-5-phosphate
FS: Good’s buffer pH 9,6 100 mmol/L Pyridoxal-5-phosphate 13mmol/L
D. Alat Penelitian
Alat Infundasi yang digunakan adalah seperangkat alat gelas berupa
Beakker glass, gelas ukur, labu takar, pipet tetes, batang pengaduk (Pyrek Iwaki
Glass), panci, termometer, gelas stainless steeldan timbangan analitik. Sedangkan
alat untuk uji antihepatotoksik adalah seperangkat alat gelas (Pyrex), tabung
Eppendorf, timbangan elektrik, sentrifuge, vortex, spuit peroral dan syringe 5 cc (Terumo), pipa kapiler, dan vitalab mikro (Microlab 200, Merck).
E. Tata Cara Penelitian 1. Determinasi tanaman Mimosa pigra L.
Determinasi tanaman Mimosa pigra L. dilakukan dengan mencocokan
ciri-ciri tanaman Mimosa pigra L.dengan buku acuan (Backer, 1963).
2. Pengumpulan bahan
Bahan uji yang digunakan adalah herba Mimosa pigra L. yang masih
segar dengan batang berwarna hijau dan terdapat daun, bunga, serta polong.
3. Pembuatan infusa herba Mimosa pigra L.
Sebanyak 11,34 gram herba Mimosa pigra L dibasahi dengan 50 ml
aquades di dalam gelas stainless steel. Kemudian gelas direndam dalam aqudes
pada panci dan dipanaskan hingga suhu 90oC. Pemanasan dilakukan selama 15
rebusan disaring dengan kertas saring dan kemudian ditambahkan aquades panas
melalui ampas hingga 50 ml untuk mengganti pelarut yang hilang selama proses
infundasi.
4. Penetapan dosis infusa herba Mimosa pigra L.
Dasar penetapan peringkat dosis adalah bobot tertinggi tikus dan
pemberian cairan secara peroral separuh volume maksimum yaitu 2,5 ml.
Penetapan dosis tertinggi infusa herba Mimosa pigra L. adalah :
D x BB = C x V
D x BB tertinggi tikus ( KgBB) = C ekstrak (mg/ml) x 2,5 ml
D = (C ekstrak x 2,5 ml) / BB
Dosis yang didapat adalah dosis pemberian maksimum. Dua dosis
lainnya diperoleh dengan membagi 1,5 nilai dosis maksimum yang didapat
sebagai peringkat dosis II dan membagi 2,25 nilai dosis maksimum yang didapat
sebagai peringkat dosis I.
5. Pembuatan larutan karbon tetraklorida dalam minyak zaitun
Larutan karbon tetraklorida dalam minyak zaitun dibuat dengan cara
mengambil volume karbon tetraklorida secara seksama, kemudian dilarutkan
dengan minyak zaitun dengan perbandingan 1 : 1.
6. Pembuatan suspensi ekstrak silimarin
Sebanyak 100 mg ekstrak kering silimarin disuspensikan dalam 50 ml
CMC-Na 1%. Suspensi serbuk silimarin kemudian digojok hingga terdispersi
7. Uji pendahuluan
a. Penetapan dosis hepatotoksin karbon tetraklorida.
Pemilihan dosis karbon tetraklorida dilakukan untuk mengetahui dosis karbon
tetraklorida yang mampu menyebabkan kerusakan hati tikus dengan indikasi
peningkatan aktivitas serum ALT dan AST paling tinggi tetapi tidak menimbulkan
kematian. Dosis hepatotoksik yang digunakan dalam penelitian ini adalah 2,0
ml/kg BB karbon tetraklorida dalam minyak zaitun dengan perbandingan 1 : 1 dan
diberikan secara intraperitoneal (Murugesan, Sathiskumar, Jayabalan, Binupriya,
Swaminantan, dan Yun, 2009).
b. Penetapan waktu pencuplikan darah.
Aktivitas serum ALT dan AST tikus terinduksi karbon tetraklorida dosis 2,0
ml/KgBB secara intraperitoneal diukur pada jam ke-0, 24, 48, dan 72 setelah
pemejanan kemudian ditetapkan kenaikan paling tinggi dari kedua serum tersebut.
Waktu peningkatan serum ALT dan AST yang paling tinggi akan dijadikan
sebagai waktu pencuplikan darah untuk penelitian antihepatotoksik.
c. Penetapan waktu pemberian infusa herba Mimosa pigra L.
Pemberian infusa herba Mimosa pigra L. dilakukan 6 jam setelah pemejanan
karbon tetraklorida. Kerusakan sel-sel hati akan terjadi setelah 6 jam terpapar
karbon tetraklorida (Mumtaz, 2010). Pengukuran aktivitas ALT dan AST
dilakukan berdasarkan waktu hasil orientasi.
8. Pengelompokan dan perlakuan hewan uji
Hewan percobaan yang dibutuhkan sebanyak 35 ekor tikus putih jantan
merupakan kontrol negatif yaitu pemberian minyak zaitun secara intraperitoneal.
Kelompok II merupakan kontrol hepatotoksin karbon tetraklorida dengan dosis
2,0 ml/KgBB dalam minyak zaitun dengan perbandingan 1 : 1 secara
intraperitoneal. Kelompok III merupakan kontrol perlakuan yaitu pemberian
infusa herba Mimosa pigra L. dosis tertinggi 2,835 g/kg BB secara per oral.
Kelompok IV adalah kelompok kontrol positif, dimana pemberian karbon
tetraklorida dosis 2,0 ml/KgBB secara intraperitoneal diikuti dengan suspensi
ekstrak silimarin dengan dosis 25 mg/KgBB setelah 6 jam. Kelompok V
merupakan perlakuan dosis I dengan pemberian karbon tetraklorida pada dosis 2,0
ml/KgBB secara intraperitoneal dan diikuti dengan pemberian infusa dosis 1,26
g/KgBB setelah 6 jam. Kelompok VI merupakan perlakuan dosis II dengan
pemberian karbon tetraklorida secara intraperitoneal pada dosis 2,0 ml/KgBB dan
diikuti dengan pemberian infusa dosis 1,89 g/KgBB setelah 6 jam. Kelompok VII
merupakan perlakuan dosis III dengan pemberian karbon tetraklorida secara
intraperitoneal pada dosis 2,0 ml/KgBB dan diikuti dengan pemberian infusa
dosis 2,835 g/KgBB setelah 6 jam. Pada jam ke-24 setelah diberi karbon
tetraklorida semua kelompok diambil darahnya pada daerah vena orbitalis,
kemudian ditampung dalam tabung Eppendorf untuk penetapan aktivitas serum
ALT dan AST. Darah disentrifugasi selama 10 menit dengan kecepatan 5000 rpm
dan bagian supernatannya diambil.
9. Penetapan aktivitas ALT-AST serum
Alat yang digunakan untuk menganalisis aktivitas ALT dan AST serum