BAB II
TINJAUAN PUSTAKA 2.1. Kitosan
Kitosan merupakan polisakarida alami yang terdiri dari kopolimer glukosamin dan N – asetilglukosamin, dan dapat diperoleh dari deasetilasi kitin ( Khan et al, 2002 ). Kitin biopolimer alami terbesar ke dua yang dapat ditemukan di alam setelah selulosa. Kitin dapat diperoleh dari arthropoda, jamur, dan ragi (Fernandez-Kim., 2004), tetapi sumber komersial yang penting adalah eksoskleton dari kepiting (Kim & Park., 2001).
Kitin dapat diisolasi dari kulit udang yang mengandung protein (25% - 40%), kitin (15% - 20%), dan kalsium karbonat (45% - 50%) (Margahof, 2003).
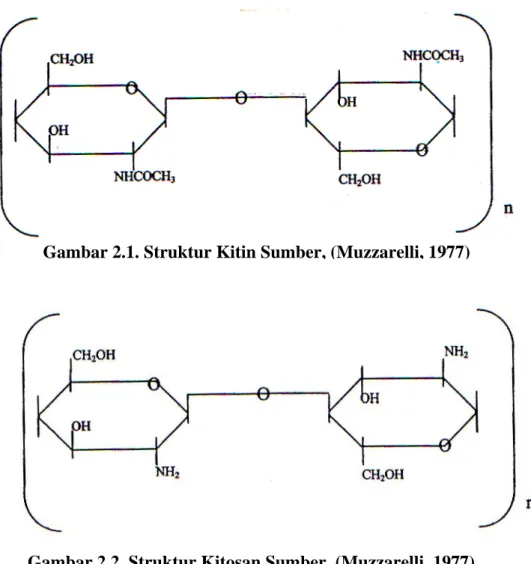
Struktur kitin sangat mirip dengan selulosa yaitu ikatan yang terjadi antara monomernya terangkai dengan ikatan glikosida pada posisi β-( 1 – 4 ).Perbedaannya dengan selulosa adalah gugus hidroksil yang terikat pada atom karbon yang kedua, pada kitin diganti oleh gugus asetamida ( NHCOCH3 ) sehingga kitin menjadi sebuah polimer berunit N – asetilglukosamin kitosan mempunyai rantai tidak linier dan mempunyai rumus umum ( C6H11NO4 ) n atau disebut sebagai ( 1 – 4 ) – amino – 2 – deoksi – β – D – glukosa ( Fernandez – Kim., 2004 )
Gambar 2.1. Struktur Kitin Sumber, (Muzzarelli, 1977)
Gambar 2.2. Struktur Kitosan Sumber, (Muzzarelli, 1977)
2.1.1 Nanopartikel
Dalam nano teknologi, suatu partikel digambarkan sebagai satu objek kecil yang bertindak secara unit keseluruhan dalam hal transfor dan sifat – sifatnya.
Dengan nano teknologi material dapat didesain sedemikian rupa dalam orde nano sehingga dapat diperoleh sifat dan material yang diinginkan tanpa melakukan pemborosan atom – atom yang tidak diperlukan.
Ruang lingkup nano teknologi meliputi usaha dan konsep untuk menghasilkan material berskala nano meter melalui eksplorasi dan rekayasa
karakteristik material serta mendesain ulang material ke dalam bentuk atau ukuran yang diinginkan.
Nanopartikel merupakan partikulat material dengan ukuran paling sedikit satu dimensi lebih kecil dari 100 nanometer. Satu nanometer adalah 10-9 m.
Sehingga nanopartikel mempunyai luas permukaan yang lebih besar terhadap perbandingan volume.Karakteristik nanopartikel umumnya dilakukan dengan teknik mikroskop elektron [TEM, SEM], mikroskop atomic [AFM], penghamburan cahaya dinamik [ DLS], x-ray mikroskop foto elektron [XPS], bubuk x-ray difraktometri [XRD], FT-IR, spektroskopi UV-Vis.(Anisa Muyusiwalla, 2003).
2.1.2 Kitosan nano partikel
Kitosan nano partikel adalah kitosan yang mana partikelnya berukuran 100- 400 nm. Sekarang ini banyak ahli menggunakan kitosan dengan nano teknologi, You Shan Szeto dan Zhigang Hu untuk menyiapkan kitosan nano partikel dimana kitosan dilarutkan dalam larutan asam lemah kemudian ditambahkan larutan yang bersifat basa seperti larutan amoniak, natrium hidroksida atau kalium hidroksida distirer dengan kecepatan 300 rpm sehingga diperoleh gel kitosan putih dan dibilas dengan aquadest sampai netral kemudian ditempatkan dalam ultrasonic batch untuk memecah partikel partikel gel kitosan menjadi lebih kecil. (Szeto, 2007).Sebagian ahli juga mencoba metode lain untuk menyiapkan kitosan nano partikel dengan menambahkan larutan tripolipospat ke dalam larutan kitosan sehingga diperoleh emulsi kitosan sambil distirer dengan
kecepatan 1200 rpm kemudian emulsi dibuat pH 3,5 dengan menambahkan asam asetat hasilnya akan berupa suspensi kitosan (Cheung, 2008 ).
2.1.3 Sifat – sifat dan Penggunaan Kitosan
Kitosan bersifat polielektrolit kation yang dapat mengikat logam berat, sehingga dapat berfungsi sebagai absorben terhadap logam berat dalam air limbah.
Prinsip dasar dalam mekanisme pengikatan antara kitosan dan logam berat yang terkandung dalam limbah cair adalah prinsip penukar ion. Gugus amina khususnya nitrogen dalam kitosan akan beraksi dan mengikat logam dari persenyawaan limbah cair. Kitosan yang tidak dapat larut dalam air akan menggumpalkan logam menjadi flok – flok yang akan bersatu dan dapat dipisahkan dari air limbah. Kitosan dapat bekerja sempurna jika dilarutkan dalam larutan asam ( Marganof., 2003 ; Widodo et al, 2005 ).
Kitosan juga bersifat hidrofilik, menahan air dalam strukturnya dan membentuk gel secara spontan. Pembentukan gel berlangsung pada harga pH asam dan sedikit asam, disebabkan sifat kationik kitosan. Viskositas juga meningkat dengan meningkatnya derajat deasetilasi. Gel kitosan terdegradasi secara berangsur – angsur, sebagaimana halnya kitosan melarut ( Muzzarelli et al, 1988 ).
Kitosan juga telah digunakan secara luas dalam bidang pengobatan, bioteknologi, menjadi bahan yang penting dalam aplikasi farmasi, karena mempunyai kemampuan biodegradasi dan biocompatibility dan rendah
toksisitasnya ( Berger et al, 2004 ). Kitosan juga memperlihatkan aktivitas biologi seperti hypocholesterolemic, antimikroba, anti jamur ( Rhoades & Roller., 2000 ).
Tabel 2.1. Pemanfaatan Kitosan pada Beberapa Industri
Industri Manfaat
Industri pengolahan Penyerap ion logam, koagulan, protein, asam amino, dan
Limbah bahan pencelup.
Industri makanan Pengawet, penstabil makanan, penstabil warna, bahan pengental, dan lain – lain.
Industri kesehatan Penyembuh luka dan tulang, pengontrol kolesterol
darah, kontak lensa, penghambat plat gigi, dan lain – lain . Industri pertanian Pupuk, pelindung biji dan lain – lain.
Kosmetik Pelembab ( moisturizer ), krem wajah, tangan dan badan, dan lain – lain.
Bioteknologi Dapat immobilisasi enzim, chromatography, penyembuh sel dan lain – lain.
__________________________________________________________________
Sumber : Fernandez-Kim., 2004
2.1.4 Derajat Deasetilasi
Derajat deasetilasi adalah persentasi gugus asetilasi yang berhasil dihilangkan selama proses deasetilasi kitin. Derajat deasetilasi berperan penting dalam proses penyerapan. Pertambahan nilai derajat deasetilasi menyebabkan bertambahnya jumlah gugus amina bebas ( Milot et al, 1998 ). Berat molekul kitosan dan derajat deasetilasi juga dapat mempengaruhi kelarutan kitosan dalam suasana asam dan membawa pengaruh pada proses penyerapan.
Beberapa publikasi menyatakan bahwa derajat deasetilasi akan dapat meningkatkan keupayaan dalam proses penyerap ion logam. Ini disebabkan
meningkatnya gugus amina bebas didalam praktiknya berat molekul dan derajat deasetilasi bertambah nilainya juga membawa pengaruh pada sifat fisik dan fisikokimia pada porositas, viskositas, dan titik leburnya ( Agusnar., 1990 ).
Perbedaan antara kitin dengan kitosan terdapat dalam derajat deasetilasinya. Kitosan mempunyai derajat deasetilasi 80 – 90 % akan tetapi kebanyakan publikasi menggunakan istilah kitosan apabila derajat deasetilasi lebih besar dari 70 %.
2.1.5 Interaksi Kitosan Dengan Ion Logam
Interaksi kitosan dengan ion logam terjadi karena proses pengkompleksan dimana pertukaran ion, penyerapan dan pengkhelatan terjadi selama proses berlangsung. Ketiga proses tersebut tergantung dari ion logam masing – masing.
Kitosan menunjukkan afinitas yang tinggi pada logam transisi golongan 3, begitu pula pada logam yang bukan golongan alkali dengan konsentrasi rendah.
( Muzzarelli., 1973, 1977 ).
Sifat penyerapan ion logam yang sangat baik oleh kitosan dengan selektif dan kapasitas penyerapan yang tinggi yang disebabkan tiga sifat yaitu :
1. Sifat hidrofilik kitosan dengan jumlah yang besar pada gugusan hidroksil.
2. Gugus amina primer dengan aktivitas yang tinggi.
3. Struktur rantai polimer kitosan yang fleksibel yang dapat membentuk konfigurasi untuk pengkompleksan kitosan dengan ion logam.
Menurut Mc Kay ( 1987 ), kitosan mempunyai kemampuan untuk mengikat logam dan membentuk kompleks logam - kitosan. Contoh mekanisme yang terjadi seperti dibawah ini.
2R-NH3 + Fe+² +2Cl¯ 2 ( RNH3 )FeCl2
( Amelia A., 1991 )
Kitosan mempunyai satu kumpulan amino linier bagi setiap unit glukosa.
Kumpulan amino ini mempunyai sepasang elektron yang dapat berkoordinat untuk membentuk ikatan – ikatan aktif dengan kation – kation logam. Unsur nitrogen pada setiap monomer kitosan dikatakan sebagai gugus yang aktif berkordinat dengan kation logam. ( Hutahahean., 2001 ).
2.2 Jenis – Jenis Daya Serap Kitosan 2.2.1 Adsorbsi
Molekul – molekul pada permukaan zat padat atau zat cair, mempunyai gaya tarik kearah dalam, karena tidak ada gaya – gaya lain yang mengimbanginya.
Adanya gaya – gaya ini menyebabkan zat padat dan zat cair, mempunyai gaya adsorbsi. ( Sukardjo., 1997 ). Apabila pada permukaan antara dua fasa yang bersih ( seperti antara gas – cairan dan cairan – cairan ) ditambahkan komponen ketiga, maka komponen ini akan sangat mempengaruhi sifat permukaan. Dimana komponen ketiga yang ditambahkan adalah molekul yang teradsorbsi pada permukaan. ( Bird, Tony., 1993 ).
Peristiwa penyerapan suatu zat pada permukaan zat lain semacam ini, disebut adsorbsi. Zat yang diserap disebut fase terserap sedang zat yang menyerap disebut adsorbsi.Kecuali zat padat, adsorben dapat juga berupa zat cair. Karena
itu,adsorsi dapat terjadi antara zat padat dan zat cair, zat padat dan gas, zat cair dan zat cair, atau gas dan zat cair.
Peristiwa adsorbsi ini disebabkan oleh gaya tarik molekul – molekul di permukaan adsorben. Adsorbsi berbeda dengan absorbsi, Karena pada absorbsi zat yang diserap masuk ke dalam adsorben, misalnya absorbsi air dengan sponge atau uap air oleh CaCl2 anhidrous. ( Sukardjo., 1990 )
Zat – zat teradsorbsi terikat dengan kuat dalam lapisan – lapisan yang biasanya tebalnya tak lebih dari satu atau dua molekul ( atau ion ). Banyaknya zat asing yang dapat diadsorbsi bergantung pada luasnya permukaan yang tersingkap.
Meskipun adsorbsi merupakan suatu gejala umum dari zat padat, adsorbsi ini teristimewa efisiensinya dengan materi koloid yang disebabkan oleh besarnya luas permukaan itu (Keenan., 1999).
Adsorbsi ada dua jenis yaitu adsorbsi fisika dan adsorbsi kimia. Pada adsorbsi fisika, adsorbsi disebabkan gaya van der Waals yang ada pada permukaan adsorben, panas adsorbsi fisika biasanya rendah ( ~ 10000 Kal/ Mol), lapisan yang terjadi pada permukaan adsorben biasanya lebih dari satu molekul dan kesetimbangan adsorbsi reversible dan cepat misalnya adsorbsi gas pada charcoal.
Pada adsorbsi kimia terjadi reaksi pada zat yang diserap dan adsorben.
Lapisan molekul pada permukaan adsorbennya satu lapis dan panas adsorbsinya tinggi (20000 – 100000 Kal/Mol) adsorbsi ini terjadi dengan pembentukan senyawa kimia hingga ikatannya lebih kuat misalnya adsorbsi CO pada W, O2
pada Ag, Au, Pt, dan C. (Sukardjo., 1990).
2.2.2 Koagulasi
Koagulasi adalah proses pengolahan air atau limbah cair dengan menstabilkan partikel – partikel koloid untuk memfasilitasi pertumbuhan partikel selama flokulasi, sedangkan flokulasi adalah proses pengolahan air dengan cara mengadakan kontak diantara partikel – partikel koloid yang telah mengalami destabilisasi sehingga ukuran partikel – partikelnya tumbuh menjadi partikel yang lebih besar ( Kiely, 1998 ). Koagulasi dan flokulasi diperlukan untuk menghilangkan material limbah berbentuk suspensi atau koloid. Koloid mempunyai ukuran partikel diameter sekitar 1 nm. Partikel – partikel ini tidak dapat mengendap dalam periode waktu yang wajar dan tidak dapat dihilangkan dengan proses perlakuan fisika biasa.
2.2.3 Flokulasi
Agar partikel – partikel koloid dapat menggumpal, gaya tolak menolak elektrostatis antara partikelnya harus dikurangi dan transportasi partikel harus menghasilkan kontak diantara partikel yang mengalami destabilisasi. Setelah partikel koloid mengalami destabilisasi maka partikel – partikel terbawa kedalam satu kotak antara satu dengan yang lainnya sehingga dapat mengalami penggumpalan dan membentuk partikel yang lebih besar yang disebut dengan flok.
Proses kontak ini disebut dengan flokulasi dan biasanya dilakukan dengan pengadukan lambat ( slow mix ) secara hati – hati. Flokulasi merupakan faktor paling penting yang mempengaruhi efisiensi penghilangan partikel. Tujuan flokulasi adalah untuk membawa partikel – partikel dalam kontak sehingga
mereka bertubrukan, tetap bersatu, dan tumbuh menjadi satu ukuran yang siap mengendap. Pengadukan yang cukup harus diberikan untuk membawa flok kedalam kotak. Terlalu banyak pengadukan dapat membubarkan flok sehingga ukurannya menjadi kecil dan terdispersi halus ( Davis dan Cornwell ). Dalam proses flokulasi, kecepatan penggumpalan dari agregat ditentukan oleh banyaknya tubrukan antar partikel yang terjadi serta efektifitas dari benturan yang terjadi.
2.3 Logam
Meningkatnya perkembangan sektor industri di Indonesia merupakan sarana untuk memperbaiki taraf hidup rakyat, tetapi dilain pihak muncul masalah pencemaran air akibat limbah cair industri yang dibuang ke dalam badan air.
Adanya pencemaran air dapat merusak kelestarian lingkungan, keseimbangan sumber daya alam dan berkembang biaknya bibit penyakit sehingga air tersebut tidak dapat dikonsumsi.
Pencemaran logam berat terhadap lingkungan merupakan suatu proses yang erat hubungannya dengan penggunaan logam berat tersebut oleh manusia.
Pada awalnya digunakannya logam sebagai alat, belum diketahui pengaruh pencemaran pada lingkungan. Proses oksidasi dari logam yang menyebabkan perkaratan sebetulnya merupakan tanda – tanda adanya pencemaran tersebut di atas.
Limbah cair dari berbagai industri seperti industri pupuk, pengecoran logam, pelapisan logam, pestisida, penyamakan kulit, industri cat, umumnya mengandung senyawa - senyawa logam. Disamping itu, limbah dari tempat pembuangan sampah dengan sistem penimbunan, aliran permukaan dari kawasan
pertanian ( pemakaian pupuk dan pestisida ) juga memberikan kontribusi terhadap pencemaran logam.
Beberapa metode dalam mengolah limbah cair yang mengandung cemaran logam adalah perlakuan dengan pengendapan, koagulasi atau flokulasi, filtrasi, proses membran, pertukaran ion, proses biologi dan reaksi – reaksi kimia. Dalam penerapannya setiap metode memiliki keunggulan dan keterbatasan masing – masing dari aspek teknis, ekonomis dan dampak ikutannya.
Logam dapat juga menyebabkan timbulnya suatu bahaya pada makhluk hidup.Hal ini terjadi jika sejumlah logam mencemari lingkungan.Logam – logam tersebut berbahaya jika ditemukan dalam konsentrasi tinggi dalam lingkungan (dalam air, tanah dan udara ) karena logam tersebut memiliki sifat yang merusak jaringan tubuh makhluk hidup. Pencemaran lingkungan oleh logam – logam berbahaya dapat terjadi jika orang atau pabrik yang menggunakan logam tersebut untuk proses produksinya tidak memperhatikan keselamatan lingkungan.
2.3.1 Limbah Cair Logam Besi ( Fe )
Besi atau ferrum (Fe) adalah metal berwarna putih keperakan, liat dan dapat dibentuk.Kandungan Fe di bumi sekitar 6,22 %, di tanah sekitar 0,5 – 4,3 % , di sungai sekitar 0,7 mg/L, di air tanah sekitar 0,1 – 10 mg/L, air laut sekitar 1 – 3 ppb, pada air minum tidak lebih dari 200 ppb. Pada air permukaan biasanya kandungan zat besi relatif rendah yakni ± 1 mg/L, sedangkan konsentrasi besi pada air tanah 0,01 mg/L – 25 mg/L. Di alam biasanya banyak terdapat didalam bijih besi hematite, magnetite, dan sebagainya, sedangkan didalam air umumnya
dalam bentuk terlarut sebagai senyawa garam ferri ( Fe+³ ) atau garam ferro ( Fe²+ ); tersuspensi sebagai butir koloidal ( diameter < 1 mm ) atau lebih besar seperti Fe(OH)3 ;dan tergabung dengan zat organik atau zat padat yang anorganik ( seperti tanah liat dan partikel halus terdispersi ). ( Eaton et,al, 2005 ).
Besi berperan dalam aktivitas beberapa enzim seperti sitokrom dan flavo protein apabila tubuh tidak mampu mengekskresikan besi (Fe) akan menjadi akumulasi besi ( Fe ) karenanya kulit menjadi hitam. ( Juli Soemirat., 1996 )
Sekalipun Fe diperlukan oleh tubuh, tetapi dalam dosis besar dapat merusak dinding usus. Kematian seringkali disebabkan oleh rusaknya dinding usus, debu Fe juga dapat diakumulasi dalam alveori menyebabkan berkurangnya fungsi paru – paru ( Juli Soemirat.,1996 ).
2.3.2 Limbah Cair Logam Natrium ( Na )
Natrium elemental ( Na ) sangat reaktif, karenanya bila berada di dalam air akan terdapat sebagai suatu senyawa. Natrium sendiri bagi tubuh tidak merupakan benda asing, tetapi toksisitasnya tergantung pada gugus senyawanya. NaOH atau hidroksida Na ini sangat korosif.
2.3.3 Detergen
Produk yang disebut detergen merupakan pembersih sintetis yang terbuat dari bahan – bahan turunan minyak bumi. Dibanding dengan produk terdahulu yaitu sabun, detergen mempunyai keunggulan antara lain mempunyai daya cuci yang lebih baik serta tidak terpengaruh oleh kesadahan air.
Detergen adalah Surfaktant anionik dengan gugus alkil ( umumnya C9 – C15 ) atau garam dari sulfonat atau sulfat berantai panjang dari Natrium ( RSO¯3 Na+ dan ROSO¯3 Na+ )yang berasal dari derivate minyak nabati atau minyak bumi ( fraksi parafin dan olefin ).
Proses pembuatan detergen dimulai dengan membuat bahan penurun tegangan permukaan, misalnya : p-alkilbenzena sulfonat dengan gugus alkil yang sangat bercabang, disintesis dengan polimerisasi propilena dan dilekatkan pada cincin benzena dengan reaksi alkilasi Friedel – Craft Sulfonasi, yang disusul pengolahan dengan basa.
Pada umumnya, detergen mengandung bahan – bahan berikut :
1. Surfaktan (surface active agent) merupakan zat aktif permukaan yang mempunyai ujung berbeda yaitu hydrophile ( suka air ) dan hydrophobe ( suka lemak ). Bahan aktif ini berfungsi menurunkan tegangan permukaan air sehingga dapat melepaskan kotoran yang menempel pada permukaan bahan. Surfaktan ini dapat berupa anionik ( Alkyl Benzene Sulfonate/ABS, Linier Alkyl Benzene Sulfonate/LABS, Alpha Olein Sulfonate/AOS ), Kationik ( Garam Ammonium ), Non ionic ( Nonyl phenol polyethoxyle ), Amphoterik ( Acyl Ethylenediamines ).
2. Builder ( Pembentuk ) berfungsi meningkatkan efisiensi pencuci dari surfaktan dengan cara menon-aktifkan mineral penyebab kesadahan air.
Baik berupa Phosphates (Sodium Tri Poly Phosphate/STPP), Asetat (Nitril Tri Acetate/NTA, Ethylene Diamine Tetra Acetate/EDTA), Silikat (zeolit), dan Sitrat (asam sitrat).
3. Filler (pengisi) adalah bahan tambahan detergen yang tidak mempunyai kemampuan meningkatkan daya cuci, tetapi menambah kuantitas atau dapat memadatkan dan memantapkan sehingga dapat menurunkan harga.
Contoh sodium sulfate.
4. Additives adalah bahan suplemen/tambahan untuk membuat produk lebih menarik, misalnya pewangi, pelarut, pewarna dan sebagainya yang tidak berhubungan langsung dengan detergen. Additives ditambahkan untuk maksud komersialisasi produk. Contoh: Carboxy Methyl Cellulosa (CMC), di pakai agar kotoran yang telah dibawa oleh detergen ke dalam larutan tidak kembali ke bahan cucian pada waktu mencuci (anti dereposisi). Parfum dipakai agar cucian berbau harum, sedangkan air sebagai bahan pengikat.
Kemampuan detergen untuk menghilangkan kotoran yang menempel pada kain dan objek lain, mengurangi keberadaan kuman dan bakteri yang menyebabkan infeksi dan meningkatkan umur pemakaian kain dan lainnya sudah tidak diragukan lagi. Oleh karena banyaknya manfaat penggunaan detergen, sehingga menjadi bagian penting dalam kehidupan masyarakat modern.
Tanpa mengurangi makna manfaat detergen dalam memenuhi kebutuhan sehari –hari, harus diakui bahwa bahan kimia yang digunakan pada detergen dapat menimbulkan dampak negatif baik terhadap kesehatan maupun lingkungan.
2.4 Spektrofotometer Serapan Atom
Prinsip Dasar Spektrofotometer Serapan Atom
Prinsip penentuan metode ini berdasarkan pada penyerapan energi radiasi oleh atom-atom netral pada keadaan dasar dengan panjang gelombang tertentu yang menyebabkan tereksistansinya dalam berbagai tingkatan energi. Keadaan eksitasi ini tidak stabil dan kembali ke tingkat dasar dengan melepaskan sebahagian atau seluruh energi eksistansinya dalam bentuk radiasi. Sumber radiasi tersebut dikenal sebagai lampu katoda berongga (hallow chode lamp). Proses- proses yang terjadi dari saat pemasukan larutan dari unsur yang dianalisis sampai pencatatan adalah atomisasi, interaksi atom dengan berbagai bentuk energi dan penguluran intensitas frekuensi radiasi oleh alat pencatat. Unsur yang diperiksa harus dalam keadaan atom yang tidak tereksitasi, proses untuk menghasilkan atom tersebut disebut atomisasi.
Jika larutan yang mengandung suatu garam logam (atau sesuatu senyawa logam ) dihembuskan ke dalam suatu nyala (misalnya asetilena yang terbakar di udara ) dapatlah terbentuk uap yang mengandung atom–atom logam dalam gas ini dapat dieksitasi ke tingkatan energi yang cukup tinggi untuk memungkinkan pemancaran radiasi yang karakteristik dari logam tersebut. Atom – atom keadaan dasar ini mampu menyerap energi cahaya yang panjang gelombang resonansinya khas untuknya, yang pada umumnya adalah panjang gelombang radiasi yang dipancarkan atom – atom itu bila tereksitasi dari keadaan dasar.
Jika cahaya dengan panjang gelombang resonansi itu dilewatkan nyala yang mengandung atom – atom yang bersangkutan, maka sebagian cahaya itu
akan diserap, dan jauhnya penyerapan akan berbanding lurus dengan banyaknya atom keadaan dasar yang berada dalam nyala. Inilah yang mendasari spektroskopi serapan atom ( AAS ).
Secara garis besar instrumentasi dari Spektrofotometer Serapan Atom dapat digambarkan sebagai berikut :
7. Penguat Arus 6. Detektor
5. Monokromator 4. Nyala
1. Sumber Cahaya
3. Udara Gas pembakar
8. Pencatat
2. Sampel
Gambar 2.3. Skematis Peralatan Spektrofotometer Serapan Atom Keterangan :
1. Sumber cahaya 2. Sampel
3. Udara – bahan bakar 4. Nyala
5. Monokromator 6. Detektor 7. Penguat Arus 8. Pencatat
Sumber cahaya yang sesuai untuk SSA adalah lampu katoda berongga yang mempunyai sifat yang sesuai dengan yang diinginkan untuk mendapatkan
spectrum dengan ketelitian yang tinggi dan tajam, serta menghasilkan pancaran
cahaya yang diskrit dengan garis serapan yang kelebaran jalurnya 0.0001 . Nyala yang digunakan harus memberi suhu > 2000 K untuk mencapai suhu biasanya digunakan gas pembakar dalam gas pengoksida (oksigen) seperti udara dan nitrogen oksida (N2O). Gas pembakar yang umum dipakai adalah etena (C2H2), Hidrogen (H2) dan propane (C3H8). Monokromator pada SSA adalah memisahkan, mengisolasi serta mengontrol intensitas radiasi yang mencapai detector. Sampai saat ini detector tabung penggandaan foton (PMP = Photo Multipler Tube). Frekuensi resonansi yang telah dipisahkan oleh monokromator selanjutnya ditransmisikan ke amplifier.
0
A
2.5 Spektrum Inframerah
Seperti hal nya tipe penyerapan energi yang lain maka molekul akan tereksitasi ke tingkatan energi yang lebih tinggi bila menyerap radiasi inframerah.
Penyerapan radiasi inframerah sesuai dengan perubahan energi.
Karena setiap ikatan yang berbeda mempunyai sifat frekuensi vibrasi yang berbeda dan arena tipe ikatan yang sama dalam dua senyawa yang berbeda terletak dalam lingkungan yang sedikit berbeda, maka tidak ada dua molekul yang berbeda struktur akan mempunyai bentuk serapan inframerah atau spektrum inframerah dari dua senyawa yang diperkirakan identik, maka seseorang dapat menyatakan apakah kedua senyawa tersebut identik atau tidak. Pelacakan lazim disebut dengan bentuk sidik jari dari dua spektrum inframerah. Jika puncak
spektrum inframerah kedua senyawa tepat sama maka dalam banyak hal dua senyawa tersebut adalah identik.
Alat yang menentukan spectrum serapan suatu senyawa disebut spektrofotometer inframerah.Spektrofotometer menentukan kekuatan dan kedudukan relatif dari semua serapan dalam daerah inframerah dan melukiskannya pada kertas grafik yang telah dikalibrasi. Gambar yang menyatakan intensitas serapan lawan bilangan gelombang disebut spektrum inframerah.
Bentuk dari puncak sering mengungkapkan identitasnya. Sebagai contoh,daerah N-H, sedangkan O-H biasanya memberikan puncak serapan yang lebar.
Dalam mempelajari spectra inframerah maka kita perlu memperhatikan bentuk intensitas.Sehingga kita sering mendapat serapan-serapan dengan tanda kuat (s), medium (m), tanda lemah (w), lebar atau tajam.
Untuk memperoleh informasi struktur dari spectra inframerah lebih lanjut, kita harus terbiasa dengan frekuensi atau panjang gelombang dimana sebagai gugus fungsional menyerap sebagai pelengkap informasi tersebut, dipakai tabel yang disebut tabel korelasi inframerah yang memuat informasi dimana berbagai gugus fungsional menyerap.
2.6 Proses Pengikatan Logam Oleh Kitosan Nanopartikel
Kitosan bersifat poli elektrolit kation yang dapat mengikat logam berat, sehingga dapat berfungsi sebagai adsorben terhadap logam dalam air limbah.
Prinsip dasar dalam mekanisme pengikatan antara kitosan dan logam berat yang
terkandung dalam limbah cair adalah prinsip penukar ion.Gugus amina khususnya nitrogen dalam kitosan akan bereaksi dan mengikat logam dari persenyawaan limbah cair. Kitosan yang tidak larut dalam air akan menggumpalkan logam menjadi flok – flok yang akan bersatu dan dapat dipisahkan dari air limbah.
Kitosan dapat bekerja sempurna jika dilarutkan dalam larutan asam.(Marganof., 2003:Widodo et al., 2005). Proses koagulasi logam berat oleh kitosan seperti gambar berikut
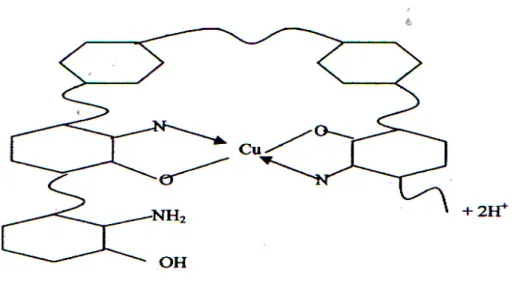
Gambar 2.4. Mekanisme Pengikatan Logam Berat oleh Kitosan
Contoh di atas menggunakan logam Cu atau tembaga.Terjadi pengikatan Cu oleh gugus N (nitrogen ) dan O (oksigen). Logam Cu tersebut akan terikat atau terserap, terkumpul dan terjadi flok – flok logam. Kitosan dengan kemampuan daya ikat atau daya serapnya mampu menjadikannya jadi tidak berbahaya.
Polielektrolit merupakan bagian dari polimer khusus yang dapat terionisasi dan mempunyai kemampuan untuk membuat terjadinya suatu flokulasi dalam medium cair. Kitosan merupakan salah satu contoh dari polielektrolit.
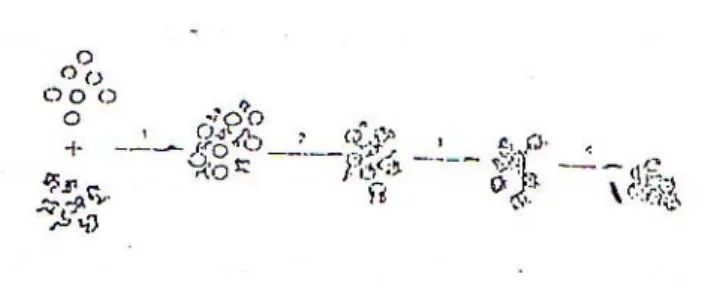
Koagulasi yang disebabkan oleh polielektrolit meliputi empat tahap, yaitu:
1. Dispersi dari polielektrolit dalam suspensi.
2. Adsorbsi antara permukaan solid- liquid.
3. Kompresi atau pemeraman dari polielektrik yang teradsorbsi.
trik yang telah terlingkupi oleh enjadi flok 4. Penyatuan dari masing –masing polielek
partikel untuk membentuk flok-flok kecil dan berkembang m yang lebih besar.
Keempat proses tersebut digambarkan sebagai berikut :
Gambar 2.5 Tahap-tahap koagulasi polielektrolit kitosan (Kennedy, dkk.2001)
rutan elektrolit erupakan partikel bermuatan positif, sedangkan kitosan adalah polielektrolit Logam berat dan logam lain secara keseluruhan dalam la
m
bermuatan negatif, reaksi antara kedua partikel akan menuju ke arah penghilangan gradien muatan dan terbentuk senyawa produk yang tidak bermuatan ditunjukkan oleh gambar 2.5
Gambar 2.6 Mekanisme koagulasi perbedaan muatan (Kennedy, dkk.2001)
Kitosan juga bersifat hidrofilik, menahan air dalam strukturnya dan membentuk gel secara spontan. Pembentukan gel berlangsung pada pH asam dan sedikit asam, disebabkan sifat kationik kitosan.viskositas gel kitosan akan meningkat dengan meningkatnya berat molekul atau jumlah polimer. Viskositas juga meningkat dengan meningkatnya derajat deasetilasi. Gel kitosan terdegradasi secara berangsur-angsur sebagaimana halnya kitosan melarut (Muzzarelli et al, 1988).