22
III.
METODE PENELITIAN
A. BAHAN DAN ALAT
Bahan utama yang digunakan adalah tapioka dan maizena. Tapioka yang digunakan berasal dari singkong varietas Manggu yang diperoleh dari petani di Cibungbulan. Maizena yang digunakan merupakan maizena komersial dengan merek “Maizenaku” yang diperoleh di toko kue Yoeks, Bogor. Bahan kimia yang digunakan terdiri atas K2SO4, HgO, cairan H2SO4 pekat, larutan H3BO3 3%, NaOH-Na2S2O3, larutan HCl 0.02 N, larutan H2SO4 0.255 N, larutan NaOH 0.625 N, larutan K2SO4 10%, heksana, alkohol 95%, larutan NaOH 1 N, larutan CH3COOH 1 N, larutan fenol 5%, serta bahan pendukung seperti akuades, kertas saring Whatman no. 1, indikator MRMB, larutan iod, amilosa standar, larutan glukosa standar, minyak goreng, air, dan kapas.
Peralatan untuk produksi tapioka yang digunakan antara lain ember, baskom, pisau, pemarut, pengepres, oven pengering jenis cabinet try dryer, loyang, disc mill, dan pengayak getar 100 mesh. Alat-alat analisis yang digunakan adalah neraca analitik; cawan alumunium; cawan porselen; penangas air; hot plate; sentrifuse; desikator; oven; tanur; peralatan analisis Kjehdahl; pH-meter; spektrofotometer UV-Vis Spectronic 20 D+; perangkat soxhlet; Whitnessmeter;
Texture Analyzer TA-XT2; freezer; refrigerator; Polarized Light Microscope (PLM) Olympus, Rapid Visco Analyzer (RVA) Newport Scientific, Australia; Differential Scanning Calorymeter
DSC 8 Shimadzu, Jepang; X-ray Diffraction Shimadzu 7000, Jepang; sudip; termometer; spatula; dan alat gelas lainnya.
Alat-alat yang digunakan untuk perlakuan HMT terdiri atas neraca analitik, sendok, botol akuades, plastik HDPE, sealer, wadah gelas bertutup untuk penggunaan microwave merek “Royalex” dengan volume maksimal 190 mm3
, microwave caroussel merek “SHARP R-4A58” 850 W 220 – 240 V/ 2450 Hz, dan oven pengering.
B. TAHAPAN PENELITIAN
Tahapan penelitian yang dilakukan terdiri atas penyediaan bahan baku, karakterisasi pati
native baik tapioka maupun maizena, penelitian pendahuluan modifikasi HMT, modifikasi HMT,
dan karakterisasi sifat fisikokimia dan fungsional pati termodifikasi HMT.
1. Penyediaan Bahan Baku
Penyediaan bahan baku meliputi penyediaan tepung tapioka dan maizena. Pembuatan tapioka dilakukan dengan cara tradisional menggunakan metode yang dilakukan Pangestuti (2010). Diagram alir pembuatan tepung tapioka disajikan pada Lampiran 2.
2. Karakterisasi Pati Native
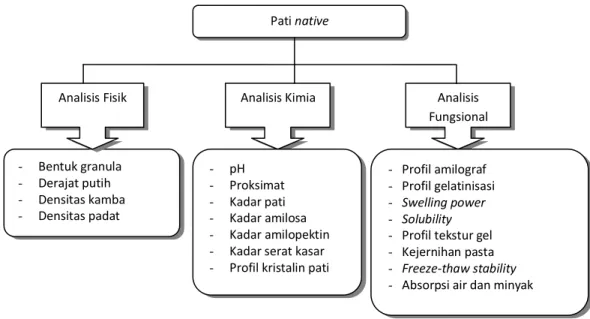
Pada tahap ini dilakukan beberapa analisis untuk mengetahui sifat fisikokimia dan fungsional pati native. Analisis yang dilakukan adalah analisis fisik terdiri atas bentuk granula pati menggunakan mikroskop polarisasi, derajat putih menggunakan Whitenessmeter, densitas kamba, dan densitas padat; analisis kimia terdiri atas analisis proksimat (kadar air, kadar abu,
23 kadar protein, kadar lemak, kadar karbohidrat), nilai pH, kadar pati, kadar amilosa, kadar amilopektin, kadar serat kasar, serta profil kristalin pati menggunakan X-ray Diffraction; serta analisis sifat fungsional yang meliputi profil amilograf menggunakan RVA, profil gelatinisasi menggunakan DSC, swelling power, kelarutan, absorpsi air dan minyak, viskositas, profil tekstur gel menggunakan TA-XT2, kejernihan pasta, dan freeze-thaw stability. Diagram alir analisis pati alami dapat dilihat pada Gambar 9.
Gambar 9. Diagram alir analisis karakterisasi pati native
3. Penelitian Pendahuluan Modifikasi HMT
Penelitian pendahuluan ini bertujuan untuk menentukan perlakuan optimum yang dapat memberikan profil amilograf yang berbeda dari pati native-nya. Penelitian pendahuluan dilakukan pada pati maizena alami dengan pengaturan kadar air 25 %bb dengan mode pemanasan low,
medium low, dan medium; serta waktu pemanasan 15 menit – 4 jam. Selain itu dilakukan pula
pengukuran suhu akhir proses gelatinisasi, pengukuran dilakukan dengan menggunakan termometer. Untuk mengurangi kemungkinan panas yang keluar dari wadah gelas selama pengukuran, digunakan beberapa lap kering untuk menutup celah-celah terbuka saat pengukuran.
4. Modifikasi Pati dengan Teknik HMT
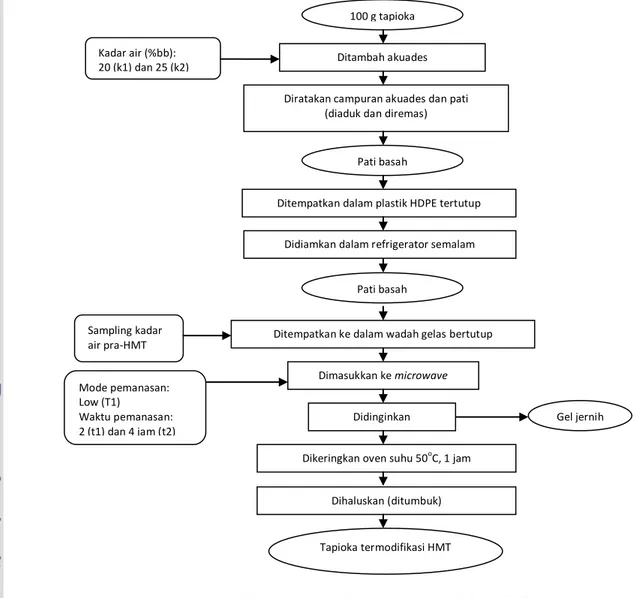
Pati dianalisis kadar air awalnya (%bb) terlebih dulu. Proses modifikasi pati adalah sebagai berikut: sebanyak 100 gram pati diatur kadar airnya hingga mencapai kadar air yang diinginkan yaitu 20 dan 25 %bb dengan cara menuangkan akuades secara perlahan sambil diaduk dan diremas secara manual guna meratakan kadar air pada pati. Jumlah akuades ditentukan berdasarkan kesetimbangan massa dan formulasi kesetimbangan massa diperoleh sebagai berikut:
(100% - KA1) x BP1 = (100% - KA2) x BP2 Pati native - Bentuk granula - Derajat putih - Densitas kamba - Densitas padat
Analisis Fisik Analisis Kimia Analisis
Fungsional - pH - Proksimat - Kadar pati - Kadar amilosa - Kadar amilopektin - Kadar serat kasar - Profil kristalin pati
- Profil amilograf - Profil gelatinisasi - Swelling power - Solubility - Profil tekstur gel - Kejernihan pasta - Freeze-thaw stability - Absorpsi air dan minyak
24 Keterangan:
KA1 = kadar air kondisi awal (%bb) KA2 = kadar air pati yang diinginkan (%bb) BP1 = bobot pati pada kondisi awal
BP2 = bobot pati setelah mencapai KA2 (BP1 + Bair)
Pati lembab selanjutnya ditempatkan di dalam plastik HDPE bertutup. Pati didiamkan dalam refrigerator selama semalam untuk penyeragaman kadar air. Pati yang akan dimodifikasi HMT ditempatkan pada wadah gelas bertutup yang untuk microwave. Modifikasi HMT pada
microwave dilakukan dengan variasi waktu pemanasan yaitu 2 dan 4 jam dengan mode
pemanasan rendah (low). Mode dan waktu pemanasan diperoleh dari penelitian pendahuluan. Pati termodifikasi kemudian didinginkan dan dipisahkan dari sebagian pati yang tergelatinisasi (ditunjukkan dengan gumpalan gel yang jernih). Pati termodifikasi lalu dikeringkan selama 1 jam pada suhu 50oC, setelahnya ditumbuk untuk meratakan ukuran. Pembuatan pati termodifikasi HMT pada tiap-tiap perlakuan dilakukan sebanyak dua kali ulangan. Proses pembuatan pati termodifikasi HMT dapat dilihat pada Gambar 10.
Gambar 10. Diagram pembuatan pati termodifikasi HMT (Lewandowicz et al. 2000; Zondag 2003 dengan modifikasi)
Diratakan campuran akuades dan pati (diaduk dan diremas)
Pati basah Dihaluskan (ditumbuk) Sampling kadar air pra-HMT Gel jernih Dimasukkan ke microwave Mode pemanasan: Low (T1) Waktu pemanasan: 2 (t1) dan 4 jam (t2) Kadar air (%bb):
20 (k1) dan 25 (k2) Ditambah akuades
Ditempatkan dalam plastik HDPE tertutup
Didiamkan dalam refrigerator semalam
Ditempatkan ke dalam wadah gelas bertutup 100 g tapioka
Pati basah
Didinginkan
Dikeringkan oven suhu 50oC, 1 jam
25
5. Karakterisasi Sifat Fisiko-kimia dan Fungsional Pati Termodifikasi
HMT
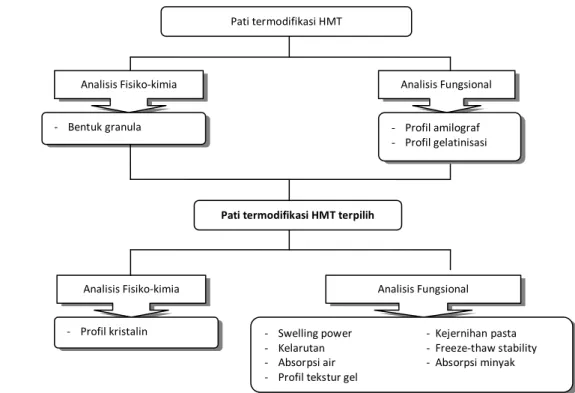
Untuk mengetahui pati termodifikasi HMT terbaik dilakukan karakterisasi baik sifat fisikokimia maupun fungsional dati pati termodifiakasi. Mula-mula pati termodifikasi HMT dikarakterisasi melalui analisis bentuk granula, profil amilografi, dan profil gelatinisasi untuk mengetahui perlakuan HMT terpilih yang mampu mengubah karakteristik fisikokimia dan fungsional seperti yang telah disebutkan. Pati HMT dengan kondisi terpilih dianalisis lebih lanjut sebagaimana yang ditunjukkan pada Gambar 11.
Gambar 11. Diagram alir tahapan analisis pati termodifikasi HMT
C. PROSEDUR ANALISIS
1. Profil Bentuk Granula Pati
Profil bentuk granula diamati dengan Polarized Light Microscope (PLM) (Olympus Optical Co. Ltd, Japan) yang dilengkapi dengan kamera. Suspensi pati disiapkan dengan mencampurkan pati dan akuade. Suspensi diteteskan pada atas gelas objek dan ditutup dengan gelas penutup, preparat kemudian dipasang pada PLM. Pengamatan dilakukan dengan dengan perbesaran 400 dan 1000 kali.
2. Profil Kristalin Pati (Hustiany 2006)
Profil kristalin pati dianalisis menggunakan X-Ray Diffraction Shimadzu 7000, Japan. Radiasi Cu monokromatik dengan panjang gelombang α1 = 1.54056 Ǻ dan α2 = 1.54439 Ǻ
Pati termodifikasi HMT
Analisis Fisiko-kimia Analisis Fungsional
- Bentuk granula - Profil amilograf - Profil gelatinisasi
Analisis Fungsional
- Swelling power - Kejernihan pasta - Kelarutan - Freeze-thaw stability - Absorpsi air - Absorpsi minyak - Profil tekstur gel
Analisis Fisiko-kimia
- Profil kristalin
26 dengan daya yang dihasilkan oleh generator pada 40 kV dan 30 mA. Daerah canning difraksi pada sudut 2 θ yaitu 5-30o
dengan step interval 0,02o dan kecepatan scan1.5o/menit. Pengukuran kristalinitas relatif dilakukan dengan menggunakan software Shimadzu 7000. Kurva halus yang menghubungkan dasar puncak-puncak difraktogram. Area di atas kurva halus merupakan daerah kristalin. Rasio antara luas area di atas kurva dengan total area difraksi menunjukkan kristalinitas relatif.
𝑋𝑐 % = 𝐴𝑐
𝐴𝑐 + 𝐴𝑎 × 100 % Keterangan : Ac = Area daerah kristalin
Aa = Area daerah amorphous
Xc = Persentase kristalinitas relatif
3. Derajat Putih
Pengukuran dilakukan menggunakan Whiteness Meter (Kett Electric Laboratory (C-100-3). Kalibrasi dilakukan dengan standar warna putih BaSO4, yang memiliki derajat putih 100% (110.8). Sejumlah contoh dimasukkan ke dalam wadah khusus, dipadatkan, ditutup, kemudian dimasukkan ke dalam tempat pengukuran lalu nilai derajat putih akan keluar pada layar (A).
𝐷𝑒𝑟𝑎𝑗𝑎𝑡 𝑝𝑢𝑡𝑖ℎ % = A
110,8 𝑥 100% Keterangan : A = Nilai yang terbaca pada alat
110,8 = Standar BaSO4
4. Densitas Kamba (bulk density) (Wirakartakusumah et al. 1992)
Densitas kamba ditentukan oleh berat wadah yang diketahui volumenya dan merupakan hasil pembagian berat bubuk dengan volume wadah. Sampel dimasukkan ke dalam gelas ukur 25 ml. Isi hingga volumenya mencapai tepat 25 ml lalu ditimbang bobotnya.
𝐷𝑒𝑟𝑎𝑗𝑎𝑡 𝐾𝑎𝑚𝑏𝑎 𝑔/𝑚𝑙 =𝑏𝑜𝑏𝑜𝑡 𝑠𝑎𝑚𝑝𝑒𝑙 (𝑔) 𝑣𝑜𝑙𝑢𝑚𝑒 (𝑚𝑙)
5. Densitas padat
Densitas padat adalah massa partikel yang menempati suatu unit volume tertentu dengan dipadatkan. Sampel dimasukkan ke dalam gelas ukur 25 ml, kemudian dipadatkan. Isi hingga volumenya mencapai tepat 25 ml lalu ditimbang bobotnya.
𝐷𝑒𝑟𝑎𝑗𝑎𝑡 𝑃𝑎𝑑𝑎𝑡 𝑔/𝑚𝑙 =𝑏𝑜𝑏𝑜𝑡 𝑠𝑎𝑚𝑝𝑒𝑙 (𝑔) 𝑣𝑜𝑙𝑢𝑚𝑒 (𝑚𝑙)
27
6. Kadar Air Metode Oven Biasa (Apriyantono et al. 1989)
Cawan alumunium dikeringkan dalam oven pada suhu 105oC selama 15 menit, lalu didinginkan dalam desikator selama 10 menit. Cawan ditimbang menggunakan neraca analitik. Sampel sebanyak 5 gram dimasukkan ke dalam cawan, kemudian cawan serta sampel ditimbang dengan neraca analitik. Cawan berisi sampel dikeringkan dalam oven pada suhu 105oC selama semalam. Selanjutnya cawan berisi sampel didinginkan dalam desikator, kemudian ditimbang.
𝐾𝑎𝑑𝑎𝑟 𝑎𝑖𝑟 (%𝑏𝑏) =𝑎 − (𝑏 − 𝑐)
𝑎 × 100%
𝐾𝑎𝑑𝑎𝑟 𝑎𝑖𝑟 %𝑏𝑘 = 𝑎 − (𝑏 − 𝑐)
(𝑏 − 𝑐) × 100% Keterangan: a = bobot sampel awal (g)
b = bobot sampel dan cawan setelah dikeringkan (g) c = bobot cawan kosong (g)
7. Kadar Abu (Apriyantono et al. 1989)
Cawan pengabuan dibakar dalam tanur, kemudian didinginkan dalam desikator, dan ditimbang. Sampel sebanyak 3-5 gram ditimbang dalam cawan tersebut, kemudian cawan yang berisi sampel dibakar sampai didapatkan abu berwarna abu-abu atau sampai bobotnya konstan. Cawan yang berisi sampel didinginkan dalam desikator, kemudian ditimbang dengan neraca analitik. Catatan: sebelum masuk tanur, sampel di dalam cawan dibakar dulu pada hot plate sampai asapnya habis.
𝐾𝑎𝑑𝑎𝑟 𝑎𝑏𝑢 (%𝑏𝑏) = 𝑏𝑜𝑏𝑜𝑡 𝑎𝑏𝑢
𝑏𝑜𝑏𝑜𝑡 𝑠𝑎𝑚𝑝𝑒𝑙× 100%
𝐾𝑎𝑑𝑎𝑟 𝑎𝑏𝑢 %𝑏𝑘 = 𝑘𝑎𝑑𝑎𝑟 𝑎𝑏𝑢 (%𝑏𝑏)
(100 − 𝑘𝑎𝑑𝑎𝑟 𝑎𝑖𝑟)× 100%
8. Kadar Protein Metode Kjehdahl-mikro (AOAC 1995)
Sejumlah kecil sampel (kira-kira 100–250 mg) ditimbang, dipindahkan ke dalam labu Kjedahl 30 ml. Setelah itu, ditambahkan 1.9 ± 0.1 gram K2SO4, 40 ± 10 mg HgO, dan 2.0 ± 0.1 ml H2SO4 ke dalam labu Kjedahl yang berisi sampel. Jika sampel lebih dari 150 mg, ditambahkan 0.1 ml H2SO4 untuk setiap 10 mg bahan organik. Labu Kjehdahl yang berisi sampel didestruksi elama 1-1,5 jam hingga cairan menjadi jernih. Setelahnya labu Kjedahl didinginkan dan ditambahkan sejumlah kecil akuades secara perlahan, lalu didinginkan kembali. Isi labu dipindahkan ke dalam alat destilasi. Labu Kjedahl yang isinya sudah dipindahkan ke dalam alat destilasi dicuci dan bilas 5-6 kali dengan 1-2 ml air, air cucian dipindahkan ke alat destilasi.
Erlenmeyer 125 ml yang berisi 5 ml larutan H3BO3 dan 2-4 tetes indikator (campuran dua bagian metil merah 0.2% dalam alkohol dan satu bagian metilen blue 0.2% dalam alkohol) diletakan di bawah kondensor. Ujung tabung kondensor harus terendam di bawah larutan H3BO3
28 kemudian di tambahkan 8-10 ml larutan NaOH-Na2S2O3 dan dilakukan destilasi sampai tertampung kira-kira 15 ml destilat dalam erlenmeyer. Setelah itu, tabung kondensor dibilas dengan air dan bilasannya ditampung dalam erlenmeyer yang sama. Selanjutnya isi erlenmeyer diencerkan sampai kira-kira 50 ml dan kemudian ditritasi dengan HCl 0.02 N yang sudah distandardisasi sampai terjadi perubahan warna menjadi abu-abu. Penentuan protein pun dilakukan untuk blanko.
𝐾𝑎𝑑𝑎𝑟 𝑁 % = 𝑚𝑙 𝐻𝐶𝑙 − 𝑚𝑙 𝑏𝑙𝑎𝑛𝑘𝑜 × 𝑁 𝐻𝐶𝑙 × 14.007
𝑚𝑔 𝑠𝑎𝑚𝑝𝑒𝑙 × 100%
Kadar protein (%bb) = %N x faktor konversi (6.25)
𝐾𝑎𝑑𝑎𝑟 𝑝𝑟𝑜𝑡𝑒𝑖𝑛 %𝑏𝑘 = 𝑘𝑎𝑑𝑎𝑟 𝑝𝑟𝑜𝑡𝑒𝑖𝑛 (%𝑏𝑏)
(100 − 𝑘𝑎𝑑𝑎𝑟 𝑎𝑖𝑟) × 100%
9. Kadar Lemak Metode Soxhlet (Apriyantono et al. 1989)
Sampel yang akan dianalisis ditimbang sebanyak 1-2 gram lalu dimasukkan ke dalam selongsong kertas yang dialasi dengan kapas. Bagian atas selongsong kertas yang telah diisi sampel juga disumbat dengan kapas lalu dikeringkan dalam oven pada suhu tidak lebih dari 80oC selama lebih kurang 1 jam. Selongsong kemudian dimasukkan ke dalam alat Soxhlet yang telah dihubungkan dengan labu lemak. Sampel diekstrak dengan heksana atau pelarut lemak lainnya selama lebih kurang 6 jam. Pelarut kemudian disuling kembali dan hasil ekstraksi lemak dikeringkan dalam oven pengering pada suhu 105oC. Labu berisi lemak sampel kemudian didinginkan dalam desikator lalu ditimbang bobotnya. Pengeringan diulangi hingga didapat bobot yang tetap.
𝐾𝑎𝑑𝑎𝑟 𝑙𝑒𝑚𝑎𝑘 (%𝑏𝑏) =𝑎 − 𝑏
𝑐 𝑥 100%
𝐾𝑎𝑑𝑎𝑟 𝑙𝑒𝑚𝑎𝑘 %𝑏𝑘 = 𝑘𝑎𝑑𝑎𝑟 𝑙𝑒𝑚𝑎𝑘 (%𝑏𝑏)
(100 − 𝑘𝑎𝑑𝑎𝑟 𝑎𝑖𝑟) × 100% Keterangan: a = Bobot labu lemak setelah diekstraksi (g)
b = Bobot labu lemak sebelum diekstraksi (g) c = Bobot sampel (g)
10. Kadar Karbohidrat (by difference)
Kadar karbohidrat dihitung sebagai sisa dari kadar air, abu, lemak dan protein. Kadar karbohidrat ditentukan sebagai berikut :
Kadar karbohidrat (%bb) = 100% - (air + abu + lemak + protein) (%bb)
𝑘𝑎𝑑𝑎𝑟 𝑘𝑎𝑟𝑏𝑜ℎ𝑖𝑑𝑟𝑎𝑡 %𝑏𝑘 = 𝑘𝑎𝑑𝑎𝑟 𝑘𝑎𝑟𝑏𝑜ℎ𝑖𝑑𝑟𝑎𝑡 (%𝑏𝑏)
29
11. Nilai pH (Apriyantono et al., 1989)
Sampel sebesar 1 gram ditimbang, kemudian ditambahkan 20 ml air. Kocok dengan stirrer sampai basah sempurna. Kemudian ditambahkan 50 ml air dan dihomogenkan. Biarkan sampel selama 1 jam. Jangan disaring, biarkan mengendap. Ukur pH supernatan sampel. pH diukur dengan menggunakan pH meter terkalibrasi.
12. Kadar Pati Metode Fenol-Sulfat (Dubois et al. 1956 dengan modifikasi)
a. Pembuatan larutan fenol 5%
Fenol (standar pereaksi) yang terdistilasi sebanyak 50 gram dilarutkan dalam akuades dan ditepatkan hingga volume 1 liter.
b. Persiapan standar kerja glukosa
Standar glukosa (larutan stok) dibuat dengan cara melarutkan 100 mg glukosa dalam 100 ml akuades. Kemudian dari larutan stok tersebut diambil sebanyak 10 ml dan dilarutkan dengan akuades hingga mencapai 100 ml larutan stadar kerja glukosa.
c. Persiapan sampel
Sebanyak 1 gram sampel dimasukkan ke dalam etanol 95%, aduk merata. Gula-gula sederhana akan larut dalam etanol sementara pati akan mengendap pada dasar gelas piala. Sampel yang telah dilarutkan tersebut kemudian disaring menggunakan kertas saring Whatman no. 1. Bilas kembali gelas piala dengan etanol 95% dan pindahkan kembali secara kuantitatif untuk dilakukan penyaringan. Kertas saring yang terdapat pati basah kemudian dikeringkan dalam desikator semalam. Sampel pati yang telah dikeringkan semalam dikerik dari kertas saring dan dihaluskan. Ambil sampel pati kering sebanyak 40 mg dan masukkan ke dalam erlenmeyer 100 ml. kemudian larutkan dengan 25 ml akuades dan tutup erlenmeyer dengan alumunium foil. Panaskan erlenmeyer berisi larutan sampel dengan autoklaf pada suhu 105oC selama 60 menit. Angkat dan dinginkan hingga mencapai suhu ruang. Ambil larutan pati dan lakukan pengenceran 40 kali.
d. Analisis kadar pati
Larutan kerja glukosa sebanyak 0.1; 0.2; 0.3; 0.4; 0.5; 0.6; 0.7; 0.8 ml dipipet ke dalam tabung reaksi bertutup dan buat hingga 1 ml. Pipet juga sebanyak 1,0 ml larutan sampel pati ke dalam tabung reaksi terpisah (lakukan duplo). Untuk blanko siapkan 1 ml akuades pada tabung reaksi terpisah. Larutan fenol 5% sebanyak 1 ml ditambahkan pada masing-masing tabung kemudian vorteks, dan disusul dengan penambahan 5 ml asam sulfat pekat. Diamkan selama 10 menit. Vorteks kembali dan diamkan ada suhu ruang selama 20 menit. Vorteks kembali dan ukur absorbansi pada panjang gelombang 490 nm.
30
e. Perhitungan kadar pati
Dengan mengetahui persamaan linear dari kurva standar glukosa, kadar pati dapat dihitung dengan memasukkan nilai absorbansi ke persamaan linear tersebut untuk mendapatkan nilai glukosa dalam sampel, kemudian dikonversikan dengan faktor konversi pati (0.9).
𝐾𝑎𝑑𝑎𝑟 𝑝𝑎𝑡𝑖(%𝑏𝑏) =𝑚𝑔 𝑔𝑙𝑢𝑘𝑜𝑠𝑎 𝑥 𝐹𝑃
𝑚𝑔 𝑠𝑎𝑚𝑝𝑒𝑙 𝑥 0.9
𝐾𝑎𝑑𝑎𝑟 𝑝𝑎𝑡𝑖 %𝑏𝑘 = 𝑘𝑎𝑑𝑎𝑟 𝑝𝑎𝑡𝑖 (%𝑏𝑏)
(100 − 𝑘𝑎𝑑𝑎𝑟 𝑎𝑖𝑟) × 100%
13. Kadar Amilosa Metode IRRI (Apriyantono et al. 1989)
a. Pembuatan larutan iod
Sebanyak 1 gram iodine dan 10 gram KI ditimbang dan tepatkan dengan akuades hingga mencapai volume 500 ml.
b. Pembuatan kurva standar amilosa
Sebanyak 40 mg amilosa murni dimasukkan ke dalam tabung reaksi. Kemudian ke dalam tabung reaksi tersebut ditambah 1 ml etanol 95% dan 9 ml NaOH 1 N. Tabung reaksi dipanaskan dalam air mendidih sekitar 10 menit sampai semua amilosa membentuk gel. Setelah didinginkan, campuran tersebut dipindahkan secara kuantitatif ke dalam labu takar 100 ml dan tepatkan dengan air sampai tanda tera. Sebanyak masing-masing 1, 2, 3, 4, dan 5 ml larutan tersebut dipipet ke dalam labu takar 100 ml. Masing-masing labu takar ditambah asam asetat 1 N sebanyak 0.2, 0.4, 0.6, 0.8, dan 1 ml, kemudian masing-masing ditambah 2 ml larutan iod dan tepatkan dengan air sampai tanda tera. Setelah didiamkan selama 20 menit, larutan tersebut diukur absorbasi dari intensitas warna biru yang terbentuk dengan spektrofotometer pada panjang gelombang 625 nm. Buat kurva standar sebagai hubungan antara kadar amilosa (sumbu x) dengan absorbansi (sumbu y).
c. Analisis sampel
Sebanyak 100 mg contoh dimasukkan ke dalam tabung reaksi. Kemudian ke dalam tabung reaksi tersebut ditambah 1 ml etanol 95% dan 9 ml NaOH 1 N. Tabung reaksi dipanaskan dalam air mendidih sekitar 10 menit untuk menggelatinisasi pati. Setelah didinginkan, campuran tersebut dipindahkan secara kuantitatif ke dalam labu takar 100 ml dan tepatkan dengan air sampai tanda tera. Sebanyak 5 ml dari larutan tersebut dipipet dan dimasukkan ke dalam labu takar. Ke dalam labu takar ditambah 1 ml asam asetat 1 N, lalu ditambah 2 ml larutan iod dan tepatkan dengan air sampai tanda tera. Setelah didiamkan selama 20 menit, larutan tersebut diukur absorbasi dari intensitas warna biru yang terbentuk dengan spektrofotometer pada panjang gelombang 625 nm.
31 𝐾𝑎𝑑𝑎𝑟 𝑎𝑚𝑖𝑙𝑜𝑠𝑎(%𝑏𝑏) =𝐶 𝑥 𝑉 𝑥 𝐹𝑃 𝑥 100 𝑊 𝐾𝑎𝑑𝑎𝑟 𝑎𝑚𝑖𝑙𝑜𝑠𝑎 %𝑏𝑘 = 𝑘𝑎𝑑𝑎𝑟 𝑎𝑚𝑖𝑙𝑜𝑠𝑎 (%𝑏𝑏) (100 − 𝑘𝑎𝑑𝑎𝑟 𝑎𝑖𝑟) × 100% Keterangan:
C = Konsentrasi amilosa contoh dari kurva standar (mg/ml) V = Volume akhir contoh (ml)
FP = Faktor pengenceran W = Berat contoh (mg)
14. Kadar Amilopektin
Pati terdiri dari fraksi amilosa dan amilopektin. Oleh karena itu, kadar amilopektin merupakan selisih antara kadar pati dengan kadar amilosa.
Kadar amilopektin (%bb) = Kadar pati (%) – kadar amilosa (%)
𝐾𝑎𝑑𝑎𝑟 𝑎𝑚𝑖𝑙𝑜𝑝𝑒𝑘𝑡𝑖𝑛 %𝑏𝑘 = 𝑘𝑎𝑑𝑎𝑟 𝑎𝑚𝑖𝑙𝑜𝑝𝑒𝑘𝑡𝑖𝑛 (%𝑏𝑏)
(100 − 𝑘𝑎𝑑𝑎𝑟 𝑎𝑖𝑟) × 100%
15. Kadar Serat Kasar (AOAC 1995 dengan modifikasi)
Sampel bebas lemak sebanyak 1 gram dipindahkan secara kuantitatif ke dalam labu erlenmeyer 600 ml. Kemudian dalam erlenmeyer ditambahkan 100 ml larutan H2SO4 0.255 N. Letakkan erlenmeyer di dalam penangas air bergoyang (wadah harus dalam keadaan tertutup) dan didihkan selama 30 menit. Tambahkan 100 ml larutan NaOH 0.625 N. Didihkan kembali selama 30 menit pada penangas bergoyang. Saring kembali sampel menggunakan kertas saring Whatman no. 1 yang telah diketahui beratnya sambil dicuci dengan K2SO4 10%. Cuci residu di kertas saring dengan air mendidih, kemudian dengan etanol 95%. Keringkan kertas saring dalam oven 110oC sampai berat konstan (1-2 jam). Setelah itu dinginkan dalam desikator, kemudian kertas saring ditimbang kembali. 𝐾𝑎𝑑𝑎𝑟 𝑠𝑒𝑟𝑎𝑡 𝑘𝑎𝑠𝑎𝑟 %𝑏𝑏 =𝑊2 − 𝑊1 𝑊 × 100% 𝐾𝑎𝑑𝑎𝑟 𝑠𝑒𝑟𝑎𝑡 𝑘𝑎𝑠𝑎𝑟 %𝑏𝑘 = 𝑘𝑎𝑑𝑎𝑟 𝑠𝑒𝑟𝑎𝑡 𝑘𝑎𝑠𝑎𝑟 (%𝑏𝑏) 100 − 𝑘𝑎𝑑𝑎𝑟 𝑎𝑖𝑟 𝑥 100% Keterangan:
W2 = berat residu dan kertas saring yang telah dikeringkan (g) W1 = berat kertas saring (g)
32
16. Profil Amilograf
Profil amilograf diukur menggunakan Rapid Visco Analyzer (RVA, Model Tecmaster, Newport Scientific, Australia). Sebanyak ± 3.00 g dilarutkan secara langsung pada akuades sebanyak ± 25 ml pada canister. Pada pengukurannya digunakan standar dua dimana sampel akan diatur suhu awalnya 50 oC dalam satu menit pertama kemudian dipanaskan sampai suhu 95 oC dalam waktu 7.5 menit dan ditahan pada suhu tersebut selama 5 menit. Setelah itu, suhu sampel didinginkan kembali ke suhu awal 50 oC selama 7.5 menit dan ditahan selama 2 menit. Kecepatan rotasi diatur pada 160 rpm selama proses. Parameter yang dapat diukur antara lain viskositas puncak (VP), viskositas pada akhir waktu ditahan 95 oC atau viskositas pasta panas (VPP), viskositas akhir (FV) pada akhir pendinginan, viskositas breakdown (BD = VP-VPP), setback (SB = FV-VPP), temperatur pasta dan suhu pada saat viskositas puncak.
17.
Profil Gelatinisasi Pati (Collado dan Corke 1999)
Karakteristik gelatinisasi pati ditentukan menggunakan Differential Scanning
Calorimetry (DSC 8, Shimadzu, Japan). Sampel pati (2.5 ± 0.1 mg) ditimbang langsung didalam
pan aluminium, dan ditambahkan 7.5 µl air de-ionisasi. Kemudian pan di seal secara hermetis dan dibiarkan semalam pada suhu 4 oC. Pan yang berisi sampel dipanaskan dari 30-120 oC dengan kenaikan 5 oC/ menit. Pan kosong digunakan sebagai referen. Parameter yang dapat di ukur antara lain suhu mula gelatinisasi (To), suhu puncak (Tp), suhu akhir gelatinisasi (Tc) dan entalpi gelatinisasi (ΔHgel,J/g).
18. Daya Kembang (Swelling Power) dan Kelarutan (Solubility Index)
(Adebowale et al. 2005 dengan modifikasi)
Sampel tepung sebanyak 0.1 gram ditimbang dalam tabung sentrifuse yang diketahui beratnya (lakukan duplo). Kemudian ditambahkan sebanyak 5 ml akuades, vorteks. Larutan pati tersebut dipanaskan dalam penangas air dengan suhu 60oC, 70oC, 80oC, 90oC, dan 95oC selama 30 menit sambil digoyangkan dengan kecepatan konstan secara berkala setiap 5 menit. Dinginkan hingga mencapai suhu ruang. Kemudian sentrifuse dengan kecepatan 3500 rpm selama 15 menit, pisahkan supernatan dari endapan. Nilai swelling power diukur dengan membagi berat endapan basah dengan berat sampel sebelum dipanaskan (g/g).
𝑆𝑤𝑒𝑙𝑙𝑖𝑛𝑔 𝑃𝑜𝑤𝑒𝑟(𝑔 𝑔) =𝑋 − 𝑌 𝑊 Keterangan: W = berat sampel (g)
Y = berat tabung kosong (g) X = berat tabung dan endapan (g)
Supernatan yang telah dipisahkan ditimbang dalam cawan alumunium yang telah sebelumnya diketahui bobotnya. Pemisahan supernatan lebih sulit pada tapioka karena terdapat beberapa padatan keruh (cloudy solid) yang bercampur pada supernatan. Sehingga diperlukan suatu asumsi bahwa yang disebut endapan adalah padatan yang melekat pada tabung sentrifuse. Kemudian cawan berisi supernatan tersebut dikeringkan dalam oven 105oC hingga mencapai
33 berat konstan. Kelarutan dinyatakan sebagai persen berat pati yang larut dalam supernatant dalam basis berat kering.
𝐾𝑒𝑙𝑎𝑟𝑢𝑡𝑎𝑛 % = 𝑋 − 𝑌
𝑊 𝑥 (100 − 𝑘𝑎𝑑𝑎𝑟 𝑎𝑖𝑟 %𝑏𝑏 )× 100% Keterangan: W = berat sampel (g)
X = berat cawan dan endapan (g) Y = berat cawan kosong (g)
19. Profil Tekstur Gel (Collado dan Corke 1999 dengan modifikasi)
Kekuatan gel diukur dengan menggunakan alat textur analyzer (TA-XT2). Pati dengan konsentrasi 21% dipanaskan dari suhu 30oC sampai 95oC, dan dipertahankan pada suhu 95oC selama 30 menit, kemudian didinginkan sampai suhu 50oC. Pasta pati ini dituangkan ke dalam tabung dengan diameter 4 cm dan tinggi 3 cm, kemudian disimpan pada suhu 4oC selama 24 jam. Gel ditekan dengan kecepatan penetrasi 2,5 mm/s dan jarak 5 mm. Profil yang diukur adalah kekerasan, elastisitas, daya kohesif, dan kelengketan. Kekerasan merupakan gaya maksimum selama penekanan (g), elastisitas dihitung dari rasio waktu yang dibutuhkan untuk mencapai puncak pada gigitan kedua dan pertama (T2/T1), daya kohesif dihitung dari rasio luasan kurva pada tekanan kedua dengan luasan kurva pada tekanan pertama (A2/A1), serta kelengketan yang diperoleh dari pengalian kekerasan dan daya kohesif (kekerasan * A2/A1). Penentuan gaya maksimum dan luasan kurva diperoleh dengan perhitungan menggunakan software Exponent Lite TE32. Probe yang digunakan adalah probe silinder p/100 dengan diameter 100 mm.
20. Kejernihan Pasta (Wattanachant et al. 2002)
Pengukuran kejernihan pasta dilakukan menggunakan spektrofotometer UV-Vis Spectronic 20 D+. Pasta pati (1%) disiapkan dengan cara mensuspensikan 50 mg sampel dalam 5 ml air (digunakan tabung reaksi berulir). Tabung dicelupkan dalam air mendidih selama 30 menit, kemudian dikocok setiap 5 menit. Sampel didinginkan hingga suhu kamar. Nilai transmitan (%T) dibaca pada spektrofotometer dengan λ 650 nm. Akuades digunakan sebagai blanko.
21. Freeze-Thaw Stability (Wattanachant et al., 2002 dengan modifikasi)
Pasta pati (konsentrasi 8%) disiapkan dalam tabung sentrifuse. Sejumlah pati dan sampel dipanaskan dari temperatur 30oC hingga 95oC, kemudian di-holding selama 30 menit pada temperatur 95 oC. Pasta pati yang dihasilkan ditimbang beratnya. Tabung sentrifuse ditutup dengan rapat. Tabung disimpan pada suhu -20oC selama 18 jam, kemudian di-thawing pada suhu ruang selama 6 jam. Sampel yang telah mendapat perlakuan satu siklus freeze-thaw tersebut disentrifuse pada 3000 rpm selama 30 menit. Jumlah (volume) air (supernatant jernih) yang terpisah setelah siklus freeze-thaw diukur dan dinyatakan dalam % sineresis. Freeze-thaw dilakukan sebanyak 4 siklus.
34 𝑆𝑖𝑛𝑒𝑟𝑒𝑠𝑖𝑠 % = 𝑐𝑎𝑖𝑟𝑎𝑛 𝑦𝑎𝑛𝑔 𝑑𝑖𝑝𝑖𝑠𝑎ℎ𝑘𝑎𝑛 (𝑔)
𝑏𝑜𝑏𝑜𝑡 𝑝𝑎𝑠𝑡𝑎 𝑝𝑎𝑡𝑖 (𝑔) × 100%
22. Absorpsi Minyak dan Air (Sathe dan Salunkhe 1981)
Sebanyak 1 gram sampel ditambah 10 ml akuades atau minyak dan diaduk selama 30 detik. Lalu didiamkan pada suhu kamar selama 30 menit dan disentrifuse selama 40 menit pada 3500 rpm.
𝐴𝑏𝑠𝑜𝑟𝑝𝑠𝑖 𝑎𝑖𝑟 𝑎𝑡𝑎𝑢 𝑚𝑖𝑛𝑦𝑎𝑘 (𝑔 𝑔 ) =𝑎 − 𝑏 𝑐 Keterangan:
a = berat air atau minyak (g) b = berat supernatan (g) c = berat sampel (g)