1 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
LAPORAN RESMI
LABORATORIUM PROSES KIMIA
MATERI
ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
Disusun Oleh : Kelompok 3/A
1. Muliasari Kurniati M. NIM : L2C009004 2. Muhammad Adi Irawan NIM : L2C009047
3. Eva Sofiana NIM : L2C009065
LABORATORIUM PROSES KIMIA
JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO
SEMARANG 2011
ii ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
LEMBAR PENGESAHAN
NAMA : 1. Muliasari Kurniati M. (L2C009004) 2. Muhammad Adi Irawan (L2C009047)
3. Eva Sofiana (L2C009065)
Kelompok : 3 / A
Materi : Absorbsi Gas CO2 dengan Larutan NaOH
Semarang, Juni 2011 Dosen Pengampu
Dr. Andri Cahyo Kumoro, S.T., M.T. 19740523 199802 1 001
iii ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT. atas segala limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan Laporan Resmi Praktikum Proses Kimia untuk materi Absorbsi Gas CO2 dengan Larutan NaOH
dengan lancar.
Dalam laporan ini penulis meyakini sepenuhnya bahwa tidaklah mungkin menyelesaikan makalah ini tanpa doa, bantuan dan dukungan baik secara langung maupun tidak langsung. Sehingga pada kesempatan ini penulis ingin mengucapkan terima kasih kepada :
1. Dosen pengampu Laboratorium Proses Kimia Universitas Diponegoro 2. Asisten dan laboran Laboratorium Proses Kimia Universitas Diponegoro 3. Kedua orang tua atas doa, kesabaran, limpahan kasih sayang, dukungan,
dan pengorbanan yang telah diberikan
4. Teman-teman angkatan 2009 Teknik Kimia Universitas Diponegoro Penulis pun meyakini bahwa laporan ini jauh dari kesempurnaan. Mohon maaf apabila terdapat kekurangan. Penulis mengharapkan kritik dan saran yang membangun dari semua pihak berkaitan dengan laporan ini. Akhir kata, semoga laporan ini dapat bermanfaat bagi semua pihak dan dapat berguna sebagai bahan penambah ilmu pengetahuan.
Semarang, Juni 2011
iv ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
DAFTAR ISI
Lembar Pengesahan... ii
Kata Pengantar... iii
Daftar Isi... iv
Daftar Gambar... v
Daftar Tabel... vi
Intisari... vii
BAB I Pendahuluan... 1
I.1 Latar Belakang... 1
I.2 Tujuan Percobaan... 1
I.3 Manfaat Percobaan... 1
BAB II Landasan Teori... 2
BAB III Pelaksanaan Percobaan... 10
III.1 Bahan dan Alat yang Digunakan... 10
III.2 Gambar Alat Utama... 10
III.3 Variabel Operasi... 11
III.4 Prosedur Percobaan... 11
BAB IV Hasil Percobaan dan Pembahasan... 12
BAB V Penutup... 17 IV.1 Kesimpulan... 17 IV.2 Saran... 17 Daftar Pustaka... 18 Lampiran A. Perhitungan... 19 B. Laporan Sementara... 27 C. Fotocopy Referensi yang Dipakai
v ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
DAFTAR GAMBAR
Gambar 1. Perubahan Konsentrasi Komponen Melalui Fase Gas dan Cairan... 3 Gambar 2. Elemen Bidang Kontak... 5 Gambar 3. Rangkaian Alat Utama... 10 Gambar 4. Grafik Hubungan Waktu vs CO2 Terserap pada Berbagai Laju alir NaOH.... 14
Gambar 5. Grafik Hubungan Laju Alir NaOH vs Konstanta Perpindahan Massa (Kga)... 15
vi ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
DAFTAR TABEL
Tabel 1. Hasil Percobaan pada variabel I…………... 12
Tabel 2. Hasil Percobaan pada variabel II... 12
Tabel 3. Hasil Percobaan pada variabel III... 13
vii ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
INTISARI
Percobaan absorbsi CO2 dengan NaOH bertujuan untuk mempelajari pengaruh
konsentrasi terhadap jumlah CO2 terserap, menentukan besar koefisien perpindahan
massa pada proses absorbsi, dan menentukan waktu terhadap proses absorbsi.
Absorbsi merupakan salah satu proses separasi dalam industri kimia dimana suatu campuran gas dikontakkan dengan suhu cairan penyerap tertentu sehingga satu atau lebih komponen gas tersebut larut dalam cairannya.
Pada percobaan kami, variabel tetapnya adalah normalitas NaOH, yaitu 0,1 N, beda waktu pengambilan sampel, yaitu 2 menit, dan normalitas HCl, yaitu 0,1 N. Variabel berubahnya adalah laju alir NaOH (0,1 L/menit; 0,2 L/menit; 0,4 L/menit; dan 1 L/menit). Yang pertama dalam melakukan praktikum ini adalah membuat larutan NaOH 0,1 N sebanyak 10 L, yaitu menimbang 40 gram NaOH, kemudian melarutkan NaOH 40 gram ke dalam 10 L aquadest. Langkah kedua adalah proses absorbsi, yaitu NaOH dipompa dan diumpankan pada bagian atas menara pada laju alir tertentu, kemudian aliran gas pada CO2 dimasukkan ke dalam absorber, biarkan NaOH dan CO2
saling kontak, setelah 2 menit ambil sampel sebanyak 20 mL. Langkah yang ketiga adalah analisa hasil, ambil sampel sebanyak 10 mL, tambahkan indikator PP, kemudian titrasi dengan HCl sampai warna merah hampir hilang, catat kebutuhan titran sebanyak a mL, tambahkan indikator MO, kemudian titrasi kembali dengan HCl, sampai warna merah oranye, catat kebutuhan titran sebanyak b mL.
Dari hasil percobaan, didapatkan bahwa semakin besar laju alir NaOH, maka normalitas CO2 yang terserap adalah semakin sedikit, pada laju alir 0,1 L/menit, CO2
yang terserap rata-rata sebanyak 0,15022 N; 0,2 L/menit = 0,13438 N; 0,4 L/menit = 0,17 N; dan 1 L/menit = 0,1357 N. Laju alir NaOH 1 L/menit memberikan kesetimbangan yang paling cepat, karena CO2 yang terserap tidak dipengaruhi oleh waktu, atau
mencapai keadaan steady state paling cepat.
Dapat disimpulkan bahwa semakin besar laju alir NaOH, maka CO2 yang
terserap akan semakin banyak, semakin besar laju alir NaOH, maka harga Kga semakin
besar, dan laju alir NaOH 1 L/menit mencapai keadaan steady state paling cepat. Disarankan agar pengamatan TAT harus teliti dan laju alir gas CO2 dibuat konstan.
1 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
BAB I PENDAHULUAN I.1. Latar Belakang
Dalam suatu industri gas-gas pencemar seperti CO2 ataupun CO harus
diserap agar tidak teremisi ke udara luar. Gas karbondioksida meskipun kurang begitu berbahaya dapat menyebabkan efek rumah kaca yang dapat menyebabkan pemanasan global. Dalam suatu pabrik amonia gas CO2 dapat meracuni katalis
besi pada reaktor amonia. Proses penyerapan gas CO2 biasanya dilakukan dengan
menggunakan triethanolamine, diethanolamine, monomethanolamine, sodium carbonat, potassium carbonat, maupun larutan alkali hidroksida atau natrium hidroksida. Dapat juga gas karbon dioksida tersebut diserap dengan menggabungkan penyerap-penyerap yang ada untuk mendapatkan efisiensi penyerapan yang tinggi. Pemilihan penyerap biasanya didasarkan pada efektivitas penyerapannya, mudahnya penyerap diregenerasi, dan faktor lain seperti toksisitas dan korosifitas. Pada percobaan absorbsi CO2 kali ini akan menggunakan larutan
alkali hidroksida dan karbonat (NaOH dan Na2CO3). Pemilihan kedua jenis
penyerap tersebut disebabkan oleh waktu reaksinya yang relatif cepat, harganya murah, dan dapat dengan mudah diregenerasi dengan pelucutan saja. Walaupun demikian adalah penting untuk mengetahui tetapan-tetapan proses dan mengembangkan model matematika proses absorbsi sebagai langkah (titik) awal (start point) untuk mengembangkan proses tersebut ke berbagai skala menurut kebutuhannya.
I.2. Tujuan Percobaan
1. Mempelajari pengaruh laju alir NaOH terhadap CO2 yang terserap.
2. Mempelajari pengaruh laju alir terhadap nilai Kga.
3. Mempelajari pengaruh waktu terhadap absorbsi CO2.
I.3. Manfaat Percobaan
1. Mahasiswa dapat mempelajari pengaruh laju alir NaOH terhadap CO2
yang terserap.
2. Mahasiswa dapat mempelajari pengaruh laju alir terhadap nilai Kga.
2 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
BAB II
LANDASAN TEORI
II.1. Pengertian
Absorbsi merupakan salah satu proses pemisahan dengan mengontakkan campuran gas dengan cairan sebagai penyerapnya. Penyerap tertentu akan menyerap setiap satu atau lebih komponen gas. Pada absorbsi sendiri ada dua macam proses, yaitu:
1. Absorbsi fisik 2. Absorbsi kimia
Absorbsi fisik merupakan absorbsi dimana gas terlarut dalam cairan penyerap tidak disertai dengan reaksi kimia. Contoh absorbsi ini adalah absorbsi gas H2S dengan air, metanol, propilen, dan karbonat. Penyerapan terjadi karena
adanya interaksi fisik, difusi gas ke dalam air, atau pelarutan gas ke fase cair. Dari asborbsi fisik ini ada beberapa teori untuk menyatakan model mekanismenya, yaitu:
1. Teori model film 2. Teori penetrasi
3. Teori permukaan yang diperbaharui
Absorbsi kimia merupakan absorbsi dimana gas terlarut didalam larutan penyerap disertai dengan adanya reaksi kimia. Contoh absorbsi ini adalah absorbsi dengan adanya larutan MEA, NaOH, K2CO3, dan sebagainya. Aplikasi dari
absorbsi kimia dapat dijumpai pada proses penyerapan gas CO2 pada pabrik
amoniak. Penggunaan absorbsi kimia pada fase kering sering digunakan untuk mengeluarkan zat terlarut secara lebih sempurna dari campuran gasnya. Keuntungan absorbsi kimia adalah meningkatnya koefisien perpindahan massa gas, sebagian dari perubahan ini disebabkan makin besarnya luas efektif permukaan. Absorbsi kimia dapat juga berlangsung di daerah yang hampir stagnan disamping penangkapan dinamik.
3 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
A. Teori Model Film
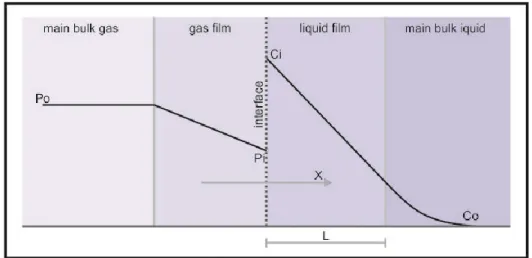
Konsep yang paling banyak digunakan dalam proses absorbsi diberikan oleh teori dua film dari Whiteman (1923). Menurut teori ini, material dipisahkan dari fase (bulk fase) oleh aliran konveksi (convection currents) dan perbedaan konsentrasi dapat disebabkan dalam batas antara fase. Di samping itu dari batas dapat dianggap bahwa arah alirannya keluar dan keberadaan dari lapisan tipis (film) fluida yang mempengaruhi perpindahan dipengaruhi oleh difusi molekuler satu film sedikit lebih tebal dibandingkan sub layer laminer. Karena film memberikan tahanan ekivalen daripada seluruh lapisan batas. Menururt hukum Fick (1855), laju alir perpindahan massa oleh difusi adalah sebanding dengan gradien konsentrasi dan luas penampang lapisan batas tempat difusi itu terjadi. Arah perpindahan material tegak lurus dengan bidang batas perpindahan massa, bagaimanapun tidak tergantung pada perbedaan konsentrasi tetapi berhubungan dengan kesetimbangan fase komponen yang bereaksi. Faktor pengendali merupakan faktor yang berpengaruh perpindahan massa difusi yang paling lambat, yakni disaat semua hambatan diabaikan.
Gambar 1. Perubahan konsentrasi komponen melalui fase gas dan cairan
Dimana:
Po: tekanan parsial dalam fase gas (bulk gas) Pi: tekanan parsial pada batas
4 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
B. Teori Penetrasi
Teori penetrasi (Higbie, 1935) menganggap bahwa arus putar berjalan dari fase bulk ke interface, dan berhenti pada waktu tertentu. Solute dianggap masuk ke dalam putaran dan menetap pada interface untuk beberapa saat melalui proses difusi molekul secara unsteady state. Model ini menyatakan bahwa koefisien perpindahan massa berbanding langsung dengan akar kuadrat difusifitas molekuler.
C. Teori Permukaan yang Diperbaharui
Teori permukaan yang diperbaharui (Danckwerts, 1951) menunjukkan bahwa adanya zona yang mempunyai elemen-elemen permukaan dengan waktu keberadaan yang tak terhingga dan fungsi distribusi umur permukaan. Teori ini dapat membantu kita untuk memvisualisasikan mekanisme perpindahan massa pada interface dan juga untuk mengetahui ketergantungan difusifitas molekuler secara eksponensial terhadap koefisien perpindahan massa.
Absorbsi kimia merupakan absorbsi dimana gas terlarut di dalam larutan penyerap disertai dengan adanya reaksi kimia. Contoh absorbsi ini adalah absorbsi dengan adanya larutan MEA, NaOH, K2CO3, dan sebagainya. Aplikasi dari
absorbsi kimia dapa dijumpai pada proses penyerapan gas CO2 pada pabrik
amoniak. Penggunaan absorbsi kimia pada fase kering sering digunakan untuk mengeluarkan zat terlarut secara lebih sempurna dari campuran gasnya. Keuntungan absorbsi kimia adalah meningkatnya koefisien perpindahan massa gas, sebagian dari perubahan ini disebabkan makin besarnya luas efektif permukaan.
Untuk memperluas permukaan kontak digunakan kolom berisi packed (packed kolom) dengan kriteria pemilihan packing sebagai berikut:
1. Memiliki luas permukaan terbasahi tiap unit volume yang besar
2. Memiliki ruang kosong yang cukup besar sehingga kehilangan tekanan kecil
3. Karakteristik pembasahan baik
4. Densitas kecil agar berat kolom keseluruhan kecil 5. Tahan korosi dan ekonomis
5 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
II.2. Laju Absorbsi
Di dalam merancang suatu menara absorbsi, harga koefisien perpindahan massa merupakan besaran yang sangat penting. Penurunan korelasi harga Kga
berdasarkan pada absorbsi fisik. Dengan adanya harga Kga dapat ditentukan
besaran-besaran lainnya seperti:
1. Kecepatan perpindahan massa
Kecepatan perpindahan massa dapat dihitung setelah konsentrasi gas yang berkesinambungan dengan fase cairnya diketahui. Dalam hal ini gas harus berdifusi ke aliran cairan tiap satuan waktu.
2. Waktu operasi
Jika harga Kga diketahui maka kecepatan perpindahan massanya dapat
juga ditentukan sehingga waktu operasi bisa dihitung pula. 3. Ukuran alat dan bahan
Untuk mengetahu dimensi alat dan besarnya biaya pembuatan alat tersebut, dapat diturunkan dari persaman berikut:
HOG= GM
Kga.P (1)
Keterangan:
HOG = tinggi transfer unit total gas (ft)
GM = laju alir gas (lbmol/dt)
Kga = koefisien perpindahan massa total (lbmol/dt, ft)
P = tekanan total kolom (lb/ft2)
Rumus untuk menentukan harga Kga dapat didasarkan pada absorbsi fisik
dengan menganggap bahwa kurva kesetimbangan berurutan pada selang waktu tertentu dimana perpindahan massa berlangsung.
6 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
Dari skema tersebut didapat persamaan:
dGy=Kga.P y-y0 dz (2)
Kecepatan perpindahan massa dapat ditentukan berdasarkan persamaan yang diturunkan oleh Maxwell dan Stefan (Bird et all, 1960):
NA= DAB R.T.Z.Pt×
(YA1-YA2)
1-YA .m (3)
Dengan, N=NA.A (4)
Persamaan tersebut merupakan persamaan untuk difusi gas dalam keadaan tetap di komponen A melalui B yang tidak bergerak dan gas berdifusi dalam tubuh gas ke permukaan batas gas-cair. Dari persamaan tersebut dapat digunakan untuk mencari korelasi Kga, yaitu:
Kga=(Z.A.∆P.f)N
(5)
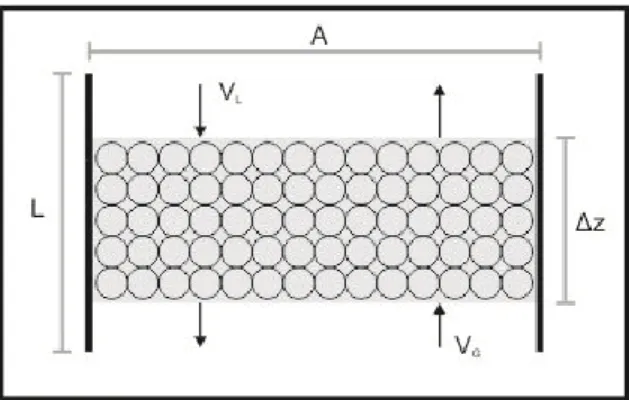
Neraca massa A pada fase cair di sepanjang elemen volume A.∆z, menghasilkan persamaan: d(VL A L) dz = π.D2 4 -DAa d[A] dx L-εL(-r A ) (6)
Neraca massa A pada fase gas pada elemen volume yang sama menghasilkan persamaan: d(VGPA R.Tb) dz = d dz VL A L =N A.a
(7)
Pada absorbsi CO2 dengan larutan NaOH, terjadi reaksi: CO2 (g) + 2NaOH (l) → Na2CO3 (l) + H2O
Jika laju reaksi pembentukan Na2CO3 jauh lebih besar dibandingkan laju difusi
CO2 kedalam larutan NaOH, maka konsentrasi CO2 pada batas film cairan dengan bahan utama cairan adalah nol. Hal ini disebabkan oleh konsentrasi CO2 yang sangat cepat selama reaksi di sepanjang film.
Pada reaksi instan (sangat cepat), bilangan Ha (Ha=( L(k1 B 1 DA) 1 2) >>>1, maka konsentrasi reaktan akan habis pada posisi X*<L. Hal ini berakibat
7 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
[A]L=0. Letak X*
adalah pada suatu tempat dimana fluks A dari antar muka dan B dari badan utama cairan berada pada perbandingan stoikiometri. Pada kasus ini, perbandingan stoikiometri A terhadap B adalah 1:2, maka berlaku persamaan:
-D [A]X**-[A]-0 0 =2.DB [B]L-[B]X*
L-X* (8)
[A]0= γ-β [A]*
1+γ (9)
Dan enchancement faktor E =1+β
Dengan γ=Kga.L
DA.α ; β=2 DB[β]L
DA[A]* (10)
Tebal film (X*) dapat ditentukan dengan menganggap bahwa semua CO2 yang berpindah dari fase gas ke fase cair habis bereaksi sepanjang film.
-DA [A]X**-[A]-0 0 =NA (11)
X*=DA[A]0 NA =
-DAPA NART
II.3. Aplikasi Absorbsi
Absorbsi dalam dunia industri digunakan untuk meningkatkan nilai guna dari suatu zat dengan cara merubah fasenya.
1. Proses Pembuatan Formalin
Formalin yang berfase cair berasal dari formaldehid yang berfase gas dapat dihasilkan melalui proses absorbsi.Teknologi proses pembuatan formalin Formaldehid sebagai gas input dimasukkan ke dalam reaktor. Output dari reaktor yang berupa gas yang mempunyai suhu 182 oC didinginkan pada kondensor hingga suhu 55oC,dimasukkan ke dalam absorber. Keluaran dari absorber pada tingkat I mengandung larutan
8 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
formalin dengan kadar formaldehid sekitar 37-40%. Bagian terbesar dari metanol, air,dan formaldehid dikondensasi di bawah air pendingin bagian dari menara, dan hampir semua removal dari sisa metanol dan formaldehid dari gas terjadi dibagian atas absorber dengan counter current contact dengan air proses.
2. Proses Pembuatan Asam Nitrat
Pembuatan asam nitrat (absorpsi NO dan NO2).Proses pembuatan
asam nitrat Tahap akhir dari proses pembuatan asam nitrat berlangsung dalam kolom absorpsi. Pada setiap tingkat kolom terjadi reaksi oksidasi NO menjadi NO2 dan reaksi absorpsi NO2 oleh air menjadi
asam nitrat. Kolom absorpsi mempunyai empat fluks masuk dan dua fluks keluar. Empat fluks masuk yaitu air umpan absorber, udara pemutih, gas proses, dan asam lemah. Dua fluks keluar yaitu asam nitrat produk dan gas buang. Kolom absorpsi dirancang untuk menghasilkan asam nitrat dengan konsentrasi 60% berat dan kandungan NOx gas buang tidak lebih dari 200 ppm.
II.4. Sifat Fisis dan Kimia Reagen 1. Karbondioksida (CO2)
a. Sifat Kimia:
BM = 44,01 gr/mol
Titik Beku = -56,6ᵒC (5,2 atm)
Daya larut dalam air 0,034 M (99,63% dari jumlah ini adalah dalam bentuk molekul-molekul CO2 dan sisanya berupa
H2CO3).
Merupakan senyawa molekuler yang volatil. b. Sifat Fisis:
Suatu gas tak berwarna, tak menyala, dan tak berbau. Gas ini 11/2
kali lebih berat dari udara. 2. Natrium Hidroksida (NaOH)
9 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
BM = 46 gr/mol
TD/TL = 39ᵒC/384ᵒC
Mudah larut dalam air.
Daya larut dalam air 2 gr/100 ml pada 0ᵒC.
Padatannya meleleh pada 318,4ᵒC. b. Sifat Fisis:
Zat padat higroskopik, berwarna putih, sedikit tembus cahaya, dan bertekstur serat.
10 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
BAB III
PELAKSANAAN PERCOBAAN III.1. Bahan dan Alat yang Digunakan
A. Bahan yang Digunakan 1. NaOH 2. Gas CO2 3. Udara 4. Aquadest 5. HCl 6. PP 7. MO
B. Alat yang Digunakan 1. Tabung CO2
2. Kolom Packing 3. Tangki NaOH 4. Pompa
5. Manometer III.2. Gambar Alat Utama
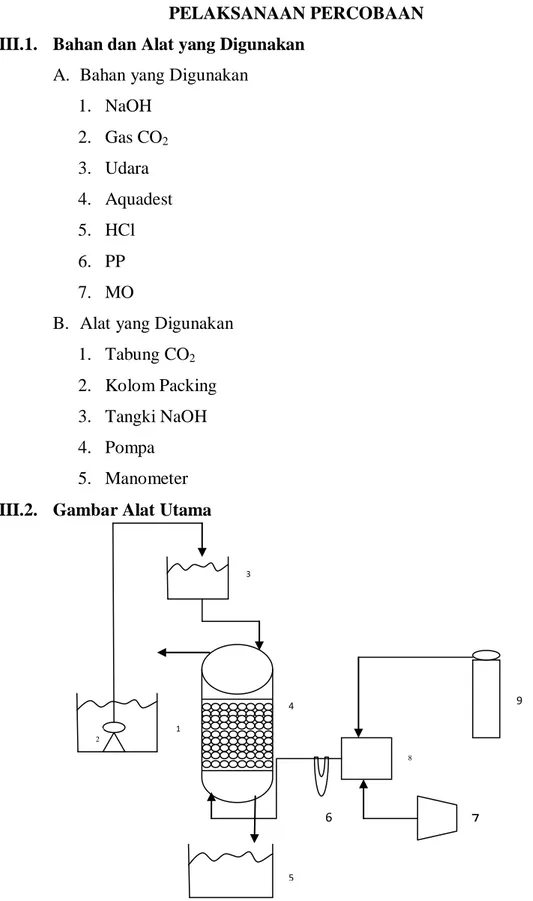
Gambar 3. Rangkaian Alat Utama
1 2 3 4 5 6 7 8 9
11 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
Keterangan:
1. Tangki NaOH bawah 2. Pompa celup
3. Tangki NaOH atas 4. Packed bed absorber
5. Tangki penampung hasil absorbsi 6. Manometer
7. Kompresor
8. Tabung pencampur udara dan CO2
9. Tabung gas CO2
III.3. Variabel Operasi
1. Variabel tetap: Konsentrasi NaOH (0,1 N), Laju alir CO2 (0,66 L/menit),
Δt = 2 menit
2. Varabel berubah: Laju alir NaOH (0,1 lt/mnt, 0,2 lt/mnt, 0,4 ltr/mnt, 1 ltr/mnt).
III.4. Prosedur Percobaan A. Operasi Absorbsi
1. NaOH dipompa dan diumpankan pada bagian atas menara pada laju alir tertentu.
2. Alirkan udara yang mengandung CO2 pada bagian bawah kolom.
3. Biarkan gas CO2 dan NaOH kontak hingga aliran keluar bawah
kolom steady.
4. Ambil sampel pada waktu ke-0
5. Ambil sampel setiap 2 menit, operasi dihentikan setelah volume titran 3 kali konstan.
6. Ulangi langkah 2-5 untuk laju alir NaOH berikutnya. B. Analisis Hasil
1. Ambil sampel 10 ml.
2. Tambahkan indikator PP, kemudian titrasi dengan HCl hingga warna merah hampir hilang (kebutuhan HCl = a ml).
3. Tambahkan indikator MO, kemudian titrasi dengan HCl hingga warna merah oranye (kebutuhan HCl = b ml).
12 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
BAB IV
HASIL PERCOBAAN DAN PEMBAHASAN IV.1. Hasil Percobaan
a. Variabel I
Laju alir NaOH = 0,1 L/menit
∆z1 (udara) = 0,8 cm
∆z2 (udara+CO2) = 1,8 cm
∆H (tinggi unggun) = 5 cm
Tabel 1. Hasil Percobaan variabel I
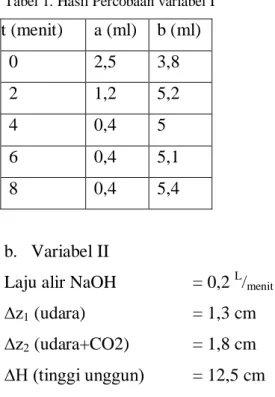
t (menit) a (ml) b (ml) 0 2,5 3,8 2 1,2 5,2 4 0,4 5 6 0,4 5,1 8 0,4 5,4 b. Variabel II
Laju alir NaOH = 0,2 L/menit
∆z1 (udara) = 1,3 cm
∆z2 (udara+CO2) = 1,8 cm
∆H (tinggi unggun) = 12,5 cm
Tabel 2. Hasil Percobaan variabel II
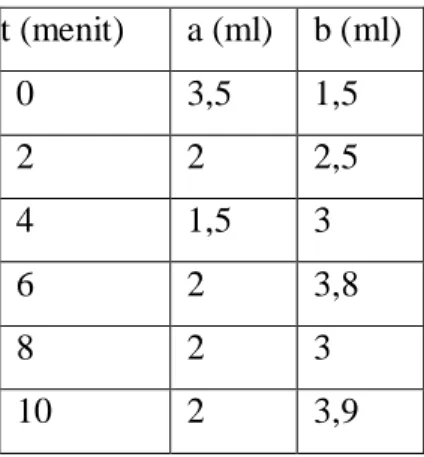
t (menit) a (ml) b (ml) 0 3,5 1,5 2 2 2,5 4 1,5 3 6 2 3,8 8 2 3 10 2 3,9
13 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
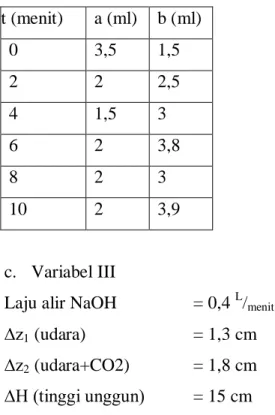
c. Variabel III
Laju alir NaOH = 0,4 L/menit
∆z1 (udara) = 1,3 cm
∆z2 (udara+CO2) = 1,8 cm
∆H (tinggi unggun) = 15 cm
Tabel 3. Hasil Percobaan variabel III
t (menit) a (ml) b (ml) 0 3,8 2,7 2 2 2,5 4 1,8 4 6 2,3 4,6 8 2 4,9 d. Variabel IV
Laju alir NaOH = 1 L/menit
∆z1 (udara) = 1,2 cm
∆z2 (udara+CO2) = 1,7 cm
∆H (tinggi unggun) = 14 cm
Tabel 4. Hasil Percobaan variabel IV
t (menit) a (ml) b (ml) 0 2,3 1,7 2 2 2,8 4 2,2 3,4 6 2,3 2,7 8 2,3 2,8
14 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
IV.2. Pembahasan
1. Pengaruh Laju Alir NaOH Terhadap CO2 Terserap
Gambar 4.
Grafik Hubungan Laju Alir NaOH dengan CO2 Terserap pada Berbagai Waktu
Grafik diatas menggambarkan hubungan antara waktu yang berada pada sumbu x dan Normalitas CO2 terserap yang berada pada sumbu y
dengan berbagai laju alir cairan. Dari grafik diatas dapat dilihat bahwa pada waktu yang sama, yaitu 8 menit laju alir NaOH 0,4 L/menit menyerap CO2 terbanyak yaitu 0,3643 N, selanjutnya adalah laju alir
NaOH 0,1 L/menit menyerap CO2 sebanyak 0,3062 N, dan laju alir NaOH
0,2 L/menit serta 1 L/menit menyerap CO2 yang cenderung sama yaitu
0,26 N. Jika menganggap bahwa laju alir NaOH 0,1 L/menit merupakan data yang eror. Maka pada waktu 8 menit akan memberikan kurva parabola. Jadi, ketika laju alir 0,2 L/menit menuju laju alir 0,4 L/menit, maka CO2 yang terserap akan bertambah banyak. Sedangkan ketika laju
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45 0 5 10 15 N C O2 te rs era p (N ) Waktu (menit)
Laju alir 0,1 L/menit Laju alir 0,2 L/menit Laju alir 0,4 L/menit Laju alir 1 L/menit
15 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
alir diperbesar menjadi 1 L/menit, maka CO2 yang terserap akan semakin
sedikit.
Hal ini dapat terjadi karena waktu kontak antara larutan NaOH dengan CO2 cukup baik untuk mencapai kesetimbangan pada laju alir
NaOH 0,2 L/menit dan 0,4 L/menit. Sedangkan pada laju alir 1 L/menit mengalami penurunan karena waktu kontak yang dibutuhkan tidak mencukupi untuk mencapai kesetimbangan reaksi. Pada proses absorbsi CO2 dengan menggunakan larutan NaOH sebagai penyerapnya merupakan
absorbsi yang menghasilkan reaksi kimia. Jadi, CO2 yang terserap dapat
dipengaruhi oleh waktu kontak atau lama kontak dengan larutan NaOH. (Reff: Maarif Fuad dan F. Arif Januar, “Absorbsi Gas Karbondioksida
(CO2) dalam Biogas dengan Larutan NaOH secara Kontinyu)
2. Pengaruh Laju Alir NaOH Terhadap Konstanta Perpindahan Massa Gas (Kga)
Gambar 5.
Grafik Hubungan Laju Alir NaOH dengan Konstanta Perpindahan Massa (Kga)
Grafik diatas menunjukan hubungan laju alir NaOH dengan konstanta perpindahan massa gas (Kga). Dapat dilihat bahwa kenaikan laju
alir larutan penyerap (NaOH) dapat meningkatkan koefisien perpindahan
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 0,16 0,18 0 0,2 0,4 0,6 0,8 1 1,2 KG a (/ m 3. m en it )
Laju Alir NaOH (L/menit)
16 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
massa antar fase gas-cair. Hal ini dapat terjadi, karena dengan semakin tinggi laju alir cairan, maka kontak antara gas dengan cairan semakin baik. Dengan demikian, maka jumlah gas yang didapat berpindah dari fase gas menuju fase cairan juga semakin besar.
(Reff: Kumoro Andri Cahyo dan Hadiyanto, “Absorpsi Gas Karbondioksida dengan Larutan Soda Api dalam
Kolom Unggun Tetap”)
3. Pengaruh Waktu Terhadap CO2Terserap
Gambar 6.
Grafik Hubungan Waktu dengan CO2 Terserap pada Berbagai Laju Alir NaOH
Gambar 6 menunjukan hubungan waktu dengan Konsentrasi CO2
yang terserap pada berbagai laju alir NaOH. Dapat dilihat untuk semua laju alir NaOH, semakin lama waktu, konsentrasi CO2 yang terserap
semakin banyak. Hal ini dikarenakan semakin lama waktu kontak antara NaOH dengan CO2 reaksi akan menuju ke kesetimbangan (jenuh). Pada
awalnya akan terjadi peningkatan jumlah CO2 yang terserap, kemudian
pada suatu waktu jumlah CO2 yang terserap akan konstan. Sehingga dapat
ditarik kesimpulan bahwa setelah terjadi kesetimbangan, jumlah CO2 yang terserap akan konstan seiring dengan waktu pada proses kontinyu.
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45 0 2 4 6 8 10 12 N C O2 te rs e ra p (N ) Waktu (menit)
Laju alir 0,1 L/menit Laju alir 0,2 L/menit Laju alir 0,4 L/menit Laju alir 1 L/menit
17 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
BAB V PENUTUP
V.1. Kesimpulan
1. Pada laju alir NaOH 0,2 L/menit dan 0,4 L/menit, konsentrasi CO2 yang
terserap akan semakin banyak. Tetapi dari laju alir penyerap 0,4 L/menit
sampai 1 L/menit CO2 yang terserap akan semakin sedikit.
2. Semakin besar laju alir NaOH, maka nilai konstanta perpindahan massa (Kga) semakin besar.
V.2. Saran
1. Pengamatan TAT saat titrasi harus teliti. 2. Laju alir gas CO2 diusahakan konstan.
18 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
DAFTAR PUSTAKA
Brown, GG. 1950.Unit Operation. John Willey & Sons Inc, New York.
Ludwig, Ernest E. 1979. Applied Process Design for Chemical and Petrochemical
Plants, Vol II 2nd edition. Gulf Publishing Company, Houston Texas. Jerry Meldon. 1999. Simplify Calculations Chemical Reactions. Hydrocarbon Processing, p 87-91.
Perry, RH. 1984. Chemical Engineering Handbook, 6th edition. Mc Graw Hill Book Co, Singapore.
Treyball, RE. 1981. Mass Transfer Operation, 3rd edition. Mc Graw Hill Book Co, Ltd.
Octave, J.L., F.J. Benitez, J.B. Herelia, and C. Rodriguez. 1990. Absorbtion of Carbon Dioxide into Aqueous Solution of Triethanolamine. AIChE Journal 39, p 1263-1266.
Maarif, Fuad; Januar Arif F. 2008. Absorbsi Gas Karbondioksida (CO2)
dalam Biogas dengan Larutan NaOH secara Kontinyu. Jurnal Jurusan Teknik Kimia Fakultas Teknik Universitas Diponegoro Semarang. Kumoro Andri Cahyo dan Hadiyanto. 2000. Absorpsi Gas Karbondioksida dengan Larutan Soda Api dalam Kolom Unggun Tetap. Forum Teknik Jilid 24, No.2, Juli 2000
19 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
LEMBAR PERHITUNGAN A. Perhitungan Reagen
1. Larutan NaOH 0,1 N , 12 liter 𝑁 = 𝐵𝑀𝑚 ×1000𝑉 × 𝑣𝑎𝑙𝑒𝑛𝑠𝑖 0,1 = 𝑚 40× 1000 12000× 1 𝑚 = 48 𝑔𝑟𝑎𝑚 2. Larutan HCL 0,1 N , 250 ml 𝑁 = 𝜌 × 𝑉 𝐵𝑀 × 1000 𝑉 × 𝑘𝑎𝑑𝑎𝑟 × 𝑣𝑎𝑙𝑒𝑛𝑠𝑖 𝑁 = 1,318 × 𝑉 36,5 × 1000 250 × 0,25 × 1 𝑉 = 2,77 𝑚𝑙
B. Perhitungan laju alir CO2 𝜌𝑟𝑎𝑘𝑠𝑎 = 13,55 𝑘𝑔/𝑚3 𝜌𝐶𝑂2 = 1,782 𝑘𝑔/𝑚3 𝐷1 = 3 𝑐𝑚 = 3 × 10−2 𝑚 𝑆1 = 1 4 𝜋𝐷2 = 1 4 × 3,14 × (3 × 10−2)2 = 7,065 × 10−4 𝑚2 𝐷2 = 1,5 𝑐𝑚 = 1,5 × 10−2 𝑚 𝑆2 = 1 4 𝜋𝐷2 = 1 4 × 3,14 × (1,5 × 10−2)2 = 1,766 × 10−4 𝑚2
a) Perhitungan laju alir gas CO2 dari udara dan kompresor (Q3)
20 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
= (13,5 − 1,782) × 9,8 × ( 1,8 × 10−2) = 2,07 𝑃𝑎 𝑉𝐶𝑂2+𝑢𝑑𝑎𝑟𝑎 = 2∝×𝑔𝑐 ( −∆𝑃 𝜌 𝐶𝑂2 )−𝛴𝐹 (𝑆1 𝑆2)−1 = 2×1×1( 2,07 1,782)−0 (7,065 ×10−41,766 ×10−4)−1 = 0,88 𝑚 𝑠 𝐿𝑎𝑗𝑢 𝑎𝑙𝑖𝑟𝐶𝑂2+𝑢𝑑𝑎𝑟𝑎 = (𝑉𝑟𝑎𝑘𝑠𝑎 + 𝑉𝐶𝑂2 )× 𝑆𝑖 = 0,88 × (7,065 × 10−4) = 6,21 × 10−4 𝑚3 𝑠 = 0,621𝑠𝑙
C. Perhitungan laju alir udara (Q1)
−∆𝑃1 = (𝜌𝑟𝑎𝑘𝑠𝑎 − 𝜌𝑈𝑑𝑎𝑟𝑎 ) × 𝑔 × ∆𝑧 𝑢𝑑𝑎𝑟𝑎 + 𝐶𝑂2 = (13,5 − 1,782) −9,8 × ( 1,15 × 10−2) = 1,39 𝑃𝑎 𝑉𝑢𝑑𝑎𝑟𝑎 = 2 ∝× 𝑔𝑐( −∆𝑃 𝜌 𝑢𝑑𝑎𝑟𝑎 ) − 𝛴𝐹 (𝑆1 𝑆2) − 1 𝑉𝑢𝑑𝑎𝑟𝑎 = 2 × 1 × 1( 1,39 1,766) − 0 (7,0651,766) − 1 = 0,86𝑚𝑠 𝐿𝑎𝑗𝑢 𝑎𝑙𝑖𝑟𝑢𝑑𝑎𝑟𝑎 = (𝑉𝑢𝑑𝑎𝑟𝑎)× 𝑆𝑖 = 0,86 × (7,065 × 10−4) = 6,076𝑚𝑠3
21 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
= 0,61𝑠𝑙
D. Penentuan kadar CO2 mula – mula ↓ Q1 (udara) Q2 CO2 Neraca total Q3 = Q1 + Q2 Q2 = Q3 – Q1 = 0,621 – 0,61 = 0.011𝐿𝑠 = 0,66𝑚𝑒𝑛𝑖𝑡𝐿
Neraca komponen CO2 Q3× 𝐶3= Q1× 𝐶1 + Q2× 𝐶2 𝑄2×𝐶2 𝑄3 = 𝐶3……….(1) Mencari C2 P = 7,3 bar R = 0,08314 𝑚𝑜𝑙 𝐾𝐿 𝑏𝑎𝑟 T = 250C = 298 K 𝑃 × 𝑉 = 𝑛 × 𝑅 × 𝑇 𝑛 𝑌= 𝑃 𝑅 × 𝑇 𝐶2 = 7,3 0,08314 × 298 = 0,2946 𝐶3 =𝑄2× 𝐶2 𝑄3 = 0,011 × 0,2946 0,621 = 5,22 × 10−3 𝑚𝑜𝑙 𝐿 Q3 (udara + CO2)
22 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
E. Perhitungan Hasil Percobaan
Jika kebutuhan 𝑎 > 𝑏, maka ; 𝐶𝐶𝑂2 terserap Na2CO3
n Na2CO3 =
2 𝑏× 𝑁𝐻𝐶𝑙 𝑣𝑎𝑙 × 𝑉𝑠𝑎𝑚𝑝𝑒𝑙
n NaOH = 𝑣𝑎𝑙 × 𝑉𝑠𝑎𝑚𝑝𝑒𝑙 𝑎−𝑏 × 𝑁𝐻𝐶𝑙
Jika kebutuhan 𝑎 < 𝑏, maka ; 𝐶𝐶𝑂2 terserap = mol Na2CO3 t mol
NaHCO3 n Na2CO3 = 2 𝑎 × 𝑁𝐻𝐶𝑙 𝑣𝑎𝑙 × 𝑉𝑠𝑎𝑚𝑝𝑒𝑙 n NaHCO3 = 𝑏−𝑎 × 𝑁𝐻𝐶𝑙 𝑣𝑎𝑙 × 𝑉𝑠𝑎𝑚𝑝𝑒𝑙 Perhitungan 𝑁𝐶𝑂2 𝑡𝑒𝑟𝑠𝑒𝑟𝑎𝑝 = 𝐶𝐶𝑂2 𝑡𝑒𝑟𝑠𝑒𝑟𝑎𝑝 × 𝑄2 × 𝑡 Variabel I
Laju alir NaOH = 0,1𝑚𝑒𝑛𝑖𝑡𝑙 ; 𝑁𝐻𝐶𝑙 = 0,1 𝑁
t (menit) a (ml) b (ml) Na2CO3 NaHCO3 CO2 terserap N CO2 0 2,5 3,8 0,05 0,013 0,063 0 2 1,2 5,2 0,024 0,04 0,064 0,0845 4 0,4 5 0,008 0,046 0,054 0,1426 6 0,4 5,1 0,008 0,047 0,055 0,2178 8 0,4 5,4 0,008 0,05 0,058 0,3062
23 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
Variabel II
Laju alir NaOH = 0,2𝑚𝑒𝑛𝑖𝑡𝑙 ; 𝑁𝐻𝐶𝑙 = 0,1 𝑁
t (menit) a (ml) b (ml) Na2CO3 NaHCO3 CO2 terserap N CO2 NaOH 0 3,5 1,5 0,07 - 0,07 0 0,02 2 2 2,5 0,04 0,005 0,045 0,0594 4 1,5 3 0,03 0,015 0,045 0,1188 6 2 3,8 0,04 0,018 0,058 0,2297 8 2 3 0,04 0,01 0,05 0,264 10 2 3,9 0,04 0,09 0,059 0,3894 Variabel III
Laju alir NaOH = 0,4𝑚𝑒𝑛𝑖𝑡𝑙 ; 𝑁𝐻𝐶𝑙 = 0,1 𝑁 t (menit) a (ml) b (ml) Na2CO3 NaHCO3 CO2 terserap N CO2 NaOH 0 3,8 2,7 0,076 - 0,07 0 0,011 2 2 2,5 0,04 0,005 0,045 0,0594 4 1,8 4 0,036 0,022 0,058 0,1531 6 2,3 4,6 0,046 0,023 0,069 0,2732 8 2 4,9 0,04 0,029 0,069 0,3643 Variabel IV
Laju alir NaOH = 1𝑚𝑒𝑛𝑖𝑡𝑙 ; 𝑁𝐻𝐶𝑙 = 0,1 𝑁 t (menit) a (ml) b (ml) Na2CO3 NaHCO3 CO2 terserap N CO2 NaOH 0 2,3 1,7 0,046 - 0,046 0 0,006 2 2 2,8 0,04 0,005 0,048 0,0634 4 2,2 3,4 0,044 0,022 0,056 0,1478 6 2,3 2,7 0,046 0,023 0,05 0,198
24 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
8 2,3 2,8 0,046 0,029 0,051 0,2693
F. Perhitungan Kga
𝐾𝐺𝑎 = 𝑁𝐴 𝐻 × 𝜋𝐷4 × 𝜀2
Ket : KGa = koefisien perpindahan massa gas
NA = Laju alir cairan penyerap
H = Tinggi Packing D = Diameter Packing 𝜀 = Volume kosong Packing
Variabel I 𝐾𝐺𝑎 = 0,1 𝐿 𝑚𝑒𝑛𝑖𝑡 34,5 𝑐𝑚 × 3,14 × 154 2× 104 × 10−3 𝐿= 0,016 𝑐𝑚3× 𝑚𝑒𝑛𝑖𝑡 Variabel II 𝐾𝐺𝑎 = 0,2 𝐿 𝑚𝑒𝑛𝑖𝑡 34,5 𝑐𝑚 × 3,14 × 154 2× 104 × 10−3 𝐿= 0,03 𝑐𝑚3× 𝑚𝑒𝑛𝑖𝑡 Variabel III 𝐾𝐺𝑎 = 0,4 𝐿 𝑚𝑒𝑛𝑖𝑡 34,5 𝑐𝑚 × 3,14 × 154 2× 104 × 10−3 𝐿= 0,06 𝑐𝑚3× 𝑚𝑒𝑛𝑖𝑡 Variabel IV 𝐾𝐺𝑎 = 1 𝐿 𝑚𝑒𝑛𝑖𝑡 34,5 𝑐𝑚 × 3,14 × 154 2× 104 × 10−3 𝐿 = 0,16 𝑐𝑚3× 𝑚𝑒𝑛𝑖𝑡
25 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
- Dari Perry’s Chemical Engineers Handbook didapat rumus 𝐾𝐺𝑎 sebagai berikut : 𝐾𝐺𝑎 × 𝑅 × 𝑇 𝑎𝑝 × 𝐷𝐺 = 𝐴 𝐺 𝑎𝑝 × 𝜇𝐺 0,7 × 𝑁𝑠𝑐𝐺13× 𝑎𝑝 × 𝑑′𝑝 −2,0
Keterangan : 𝐾𝐺𝑎 = Koefisien Perpindahan massa gas R = konstanta gas ideal
T = Suhu
𝑎𝑝 = Permukaan kering packing/volume 𝐷𝐺 = Difusivitas gas
A = -2,0
G = Laju alir gas 𝜇𝐺 = Viskositas gas
𝑁𝑠𝑐𝐺 = Bilangan Schmidt gas 𝑑′𝑝 = ukuran packing Diketahui :
R = 0,08205 𝐿.atm/gr. 𝑚𝑜𝑙. 𝐾 T = 300𝐶 = 303 𝐾
A = -2,0 ; (karena ukuran packing < 0,5 inch) 𝑎𝑝 = 1200/𝑚
𝑑′𝑝 = 6 1200= 5 × 10−3𝑚
G = 0,66 𝐿 𝑚𝑒𝑛𝑖𝑡= 0,011 𝐿 𝑠
𝜇𝐺 = 𝜇𝑢𝑑𝑎𝑟𝑎 (karena konsentrasi CO2 didalam gas sangat kecil) 𝜇𝑢𝑑𝑎𝑟𝑎 = 1,8462 (pada suhu 300 K) 𝑁𝑠𝑐𝐺 = 𝜇𝐺 𝑃𝐺𝐷𝐺 = 1,8462 1,1774 ×(16×10−10) 𝐷𝐺 = 0,0016 𝑚𝑚2 𝑠 = (16 × 10−4) × 10−6𝑚−6 = 16 ×𝑠 10−10𝑚2 𝑠 𝜌𝐺 = 𝜌𝑢𝑑𝑎𝑟𝑎 = 1,1774 𝑘𝑔 𝑚3 𝐾𝐺𝑎 × 𝑅 × 𝑇 𝑎𝑝 × 𝐷𝐺 = 𝐴 𝐺 𝑎𝑝 × 𝜇𝐺 0,7 × 𝑁𝑠𝑐𝐺13× 𝑎𝑝 × 𝑑′𝑝 −2,0
26 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
𝐾𝐺𝑎 × 0,082 × 303 1.200 × 16 × 10−10 = 2 0,011 1.200 × 1,8462 0,7 × 0,098 × 1010 13 × 1.200 × 1.200 × 5 × 10−3 −2,0 𝐾𝐺𝑎 = 8,24 × 10−10
27 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
LAPORAN SEMENTARA
PRAKTIKUM PROSES KIMIA
Materi:
ABSORBSI CO2 DENGAN LARUTAN NaOH
Disusun Oleh:
Group : 3 / A
Anggota : Muliasari Kurniati M. NIM : L2C009004 Muhammad Adi Irawan NIM : L2C009047
Eva Sofiana NIM : L2C009065
LABORATORIUM PROSES KIMIA
TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO
SEMARANG
28 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
I. TUJUAN PERCOBAAN
1. Mempelajari pengaruh laju alir NaOH terhadap CO2 yang terserap. 2. Mempelajari pengaruh laju alir terhadap nilai Kga.
3. Mempelajari pengaruh waktu terhadap absorbsi CO2.
4. Dapat menentukan tetapan laju reaksi antara CO2dan NaOH. II. BAHAN DAN ALAT
1. Bahan yang Digunakan
NaOH Gas CO2 Udara Aquadest HCl PP MO
2. Alat yang Dipakai
Tabung CO2 Kolom Packing Tangki NaOH Pompa Manometer 3. Cara Kerja A. Operasi Absorbsi
a. NaOH dipompa dan diumpankan pada bagian atas menara pada laju alir tertentu.
b. Alirkan udara yang mengandung CO2 pada bagian bawah kolom.
c. Biarkan gas CO2 dan NaOH kontak hingga aliran keluar bawah kolom steady.
29 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
e. Ambil sampel setiap 2 menit, operasi dihentikan setelah volume titran 3 kali konstan.
f. Ulangi langkah 2-5 untuk laju alir NaOH berikutnya. B. Analisis Hasil
a. Ambil sampel 10 ml.
b. Tambahkan indikator PP, kemudian titrasi dengan HCl hingga warna merah hampir hilang (kebutuhan HCl = a ml). c. Tambahkan indikator MO, kemudian titrasi dengan HCl
hingga warna merah oranye (kebutuhan HCl = b ml). d. Hasil Percobaan
a. Variabel I
Laju alir NaOH = 0,1 L/menit
∆z1 (udara) = 0,8 cm
∆z2 (udara+CO2) = 1,8 cm
∆H (tinggi unggun) = 5 cm
Tabel 1. Hasil Percobaan variabel I
t (menit) a (ml) b (ml) 0 2,5 3,8 2 1,2 5,2 4 0,4 5 6 0,4 5,1 8 0,4 5,4 b. Variabel II
Laju alir NaOH = 0,2 L/menit
∆z1 (udara) = 1,3 cm
∆z2 (udara+CO2) = 1,8 cm
∆H (tinggi unggun) = 12,5 cm
30 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
t (menit) a (ml) b (ml) 0 3,5 1,5 2 2 2,5 4 1,5 3 6 2 3,8 8 2 3 10 2 3,9 c. Variabel III
Laju alir NaOH = 0,4 L/menit
∆z1 (udara) = 1,3 cm
∆z2 (udara+CO2) = 1,8 cm
∆H (tinggi unggun) = 15 cm
Tabel 3. Hasil Percobaan variabel III
t (menit) a (ml) b (ml) 0 3,8 2,7 2 2 2,5 4 1,8 4 6 2,3 4,6 8 2 4,9 d. Variabel IV
Laju alir NaOH = 1 L/menit
∆z1 (udara) = 1,2 cm
∆z2 (udara+CO2) = 1,7 cm
∆H (tinggi unggun) = 14 cm
Tabel 4. Hasil Percobaan variabel IV
31 ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
0 2,3 1,7 2 2 2,8 4 2,2 3,4 6 2,3 2,7 8 2,3 2,8 Semarang, 7 April 2011 Mengetahui Asisten, Muhammad Zainuddin