BAB II
TINJAUAN PUSTAKA
2.1. Kista Ovarium 2.1.1. Definisi
Kista ovarium adalah kantung yang berisi cairan maupun material semi cair yang berasal dari jaringan ovarium. Kista ovarium sering muncul pada usia reproduktif dan umumnya bersifat jinak, ukurannya dapat bervariasi. Pada kebanyakan kasus kista ovarium tidak berbahaya, bahkan ada jenis kista yang dapat hilang dengan sendirinya. Meskipun demikian, temuan kista ovarium dapat menyebabkan kecemasan diantara wanita dengan adanya potensi keganasan.1,2
Kista ovarium adalah kantung berisi cairan di dalam maupun pada
permukaan ovarium, kedua ovarium yang terletak pada tiap sisi uterus dan
berukuran sebesar almon akan menghasilkan ovum dan dilepaskan tiap bulan
selama usia reproduksi. Banyak wanita mengalami kista ovarium selama
hidupnya. Kebanyakan kista ovarium tidak dijumpai gejala klinis dan tidak
berbahaya. Mayoritas dari kista ovarium menghilang tanpa terapi dalam
beberapa bulan. Namun beberapa kista ovarium terutama yang mengalami
ruptur sering menyebabkan gejala yang berat. Mengenali gejala dan
pemeriksaan pelvik yang rutin dapat mengurangi masalah tersebut.19
pembedahan. Ada dua jenis utama dari kista ovarium; (1) kista ovarium fungsional, merupakan tipe utama. Kista ini tidak berbahaya dan merupakan bagian dari siklus menstruasi yang normal dan dapat menghilang sendirinya (2) kista patologis, ini merupakan jenis kista yang tumbuh pada ovarium dan dapat bersifat jinak maupun ganas.20
2.1.2. Insidensi dan Faktor Resiko 2.1.2.1Insidensi
22,430 kanker ovarium kasus baru di AS pada tahun tersebut. Data SEER juga menunjukkan peningkatan insidensi yang besar dari kanker ovarium tiap tahunnya diantara wanita berumur ≥65.3,4,5,6,7,8,9
Di Indonesia, insiden kista ovarium ditemukan 2,39% - 11,7% pada seluruh penderita ginekologi yang dirawat. Pada penelitian Suryati (2014) di Makassar, ditemukan insiden kista ovarium hanya sebesar 0,4% pada wanita usia subur dan 99,546% pada non usia subur. Jumlah kasus kista ovarium di Propinsi Sumatera Utara bervariasi. Menurut penelitian Safitri (2010), di RSUP H. Adam Malik Medan pada tahun 2008-2009 terdapat jumlah seluruh penderita kista ovarium sebanyak 47 orang dan di RS Dr. Pirngadi Medan dari bulan Januari 2010- Oktober 2010 penderita kista ovarium pada wanita usia subur terdata sebanyak 34 kasus. Sementara itu Siringo (2012), menemukan jumlah kasus kista ovarium di RS. ST. Elisabeth Medan dari tahun 2008-2012 sebanyak 116 kasus.21,22,23
2.1.2.2 Faktor Resiko
Parazzini dkk (1999) melakukan evaluasi faktor resiko untuk kista ovarium fungsional dan menemukan bahwa kista ovarium berhubungan dengan usia, status menarche, gangguan menstruasi, indeks massa tubuh, sedangkan hubungan yang sedikit dijumpai pada resiko kista ovarium fungsional dengan merokok, status perkawinan, atau usia saat menikah.24
stimulating hormone (FSH). Dalam penggunaan obat- obatan yang merangsang ovulasi atau misalkan pola hidup yang tidak sehat dan obesitas bisa menyebabkan ketidakseimbangan hormon. Gangguan keseimbangan hormon dapat berupa peningkatan Luteinizing Hormone (LH) yang menetap sehingga dapat menyebabkan gangguan ovulasi yang menimbulkan pembentukan kista.24,25,26,27
Riwayat kista ovarium sebelumnya; riwayat keluarga pernah menderita kista ovarium sebelumnya menunjukkan risiko sebesar 5-10% untuk memiliki kelainan genetik yang diwariskan. Ras putih, tinggal di Amerika Utara dan Eropa Utara juga ditemukan sebagai faktor risiko kista ovarium. Perempuan ras putih akan memiliki risiko 30-40% lebih tinggi kista ovarium dibandingkan dengan perempuan kulit hitam dan Hispanik. Patogenesis peningkatan risiko pada suatu ras ini belum diketahui secara jelas.24,26,28,29,30,31,32
Infertilitas dan pengobatan infertilitas; pasien infertilitas yang diterapi dengan induksi ovulasi menggunakan gonadotropin atau agen lainnya, seperti
tubuh bagian atas, juga merupakan faktor risiko terjadinya kista ovarium. Pada wanita yang sudah menopause kista fungsional tidak terbentuk karena menurunnya aktivitas indung telur.35
Terapi Tamoksifen pada karsinoma mammae; penderita karsinoma mammae yang pernah menjalani kemoterapi dengan Tamoxifen dapat menderita kista ovarium. Tamoxifen dapat menyebabkan kista ovarium fungsional jinak yang biasanya menghilang dengan penghentian pengobatan tersebut.36 Gangguan siklus haid; gangguan siklus haid yang sangat pendek atau lebih panjang harus diwaspadai. Menstruasi di usia dini yaitu 11 tahun atau lebih muda merupakan faktor risiko berkembangnya kista ovarium, wanita dengan siklus haid tidak teratur juga merupakan faktor risiko kista ovarium.35,37
Pemakaian alat kontrasepsi hormonal; wanita yang menggunakan alat kontrasepsi hormonal juga merupakan faktor risiko kista ovarium, yaitu pada wanita yang menggunakan alat kontrasepsi hormonal berupa implan, akan tetapi pada wanita yang menggunakan alat kontrasepsi hormonal berupa pil cenderung memiliki risiko yang rendah untuk terkena kista ovarium. Upaya-upaya untuk mencegah ovulasi dengan penggunaan kontrasepsi oral kombinasi jangka panjang dianggap dapat mengurangi risiko kista ovarium sebesar 50%. Durasi perlindungan berlangsung sampai dengan 25 tahun setelah penggunaan terakhir. Pemberian regimen terapi pengganti estrogen setelah menopause juga akan meningkatkan risiko kista ovarium.31,38,39
akan menurun pada wanita yang memberikan ASI dimana hal ini mungkin memiliki efek perlindungan dengan memperpanjang periode amenore.31,41,42
Usia; peningkatan risiko yang juga dikaitkan dengan kista ovarium adalah bertambahnya usia, menarche dini dan menopause terlambat. Proses pertambahan usia akan memungkinkan perpanjangan waktu untuk menyebabkan perubahan genetik secara acak dalam epitel permukaan ovarium. Faktor risiko yang berhubungan dengan siklus ovulasi yang tidak terganggu selama bertahun-tahun juga menimbulkan hipotesa bahwa stimulasi yang berulang pada epitel permukaan ovarium akan menyebabkan perubahan. Teori patogenesis kista ovarium ini disebut dengan hipotesis “incessant ovulation”. Proses perbaikan jaringan epitel ovarium akibat periode panjang
ovulasi yang berulang dan siklik menyebabkan proliferasi seluler yang cukup sering. Hal ini akan dapat memicu adanya mutasi gen p53 pada fase DNA. Sehingga peristiwa ini dianggap berkontribusi terhadap proses tumorigenesis kista ovarium.43,44
2.1.3. Diagnosis Diferensial untuk Massa Ovarium
Membedakan penyakit jinak dari ganas penting tidak hanya untuk memastikan manajemen yang tepat oleh ahli bedah onkologi ginekologi bila diduga suatu keganasan, tetapi juga untuk menghindari prosedur yang tidak penting termasuk pembedahan, kecemasan pada wanita dengan kondisi kista asimtomatik, non malignan. Sampai saat ini tidak ada model tunggal atau panduan rujukan evaluasi massa adneksa yang diterima luas di seluruh dunia. Penilaian yang seksama pada pasien harus dilakukan menurut panduan terkini. Penilaian klinis termasuk riwayat keluarga, pemeriksaan fisik yang termasuk pemeriksaan vaginal dan abdominal. Bila dijumpai nyeri mendadak maka harus dipikirkan diagnosis torsio kista ovarii, ruptur kista ataupun perdarahan.46,47
CA-125 tidak dapat diandalkan untuk membedakan massa ovarium jinak dari ganas pada wanita premenopause karena meningkatnya hasil positif palsu. Pada wanita kadar CA-125 dapat tinggi pada penyakit ginekologis jinak seperti endometriosis, fibroid, infeksi pelvik, tetapi juga pada kondisi fisiologis seperti kehamilan atau fase siklus menstruasi. Kadar HE4 tidak dipengaruhi oleh kehamilan atau siklus menstruasi dan tidak pernah meningkat pada pasien dengan endometriosis atau massa ovarium jinak lainnya.48,49
campuran), vaskularisasi dengan menggunakan power-color doppler dan hubungannya dengan struktur sekitarnya.50,51
Dalam beberapa tahun belakangan, sistem skoring telah menunjukkan kriteria yang lebih objektif dalam membedakan antara massa jinak dan ganas dengan sensitivitas mendekati 100% dan spesifisitas bervariasi antara 84% dan 92%. Untuk dapat memberiksan standar dalam deskripsi pembacaan ultrasonografi, suatu studi IOTA (International Ovarian Tumor analysis)
mengumpulkan suatu klasifikasi yang akurat dari massa ovarium berdasarkan isi dari massa, permukaan, dinding, septa dan adanya pertumbuhan papiler dan vaskularisasi. Klasifikasi ini membedakan tipe yang berbeda dari lesi adneksa: unilokular, unilokular solid multilokular, solid multilokular, solid. Beberapa massa tidak dapat diklasifikasikan karena visualisasi yang buruk.51
2.1.3.1. Penggunaan Penanda Tumor Untuk Massa Ovarium
Penanda tumor adalah glikoprotein terlarut yang ditemukan dalam darah, urin, atau jaringan dari pasien pada berbagai tipe kanker. Penanda tersebut umumnya dihasilkan oleh berbagai sel tumor, tetapi pada beberapa kasus dapat diproduksi tubuh sebagai respon keganasan atau pada kondisi jinak. Berbagai penanda tumor berbeda dalam kegunaannya untuk skrining, diagnosis, prognosis, menilai respon terapi, dan deteksi rekurensi. Kanker ovarium, kanker serviks uterus, kanker endometrium, dan neoplasma trofoblastik adalah keganasan ginekologis yang sering menggunakan penanda tumor. Diantara penanda tumor ginekologis yang penting adalah : Cancer antigen 125 (CA-125), Beta human chorionic gonadotropin (beta-hCG), Urinary
gonadotropin fragment, Alpha-fetoprotein (AFP), Inhibin, Estradiol,
Carcinoembryonic antigen (CEA), Squamous cell carcinoma (SCC) antigen,
Müllerian inhibiting substance (MIS), Topoisomerase II, Carbohydrate antigen
19-9, Cancer antigen 27-29, Human telomerase reverse transcriptase (hTERT),
Ferritin. Penanda tumor ginekologis potensial lainnya termasuk :
Lysophosphatidic acid, MIB1-determined tumor growth fraction, L1 (CAM),
Mesothelin, Osteopontin, Vascular endothelial growth factor (VEGF), Interleukin
8 (IL-8), Macrophage colony-stimulating factor (M-CSF), Insulinlike growth
factor–binding protein-3, Tumor-associated trypsin inhibitor, Cyclin E, OVX1, CA-15-3, CA-19-9.53,54
oleh Blast et al tahun 1983. Antigen kanker CA-125 ini merupakan antigen soelomik dengan berat molekul tinggi dan terdeteksi pada kanker ovarium epitel. Oleh karena antigen ini dapat disekresikan dari jaringan normal lainnya, seperti jaringan amnion, sistem organ pernafasan, dan sel epitel saluran genitalia wanita maka sensitivitas dan spesifisitas CA-125 dianggap kurang ideal, walaupun kadarnya dapat ditemukan meningkat pada kurang lebih 80% kasus kanker ovarium epitel dan 50% pada kanker ovarium stadium awal.55
Kriteria diagnostik yang prediktif serta cukup akurat dalam menegakkan diagnosis tumor ovarium jinak dan ganas diperkenalkan oleh Jacob et al pada tahun 1990 yang menemukan sistem skoring yang cukup sederhana yaitu Risk of Malignancy Index (RMI) atau indeks resiko keganasan yang dihitung berdasarkan kadar serum CA-125, status menopause, dan hasil pemeriksaan morfologi tumor ovarium dengan USG. Pada penelitian tersebut dinyatakan bahwa skor RMI 200 dapat membedakan tumor ovarium epitel jinak dan ganas dengan sensitivitas 78% dan spesifisitas 80%.55
RMI dianggap sebagai sistem skoring yang sederhana dengan komponen karakteristik pemeriksaan ultrasonografi (USG) yang mudah dinilai secara sonografi transabdominal. Risk of Malignancy Index (RMI) menurut Jacob et al, dihitung berdasarkan rumus sebagai berikut:
RMI = U x M x Serum CA-125 Keterangan :
U : Hasil Pemeriksaan ultrasonografi Dengan karakteristik sebagai berikut:
Komponen solid pada tumor ovarium
Lesi bilateral
Asites
Adanya bukti metastase intra abdomen
Hasil pemeriksaan USG
Nilai U = 1, jika dijumpai salah satu saja dari karakteristik USG Nilai U = 3, jika dijumpai ≥ 2 dari karakteristik USG
M : Status menopause
Nilai M = 1 jika pre menopause Nilai M = 3 jika menopause
Penemuan dari HE4 membuat peneliti fokus pada peranannya dalam membedakan kanker ovarium epitel dan massa jinak. HE4 dengan kombinasi dengan CA-125 disertai status menopause diformulasikan menjadi suatu algoritme yang disebut “Risk of Malignancy Algorithm” (ROMA). Formula ini
digunakan sebagai dasar rujukan massa adneksa kepada ahli onkologi ginekologi. Sampai saat ini penggunaan algoritme ROMA masih kontroversial. Ada berbagai hasil penelitian yang menunjukkan hasil yang tidak konsisten, hal ini kemungkinan karena jumlah pasien yang diteliti, asal geografi yang berbeda, dan sistem analisis yang dipakai.56,57,58
dengan perluasan ovarium dan dari metastasis ovarium yang berasal dari traktus gastrointestinal. Suatu karsinoma serosa derajat tinggi menunjukkan ekspresi WT1 (+), ARIDIA (+), dan p53 (+, kuat, difus). Bila dijumpai WT1 (-), ARIDIA (- atau +), dan p53 (-, lemah, fokal) menunjukkan adenokarsinoma endometrioid.59,60
2.1.4. Klasifikasi
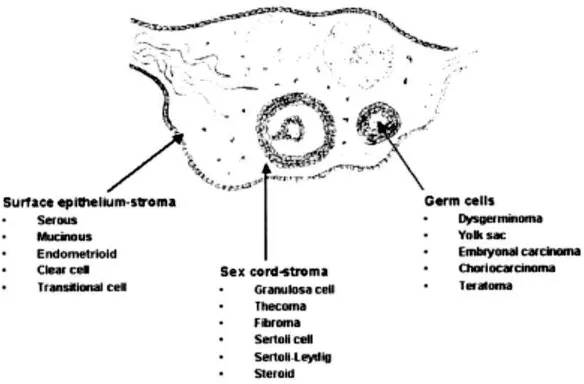
Tumor ovarium dapat dibedakan menjadi tiga kategori utama yaitu tumor epitel permukaan, tumor sex cord stromal, dan tumor sel germinal, hal ini dibedakan berdasarkan struktur anatomik dari tumor tersebut berasal. Tiap kategori termasuk sejumlah subtipe. Kombinasi dari berbagai subtipe dapat dijumpai, tumor dalam kombinasi dengan dua atau lebih subtipe disebut mixed tumor. Sesuai konvensi untuk tujuan klasifikasi, subtipe tumor yang merupakan 10% dari total massa tumor diabaikan.57
Klasifikasi histopatologi tumor ovarium berdasarkan World Health Organization (WHO):61
1. Surface epithelial-stromal tumors
a. Serous tumors: benign, borderline, malignant
b. Mucinous tumors, endocervical-like and intestinal-type: benign,
borderline,malignant
c. Endometrioid tumors: benign, borderline, malignant, epithelial-stromal
andstromal
d. Clear cell tumors: benign, borderline, malignant
e. Transitional cell tumors: Brenner tumor, Brenner tumor of borderline
malignancy, malignant Brenner tumor, transitional cell carcinoma (non
Brenner type)
f. Squamous cell tumors
g. Mixed epithelial tumors (specify components): benign, borderline,
malignant
h. Undifferentiated carcinoma
2. Sex cord-stromal tumors
a. Granulosa-stromal cell tumors: granulosa cell tumors,
thecoma-fibromagroup
b. stromal cell tumors, androblastomas: well-differentiated,
Sertoli-Leydig cell tumor of intermediate differentiation, Sertoli-Sertoli-Leydig cell tumor
poorly differentiated (sarcomatoid), retiform.
c. Sex cord tumor with annular tubules
d. Gynandroblastoma
f. Steroid (lipid) cell tumors: stromal luteoma, Leydig cell tumor,
unclassified
3. Germ cell tumors
a. Dysgerminoma: variant-with syncytiotrophoblast cells
b. Yolk sac tumors (endodermal sinus tumors): polyvesicular vitelline
tumor,hepatoid, glandular
c. Embryonal carcinoma
d. Polyembryoma
e. Choriocarcinoma
f. Teratomas: immature, mature, solid, cystic (Dermoid Cyst)
g. Mixed germ cell
h. Monodermal
4. Gonadoblastoma
5. Germ cell sex cord-stromal tumor of nongonadoblastoma type
6. Tumors of rete ovarii
7. Mesothelial tumors
8. Tumors of uncertain origin and miscellaneous tumors
9. Gestational trophoblastic diseases
10. Soft tissue tumors not specific to ovary
11. Malignant lymphomas, leukemias, and plasmacytomas
12. Unclassified tumors
13. Secondary (metastatic) tumors
Insiden kista ovarium jinak terbanyak sesuai urutan antara lain kista ovarii simpleks, kistadenoma ovarii musinosum, kistadenoma ovarii serosum, kista endometrioid, kista dermoid.22,25
2.1.5. Perkembangan Tumor Jinak Ovarium
Tumor pelvik jinak merupakan hasil dari penyimpangan perkembangan, variasi fisiologis, atau gangguan pertumbuhan. Pada perkembangan embriologi genital interna yang normal, sel germinal yang bermigrasi ke dalam dinding medial dari punggung urogenital selama bulan kedua dari perkembangan embrional menginduksi proliferasi dari epitel permukaan yang mengalami enkapsulasi sel germinal yang berproliferasi. Massa yang merupakan epitel permukaan dan sel germinal yang berproliferasi akan dibagi oleh mesenkim yang asli dari gonad ke dalam kompartemen kecil yang mengandung sel germinal kecil yang terdiri dari selapis sel epitel yang disebut pregranulosa. Struktur ini merupakan folikel primordial. Sel germinal dalam bentuk folikel primordial menjalani proliferasi mitotik. Sel tersebut memasuki profase meiosis I dan berhenti pada status tersebut sampai perkembangan folikel selanjutnya.62,63,64
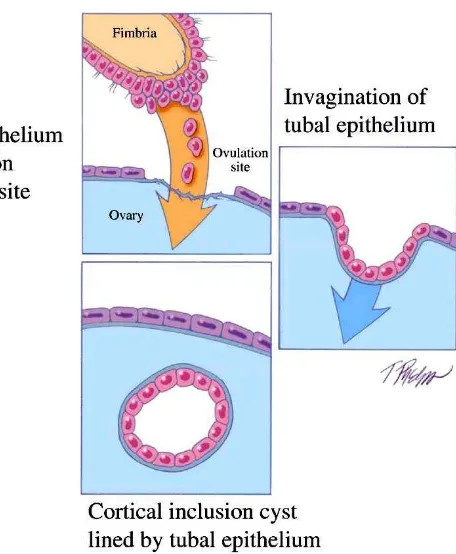
Gambar 2. Perkembangan dari kista inklusi kortikal dari epitel tuba.67
2.1.5.1 Tumor Jinak Yang Merupakan Hasil Variasi Fisiologis
Kista yang berkembang dari apparatus folikuler disebut sebagai kista fungsional. Bayi perempuan yang baru lahir dapat mengalami kista fungsional besar karena paparan dari hormon maternal, hal ini dapat mengaami komplikasi menjadi ruptur ataupun torsio kista.Folikel primordial dapat berkembang menjadi folikel primer dengan diameter 150 / μm. Dengan adanya follicle
membesar dan persisten. Kista yang tidak memiliki bukti partisipasi dalam ovulasi disebut kista folikuler. Jika dijumpai luteinisasi yang signifikan, hal ini disebut kista teka lutein. Jika kista ini merupakan tempat ovulasi, ini dinamakan kista korpus luteum. Istilah luteinisasi merujuk kepada sejumlah sel dalam sitoplasma yang menghasilkan hormon steroid. Sel – sel pada kista tersebut terdiri dari jaringan yang mengakumulasi kolesterol dan berwarna kekuningan. Istilah luteinisasi merujuk kepada istilah pada pengamatan makroskopik.62,68
2.1.5.2 Tumor Jinak Yang Disebabkan Oleh Penyimpangan Perkembangan
Ketika perkembangan berjalan normal, sel germinal mengalami enkapsulasi di dalam satu lapis lapisan pregranulosa, tetapi berbagai penyimpangan enkapsulasi dapat muncul. Salah satunya adalah enkapsulasi yang tidak sesuai dari dua sel germinal di dalam selapis lapisan pregranulosa. Hipotesa nya bahwa hal ini disebabkan oleh stimulasi dari satu oosit oleh yang lainnya dalam pola yang menyebabkan parthenogenesis. Parthenogenesis dipercaya sebagai sumber dari teratoma kistik jinak.62,68
Meskipun demikian derivat endodermal jarang dijumpai dibandingkan tipe lainnya. Komponen kistik dari dermoid umumnya dilapisi oleh kulit ektodermal, dan lumennya diisi oleh sebum dan rambut. Material ini dapat timbul melalui lapisan epidermal dan mengalami reaksi inflamasi pada jaringan konektif dari tumor atau ovarium yang mengelilinginya. Secara histologis reaksi ini memiliki ciri khas respon sel raksasa. Proses ini berakibat kerusakan dinding dari kista dengan diseksi progresif oleh isi kista. Diseksi dapat meluas kedalam jaringan lunak pelvik atau ke permukaan peritoneum. Mekanisme ini dapat menyebabkan ruptur spontan dari teratoma kistik jinak.62
2.1.5.3 Tumor Jinak Yang Disebabkan Oleh Gangguan Pertumbuhan
Kista jinak atau adenoma dari regio adneksa merupakan suatu gangguan pertumbuhan yang belum jelas. Faktor lain yang dapat berkontribusi kepada perkembangannya. Kista inklusi yang muncul dari ovulasi, inflamasi lama, endometriosis, atau faktor yang tidak diketahui yang menyebabkan epitel yang berada pada posisi yang tidak normal. Banyak kista pada adneksa yang membesar tanpa proses neoplasia, tetapi berdasarkan sekresi yang berkesinambungan.62
pertumbuhan ganas sebagai hasil dari serangkaian kecelakaan genetik yang mengganggu pola ini dimana sel berlanjut mengalami proliferasi dibandingkan berdiferensiasi. Onkogen bisa saja akan menjadi tumor jinak. Pada beberapa sistem tumor, tumor jinak terdiri dari sel – sel dengan kerusakan genetik yang serupa dijumpai pada keganasan. Diantara tumor jinak ovarium, tumor epitel terdiri dari 30% dari keseluruhan tumor jinak ovarium pada usia hingga 40 tahun, 50% antara umur 40 dan 49 tahun, 70% antara umur 50 dan 70, dan 90% setelahnya. Kista unilokular tanpa pertumbuhan papiler pada dindingnya dapat diduga suatu tumor jinak pada pemeriksaan ultrasonografi. 62,70
Kista yang terletak jauh di dalam ovarium atau pada peritoneum biasanya akan berkembang menjadi kista musinosum. Studi ultrastruktural telah menunjukkan bahwa tipe epitel endoservikal dan gastrointestinal dijumpai pada lesi ini, dan untuk alasan tersebut tumor musinosum berasal dari teratoma dan umumnya merupakan lesi yang multilokular dibandingkan serosa, dan jarang memiliki stroma fibrotik untuk didiagnosa sebagai adenofibroma. Metaplasia skuamosa dapat dijumpai, merupakan perubahan kista musinosum yang dikaitkan dengan epitel skuamosa. Tumor musinosum sering memiliki komponen stromal yang menonjol, sering dijumpai karakteristik tekal dan dapat dijumpai luteinisasi. Kista musinosum dapat timbul dengan adanya peningkatan estrogen.62
2.2. Human Epididymis Protein 4
2.2.1. Struktur Human Epididymis Protein 4
Diantara gen – gen yang umumnya mengalami overekspresi pada kanker ovarium relatif terhadap jaringan normal adalah gen human epididymis protein 4. Human epididymis protein 4 (HE4) telah diajukan sebagai penanda biologis pada diferensial diagnosis kanker ovarium epitelial, pemeriksaan ini dapat menyingkirkan diagnosa massa pelvik lainnya, dapat mendeteksi penyakit secara dini, dan sebagai monitor dari respon kemoterapi dan prognosis dari kanker ovarium. HE4 mulanya diidentifikasi pada epitel dari epididymis distal. Protein ini ditemukan sebagai inhibitor protease yang berperan pada maturasi sperma. Protein ini memiliki domain WAP-tipe empat-inti disulfida (WFDC) dan dikode oleh gen WFDC2. Diduga bahwa gen berkembang dengan duplikasi yang berulang. Gen pada lokus WFDC tersimpan dengan baik pada berbagai spesies dan berperan dalam imunitas dengan adanya aktivitas antimikrobial dan anti-inflamatori. Gen HE4 memiliki lebih dari 8 kb DNA dan memiliki lima ekson. Keseluruhan panjang HE4 adalah hasil dari splicing ekson 1, 2, 4, dan 5. Ekson 3 dan 4 dapat dijumpai dalam tiga bentuk, dua dari hal tersebut dapat di-splicing. Studi imunofluoresens intraseluler menunjukkan bahwa HE4 didistribusikan pada regio sitoplasma dengan pola perinuklear dari retikulum endoplasma dan golgi. Perannya sebagai penanda biologis potensial untuk kanker ovarium setelah percobaan hibridisasi komparatif cDNA berdasarkan pengamatan dari peningkatan ekspresi primer dari HE4 pada beberapa kanker ovarium, relatif terhadap jaringan normal.71,72,73,74,75,76,77
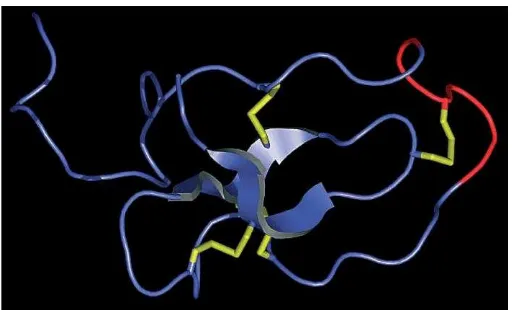
Gambar 3. Model struktural dengan karakteristik WAP domain inti empat disulfida dari protein elafin. Kuning= empat jembatan disulfida yang membentuk delapan residu sistein. Panah biru = rantai. Merah = lengkung pengikat proteinase dari elafin.81
seluruh domain WAP ini berasal, dijumpai abnormal pada berbagai tumor. Sebagai contoh, amplifikasi dari regio ini telah dilaporkan pada kanker ovarium dan payudara. Delesi dari regio ini telah dilaporkan pada karsinoma sel skuamosa. Studi ini menunjukkan bahwa adanya gen yang dijumpai pada regio ini dari kromosom 20 berperan pada karsinogenesis dan atau perkembangan tumor.80,82.83
2.2.2. Regulasi Ekspresi Human Epididymis Protein 4 Pada Jaringan
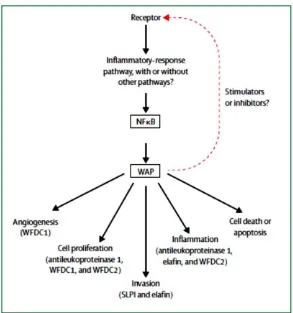
peristiwa, diantaranya adalah regulasi negatif dari kematian sel dan apoptosis, meningkatkan proliferasi sel, angiogenesis, dan invasi sel tumor. Berbagai kemokin dan sitokin berperan sebagai regulator upstream atau sebagai target
downstream untuk aktivasi gen, atau keduanya. Protein WAP mungkin diregulasikan dalam jalur pensinyalan yang kompleks ini. Promoter PI3 adalah suatu target transkripsional direk dari NFkB, dan sisi pengikatan NFkB juga memiliki promoter dari WFDC2 (HE4) dan protein WAP lainnya. Hal ini menunjukkan bahwa regulasi transkripsional dari gen WAP tergantung dari NFkB. NFkB menginduksi berbagai gen yang terlibat dalam siklus sel termasuk siklin D1, D2, D3, dan E, hal ini menunjukkan adanya korelasi yang positif antara ekspresi SLPI dan siklin D1 pada kanker endometrium manusia. Peningkatan ekspresi siklin D1 diduga menggambarkan peran antileukoproteinase 1 dalam melindungi siklin ini terhadap degradasi proteolitik.81
responsif hormonal termasuk reseptor estrogen dan RAR-related orphan receptor A (RORA), yang berperan pada peningkatan regulasi pada kanker ovarium. Fluoresensi konfokal untuk ER-a juga menunjukkan bahwa ER-a mengalami internalisasi ke dalam nukleus pada stimulasi dengan estrogen dan antiestrogen. Dijumpai kolokalisasi spasial dari HE4 dengan ER-a pada SKOV3 WT, sebagaimana juga dijumpai ko-imunopresipitasi dari ER-a dengan HE4 pada SKOV3WT dan NV, menunjukkan bahwa interaksi antara dua protein. Meskipun demikian, ko-imunopresipitasi dari HE4 dan ER-a tidak dijumpai pada SKOV3 C1, menunjukkan bahwa penurunan regulasi dari ER-a timbul mengikuti overekspresi HE4 yang stabil. Pola penurunan regulasi ER-a juga dijumpai serupa dengan jaringan kanker ovarium epitelial manusia, dimana jaringan kanker dan tumor jinak dari pasien yang menunjukkan ekspresi HE4 rendah dapat menunjukkan pewarnaan ER-a yang kuat. Mekanisme supresi ER-a pada SKOV3 C1 belum jelas, modifikasi epigenetik terhadap gen ER-a telah diidentifikasi pada kanker payudara dengan ER negatif.17
nuklear dijumpai melalui ovarium normal dan massa ovarium benigna, tetapi hampir seluruhnya tidak dijumpai pada jaringan kanker ovarium epitel serosa dan endometrioid dari pasien yang memiliki kadar serum HE4 yang tinggi. Temuan ini menunjukkan bahwa overekspresi dari HE4 dapat menyebabkan demetilasi dan menurunkan ekspresi 5 MC, sebagai kondisi yang mempromosikan aktivitas transkripsional yang kondusif untuk peningkatan produksi HE4. Jika regio demetilasi dari promoter HE4 menuju upstream dari elemen hormonal yang responsif terhadap ER-a, maka overekspresi yang stabil dari elemen respon hormon dapat menurunkan regulasi ekspresi gen ER-a. Alternatifnya, elemen responsif hormonal dari promoter HE4 dapat lebih aktif dari ER-a, seperti RARrelated orphan receptor A (RORA), yang telah menunjukkan membantu peningkatan regulasi gen yang dimediasi estrogen. Tamoksifen dan antiestrogen lainnya telah menunjukkan efek apoptotik yang signifikan bahkan pada galur sel kanker ovarium dengan ER negatif, menunjukkan bahwa terapi hormon dapat mempengaruhi ekspresi HE4 dan toksisitas independen sel kanker ovarium ER27.17
ini menunjukkan bahwa inhibisi importin sebagai target terapi potensial untuk pensinyalan yang dimediasi HE4.17
Immunostaining ganda dengan antibodi yang diarahkan melawan konstituen pada retikulum endoplasma dan apparatus Golgi menunjukkan bahwa HE4 dijumpai pada organella ini. Pengamatan ini konsisten dengan prediksi bahwa HE4 merupakan protein yang disekresikan, setidaknya pada
milleu normal dari traktus reproduksi (Epididymis). Pada sel kanker ovarium juga ditemukan sekresi dari HE4. Sel karsinoma yang mengekspresikan HE4 ke dalam medium ekstraseluler. Sekresi protein HE4 hanya dijumpai pada galur sel yang mengekspresikan RNA HE4 endogen dimana pada sel HOSE tidak dijumpai. Bentuk yang sekretori dari HE4 bermigrasi dengan berat molekul 25 kDa pada gel SDS-polyacrylamide, hampir dua kali lipat dari ukuran protein rekombinan yang diprediksi, dan lebih besar dibandingkan bentuk yang disekresikan dengan sel serangga High Five. Polipeptida HE4 matur mengandung N-glikosilasi pada posisi 14 (N-C-T), disimpulkan bahwa migrasi yang terganggu pada migrasi produk protein tersebut sebagai konsekuensi dari glikosilasi.17
inklusi kortikal ovarium. HE4 dapat disekresikan ke dalam aliran darah dari pasien dengan kanker ovarium. Hellstrom dkk melaporkan bahwa HE4 bersirkulasi dalam darah pasien kanker ovarium dan tidak dijumpai pada kelompok kontrol dengan usia yang sama. Studi tersebut mengindikasikan bahwa spesifisitas dan sensitivitas dari serologi HE4 dapat dibandingkan dengan CA-125 dan bahwa HE4 jarang positif pada pasien dengan penyakit non malignan, suatu kondisi yang terbatas dengan penggunaan CA-125 sebagai alat skrining.81
Gambar 4. Mekanisme yang diusulkan untuk perkembangan tumor yang dipengaruhi turunan Whey Acidic Protein (WAP) termasuk WFDC2 (HE4).81
HE4 protein diekspresikan pada epitel mullerian dari Kista Inklusi Kortial pada ovarium normal. Drapkin dkk (2005) melaporkan metaplasia Mullerian pada epitel permukaan ovarium, umumnya dijumpai pada kista inklusi kortikal, dimana dapat dijumpai ekspresi dari sejumlah biomarker termasuk EpCAM, Mucin 1, Mesothelin, dan CD9. HE4 dijumpai pada sel epitel permukaan dan atau oleh epitel Mullerian pada kista inklusi kortikal pada studi dengan 11 ovarium yang secara histologis jinak menunjukkan HE4 dijumpai pada kista inklusi kortikal dengan epitel Mullerian. Ekspresi dari protein HE4 yang diidentifikasi dengan profil ekspresi gen, didapatkan selama proses normal dan perkembangan dari kista inklusi kortikal serta metaplasia Mullerian.17
DNA dengan afinitas untuk HE4 dengan menggunakan seleksi aptamer berbasis kapiler, sekuens high-throughput, dan jalur bioinformasi.14,15
Studi terbaru menunjukkan bahwa HE4 dapat berperan dalam aktifasi EGFR dan jalur sinyal MAPK pada sel kanker ovarium, hasil ini dikonfirmasi dengan temuan bahwa HE4 dapat menghambat proliferasi sel dengan regulasi jalur MAPK dan PI3K/AKT in vitro dan HE4 dikaitkan dengan aktivitas EGF, VEGF, insulin dan HIF1 α. 7 gen dari 231 DEG terlibat dalam pensinyalan jalur MAPK sebagai respon terhadap protein HE4 dimana hal ini sesuai dengan fungsi biologisnya dalam hal meningkatkan proliferasi, invasi dan metastasis via jalur MAPK. Selain jalur MAPK, jalur interaksi reseptor matriks ekstraseluler juga terlibat dalam regulasi dari protein HE4.14,15,16,17
Studi menunjukkan dampak dari overekspresi HE4 pada proliferasi kanker ovarium dan pada kemoterapi baik pada studi in vitro maupun model hewan. Sel overekspresi HE4 diambil dari galur sel SKOV-3 dan OVCAR 8 menunjukkan respon yang menghilang terhadap cisplatin dan paclitaxel. Pada mencit telanjang, xenograft yang diambil dari klon SKOV-3 dengan overekspresi HE4 membentuk tumor besar dibandingkan grup kontrol selama 20 hari uji dan terapi lanjutan dengan cisplatin menunjukkan resistensi obat. Studi ini sejalan dengan kadar HE4 dan luaran survival pada 89 pasien kanker ovarium epitel. Pasien dengan penyakit resisten platinum atau overekspresi HE4 keduanya menunjukkan ketahanan hidup yang rendah dibandingkan platinum sensitif atau kelompok HE4 yang mengekspresikan HE4 yang rendah.18
c-Myc yang mentargetkan biosintesis pada nukleoli. EGF, VEGF dan insulin dan reseptornya dihubungkan secara langsung terhadap pertumbuhan tumor ovarium dan kemoresistensi. Efek dari VEGF pada translokasi nuklear HE4 menunjukkan peran HE4 dalam komponen angiogenik dari lingkungan mikro tumor. VEGF penting untuk neovaskularisasi yang dimediasi hypoxia-inducible
factor dan regulasi famili hypoxia-inducible factor (HIF). Luaran
immunoprecipitation assays, kolokalisasi dan aplikasi dari HIF1a inhibitor 2-methoxyestradiol dan siRNA menunjukkan interaksi dari HE4 dengan HIF1a. Sebagaimana untuk HIF1a, kolokalisasi dan koimunopresipitasi dari EGFR dengan HE4 menunjukkan interaksi HE4 dengan reseptor EGF. Overekspresi HE4 sebagai inisiator molekuler untuk pertumbuhan tumor dan kemoresistensi sebagaimana yang terlihat pada penurunan angka ketahanan hidup pada pasien kanker ovarium dengan tumor yang mengekspresikan HE4. Ekspresi HE4 dan lokalisasi berkorelasi dengan fungsi dari faktor pertumbuhan. Studi menunjukkan bahwa ekspresi HE4 atau interaksinya merupakan target potensial untuk terapi dari kanker ovarium. Sebagai kesimpulan overekspresi HE4 merupakan promotor molekuler untuk pertumbuhan tumor dan berhubungan dengan fungsi dari faktor pertumbuhan.17
2.2.4. Penggunaan Human Epididymis Protein 4 Dalam Praktik Klinis
dipelajari pada berbagai kondisi penyakit jinak dan ganas. Studi dari Escudero dkk (2011) menunjukkan bahwa HE4 kurang dipengaruhi oleh jenis kelamin atau status menopause dibandingkan CA-125. HE4 kadarnya tidak meningkat pada kondisi jinak bila dibandingkan dengan CA-125, termasuk kondisi ginekologik jinak. HE4 kadarnya meningkat pada 12.3% pasien dengan penyakit jinak, dan hanya 1.3% dari pasien dengan penyakit ginekologis. CA-125 meningkat pada 37% dari pasien dengan penyakit jinak dan 33.2% pasien dengan kondisi ginekologis. Escudero dkk menunjukkan bahwa pada 63% pasien endometriosis tidak dijumpai abnormalitas kadar HE4 serum dengan 49.2% pasien menunjukkan kadar CA-125 yang abnormal. Hasil ini menunjukkan bahwa HE4 berperan penting menyingkirkan differensial diagnosa kanker ovarium dari kondisi ginekologis lainnya, termasuk pada wanita premenopause. Gagal ginjal adalah sumber terpenting dari hasil HE4 yang positif palsu, sama dengan tumor marker lainnya seperti SCC (squamous cell carcinoma) antigen, S-100, dan ProGRP (pro-gastrin-releasing peptide).85
2.4. Kerangka Konsep
Variabel Bebas (independen) Variabel Tergantung (dependen) HUMAN EPIDIDYMIS
PROTEIN 4