PURIFIKASI DAN KARAKTERISASI PROTEIN INHIBITOR
ENZIM RNA HELIKASE JAPANESE ENCEPHALITIS VIRUS
DARI Streptomyces chartreusis 5-095
SHANTI RATNAKOMALA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2009
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Purifikasi dan Karakterisasi Protein Inhibitor Enzim RNA Helikase Japanese Encephalitis Virus dari Streptomyces chartreusis 5-095 adalah benar hasil karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Desember 2008
Shanti Ratnakomala
ABSTRACT
SHANTI RATNAKOMALA. P055050031. Purification and characterization of protein inhibitor to RNA helicase enzyme of Japanese encephalitis virus from Streptomyces chartreusis 5-095. Under the direction of ANJA MERYANDINI and ANDI UTAMA.
Japanese encephalitis virus (JEV), a member of flavivirus, is the most common cause of epidemic viral encephalitis. Several efforts have been performed to find a drug candidate for treatment of JEV infection, including finding of inhibitors of enzymes that essential for JEV replication. Streptomyces chartreusis 5-095 produce the inhibitor of JEV RNA helicase. In this study, an extracellular protein which has inhibition activity on JEV RNA helicase, particularly on its ATPase activity, was partially purified from supernatant of S. chartreusis 5-095 culture. The culture supernatant exhibited high inhibition activity against ATPase activity of JEV RNA helicase (approximately 43%) at 10 days of incubation. The protein inhibitor was purified by the procedures of precipitation with ammonium sulfate to 70% saturation, gel filtration (Sephadex G-50) using methanol water solution (40:60) as a mobile phase, Thin Layer Chromatography (TLC) and High Performance Liquid Chromatography (HPLC). The purity of protein inhibitor increased 9.75 fold than those of the crude protein. The specific activity after purification was 36.48 U/mg. Gradient polyacrilamide gel electrophoresis analysis showed that the relative molecular mass of the proteins were estimated to be 10 kDa and 14 kDa. The activity of purified protein inhibitor was optimum at pH 7.4, and maintained its stability over pH range from 4-9. The purified protein inhibitor relatively stable its activity at storage in the range of -20oC to room temperature for 15 days of incubation.
Key words: Japanese encephalitis virus (JEV), RNA helicase, protein inhibitor, Streptomyces chartreusis 5-095.
RINGKASAN
SHANTI RATNAKOMALA. P055050031. Purifikasi dan karakterisasi protein inhibitor enzim RNA helikase Japanese encephalitis virus dari Streptomyces chartreusis 5-095. Dibawah bimbingan ANJA MERYANDINI dan ANDI UTAMA.
Japanese encephalitis virus (JEV), adalah anggota dari famili flavivirus, yang banyak meyebabkan penyakit infeksi ensefalitis. Penyakit Japanese encephalitis (JE) merupakan salah satu penyakit infeksi yang serius. JEV menyebabkan infeksi akut sistem saraf pusat. Sekitar 30% dari yang sembuh juga menyisakan kelumpuhan, kerusakan otak dan penyakit serius lainnya. Walaupun vaksin telah dikembangkan sejak tahun 1960, sampai saat ini belum ada obat yang efektif untuk penanganan penyakit ini. Beberapa upaya telah dilakukan dalam rangka penemuan obat, diantaranya adalah penemuan inhibitor terhadap enzim yang esensial untuk replikasi virus JEV. Streptomyces chartreusis 5-095 menghasilkan inhibitor terhadap enzim RNA helikase JEV. Dalam penelitian ini, suatu protein ekstraselular yang mampu menghambat aktivitas enzim RNA helikase JEV, terutama pada aktivitas ATPase-nya, telah berhasil dipurifikasi dari supernatan biakan S. chartreusis 5-095. Supernatan biakan S. chartreusis 5-095 menunjukkan aktivitas inhibisi yang tinggi terhadap aktivitas ATPase dari RNA helikase JEV (sekitar 43%) selama 10 hari masa inkubasi. Protein inhibitor dipurifikasi melalui serangkaian prosedur purifikasi diantaranya yaitu pengendapan dengan amonium sulfat jenuh 70%, filtrasi gel dengan matriks Sephadex G-50 dan dielusi menggunakan larutan metanol-air (40:60) sebagai fasa gerak, serta Thin Layer Chromatography (TLC) dan High Performance Liquid Chromatography (HPLC). Kemurnian protein inhibitor meningkat sampai 9.75 kali dibandingkan dengan supernatan awalnya. Aktivitas spesifik setelah purifikasi adalah sebesar 36.48 U/mg. Gradien SDS PAGE menunjukkan bahwa bobot molekul relatif dari protein tersebut adalah sekitar 10 kDa dan 14 kDa. Protein inhibitor tersebut mencapai aktivitas optimum pada pH 7.4, dan relatif stabil pada kisaran pH 4-9, serta relatif stabil aktivitasnya pada penyimpanan di suhu -20 oC sampai suhu ruang selama 15 hari masa penyimpanan. Protein hasil purifikasi tersebut bersifat termostabil, dengan suhu optimum adalah pada suhu 60 oC.
Kata kunci : Japanese encephalitis virus (JEV), RNA helikase, protein inhibitor, Streptomyces chartreusis 5-095.
©Hak cipta milik IPB, tahun 2008 Hak cipta dilindungi UU
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b.Pengutipan tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau
PURIFIKASI DAN KARAKTERISASI PROTEIN INHIBITOR
ENZIM RNA HELIKASE JAPANESE ENCEPHALITIS VIRUS
DARI Streptomyces chartreusis 5-095
SHANTI RATNAKOMALA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2009
HALAMAN PENGESAHAN
Judul Tesis : Purifikasi dan Karakterisasi Protein Inhibitor enzim RNA Helikase Japanese Encephalitis Virus dari Streptomyces chartreusis 5-095
Nama Mahasiswa : Shanti Ratnakomala NIM : P055050031
Disetujui Komisi Pembimbing
Dr. Anja Meryandini, M.Si Dr. Andi Utama, M.Sc
Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Dr. Ir. Muhammad Jusuf Prof. Dr. Ir. Khairil A. Notodiputro, MS
RIWAYAT HIDUP
Penulis dilahirkan di Pontianak, Kalimantan Barat pada tanggal 1 Juni 1967. Penulis merupakan anak ke tiga dari empat bersaudara dari ayah yang bernama Ir. Makmoer Soerjonagoro dan Ibu Lilis Muljati.
Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Mardi Yuana Sukabumi pada tahun 1986 dan pada tahun yang sama diterima masuk di Jurusan Biologi FMIPA, Universitas Padjadjaran Bandung. Penulis menyelesaikan studi strata 1 pada tahun 1992.
Sejak tahun 1996 sampai sekarang, penulis bekerja sebagai staf peneliti di Pusat Penelitian Bioteknologi LIPI di Bidang Biologi Sel dan Jaringan. Tahun 2005 mendapat tugas belajar untuk melanjutkan pendidikan S2 pada Program Studi Bioteknologi (BTK) IPB. Beasiswa pendidikan Pascasarjana diperoleh dari Lembaga Ilmu Pengetahuan Indonesia.
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia, limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul Purifikasi dan Karakterisasi Protein Inhibitor enzim RNA Helikase Japanese Encephalitis Virus dari Streptomyces chartreusis 5-095. Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Bioteknologi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Selama menjalani perkuliahan hingga terselesaikannya tesis ini, penulis mendapat banyak bantuan dari berbagai pihak. Oleh karena itu dengan segala ketulusan hati, penulis mengucapkan terimakasih yang sebesar-besarnya kepada:
1. Dr. Anja Meryandini M.S. selaku ketua komisi pembimbing yang dengan penuh kesabaran dan ketelitian memberikan ilmu, arahan, masukan selama penulis melaksanakan penelitian, hingga terselesaikannya tesis ini.
2. Dr. Andi Utama M.Sc. selaku anggota komisi pembimbing yang telah berkenan memberikan bantuan fasilitas penelitian dari Program Kompetitif LIPI (2005-2008), yang telah banyak memberikan ilmu, bimbingan, pengarahan selama penelitian sehingga penulisan tesis ini dapat terselesaikan.
3. Dr. Puspita Lisdiyanti, Kepala Bidang Biologi Sel dan Jaringan, Puslit Bioteknologi LIPI, dan Dr. Yantyati Widyastuti, Project Leader LIPI-NITE Project 1 yang telah memberikan ijin kepada penulis untuk menggunakan fasilitas dan biakan Streptomyces charteusis 5-095 yang ada di biakan koleksi Puslit Bioteknologi LIPI.
4. Yang tercinta suamiku Drs. R. Muslihudin, dan anak-anakku Ustman Sidik M dan Umar Fachmi M; Mama, adik dan kakak-kakakku yang dengan kasih sayang dan tulus ikhlas selalu mendorong, memberikan doa, semangat dan inspirasi selama penulis menjalani studi.
5. Terimakasih penulis ucapkan kepada teman-teman PS Bioteknologi khususnya angkatan 2005, atas semua kerjasama dan persahabatan yang telah terjalin selama ini.
6. Teman-teman di Lab. Mikrobiologi LIPI: Roni, Wulan, Ihat, Kukun, Dwi, Naniek, Novi, Joni atas bantuan dan dukungannya.
7. Teman-teman di Lab. Virologi Molekuler, khususnya Ridwan dan Jajuli yang telah banyak membantu selama penelitian.
8. Semua pihak yang telah membantu penulis yang tidak dapat disebutkan satu persatu.
Semoga amal baik mereka tersebut di atas mendapat pahala dari Allah SWT. Akhir kata penulis mohon maaf atas segala kekurangan, semoga tesis ini bermanfaat bagi pembaca dan memberikan masukan bagi pembaca untuk melanjutkan penelitian ini, sehingga akan didapatkan hasil yang lebih sempurna.
Bogor, Desember 2008 Shanti Ratnakomala
DAFTAR ISI
HalamanDAFTAR TABEL...
DAFTAR GAMBAR...
DAFTAR LAMPIRAN...
I PENDAHULUAN
1.1 Latar Belakang... 1 1.2 Tujuan Penelitian... 3II TINJAUAN
PUSTAKA
2.1 Japanese Encephalitis Virus (JEV)... 42.2 Enzim Helikase dan RNA Helikase... 8
2.3 Streptomyces chartreusis... 13
2.4 Pemurnian Protein Inhibitor... 18
2.4.1 Pengendapan Protein... 19
2.4.2 Kromatografi Gel Filtrasi... 20
2.4.3 Pemekatan Enzim dengan Pengeringbekuan... 22
2.4.4 Kromatografi Lapis Tipis (TLC)... 22
2.4.5 Fraksinasi HPLC... 23
III
BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian... 253.2 Bahan dan Alat... 25
3.3 Metode Penelitian... 25
3.3.1 Purifikasi Enzim RNA Helikase JEV... 25
Transformasi... 25
Ekspresi protein NS3 helikase JEV... 26
Purifikasi enzim RNA helikase JEV... 27
3.3.3 Pengaruh Pertumbuhan Streptomyces chartreusis 5-095 Halaman
dengan Aktivitas Inhibitor terhadap Enzim Helikase JEV.. 28
3.3.4 Mikroorganisme dan Persiapan Ekstrak Kasar Protein Inhibitor RNA Helikase... 29
3.3.5 Pengendapan Protein Inhibitor menggunakan Amonium Sulfat... 29
3.3.6 Pemurnian Protein Inhibitor RNA Helikase... 30 3.3.6.1 Kromatografi Filtrasi Gel... 30
3.3.6.2 Kromatografi Lapis Tipis (TLC)... 30
3.3.6.3 HPLC... 31
3.3.6.4 Penghitungan Bobot Molekul Protein Inhibitor... 32
3.3.6.5 Pengukuran Kadar Protein... 33
3.3.7 Karakterisasi Protein Inhibitor Murni... 33
3.3.7.1 Pengukuran Bobot Molekul Protein Inhibitor Murni 33 3.3.7.2 Pengujian Pengaruh Suhu terhadap Stabilitas Penyimpanan Inhibitor... 34
3.3.7.3 Pengujian Pengaruh pH terhadap Stabilitas Inhibitor... 34
3.3.7.4 Pengujian Stabilitas Panas terhadap Aktivitas Protein Inhibitor... 34
IV
HASIL DAN PEMBAHASAN
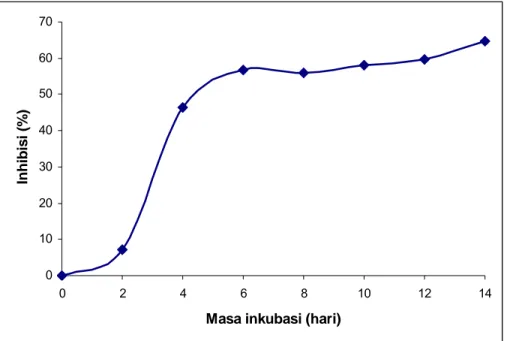
4.1 Produksi Enzim Helikase JEV... 354.2 Pertumbuhan Streptomyces chartreusis 5-095 dan Aktivitas Inhibisinya terhadap Enzim RNA Helikase JEV... 36
4.3 Pengendapan Protein Inhibitor menggunakan Amonium Sulfat... 38
4.4 Pemurnian Protein Inhibitor RNA Helikase JEV... 41
4.4.1 Pemurnian Protein Inhibitor menggunakan Kromatografi Gel Filtrasi Sephadex G-50... 41 4.4.2 Pemurnian Protein Inhibitor menggunakan Kromatografi
Lapis Tipis (TLC)... 44
Halaman
4.4.3 Pemurnian dengan HPLC... 47 4.5 Karakterisasi Protein Inhibitor... 49
4.5.1 Penentuan Suhu Penyimpanan terhadap Aktivitas Inhibisi Protein Inhibitor dari S. chartreusis 5-095... 49
4.5.2 Penentuan pH Optimum Aktivitas Inhibisi Protein
Inhibitor Streptomyces chartreusis 5-095... 50 4.5.3 Stabilitas terhadap Panas pada Protein Inhibitor RNA
Helikase JEV dari S. chartreusis 5-095... 53
V SIMPULAN DAN SARAN
5.1 Simpulan... 56 5.2 Saran... 56
DAFTAR PUSTAKA
... 57
DAFTAR TABEL
Halaman
1. Beberapa senyawaan yang memiliki aktivitas inhibisi terhadap
NTPase/helikase dari Flavivirus... 13 2. Berbagai senyawa bioaktif yang dihasilkan dari aktinomisetes... 15 3. Karakterisasi fisiologis penggunaan gula oleh S.chartreusis 5-095... 17 4. Berbagai jenis senyawa aktif yang dihasilkan oleh S. chartreusis... 17 5. Aktivitas inhibisi dan waktu retensi dari fraksi-fraksi dari HPLC…….. 47 6. Tabel purifikasi protein inhibitor ATPase terhadap RNA helikase
DAFTAR GAMBAR
Halaman
1. Struktur genom dan protein dari JEV... 4
2. Siklus hidup alami virus JEV... 7
3. Proses replikasi JEV dalam sel inang... 8
4. RNA helikase dan DNA helikase... 9
5. Mekanisme kerja enzim RNA helikase... 10
6. Streptomyces chartreusis 5-095... 16
7. Prosedur purifikasi inhibitor ATPase dari RNA helikase JEV... 32
8. Purifikasi enzim RNA helikase JEV dari E.coli BL21... 35
9. Kurva pertumbuhan S. chartreusis 5-095 dengan produksi protein inhibitor ATPase dari RNA Helikase JEV... 36
10. Persentasi inhibisi protein inhibitor S.chartreusis 5-095 terhadap enzim RNA helikase JEV pada berbagai saturasi amonium sulfat.... 38
11. Hasil pengendapan protein inhibitor ekstrak kasar dengan amonium sulfat dalam berbagai kejenuhan... 39
12. Aktivitas enzim RNA helikase JEV dengan penambahan protein inhibitor hasil fraksinasi menggunakan Sephadex G-50... 41
13. Profil aktivitas inhibisi dari fraksi-fraksi protein inhibitor yang dielusi menggunakan gel filtrasi Sephadex G-50... 42
14. Profil fraksi aktif protein inhibitor dalam lempeng TLC... 45
15. Profil SDS PAGE dari protein inhibitor... 46
16. Kromatogram dari kromatografi preparatif HPLC... 47
17. Pengaruh suhu penyimpanan terhadap aktivitas inhibisi protein inhibitor pada aktivitas ATPase dari RNA helikase JEV... 50
18. Pengaruh pH terhadap aktivitas inhibisi protein inhibitor pada aktivitas ATPase RNA helikase JEV... 51
DAFTAR LAMPIRAN
Halaman
1. Komposisi media International Streptomyces Project 2 (ISP2)... 66
2. Komposisi larutan dalam reaksi uji ATPase (50 µl/ sumur)... 66
3. Pereaksi Bradford (Bradford, 1976)... 66
4. Pengendapan protein inhibitor dengan amonium sulfat... 67
5. Larutan Bufer... 68
6. Cara perhitungan IC50... 70
7. Kurva standar Bobot Molekul relatif... 72
I PENDAHULUAN
1.1 Latar Belakang
Famili Flaviviridae terdiri atas tiga genera, yaitu genus flavivirus, pestivirus dan hepacivirus. Genus flavivirus terdiri atas lebih dari 70 jenis virus, yang pada umumnya ditularkan melalui perantaraan nyamuk atau arthropoda. Genus flavivirus diantaranya adalah virus demam berdarah (DENV), Japanese encephalitis virus (JEV), tick-borne encephalitis virus (TBEV), yellow fever virus (YFV), West Nile virus (WNV), Murray Valley encephalitis virus (MVEV), dan St.Louis encephalitis virus (SLEV). Flavivirus merupakan patogen yang sangat penting, bertanggungjawab terhadap banyak penyakit pada manusia dan hewan, dan menyebabkan banyak kematian.
WHO mencatat di seluruh dunia lebih dari 50 juta orang terinfeksi demam berdarah (DENV), 200.000 orang terinfeksi Yellow Fever Virus dan sekitar 50.000 orang terinfeksi Japanese Encephalitis virus (JEV). Infeksi flavivirus dapat menyebabkan demam berdarah (pada YFV dan DENV) dan ensefalitis serta kerusakan saraf otak (pada JEV, TBEV, WNV, SLEV, dan MVEV). Pada umumnya flavivirus yang paling mematikan yaitu JEV, YFV, TBEV dan DENV memiliki tingkat mortilitas antara 5-30% (Puig-Basagoiti 2006).
Terapi yang spesifik untuk menangani infeksi flavivirus belum didapatkan. Saat ini vaksin yang tersedia untuk manusia hanya dari tiga jenis flavivirus yaitu YFV, JEV dan TBEV (Ray & Shi 2006), sehingga menjadi prioritas bagi peneliti kesehatan masyarakat untuk mengembangkan dan mendapatkan vaksin dan senyawa antivirus untuk mencegah dan mengobati penyakit infeksi flavivirus.
Penyakit Japanese encephalitis (JE) merupakan salah satu penyakit infeksi yang serius, karena menyebabkan infeksi akut sistem saraf pusat. Sekitar 30% dari yang sembuh juga menyisakan kelumpuhan, kerusakan otak dan penyakit serius lainnya. Walaupun vaksin telah dikembangkan sejak tahun 1960, sampai saat ini belum ada obat yang efektif untuk penanganan penyakit ini. JE ditularkan melalui perantaraan nyamuk Culex tritaeniorinchus dan daerah penyebarannya adalah di
Asia terutama di Asia Tenggara. Di Indonesia yang termasuk endemik JEV yaitu di daerah Kalimantan, Bali, Nusa Tenggara, Sulawesi, Maluku , Papua dan Lombok (Spicer 2006).
Beberapa upaya telah dilakukan dalam rangka penemuan obat bagi penyakit yang disebabkan oleh flavivirus, diantaranya adalah penemuan inhibitor terhadap enzim yang esensial untuk replikasi virus tersebut, seperti enzim protease, helikase, dan polimerase (Borowski et al. 2002b). Kini telah menjadi suatu kebutuhan yang mendesak untuk menemukan inhibitor yang selektif dan sangat spesifik bagi replikasi flavivirus (Paeshuyse et al. 2006).
Banyak pendekatan telah dilakukan untuk mendapatkan senyawa kemoterapik antivirus, diantaranya adalah dengan mendesain struktur kristal 3D dari protein-protein viral atau struktur sekunder/ tersier dari genom RNA viral, menapis sejumlah besar senyawaan yang berpotensi sebagai agen antivirus, menguji inhibitor yang telah dikenal dari virus lain, memodifikasi secara kimiawi inhibitor virus yang telah diketahui untuk mengoptimalkan fungsinya, dan imunoglobulin intravenus (Ray & Shi 2006). Selain itu pencarian inhibitor enzim RNA helikase merupakan salah satu teknik untuk mengembangkan pengobatan terhadap virus tersebut sehingga menjadi salah satu target penemuan obat antivirus.
Hatsu et al. (2002), menyatakan bahwa aktinomisetes dapat menghasilkan inhibitor RNA helikase JEV. Sementara itu informasi mengenai penggunaan aktinomisetes indigen Indonesia untuk menemukan inhibitor enzim RNA helikase JEV sampai saat ini belum tersedia, sehingga mendorong peneliti untuk menemukan dan memurnikan protein inhibitor terhadap enzim RNA helikase JEV tersebut. Berdasarkan potensi aktinomisetes yang sangat besar, kegiatan isolasi, koleksi termasuk identifikasi dan karakterisasi aktinomisetes dari berbagai lokasi di Indonesia merupakan kegiatan yang sangat menarik. Selanjutnya pemanfaatan koleksi aktinomisetes ini melalui teknik penapisan secara cepat dan tepat, dengan kondisi fermentasi yang optimum, merupakan sumber alternatif untuk mendapatkan senyawa bioaktif baru. Salah satu diantaranya adalah pencarian obat terhadap penyakit menular seperti infeksi yang disebabkan oleh flavivirus.
Pada studi sebelumnya, gen helikase dari JEV telah berhasil dikloning ke dalam plasmid pET-21b (nama bangunnya masing-masing pET-21b/HCV NS3 hel dan pET-21b/JEV NS3 hel). Enzim ini bisa diekspresikan pada E. coli
BL21(DE3)pLysS dengan induksi Isopropyl ß-D thiogalactopyranoside (IPTG) (Utama et al. 2000; Hatsu et al. 2002), sehingga enzim murni helikase dapat diperoleh melalui purifikasi dari biakan E. coli BL21(DE3)pLysS dengan menggunakan kromatografi afinitas, untuk selanjutnya digunakan sebagai substrat bagi pencarian senyawa inhibitor terhadap enzim tersebut.
Saat ini telah dilakukan penapisan sekitar 1.800 isolat aktinomisetes koleksi Pusat penelitian Bioteknologi LIPI (Grace 2006), dan telah diperoleh sekitar 11 isolat aktinomisetes yang memiliki kemampuan menghambat aktivitas enzim RNA helikase JEV di dalam supernatannya. Kesebelas isolat aktinomisetes tersebut memiliki aktivitas inhibitor sekitar 45-50% terhadap enzim RNA helikase JEV. Dari isolat yang memiliki aktivitas inhibitor yang tinggi, selanjutnya akan digunakan untuk mencari protein target yang memiliki aktivitas inhibitor ATPase dari RNA helikase JEV. Enzim RNA helikase, selain memiliki aktivitas helikase (ATP-dependent helicase), juga memiliki aktivitas ikatan RNA (RNA binding) dan ATPase (RNA-stimulated ATPase). Karena aktivitas RNA helikase tergantung pada aktivitas ATPase dan uji ATPase dapat dilakukan dengan mudah, skrining inhibitor helikase dapat dilakukan melalui uji ATPase.
Protein inhibitor terhadap enzim RNA helikase JEV yang diperoleh akan dipurifikasi dengan menggunakan beberapa langkah pemurnian, seperti pengendapan dengan amonium sulfat, kromatografi gel filtrasi, TLC dan HPLC. Karakterisasi yang dilakukan terhadap inhibitor tersebut, berupa pengukuran bobot molekul, pengujian kestabilan protein tersebut terhadap suhu dan pH. Penelitian ini diharapkan akan menemukan protein yang bersifat inhibitor terhadap enzim RNA helikase JEV. Penelitian ini juga diharapkan akan membantu penemuan obat baru, sehingga mengurangi ketergantungan kita terhadap obat-obatan dari luar negeri.
1.2 Tujuan Penelitian
Tujuan dari penelitian ini adalah: 1) mendapatkan protein murni yang bersifat inhibitor terhadap enzim RNA helikase JEV, dan 2) karakterisasi protein yang bersifat inhibitor tersebut, yang meliputi stabilitas protein, bobot molekul protein inhibitor, dan aktivitas penghambatan terhadap enzim RNA helikase.
II TINJAUAN PUSTAKA
2.1 Japanese Encephalitis Virus (JEV)
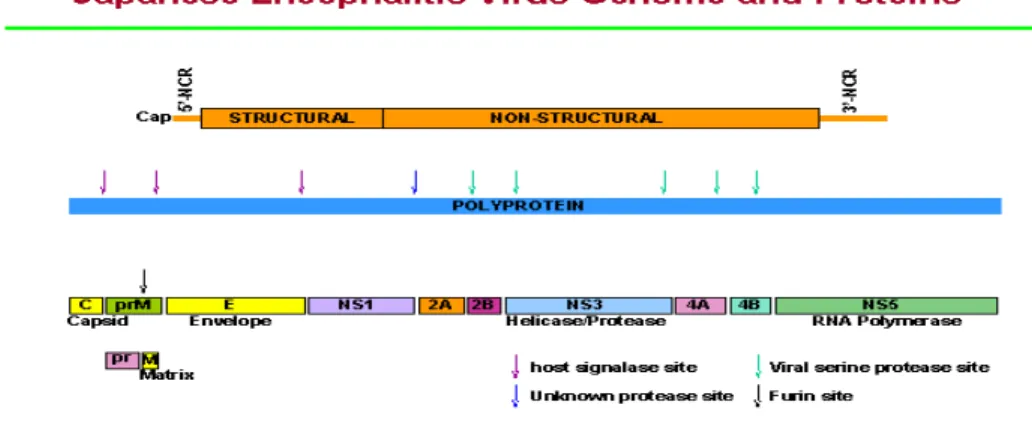
Japanese encephalitis virus (JEV), adalah suatu virus terbungkus oleh protein envelope (E) yang memiliki satu atau dua sisi aktif yang terglikosilasi (Chambers et al. 1990). Glikosilasi pada protein E, sangat penting untuk konformasi alami dari epitop protein tersebut (Lad et al. 2000). JEV memiliki diameter sekitar 50 nm, dan termasuk dalam famili Flaviviridae. JEV merupakan virus RNA positif, dengan genom RNA utas tunggal yang memiliki panjang sekitar 11 kb. Genom RNA tersebut ditranslasikan ke dalam prekursor poliprotein tunggal yang selanjutnya diproses untuk menghasilkan tiga protein struktural C (capsid), M (matrix) dan E (envelope) yang membentuk viral kapsid dan glikoproteinnya, serta tujuh protein non struktural (NS1, NS2A, NS2B, NS3, NS4A, NS4B dan NS5) yang bertanggungjawab untuk replikasi viral genomnya (Gambar 1). Poliprotein tersebut tersusun sebagai berikut: NH2-C–PrM–E–NS1–NS2A–NS2B–NS3–NS4A–NS4B– NS5–COOH (Rice 1996; Brinton 2002). Virion flavivirus berbentuk membulat dengan diameter sekitar 40-60 nm. Pembungkus intinya berdiameter sekitar 30 nm terdiri atas kapsid dan genom RNA yang dikelilingi oleh suatu lipida lapis ganda dimana pembungkus viral dan protein membran terikat (Borowski et al. 2001).
Gambar 1. Struktur genom dan protein dari Virus Japanese Encephalitis www.ias.ac.in/.../70am_talks/svrati/img6.html
Protein-protein non struktural dalam genom virus berperan dalam proses replikasi virus. NS1 yang berinteraksi dengan NS4A dibutuhkan untuk replikasi RNA. (Lindenbach & Rice 1997; Lindenbach & Rice 1999). NS2A yang bersifat hidrofobik diketahui berfungsi dalam perakitan virion dan pelepasan partikel virus yang infeksius. NS2B membentuk suatu kompleks dengan NS3 dan diperlukan sebagai kofaktor bagi fungsi serin protease dari NS3 (Arias et al. 1993; Chambers et al. 1991; Chambers et al. 1993; Falgout et al. 1993). Fungsi dari membran yang berasosiasi antara NS4A dan NS4B sampai saat ini belum diketahui. NS5 berperan didalam aktivitas RNA-dependent RNA polymerase (RdRp) dan methyltransferase.
NS3 adalah suatu protein multifungsi yang berperan dalam aktivitas enzimatik dari serin protease dengan adanya NS2B, nukleotida trifosfatase (NTPase), dan RNA helikase (Bartelma et al. 2002; Borowski et al. 2001; Li et al. 1999). Aktivitas serin protease diidentifikasikan menempati sekitar seperempat domain dari protein NS3 dari flavivirus (Lin et al. 1995; De Francesco et al. 2000; Zhang et al. 2005). Area C-terminal sisanya dari protein NS3 mengandung urutan motif yang diperkirakan berperan untuk pengikatan NTP, hidrolisis NTP dan RNA helikase. Serin protease, NTPase dan RNA helikase merupakan enzim yang sangat penting karena berperan dalam proses replikasi virus (Levin et al. 1999; Hatsu et al. 2002; Borowski et al. 2003). Dalam proses replikasi terdapat hubungan antara RNA virus dan protein NS5 (Chen et al. 1997) yang menimbulkan implikasi dalam hidrolisis ATP yang melalui aktivitas trifosfatasenya akan mengurai RNA virus utas ganda. Selanjutnya, berdasarkan analisis komplementer dari virus Kunjin, diperlihatkan bahwa NS3 utuh sangat diperlukan dalam perakitan virus (Liu et al. 2002; Chiou et al. 2003).
Sepanjang infeksi flavivirus, genom RNA positif ditranskripsikan secara komplementer ke dalam suatu genom RNA negatif, yang selanjutnya berperan sebagai cetakan untuk sintesis genom RNA positif lainnya. Sintesa dari RNA positif dan RNA negatif adalah asimetris, dimana RNA positif dihasilkan 10 sampai 100 kali lebih banyak dibandingkan dengan RNA negatif (Frick & Lam 2006).
Diantara flavivirus, aktivitas RNA yang distimulasi nukleotida trifosfatase (NTPase) diidentifikasi dalam protein NS3 dari virus Yellow Fever (YFV), virus West Nile (WNV), virus Demam berdarah (DV) dan JEV (Orvieto et al. 2003; Borowski et
al. 2002a). Saat ini, aktivitas RNA helikase dari flavivirus ditunjukkan pada protein NS3 dari virus demam berdarah tipe 2 dan JEV (Orvieto et al. 2003; Utama et al 2000). Aktivitas RNA distimulasi NTPase (NTPase-stimulated RNA helicase) dan RNA helikase juga diidentifikasi dalam protein NS3 dari virus yang secara genetis tergolong dalam flavivirus seperti virus hepatitis C (HCV), virus hepatitis G (HGV) dan bovine viral diarrhea virus (BVDV) suatu pestivirus.
Banyak flavivirus yang berhubungan dengan penyakit pada manusia, termasuk diantaranya yaitu empat serotipe dari virus demam berdarah, yellow fever virus (YFV), Japanese encephalitis virus (JEV), tick-borne encephalitis virus (TBEV), St.Louis encephalitis virus (SLEV), dan West Nile virus (WNV) (Burke & Monath 2001). JEV adalah penyakit epidemik ensefalitis yang disebabkan oleh virus yang paling banyak terjadi di seluruh dunia, dimana dari sekitar 50.000 kasus, sekitar 15.000 orang meninggal per tahunnya.
Galur JEV prototipe Nakayama pertama kali diisolasi pada tahun 1935. Kasus epidemis dan sporadis dari JEV banyak terjadi di daerah beriklim empat dan di daerah tropis di Asia, diantaranya Kamboja, China, Indonesia, India, Jepang, Malaysia, Myanmar, Nepal, Sri Lanka, Thailand, Vietnam, bagian tenggara Rusia, dan Australia (Hanna et al. 1996). JEV menimbulkan penyakit akut dengan tanda-tanda infeksi seperti sakit kepala, demam, kejang dan merupakan agen penyebab penyakit radang saraf pusat seperti meningitis dan ensefalitis yang parah, dengan tingkat mortalitas antara 20-30%.
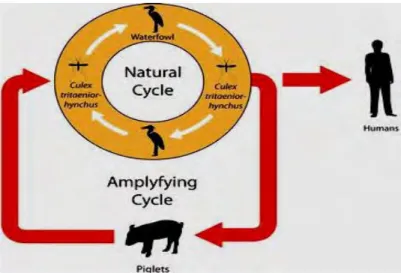
Siklus hidup alami JEV melibatkan burung-burung air dan nyamuk Culex, terutama adalah Culex tritaeniorhynchus. Hewan babi juga termasuk sebagai inang pengganda dan memungkinkan adanya suatu hubungan ke manusia karena merupakan hewan peliharaan (Gambar 2). Pada saat terjadi wabah JE di daerah Torres Strait, Australia, ditemukan bahwa Culex annulirostris juga berperan sebagai vektor pembawa virus ini (Burke et al. 1988).
Gambar 2. Siklus hidup alami virus Japanese Encephalitis.
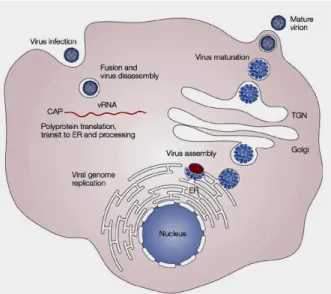
http://ocw.jhsph.edu/imageLibrary/index.cfm/go/il.viewImageDetails/resourceID Didalam proses replikasi virus, virion JE akan menempel pada permukaan sel inang dan selanjutnya akan memasuki sel melalui suatu reseptor yang dimediasi oleh endositosis. Proses asidifikasi dari vesikula endosomal akan memicu perubahan konformasi di dalam virion. Selanjutnya virion akan mengalami fusi di dalam membran sel inang, dan terjadi perombakan pada partikel-partikel virusnya. Sesaat kemudian genom akan dilepaskan ke dalam sitoplasma, kemudian RNA utas tunggal positif akan ditanslasikan ke dalam suatu poliprotein tunggal yang selanjutnya akan diproses secara pra- dan pasca- translasi oleh protease virus dan inangnya. Replikasi genom terjadi di dalam membran intraselular. Perakitan virus terjadi pada permukaan retikulum endoplasma (RE) dimana protein struktural dan RNA yang baru disintesis ditunaskan ke dalam lumen oleh RE. Viral yang belum matang dan partikel subviral dirakit di sepanjang badan Golgi. Virion yang belum matang ini selanjutnya dikelilingi oleh furin protease inang, menghasilkan partikel yang matang dan infeksius. Virion yang matang tersebut selanjutnya dilepaskan melalui proses eksositosis (Mukhopadhyay et al. 2005) Proses replikasi JEV ditunjukkan pada gambar berikut (Gambar 3):
Gambar 3. Proses replikasi JEV dalam sel inang (doi:10.1038/nrmicro1067)
2.2 Enzim Helikase dan RNA Helikase
Helikase adalah enzim yang mempunyai kemampuan untuk melepaskan untai ganda nukleotida (DNA atau RNA) menjadi untai tunggal, dan bergerak sepanjang untai nukleotida pada arah 3’ ke 5’. Enzim helikase pertama kali diperkenalkan oleh Malcolm L Gefter dan kawan-kawan dari Massachusetts Institute of Technology (MIT) tahun 1975. Mereka menemukan bahwa pada proses replikasi DNA bakteri Escherichia coli, selain enzim polimerase yang berfungsi membentuk rantai DNA baru, terdapat enzim yang berperan memisahkan pasangan rantai DNA yang diberi nama helikase. Enzim ini berfungsi memisahkan pasangan rantai induk DNA Escherichia coli untuk selanjutnya diproses dan juga pasangan induk dan anak DNA yang tersintesis.
Helikase berasal dari kata "helix" yang berarti struktur pasangan DNA "double helix" dan "ase" yang berarti enzim, sehingga "helicase" berarti enzim yang memisahkan pasangan rantai DNA atau RNA, yang masing-masing kemudian diberi nama DNA helikase atau RNA helikase (Gambar 4). Enzim helikase ada pada hampir semua organisme, mulai dari virus sampai manusia. Enzim ini berfungsi dalam berbagai proses yang berhubungan dengan DNA dan RNA, sehingga enzim ini termasuk salah satu enzim yang esensial untuk kehidupan segenap makhluk hidup, sama halnya dengan protease.
Enzim ini diperlukan untuk proses replikasi genom organisme tersebut. Karena itu, enzim helikase dapat dibagi menjadi DNA helikase dan RNA helikase, sesuai dengan genom yang dimiliki organisme tersebut. JEV yang merupakan virus RNA, memiliki RNA helikase (Utama 2003).
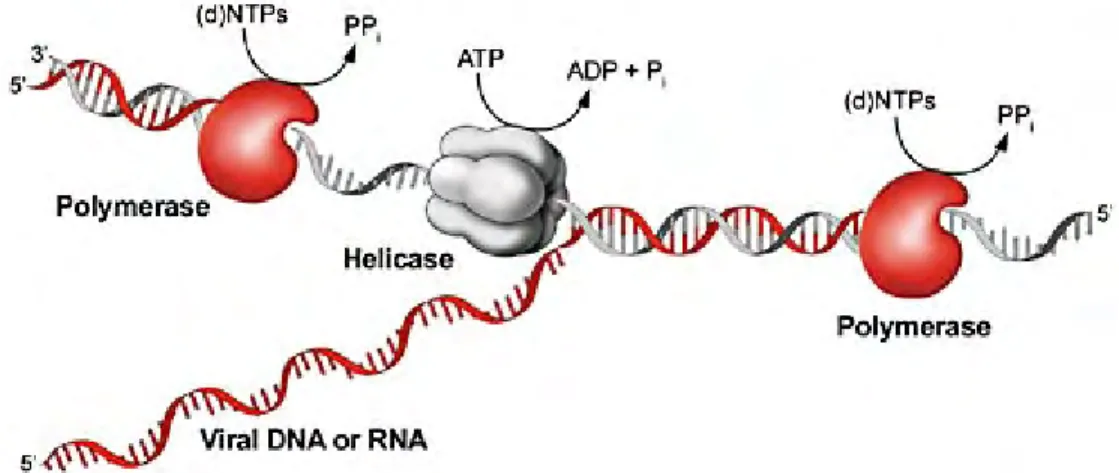
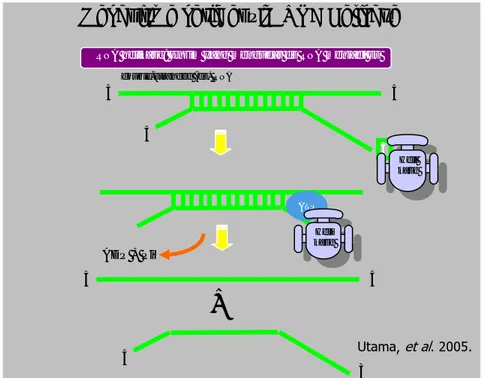
Gambar 4. RNA atau DNA helikase
http://journals.prous.com/journals/dnp/20031606/html/dn160355/images/Frick_f1.jpg Helikase bekerja secara katalitik memisahkan untai ganda DNA atau RNA menggunakan energi yang dihasilkan dari hidrolisis nukleosida trifosfat dan merupakan target pencarian obat yang menarik karena dibutuhkan dalam replikasi virus.
Gambar 5. Mekanisme kerja enzim RNA helikase
Helikase, selain memiliki aktivitas helikase itu sendiri, juga memiliki aktivitas ATPase, yaitu aktivitas yang menguraikan ATP (adenosin trifosfat) menjadi ADP (adenosin difosfat). Pada proses penguraian ini dihasilkan energi yang digunakan untuk menguraikan pasangan DNA atau RNA. Enzim helikase, selain memiliki aktivitas helikase itu sendiri, juga memiliki aktivitas ikatan RNA (RNA binding) dan ATPase (RNA-stimulated ATPase), dan kedua aktivitas ini berpengaruh terhadap aktivitas helikase. Oleh karena itu, penemuan inhibitor helikase juga bisa dilakukan dengan mencari senyawa yang menghambat aktivitas ATPase, selain senyawa yang menghambat aktivitas helikase itu sendiri. Dengan demikian, peluang untuk mendapatkan inhibitor enzim helikase yang spesifik untuk suatu virus tertentu akan lebih besar.
Adapun mekanisme kerja dari enzim RNA atau DNA helikase (Gambar 5) adalah pertama-tama helikase akan mengikat untai RNA atau DNA utas ganda pada ujung 3', selanjutnya ATP akan berikatan pada suatu sisi aktif dari RNA atau DNA helikase tersebut. Gugus ATP akan dihidrolisis oleh enzim RNA atau DNA helikase menjadi ADP dan fosfat inorganik, dari proses hidrolisis ini akan terlepas energi yang kemudian digunakan oleh enzim RNA atau DNA helikase untuk menguraikan
Mekanisme kerja enzim RNA Helikase
double-stranded (ds) RNA 3 3 5 5 ATP ADP + Pi 3 3 5 5
+
RNA helikase: Enzim yang mengudar ds RNA menjadi ss
Heli kase
Heli kase
utas ganda RNA atau DNA menjadi utas tunggal RNA atau DNA (Utama et al. 2005).
Enzim helikase dapat mengurai RNA atau DNA utas ganda melalui pemutusan ikatan hidrogen yang mengikat kedua utas tersebut. Reaksi ini berhubungan dengan hidrolisis ATP, dimana energi yang dilepaskan selama hidrolisis ATP dibutuhkan bagi proses penguraian RNA atau DNA (Shuman 1992; Wagner 1998).
Selain mengurai untai RNA atau DNA, enzim helikase juga dapat berperan dalam fungsi selular lainnya seperti membantu proses translasi, mengkoordinasi pembentukan poliprotein, memutus interaksi RNA-protein, serta menyusun RNA didalam pembungkus viral (Lam et al. 2006). Enzim helikase, juga memiliki aktivitas ikatan RNA (RNA binding) dan ATPase (RNA-stimulated ATPase), dan kedua aktivitas ini berpengaruh terhadap aktivitas RNA helikase. Oleh karena itu, enzim ini menjadi target yang potensial untuk penemuan obat anti-virus, karena penemuan inhibitor RNA helikase dapat dilakukan dengan penemuan inhibitor terhadap aktivitas RNA binding atau ATPase.
Beberapa kandidat anti-virus telah ditemukan. Kandidat obat tersebut tidak hanya terbukti secara in vitro tetapi juga secara in vivo. Betz et al. 2000, melaporkan senyawa BAY 57-1293 telah terbukti mampu menekan infeksi virus Herpes Simplex (HSV) pada kera. Beberapa studi telah menemukan kandidat obat flavivirus melalui seleksi inhibitor RNA helikase, terutama untuk HCV dan JEV, tetapi kandidat tersebut pada umumnya adalah senyawaan kimia seperti ribavirin -5’-triphosphate (Borowski et al, 2001), dan 5-[(4-bromophenyl)methyl]-2-phenyl-5H-imidazo[4,5-c]pyridine (BPIP) yang mampu menghambat replikasi dari pestivirus (Paeshuyse et al. 2006).
Senyawa-senyawa seperti N nonyl-deoxynojirimycin dan 6 O-butanoyl castanospermin dapat menghambat perkembangbiakan virus demam berdarah tipe 2 (DEN V-2) dan JEV melalui penghambatan glikoprotein selular yang menghasilkan enzim ß-glucosidase (Ray & Shi 1998). Sementara itu, sampai saat ini baru satu studi yang menemukan inhibitor helikase JEV yang diproduksi oleh Streptomyces sp. (Hatsu et al. 2002). Beberapa inhibitor menunjukkan penurunan replikasi virus di dalam biakan sel dan model hewan.
RNA helikase secara enzimatis mampu menguraikan struktur RNA utas ganda melalui pemutusan ikatan hidrogen yang menjaga kedua utas itu bersama-sama. Hal ini diselesaikan dalam suatu reaksi yang digandakan melalui hidrolisis NTP, sehingga seluruh RNA helikase yang dikenal saat ini memiliki juga aktivitas NTPase. Diduga selama hidrolisis NTP, energi yang dilepaskan digunakan untuk reaksi penguraian utas ganda, walaupun hal tersebut belum dapat dijelaskan sepenuhnya bagaimana kedua reaksi tersebut bersatu. Bagian ujung C dari protein NS3, berisi domain NTPase-helikase yang telah dipurifikasi sebagai suatu protein rekombinan dari Escherichia coli, yang menunjukkan adanya aktivitas NTPase yang distimulasi RNA (Frick & Lam 2006) dan aktivitas RNA helikase dengan adanya ATP dan suatu kation divalen seperti Mn atau Mg (Utama et al. 2000). Enzim helikase merupakan target yang potensial untuk penemuan obat anti-virus. Hal ini disebabkan karena enzim ini merupakan enzim yang esensial untuk replikasi virus, rekombinasi, transkripsi, splicing dan translasi (Levin et al. 1999).
Beberapa peneliti telah mendapatkan berbagai senyawa inhibitor terhadap NTPase/helikase dari flavivirus. Senyawa-senyawa tersebut ada yang berupa analog senyawa kimia atau berupa senyawa metabolit sekunder dari berbagai mikroorganisme. Aktinomisetes pada umumnya diketahui menghasilkan antibiotik, akan tetapi juga menghasilkan inhibitor enzim protease yang berfungsi dalam proses replikasi virus. Contoh inhibitor enzim protease yang dihasilkan oleh aktinomisetes adalah aprotinin, antipain, dan leupeptin (Andersen 1983).
Inhibitor dapat bekerja secara dapat balik (reversible) dan tidak dapat balik (irreversible). Inhibitor tidak dapat balik terjadi karena proses destruksi atau modifikasi sebuah gugus fungsi atau lebih, yang terdapat pada molekul enzim sehingga aktivitas katalitik enzim tersebut berkurang. Inhibitor yang dapat balik bisa berupa inhibitor bersaing (kompetitif) dan inhibitor tidak bersaing (non kompetitif). Inhibitor bersaing terjadi karena ada molekul yang mirip dengan substrat sehingga ada persaingan antara inhibitor dengan substrat terhadap sisi aktif enzim. Inhibitor tidak bersaing yaitu inhibitor yang dapat bergabung dengan enzim yang telah mengikat substrat maupun pada enzim yang bebas karena penggabungan terjadi di luar sisi aktif (Poedjiadi 1994). Aprotinin, antipain dan leupeptin merupakan inhibitor bersaing (Andersen 1983).
Beberapa jenis senyawa inhibitor terhadap NTPase/ helikase dari Flavivirus yang telah ditemukan dapat dilhat pada Tabel 1.
Tabel 1. Beberapa senyawaan yang memiliki aktivitas inhibisi terhadap NTPase/ helikase dari Flavivirus.
No Sumber Senyawa inhibitor Referensi
1. 2. 3. 4. Sintesis Spons laut Uridin Purin nukleosida 4,5,6,7-tetrabromobenzotriazol (TBBT) Hippuristanol N3, 5'-anhidro-4-(beta-D-ribofuranosyl)-8-aza-purin-2-on. 2'-deoksi-2'-fluoro-2'-C-metil purin nukleosida Najda et al. (2003). Bordeleaul et al. (2006). Hasan et al. (2005). Clark et al. (2005).
Beberapa jenis inhibitor terhadap flavivirus telah dilaporkan. Pertama yaitu inhibitor terhadap sintesis nukleosida trifosfat, termasuk asam mikofenolik (MPA), ribavirin, dan 6-azauridine. Sementara itu, ribavirin telah digunakan secara klinis untuk mengobati infeksi virus hepatitis C. Selain menginhibisi sintesis nukleosida trifosfat, beberapa analog nukleotida menekan replikasi virus melalui inkorporasi langsung pada rantai viral RNA.
2.3 Streptomyces chartreusis
Aktinomisetes merupakan organisme prokariotik yang termasuk dalam kelompok bakteri Gram positif, bersifat saprofitik dan memproduksi sejumlah spora dan membentuk miselia yang stabil. Aktinomisetes tersebar luas di alam seperti di tanah dan serasah. Aktinomisetes memiliki peranan penting dalam memecah dan mendegradasi senyawa-senyawa organik alami. Kelompok mikroba ini sangat menarik karena merupakan kelompok mikroorganisme yang potensinya sangat besar dalam menghasilkan antibiotik (Cross 1982).
Telah banyak diketahui bahwa genus Streptomyces menghasilkan berbagai jenis antibiotik serta berbagai jenis metabolit sekunder lainnya, sehingga sekitar dua pertiga dari antibiotik yang dihasilkan oleh mikroorganisme, sekitar 80% nya dihasilkan dari genus Streptomyces. Senyawa bioaktif yang dihasilkan dari genus
Streptomyces ini sangat beragam diantaranya yaitu sebagai antibakteri, antifungi, antitumor, antivirus, antiparasit, herbisida, imunosupresan, pemacu pertumbuhan (growth promotor) dan sebagainya.
Habitat aktinomisetes yang utama adalah tanah. Aktinomisetes lebih banyak ditemukan pada tanah dengan kondisi yang basa atau netral daripada yang asam. Walaupun demikian, dilaporkan pula adanya sebagian kecil aktinomisetes yang diisolasi dari perairan. Dari rizosfer tanaman Paraserianthes falcataria telah berhasil diisolasi dan diidentifikasi 6 Streptomyces baru yaitu S. asiaticus, S. cangkringensis, S. indonesiensis, S. javensis, S. rhizospaerius, dan S. yogyakartensis (Sembiring 2003).
Pada umumnya, aktinomisetes terbagi atas dua kelompok besar. Kelompok pertama adalah Streptomyces yang mencakup genus Streptomyces dan Kitasatospora. Kelompok kedua adalah non-Streptomyces atau disebut juga rare-Actinomycetes yang mencakup genus Actinomadura, Microbispora, Microtetraspora, Nonomuraea, Saccharomonospora, Streptosporangium, Thermobifida, Actinoplanes, Mycobacterium, Nocardia, dan lain-lain. Streptomyces merupakan genus yang paling banyak berada di alam, yaitu lebih dari 400 spesies (Lisdiyanti et al. 2006)
Produksi metabolit sekunder mikroba sangat spesifik dan sangat dipengaruhi oleh kondisi fermentasinya (Monaghan et al. 1995). Dilaporkan oleh Yarbrough (1993) bahwa dibutuhkan berbagai kondisi pertumbuhan yang berbeda untuk dapat memproduksi dan mengisolasi metabolit sekunder dari 760 bakteri yang berbeda. Produksi senyawa bioaktif Streptomyces pada umumnya bergantung pada fase pertumbuhan.
Dalam biakan cair, umumnya metabolit sekunder diproduksi saat biakan memasuki fase stasioner (Chater & Bibb 1997). Biosintesis senyawa bioaktif dipengaruhi dan ditingkatkan oleh berbagai faktor fisiologi dan lingkungan. Hal ini termasuk laju pertumbuhan (Horinouchi & Beppu 1994), ketidakseimbangan metabolisme (Hood et al. 1992) dan berbagai tekanan fisiologis lainnya (Hobbs et al. 1992; Yang et al. 1995). Optimasi proses fermentasi yang spesifik untuk produksi metabolit sekunder oleh spesies-spesies aktinomisetes yang baru, mutlak dibutuhkan. Proses penanganan pasca panenpun sangat penting karena dapat
mempengaruhi keaktifan senyawa bioaktif yang diperoleh. Berbagai senyawa bioaktif yang dihasilkan dari aktinomisetes dapat dilihat dalam Tabel 2 di bawah ini : Tabel 2. Berbagai senyawa bioaktif yang dihasilkan dari aktinomisetes.
Sumber : Kieser et al. 2000.
Isolat 5-095 yang digunakan dalam penelitian ini merupakan isolat aktinomisetes yang diisolasi dari tanah di daerah Timor, Nusa Tenggara Timur. Isolat tersebut telah diidentifikasi berdasarkan pengurutan gen 16S rRNA. Dari homologi terdekatnya berdasarkan kesamaan gen 16S rRNA, telah diketahui bahwa isolat 5-095 tersebut identik 100% dengan Streptomyces chartreusis AJ399468.
Senyawa Bioaktif Isolat penghasil Jenis senyawa Target Aplikasi Actinomycin D Avermectin Bambermycin Bialaphos Bleomycin Bafilomycin Candicidin Cephamycin C Chrymutasin Chloramphenicol Daunomycin Erythromycin Heliquinomycin Tacrolimus Mitomycin Neomycin Nikkomycin Novobiocin Phleomycin Rifamycin Ristocetin S. spp S. avermitilis S. bambergiensis S. hygroscopicus S. verticillus S. griseus N. lactamdurans (dsb) S. chartreusis S. venezuelae S. peucetius Sac. Erytharaea Streptomyces. sp S. hygroscopicus S. caespitosus S. fradiae S. tendae S. niveus S. verticillus Amycolatopsis Nocardia lurida S. pseudovenezuelae Peptida Makrolida Aminoglikosida Peptida Glikopeptida Makrolida Polien makrolida Beta- laktam Glikosida N-dikloroasil fenilpropanoid Anthrasiklin Makrolida (PK) - Makrolida (PK) Benzokuinon Aminoglikosida Nukleosida Kumerin glikosida Glikopeptida Ansamisin (PK) Glikopeptida Transkripsi Kanal ion Cl2+ Peptidoglikan glutamin sintetase Pemutusan utas DNA Membran ATP-ase Membran Peptidoglikan Mengikat ribosom menghambat sintesis protein (R) Interkalasi DNA R Mengikat protein FK DNA cross-linking R Biosintesis kitin DNA girase
Pemutusan utas DNA RNA polymerase Peptidoglikan Inhibitor (Na, K) ATPase Antitumor Antiparasit Pemacu pertumbuhan Herbisida Antitumor Antibakteri Antifungi Antibakteri Antitumor Antibakteri Antitumor Antibakteri Antivirus Imunosupresan Antitumor Antibakteri Antifungi, insektisida Antibakteri Antitumor Antibakteri Antibakteri Antitumor
Klasifikasi dari isolat S. chartreusis 5-095 adalah sebagai berikut: Dunia : Bacteria Filum : Actinobacteria Kelas : Actinobacteridae Ordo : Actinomycetales Famili : Streptomycetaceae Genus : Streptomyces Spesies : chartreusis
Isolat S. chartreusis pertama kali diidentifikasi oleh Leach et al pada tahun 1953. Galur S. chartreusis 5-095 memiliki miselium yang bercabang, membentuk hifa udara dengan rantai spora yang berbentuk spiral seperti yang terlihat pada Gambar 6. Karakteristik dari biakan S. chartreusis 5-095 dirangkum dalam Tabel 3.
Sel vegetatif dari galur S. chartreusis 5-095 berwarna pale vinaceous grey, dengan warna pigmen yang terlarut di dalam medium pertumbuhannya berwarna umber. Penamaan warna berdasarkan pada "Guide to Color Standard" (manual yang dipublikasikan oleh Nippon Shikisai Kenkyusho, Tokyo). Analisis hidrolisat sel utuh menunjukkan adanya kandungan LL-diaminopimelic acid (LL-DAP) yang merupakan karakteristik dari genus Streptomyces. Karakteristik dari galur 5-095 tersebut selanjutnya dibandingkan dengan spesies S. charteusis yang telah dikenal sebelumnya (tipe galur).
Tabel 3. Karakterisasi fisiologis penggunaan gula oleh S.chartreusis 5-095. No Gula 5-095 S. chartreusis NRRL 2287 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. Blangko Inulin Laktosa Dekstrosa Melibiosa Myo-inositol Stach D(+) Galaktosa Fruktosa Sorbosa Glukosa Arabinosa Manosa Rafinosa Ribosa Manitol Xilosa Melezitosa Salicin Cellobiosa Sorbitol Esculin Antron - - - - + - + - + - + + - - TD - + - - - - TD - - TD + + TD TD TD TD + TD + + TD + TD + + TD TD TD TD - TD Keterangan : + = positif - = negatif TD = Tidak dianalisis
Berbagai senyawa bioaktif yang dihasilkan dari fermentasi S. chartreusis yang berhasil diidentifikasi sampai saat ini diantaranya adalah sebagai berikut (Tabel 4) :
Tabel 4. Berbagai jenis senyawa aktif yang dihasilkan oleh S. chartreusis.
No Jenis senyawa Aplikasi Referensi
1 Chartreusin Antitumor antibiotik Uchida et al. (1993) 2 Chrymutasins aglikon antitumor antibiotik Uchida et al. (1994) 3 Polipeptida alpha-amilase inhibitor Katsuyama et al. (1992) 4
alpha-L-arabinofuranosidase
glikosida hidrolase Matsuo et al. (2000) 5 Glukanase Hidrolisis WIS glukan Takehara et al. (1981)
Chartreusin adalah suatu agen antitumor potensial berupa campuran dari struktur poliketida- karbohidrat yang dihasilkan oleh Streptomyces chartreusis. Tiga tipe poliketida sintase (PKS) kluster gen telah diidentifikasi dari pustaka genom S. chartreusis HKI-249, yang salah satunya mengkodekan biosintesis chartreusin (cha) (Xu et al. 2005).
Katsuyama et al (2000) melaporkan bahwa suatu polipeptida inhibitor baru yaitu, AI-409, mampu menghambat alfa amilase air liur manusia, dan telah berhasil dipurifikasi dari biakan fermentasi S. chartreusis galur no 409. Protein ini terdiri atas rantai tunggal polipeptida 78 asam amino, termasuk dua jembatan disulfida.
2.4 Pemurnian Protein Inhibitor
Pemurnian protein adalah serangkaian proses yang dilakukan untuk mengisolasi suatu jenis protein dari suatu campuran yang kompleks. Berbagai langkah dalam proses pemurnian akan melepaskan protein dari matriks yang mengikatnya, dan memisahkan protein dan bagian yang bukan protein dari larutan campuran, dan akhirnya memisahkan protein yang diinginkan dari seluruh protein lainnya. Pemisahan campuran protein dari suatu ekstrak kasar menjadi komponen-komponennya sangat penting, salah suatu caranya adalah dengan kromatografi yang ditemukan oleh Tswett pada tahun 1903.
Teknik ini bermanfaat sebagai cara untuk menguraikan suatu campuran. Dalam kromatografi, komponen-komponen terdistribusi dalam 2 fasa yaitu fasa diam dan fasa gerak. Menurut IUPAC (International Union and Pure Applied Chemistry), kromatografi adalah metode yang digunakan terutama untuk memisahkan komponen dalam sampel, dimana komponen tersebut didistribusikan diantara 2 fasa yaitu fasa diam dan fasa gerak. Fasa diam dapat berupa padatan atau cairan yang dilapiskan pada padatan atau gel. Fasa diam dapat dimasukkan dalam suatu kolom, ditabur sebagai lapisan dan didistribusikan sebagai film.
Beberapa teknik dengan berbagai kombinasi telah digunakan untuk mendapatkan protein inhibitor murni dari S. chartreusis 5-095. Pada umumnya metode purifikasi yang dilakukan melibatkan beberapa tahapan pemurnian seperti pengendapan protein dengan amonium sulfat, kromatografi gel filtrasi, kromatografi lapis tipis dan pemisahan HPLC.
2.4.1 Pengendapan Protein
Pengendapan protein yang dilakukan pada tahap awal fraksinasi merupakan teknik pemisahan berdasarkan kelarutan menggunakan garam amonium sulfat. Pengendapan dilakukan terhadap cairan biakan sel dari biakan fermentasi dan diendapkan dengan berbagai kejenuhan amonium sulfat. Pada umumnya teknik pengendapan menggunakan amonium sulfat dapat mengendapkan protein karena terikatnya molekul air oleh ion garam. Molekul air akan berkurang dan bagian hidrofobik protein akan saling bergabung membentuk agregat. Metode ini menguntungkan karena mudah dan efektif dilakukan, akan tetapi memiliki kekurangan yaitu memungkinkan ikut terendapnya protein dan molekul lain seperti glikogen, pati, atau polisakarida.
Ada beberapa metode pengendapan protein, dan yang umum digunakan adalah pengendapan dengan induksi garam. Pada kondisi larutan garam yang rendah, kelarutan protein cenderung meningkat yang disebut dengan istilah salting in. Namun pada saat konsentrasi garam terlarut tinggi, kelarutan protein akan turun dengan cepat sehingga protein mengendap. Fenomena ini disebut salting out. Metode lain adalah dengan menambahkan bahan organik terlarut. Jika medium menurun konstanta dielektriknya dengan penambahan bahan organik, maka kelarutan protein menurun sehingga akan diperoleh endapan. Metode ketiga adalah dengan mengubah pH larutan protein yang menyebabkan perbedaan gugus fungsional pada protein.
Proses pengendapan menggunakan amonium sulfat dapat dikelompokkan menjadi dua bagian yaitu salting in dan salting out. Pada salting in, garam yang ditambahkan tidak jenuh atau pada konsentrasi rendah sehingga protein menjadi bermuatan dan larut dalam larutan garam. Kelarutan protein akan terus meningkat sejalan dengan peningkatan konsentrasi garam. Bila konsentrasi garam ditingkatkan terus, maka justru kelarutan protein akan turun. Bahkan pada konsentrasi garam yang lebih tinggi, protein akan mengendap. Proses penambahan garam amonium sulfat jenuh pada isolasi protein dinamakan salting out (Widyarti 2006).
Mekanisme dalam salting out sangat kompleks, tapi diperkirakan bahwa pengendapan terjadi karena proses persaingan antara garam dan protein untuk mengikat air. Pada konsentrasi tinggi, kekuatan ionik garam semakin kuat sehingga
garam dapat lebih mengikat molekul air. Dengan demikian, tidak cukup banyak air yang terikat pada protein sehingga gaya tarik menarik antara molekul protein lebih kuat bila dibandingkan dengan gaya tarik menarik antara molekul protein dengan air, sehingga protein akan mengendap (Widyarti 2006). Wang (2006) menyatakan, kelarutan protein tergantung pada konsentrasi garam dalam larutan. Pada konsentrasi garam yang rendah, keberadaan garam akan menstabilkan berbagai golongan muatan molekul protein sehingga protein menjadi lebih tertarik pada larutan dan meningkat kelarutannya. Keadaan ini dikenal dengan istilah salting in. Bagaimanapun, saat konsentrasi garam terlarut semakin meningkat, kelarutan protein akan mencapai batas optimum. Peningkatan konsentrasi garam lebih lanjut akan menyebabkan lebih sedikit kandungan air dalam larutan untuk melarutkan protein. Akhirnya, protein akan mengendap jika tidak ada lagi cukup air untuk berikatan. Fenomena pengendapan protein dalam larutan dengan kadar garam jenuh disebut salting out.
Selama proses salting out, sangat penting untuk tetap menjaga konsentrasi garam agar tidak menurun dalam larutan sehingga tidak terjadi pengendapan yang bersamaan antara protein yang ingin dimurnikan dengan protein yang tidak diinginkan. Dengan demikan selalu dilakukan pengadukan selama penambahan garam dalam prosedur salting out (Widyarti 2006).
2.4.2 Kromatografi Gel Filtrasi
Kromatografi gel filtrasi adalah suatu metoda untuk pemisahan protein dan peptida berdasarkan pada ukurannya. Matriks kromatografinya terdiri atas gel berpori. Ukuran dari gel berpori tersebut menunjukkan ukuran dari makromolekul yang dapat terfraksinasi, sehingga protein atau peptida yang terlalu besar untuk masuk ke dalam pori akan tersingkirkan dan selanjutnya terelusi dari kolom terlebih dulu. Makromolekul yang masuk ke dalam pori-pori, akan tinggal sedikit lebih lama di dalam matriks dan akan dikeluarkan dari kolom kemudian. Akhirnya molekul kecil yang masuk ke hampir seluruh pori matriks, akan terelusi belakangan dengan volume larutan eluen yang lebih banyak. Metoda ini dikenal pula dengan nama gel permeasi, penyaringan molekul, gel eksklusi dan kromatografi eksklusi berdasarkan ukuran (size-exclusion chromatography). Kromatografi gel filtrasi jarang
menginaktifasi enzim, sehingga sering kali digunakan sebagai langkah yang penting dalam purifikasi peptida atau protein.
Beberapa matriks yang digunakan dalam gel filtrasi adalah dekstran, akrilamid, agarosa dan polistiren, sehingga beberapa istilah juga digunakan untuk matriks gel filtrasi sesuai dengan bahan polimer yang membuatnya. Contohnya adalah Sephadex (gel dekstran), Sepharose (gel agarosa), Sephacryl (dekstran/ bis akrilamid) dan sebagainya (Hedlund 2004).
Gel dekstran yang biasa disebut juga dengan istilah Sephadex memiliki sifat tahan terhadap garam atau basa pada konsentrasi tinggi, akan tetapi rusak oleh asam (di bawah pH 2) dan oksidator kuat. Contoh-contoh Sephadex yang biasa digunakan untuk filtrasi gel adalah Sephadex G-25, Sephadex G-50 dan sebagainya. Salah satu bahan yang penting sebagai gel adalah dekstran (polimer gula yang biasanya larut dalam air) yang telah mengalami reaksi "cross linkage" dengan bantuan epikhlorhidrin. Hasil yang di dapat adalah dekstran yang menjadi tidak larut di dalam air, akan tetapi masih dapat menyerap molekul-molekul air di dalam molekulnya sendiri. Daya serap ini bergantung kepada jumlah “cross linkage" atau ikatan silang yang terjadi. Makin banyak ikatan silang daya serapnya makin kurang baik. Gel filtrasi merupakan teknik pemurnian yang efektif di dalam pemisahan enzim dari pelarut penggumpal, larutan garam dan bufer yang tidak dikehendaki. Kapasitas sampel cukup tinggi dan efisiensi gel filtrasi meningkat dengan semakin tingginya kolom (Ersson et al. 1998; Janson & Ryden 1998; Harris 1989).
Pada filtrasi gel tidak terjadi ikatan antara matriks dengan protein yang akan dipisahkan, sehingga komposisi bufer tidak mempengaruhi resolusi secara langsung. Pemisahan dari molekul tergantung pada spesifikasi medium gel filtrasi yang digunakan dan volume hidrodinamik dari molekul protein itu sendiri. Volume hidrodinamik bergantung pada ukuran dan bobot molekul protein tersebut. Beberapa keuntungan proses kromatografi adalah pelaksanaan yang sederhana, penggunaan waktu yang relatif singkat dan memiliki resolusi kepekaan yang tinggi. Teknik ini merupakan teknik pemisahan makromolekul protein berdasarkan ukuran relatif dari molekul protein (Harris, 1989). Filtrasi gel sangat sesuai untuk memisahkan biomolekul yang sensitif terhadap perubahan pH, konsentrasi ion logam atau ko faktor dan kondisi lingkungan yang ekstrim (Widhyastuti 2007).
2.4.3 Pemekatan Enzim dengan Pengeringbekuan
Seringkali sebelum proses pemurnian perlu pula dilakukan pemekatan larutan enzim. Hal ini terutama penting untuk pemurnian protein dari bakteri atau biakan jaringan (Harris 1989). Pemekatan protein dilakukan dengan cara pengeringbekuan, dan ekstraksi. Pengeringbekuan adalah suatu proses dimana air dihilangkan dari fasa beku melalui proses sublimasi. Pengeringbekuan banyak digunakan dalam penyimpanan berbagai material organik, diantaranya yaitu sel bakteri, dan senyawa biologis lain seperti enzim. Salah satu keuntungan proses pengeringbekuan adalah dapat diminimalisirnya perubahan kimiawi dari material organik tersebut, melalui pemekatan larutan, selain itu penggunaan suhu yang rendah akan mengurangi laju reaksi kimia (Rudge 1984).
Dalam penelitian ini pemekatan protein inhibitor dilakukan dengan cara mengeringbekukan sampel protein inhibitor yang telah dibekukan ke dalam suatu alat yaitu freeze dryer Dynafac, dan dikeringbekukan selama semalam.
2.4.4 Kromatografi Lapis Tipis (TLC)
TLC plate adalah suatu lempengan dari gelas, metal atau plastik yang dilapisi dengan lapisan tipis dari adsorben yang padat, biasanya berupa silika atau alumina . Sejumlah kecil campuran yang akan dianalisis ditotolkan di dekat dasar lempeng TLC tersebut. Lempeng TLC selanjutnya ditempatkan di dalam bejana pengembang yang berisi larutan solven pengembang, jadi hanya di bagian dasar dari lempeng tersebut yang terendam dalam larutan pengembang. Larutan pengembang tersebut adalah fasa geraknya, perlahan-lahan akan bergerak naik pada lempeng TLC melalui aktivitas kapiler.
Pada saat solven bergerak melalui spot yang ditotolkan, suatu keseimbangan akan terbentuk bagi setiap komponen didalam campuran antara molekul dari komponen yang terserap di dalam padatan dan molekul yang ada dalam larutan. Pada dasarnya, masing-masing komponen akan berbeda kelarutan dan kekuatan penyerapannya pada adsorben, dan beberapa komponen akan terbawa ke atas lempeng terlebih dulu dibandingkan dengan yang lain. Ketika solven telah mencapai puncak dari lempeng, lempeng tersebut dikeluarkan dari bejana pengembang,
dikeringkan, dan komponen-komponen yang terpisahkan dari campuran divisualisasikan. Jika senyawa tersebut berwarna, visualisasi dapat dilihat secara langsung. Biasanya untuk senyawa yang tidak berwarna, digunakan lampu UV untuk visualisasinya.
Kekuatan senyawa organik yang mengikat adsorben tergantung pada kekuatan beberapa tipe interaksi berikut ini: ion-dipol, dipol-dipol, ikatan hidrogen dan ikatan van der Walls. Dengan silika gel, kekuatan interaktif dominan antara adsorben dan material yang akan dipisahkan adalah tipe dipol-dipol. Molekul yang sangat polar akan berikatan sedikit kuat dengan ikatan Si-O yang polar dari adsorben tersebut dan kemudian akan menyerap ke dalam partikel-partikel kecil dari adsorben, dimana molekul dengan polaritas yang lemah akan terikat kurang kuat. Molekul dengan polar yang lemah selanjutnya akan terus bergerak disepanjang adsorben lebih cepat dibandingkan dengan molekul polar
(http://orgchem.colorado.edu/hndbksupport/TLC/TLC.html).
Silika gel adalah suatu bentuk silikon dioksida (silika). Atom silikon bergabung dengan atom-atom oksigen dalam struktur kovalen raksasa. Akan tetapi, dipermukaan silika gel, atom-atom silikon terikat menjadi gugus -OH. Jadi di permukaan silika gel akan terdapat ikatan Si-O-H selain dari ikatan Si-O-Si. Permukaan dari silika gel sangat polar, karena dengan adanya gugus -OH dapat membentuk ikatan hidrogen dengan senyawa-senyawa disekitarnya.
(http://www.chemguide.co.uk/analysis/chromatography/thinlayer.html)
2.4.5 Fraksinasi HPLC
High-performance liquid chromatography (HPLC), adalah suatu teknik yang mapan, kokoh, dan banyak digunakan untuk mengisolasi senyawa aktif dari produk-produk alami. Perbedaan utama antara HPLC dengan mode lainnya dalam kolom kromatografi adalah diameter dari partikel-partikel fasa stasionernya yang komparatif (3-10 µm), dan partikel-partikel ini di dikemas padat untuk memberikan struktur kolom yang sangat seragam. Diameter partikel yang kecil berarti bahwa tekanan tinggi diperlukan untuk mengalirkan solven eluen di sepanjang kolom, tetapi energi yang digunakan untuk HPLC sangat tinggi, karena total area permukaan yang memungkinkan untuk berinteraksi dengan solut juga sangat tinggi (sekitar 100-300 m2/g untuk fasa stasioner dengan diameter 5-µm) dan keseragaman dari struktur
kolom. HPLC menunjukkan efisiensi pemisahan yang tinggi yang dapat diperoleh dengan cepat, dan ekonomis dalam skala yang cukup jumlahnya untuk pemeriksaan secara spektroskopis, uji biokimia dan pengujian biologis (DOI: 10.1007/978-1-59259-256-2_6)
III BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai November 2006-Juni 2008, di Pusat Penelitian Bioteknologi-LIPI.
3.2 Bahan dan Alat
Bahan yang digunakan meliputi isolat Streptomyces chartreusis 5-095, E. coli BL21(DE3)pLysS, medium ISP2, 100 mM NaCl, 10% Gliserol, 100 mM Tris-HCl (pH 7.4), 5 mM EDTA, 0.5% SDS, 50% Gliserol, 0.1% Xylene cyanol, 0.1% Bromophenol blue, Imidazole, 10 mM MOPS bufer(pH 6.5), 2 mM ATP, 1 mM MgCl2, Amonium
sulfat, 0.081% Malachite green, 5.7% Amonium molibdat dalam 6 N HCl, 2.3% Polivinil alkohol, 30% Akrilamid bis akrilamid, APS, TEMED, β-merkaptoetanol, Commasie brilliant blue, Glisin, SDS, Marka protein 250 kDa (Biorad), Kit pewarnaan perak (Pierce) dll.
Alat-alat yang digunakan meliputi ultrasentrifugasi Sorvall RC-26 Plus, Inkubator bergoyang, sonikator (LabSonic), rotator (N-Biotec) hot plate stirrer, penangas air (Memmert), piranti elektroforesis protein (ATTO), kantung dialisis DO405-10 ft Seamless Cellulose Tubing (20 mm x 15 mm) (Sigma Aldrich), Kromatografi afinitas TALON resin (Novagen), Sephadex G-50, 96-well microtiter plate (Nalge Nunc), microplate reader (Multiscan EX Thermo), reservoir 100 ml (Labcor), Mikropipet (Pipetman), lempeng TLC Silika gel F256, kolom HPLC YMC Pack ODS (C-18) 250 x 20 mm I.D, S-5 µm dan peralatan laboratorium lainnya.
3.3 Metode Penelitian
3.3.1 Purifikasi Enzim RNA Helikase JEV Transformasi
Transformasi dilakukan dengan metode medium TSS berdasarkan modifikasi (Chung 1989). Bakteri E. coli BL21(DE3)pLysS dibiakan dalam 2 ml medium Luria Bertani (LB) cair selama satu malam dengan inkubator bergoyang pada suhu 37° C, dengan kecepatan 200 rpm. Biakan tersebut ditransfer ke dalam 50 ml medium LB
lalu diinkubasi selama 2 jam dalam inkubator bergoyang pada suhu 37° C, dengan kecepatan 200 rpm atau sampai OD600 mencapai 0.6. Jika OD600 OD600 sudah
mencapai 0.6 maka biakan tersebut disentrifugasi dengan kecepatan 4.000 rpm selama 5 menit pada suhu 4° C. Pelet yang dihasilkan dilarutkan dengan 2 ml medium TSS dingin dan campuran tersebut mengandung sel kompeten. Seratus mikroliter campuran yang mengandung sel kompeten, ditambahkan dengan 2 µl larutan yang mengandung plasmid pET-21b/JEV JNS3 helikase. Campuran sel kompeten dan plasmid diinkubasi dalam es selama 20 menit. Campuran kemudian dipindahkan ke dalam penangas air (42° C) selama 45 detik (heat shock) dan diinkubasi kembali dalam es selama 2 menit. Biakan (sel kompeten + plasmid) tersebut selanjutnya dicampur dengan 400 µl medium LB cair yang mengandung ampisilin dan diinkubasi selama satu jam dalam inkubator bergoyang pada suhu 37° C, dengan kecepatan 200 rpm. Hasil inkubasi disebar pada medium LB padat yang mengandung ampisilin kemudian diinkubasi semalam pada suhu 37° C.
Ekspresi protein NS3 helikase JEV
Ekspresi protein NS3 helikase dilakukan berdasarkan metode Utama et al. (2000a). Satu koloni bakteri E. coli BL21(DE3)pLysS yang membawa vektor ekspresi pET-21b/JEV JNS3 helikase, diinokulasikan sebanyak satu ose ke dalam 5 ml medium LB cair yang mengandung ampisilin, kemudian dibiakan selama satu malam dalam inkubator bergoyang pada suhu 37° C dengan kecepatan 200 rpm. Hasil biakan diinokulasikan ke dalam 60 ml medium LB cair yang mengandung ampisilin, kemudian dibiakan selama 1 sampai 2 jam atau sampai OD600 mencapai ±
1 dalam inkubator bergoyang pada suhu 37° C dengan kecepatan 200 rpm.
Kemudian ke dalam biakan tersebut ditambahkan 140 ml medium LB cair yang mengandung ampisilin, setelah OD600 mencapai ± 0.3 maka ke dalam biakan
ditambahkan 200 µl IPTG (konsentrasi akhir IPTG 0.3 mM). Biakan E. coli BL21(DE3)pLysS kemudian diinkubasi selama 3 jam dalam inkubator bergoyang pada suhu 37° C dengan kecepatan 200 rpm atau sampai OD600 mencapai ± 1.
Selanjutnya disentrifugasi dengan kecepatan 3.500 rpm, selama 10 menit, pada suhu 4° C. Pelet dilarutkan kembali dengan 6 ml medium LB cair kemudian disatukan dengan pelet yang lain. Semua campuran pelet tersebut disentrifugasi
dengan kecepatan 3.500 rpm, selama 10 menit, pada suhu 4° C. Pelet yang terbentuk disimpan pada suhu -70° C.
Purifikasi enzim RNA helikase JEV
Purifikasi enzim helikase JEV dilakukan berdasarkan pada metode Utama et al (2000b). Dinding sel E. coli BL21(DE3)pLysS (pelet) dilisis dengan menggunakan metode freeze & thaw sebanyak 3 kali ulangan, mula-mula pelet dibekukan pada suhu -70° C selama 30 menit lalu dicairkan pada suhu ruang (25° C) selama 30 menit. Pelet sel selanjutnya dilarutkan kembali dalam bufer B (10 mM Tris-HCl bufer (pH 8.5), 100 mM NaCl, 0.25% Tween 20) dan dipecah menggunakan sonikasi selama 5 menit dalam es (Amplitudo 40; cycle 0,5; waktu 3 x 15 detik; interval waktu 1 menit). Fraksi terlarut dari sel lisat yang jernih, selanjutnya dipurifikasi menggunakan kromatografi afinitas resin TALON metal afinity (Novagen). Setelah diaduk pelan selama 1 jam pada suhu 4 oC, resin dikoleksi melalui sentrifugasi dan
dicuci dengan bufer B.
Ekuilibrasi resin TALON dilakukan dengan cara 150 µl resin BD-Talon dicampur dengan 1 ml bufer dalam tabung mikrosentrifugasi 1,5 ml (Eppendorf), disentrifugasi sebentar lalu larutan bufer B dibuang. Proses ekuilibrasi dilakukan sebanyak tiga kali. Resin TALON yang sudah diekuilibrasi kemudian dicampur dengan supernatan (sampel), menggunakan rotator selama 2 jam dalam ruangan pendingin (6° C) dengan tujuan agar terjadi pengikatan resin TALON dengan NS3 helikase JEV. Sampel selanjutnya disentrifugasi dengan kecepatan 3.500 rpm, selama 10 menit, pada suhu 4° C. Supernatan (inner volume) disimpan pada suhu -20° C sebagai sampel untuk SDS-PAGE. Pelet (resin binding) dicuci dua kali dengan cara, pelet ditambahkan 15 ml bufer B, dan dicampur sampai homogen (selama satu menit) kemudian disentrifugasi dengan kecepatan 3.500 rpm, selama 5 menit, pada suhu 4° C. Supernatan yang terbentuk disebut washing 1 (W1). Pelet dari hasil pencucian pertama ditambahkan lagi dengan 15 ml larutan bufer B dan dicampur sampai homogen (selama satu menit), lalu disentrifugasi kembali dengan kecepatan 3.500 rpm, selama 5 menit, pada suhu 4° C. Supernatan yang terbentuk dinamakan washing 2 (W2). Kedua larutan supernatan (W 1 & W 2) disimpan pada suhu -20° C untuk SDS-PAGE.
Protein yang terikat pada resin selanjutnya dielusi dengan 2 volume bufer B yang mengandung 400 mM imidazole. Fraksi protein yang terelusi selanjutnya didialisis dalam bufer (10 mM Tris-HCl pH 8.5,100 mM NaCl, 10% gliserol) pada suhu 4 oC.
3.3.2 Uji ATPase Secara Kolorimetri
Jumlah moiety fosfat bebas yang dilepaskan dari ATP diukur secara kolorimetri. Sebanyak 50 µl campuran reaksi/ sumur mengandung 10 mM MOPS bufer (pH 6.5), 2 mM ATP, 1 mM MgCl2, dan enzim RNA helikase murni (0.8 pmol)
diinkubasi dalam 96 well microtiter plate pada suhu ruang selama 45 menit. Reaksi selanjutnya dihentikan dengan penambahan 100 µl larutan pewarna/ sumur (air : 0,081% malachite green : 5.7% amonium molibdat 6 N HCl : 2.3% polivinil alkohol = 2:2:1:1, v/v). Setelah penambahan 30% sodium sitrat sebanyak 25 µl/ sumur, selanjutnya diukur absorbansinya pada panjang gelombang 620 nm dengan referensi 405 nm. Persentasi inhibisi (%) diukur dengan menggunakan persamaan
(A-I) /A x 100, dimana A adalah aktivitas enzim yang diukur dalam keadaan tanpa
adanya senyawa inhibitor, dan I adalah aktivitas enzim yang diukur dengan adanya senyawa inhibitor (Hatsu et al. 2002).
3.3.3 Pengaruh Pertumbuhan Streptomyces chartreusis 5-095 dengan Aktivitas Inhibitor terhadap Enzim Helikase JEV
Isolat S. chartreusis 5-095 diinokulasikan sebanyak 3 ose ke dalam erlenmeyer 1.000 ml yang berisi medium cair ISP2 sebanyak 200 ml, selanjutnya diinkubasi pada suhu ruang selama 14 hari dengan pengocokan. Biakan selanjutnya dilakukan pengambilan sampel setiap hari selama 8 hari dan berikutnya 2 hari sekali. Sebanyak 5 ml biakan diambil dalam setiap pengambilan sampel dan disentrifugasi dengan kecepatan 10.000 rpm selama 10 menit. Filtrat yang diperoleh dipisahkan dari endapan dan digunakan sebagai ekstrak kasar protein inhibitor, selanjutnya diuji aktivitas inhibitornya terhadap aktivitas ATPase.