KURVA RESPON DOSIS ABERASI KROMOSOM TRANSLOKASI
AKIBAT PAPARAN RADIASI
Yanti L, Zubaidah A, Sofiati P, Dwi Ramadhani
Pusat Teknologi Keselamatan dan Mertologi Radiasi Email untuk korespondensi: k_lusiyanti@batan.go.idABSTRAK
KURVA RESPON DOSISABERASI KROMOSOM TRANSLOKASI AKIBAT PAPARAN RADIASI GAMMA. Kromsom translokasi adalah kromosom stabil yang dapat digunakan sebagai indikator kerusakan
akibat paparan radiasi pengion, tetap tinggal dalam sel darah manusia selama beberapa tahun. Analisis kromosom translokasi digunakan sebagai pengujian retrospektif untuk mengkaji kerusakan sitogenetik yang diakibatkan oleh paparan radiasi pengion dengan menggunakan kurva respon dosis yang menggambarkan hubungan antara frekuensi aberasi kromosom translokasi dengan dosis. Tujuan penelitian ini adalah pembuatan kurva standar aberasi kromosom stabil translokasi sebagai fungsi dosis radiasi gamma. Sampel darah perifer diperoleh dari tiga orang donor sehat tidak merokok berusia 25 -42 tahun dan telah mengisi”informconsent”di iradiasidengan dosis antara 1-4 Gy dan kontrol, pada laju dosis 0.38 Gy/menit, menggunakan sumber gamma teleterapi di laboratorium Meterologi Radiasi Nasional PTKMR. Sampel darah dibiakkan dengan metode pembiakkan standar, meliputi preparasi sampel, preparasi preparat dan pengecatan terhadap kromosom dengan teknik FISH menggunakan whole chromosom probe (WCP) no1 dan no 2 yang dilabel fluorocrome FITC. Pengolahan data menggunakan model persamaan Linier Quadratik, Y= a + αD + βD2. Hasil yang diperoleh
menunjukkan bahwa kurva respon aberasi kromosom translokasi terhadap dosis untuk kromosom 1 dan 2 mengikuti pola linier quadratic dengan nilai αdanβ berturut-turut, 0.004 ± 0.009 dan0.021± 0.003 untuk kromosom no 1 dan 0.027± 0.009 dan 0.01± 0.003 untuk kromosom nomor 2.Kurva respon dosis ini masih perlu dilakukan uji distribusi aberasi kromosom translokasi terhadap dosis untuk setiap individu apabila akan diaplikasikan sebagai biodosimetri radiasi restrosfektif.
Kata kunci: Kromosom, translokasi, radiasi gamma, kurva standard, biodosimetri
ABSTRACT
DOSE RESPON CURVE OF TRANSLOCATION CHROMOSOME ABERRATION CUSED BY GAMMA RADIATION EXPOSURE.Chromosome translocations are stable chromosome that can be used as
indicator of damage doe toionizing radiation exposure that remains in the human blood cells for several years. The translocation chromosome assaywere used as retrospectively to assess sitogenetic damage due to ionizing radiation exposure by using dose response curve which describes the relationship between the translocation chromosome aberration frequencies with the doses. The purpose of this study was to generate dose response curve ofchromosome aberration (translocation) induced by gamma radiation. Peripheralblood sample from three non smoking healthly volunteers age between 25-48 year with informed consent were irradiated with doses between 1-4 Gy and a control using γ teleterapy source at a dose rate of 0.38 Gy / minute at the National Radiation Meteorology Laboratory PTKMR. Blood samples were cultured by standard methods, and do procsesing of sample preparation, slide preparation and painting of the chromosome preparations with the FISH technique usingFITC-labeled fluorocrome whole chromosom probes (WCP)no1 and no 2. Analysis of dose-response curves used was LQ model Y = a + αD + βD2. The result showed that dose response curve of translocation chromosome
induced by gamma radiation for chromosome no 1 and 2 was fitted to LQ model. The value of α and β of the curve obtained were0.004 ± 0.009 and 0.021D2 ± 0.003for chromosome no 1 and 0.0267± 0.009 and 0.01± 0.003
for chromosome no 2, respectively. This response curve is steel needed individualy to be constructed for distribution test of chromosome aberration translocation versus doses since this curve will implemented for restrospective biodosimetry.
PENDAHULUAN
Aberasi kromosom yang diinduksi oleh radiasi pengion pada sel limfosit dapat berupa aberasi kromoso tidak stabil, seperti kromosom disentrik (kromosom dengan dua sentromer) dan kromosom cincin, dan aberasi kromosom stabil seperti kromosom translokasi (pertukaran fragmen dari dua atau lebih kromosom). Analisa frekuensi kromosom disentrik khususnya digunakan pada individu yang terpapar secara akut akibat kerja atau dalam kasus kecelakaan radiasi yang harus dilakukan dalam waktu secepatnya pasca paparan radiasi, karena jumlah sel yang mengandung kromosom ini akan terus menurun bersama dengan bertambahnya waktu sebagai akibat dari proses seleksi yang terjadi selama proliferasi sel [1,2].
Pemeriksaan terhadap individu yang terpapar radiasi secara kronik atau mereka yang terpapar beberapa bulan dapat dilakukan pemeriksaan terhadap kromosom bersifat stabil yaitu translokasi. Kromosom ini tidak hilang dengan bertambahnya waktu karena sel yang mengandung kromosom bentuk ini tidak mati ketika melakukan pembelahan sel. Dengan demikian adanya translokasi pada kromosom dapat digunakan sebagai indikator kerusakan genetik yang tetap ada pada sel darah pekerja atau individu yang terpapar radiasi setelah waktu yang lama atau sebagai indikator terjadinya akumulasi kerusakan untuk pendugaan risiko timbulnya kerusakan yang mengarah pada pembentukan kanker akibat radiasi. Pemeriksaan ini dapat digunakan untuk memprediksi kemungkinan adanya risiko pembentukan kanker pada individu meskipun terpapar radiasi pada waktu beberapa tahun yang lalu. Kromosom translokasi berperan dalam proses perkembangan kelainan atau penyakit genetik dan dalam karsinogenesis termasuk proses aktivasi onkogen yang menyebabkan sel normal berkembang menjadi sel malignan [2,3].
Analisis aberasi kromosom stabil translokasi sangat sulit bila menggunakan tehnik pewarnaan (banding) konvensional seperti yang digunakan untuk pengamatan kromosom tidak stabil. Chromosome
Painting adalah teknik pengujian untuk memvisualisasikan terjadinya translokasi atau inversi pada kromosom yang dikenal dengan teknik
Fluorescence in situ hybridization (FISH). Tehnik
pengujian ini dapat digunakan untuk analisa sitogenetik rutin baik untuk deteksi perubahan struktur maupun jumlah kromosom secara individual. Dengan demikian teknik FISH ini sangat bermanfaat untuk memprediksi efek radiasi tertunda (retrospektif) melalui analisa kerusakan sitogenetik [4,5]. Estimasi dosis berdasarkan frekuensi kromosom translokasi, dapat diterapkan
dengan menggunakan kurva standar aberasi kromosom yang menggambarkan frekuensi aberasi kromosom translokasi terhadap dosis. Dari hasil penelitian telah melakukan evaluasi dosis berdasarkan frekuensi aberasi kromosom translokasi yang diterima pekerja radiasi yang telah bekerja selama 36 tahun dengan dosis akumulasi fisik yang diterima adalah 0,56 Sv, estimasi dosisnya sekitar 0,6 Sv [16].
Secara umum aberasi kromosom dapat diinduksi oleh semua jenis radiasi. Frekuensi terjadinya aberasi kromosom bergantung pada linear energy transfer (LET), laju dosis dan dosis. Dengan diketahui frekuensi kromosom translokasi sebagai fungsi dosis suatu jenis radiasi, dapat dibuat kurva standar untuk jenis radiasi tersebut. Jadi setiap jenis radiasi dengan laju dosis tertentu mempunyai kurva standar yang spesifik yang menggambarkan daya rusak jenis radiasi tersebut terhadap sistem biologik, dalam hal ini adalah sel darah limfosit [5,6].
Tujuan penelitian ini adalah pembuatan kurva respon aberasi kromosom stabil translokasi yang diinduksi paparan radiasi sinar gamma Co-60. Implementasi kurva ini diharapkan dapat digunakan dalam mengkaji kerusakan sitogenetik yang diterima individu yang terpapar radiasi retrospektif akibat kerja, kedaruratan radiasi, tindakan medis atau lainnya.
METODOLOGI
Pengambilan sampel dan Iradiasi sampel darah Sampel darah perifer diambil dari 3 donor berjenis kelamin pria sehat tidak merokok berusia antara 25-48 tahun dan telah mengisi inform consernt. Masing-masing donor diambil sebanyak ± 35 ml dimasukkan dalam tabung BD (Beck and Dickinson) vacutainer volume 4 ml yang berisi heparin. Salah satu aliquot digunakan sebagai kontrol dan terhadap sisanya dilakukan radiasi menggunakan pesawat teleterapi Co-60 (CIRUS) di Laboratorium Metrologi Radiasi Nasional PTKMR BATAN. Dosis yang diberikan adalah 1-4 Gy pada laju dosis 0,38 Gy/min. Prosedur iradiasi berlangsung seperti yang dijelaskan dalam IAEA TRS 398 [7] dan untuk masing masing dosis dilakukan dua kali. Setelah proses irradiasi, sampel darah disimpan pada suhu 370C selama ± 1 jam untuk memberikan peluang proses perbaikan pada sel pasca irradiasi sesuai prosedur standar IAEA [1]. Visualisasi proses irradiasi ditampilkan dalam Gambar 1.
Gambar 1. Proses Irradiasi sampel darah menggunakan sinar Gamma Co-60. Pembiakan dan pemanenan sel darah limfosit
Sebanyak 1 ml darah yang telah diirradiasi dibiakkan dalam media pertumbuhan yang diperkaya dengan 7,5 ml RPMI-1640 yang telah dilengkapi HEPES BUFFER dan L-glutamin.20 % fetal bovine
serum, PHA dan 1 % penicillin streptomycin. Botol
biakan ditutup rapat dan disimpan dalam inkubator 37ºC yang dialiri CO2 5 % selama 48 jam. Pada 3 jam sebelum panen, ditambahkan kolhisin untuk menghentikan proses pembelahan agar sel berada pada tahap metafase. Darah yang telah dibiakkan, disentrifus dengan kecepatan 1500 rpm selama 10 menit. Supernatan dibuang dan endapan darah diaduk dengan pipet pasteur dan ditambah dengan larutan 0,075 M KCL lalu disimpan di waterbath selama 25 menit. Dilakukan
sentrifugasi dengan kecepatan yang sama, supernatan
dibuang dan pada endapan ditambahkan 8-10 ml larutan fixativ carnoy ( 3 :1 Matanol : Asam asetic) dan dilakukan sentrifugasi dengan kecepatan yang sama. Tahapan ini diulang beberapa kali sampai diperoleh endapan limfosit yang berwarna putih.
Pengecatan kromosom sel limfosit dengan teknik FISH
Preparat kromosom disiapkan dengan meneteskan endapan limfosit sebanyak 3 tetes di atas objek glass dan dikeringkan pada suhu 65o C selama 1,5 jam.Preparat kromosom dicuci dalam serial etanol 70% (2x), 90% masing-masing selama 2 menit dan etanol 100% selama 5 menit. Preparat dikeringkan pada suhu 65o Cselama 1,5 jam. Selanjutnya dilakukan proses denaturasi Preparat dengan merendam preparat dalam larutan formamide (direndam dalam air suhu 65o C) selama 1,5 menit, kemudian dicuci dalam serial etanol 70 % dingin selama
4 menit, etanol 70 %, 90 % (2x) masing-masing selama 2 menit dan terakhir etanol 100 % selama 5 menit. Kemudian dilakukan denaturasi probe chromosome
painting dalam air dengan suhu 65o Cselama 10 menit lalu probe direndam dalam waterbath 37oC selama 45 menit. WCP yang digunakan adalah kromosom no1 dan no 2.Kemudian dilakukan hibridisasi pada preparat kromosom dengan meneteskan 10 µl dengan komposisi ( 3 µl probe + 7 µl Buffer) lalu ditutup dengan cover
glass dan direkat dengan lem kuning. Setelah diinkubasi
preparat kromosom disimpan dalam kotak plastik gelap dan diinkubasi pada 37oC selama 16 jam. Proses pencucian dilakukan dengan carapreparat dicelupkan dalam larutan 1x SSC dan cover glass dilepas. Kemudian preparat berturut-turut dicuci dalam larutan
stringency selama 5 menit, larutan 1 x SSC selama 5
menit (2 x) dan larutan detergen selama 4 menit. Semua larutan pencuci tersebut sebelumnya direndam dalam waterbath suhu 45oC selama 30 menit.Preparat dikeringkan dan diteteskan 10 ul DAPI di atas preparat kromosom dan ditutup dengan cover glass untuk kemudian dilakukan pengamatan dan pemotretan di bawah mikroskop fluorescence yang dihubungkan dengan program Aplied imaging sytem Cytovision. Analisis Statistik
Pengolahan data untuk pembuatan kurva respon kromosom translokasi terhadap dosis , dibuat dengan menggunakan program perangkat lunak DOSE ESTIMATE V4.1 olehHelath Protection Agency (HPA) [8] dan uji t-test pada taraf keperrcayaan 5 % (p=0.05) untuk menguji signifikansifrekuensi kromosom translokasi dan persamaan kurva respon translokasi pada kromosom 1 dan 2.
HASIL DAN PEMBAHASAN
Pada penelitianini, pengamatan kromosom translokasi pada sel limfosit pasca irradiasisinar gamma, dilakukan dengan melakukan pengecatan kromosom pada kromosom 1 dan 2 untuk setiap dosis dengan teknik FISH menggunakan kromosom spesifik yang dilabel dengan fluorochrome FITC. Pengecatan dilakukan terhadap kromosom spesifik, sementara kromosom yang lain diberi pewarna DNA berpendar yang tidak selektif (nonselective fluorescent DNA dye) yaitu DAPI. Penggunaan probe dengan urutan genom yang spesifik, dan melalui proses hibridisasi yang simultan dengan probe yang dilabel dan flurescent dye yang berbeda dapat mendeteksi beberapa lokasi genom dengan urutan yang berbeda dalam waktu yang sama [9,10]. Hasil Irradasi sampel darah dalam fantom air Pesawat teleterapi C0-60
pemotretan terhadap kromosom translokasi maupun yang kromosom normal ditunjjukan pada Gambar 2.
Gambar 2. Visualisasi pengecatan kromosom nomor1dan 2 pasca irradiasi sinar gamma (a) kromosom nomor1 normal (b&d) translokasi pada kromosom nomor1 (c) translokasi pada kromosom
nomor 2
Sedangkan data pengamatan sebaran sel yang mengandung kromosom translokasi pada setiap dosis ditunjukkan pada Tabel 1.
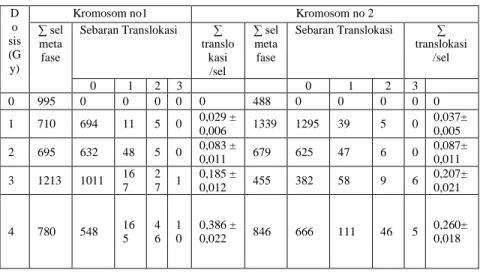
Tabel 1. Data frekuensi sebaran sel yang mengandung kromosom translokasi pada sel kromosom nomor 1 dan 2 pasca irradiasi gamma
Terlihat untuk perlakuan dosis 1 Gy frekuensi kromosom translokasi/sel metaphase pada kromosom 1 dan 2 berturut turut adalah 0,029 dan 0,037 dan frekuensinya meningkat sesuai dengan kenaikan dosis radiasi hingga dosis 4 Gy frekuensinya meningkat menjadi 0,368 dan 0,260. Dari hasil penelitian ini
terlihat bahwa frekuensi translokasi per/seluntuk kromosom no 1 lebih dominan dibanding dengan kromosom nomor 2. Dalam penelitian ini dilakukan uji statistic t-tes terhadap frequensi translokasi pada kromosom 1 dan 2 untuk dosis 1-4 Gy dengan taraf kepercayaan 5 % (p=0,05). Berdasarkan uji tersebut diperoleh hasil bahwa frequensi kromosom translokasi pada kromosom 1 dan 2 menunjukkan perbedaan bermakna pada tingkat kepercayaan 5% (p=0,05).
Penelitian lain oleh Boei 1997 [12] mendapatkan hasil yang sama dengan penelitian ini yakni kromosom nomor1 lebih banyak mengalami Exchange dibanding dengan kromosom nomor 2. Namun pada penelitian Wojck 1998, dengan menggunakan WCP yang sama melaporkan bahwa frekuensi kromosom translokasi no 2 lebih tinggi dibanding dengan kromosom nomor 1. Fenomena tersebut tidak dapat secara mutlak dapat diprediksi karena hasil heterogen terhadap induksi yang terjadi kemungkinan disebabkan karena adanya kontribusi sensitifitas dan status fisiologi sel dari individu yang berbeda-beda dalam Wojcik [11] mengemukakan bahwa semua kromosom berdasarkan kandungan DNA nya secara umum dapat terinduksi oleh radiasi pengion.
Perbedaan hasil yang heterogen kemungkinan disebabkan oleh variabilitas dan sensitivitas kromosom pada individu yang berbeda beda serta kriteria scoring yang berbeda-beda untuk setiap penelitian. Kemungkinan yang lain adalah karena homogenitas paparan radiasi yang diterima tidak merata.
Hasil penelitian menunjukkan bahwa sejumlah kromosom tertentu ternyata lebihsen sitif terhadap radiasi dibanding dengan kromosom lainnya sehingga lebi sering terinduksi kerusakan pertukaran fragmen kromosom atau translokasi. Distribusi patahan kromosom ternyata bersifat tidak random pada genom
D o sis (G y)
Kromosom no1 Kromosom no 2
∑ sel meta fase Sebaran Translokasi ∑ translo kasi /sel ∑ sel meta fase Sebaran Translokasi ∑ translokasi /sel 0 1 2 3 0 1 2 3 0 995 0 0 0 0 0 488 0 0 0 0 0 1 710 694 11 5 0 0,029 ± 0,006 1339 1295 39 5 0 0,037± 0,005 2 695 632 48 5 0 0,083 ± 0,011 679 625 47 6 0 0,087±0,011 3 1213 1011 16 7 2 7 1 0,185 ± 0,012 455 382 58 9 6 0,207± 0,021 4 780 548 16 5 4 6 1 0 0,386 ± 0,022 846 666 111 46 5 0,260± 0,018 c a b d
manusia.Dari penelititian Louhmarara diketahui bahwa kromosom nomor 1 dan 4 mempunyai lebih banyak patahan pada bagian tengah lengan p dan q, sementara patahan relatif merata sepanjang kromosom nomor 2 [13]. Dari data frequensi kromosom translokasi dilakukan pengolahan statistik pembuatan kurva respon aberasi kromosom translokasi, menggunakan persamaan Linier Quadratic ( LQ) Y= a + αD + βD2 dengan Y adalah jumlah kromosom translokasi, a adalah translokasi akibat radiasi latar, α adalah koefisien korelasi linier untuk aberasi kromosom translokasi yang yang diinduksi oleh radiasi jejak tunggal (single track) dan β koefisien kuadrat dosis untuk aberasikromosom translokasi yang produksi oleh radiasi jejak ganda. Pengolahan data dilakukan dengan menggunakan perangkat lunak DOSE ESTIMATE 4.1 oleh Helath
Protection Agency (HPA), yaitu perangkat lunak yang
digunakan untuk membantu pembuatan kurva respon dosis untuk memudahkan penentuan nilai a,α dan β (Gambar 3) [8].
Gambar 3. Kurva standar kromosom translokasi 1 dan 2 Vesus dosis pasca irradiasi sinar gamma
dosis 1-4 Gy serta Kontrol.
Dari hasil pengolahan data diperoleh persamaan untuk kromosom nomor 1 Y = 0 + 0.004D ± 0.009+ 0.021D2 ± 0.003 dengan nilai koefisien korelasi r = 0,996 sedangkan untuk kromosom no 2 Y=0 + 0.027D ± 0.009+0.011D2± 0.003 dengannilai r = 0,986. Untuk melihat signifikansi antar koefisien α dan β pada masing masing persamaan kurva respon aberasi kromosom translokasi terhadap dosis untuk kromosom 1 dan 2, dilakukan uji t tes dengan hasil yang menunjukkan perbedaan bermakna pada tingkat kepercayaan 5 % (p=0,05).
Beberapa faktor yang mempengaruhi hasil induksi aberasi kromosom, yaitu faktor fisikbiologis dan kondisi laboratorium. Faktor fisik yang berpengaruh pada induksi pembentukan disentrik adalah LET, laju dosis dan dosis sedangkan faktor biologi diantaranya adalah kinetika sel limfosit, variasi media kultur dan sensitivitas sel [6,7]. Kurva respon translokasi terhadap
dosis yang diperoleh di setiap laboratorium tidak dapat dengan mudah dibandingkan karena pemilihan kombinasi nomor kromosom yang akan di cat (painting)dan criteria scoring untuk setiap laboratorium berbeda-beda.
KESIMPULAN
Kurva respon dosis terhadap frekuensi translokasi pasca radiasi sinar gamma untuk kromosom 1 dan 2 mengikuti pola Linier Quadratik, dengan nilai koefisien αdan β berturut turut 0.004 ±0.009 dan 0.021± 0.003 untuk kromosom nomor 1 dan 0.027± 0.009 dan 0.011± 0.003 untuk kromosom nomor 2. Dalam penelitian ini frekuensi translokasi per sel untuk kromosom nomor 1 lebih dominan dibanding dengan kromosom nomor 2. Terdapat perbedaan bermakna untuk frekuensi translokasi per sel untuk setiap dosis dan untuk koefisien α maupun β untuk kedua kurva respon aberasi tersebut pada tingkat kepercayaan (p=0,05).
UCAPAN TERIMAKASIH
Penelitian ini telah terlaksana dengan dana DIPA PTKMR. Penulis mengucapkan banyak terima kasih kepada Laboratorium SSDL PTKMR.
DAFTAR PUSTAKA
1. INTERNATIONAL ATOMIC ENERGY AGENCY. Cytogenetic Dosimetry : Applications in Preparedness for and Response to Radiation Emergencies. IAEA Vienna Pub : September (2011).
2. LLOYD, D.C., PURROTT,R.J, DOLPHIN, G.W., BOLTON, D., EDWARDS. A.A and CORP, M.J., 1975, The relationship between chromosome aberrations and low LET radiation dose to human lymphocytes, International Journal of Radiation
Biology28 (1).
3. HALL., E.J., 2000, Radiobiology for Radiologist, 5th ed J.B. Lippincott Company, Philadelphia. 4. BUSHONG,S.C., 1988, Radiobologic Science For
Technologists: Physics, Biology, and Protection. 4th ed. The CV Mosby Company, St Louis.
5. LLOYD, D.C., PURROTT,R.J, DOLPHIN, G.W., BOLTON, D., EDWARDS. A.A and CORP, M.J., 1975, The relationship between chromosome aberrations and Low LET radiation dose to Human Lymphocytes. International Journal of Radiation
Biology Vol 28 N0 1 : 75-90. Fr e ku e n si Tr an sl o kasi /sel Dosis (Gy) Kr…
6. SASAKI, M.S., 1971 Biological Aspects of Radiation Protection, edited by T. SUGAHARA and O..HUG Berlin Springer.
7. INTERNATIONAL ATOMIC ENERGY AGENCY, “Absorbed Dose Determination in Photon and Electron Beams an International Code of Practice” (Technical Reports Series. 277 2nd ed), IAEA, Vienna, (1987).
8. AINSBURY, A., and LLYOD, D., 2010, Dose Estimation Software for Radiation Biodosimetry,
Health Physics 98 (2), , P 290-295.
9. Du FRAIN, R.J, LITTLEFILD, L.G., JOINER, E.E., and FROME, E.L., 1980, In Vitro Human Cytogenetic Dose-Response Systems. In The Medical Basis for Radiation Accident Preparedness. By Hubner.K.F. and S.A.Fry,(Eds) Elsevier North Holland Inc.
10. EDWARDS, A.A., LLYOD, D,C., PURROT, R.J., 1979, Radiation Induced Chromosome Aberrations and The Poisson Distribution, Radiat, Eviron
Biophysis. 16.
11. WOJIC, A., and CHRISTIAN STREFFER, 1998, Comparison of Radiation Induced Aberration Frequencies in Chromosomes 1 and uman Donors. Int J Radiat Biol 74, No 5.
12. LINDHOLM,C., S. LUMAHAARA, A.KOIVISTOINEN, T. ILUS, A.A. EDWARDS and S. SALOMAA, 1998, Comparison of dose-response curves for chromosomal aberration established by chromosome painting and conventional analysis. International Journal of
Radiation Biology 74 (1).
13. LUOHAMAARA, S., LINDHOLM, C., MUSTONEN,R. and SLOMAA, S., 1999, Distribution of Radiation-Induced Exchange Aberrations in Human Chromosome 1,2 and 4.
International Journal of Radiation Biology 75(12),
1551-1556.
14. FINNON, P., MOQUET, J.E., EDWARDS, A.,A and D.C.LLYOD, 1999, The 60Co Gamma Ray Dose-Response for Chromosomal Aberrations In Human Lymphocytes Analysed by FISH: Applicability to Biological Dosimetry
International Journal of Radiation Biology 75 (12).
15. LINDHOLM,C., SALOMAA, S., TEKKEL, W., PAILE,A., KOIVISTOINEN, T., ILUS, and VEIDEBAUM, T., 1996, Biodosimetry after Accidental Radiation Exposure by Conventional Chromosomal Analysis and FISH. International
Journal of Radiation Biology 70 (6).
16. HSIEH, W.A., J.N, LUCAS., J.J. HWANG., C.C.CHAN and W.P.CHANG. Biodosimetri Using Chromosomal Translocations Measured by FISH in a Population Chronical Exposed to Low Dose Rate
60Co γ-Irradiation. Int.J.Radiat. Biol 77.No.7 [2001] 797-804