TESIS
FRAKSINASI DAN KARAKTERISASI EKSTRAK ETANOL
BUAH PANDAN JERONGGI (Iris domestica (L.) Goldblatt &
Mabb) SERTA UJI AKTIVITAS ANTIBAKTERI
DARI MASING-MASING FRAKSI
OLEH :
JON KENEDY MARPAUNG
NIM 147014039
PROGRAM STUDI MAGISTER
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
FRAKSINASI DAN KARAKTERISASI EKSTRAK ETANOL
BUAH PANDAN JERONGGI (Iris domestica (L.) Goldblatt &
Mabb) SERTA UJI AKTIVITAS ANTIBAKTERI
DARI MASING-MASING FRAKSI
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Magister Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH :
JON KENEDY MARPAUNG
NIM 147014039
PROGRAM STUDI MAGISTER
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN TESIS
FRAKSINASI DAN KARAKTERISASI EKSTRAK ETANOL BUAH PANDAN JERONGGI (Iris domestica (L.) Goldblatt & Mabb) SERTA UJI
AKTIVITAS ANTIBAKTERI DARI MASING-MASING FRAKSI
OLEH :
JON KENEDY MARPAUNG NIM 147014039
Disetujui Oleh :
Komisi Pembimbing, Komisi Penguji,
Dr. Panal Sitorus, M.Si.,Apt Prof. Dr. Masfria, M.S.,Apt NIP 195310301980031002 NIP 195707231986012001
Prof. Dr. Dwi Suryanto, M.Sc Dr. M. Pandapotan Nst, MPS.,Apt. NIP 196424091994031003 NIP 194908111976031001
Dr. Panal Sitorus, M.Si.,Apt NIP 195310301980031002
Prof. Dr. Dwi Suryanto, M.Sc NIP 196424091994031003
Medan, 19 Agustus 2020
Mengetahui, Disahkan Oleh:
Ketua Program Studi, Dekan,
Prof. Dr. Urip Harahap, Apt Prof. Dr. Masfria, M.S.,Apt NIP 195301011983031004 NIP 195707231986012001
PERSETUJUAN TESIS
Nama : Jon Kenedy Marpaung
Nomor Induk Mahasiswa : 147014039
Program Studi : Magister Ilmu Farmasi
Judul Tesis : Fraksinasi Ekstrak Etanol dan Karakterisasi Ekstrak Etanol Buah Pandan Jeronggi (Irisdomestica (L.) Goldblatt & Mabb) Serta Uji Aktifitas Antibakteri dari Masing-Masing Fraksi
Telah diuji dan dinyatakan LULUS di depan Komisi Penguji Tesis Pada Hari Kamis, 30 Januari 2020
Menyetujui :
Komisi Penguji Tesis,
Ketua : Dr. Panal Sitorus, M.Si.,Apt Sekertaris : Prof. Dr. Dwi Suryanto, M.Sc Anggota : Prof. Dr. Masfria, M.S.,Apt
PERNYATAAN ORISINALITAS
Saya yang bertanda tangan di bawah ini:
Nama Mahasiswa : Jon Kenedy Marpaung Nomor Induk Mahasiswa : 147014039
Program Studi : Magister Ilmu Farmasi
Judul Tesis : Fraksinasi Ekstrak Etanol dan Karakterisasi Ekstrak Etanol Buah Pandan Jeronggi (Irisdomestica (L.) Goldblatt & Mabb) Serta Uji Aktifitas Antibakteri dari Masing-Masing Fraksi
Dengan ini menyatakan bahwa hasil penelitian pada Tesis yang saya buat adalah asli karya saya sendiri bukan plagist dan apabila dikemudian hari diketahui Tesis saya tersebut plagiat karena kesalahan saya sendiri, maka saya bersedia diberi sanksi apapun oleh Program Studi Magister Ilmu Farmasi Fakultas Farmasi Universitas Sumatera Utara. Saya tidak akan menuntut pihak manapun atas perbuatan saya tersebut.
Demikian pernyataan ini saya buat dengan sebenarnya dan dalam keadaan sehat.
Medan, 30 Januari 2020 Yang Menyatakan
Jon Kenedy Marpaung NIM : 147014039
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah melimpahkan rahmat, karunia, dan ridhoNya sehingga penulis dapat menyelesaikan Tesis yang berjudul “ Fraksinasi Ekstrak Etanol dan Karakterisasi Ekstrak Etanol Buah Pandan Jeronggi (Irisdomestica (L.) Goldblatt & Mabb)”. Tesis ini diajukan sebagai salah satu syarat untuk memperoleh gelar Magister Ilmu Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada tumbuhan ini ditemukan metabolit sekunder yang berpotensi menyembuhkan luka dan mengobati bisul. Atas dasar itulah maka dilakukan penelitian untuk memastikan potensi antibakteri terhadap bakteri gram positif dan garam negative. Penelitian ini menyimpulkan bahwa Ekstrak etanol buah pandan jeronggi dapat bersifat antibakteri terhadap bakteri Gram positif dan Gram negatif. Penelitian ini diharapkan memperoleh data awal untuk kemudian dikembangkan dalam publikasi ilmiah.
Pada kesempatan ini penulis menyampaikan terima kasih yang sebesar-besarnya kepada Dr. Panal Sitorus, M. Si., Apt. dan Prof. Dr. Dwi Suryanto, M.Sc. atas waktu, arahan, dan bimbingan yang diberikan selama penyelesaian Tesis ini. Pada kesempatan juga peneliti menyampaikan terima kasih kepada Prof. Dr. Masfria, M.S., Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan dan fasilitas selama menjalani pendidikan di Program Magister Ilmu Farmasi Ilmu Farmasi. Kepada kedua orang tua, Ayahanda Jamaluddin Marpaung dan Ibunda Ruminah tercinta, penulis menyampaikan terima kasih dan penghargaan yang setinggi-tingginya atas semua pengorbanan, doa, dan dorongannya, sehingga Tesis ini dapat diselesaikan.
Medan, 30 Januari 2020 Penulis,
Jon Kenedy Marpaung NIM 147014039
FRAKSINASI EKSTRAK ETANOL DAN KARAKTERISASI EKSTRAK ETANOL BUAH PANDAN JERONGGI (Iris domestica (L.) Goldblatt &
Mabb) SERTA UJI AKTIVITAS ANTIBAKTERI DARI MASING-MASING FRAKSI
ABSTRAK
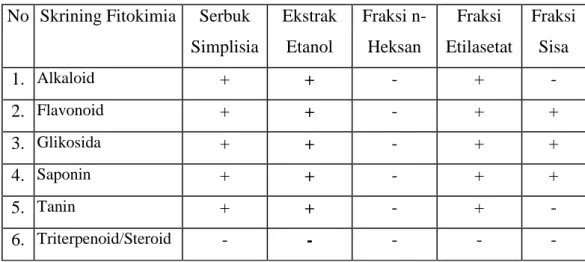
Pandan Jeronggi merupakan tumbuhan yang hidup di daerah rawa pada hutan muda suku Iridaceae. Buah pandan jeronggi digunakan sebagi obat untuk menghentikan pendarahan pada Luka, untuk mengobati Luka serta digunakan sebagai obat Bisul, untuk mempercepat pematangan Bisul, anti bakteri dan Penyakit Kulit. Pada bagian buah pandan jeronggi mengandung senyawa kimia flavonoid, alkaloid, glikosida, saponin dan tanin.
Tujuan Penelitian untuk mengetahui aktivitas antibakteri dari ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi sisa (air) dari buah pandan jeronggi terhadap beberapa jenis bakteri.
Karakterisasi simplisia meliputi pemeriksaan organoleptik, makroskopik simplisia, mikroskopik serbuk simplisia, penetapan kadar air dan dilakukan juga terhadap ekstrak etanol. Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut etanol 96% kemudian di fraksinasi dengan pelarut n-heksan dan etilasetat. Uji skrining fitokimia dilakukan terhadap serbuk simplisia dan ekstrak etanol. Uji aktivitas antibakteri dilakukan menggunakan metode difusi agar dengan mengukur diameter zona bening sekitar kertas cakram.
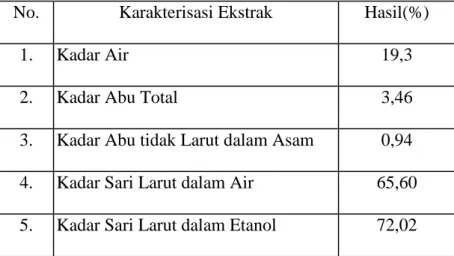
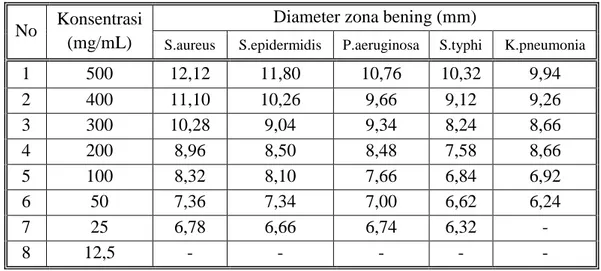
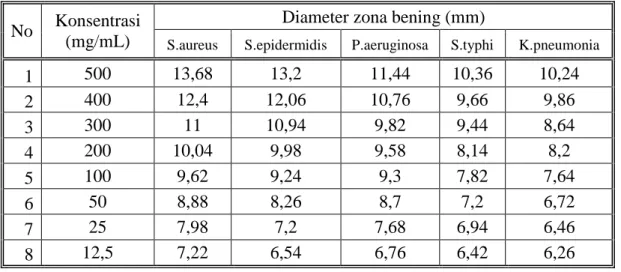
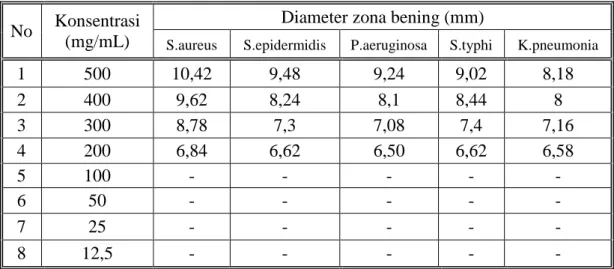
Hasil karakterisasi simplisia dan ekstrak etanol diperoleh kadar air 9,23% dan 19,13%. Hasil uji skrining fitokimia pada ekstrak kental terdapat golongan alkaloid, flavonoida, glikosida, saponin, dan tanin. Hasil uji aktivitas antibakteri menunjukkan adanya daya hambat pada bakteri gram positif dan gram negatif. Fraksi etilasetat dan ekstrak etanol mempunyai aktivitas antibaketri tertinggi dengan konsentrasi 500 mg/ml diameter hambat 13,68 mm untuk bakteri Staphylococcus aureus,13,2 mm untuk bakteri Staphylococcus epidermidis, 11,44 mm untuk bakteri Pseudomonas aeruginosa,10,36 mm untuk bakteri Salmonella typhi dan 10,24 untuk bakteri Klebsiella pneumonia. Pada ekstrak etanol untuk bakteri Staphylococcus aureus 12,12 mm untuk bakteri Staphylococcus epidermidis, 11,80 mm untuk bakteri Pseudomonas aeruginosa,10,76 mm untuk bakteri Salmonella typhi 10,32 dan untuk bakteri Klebsiella pneumonia 9,94 mm, sedangkan pada fraksi sisa menunjukkan daya hambat yang tidak terlalu tinggi seperti ekstrak etanol dan fraksi etilasetat pada fraksi n- heksan tidak memiliki daya hambat.. Hasil KKt yang didapat dari fraksi etil acetat terdapat 3 (tiga) noda secara visual, dengan penyemprot AlCl3 terdapat 2 noda, dengan uap ammonia
terdapat 3 noda, senyawa yang terdapat dalam fraksi etil acetat diduga sebagai aktivitas antibakteri adalah fenolik.
Kata kunci: Iris domestica (L.) Goldblatt & Mabb, Antibakteri,. Staphylococcus aureus, Staphylococcus epidermidis, Pseudomonas aeruginosa, salmonella typhi, Klebsiella pneumonia, KKt.
FRACTINATION AND CHARACTERIZATION OF ETHANOL EXTRACT OF PANDAN JERONGGI FRUIT (Iris domestica (L.)
Goldblatt & Mabb) AND ANTIBACTERIAL ACTIVITY OF EACH FRACTION
ABSTRACT
Pandan Jeronggi of the family Iridaceae is a plant that lives in swampy areas of the rain forest. Jeronggi pandan fruit is widely used to stop bleeding of wounds, accelerating the maturation of boils, anti-bacterial for skin diseases. The Pandan Jeronggi fruit contains flavonoids, alkaloids, glycosides, saponins and tannins.
The research aims to find out antibacterial activity of ethanol extract, n-hexane fraction, ethylacetate fraction and residual fraction (aqueous) of Pandan Jeronggi fruit against several types of bacteria.
Simplisia characterization includes organoleptic, macroscopic, microscopic, determination of aqueous content and which are also carried out on ethanol extract. Extraction was accomplished by maceration using 96% ethanol as solvent then fractionated with n-hexane and ethylacetate. Phytochemical screening tests were carried out against simplicia powder and ethanol extract. Antibacterial activity test was carried out using the agar diffusion method by measuring the diameter of the clear zone around the paper disc.
The results of the simplicia characterization and ethanol extract gave water content of 9.23% and 19.13%. Phytochemical screening test of extract showed the presence of alkaloids, flavonoids, glycosides, saponins, and tannins. Antibacterial activity test results shows ed the inhibition of gram-positive and gram-negative bacteria. Growth ethyl acetate fraction and ethanol extract have the strongest antibacterial activity with a concentration of 500 mg/ ml with inhibitory diameter of 13.68 mm for Staphylococcus aureus, for Staphylococcus epidermidis 13,2 mm, and 11.44 mm for Pseudomonas aeruginosa, for Salmonella typhi 10,36 and Klebsiella pneumonia10,24 mm. Ethanol extract in Sthaphylococcus aureus 12.12 mm, for Staphylococcus epidermidis 11,80 mm, and 10,76 mm for Pseudomonas aeruginosa, for Salmonella typhi 10,32 and Klebsiella pneumonia 9,94 mm while the remaining fraction shows not too high inhibitory properties such as ethanol extract and ethylacetate fraction the n-hexane fraction has no inhibitory power. The KKt results obtained from the ethyl acetate fraction contained three visual stains, with AlCl3 spray two are also three stains, with ammonia vapor there are
three stains, the compound contained in the ethyl acetate fraction suspected as an antibacterial activity is fenolik.
Keywords : Iris domestica (L.) Goldblatt & Mabb, Antibacterial, Staphylococcus aureus, Staphylococcus epidermidis, Klebsiella pneumoniae, Pseudomonas aeruginosa, Salmonella typhi, KKt
DAFTAR ISI
HALAMAN SAMPUL --- i
HALAMAN PENGESAHAN TESIS --- iii
HALAMAN PERSETUJUAN TESIS --- iv
HALAMAN PERNYATAAN ORISINALITAS --- v
KATA PENGANTAR --- vi
ABSTRAK --- vii
ABSTRACT --- viii
DAFTAR ISI --- ix
DAFTAR TABEL --- xii
DAFTAR GAMBAR --- xiii
DAFTAR LAMPIRAN --- xiv
BAB 1 PENDAHULUAN --- 1 1.1 Latar Belakang --- 1 1.2 Perumusan Masalah --- 3 1.3 Hipotesa --- 3 1.4 Tujuan Penelitian --- 4 1.5 Manfaat Penelitian --- 4
1.6 Kerangka Pikir Penelitian --- 5
BAB II TINJAUN PUSTAKA --- 6
2.1 Uraian Tumbuhan --- 6 2.1.1 Klasifikasi Tumbuhan --- 6 2.1.2 Morfologi Tumbuhan --- 6 2.1.3 Senyawa Aktif --- 7 2.2 Simplisia --- 7 2.3 Ekstrak --- 7 2.3.1 Ekstraksi --- 8 2.3.2 Fraksinasi --- 8 2.4 Kromatografi --- 8 2.4.1 Kromatografi Kertas (KKt) --- 9 2.5. Bakteri --- 10
2.5.1 Uraian Umum Bakteri --- 10
2.5.2 Bakteri Staphylococus aureus --- 12
2.5.3 Bakteri Klebsiella pneumonia --- 13
2.5.4 Bakteri Salmonella thypi --- 13
2.5.5 Bakteri Pseudomonas aeruginosa --- 14
2.5.6 Bakteri Staphylococus epidermidis --- 15
2.6. Pengukuran Aktivitas Antibakteri --- 15
2.7 Mekanisme Kerja Antimikroba --- 19
BAB IIII METODE PENELITIAN --- 21
3.1. Tempat Pelaksanaan Penelitian --- 21
3.2 Metode Penelitian --- 21
3.3. Alat dan Bahan --- 21
3.3.1 Alat --- 21
3.3.2 Bahan --- 22
3.4. Pengumpulan dan Pengolahan Bahan Tumbuhan --- 22
3.4.2 Pengolahan Bahan Tumbuhan --- 22
3.4.3 Identifikasi Tumbuhan --- 23
3.5. Pembuatan Larutan Pereaksi --- 23
3.5.1 Pereaksi Liebermann-Burchard --- 23
3.5.2 Pereaksi Asam Sulfat 2 N --- 23
3.5.3 Pereaksi Molisch --- 23
3.5.4 Pereaksi Mayer --- 23
3.5.5 Pereaksi Besi (III) Klorida 10 % --- 24
3.5.6 Pereaksi Dragendorff --- 24
3.5.7 Pereaksi Bouchardat --- 24
3.5.8 Pereaksi Natrium Hidroksida 2 N --- 24
3.5.9 Pereaksi Asam Nitrat 0,5 N --- 24
2.5.10 Pereaksi Timbal (II) Asetat 0,4 N --- 24
2.5.11 Kloralhidrat 70 % b/v --- 24
3.6 Pemeriksaan Karakterisasi Simplisia --- 25
3.6.1 Pemeriksaan Makroskopik Simplisia --- 25
3.6.2 Pemeriksaan Mikroskopik Serbuk Simplisia --- 25
3.6.3 Penetapan Kadar Air --- 25
3.6.4 Penetapan Kadar Sari Larut dalam Air --- 26
3.6.5 Penetapan Kadar Sari Larut dalam Etanol --- 26
3.6.6 Penetapan Kadar Abu Total --- 26
3.6.7 Penetapan Kadar Abu Tidak Larut Asam --- 27
3.7 Skrining Fitokimia --- 27 3.7.1 Pemeriksaan Alkaloid --- 27 3.7.2 Pemeriksaan Glikosida --- 28 3.7.3 Pemeriksaan Saponin --- 28 3.7.4 Pemeriksaan Flavonoid --- 28 3.7.5 Pemeriksaan Tanin --- 29 3.7.6 Pemeriksaan Steroid/Triterpenoid --- 29
3.8 Pembuatan Ekstrak Etanol Buah Pandan Jeronggi --- 29
3.9 Pemeriksaan Karakteristik Ekstrak Etanol --- 30
3.10 Fraksinasi Ekstrak Etanol --- 30
3.11 Fraksinasi Etil Asetat dengan Kromatografi Kertas (KKt).. 31
3.12 Pengujian Anti Bakteri --- 31
3.13 Pembuatan Larutan Uji dengan berbagai Konsentrasi --- 31
3.13.1 Ekstrak Etanol Buah Pandan Jeronggi --- 31
3.13.2 Larutan Uji Fraksi Etilasetat dan Fraksi Sisa --- 31
3.14 Sterilisasi Alat --- 32
3.15 Pembuatan Media --- 32
3.15.1 Pembuatan Nutrient Agar --- 32
3.15.2 Pembuatan Mueller Hilton Agar --- 33
3.15.3 Pembuatan Agar Miring --- 33
3.15.4 Pembuatan Peremajaan Bakteri --- 33
3.15.5 Pembuatan Inokulum --- 34
3.15.6 Pengujian Anti Bakteri --- 34
BAB IV HASIL DAN PEMBAHASAN --- 35
4.1. Hasil Identifikasi Tumbuhan --- 35
4.2.1 Hasil Pemeriksaan Makroskopik --- 35
4.2.2 Hasil Pemeriksaan Mikroskopik --- 35
4.3. Hasil Pemeriksaan Karakterisasi Simplisia --- 35
4.4. Hasil Skrining Fitokimia Simplisia --- 37
4.5. Hasil Ekstraksi --- 40
4.6 Karakteristik Ekstrak Etanol Buah Pandan Jeronggi --- 40
4.7 Hasil Pengujian Antibakteri Ekstrak Etanol --- 42
4.8 Fraksi n-Heksan Buah Pandan Jeronggi --- 45
4.9 Hasil Uji Antibakteri Fraksi Etilacetat --- 45
4.10 Hasil Uji Antibakteri Fraksi Sisa --- 48
BAB V KESIMPULAN DAN SARAN --- 52
5.1. Kesimpulan --- 52
5.2 Saran --- 53
DAFTAR PUSTAKA --- 54
DAFTAR TABEL
4.1 Hasil Karakterisasi Simplisia dan Ekstrak ... 36
4.2 Hasil Skrining Fitokimia Simplisia, Ekstrak, dan Fraksi ... 37
4.3 Hasil Karakterisasi Ekstrak Etanol... 41
4.4 Hasil Uji Aktifitas Antibakteri Ekstrak Etanol ... 43
4.5 Hasil Uji Aktifitas Antibakteri Fraksi Etilasetat ... 46
DAFTAR GAMBAR
1.1 Kerangka Pikir Penelitian ... 5 2.1 Tumbuhan dan Buah Pandan Jeronggi ... 7
DAFTAR LAMPIRAN
Lampiran 1. Determinasi Tumbuhan Pandan Jeronggi ... 60
Lampiran 2. Tumbuhan dan Buah segar Pandan Jeronggi ... 61
Lampiran 3. Simplisia Buah Pandan Jeronggi ... 62
Lampiran 4. Hasil Pemeriksaan mikroskopik serbuk simplisia Pandan Jeronggi ... 63
Lampiran 5. Bagan Proses Pembuatan Estrak Etanol Secara Maserasi ... 64
Lampiran 6. Bagan pengujian Aktivitas Antibakteri ... 65
Lampiran 7. Pengujian Fraksi Secara KKt Dari Buah Pandan Jeronggi... 66
Lampiran 8. Bagan pembuatan fraksi n-heksana, fraksi etil asetat dan fraksi sisa dari ekstrak Etanol Buah Pandan Jeronggi ... 67
Lampiran 9. Karakterisasi Simplisia Buah Pandan Jeronggi ... 68
Lampiran 10. Karakterisasi Ekstrak Etanol Buah Pandan Jeronggi ... 71
Lampiran 11. Diameter Daerah Hambat Pertumbuhan Bakteri dari Ekstrak Etanol Buah Pandan Jeronggi ... 75
Lampiran 12. Diameter Daerah Hambat Pertumbuhan Bakteri dari Fraksi Etilasetat Buah Pandan Jeronggi ... 76
Lampiran 13. Diameter Daerah Hambat Pertumbuhan Bakteri dari Fraksi Sisa Buah Pandan Jeronggi ... 77
Lampiran 14. Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Pandan Jeronggi 78 Lampiran 15. Hasil Uji Aktivitas Antibakteri Fraksi Etilasetat Buah Pandan Jeronggi ... 80
Lampiran 16. Hasil Uji Aktivitas Antibakteri Fraksi Sisa Buah Pandan Jeronggi ... 82
Lampiran 17. Profil Kromatografi Kertas Pada Fraksi Etilasetat ... 84
Lampiran 18. Profil Kromatografi Kertas Pada Fraksi Etilasetat disemprot AlCl3 ... 85
BAB I
PENDAHULUAN
1.1 Latar Belakang
Sumatera Utara merupakan daerah yang subur dan kaya dengan berbagai tumbuhan. Sebagian tumbuhan tersebut telah digunakan secara tradisional oleh masyarakat sebagai bahan obat. Salah satu diantaranya adalah Pandan Jeronggi (Iris domestica (L.) Goldblatt & Mabb). Tumbuhan ini dapat mencapai tinggi hingga 150 cm dan tumbuh di lereng bukit dan daerah rawa di daerah hutan muda. Pemanfaatan buah pandan jeronggi secara tradisional untuk menghentikan pendarahan pada luka dan untuk mengobati luka serta digunakan sebagai obat bisul, untuk mempercepat pematangan bisul dan anti bakteri pada penyakit kulit lainnya (Adnan, 1997).
Pada saat ini penelitian dan pengembangan tumbuhan obat baik di dalam maupun di luar negeri berkembang pesat. Berkembangnya penelitian terutama pada segi farmakologi, fitokimia maupun mikrobiologi berdasarkan indikasi tumbuhan obat yang telah digunakan oleh sebagian masyarakat dengan khasiat yang teruji secara empiris. Hasil penelitian ini lebih memantapkan para pengguna tumbuhan obat akan khasiat maupun kegunaannya (Dalimartha, 2003).
Infeksi dapat disebabkan oleh berbagai mikroorganisme seperti bakteri, virus, jamur dan protozoa (Gibson,1996). Bakteri penyebab infeksi ialah Staphylacoccus aureus. Infeksi yang ditimbulkannya berupa abses setempat (borok dan jerawat), endokarditis, faringitis, pneumonia (Willey, 2008), meningitis (Brook, dkk, 2007). Bakteri Staphylococcus aureus merupakan bakteri yang bersifat flora normal yang terdapat dikulit, hidung dan saluran pernafasan,
penyakit yang muncul seperti jerawat, bisul, borok luka dan pneumonia (Madigan, dkk.,2002). Bakteri Staphylococcus aureus, bakteri Escherchia coli penyebab dari penyakit diare pada manusia. Cara untuk mencegah pertumbuhan bakteri ini adalah dengan memanfaatkan bahan aktif dari tumbuhan yang dapat digunakan sebagai antibakteri (Prasad dkk.,2008).
Penelitiaan sebelumnya telah dilakukan terhadap spesies Iris nigricans. Pengujian yang dilakukan adalah uji efektivitas antioksidan dan antimikroba dari ekstrak metanol Iris nigricans (rimpang, daun dan bunga). Aktivitas antimikroba ekstrak rimpang, ekstrak daun dan ekstrak bunga dilakukan dengan metode disk diffusion terhadap berbagai jenis bakteri di mana bakteri yang digunakan yaitu Escherichia coli, Bacillus subtitilis, Staphylacoccus aureus dan Klepsiella pneumonia. (Sajee Hewaitat dkk.,2013).
Menurut peneliti terdahulu terhadap spesies Iris nigricans yang dilakukan oleh Sajee Hewaitat dkk.,2013, dengan melakukan uji terhadap ekstrak rimpang, daun dan bunga menggunakan pelarut metanol. Peneliti menggunakan metode difusi cakram, menurut hasil penelitian yang didapat aktivitas anti bakteri dari berbagai bagian Iris nigricans ekstrak daun dan rimpang menunjukkan aktivitas antibakteri katagori kuat yang dikaitkan dengan adanya komponen fenolik (flavonoid dan xanthone) yang dapat mengganggu membran sel bakteri.
Berdasarkan latar belakang di atas penulis melakukan penelitian terhadap spesies yang berbeda dengan menguji pengaruh ekstrak dan fraksi buah pandan jeronggi (Iris domestica (L.) Goldblatt & Mabb) terhadap aktivitas antibakteri dan profil kromatografi Kertas (KKt) dari fraksi yang paling efektif.
1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka permasalahan dalam penelitian adalah: a. Golongan senyawa apa yang terdapat pada ekstrak etanol buah pandan
jeronggi (Iris domestica (L.) Goldblatt & Mabb) fraksi n-heksan, fraksi etil asetat dan fraksi sisa?
b. Apakah ekstrak etanol dari buah Pandan Jeronggi dan fraksinya bersifat antibakteri terhadap bakteri Gram positif dan Gram negatif?
c. Fraksi mana dari buah Pandan Jeronggi yang memberikan aktivitas antibakteri lebih kuat terhadap Gram positif dan Gram negatif?
d. Apakah dapat diketahui profil Kromatografi Kertas dari fraksi yang lebih aktif?
1.3 Hipotesis
Berdasarkan perumusan masalah diatas, maka hipotesis penelitian ini adalah:
a. Golongan senyawa yang terdapat pada ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi sisa dari ekstrak buah Pandan Jeronggi adalah alkaloid, flavonoid, glikosida, saponin dan tanin.
b. Ekstrak etanol dan fraksinya dari buah Pandan Jeronggi bersifat antibakteri terhdap bakteri Gram positif dan Gram negatif.
c. Fraksi dari buah Pandan Jeronggi yang memberikan aktivitas antibakteri lebih kuat terhadap bakteri Gram positif dan Gram negatif adalah fraksi etilacetat. d. Profil KKt dari fraksi yang lebih aktif adalah fraksi etilacetat.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah
a. Mengetahui golongan senyawa apa yang terdapat pada ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi sisa dari buah Pandan Jeronggi.
b. Mengetahui apakah ekstrak etanol buah Pandan Jeronggi dan fraksi n-heksan, fraksi etilasetat, fraksi sisa bersifat antibakteri terhadap bakteri Gram positif dan Gram negatif.
c. Mengetahui fraksi dari buah Pandan Jeronggi yang memberikan aktivitas antibakteri lebih kuat terhadap bakteri Gram positif dan Gram negatif.
d. Mengetahui profil KKt dari fraksi yang lebih aktif.
1.5 Manfaat Penelitian
a. Mendapatkan gambaran mengenai aktivitas antibakteri ekstrak etanol buah Pandan Jeronggi dalam pengembangan dan pemanfaatan obat tradisional. b. Mengetahui fraksi mana yang memiliki efek antibakteri dari ekstrak etanol
buah Pandan Jeronggi.
c. Mengetahui fraksi mana yang baik memberikan efek daya hambat terhadap pertumbuhan bakteri.
5
1.6 Kerangka Pikir Penelitian
Pengamatan
Buah Pandan Jeronggi segar (Iris domestica (L.) Goldblatt & Mabb)
- Kadar air - Kadar abu total - Kadar sari yang
larut dalam air - Kadar sari yang
larut dalam etanol
- Kadar abu tidak larut dalam asam
Serbuk simplisia buah Pandan Jeronggi diekstrasi Karakterisasi simplisia dan Eekstrak Kental - Alkaloida - Steroida/ Triterpenoid - Glikosida - Flavonoida - Saponin - Tanin - Tanin Ekstrak etanol Fraksi n- heksan Fraksi-fraksi Skrining fitokimia (golongan senyawa metabolit sekunder) simplisia dan ekstrak Fraksi etilasetat Fraksi sisa Bakteri 1. Staphylacoccus aureus 2. Salmonella typhi 3. Klebsiella pneumonia 4. Pseudomonas aeruginosa. 5. Staphylococcus epidermidis KKt
Uji aktivitas antibakteri
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi klasifikasi tumbuhanan, morfologi tumbuhan, kandungan kimia, khasiat dan kegunaan.
2.1.1 Klasifikasi Tumbuhan
Klasifikasi dari buah pandan jeronggi (Iris domestica (L.) Goldblatt & Mabb) sebagai berikut (Anonim2016).
Divisio : Magnoliophyta Class : Magnoliopsida Sub Class : Magnoliidae Ordo : Asparagales Family : Iridaceae Genus : Iris
Species : Iris domestica (L.) Goldblatt & Mabb
2.1.2 Morfologi Tumbuhan
Tumbuhan pandan jeronggi (Iris domestica (L.) Goldblatt & Mabb) merupakan tumbuhan berbatang semu yang dapat mencapai tinggi hingga 150 cm. Daun panjangnya berkisar 20 – 40 cm berbentuk seperti daun ilalang. Bunga berukuran 0,5 cm berwarna ungu. Buah berwarna biru atau ungu terang berbentuk hampir bulat berukuran 0,5 - 1 cm dan diameter 0,5 – 1 cm. Daun dan buah pandan jeronggi dapat dilihat pada Gambar 2.1
Gambar 2.1 Tumbuhan dan buah Pandan Jeronggi
2.1.3 Senyawa aktif
Penelitian yang pernah dilakukan menunjukkan kandungan senyawa kimia yang terdapat pada famili Iridaceae adalah senyawa flavonoid, saponin, alkaloid, glikosida, fenolik dan tanin (Prasad dkk., 2008).
2.2 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga kecuali dinyatakan lain berupa bahan yang telah dikeringkan. Simplisia dikelompokkan menjadi tiga kelompok yaitu simplisia nabati, hewani dan mineral. Simplisia nabati adalah simplisia yang berupa tanaman utuh, bagian tanaman atau eksudat tanaman. Simplisia hewani berupa zat-zat berguna yang dihasilkan oleh hewan dan belum berupa zat-zat kimia murni. Simplisia mineral merupakan simplisia yang berasal dari bumi, baik telah diolah atau belum, tidak berupa zat kimia murni (Depkes, RI., 1995).
2.3 Ekstrak
Ekstrak adalah sediaan kering, kental atau cair yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut
diuapkan dan masa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Ditjen POM RI, 2000).
2.3.1 Ekstraksi
Ekstraksi adalah proses penarikan komponen atau zat aktif suatu simplisia dengan menggunakan pelarut tertentu. Pemilihan metode ekstraksi dipengaruhi oleh beberapa faktor, yaitu sifat jaringan tumbuhan, sifat kandungan zat aktif serta kelarutan dalam pelarut yang digunakan. Prinsip ekstraksi adalah melarutkan senyawa polar dalam pelarut polar dan senyawa non polar dalam pelarut non polar. Ekstraksi bertingkat secara umum dilakukan secara berturut-turut mulai dengan pelarut non polar (n-heksana), lalu pelarut semipolar (diklor metan atau etilasetat) kemudian pelarut bersifat polar (metanol atau etanol) (Harborne, 1987).
2.3.2 Fraksinasi
Fraksinasi adalah proses pemisahan suatu kuantitas tertentu dari campuran (padat, cair, terlarut, suspensi atau isotop) dibagi dalam beberapa jumlah kecil (fraksi). Fraksinasi bertingkat biasanya menggunakan pelarut organik seperti eter, aseton, diklorometana, atau campuran pelarut tersebut Pemakaiaan pelarut pada fraksinasi bertingkat diawali dengan pelarut yang kurang polar dan dilanjutkan dengan pelarut yang lebih polar (Adijuwana dan Nur, 1989).
2.4 Kromatografi
Kromatografi merupakan suatu teknik pemisahan yang menggunakan fase diam (stationary phase) dan fase gerak (mobile phase). Saat ini, kromatografi merupakan tehnik pemisahan yang paling umum dimanfaatkan untuk melakukan analisis kualitatif maupun kuantitatif (preparatif) dalam bidang farmasi
2.4.1 Kromatografi Kertas (KKt)
Suatu keuntungan utama KKt ialah kemudahan dan kesederhanaannya pada pelaksanaan pemisahan, yaitu hanya pada lembaran kertas saring yang berlaku sebagai medium pemisahan dan juga sebagai penyangga. Keuntungan lain ialah keterulangan bilangan Rf yang besar pada kertas sehingga pengukuran Rf merupakan parameter yang berharga dalam memaparkan senyawa tumbuhan baru. Kromatografi pada kertas biasanya melibatkan kromatografi pembagian atau penjerapan. Pada kromatografi pembagian, senyawa terbagi dalam pelarut alkohol yang sebagian besar tidak tercampur dengan air (missal n-butanol) dan dalam air. Campuran klasik yaitu n-butanol-asam asetat-air dengan perbandingan 4:1:5, atau disingkat BAA (Harborne, 1987).
Campuran yang akan dipisahkan berupa larutan, ditotolkan berupa bercak atau pita. Setelah lembar lapisan fase diam disimpan di dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahaan terjadi karena perambatan kapiler (pengembangan). Senyawanya, yang tidak berwarna harus ditampakkan (divisualisasi) (Stahl, 1985).
Fase gerak adalah medium angkut, terdiri dari satu atau beberapa pelarut, yang bergerak di dalam fase diam, yaitu suatu lapisan berpori karena adanya gaya kapiler (stahl, 1985). Pemilihan sistem pelarut yang dipakai didasarkan atas prinsip like dissolves like, artinya untuk memisahkan sampel yang bersifat nonpolar digunakan sistem pelarut yang bersifat nonpolar juga. Proses pengembangan akan lebih baik bila ruangan pengembangan tersebut telah jenuh dengan uap sistem pelarut (Adnan, 1997).
Nilai Rf dihitung dengan menggunakan perbandingan sebagaimana persamaan sebagai berikut:
Rf =
Nilai maksimum Rf adalah 1, artinya pelarut bermigrasi dengan kecepatan sama dengan fase gerak. Nilai minimum Rf adalah 0, ini teramati jika solut tertahan pada posisi titik awal penotolan sampel dipermukaan fase diam (Rohman, 2007).
2.5 Bakteri
Nama bakteri berasal dari kata “bakterion” (Bahasa Yunani) yang berarti tongkat atau batang. Sekarang nama itu dipakai untuk menyebut sekelompok mikroorganisme yang bersel satu, tidak berklorofil, berkembang biak dengan pembelahan diri serta demikian kecilnya sehingga hanya tampak dengan mikroskop. Pembagian bakteri berdasarkan tahap pewarnaan dibagi atas dua bagian, yaitu bakteri Gram positif dan bakteri Gram negatif (Gibson, 1996).
2.5.1 Uraian Umum Bakteri
Bakteri adalah mikroorganisme bersel satu, berbentuk bola, batang atau spiral berdiameter sekitar 0,5-10µm dan panjangnya 1,5-2,5µm. Berkembang biak dengan cara membelah diri (Dwijoseputro, 1982).
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh:
a. Zat makanan (nutrisi)
Nutrisi merupakan substansi yang diperlukan untuk biosintesis dan pembentukan energi. Berdasarkan kebutuhannya, nutrisi dibedakan menjadi dua yaitu makro elemen yaitu elemen-elemen nutrisi yang diperlukan dalam jumlah banyak dan mikroelemen yang diperlukan dalam jumlah sedikit. b. Temperatur.
kimia yang dipengaruhi oleh temperatur. Berdasarkan ini maka bakteri dapat diklasifikasikan sebagai berikut:
1. Bakteri psikofil yaitu bakteri yang dapat hidup pada temperatur maksimal 20oC, temperatur optimum adalah 0-15oC.
2. Bakteri mesofil yaitu bakteri yang dapat hidup pada temperatur maksimal 45oC, temperatur optimum adalah 20-40oC
3. Bakteri termofil yaitu bakteri yang dapat hidup pada temperatur maksimal 100oC, temperatur optimum 55-65oC
Temperatur optimum biasanya merupakan refleksi dari lingkungan normal organisme tersebut. Oleh karena itu bakteri-bakteri yang pathogen bagi manusia biasanya tumbuh dengan baik pada 37 0C.
c. Oksigen
Beberapa spesies bakteri dapat hidup dengan adanya oksigen dan sebaliknya spesies lain akan mati. Berdasarkan kebetuhan akan oksigen, bakteri dapat dikelompokkan sebagai berikut:
1. Bakteri aerobik yaitu bakteri yang membutuhkan oksigen untuk pertumbuhannya.
2. Bakteri anaerobik yaitu bakteri yang dapat tumbuh tanpa oksigen.
3. Bakteri anaerobik fakultatif yaitu bakteri yang dapat tumbuh dengan oksigen ataupun tanpa oksigen.
4. Bakteri mikroaerob yaitu bakteri yang dapat tumbuh baik dengan adanya sedikit oksigen (Irianto, 2006).
d. pH
pH merupakan konsentrasi ion hidrogen. Peningkatan dan penurunan konsentrasi ion hidrogen dapat menyebabkan ionisasi gugus-gugus dalam
protein, amino dan karboksilat. Hal ini dapat menyebabkan denaturasi protein yang mengganggu pertumbuhan sel. Kebanyakan bakteri yang patogen mempunyai pH optimum 7,2 – 7,6 (Pratiwi, 2008).
e. Tekanan osmosis
Osmosis merupakan perpindahan air melewati membrane semipermeabel karena ketidakseimbangan material terlarut dalam media. Bagi kebanyakan bakteri sifat-sifat yang dimiliki perbenihan yang biasa dipergunakan sudah memuaskan, tetapi bagi bakteri yang berasal dari air laut dan bakteri-bakteri yang diadaptasikan terhadap pertumbuhan dalam larutan gula berkadar tinggi faktor-faktor tersebut perlu diperhatikan. Bakteri yang memerlukan kadar garam tinggi disebut halofilik, sedangkan yang memerlukan tekanan osmotik yang tinggi disebut osmofilik.
2.5.2 Bakteri Staphylococcus aureus
Staphylococcus aureus umumnya membentuk pigmen kuning keemasan, memproduksi koagulase, dan dapat memfermentasi glukosa dan mannitol dengan memproduksi asam dalam keadaan anaerobik. Bakteri ini bersifat anaerobik, berbentuk bulat berukuran diameter 0,5–1,5μm dan tidak membentuk spora (Supardi dan Sukamto, 1999).
Staphylococcus adalah suatu bakteri Gram positif, berbentuk bulat (kokus berukuran kecil), dan biasanya sel-selnya terdapat dalam bentuk menggerombol seperti buah anggur. Suhu optimum untuk pertumbuhan Staphylococcus aureus adalah 35 – 370C, dengan suhu minimum 6,7 0C dan suhu maksimum 45,5 0C. Bakteri ini dapat tumbuh pada pH 4,0 sampai 9,8, dengan pH optimum sekitar 7,0 – 7,5 (Fardiaz dan Jenie, 1989).
gastroenteritis. Gejala gastroenteritis adalah tiba- tiba muntah hebat hingga 24 jam. Staphylococcus aureus umumnya menyebabkan penyakit yang berasal dari makanan karena bakteri ini menghasilkan racun yang dapat menimbulkan penyakit. Keracunan makanan umumnya terjadi karena termakan toksik yang dihasilkan oleh galur- galur toksigenik Staphylococcus aureus, walaupun jarang terjadi, dapat mengakibatkan rejatan (shock) dan kematiaan karena dehidrasi
(Regina, 2007).
2.5.3 Bakteri Klebsiella pneumonia
Klebsiella pneumonia pertama kali ditemukan oleh Carl Friedlander. Klebsiella pneumoniae merupakan bakteri, gram negative yang berbentuk batang (basil), bakteri yang non motil (tidak bergerak), Berdasarkan kebutuhannya akan oksigen. Klebsiella pneumonia dapat memfermentasikan laktosa. Pada test dengan indol, Klebsiella pneumonia akan menunjukkan hasil negative (Pratiwi, 2008).
2.5.4 Bakteri Salmonella typhi
Salmonella typhi merupakan bakteri penyebab tifus (tifes) dengan cara masuk ke usus melalui makanan atau minuman yang terkontaminasi dan kemudian berkembang biak di dalam saluran pencernaan, yang akan mengakibatkan demam tinggi, sakit perut, sembelit atau diare ketika bakteri ini telah berkembang biak. Jika tidak segera diobati maka bakteri ini akan menyebar keseluruh tubuh dengan memasuki pembuluh darah. Gejala tifus akan memburuk jika bakteri telah menyebar ke luar system pencernaan. Selain itu bakteri yang menyebar dapat merusak organ dan jaringan dan menyebabkan komplikasi serius, kondisi yang paling umum terjadi adalah pendarahan internal atau usus bocor (Pratiwi, 2008).
2.5.5 Bakteri Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan patogen utama bagi manusia. Bakteri ini kadang-kadang mengkoloni pada manusia dan menimbulkan infeksi apabila fungsi pertahanan inang abnormal. Oleh karena itu, Pseudomonas aeruginosa disebut patogen oportunistik, yaitu memanfaatkan kerusakan pada mekanisme pertahanan inang untuk memulai suatu infeksi. Bakteri ini dapat juga tinggal pada manusia yang normal dan berlaku sebagai saprofit pada usus normal dan pada kulit manusia. Tetapi, infeksi Pseudomonas aeruginosa menjadi problema serius pada pasien rumah sakit yang menderita kanker, fibrosis kistik dan luka bakar. Angka fatalitas pasien-pasien tersebut mencapai 50%.
Pseudomonas aeruginosa berbentuk batang dengan ukuran sekitar 0,6 x 2 μm. Bakteri ini terlihat sebagai bakteri tunggal, berpasangan, dan terkadang membentuk rantai yang pendek. Pseudomonas aeruginosa termasuk bakteri Gram negatif. Bakteri ini bersifat aerob, katalase positif, oksidase positif, tidak mampu memfermentasi tetapi dapat mengoksidasi glukosa/karbohidrat lain, tidak berspora, tidak mempunyai selubung (sheat) dan mempunyai flagel monotrika (flagel tunggal pada kutub) sehingga selalu bergerak. Bakteri ini dapat tumbuh di air suling dan akan tumbuh dengan baik dengan adanya unsur N dan C. Suhu optimum untuk pertumbuhan Pseudomonas aeruginosa adalah 42
o
C. Pseudomonas aeruginosa mudah tumbuh pada berbagai media pembiakan karena kebutuhan nutrisinya sangat sederhana. Di laboratorium, medium paling sederhana untuk pertumbuhannya digunakan asetat (untuk karbon) dan ammonium sulfat (untuk nitrogen). Pembiakan dari spesimen klinik biasanya menghasilkan satu atau dua tipe koloni yang halus yaitu tipe Koloni besar dan halus dengan permukaan rata dan meninggi dan tipe Koloni halus dan mukoid
sebagai hasil produksi berbahan dari alignat. Tipe ini sering didapat dari sekresi saluran pernafasan dan saluran kemih.
Alignat dapat melindungi bakteri dari pertahanan tubuh inang, seperti
limfosit, fagosit, silia, di saluran pernafasan, antibody dan komplemen. Pseudomonas aeruginosa membentuk biofilm untuk membantu kelangsungan
hidupnya saat membentuk koloni pada paru-paru manusia (Pelezar dan Chan, 1988).
2.5.6 Bakteri Staphylococcus epidermidis
Bakteri Staphylococcus epidermidis adalah salah satu spesies bakteri dari genus Staphylococcus yang diketahui dapat menyebabkan infeksi oportunistik (menyerang individu dengan sistem kekebalan tubuh yang lemah). Bakteri ini adalah gram-positif, berbentuk kokus, dan berdiameter 0,5-1,5µm. Bakteri ini secara alami hidup pada kulit dan membran mukosa manusia. Infeksi Staphylococus epidermidis dapat terjadi karena bakteri ini membentuk biofilm pada alat-alat medis dirumah sakit dan menulari orang-orang di lingkungan rumah sakit tersebut (infeksi nosokomial). Secara klinis, bakteri ini menyerang orang-orang yang rentan atau imunitas rendah seperti pasien kritis, pengguna obat terlarang (narkotika), bayi yang baru lahir dan pasien rumah sakit yang dirawat dalam waktu lama. (Jody A Lindsay, 2008)
2.6 Pengukuran Aktivitas Antibakteri
Pengukuran aktivitas antibakteri dapat dilakukan dengan metode dilusi (pengenceran), metode difusi atau dengan Metode Turbidimetri
a. Metode Dilusi
berbeda-beda dimasukkan pada media cair. Media tersebut langsung diinokulasikan dengan bakteri dan diinkubasi (Pratiwi, 2008). Tujuan dari percobaan ini adalah menentukan konsentrasi terkecil suatu zat antibakteri dapat menghambat pertumbuhan atau membunuh bakteri uji. Metode dilusi agar membutuhkan waktu lama dalam pengerjaannya sehingga jarang digunakan (Jawetz dkk., 2001).
Metode ini dapat dilakukan dengan 2 cara yaitu: 1. Cara penipisan lempeng agar
Zat antimikroba yang akan diuji aktivitasnya diencerkan sehingga diperoleh suatu larutan stock yang mengandung 100 µg/ml zat uji. Kemudian dari larutan stock tersebut dibuat suatu larutan seri uji dengan metode pengenceran kelipatan dua dalam media agar yang masih cair (suhu 450C – 500C), kemudian dituangkan ke dalam cawan petri. Bakteri uji diinokulasi setelah campuran media agar dan zat uji membeku, kering dan diinkubasi pada kondisi optimum (waktu dan suhu) dari bakteri uji. Aktivitas zat uji ditentukan sebagai konsentrasi hambatan minimum (KHM) yaitu konsentrasi terkecil dari zatr anti mikroba uji yang masih dapat memberikan efek penghambatan terhadap pertumbuhan mikroba uji.
2. Cara pengenceran tabung.
Prinsip ini adalah penghambatan pertumbuhan mikroba dalam pembenihan cair oleh suatu zat antimikroba yang dicampur ke dalam pembenihan. Dibuat suatu seri larutan zat uji dengan konsentrasi tertentu dengan cara pengenceran kelipatan dua dalam media cair, kemudian diinokulasi dengan mikroba uji dan diinkubasikan (waktu dan suhu) sesuai kondisi optimum dari mikroba uji. Aktivitas zat antimikroba ditentukan sebagai konsentrasi hambatan minimum (KHM) yang merupakan pengenceran tertinggi dari seri zat antimikroba uji yang tidak menunjukkan adanya pertumbuhan mikroba.
b. Metode Difusi
Metode yang paling sering digunakan adalah metode difusi agar dengan menggunakan cakram kertas, cakram kaca, pencetak lubang. Prinsip metode ini dalah mengukur zona hambatan pertumbuhan bakteri yang terjadi akibat difusi zat yang bersifat sebagai antibakteri di dalam media padat melalui pencadang. Daerah hambatan pertumbuhan bakteri adalah daerah jernih di sekitar cakram. Luas daerah hambatan berbanding lurus dengan aktivitas antibakteri, semakin kuat daya aktivitas antibakterinya maka semakin luas daerah hambatnya. Metode ini dipengaruhi oleh banyak faktor fisik dan kimia, misalnya: pH, suhu, zat, inhibitor, sifat dari media dan kemampuan difusi, ukuran molekul dan stabilitas dari bahan obat (Mudihardi, 2001).
Metode ini dapat dilakukan dengan 3 cara yaitu: 1. Cara Cakram (disc)
Cara ini adalah cara yang paling banyak digunakan untuk menentukan kepekaan kuman terhadap berbagai macam obat-obatan. Pada cara ini digunakan suatu cakram kertas saring (paper disc) yang berfungsi sebagai tempat menampung zat antimikroba. Kertas saring yang mengandung antimikroba tersebut diletakkan pada lempeng agar yang telah diinokulasi dengan mikroba uji kemudiaan diinkubasi pada waktu tertentu dan suhu tertentu, sesuai dengan kondisi optimum mikroba uji. Biasanya hasil dibaca setelah inkubasi selama 18-24 jam dengan suhu 370C. Hasil pengamatan yang akan diperoleh adalah ada atau tidanknya daerah bening yang terbentuk disekeliling kertas cakram yang menunjukkan zona pertumbuhan hambatan bakteri. Hambatan akan terlihat sebagai daerah yang tidak memperlihatkan adanya pertumbuhan kuman disekitar cakram. Semakin besar zona hambatan yang ditunjukkan, semakin besar pula
kemampuan aktivitas zat antimikroba dan lebar daerah hambatan ini juga tergantung kepada daya resap obat kedalam agar.
2. Cara Parit (ditch)
Suatu lempeng agar yang telah diinokulasi dengan bakteri uji dibuat sebidang parit. Parit tersebut diisi dengan zat antimikroba, kemudiaan diinkubasi pada waktu dan suhu optimum yang sesuai untuk mikroba uji. Hasil pengamatan yang diperoleh adalah ada atau tidaknya zona hambatan yang terbentuk disekitar parit. Analog dengan cara cakram, besarnya zona hambatan dari zat antimikroba yang diujikan.
3. Cara Lubang (hole/cup)
Lempeng agar yang telah diinokulasi dengan bakteri uji dibuat suatu lubang yang selanjutnya diisi dengan zat antimikroba uji. Cara ini dapat diganti dengan meletakkan cawan porselin kecil yang biasa disebut fish spines diatas medium agar. Kemudian cawan-cawan tersebut diisi dengan zat antimikroba setelah diinkubasi pada suhu dan waktu optimum yang sesuai untuk mikroba uji, dilakukan dengan pengamatan dengan ada atau tidaknya zona hambatan disekeliling lubang atau cawan.
c. Metode Turbidimetri
Cara ini digunakan media pertama air. Pertama dilakukan penuangan media kedalam tabung reaksi, lalu ditambahkan suspensi bakteri, kemudaian dilakukan pemipetan larutan uji, dilakukan inkubasi. Selanjutnya dilakukan pengukuran kekeruhan, kekeruhan yang disebabkan oleh pertumbuhan bakteri diukur dengan menggunakan instrumen yang cocok, misalnya spektrofotometer setelah itu dilakukan penghitungan potensi antimikroba (Depkes, RI., 1995).
2.7 Mekanisme Kerja Antimikroba
Mekanisme penghambatan terhadap pertumbuhan bakteri oleh senyawa antibakteri dapat berupa perusakan dinding sel dengan cara menghambat pembentukannya atau mengubahnya setelah selesai terbentuk, perubahan permeabilitas membran sitoplasma sehingga menyebabkan keluarnya bahan makanan dari dalam sel, perubahan molekul protein dan asam nukleat, penghambatan kerja enzim, dan penghambatan sintesis asam nukleat dan protein. Di bidang farmasi, bahan antibakteri dikenal dengan nama antibiotik, yaitu suatu substansi kimia yang dihasilkan oleh mikroba dan dapat menghambat pertumbuhan mikroba lain. Senyawa antibakteri dapat bekerja secara bakteriostatik, bakterisidal dan bakteriolitik (Pelczar dan Chan, 1988). Menurut Madigan dkk (2000), berdasarkan sifat toksisitas selektifnya, senyawa antimikrobia mempunyai 3 macam efek terhadap pertumbuhan mikrobia yaitu: 1. Bakteriostatik memberikan efek dengan cara menghambat pertumbuhan tetapi tidak membunuh. Senyawa bakterostatik seringkali menghambat sintesis protein 8 atau mengikat ribosom. Hal ini ditunjukkan dengan penambahan antimikrobia pada kultur mikrobia yang berada pada fase logaritmik. Setelah penambahan zat antimikrobia pada fase logaritmik didapatkan jumlah sel total maupun jumlah sel hidup adalah tetap.
2. Bakterisidal memberikan efek dengan cara membunuh sel tetapi tidak terjadi lisis sel atau pecah sel, hal ini ditunjukkan dengan penambahan antimikrobia pada kultur mikrobia yang berada pada fase logaritmik. Setelah penambahan zat antimikrobia pada fase logaritmik didapatkan jumlah sel total tetap sedangkan jumlah sel hidup menurun.
3. Bakteriolitik menyebabkan sel menjadi lisis atau pecah sel sehingga jumlah sel berkurang atau terjadi kekeruhan setelah penambahan antimikrobia.
Hal ini ditunjukkan dengan penambahan antimikrobia pada kultur mikrobia yang berada pada fase logaritmik. Setelah penambahan zat antimikrobia pada fase logaritmik, jumlah sel total maupun jumlah sel hidup menurun. Mekanisme penghambatan antibakteri dapat dikelompokkan menjadi lima, yaitu menghambat sintesis dinding sel mikrobia, merusak keutuhan dinding sel mikrobia, menghambat sintesis protein sel mikrobia, menghambat sintesis asam nukleat, dan merusak asam nukleat sel mikrobia (Jawetz, 2001).
BAB III
METODE PENELITIAN
3.1 Tempat Pelaksanaan Penelitian
Penelitian ini dilaksanakan di Laboratorium Fitokimia, Laboratorium Mikrobiologi dan Laboratorium Penelitian di Fakultas Farmasi Universitas Sumatera Utara.
3.2 Metode Penelitian
Penelitian ini dilakukan dengan metode eksperimental. Metode penelitian meliputi pengumpulan sampel, pembuatan simplisia, skrining fitokimia, pembuatan ekstrak, pemeriksaan karakterisasi ekstrak etanol, fraksinasi ekstrak etanol, pemeriksaan profil Kromatografi Lapis tipis (KKt) dari fraksi yang paling aktif dan uji antibakteri terhadap bakteri patogen biakan murni dari Laboratorium Mikrobiologi Farmasi USU dengan metode difusi agar dan pencadang kertas, bakteri yang digunakan adalah Gram positif (Staphylococcus aureus ATCC 25923, Staphylococcus epidermidis ATCC 12228) dan bakteri Gram negatif (Salmonella typhi ATCC 14028, Pseudomonas aeruginosa ATCC 9027, Klebsiella pneumonia).
3.3 Alat dan Bahan 3.3.1 Alat
Alat-alat yang digunakan pada penelitian ini meliputi alat-alat gelas laboratorium, alumunium foil, blender (Philip), chamber, kertas saring, lemari pengering, neraca kasar, krus porselin, bola karet, neraca listrik (Mettler Toledo),
oven listrik (Memmert), alat rotary evaporator, Laminar Air Flow Cabinet, lemari pendingin, penangas air, pencadang kertas, cawan petri, pingset, pipet mikro, seperangkat alat kromatografi lapis tipis, seperangkat alat penetapan kadar air, tanur, lampu visualisasi kromatografi lapis tipis.
3.3.2 Bahan
Bahan yang digunakan adalah buah pandan jeronggi yang diperoleh dari daerah Bandar Pulau, bakteri yang digunakan adalah Gram positif (Staphylococcus aureus ATCC 25923, Staphylococcus epidermidis ATCC 12228) dan bakteri Gram negatif (Salmonella typhi ATCC 14028, Pseudomonas aeruginosa ATCC 9027, Klebsiella pneumonia), etanol 96%, etil asetat, n-heksana, asam khlorida, kalium iodida, iodium, sublimat, asam sulfat, bismut subnitrat, kertas saring Whatman no.1, tube penotol (pipet mikro), kertas kromatografi (lembar lapisan fase diam), asam asetat, raksa (II), seng serbuk, timbal (II) asetat, aquades, kloroform, metanol, asam format, aseton, toluena, amoniak, buffer fospat pH 7. Bahan kimia yang digunakan kecuali dinyatakan lain adalah berkualitas pro analisis.
3.4 Pengumpulan dan Pengolahan Bahan Tumbuhan 3.4.1 Pengumpulan Bahan Tumbuhan
Bahan Tumbuhan yang digunakan adalah buah pandan jeronggi segar yang diperoleh dari desa Padang Pulau, Kecamatan Bandar Pulau, Kabupaten Asahan, Propinsi Sumatera Utara dan pengambilan bahan bumbuhan secara purposif.
3.4.2 Pengolahan Bahan Tumbuhan
Buah pandan jeronggi segar dikumpulkan dan dicuci bersih dengan air mengalir, ditiriskan, diangin-anginkan kemudian ditimbang sebagai berat basah.
Bahan ini dikeringkan di lemari pengering pada suhu 400C hingga kering, kemudian ditimbang sebagai berat kering, kemudian diserbuk dengan menggunakan blender. Simplisia dimasukkan dalam wadah plastik dan diikat, diberi label lalu disimpan pada tempat yang terlindung dari cahaya matahari.
3.4.3 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Jl. Raya Jakarta – Bogor Km. 46 Cibinong 16911 Bogor – Indonesia.
3.5 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi meliputi pereaksi Liebermann-Bouchard, asam sulfat 2 N, Molisch, Mayer, besi (III) klorida 1%, Dragendorff, Bouchardat, natrium hidroksida 2 N, asam nitrat 0,5 N dan timbal (II) asetat 0,4 M (Depkes,
RI., 1995).
3.5.1 Pereaksi Liebermann-Burchard
Dicampurkan secara perlahan 5 ml asam asetat anhidrida dengan 5 ml
asam sulfat pekat tambahkan etanol hingga 50 ml (Depkes, RI., 1995).
3.5.2 Pereaksi Asam Sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling secukupnya hingga volume 100 ml (Depkes, RI., 1995). 3.5.3 Pereaksi Molisch
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Depkes, RI., 1995). 3.5.4 Pereaksi Mayer
Sebanyak 1,359 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml. Sebanyak 5 g kalium iodida pada wadah lain dilarutkan dalam 10 ml air
suling, kemudian keduanya campur dan ditambahkan air suling hingga 100 ml (Depkes, RI., 1995).
3.5.5 Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, dilarutkan dalam air suling sehingga diperoleh larutan 100 ml (Depkes, RI., 1995). 3.5.6 Pereaksi Dragendorff
Sebanyak 0,6 g bismuth (III) nitrat ditimbang, dilarutkan dalam 2 ml asam klorida pekat, lalu ditambahkan 10 ml air suling. Pada wadah lain dilarutkan 6 g kalium iodida dalam 10 ml air suling. Kemudian kedua larutan dicampurkan dengan 7 ml asam klorida pekat dan 15 ml air suling (Depkes, RI., 1995).
3.5.7 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.5.8 Pereaksi Natrium Hidroksida 2 N
Sebanyak 8,001 g kristal natrium hidroksida ditimbang, dilarutkan dalam air suling sehingga diperoleh larutan 100 ml (Depkes, RI., 1995). 3.5.9 Pereaksi Asam Nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga
100 ml (Depkes, RI., 1995).
3.5.10 Pereaksi Timbal (II) Asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas CO2
hingga 100 ml (Depkes, RI., 1995).
3.5.11 Pembuatan Kloralhidrat 70% b/v
3.6 Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakterisasi simplisia seperti penetapan kadar air dilakukan menurut prosedur (World Health Organization., 1992) pemeriksaan makrokospik, pemeriksaan mikroskopik, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut asam, susut pengeringan dilakukan menurut prosedur (Depkes, RI.,1995).
3.6.1 Pemeriksaan Makroskopik Simplisia
Pemeriksaan makroskopik dilakukan dengan mengamati morfologi luar yaitu bentuk, warna, ukuran dan bau dari buah pandan jeronggi.
2.6.2 Pemeriksaan Mikroskopik Serbuk Simplisia
Pemeriksaan mikroskopik dilakukan untuk melihat fragmen-fragmen yang terdapat pada serbuk simplisia buah pandan jeronggi.
3.6.3. Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi Toluen). Alat-alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung, tabung penerima 5 ml.
Cara kerja : ke dalam labu alas bulat dimasukkan 200 ml Toluen dan 2 ml air suling, didestilasi selama 2 jam, toluena didinginkan selama 30 menit dan volume air di dalam tabung penerima dibaca dengan ketelitian 0,05 ml. Ke dalam labu dimasukkan 5 g serbuk simplisia yang telah ditimbang, lalu dipanaskan selama 15 menit, setelah toluena mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen yang telah jenuh. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan dingin sampai pada suhu kamar. Setelah air dan
toluena memisah sempurna, volume air dibaca sesuai dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen. (WHO., 1992).
3.6.4 Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 g sampel dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml air-kloroform dalam air suling sampai 100 ml) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes, RI.,
1995).
3.6.5 Penetapan Kadar Sari Larut dalam Etanol
Sebanyak 5 g sampel dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan.
3.6.6 Penetapan Kadar Abu Total
Sebanyak 2 g sampel ditimbang dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung
terhadap bahan yang telah dikeringkan (Depkes, RI., 1995).
3.6.7 Penetapan Kadar Abu Tidak Larut Asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 mL asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes, RI., 1995).
3.7 Skrining Fitokimia
Skrining fitokimia dilakukan terhadap simplisia buah pandan jeronggi meliputi pemeriksaan senyawa kimia golongan alkaloid, glikosida antraquinon, saponin (Depkes, RI., 1995) tannin, flavonoid, triterpennoid dan steroid
(Farnsworth., 1996).
3.7.1 Pemeriksaan Alkaloida
Ekstrak ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk tes alkaloid. Diambil 3 tabung reaksi, lalu ke dalamnya dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi ditambahkan 2 tetes pereaksi Mayer, ditambahkan 2 tetes pereaksi Bouchardat dan ditambahkan 2 tetes pereaksi Dragendorff. Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga percobaan diatas (Depkes, RI., 1995).
3.7.2 Pemeriksaan Glikosida
Sebanyak 3 g ekstrak disari dengan 30 ml campuran etanol 96% dengan air (7:3) direfluks selama 10 menit, didinginkan dan disaring. Kemudian diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran kloroform dan isopropanol (3:2), dilakukan berulang sebanyak 3 kali. Kumpulan sari air diuapkan pada suhu tidak lebih dari 500C. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan: sebanyak 0,1 ml larutan percobaan dimasukkan dalam tabung reaksi dan diuapkan diatas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish. Kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuk cincin warna ungu pada batas kedua cairan, menunjukkan adanya gula sebagai pertanda glikosida positif (Depkes, RI., 1995).
3.7.3 Pemeriksaan Saponin
Ekstrak ditimbang sebanyak 0,5 g dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan, kemudian dikocok kuat-kuat selama 10 menit. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan buih tidak hilang dengan penambahan 1 tetes asam
klorida 2 N menunjukkan adanya saponin (Depkes, RI.,1995).
3.7.4 Pemeriksaan Flavonoida
Sebanyak 10 g ekstrak ditimbang, dilarutkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah, kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.7.5 Pemeriksaan Tanin
Sebanyak 0,5 g ekstrak ditimbang, disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Depkes, RI.,
1995).
3.7.6 Pemeriksaan Steroid / Triterpenoid
Ekstrak ditimbang sebanyak 1 g, direndam dengan 20 ml n-heksan selama 2 jam, disaring. Filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan pereaksi Liebermann-Burchard melalui dinding cawan. Apabila terbentuk warna ungu atau merah yang berubah menjadi biru ungu atau biru hijau menunjukkan adanya triterpenoid/steroid (Harborne, 1987).
3.8 Pembuatan Ekstrak Etanol Buah Pandan Jeronggi
Sebanyak 500 g serbuk simplisia dimasukkan ke dalam wadah tertutup, ditambahkan 3,75 liter etanol 96% lalu wadah ditutup dan dibiarkan selama 5 hari terlindung dari cahaya sambil sesekali diaduk. Kemudian disaring dan ditampung pada botol berwarna gelap (maserat I). Pada serbuk simplisia yang sama di tambahkan 1,25 liter etanol 96% (dibilas). Kemudian disaring dan ditampung pada botol berwarna gelap (maserat II). Kemudian maserat I dan II digabung dan didiamkan selama 2 hari lalu dienaptuangkan dan diambil cairan yang jernih di bagian atas. Ekstrak dipekatkan dengan menggunakan rotary evaporator (Depkes, RI., 1995).
3.9 Pemeriksaan Karakteristik Ekstrak Etanol
Pemeriksaan karakteristik ekstrak etanol sama dengan pemeriksaan karakteristik simplisia yang meliputi penetapan kadar air dilakukan menurut World Health Organization (1992); penetapan kadar sari yang larut air, penetapan kadar sari larut etanol, penetapan kadar abu tidak larut asam dilakukan menurut metode ditjen POM, RI (1995).
3.10 Fraksinasi Ekstrak Etanol
Sebanyak 20 g ektrak etanol dilarutkan dalam etanol 96% sampai larut kemudian ditambahkan 40 ml air suling, dimasukkan ke dalam corong pisah, lalu ditambahkan 100 ml n-heksana, lalu dikocok, dan didiamkan sampai terdapat 2 lapisan yang terpisah (± 30 menit). Lapisan n-heksana (lapisan atas) diambil dengan cara mengalirkan cairan pada corong pisah dan fraksinasi dilakukan sampai lapisan n-heksana memberikan hasil negatif dengan pereaksi LB. Lapisan n-heksana yang dikumpulkan dipekatkan dengan rotary evaporator sehingga diperoleh fraksi n-heksana. Kemudian pada residu (sisa) ditambahkan 100 ml etilasetat, lalu dikocok, didiamkan sampai terdapat 2 lapisan yang terpisah (± 30 menit), lapisan etilasetat (lapisan atas) diambil dengan cara mengalirkan cairan pada corong pisah dan fraksinasi dilakukan sampai lapisan etilasetat memberikan hasil negatif dengan pereaksi FeCl3. Lapisan etilasetat yang dikumpulkan
dipekatkan dengan rotary evaporator sehingga diperoleh fraksi etilasetat. Lapisan air (sisa) diambil dan dipekatkan dengan rotary evaporator sehingga didapat fraksi air (Bassett, dkk., 1994).
3.11 Fraksi Etilasetat dengan Kromatografi Kertas (KKt)
Terhadap fraksi etilasetat dilakukan analisi KKt menggunakan fase diam berupa kertas dengan fase gerak n-butanol : ammonia : air (4 : 1 : 5). Penampak noda untuk fraksi etilasetat yang digunakan adalah AlCl3 dan Uap Ammonia.
3.12 Pengujian Antibakteri
Pengujian aktivitas antibakteri terhadap ekstrak etanol, fraksi n- heksan, fraksi etilasetat dan fraksi sisa dilakukan dengan metode difusi agar menggunakan pencadang kertas, bakteri yang digunakan bakteri Gram positif (Staphylococcus aureus ATCC 25923, Staphylococcus epidermidis ATCC 12228) dan bakteri Gram negatif (Salmonella typhi ATCC 14028, Pseudomonas aeruginosa ATCC 9027 dan Klebsiella pneumonia).
3.13 Pembuatan Larutan Uji dengan Berbagai Konsentrasi 3.13.1 Larutan Uji Ekstrak Etanol Buah Pandan Jeronggi
Cara kerja : Ekstrak etanol ditimbang 5g, dilarutkan dengan dimetilsulfoksida (DMSO) hingga 10 ml, sehingga diperoleh konsentrasi ekstrak 500 mg/ml, kemudian dibuat pengenceran selanjutnya sampai diperoleh ekstrak dengan konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml, 50 mg/ml, 25 mg/ml,
dan 12,5 mg/ml.
3.13.2 Larutan Uji Fraksi Etilasetat dan Fraksi sisa
Cara kerja : Masing-masing fraksi ditimbang sebanyak 5g, lalu dilarutkan dengan DMSO di dalam labu tentukur 10 ml hingga garis tanda dan diperoleh konsentrasi ekstrak adalah 500 mg/ml, selanjutnya larutan tersebut diencerkan
kembali dengan DMSO hingga diperoleh ekstrak dengan konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml, 50 mg/ml, 25 mg/ml, 12,5 mg/ml.
3.14 Sterilisasi Alat
Sterilisasi untuk alat-alat yang digunakan antara lain:
1. Alat–alat yang terbuat dari gelas dibungkus dengan kertas perkamen, disterilkan menggunakan oven pada suhu 170oC selama 1 jam.
2. Alat-alat kuantitatif seperti gelas ukur dan termasuk juga media disterilkan di autoklaf pada suhu 121oC selama 15 menit.
3. Jarum ose dan pinset disterilkan dengan cara dibakar pada lampu bunsen. 4. Sebelum mulai daerah sekitar pengerjaan disemprot dengan etanol 70% dan
dibiarkan selama 15 menit sebelum digunakan.
Meja dibersihkan dari debu dan dilap menggunakan desinfektan (Lay, 1994).
3.15 Pembuatan Media
3.15.1 Pembuatan Nutrient Agar
Komposisi : Lab-Lemco Powder 1,0 g
Yeast Extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g
Agar 15,0 g
Cara pembuatan: Ditimbang sebanyak 28 g serbuk nutrient agar kemudian disuspensikan dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga 1000 ml, dipanaskan hingga mendidih sambil sekali-kali diaduk
sampai bahan larut sempurna dan jernih. Tutup labu erlenmeyer dengan kapas yang dilapisi dengan aluminium foil. Disterilkan di dalam autoklaf pada suhu 121oC tekanan 2 atm selama 15 menit (Oxoid 1982).
3.15.2 Pembuatan Mueller Hinton Agar (MHA)
Komposisi : Meat infusion 6,0 g
Casein hydrolysate 17,5 g
Starch 1,5 g
Agar No. 1 10,0 g
pH 7,4
Cara pembuatan: Ditimbang sebanyak 35 g serbuk Muller Hinton Agar kemudian disuspensikan dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga 1000 ml, dipanaskan hingga mendidih sambil sekali-kali diaduk sampai bahan larut sempurna dan jernih. Tutup labu erlenmeyer dengan kapas yang dilapisi dengan aluminium foil. Disterilkan di dalam autoklaf pada suhu 121oC tekanan 2 atm selama 15 menit (Difco laboratories, 1977).
3.15.3 Pembuatan Agar Miring
Kedalam tabung reaksi steril dimasukkan 3 ml media Nutrient Agar Steril, didiamkan pada temperatur kamar sampai sediaan memadat pada posisi miring kira-kira 450. Kemudiaan disimpan dalam lemari pendingin pada suhu 50C (Ditjen
POM, RI., 1995).
3.15.4 Peremajaan Bakteri
Satu koloni bakteri diambil dari stok kultur dengan menggunakan jarum ose steril, lalu ditanamkan pada media agar miring dengan cara menggores. Kemudian diinkubasi dalam inkubator pada suhu 36-370C selama 18 – 24 jam