BAB 2
TINJAUAN PUSTAKA
2.1 Tanah Gambut
Tanah gambut adalah tanah-tanah jenuh air yang tersusun dari bahan tanah organik yaitu sisa-sisa tanaman dan jaringan tanaman yang melapuk dengan ketebalan lebih dari 50 cm.
Tanah gambut biasanya adalah merupakan lokasi yang tergenang air yang biasanya ditemukan pada landskap yang relatip rata. Kondisi dingin dan anaerobik hingga sepuluh sentimeter di bawah permukaan menyebabkan residu organik menumpuk, hingga kedalaman setidaknya 30 cm dan kerap kali hingga beberapa meter. Serangkaian proses dekomposisi dan akumulasi yang kompleks yang menjadi ciri dari lingkungan semacam ini menghasilkan formasi gambut. Bog-bog gambut terbentuk di mana keberadaan air yang berlebihan selama sebagian besar waktu setahun atau sepanjang tahun mencegah degradasi total substansi-substansi organik, yang menyebabkan akumulasi sedimen-sedimen yang membentuk gambut.
Tanah gambut mengandung bahan-bahan anorganik dan bahan organik, menurut Aiken dkk (1985) secara kimia, bahan-bahan organik dalam tanah diklasifikasikan menjadi 3 fraksi yaitu : (1) Humin, tidak larut dalam larutan asam maupun basa, (2) Asam humat, larut dalam larutan basa tetapi tidak larut dalam larutan asam (pH < 2), (3) Asam fulvat , larut dalam larutan asam maupun larutan basa.
Salah satu sifat yang menjadikan gambut berperan penting dalam sistem hidrologi adalah kemampuannya bertindak seperti spons. Tanah gambut merupakan tanah organik yang mampu menyerap air dalam jumlah yang sangat besar sehingga air hujan yang jatuh dapat diserap dan dapat mengurangi bahaya banjir. Sebaliknya pada musim kemarau, lahan rawa gambut dapat melepaskan kembali air tawarnya sebagai aliran sungai/ permukaan yang dapat dipergunakan oleh pemukiman sekitarnya (Andri esse, 1988).
2.2 Air Gambut
Air gambut adalah air permukaan yang banyak terdapat di daerah berawa atau dataran rendah di Sumatera dan Kalimantan, yang mempunyai ciri-ciri sebagai berikut:
1) Intensitas warna yang tinggi (berwarna coklat kemerahan) 2) pH yang rendah
3) Kandungan zat organik yang tinggi
4) Kekeruhan dan kandungan partikel tersuspensi yang rendah 5) Kandungan kation yang rendah
Warna coklat kemerahan pada air gambut merupakan akibat dari tingginya kandungan zat organik (bahan humus) terlarut terutama dalam bentuk asam dan turunannya. Asam humus tersebut berasal dari dekomposisi bahan organik seperti daun, pohon atau kayu (Kusnaedi, 2006).
Ion Fe+2 dalam air gambut berasal dari pirit. Pirit adalah mineral tanah berukuran mikro yang tidak terlihat dengan mata, yang terdapat pada
tanah-tanah yang berkembang dari bahan endapan marin. Pirit terbentuk dalam lingkungan air laut atau payau, yang mempunyai bahan organik yang berasal dari tumbuhan pantai seperti api-api bakau atau nipah dan bakteri anaerobik pereduksi senyawa sulfat. Sebagai hasil kerja bakteri anaerob pereduksi senyawa sulfat, terbentuk mineral-mineral tanah berukuran mikro, yang disebut pirit (FeS2) (Pyrite cubic-FeS2). Lapisan tanah yang banyak mengandung mineral pirit ini, apabila masih belum diganggu, jenuh air atau tergenang dan piritnya belum teroksidasi disebut lapisan bahan sulfidik.
Proses pembentukan pirit pada tanah / endapan marin ternyata melalui beberapa tahapan (Laragenhoff, 1986) sebagai berikut :
a. Reduksi sulfat (SO4)-2 menjadi sulfide (S-) oleh bakteri pereduksi sulfat dalam lingkungan anaerob.
b. Oksidasi parsial sulfide menjadi polisulfida, atau unsur S, diikuti pembentukan FeS, dari senyawa S-terlarut dan besi (Fe)-oksida atau mineral silikat mengandung Fe.
c. Pembentukan FeS2, dari kombinasi FeS dengan unsur S, atau presipitasi langsung dari Fe-terlarut (Ion Ferro, Fe2+) dengan ion-ion polisulfida.
d. Reaksi kimia pembentukan pirit, dari senyawa Fe-oksida digambarkan sebagai berikut :
6) Fe2O3 + 4(SO4)-2 + 8 (H2O Intensitas warna yang tinggi (berwarna coklat kemerahan)
7) pH yang rendah
8) Kandungan zat organik yang tinggi
9) Kekeruhan dan kandungan partikel tersuspensi yang rendah 10) Kandungan kation yang rendah
+ ½ O2 2FeS2 + 8(HCO3)- + H2O
sulfat bahan organik pirit karbohidrat
Tanah marin mempunyai kenampakan sebagai tanah liat yang selalu jenuh air (water logged) dengan muka air tanah dekat dengan permukaan tanah. Dalam kondisi alami sebelum dibuka untuk pemukiman, tanah marin sering tergenang air, namun apabila tanah marin kemudian direklamasi dengan dibukanya saluran-saluran drainase, air tanah menjadi turun, lingkungan pirit menjadi terbuka dalam suasana aerobik. Sehingga terjadi oksidasi pirit, yang menghasilkan asam sulfat. Reaksinya dapat digambarkan sebagai berikut :
FeS2 + 14/4 O2 + 7/2 H2O Fe(OH)3 + 2(SO4)-2 + 4H+ pirit oksigen besi-III asam sulfat
Hasil reaksi adalah terbentuknya asam sulfat, dengan terbebasnya ion H+, yang mengakibatkan pH sangat rendah (pH 1,9 sampai < 3,5).
Dalam kondisi teroksidasi sangat kuat, antara lain akibat drainase yang drastis, misalnya air tanah turun terlalu dalam, atau oleh penggalian parit atau saluran drainase, bahan sulfidik mengandung pirit akan menghasilkan mineral jarosit yang nampak sebagai karatan-karatan berwarna kuning jerami, dengan reaksi tanah yang sangat masam.
FeS2 + 15/4 O2 + 1/3 K+ 1/3 KFe(SO4)2(OH)6 + 4/3(SO4)-2 + 3 H+ pirit oksigen jarosit asam sulfar
Pada proses oksidasi pirit dibebaskan ion sulfat. Ion H+ dan senyawa besi Ferri bervalensi tiga (Fe(OH)3) yang segera tereduksi menjadi ion besi Ferro-bervalensi dua (Fe(OH)2) yang mudah bergerak, karena merupakan ion-ion bebas. Terlalu banyaknya ion-ion H+ dalam larutan tanah, disamping menyebabkan terjadinya pertukaran ion yang mendesak keluar semua basa-basa tanah (Ca, Mg, K dan Na) dalam kompleks adsorpsi liat dan humus, ion-ion H+ juga membentuk senyawa hidrat dengan molekul air (yang bersifat bipolar) dan masuk kedalam struktur kisi (Lattice) mineral liat untuk menggantikan / subtitusi tempat. Ion Al3+ dalam kisi mineral. Mineral liat menjadi tidak stabil, kisinya runtuh (Collapsed)
dan strukturnya rusak, sehingga dibebaskan banyak sekali ion Al3+ dalam larutan tanah. Kompleks pertukaran liat dan humus, karena reaksi pertukaran dengan Al3+ dan Fe3+ yang melimpah, akan dijenuhi oleh kedua ion tersebut, khususnya ion Al3+. Ion-ion basa lain (K, Ca, Mg dan Na) tercuci keluar dan hanyut terbawa air mengalir.
Humus terdiri dari 2 senyawa utama yaitu substansi non humus (missal: lipid, asam amonia, karbohidrat) dan substansi humus (merupakan senyawa amorf dengan berat molekul tinggi, warna coklat sampai hitam).
Substansi humus dibedakan menjadi:
1. Humic Acid (asam humus): warna gelap, amorf, dapat diekstaksi (larut) dengan basa kuat, garam netral, tidak larut dalam asam; mengandung gugus fungsional asam seperti fenoliuk dan karboksilik; aktif dalam reaksi kimia; Berat molekul (BM) 20.000-1.360.000.
2. Fulvic Acid (asam Fulfat); dapat diekstraksi dengan basa kuat, gugus fungsional asam, larut juga dalam asam, mengandung gugus fungsional basa; aktif dalam reaksi kimia; BM 275-2110.
3. Humin: tidak terlarut dalam asam dan basa; BM terbesar; tidak aktif; warna paling gelap.
Gambar 2.1. Model struktur asam humat berdasarkan Stevenson (1982); R dapat berupa alkil, aril, atau aralkil.
Gambar 2.2. Model struktur asam fulvat berdasarkan Buffle et al. (1977).
Asam humat merupakan bahan makromolekul polielektrolit yang memiliki gugus fungsional seperti –COOH, -OH fenolat maupun –OH alkoholat sehingga asam humat memiliki peluang untuk membentuk kompleks dengan ion logam karena gugus ini dapat mengalami deprotonasi pada pH yang relatif tinggi. Menurut Swift (1989), deprotonasi gugus-gugus fungsional asam humat akan menurunkan kemampuan pembentukan ikatan hidrogen, baik antar molekul maupun sesama molekul dan meningkatkan jumlah muatan negatif gugus fungsional asam humat, sehingga akan meningkatkan gaya tolak menolak antar gugus dalam molekul asam humat. Kedua pengaruh tersebut akan menyebabkan permukaan partikel-partikel koloid asam humat bermuatan negatif dan menjadi lebih terbuka serta berbentuk linear dengan meningkatnya pH. Salah satu faktor yang mempengaruhi kelarutan asam humat adalah pH, yang lebih lanjut akan mempengaruhi disosiasi gugus yang bersifat asam pada asam humat. Disosiasi proton yang terjadi pada gugus fungsional yang bersifat asam pada asam humat dipengaruhi oleh: (1) atraksi elektrostatik atau tolakan muatan yang ada dalam molekul, (2) ikatan hidrogen sesama dan antar molekul.
Dalam larutan (pH 3,5 - 9), asam humat membentuk sistem koloid polielektrolit linear yang bersifat fleksibel; sedangkan pada pH rendah asam humat berbentuk kaku (rigid) dan cenderung teragregasi membentuk suatu padatan makromolekul melalui ikatan hidrogen. Dengan meningkatnya pH akan menyebabkan ikatan hidrogen semakin lemah sehingga agregat akan terpisah satu sama lain. Keadaan tersebut dipengaruhi oleh disosiasi gugus fungsional yang bersifat asam pada asam humat seperti -COOH. Umumnya gugus -COOH terdisosiasi pada pH sekitar 4-5, sedangkan gugus -OH fenolat atau –OH alkoholat terdisosiasi pada pH sekitar 8-10. Spark dkk (1997) telah mengamati kelarutan asam humat batubara yang menunjukkan bahwa kelarutan maksimum asam humat terjadi pada pH 3-6 yaitu sekitar 80% dan sisa padatan mulai larut pada pH 8,5. Dengan demikian dapat dinyatakan bahwa pada pH yang relatif tinggi (konsentrasi H+ rendah) akan meningkatkan kensentrasi -COO- yang dapat berfungsi sebagai ligan pada asam humat.
Walaupun pada pH yang relatif rendah, asam humat cenderung tidak berinteraksi dengan ion logam, akan tetapi sebagai padatan polielektrolit, asam humat memiliki kemampuan untuk mengadsorpsi logam. Asam humat dengan ion logam dapat mengalami presipitasi. Tingkat flokulasi yang terjadi bergantung pada pH, sifat-sifat gugus fungsional pada asam humat yang dapat bertindak sebagai ligan dan sifat ion logam.
Substansi humus bergabung dengan bagian mineral tanah adalah sebagai berikut: 1. Sebagai garam dari asam organik dengan berat molekul rendah (acetat, oxalat,
2. Sebagai garam dari substansi humus dengan kation alkalin – humat, fulvat. 3. Sebagai chelat dengan ion logam.
4. Sebagai subsansi yang tertahan pada permukaan mineral tanahliat. Substansi humus dengan kation alkalin terdiri dari senyawa:
1. humat (garam dari asam humus) 2. fulvat (garam dari asam fulvat)
Ini adalah sebagian besar senyawa karakteristik substansi tanah humus. Kation alkalin (Na+, K+, Ca2+, Mg2+) terbentuk terutama melalui pertukaran ion sederhana dengan gugus COOH (RCOONa, RCOOK, dll.). Humat dan fulvat terjadi di dalam tanah sebagian besar sebagai campuran dengan hidroksida Fe dan Al. Kemampuan membentuk kompleks dari asam humus dan asam fulvat sebagian besar merupakan hasil dari isi gugus fungsionalnya yang mengandung oksigen, seperti COOH, phenol OH dan gugus C=O. Bahan-bahan organik utama tanah membentuk komplek yang bisa larut dan yang tidak bisa larut dengan ion logam dan dengan demikian memegang peranan rangkap di dalam tanah.
dalam penyerapan substansi humus oleh mineral tanahliat, antara lain: 1. gaya van der Waals
2. pengikatan dengan pembentukan-jembatan kation 3. pengikatan H
4. penyerapan melalui penggabungan dengan oxida cair 5. penyerapan pada ruang antar-lapisan mineral tanahliat.
Kation polivalen utama bertanggungjawab atas pengikatan asam humus dan asam fulvat pada tanahliat adalah Ca2+, Fe3+ dan Al3+. Sebaliknya Fe3+ dan Al3+ membentuk komplek koordinasi yang kuat dengan senyawa organik. Kation polivalen bertindak sebagai jembatan antara kedua tempat bermuatan.
Penyerapan asam fulvat pada permukaan oksida disertai dengan penggantian gugus OH oleh ion COO-. Anion organik tidak mudah diganti dengan garam sederhana, walaupun penyerapan sensitif pH. Seperti halnya dengan kation organik pada permukaan mineral tanahliat, ikatan yang sangat kuat akan terjadi jika lebih dari satu gugus pada molekul humus berpartisipasi.
2.3 Pengolahan Air Gambut
Karekteristik air gambut seperti yang telah disebutkan di atas menunjukkan bahwa air gambut kurang menguntungkan untuk dijadikan air bagi masyarakat di daerah berawa. Namun karena jumlah air gambut tersebut sangat banyak dan dominan berada di daerah tersebut maka harus bisa menjadi alternatif sumber air minum masyarakat. Kondisi yang kurang menguntungkan dari segi kesehatan adalah sebagai berikut (Mu-min 2002).
a. Kadar keasaman pH yang rendah dapat menyebabkan kerusakan gigi dan sakit perut.
b. Kandungan Organik yang tinggi dapat menjadi sumber makanan bagi mikroorganisne dalam air, sehingga dapat menimbulkan bau apabila bahan organik tersebut terurai secara biologis.
c. Apabila dalam pengolahan air gambut tersebut digunakan klor sebagai desinfektan, akan terbentuk TriHaloMetan (THM) seperti senyawa organoklor yang dapat bersifat karsinogenik.
d. Ikatan yang kuat dengan logam (besi dan mangan) menyebabkan kandungan logam dalam air tinggi dan dapat menimbulkan kematian jika dikonsumsi secara terus-menerus.
Berdasarkan pada pengetahuan tentang penyebab dan kandungan warna pada air gambut dan sifat-sifatnya, maka proses dan metode pengolahan yang dapat diterapkan untuk mengolah jenis air berwarna alami adalah Metode Elektrokoagulasi (Mahmud, 2002).
2.4 Elektrokoagulasi
Elektrokoagulasi adalah proses penggumpalan dan pengendapan partikel-partikel halus dalam air menggunakan energi listrik. Proses elektrokoagulasi dilakukan pada bejana elektrolis yang di dalamnya terdapat dua penghantar arus listrik searah yang disebut elektroda yang tercekup dalam larutan limbah sebagai elektrolit.
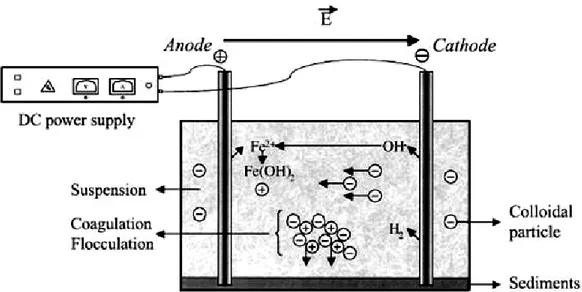
Gambar 2.3. Prinsip dari proses elektrokoagulasi (Ni’am, 2007)
Apabila dalam suatu larutan elektrolit di tempat dua elektroda dan dialiri arus listrik searah, maka akan terjadi peristiwa elektrokimia yaitu gejala dekomposisi elektrolit, yaitu ion positif (kation) bergerak ke anoda dan (anion) bergerak ke Anoda dan menyerahkan elektron menerima elektron yang dioksidasi. Sehingga membentuk flok yang mampu mengikat kontaminan dan partikel-partikel dalam limbah.
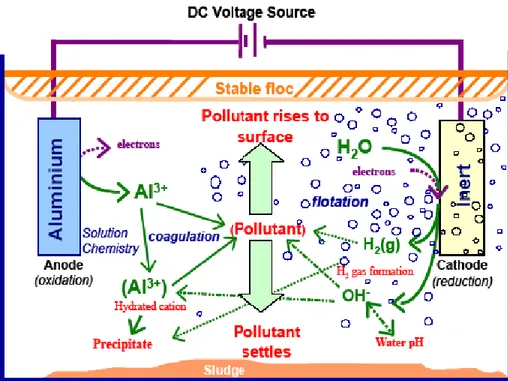
Gambar 2.4. Mekanisme Dalam Elektrokoagulasi (Holt,2001)
Tampak jelas bahwa elektrokoagulasi memiliki kemampuan untuk membersihkan berbagai polutan dengan berbagai kondisi mulai dari: zat-zat padat tersuspensi; logam berat; produk petroleum; warna dari larutan yang mengandung pewarna; humus cair; dan defluoridasi air.
Mekanisme yang mungkin:
Arus dialirkan melalui suatu elektroda logam, yang mengoksidasi logam (M) menjadi kationnya (Mn+) (Persamaan 1). Secara simultan, air tereduksi menjadi gas hidrogen dan ion hidroksil (OH-) (Persamaan 2). Dengan demikian elektrokoagulasi
memasukkan kation logam in situ, secara elektrokimia, dengan menggunakan anoda yang dikorbankan (biasanya aluminium atau besi).
M → Mn+
+ ne- (1)
2H2O + 2e- → 2OH- + H2 (2) Kation terhidrolisis di dalam air yang membentuk hidroksida dengan
spesies-spesies utama yang ditentukan oleh pH larutan. Persamaan 3-6 menggambarkan hal ini dalam kasus aluminium.
Al3+ + H2O → AlOH2+ + H+ (3)
AlOH2+ + H2O → Al(OH)2+ + H+ (4)
Al(OH)2+ + H2O → Al(OH)30 + H+ (5) Al(OH)30 + H2O → Al(OH)4- + H+ (6) Kation bermuatan tinggi mendestabilisasi setiap partikel kolloid dengan
pembentukan komplek polihidrosida polivalen. Komplek-komplek ini memiliki sifat-sifat penyerapan yang tinggi, yang membentuk agregat dengan polutan. Evolusi gas hidrogen membantu dalam percampuran dan karenanya membantu flokulasi. Begitu flok dihasilkan, gas elektrolitik menimbulkan efek pengapungan yang memindahkan polutan ke lapisan flok-foam pada permukaan cairan.
Ada berbagai cara dengan mana spesies-spesies bisa berinteraksi dalam larutan:
1. Migrasi ke elektroda dengan muatan berlawanan (elektroforesis) dan agregasi disebabkan netralisasi muatan.
2. Kation atau ion hidrosil (OH-) membentuk endapatan dengan polutan. pH
3. Kation logam berinteraksi dengan OH- untuk membentuk hidroksida, yang memiliki sifat-sifat penyerapan tinggi yang dengan demikian mengalami pengikatan pada polutan (koagulasi jembatan).
4. Hidroksida membentuk struktur mirip-kisi yang lebih besar dan menyapu air (koagulasi sapuan).
5. Oksidasi polutan menjadi spesies yang tidak begitu toksit.
6. Pembersihan dengan elektroflotasi dan pelekatan pada gelembung-gelembung.
Reaksi yang terjadi pada proses ini adalah : a. Reaksi pada katoda
Reaksi pada katoda adalah reaksi reduksi terhadap kation, jadi yang diperhatikan kationnya saja.
1. Jika larutan mengandung ion-ion logam alkali, ion-ion logam alkali tanah, ion Al+3, dan ion Mg2+, mengandung ion-ion logam ini tidak dapat direduksi dari larutannya. Yang akan mengalami reduksi adalah pelarut (air) dan terbentuk gas Hidrogen (H2) pada katoda.
2H2 O + 2e 2OH- + H2
Dari daftar E0 diketahui bahwa reduksi terhadap air lebih mudah berlangsung dari pada reduksi terhadap ion-ion di atas.
2. Jika larutan mengandung asam maka ion H+ dari asam akan direduksi menjadi gas Hidrogen pada katoda.
2H+ + 2e H2
3. Jika larutan mengandung ion-ion lain maka ion-ion logam ini diendapkan pada permukaan batang katoda.
Fe2+ + 2e Fe Mn 2+ + 2e Mn
b. Reaksi Pada Anoda
Elektroda pada Anoda, elektrodanya dioksidasi (bereaksi) diubah menjadi ionnya.
Contoh :
Al Al3+ + 3e Zn Zn2+ + 2e
Dalam system elektrokimia dengan anoda terbuat dari alumunium, berapa kemungkinan reaksi elektroda dapat terjadi sebagai berikut.
Anoda : Al Al3+ + 3e Katoda : 2H2O + 2e H2 + 2 OH
2H+ + 2e H2 O2 + 4H+ + 4e 2H2O
2.4.1. Koagulasi
Koagulasi adalah peristiwa destabilisasi partikel-partikel koloid dan larutan. Partiekl-partikel tersebut membentuk lapisan secara kimia yang kemudian diikuti dengan flokulasi. Zat-zat kimia yang digunakan untuk mendestabilkan partikel koloid disebut dengan koagulan.
Koagulan yang paling umum dan sering digunakan adalah alum (aluminium sulfat) dan garam-garam dari senyawa besi. Karakteristik dari kation multivalensi adalah mempunyai kemampuan menarik koagulan ke muatan partikel koloid (Proste,1997).
Pada dasarnya koagulasi disebabkan oleh ion-ion yang muatannya berlawanan dengan partikel koloid, dalam hal ini ion-ion koagulan yang bermuatan positif akan mentralisir muatan negatif partikel koloid yang menyebabkan dapat mengurangi gaya tolak-menolak antar partikel-partikel koloid sehingga terjadi pengendapan (Robert,1986).
2.4.2. Flokulasi
Flokulasi adalah penggabungan dari partikel-partikel hasil koagulasi menjadi partikel yang lebih besar dan mempunyai kecepatan mengendap yang lebih besar, dengan cara pengadukan lambat. Dalam hal iniu proses koagulasi harus diikuti flokulasi yaitu penggumpalan koloid terkoagulasi sehingga membentuk flok yang mudah terendapkan atau transportasi partikel tidak stabil, sehingga kontak antar partikel dapat terjadi (Sutrisno,1987).
2.4.3. Keuntungan dari elektrokoagulasi
a. Elektrokoagulasi membutuhkan peralatan yang sampel dan mudah untuk mengoperasikannya
b. Air yang ditreatmen dengan elektrokoagulasi menjadi bersih, jernih dan tidak berbau.
c. Effluen yang dihasilkan elektrokoagulasi mengandung TDS (Total Dissolved Solid) yang lebih sedikit dibandingkan dengan yang ditreatment secara kimia. d. Proses elektrokoagulasi mempunyai keuntungan memindahkan (Removing)
partikel-partikel koloid yang paling kecil, sebab di aplikasikan medan elektrik dengan gerak yang lebih cepat.
e. Proses elektrokoagulasi jauh dari penggunaan bahan-bahan kimia dan tidak ada problem untuk menetralisir kelebihan bahan-bahan kimia, dan tidak ada polusi yang kedua yang disebabkan subtansi kimia yang ditambahkan pada konsentrasi yang tinggi.
f. Produksi gelembung-gelembung gas selama elektrolisis dapat membawa polutan-polutan ke atas sehingga dapat dengan mudah di konsentrasikan, dikumpulkan dan dipindahkan (removed).
g. Proses elektrolit pada sel elektrokoagulasi dikontrol secara elektrik dan dengan tidak memindahkan bagian-bagian sehingga membutuhkan sedikit perawatan.
2.5 Zat Besi (Fe)
2.5.1. Sifat-sifat logam besi
Besi (Fe) adalah metal berwarna putih kepekatan, liat dapat dibentuk. Besi dalam sistem periodik unsur dengan nomor atom 26 terdapat dalam golongan VIII B dan period eke-4. Besi melebur pada suhu 15350C, titik didihnya 30000C, dan mempunyai densitas 7,87 g/cm3.
2.5.2. Logam besi dalam kehidupan manusia
Proses biokimia dalam tubuh mahluk hidup hamper selalu melibatkan unsur-unsur logam di dalamnya. Pada suatu proses fisiologi yang normal, ion logam esensial sangat berperan aktivitasnya baik dalam ikatannya dengna protein, enzim maupun bentuk lainnya. Manusia yang sehat dalam jaringan tubuhnya selalu ditemukan ion logam yang normal. Sedang ion logam yang ditemukan terlalu rendah pada jaringan tertentu misalnya darah (Fe), hati (Cu), dapat digunakan untuk mendiagnosa adanya kelainan pada orang yang bersangkutan yang kemungkinan menderita defisiensi atau penyakit lainnya.
Diperkirakan bahwa untuk setiap pria dewasa harus memperoleh sekitar 1 mg/ Fe/hari untuk mengganti Fe yang diekskresikan melalui saluran pencernaan, urine dan kulit. Pada wanita dewasa darah, yang hilang pada saat menstruasi perlu diganti dengan 1,4-2,2 mg Fe/hari. Pada umumnya manusia memperoleh 10% Fe dari makanan yang diabsorbsi melalui saluran pencernaan, sehingga mereka memperoleh sekitar 10-20 mg Fe/hari.
2.5.3. Logam besi dalam air
Besi merupakan salah satu elemen kimia yang dapat ditemui pada hamper setiap tempat di bumi, pada semua lapisan geologis dan semua badan air, besi yang ada di dalam air dapat bersifat :
1. Terlarut sebagai Fe2+ (ferro) atau Fe3+ (ferri).
2. Tersuspensi sebagai butir kolodial (diameter <1um) atau lebih besar seperti Fe2O3, FeO, Fe(OH)3, dan sebagainya.
3. Tergabung dengan zat organik atau zat padat yang inorganik atau seperti tanah liat.
Pada air permukaan jarang dijumpai kadar Fe yang lebih besar dari 1 mg/l, tetapi di dalam air tanah kadar Fe dapat jauh lebih tinggi. Pada air yang mengandung oksigen (O2), seperti seringkali air tanah, besi berada sebagai Fe3+ yang cukup larut, sedangkan pada air sungai yang mengalir dan terjadi aerasi, Fe2+ teroksidasi menjadi Fe3+, Fe3+ ini sulit larut pada pH 6 sampai 8, bahkan dapat menjadi ferihidroksida (Fe(OH)3 atau salah satu jenis oksida yang merupakan zat padat dan dapat mengendap. Demikian halnya di dalam air sungai, besi berada sebagai Fe2+, Fe3+ terlarut dan Fe3+ dalam bentuk senyawa organik berupa koloidal.
Sekalipun Fe diperlukan oleh tubuh, tetapi dalam dosis besar dapat merusak dinding usus. Kematian seringkali menyebabkan oleh rusaknya dinding usus ini, Konsentrasi unsur ini dalam air yang melebihi ±2 mg/l akan menimbulkan noda-noda pada peralatan dan bahan-bahan berwarna putih. Adanya unsur ini dapat pula menimbulkan bau dan warna pada air minum, dan warna koloid pada air. Selain itu,
konsentrasi yang lebih besar dari 1mg/l dapat menyebabkan warna air menjadi kemerah-merahan, memberi rasa yang tidak enak pada minuman, dapat membentuk endapan pada pipia-pipa logam dan bahan cucian.
Atas dasar pertimbangan diatas, maka ditetapkan standar konsentrasi maksimum Fe dalam air minum oleh Depkes RI, sebesar 0,1-1,0 mg/l (SNI 06-6989,4-2004). Dengan dipenuhinya standar tersebut oleh air minum, maka diharapkan berbagai hal yang tidak inginkan tersebut diatas tidak terjadi
2.6 Logam Berat Tembaga (Cu)
Tembaga dengan nama kimia cuprum dilambangkan dengan Cu. Unsur logam ini berbentuk kristal dengan warna kemerahan. Dalam tabel periodik unsur-unsur kimia, tembaga menempati posisi dengan nomor atom 29 dan mempunyai bobot berat atom 63,546. Unsur tembaga di alam dapat ditemukan dalam bentuk logam bebas. Akan tetapi, lebih banyak ditemukan dalam bentuk persenyawaan atau sebagai senyawa padat dalam bentuk mineral.
Logam Cu dapat terakumulasi dalam jaringan tubuh, maka apabila konsentrasinya cukup besar logam itu akan meracuni manusia tersebut. Pengaruh racun yang ditimbulkan dapat berupa muntah-muntah, rasa terbakar di daerah esofargus dan lambung, kolik serta mencret-mencret. Kemudian disusul dengan hipotensi, nekrosi hati dan koma (Supriharyono, 2000).
Keracunan sistematik tembaga mirip dengan keracunan sistematik oleh logam berat lainnya yang dapat meluas terhadap kerusakan serabut-serabut darah, kerusakan
ginjal, sarap sentral dan diikuti pada dengan despresi. Keracunan tembaga menunjukkan sifat-sifat yang agak kurang beracun dibandingkan dengan logam berat lainnya, tetapi bila keracunan dalam jumlah kecil terjadi terus menerus( menelan) dapat menimbulkan pigmentary cirrhosis hati (hati mengeras) (Adiwisastra,1985).
.Logam Cu dibutuhkan untuk sistem enzimoksidatif seperti enzim askorbat-oksidasi, sistikrom Cu-oksidase, Polipenol-oksidase, amina-oksiadse dan lain-lain. Cu juga dibutuhkan manusia sebagai komplek Cu-protein yang mempunyai fungsi tertentu dalam pembentukan haemoglobin, kalogen, pembuluh darah dan myelin otak (Heryandro palar,1994).
2.7 Logam Kalsium (Ca)
Kalsium terdapat sebanyak 99% dalam tulang kerangkan dan sisanya dalam cairan antar sel dan plasma. Dalam bahan makanan terutama terdapat dalam susu dan telur, juga gandum dan sayur-mayur, antara lain bayam. Resorpsinya dari usus memerlukan adanya vitamin D dalam bentuk aktifnya, yaitu kalsitriol.
Fungsinya selain sebagai bahan bangun bagi kerangka, juga sebagai pemeran penting pada regulasi daya rangsang dan kontraksi otot serta penerusan implus saraf. Lagi pula Ca mengatur permeabilitas membran sel bagi Kdan Na dan mengaktivasi banyak reaksi enzim, seperi pembekuan darah.
Defisiensi kalsium menimbulkan antara lain melunaknya tulang (ostemalacia) serta mudah terangsangnya saraf dan otot, dengan akibat serangan kejang(tetania).
Dalam kebanyakan kasus kekurangan di sebabkan oleh defisiensi Vitamin D dan terhambatnya resorpsi Ca, atau karena penyakit hipoparatiroris dan insufisiensi ginjal.
2.8 Spetrofotometer Serapan Atom (SSA)
Spektrofotometer Serapan Atom adalah suatu metode pengukuran kuantitatif suatu unsur yang terdapat dalam cuplikan berdasarkan penerapan cahaya pada panjang gelombang tertentu oleh atom-atom bentuk gas dalam keadaan dasar. Telah lama ahli kimia menggunakan pancaran radiasi oleh atom yang dieksistasikan dalam suatu nyala sebagai alat analitis. Suatu nyala yang lain, kebanyakan atom berada dalam keadaan eksitasi. Fraksi atom-atom yang tereksitasi berubah secara eksponensial dengan temperatur. Tehnik ini digunakan untuk penetapan sejumlah unsur, kebanyakan logam, dan sample yang sangat beraneka ragam.
2.8.1 Prinsip Dasar Spektrofotometer Serapan Atom
Jika cahaya dengan panjang gelombang resonansi dilewatkan nyala yang mengandung atom-atom yang bersangkutan, maka sebagian cahaya itu akan diserap, dan jauhnya penyerapan akan berbanding lurus dengan banyaknya atom keadaan dasar yang berada dalam nyala. Hal ini merupakan dasar penentuan kuantitatif logam-logam dengan menggunakan SSA (Walsh,1955).
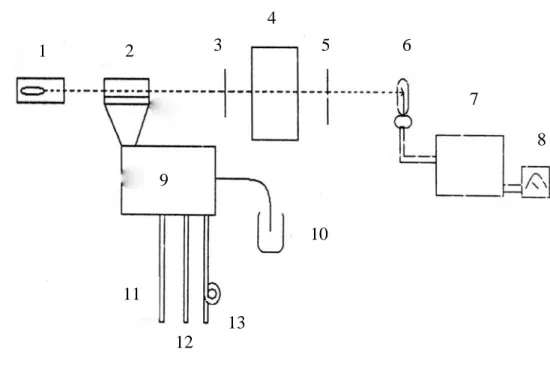
2.8.2. Cara Kerja Spektrofotometer Serapan Atom Setiap alat SSA terdiri atas tiga komponen berikut :
a. Unit atomisasi b. Sumber radiasi
c. Sistem pengukur fotometrik
Gambar 2.5. Skematis Ringkas Spektrofotometer Serapan Atom Keterangan : 1 : Lampu katoda 2 : Tungku 3 : Entrace Slit 4 : Monokromator 5. : Exit Slit 1 2 3 4 5 6 7 8 9 10 11 12 13
6. : Foto Detektor 7. : Amplifier 8. : Skala Pembacaan 9 : Nebulizer 10. : Sampel 11 : Gas Asetilen 12 : Udara 13. : Buangan