Studi Inhibisi Faktor Virulens Mycobacterium tuberculosis (Mtb
) “
Protein
Tirosin Fosfatase A
(PtpA)” dengan Inhibitor
Asam Lemak Eikosenoat
Baiq Repika Nurul Furqan
Jurusan Kimia, Fakultas MIPA, Universitas Mataram
Abstrak
Telah dilakukan studi inhibisi enzim PtpA yang merupakan protein virulensi dari
Mycobacterium tuberculosis (Mtb) menggunakan inhibitor Asam lemak eikosenoat.
Beberapa tahap yang dilakukan dalam studi inhibisi adalah dilakukan analisis SDS-PAGE terlebih dahulu untuk mengkonfirmasi ekspresi PtpA, selanjutnya dilakukan penentuan time course atau penentuan aktivitas PtpA dalam menghidrolisis substrat p-NPP, kemudian dilakukan uji inhibisi enzim PtpA oleh senyawa isomer Asam lemak eikosenoat. Didapatkan hasil berupa enzim PtpA dapat diinhibisi secara signifikan oleh senyawa Asam lemak cis-2-eikosenoat dengan nilai IC50 sebesar 17,51 μM dan Asam lemak trans-2-eikosenoat sebesar
19,76 μM, serta Asam lemak trans-11-eikosenoat dapat menginhibisi PtpA namun tidak signifikan. Selain itu, penelitian ini menghasilkan docking yang menunjukkan interaksi antara ligand (inhibitor) dengan receptor (enzim) yakni jenis interaksi ikatan hidrogen polar dengan residu asam amino Arg30, Thr41, dan Gly35, serta kemungkinan interaksi lain juga terjadi antara Asam lemak trans-2-eikosenoat dengan asam amino Arg39 dan Thr69. Oleh sebab itu, penemuan ini menunjukkan kemungkinan untuk mengeksplorasi derivat asam lemak eikosenoat sebagai inhibitor yang potensial untuk protein modulator Mtb.
Kata Kunci : Protein tirosin fosfatase A, Asam lemak eikosenoat, Mycobacterium tuberculosis
Abstract
This research is a preliminary study of PtpA inhibition with eicosenoic acids. PtpA is a virulence factor of Mycobacterium tuberculosis (Mtb) that responsible for latent Mtb infection. Prior to inhibition assay, expression of PtpA was confirmed by SDS-PAGE analysis, and time course profile or PtpA activity in hydrolyzing pNPP substrate was determined. Inhibition assays showed that both trans-2-eicosenoic fatty acid and cis-2-eicosenic fatty acid are able to inhibit PtpA, whereas insignificant inhibition is shown by
trans-11-eicosenoic fatty acid. Furthermore, trans-2-eicosenoic fatty acid and cis-2-eicosenoic fatty acid have IC50 value of 17.51 μM and 19.76 μM, respectively. Possible interaction
between PtpA with trans-2-eicosenoic fatty acid was shown by docking assay that revealed that trans-2-eicosenoic fatty acid that was found forming polar hydrogen bond with residues Arg30, Thr41, and Gly35, and unknown interaction between trans-2-eicosenoic fatty acid
with residues Arg39 and Thr69. All together, these finding suggests a possibility to explore
eicosenoic fatty acid derivatives as potential inhibitors for Mtb modulator protein.
1. PENDAHULUAN
Penyakit yang masih menjadi masalah utama bagi dunia kesehatan hingga saat ini adalah Tuberkulosis (TB) yang disebabkan oleh Mycobacterium tuberculosis (Mtb) (Mascarello et al., 2013) yakni mengakibatkan 1,4 juta orang meninggal setiap tahunnya, dan telah menginfeksi secara laten 1/3 populasi dunia (WHO, 2014). TB laten adalah kondisi pada saat Mtb di tubuh sedang dormant (tidur) namun masih hidup. Mtb akan tidur selama tubuh penderita TB laten dapat melawannya dan tidak dapat ditularkan kepada orang lain. Apabila penderita TB laten sedang mengalami penurunan sistem imun, maka
Mtb akan "bangun" dan berkembang biak yang dikenal dengan TB aktif atau kasus TB (Meena dan Rajni, 2010).
Dalam keadaan TB laten, bakteri Mtb dapat menginfeksi dan resisten di dalam sel makrofag. Hal ini disebabkan kemampuan Mtb untuk mensekresi beberapa protein virulens seperti: Protein lipoamida dehidrogenase C (PpdC), Protein kinase G (PknG),
Protein tirosin fosfatase A (PtpA), Protein tirosin fosfatase B (PtpB), dan beberapa protein lain yang mampu memodulasi dan mencegah pembentukan fusi fagosom dengan lisosom yang bersifat degradatif terhadap bakteri Mtb (Wiliams, et al., 2010).
Untuk mengatasi masalah resistensi tersebut, maka diperlukan suatu pencarian target obat baru yakni didasarkan pada inhibisi protein yang disekresi oleh Mtb, sehingga pematangan fagosom dan degradasi Mtb di dalam sel makrofag dapat berlangsung. Salah satu protein Mtb yang banyak dipelajari adalah PtpA yang diketahui mengganggu sinyal makrofag pada pembentukan fagosom-lisosom (Bach et al., 2008).
Usaha mencegah infeksi laten TB dilakukan dengan pencarian inhibitor bagi PtpA melalui pendekatan biokimia yaitu menguji aktivitas PtpA setelah penambahan inhibitor. Studi terkait mengenai senyawa potensial yang dapat menginhibisi faktor virulensi dari
Mtb telah dilaporkan oleh Dhanjal et al (2014), yang menggunakan pendekatan bioinformatika untuk menemukan senyawa yang dapat menginhibisi PtpB, yaitu asam lemak trans-2-eikosenoat (Dhanjal et al, 2014). Dalam beberapa penelitian, senyawa yang mampu menginhibisi PtpB juga mampu menginhibisi PtpA (Chiaradia, et al., 2008, Macarello, et al., 2010, dan Mascarello, et al., 2013). Oleh sebab itu, dalam penelitian ini dilakukan inhibisi PtpA dengan Asam lemak trans-2-eikosenoat dan isomernya (Asam lemak cis-2-eikosenoat dan Asam lemak trans-11-eikosenoat) dengan berbagai konsentrasi.
2. BAHAN DAN METODE
Bahan- bahan yang digunakan dalam penelitian ini adalah ekstrak kasar enzim PtpA, NaCl, agar, kanamisin (Bioworld), Buffer Assay (Terlampir), akrilamida (Bio Basic Canada), bis-akrilamida (Bio Basic Canada), Tris-HCl 2 M (Bio Basic Canada), Sodium Dodecyl sulphate (SDS) 10% (Bio Basic Canada), Aquades, TEMED (N, N, N’, N’, tetrametilen-etilendiamin) (Bio Basic Canada), APS (ammonium persulfat) (Bio Basic Canada), gliserol 50%, -merkaptoetanol (sigma), bromfenol biru (Bio Basic Canada), Buffer lisis, Marker protein (GEhealth), N- butanol, Coomassie Brilliant Blue (CBB) R250 (Sigma), methanol, asam asetat glacial, substrat p-NPP (Sigma), Imidazol 100 mM, miliQ,
Asam lemak trans-2-eikosenoat (Larodan AB, Swedia), Asam lemak cis-2-eikosenoat
(Larodan AB, Swedia), Asam lemak trans-11-eikosenoat (Sigma), etanol p.a, ddH2O,
Penelitian ini dilakukan dengan menguji inhibisi Protein tirosin fosfatase A (PtpA) dari Mycobacterium tuberculosis (Mtb) dengan melakukan ekspresi gen PtpA dalam E. coli BL21 (DE3) terlebih dahulu. Setelah terekspresi dengan baik, dilanjutkan dengan menguji inhibitor Asam lemak eikosenoat dalam menginhibisi enzim PtpA.
Ekspresi PtpA dalam E. coli BL21 (DE3)
Ekpresi PtpA dikonfirmasi menggunakan alat Elektroforesis gel poliakrilamida-Sodium Dodesil Sulfat (SDS-PAGE) dilakukan dengan metode Laemmli (1970) yang dimodifikasi.
Pengukuran konsentrasi protein dengan Spektroskopi Serapan Ultraviolet Nanodrop
Pengukuran konsentrasi protein menggunakan spektroskopi serapan ultraviolet
Nanodrop (A280nm untuk protein serta A260nm untuk DNA dan RNA). Disiapkan blanko
dan protein yang akan diukur konsentrasinya. Kemudian masing-masing diukur menggunakan instrument Nanodrop yang mengukur serapan A280nm dan A260nm dari
sampel,dan menghitung konsentrasi protein dengan rumus empiris:
Konsentrasi Protein (mg/mL) = 1,55A280nm– 0,76A260nm (Noble and Bailey, 2009).
Penentuan time course.
Pengujian time course dilakukan dengan memodifikasi metode Mascarello, et al.,
(2013). Sebanyak 156 L Imidazol 100 mM, pH 6 dimasukkan ke dalam plate-96 well, kemudian ditambahkan 24 l substrat p-NPP 50 mM, terakhir ditambahkan enzim PtpA sebanyak 20 L (konsentrasi 1 mg/ml). Setelah itu, dilakukan pengukuran absorbansi menggunakan alat Multi Skan Go dengan urutan : plate out, pause (user action), plate in, shake (5 detik), inkubasi (2 menit), diatur suhu 37 C, Kinetik Loop (waktu 2 menit, interval 22 kali), dan Photometric (pada panjang gelombang 410 nm).
Uji daya inhibisi enzim PtpA oleh Asam lemak eikosenoat.
Pengujian inhibisi dilakukan dengan memodifikasi metode Mascarello, et al.,
(2013). Dalam hal ini dilakukan uji inhibisi dengan 3 jenis inhibitor, yaitu Asam lemak trans-2-eikosenoat,Asam lemak cis-2- eikosenoat, dan Asam lemak trans-11-eikosenoat.
Diambil imidazol 100 mM pH 6 (volume bervariasi, tergantung volume inhibitor, yakni 115,2 µL imidazol untuk 0,8 µL inhibitor; 114,4 µL imidazol untuk 1,6 µL inhibitor; 112,8 µL imidazol untuk 3,2 µL inhibitor; 109,6 µL imidazol untuk 6,4 µL inhibitor; 104 µL imidazol untuk 12 µL inhibitor; 92 µL imidazol untuk 24 µL inhibitor) yang dimasukkan kedalam plate 96-well, kemudian ditambahkan dengan 24 µL substrat p-NPP 50 mM, terakhir ditambahkan 20 µL enzim PtpA (20 mg/ml) dan inhibitor dengan variasi konsentrasi 2 µM (0,8 µL), 4 µM (1,6 µL), 8 µM (3,2 µL), 16 µM (6,4 µL), 30 µM (12 µL), dan 60 µM (24 µL). Diketuk-ketuk pinggiran plate kemudian dimasukkan ke dalam Multiskan GO, yang diatur dengan urutan sebagai berikut: plate out, pause (user action), plate in, shake (5 detik kecepatan medium), inkubasi (2 menit), di atur suhu 37 C, Kinetik Loop (waktu 2 menit, interval 15 kali), dan photometric (pada panjang gelombang 410 nm).
Analisis bioinformatika inhibisi PtpA oleh Asam lemak eikosenoat.
docking. Adapun beberapa software yang digunakan di antaranya: Struktur PtpA telah tersimpan didalam Protein Data Bank (PDB) dengan ID 1U2P dan resolusi 2,5 (www.pdb.org). Setelah ID PtpA (1U2P) didapatkan, dilakukan analisis dengan software
Docking Blaster untuk melihat kemungkinan interaksi enzim dengan Asam lemak eikosenoat, hasilnya kemudian ditampilkan dengan software Chimera 1.10.2. Studi bioinformatika ini, dianalisis juga menggunakan Vina Autodock-MGL tools, lalu hasilnya diview menggunakan program Pymol.
3. HASIL DAN PEMBAHASAN
Ekspresi PtpA dalam E. coli BL21 (DE3)
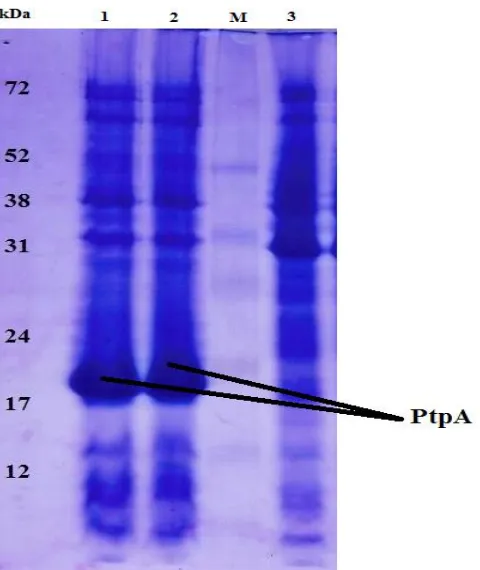
Hasil analisis SDS-PAGE seperti yang terlihat pada Gambar 1. menunjukkan bahwa gen PtpA yang dibawa oleh plasmid pET30b terekspresi dengan sangat baik di dalam E. coli BL21 (DE3). Pita tebal pada lajur 1 dan 2 adalah ekstrak kasar pET30b-PtpA dengan berat molekul 18 kDa, yang sesuai dengan penelitian Silva et al., 2015 yang menyatakan bahwa PtpA termasuk dalam kelompok protein posfatase yang memiliki berat molekul rendah (LMW PTPs) yakni hanya sebesar 18 kDa yang dikodekan oleh asam fosfatase gen lokus 1 (ACP1).
Gambar 1. Gel hasil SDS-PAGE, ekspresi PtpA dalam E. coli BL21 (DE3). Lajur 1&2: ekstrak kasar PtpA. Lajur M: marker protein. Lajur 3: ekstrak kasar E. coli
BL21 .
molekul 18 kDa adalah dengan melihat lajur 3 yang merupakan ekstrak kasar sel E. coli
BL21 (E. coli BL21 yang tidak memiliki enzim PtpA) yang dalam hal ini bertindak sebagai kontrol atau pembanding, di mana pita tebal pada ekstrak kasar PtpA tidak terdapat dalam ekstrak kasar BL21 . Hal inilah yang mengindikasikan bahwa pET30b-PtpA telah berhasil diekspresikan dengan sangat baik dan kuat di dalam E. coli BL21 (DE3).
Pengukuran konsentrasi protein dengan Spektroskopi Serapan Ultraviolet
Nanodrop.
Ekstrak kasar protein yang sudah di analisis SDS-PAGE ditentukan konsentrasinya dengan metode spektroskopi serapan ultraviolet (dengan panjang gelombang A280nm untuk
protein serta A260nm untuk DNA dan RNA) menggunakan instrumen Nanodrop.
Didapatkan konsentrasi protein sebesar 34.350 μg/mL untuk PtpA dan 66.150 μg/mL untuk BL21 .
Penentuan time course.
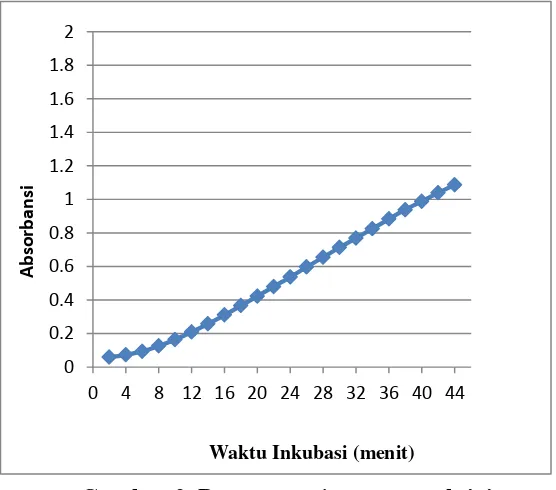
Pada penelitian ini, didapatkan nilai aktivitas tertinggi dan terbaik pada penggunaan imidazol 100 M pH 6, ekstrak kasar enzim PtpA 1 g/mL, dan substrat p-NPP 8 mM. Adapun untuk waktu inkubasi, didapatkan waktu 30 menit dengan nilai absorbansi 0,713 (Gambar 2) yang sesuai dengan Hukum Lambert-Beer, dimana absorbansi maksimum tidak boleh lebih dari 0,8 sehingga tingkat kesalahan dari penelitian tidak terlalu tinggi.
Gambar 2. Penentuan time course aktivitas enzim.
Uji daya inhibisi enzim PtpA oleh Asam lemak eikosenoat.
aktivitas ekstrak kasar enzim PtpA seiring bertambahnya konsentrasi inhibitor Asam lemak trans-2-eikosenoat (Gambar 2), di mana penurunan ini terjadi cukup signifikan dengan penambahan inhibitor dalam ukuran M.
Adapun aktivitas enzim dapat diketahui melalui persamaan:
( ) ( ) ( ( ) ( )) Di mana
enzim turnover number = aktivitas enzim (Unit) x berat molekul enzim dengan : adalah koefisien extinction (M-1cm-1).
pNPP = 1,78x 104M-1cm-1 (Gresham, et al., 2000) A (cm-1) adalah absorbansi pada 410 nm (cm-1) V adalah volume akhir pengujian.
Tabel. 1 Nilai aktivitas PtpA dengan penambahan inhibitor Konsentrasi
Inhibitor ( M)
Nilai Aktivitas dengan Penambahan Inhibitor (Unit) Asam lemak
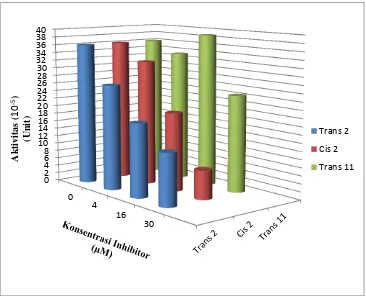
trans-Uji inhibisi PtpA selanjutnya dilakukan dengan Asam lemak cis-2-eikosenoat. Data yang didapatkan tidak jauh berbeda dengan inhibisi menggunakan Asam lemak trans-2-eikosenoat. Seperti yang terlihat pada Tabel 4.1 didapatkan nilai aktivitas berturut-turut sebesar 36,1 x 10-5 Unit untuk penambahan 0 M inhibitor, 31,9 x 10-5 Unit untuk penambahan 4 M inhibitor, 19,9 x 10-5 Unit untuk penambahan 16 M inhibitor, dan 7,3 x 10-5 Unit untuk penambahan 30 M inhibitor. Penurunan nilai aktivitas tersebut dapat dilihat pada Gambar 3. Untuk data dari pengujian inhibisi PtpA menggunakan Asam lemak trans-11-eikosenoat, didapatkan hasil yang berbeda dengan inhibisi menggunakan
Asam lemak trans-2-eikosenoat dan Asam lemak cis-2-eikosenoat yakni secara berturut-turut didapatkan nilai aktivitas enzim sebesar 36,1 x 10-5 Unit untuk penambahan 0 M inhibitor, 33,3 x 10-5 Unit untuk penambahan 4 M inhibitor, 38,8 x 10-5 Unit untuk penambahan 16 M inhibitor, dan 24,5 x 10-5 Unit untuk penambahan 30 M inhibitor (Tabel 1). Nilai aktivitas yang masih naik turun (Gambar 3) menunjukkan ketidakstabilan dari Asam lemak trans-11-eikosenoat dalam menginhibisi ekstrak kasar enzim PtpA.
Berdasarkan uraian perbandingan nilai aktivitas oleh ketiga inhibitor di atas, maka dapat diketahui bahwa inhibitor Asam lemak cis-2-eikosenoat dan Asam lemak trans-2-eikosenoat memiliki kemampuan menginhibisi yang signifikan, sedangkan Asam lemak trans-11-eikosenoat tidak signifikan dalam menginhibisi PtpA. Hal tersebut menunjukkan bahwa perbedaan posisi ikatan rangkap atom karbon pada senyawa asam lemak eikosenoat
sterik yang cukup besar sehingga kemungkinan inhibitor ini tidak mudah berinteraksi dengan enzim PtpA (Kozt, 2006). Untuk lebih memudahkan membaca kekuatan inhibisi dari ketiga inhibitor, maka nilai aktivitas dikonversi menjadi %inhibisi dengan nilai pada Tabel 2.
Gambar 3. Nilai aktivitas enzim PtpA dengan Asam lemak trans-2-eikosenoat, Asam lemak cis-2-eikosenoat, dan Asam lemak trans-11-eikosenoat.
Tabel 2. Persentase inhibisi enzim PtpA dengan 3 isomer senyawa Asam lemak eikosenoat.
Konsentrasi Inhibitor
( M)
Nilai Persentase Inhibisi dengan Penambahan Inhibitor (%)
Asam lemak
trans-2-Adapun %inhibisi tersebut, didapatkan dengan rumus: % Inhibisi PtpA = [(A-B) – (C-D)/(A-B)] x 100%
Dengan A adalah absorbansi enzim tanpa penambahan inhibitor, B adalah absorbansi blanko tanpa penambahan inhibitor, C adalah absorbansi enzim dengan penambahan inhibitor, D adalah absorbansi blanko dengan penambahan inhibitor.
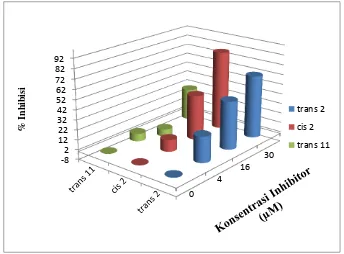
Dari Tabel 2 dapat dilihat bahwa pada inhibitor Asam lemak trans-2-eikosenoat dan asam lemak cis-2-eikosenoat semakin besar konsentrasi inhibitor yang ditambahkan maka daya inhibisinya semakin besar. Sementara itu untuk Asam lemak trans-11-eikosenoat, pada konsentrasi 16 μM memiliki daya inhibisi dengan nilai negatif. Pada konsentrasi sampel yang sama, ketiga sampel memperlihatkan daya inhibisi yang berbeda-beda.
Gambar 4. Inhibisi enzim PtpA dengan 3 Asam Lemak Eikosenoat.
Data yang ditunjukkan oleh ketiga variasi konsentrasi inhibisi yang diuji (4, 16, dan 30 μM) memperlihatkan bahwa Asam lemak cis-2-eikosenoat dan Asam lemak trans-2-eikosenoat memiliki daya inhibisi lebih kuat dengan penurunan nilai aktivitas yang lebih signifikan dibandingkan Asam lemak trans-11-eikosenoat (Gambar 4). Perbedaan daya inhibisi ini diduga karena adanya perbedaan aktivitas biologi akibat perbedaan cis dan
trans serta perbedaan letak ikatan rangkap atom C dari ketiga senyawa isomer tersebut yang berfungsi sebagai inhibitor ekstrak kasar enzim PtpA (Chang, 2001). Menurut Kim
et al., (2004) nilai IC50 penting diketahui untuk menentukan berapa besar potensi
inhibitor dalam menginhibisi reaksi enzimatis. Untuk menentukan nilai IC50 maka
dibuatlah kurva hubungan konsentrasi inhibitor dengan aktivitas inhibisi untuk asam lemak cis-2-eikosenoat seperti yang terdapat pada Gambar 5, dan kurva hubungan konsentrasi inhibitor dengan aktivitas inhibisi untuk asam lemak trans-2-eikosenoat
seperti yangterlihat pada Gambar 6.
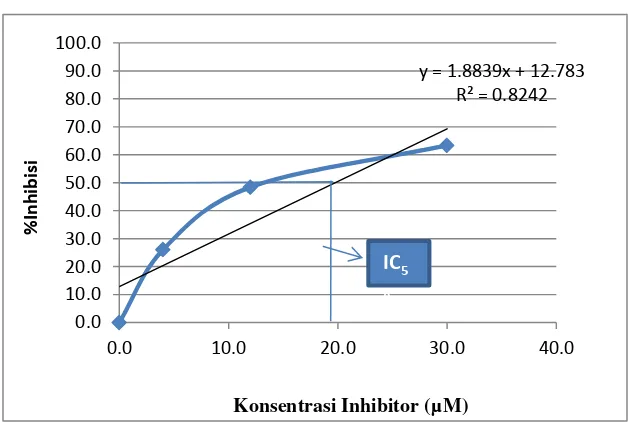
Adapun dalam penelitian ini didapatkan nilai IC50 dari Asam lemak-cis-2-eikosenoat
sebesar 17,51 μM, dan nilai IC50 dari Asam lemak-trans-2-eikosenoat sebesar 19,76 μM.
Nilai IC50 yang didapatkan pada penelitian ini menunjukkan bahwa Asam lemak-cis-2-eikosenoat dan Asam lemak-trans-2-eikosenoat berpotensi untuk dijadikan inhibitor enzim PtpA dengan kategori inhibitor kuat. Hal ini sesuai dengan teori yang menyatakan IC50 adalah bilangan yang menunjukkan konsentrasi senyawa inhibitor (dalam
semakin tinggi aktivitas senyawa inhibitor. Suatu senyawa dikatakan sebagai inhibitor sangat kuat jika nilai IC50 kurang dari 50 M, kuat 50-100 M, sedang 100-150 M, dan
lemah 151-200 M (Rinidar et al., 2013). Selain itu, hasil tersebut menunjukkan senyawa
asam lemak trans-2-eikosenoat dan asam lemak-cis-2-eikosenoat berhasil menginhibisi ekstrak kasar enzim PtpA juga dibuktikan dengan merujuk hasil penelitian Mascarello et. al. (2010) yang menyatakan aktivitas inhibitor dari senyawa alami naftilchalcones berpotensi sebagai inhibitor PtpA dengan nilai IC50 sebesar 8,4 – 53,7 M (rentang Ki
dari 5 sampai 21 M) sehingga dapat dikatakan aktivitas penghambatannya signifikan terhadap pertumbuhan Mtb di makrofag yang terinfeksi (Mascarello et. al., 2010).
Gambar 5. Penetuan IC50Asam lemak cis-2-eikosenoat terhadap PtpA.
Analisis bioinformatika inhibisi PtpA oleh Asam lemak eikosenoat.
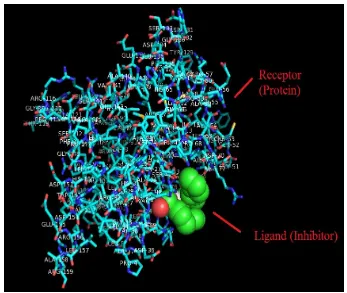
Gambar 7. Interaksi enzim PtpA dengan Asam lemak trans-2-eikosenoat.
Hasil docking pada Gambar 7 menunjukkan interaksi antara enzim PtpA (molekul kecil berwarna hijau) dengan Asam lemak trans-2-eikosenoat (molekul besar warna-warni) secara kasar, yakni adanya interaksi ikatan hidrogen dari ligan Asam lemak trans-2-eikosenoat dengan reseptor enzim PtpA.
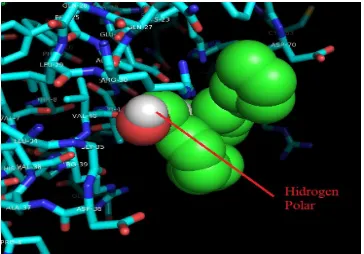
Hasil dari docking menggunakan Autodock Vina-MGL Tools juga menunjukkan interaksi antara ligand dan receptor dengan jenis interaksi ikatan hidrogen polar dengan residu asam amino Arg30, Thr41, dan Gly35. Kemungkinan interaksi lain terjadi antara
Gambar 8. Interaksi hidrogen polar ligan-reseptor.
Gambar 4.11 Kemungkinan interaksi lain
4. PENUTUP Kesimpulan
Dari penelitian yang telah dilakukan, maka dapat disimpulkan:
a. Ekstrak kasar enzim PtpA dapat diinhibisi dengan senyawa Asam lemak cis-2-eikosenoat dengan nilai IC50 sebesar 17,51 μM dan Asam lemak trans-2-eikosenoat
sebesar 19,76 μM. Isomer Asam lemak eikosenoat lain yaitu Asam lemak trans-11-eikosenoat tidak dapat menginhibisi PtpA secara signifikan.
b. Interaksi enzim PtpA dengan senyawa Asam lemak eikosenoat dapat dianalisis dengan studi bioinformatika. Analisis tersebut menunjukkan adanya interaksi ikatan hidrogen polar dari inhibitor dengan residu asam amino Arg30, Thr41, dan Gly35. Kemungkinan interaksi lain juga terjadi antara inhibitor dengan residu asam amino Arg39 dan Thr69.
Saran
Saran-saran yang dapat disampaikan oleh penulis adalah:
a. Diperlukan analisis lebih lanjut tentang studi inhibisi dari enzim PtpA yang sudah dimurnikan dengan senyawa Asam lemak eikosenoat sebagai inhibitor.
b. Diperlukan analisis lebih lanjut tentang studi docking dari enzim PtpA dengan senyawa Asam lemak eikosenoat sebagai inhibitor.
DAFTAR PUSTAKA
Abdalla, A.E., Q. Li, L. Xie, dan X. Jianping.2015. Biology of IL-27 and its Role in the Host Immunity against Mycobacterium Tuberculosis.Int J Biol Sci. 11(2): 168–175
Bach, H., K.G. Pavavinasasundaram, D. Wong, Z. Hmama, dan Y. Av-Gay.2008.Mycobacterium tuberculosis Virulence Is Mediated by PtpA Dephosphorylation of Human Vacuolar Protein Sorting 33B.Cell Host Microbe. 3(5):316-22
Castillo, C.C., dan B. Song.2004.Dinamical Models of Tuberculosis and Their Aplication. Math. Biosci. and Eng. 361-404
Chang, R. 2004. Kimia Dasar Konsep-Konsep Inti Edisi Ketigaa Jilid 2. Jakarta : Erlangga.
Chiaradia, L.D., A. Mascarello, M. Purificação, J. Vernal, M.N. Cordeiro, M.E. Zenteno, A. Villarino, R.J. Nunes, R.A. Yunes, dan H. Terenzi.2008.Synthetic chalcones as efficient inhibitors of Mycobacterium tuberculosis protein tyrosine phosphatase PtpA. Bioorganic & Medicinal Chemistry Letters 18: 6227–6230
Depkes RI.2010.Profil KesehatanIndonesia 2010.Jakarta : Kementrian Kesehatan RI.
Gresham, H.D., B.M. Dale, J.W. Potter, P.W. Chang, C.M. Vines, C.A. Lowell, C.F. Lagenaur, dan C.L. Willman.2000. Negative Regulation of Phagocytosis in Murine Macrophages by the Src Kinase Family Member, Fgr.J Exp Med.191(3): 515–528
Jaji.2012.Upaya Keluarga dalam Pencegahan Penularan Tuberkulosis (Tb) Paru ke Anggota Keluarga Lainnya Di Wilayah Kerja Puskesmas Sidorejo Pagaralam Tahun 2010.Palembang : Universitas Sriwijaya.
Jalili, V., M. Matteuci, M. Masseroli, dan M.J. Morelli.2015.Using combined evidence from replicates to evaluate ChIP-seq peaks.Bioinformatics.31 (17): 2761-2769
Kim, Y.J., K.J. Kyung, J.H. Lee, dan H.Y. Chung.2004.“4-4’-Dihydroxybiphenyl as a New Potent Tyrosinase Inhibitor”. J. Biol. Pharm. Bull. 28 (2) 323-327
Kotz, J.C. 2006. Chemistry and Chemical Reactivity. Canada: Thomson Learning Academic Resource Center.
Krupakaran, P.R., dan S. Arunkumar.2014.Sds-Page Analysis of Serum Proteins In Giriraja Fowl.India : Veterinary College and Research Institute.
Laemmli, U.K.1970.Cleavage of Structural Protein During The Assembly of The Head of Bacteriophage: Nature (227) 680-685
Meena. L.S., dan Rajni.2010. Survival Mechanisms of Pathogenic Mycobacterium tuberculosis H37Rv. FEBS Journal 277, 2416–2427.
Mascarello, A., L.D. Chiaradia, J. Vernal, A. Villarino, R.V.C. Guido, P. Perizzolo, V. Poirier, D. Wong, P.G.A. Martins, R.J. Nunes, R.A. Yunes, A.D. Andricopulo, Y. Av-Gay, dan H. Terenzi.2010.Inhibition of Mycobacterium tuberculosis Tyrosine Phosphatase PtpA by syinthetic chalcones: kinetics, molecular modeling, toxicity, and effect on growth. Bioorg Med Chem 18: 3783-3789
Mascarello, A., M. Mori, L.D. Chiaradia-Delatorre, A.C.O. Menegatti, F.D. Monache, F. Ferrari, R.A. Yunes, R.J. Nunes, H. Terenzi, B. Botta, dan M. Botta.2013.Discovery of Mycobacterium tuberculosis Protein Tyrosine Phosphatase B (PtpB) Inhibitors from Natural Products. PLoS ONE 8(10): e77081
Matthews, J.A., S.O. Dahl, A. Nesje, M.S. Berrisford, dan C.A. Dahl.2000. Holocene glacier variations in central Jotunheimen, southern Norway based on distal glaciolacustrine sediment cores*1. Quaternary Science Reviews 19(16): 1625-1647
Menzies, D., H.A. Jahdali, dan B.A. Otaibi.2010.Recent developments in treatment of latent tuberculosis infection.Indian J Med Res 133, pp 257-266
Murray, R.K., D.K. Granner, dan V.W. Rodwell.2006. Biokimia Harper edisi 27. Jakarta: EGC.
Nester, E.W.2001. Microbiology: A Human Perspective 3rd edition. New York: McGraw Hill.
Ngili, Y.2008.Biokimia: Struktur & Fungsi Biomolekul. Bandung: Graha Ilmu.
Noble, J.E., dan M.J.A Bailey.2009.Quantitation of Protein dalam Guide to Protein Purification, 2nd Edition.USA: Academic Press.
Pant, M., T.K. Nailwal, L.M. Tewari, S. Kumar, P. Kumari, H. Kholia, dan G. Tewari.2007.Molecular Characterization of Valeriana Species with PCR, RAPD and SDS PAGE.India : Kumaun University.
Poedjiadi, A. 2012. Dasar-Dasar Biokimia.Jakarta : UI-Press.
Rinaldhi, R.2012. Uji in Silico Turunan Senyawa 1,3 Dibenzoiltiourea pada Reseptor yang Bekerja sebagai Anti Tuberculosis.Tasikmalaya: STIKES BTH.
Savalas, L.R.T., A. Nurunnisa, dan H. Mulyasari.2013.Konstruksi dan Ekspresi Protein Tirosin Fosfatase A (PtpA) dari Mycobacterium tuberculosis. RD-2013-1343: 2
Scopes, R.K.1994.Protein Purification: Principles and Practice. New York: Springer Verlag, New York.
Silva, R.A., M.V. Palladino, R.P. Cavalheiro, D. Machado, B.L. Cruz, E.J. Paredes-Gamero, M.C. Gomes-Marcondes, W.F. Zambuzzi, L. Vasques, H.B. Nader, A.C. Souza, dan G.Z. Justo.2015.Activation of the Low Molecular Weight Protein Tyrosine Phosphatase in Keratinocytes Exposed to Hyperosmotic Stress.PLoS One.10(3):e0119020
Sukardi.1994.Metodologi Penelitian.Jakarta: Balai Pustaka.
Sukma, L.N., Zackiyah, dan G.G. Gumilar.2010.Pengkayaan Asam Lemak Tak Jenuh pada Bekatul dengan Cara Fermentasi Padat mengggubakan Aspergillus terreus.Bandung : Universitas Pendidikan Indonesia.
Sylvia, A.P., dan L.Mc.C. Wilson.2005.Patofisiologi Konsep Klinik Proses-Proses Penyakit.Buku 2 Edisi4. Jakarta : EGC.
Trott, O., dan A.J. Olson.2010. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization and multithreading. J Comput Chem.31(2): 455–461
Williams, B.G., dan C. Dye.2010. The population and control of tuberculosis. Science 328:856-861