i
TESIS
Disusun untuk memenuhi sebagian persyaratan mencapai derajat Magister Program Studi Teknik Kima
Oleh :
WINDHU GRIYASTI SUCI
S071608001
PROGRAM STUDI MAGISTER TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS SEBELAS MARET SURAKARTA
I00s0911,0i
ffi
'n,t1.stsEL{BI{ gr oz -fi qiifo% {'a$6tfems
-rqeFlq Eue.{
ryurepe4u rsryt?s uapedzpuaur ?rpas$q e.{es eleru 1ut rsr4qqnd uengepl r.lep uu:u88uqad uqquleur e,{€s ellqudy 'e,{ursnlr1sur
teEcqas
SNft
sdd rrep rottt?tn pBeqestolouo:d r.uq
uelepe.{ueu, sffBq qe:uqi um-roJ nep ieumf eped srs*; rs] Eur{rrmlasa{ l}E}E uel8eqas Isery}qrtd -Z'n{BIr3q
8ue,{ $e8uuprn-Suupunrad ueNrprad uu8ssp runsas scsctdrp slras $e{F}uqlp
e,tus ralslEeur -re;aE egasaq s1seJ
{ieq
'rsBues au$;ou}r$ erpasraq e,{es sX€aI 'lsBIBEd rr?$Er-msErr pdup:*1 uary11qqlp $dep F{ qs+1qqscs E}qep }p eledrual uupqedy'slie$&d ressp u€p ue8trem>1 qe{suu rselep 4req'e.(maqruns $s{}nqas{p Ese,{ {re$3s saEuap qlsiral EseA qserc{'sr-€{ E*e.ro qa{o us+{qralrpftElu sgn+Ip qe*ad 8ue.,! ludepaed nele r.&e1 pduptsr {spJ} s1:ss Iltrr}pBTB
.r*i*3 qa;o:adrxaw Inlurr um; Stru+ qa;* *e4nferp qru.red Eut{ qeu*11 e{:eq
ledep:e1{Bpp nep lrlpu}s e,ies ue4}}au+de.t:e{ qe{epe rur '.J{-xx?aorg tslnpl}rd
wcp(
rsr,r[5 rpa$ua g ap**o{ssoA1o d #t?q
t{;} r$ts srp)fogotg ueryr**<?Eu*;r6afi$*?.t?:] sr:t-{*i{}.&q;}Jt}S
IaS
rs€lfr4+lJ}prils,,
:prpnl-req B1;edsls*3 .l
:Er&qzq e*:m:aq-:w*qas ueEx*p r:eqelri*etx e,{eg
g Eurqruiqum6 : pE{ue;
Isseles ueqeP,{mg
'Iesolas uappdr4p $dep {n}un
'J'IAtr''J'S'ouo8rul41'rg : l Eurqrurqruag
8I0Z pW g1 : nuEurqnnqued repru p3Eueg
Iouslaolfi l$[npord rrrBIB(I rsB{IIlporrrreJ aguoy{tcotyod
rfu$
qrnts
rrslrulogorg ur4pun88usptraoasnara) sactutototlccos IeS rseln{olC 1pn1s : r00809rt0 s : lcng psa(lrq nqpurl11 :
SISSJ, ISYI1NSNOX UYgWgT
slsel Inpnf I^IIN BEIBN
IIe>{ 8 4e,(treqes l"tururtr Eqqulqued Surseur-8ursuu ue8uap rsu{nsuo>l t{Blumf
.
r
/
v
g
.
\,ll1ol2>1 ul2+nlplrlbrtuasuol
uunluau1.
louqa
JDpD{ rCn ltsur,l .r"5n) st6lotd
uoi,rur4o1a,\ rCP apola|r{
sullPlc4-rn) 1C6
rrDJluasuo)t uoP hl{U at
12 qP.rlDA r,l En y.laurzl r,ru1",1o1l
uDlnrgl
.rtl)rlua.Suo),I Uunluauad +u\o oqo) 1Cn
11:o\
)sn{stQuD.q.{auaa lD\D Dqot rCp
uo\uq
uof
+D\, 6D\\hsuo) rJro1{.1aual }palzru lsnlir 0B'r
/
6/s
gtl
t/
1t
gr/r/11
0r
/t
/t
Br/roll
gt)
e/ai
0l i lo,/sZ
Bu
rol{l
gr J 1a/11 $r ilolor
'g
al's
a ,? 5 v 'e t,.I
'}e)
II'q(nad I'q{rt3d lsBunsuo){ leEEuul 'oNvi
Mujtahid Kaavessina, S.T., M. T., Ph.D Dinyatakan selesai
Tanggal :
Pemb~bing II
• Jumlah konsultasi dengan masing-masing pembimbing minimal sebanyak 8 kali untuk dapat dinyatakan selesai.
No. Tanggal Konsultasi Paraf Ket.
Pemb. I Pemb. II
II.zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA~~I '31 \G Q\S\<'\..1. c;i ~e('co\7aa(\ ko.ol\n. ~ \'l .zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA2 1 f3 (\S T\Jrlo\c\i~as \..a.rutQn ko.oun.
/L
l~ . C;f-lfl~ O\C;ku~i ~o'c::Q.o.(\ t\o~utas; r-S('..\0.<2.I."Y(\ VZOlro\::o.~
~ \,i~14. \o/~(18
Merod.e
FermeCltQSt d~pe\'\\'n3\~ tC i.lf\ \--on~ e~ ® I'> \-zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA ~ l
}{
\~. 1 6 /4 fIB U J\' d\..l\C\.bi\'\~a.~ ~~L
lc.. ~1{4 (ICO ~!(\e(\\\.{_Qt"\
e t\~e n s
I~
pa--menta.
'b "\1 . 3/!? f\& L C \? ,ra n ~ Q 'o 1
lB. 9
rs
{Iel~?ot
Q ~~b
~ .
~ ~
l~ .
-,0/>
(\8 \....apora:(\tbab
51 .
Menggunakan Bioflokulan Starch Graft Polyacrylamide
Termodifikasi Dalam Produksi Bioetanol Tanggal mulai pembimbingan: 18 Mei 2018
Pembimbing I : Dr. Margono, S.T., M.T.
v ii
Mujtahid Kaavessina, S.T., M.T., Ph.D Dinyatakan selesai
Tang'gal:zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBAI$ "-l(-zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA20(i Pembimbing II
• Jumlah konsultasi dengan masing-masing pembimbing minimal sebanyak 8 kali untuk dapat dinyatakan selesai.
No. Tanggal Konsultasi Paraf Ket.
P~b.I Pemb. II
;to. 41 b /l~
\..o.?orun
bOlo\.y.
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA~ {
.."rb [1 8 .
-It· (2.eVi<;1 '60..\0 t\)~ .
f i
,no
l?"( G [[8 Rev\si (;'b f i'f:. cion 1o.Wt . ~ ;(~~ D!re
(d) Pern\Qo.nasa.n ~ect~a tq n~
f\o \<:'u\uC;\·
:l. C \. ')?J((P ((8 \...Gtf<',an ~a~ ~ .
~ ~ . ?,o(frJ(18 Re.v(s,· 'oo\?
"
-~r;,. . ")_/1[\?'
Abstral
2+ .
filr(t9La.m?
ira.
\"1~ \
2 8 C jIt ( It\
~e(\u~?
5Z
.25 . \":; / 1-t.
8\..a.?o,an
to t-C t l~ ~
30,
n'{1-(lS
ACe
't
t
Menggunakan Bioflokulan Starch Graft Polyacrylamide Termodifikasi Dalam Produksi Bioetanol
Tanggal mulai pembimbingan : 18 Mei 2018 Pembimbing I : Dr. Margono, S.T., M.T.
viii
judul “Studi Flokulasi Sel Saccharomyces cereviseae Menggunakan Bioflokulan
Starch Graft Polyacrylamide Termodifikasi Dalam Produksi Bioetanol”. Dalam penyusunan Tesis ini penulis memperoleh banyak bantuan baik berupa dukungan moral maupun material dari berbagai pihak. Oleh karena itu sudah sepantasnya penulis mengucapkan terima kasih kepada :
1. Inayati, S.T., M.T., Ph.D., selaku Kepala Program Studi Magister Teknik Kimia FT UNS dan pembimbing akademik.
2. Dr. Margono, S.T., M.T., selaku dosen pembimbing utama penelitian dan tesis.
3. Mujtahid Kaavessina, S.T., M.T., Ph.D selaku dosen pembimbing pendamping penelitian dan tesis.
4. Suami, anak-anakku, dan keluarga tercinta yang selalu memberi semangat dan
do’a.
5. Tim penelitian flokulasi dan fermentasi 2018 (Hasan, Clarissa, Ratna, dan Febian) yang telah membantu pelaksanaan penelitian.
6. Segenap sivitas akademika Teknik Kimia FT UNS yang tidak dapat disebutkan satu persatu.
Akhir kata penulis mengucapkan semoga tesis ini dapat bermanfaat bagi penulis dan pembaca sekalian. Apabila ada kesalahan dalam penyusunan tesis ini, penulis mohon maaf. Kritik dan saran membangun penulis harapkan demi perbaikan laporan yang akan datang.
Surakarta, Desember 2018
mahal. Upaya pengurangan biaya produksi dapat dilakukan melalui peningkatan produktivitas bioetanol. Salah satu upaya peningkatan produktivitas bioetanol adalah menggunakan metode imobilisasi sel.
Imobilisasi sel menjadi menarik karena telah diklaim dapat meningkatkan performa proses fermentasi. Metode imobilisasi menggunakan matriks padat telah banyak diteliti dan dikembangkan. Kelemahannya timbul masalah difusivitas substrat dan desorbsi produk. Penelitian ini bertujuan untuk mengembangkan kebaruan imobilisasi sel melalui proses flokulasi menggunakan flokulan
Polyacrylamide Grafted Starch (St-g-PAM). Performa dari St-g-PAM dalam menjaring sel pada medium molases dipelajari dengan variasi konsentrasi flokulan. Kemampuan sel untuk bertahan hidup didalam flok selama flokulasi dan adanya penambahan partikel impuritas (kaolin) juga diteliti. Efisiensi flok dalam proses fermentasi dipelajari menggunakan variasi konsentrasi sel. Kadar gula terkonsumsi dan kadar etanol menjadi parameter perhitungan yield dan produktivitas bioetanol. Penggunaan ulang sel terimobil juga dipelajari.
Sel Saccharomyces cereviseae 10%(w/v) dalam medium molases
diinkubasi dalam incubator shaker T 30oC dan 125 rpm selama 24 jam. Larutan flokulan St-g-PAM ditambahkan kedalam medium molases dengan variasi konsentrasi 10%, 20%, 30%, 40% (v/v). Proses flokulasi dijaga pada suhu 30oC selama 24 jam. Sel S. cerevisiae yang terjaring dalam flok terikut turun mengendap di dasar erlenmeyer. Flok berisi sel terjaring tersebut digunakan sebagai stater pada proses fermentasi. Hasil penambahan flokulan terbaik dari proses flokulasi digunakan pada fermentasi. Media produksi dibuat dengan pengenceran molases, sel hasil flokulasi ditambahkan ke media produksi. Inkubasi media produksi menggunakan incubator shaker dengan kecepatan 125 rpm dan suhu 30oC selama 24 jam.
Karakteristik proses flokulasi sel terbaik diperoleh saat penambahan flokulan 40%v/v dengan turbiditas 184 NTU. Hasil yang berbeda ketika flokulasi sel dengan penambahan impuritas turbiditasnya 275 NTU. Proses fermentasi terbaik diperoleh ketika konsentrasi flok 4x dengan yield mencapai 49,99% g/g dan produktivitasnya 4,46 g/L/jam. Pada percobaan pengujian ulang sel diperoleh yield tertinggi pada ulangan ke 2 yaitu mencapai 49,13% g/g, produktivitas 4,11 g/L/jam, dan efisiensinya 96,34%. Hal ini dapat disimpulkan bahwa St-g-PAM
dapat digunakan sebagai flokulan untuk mengimobilisasi S. cerevisiae. Imobilisasi sel melalui proses flokulasi mampu meningkatkan konsentrasi sel sehingga produktivitas bioetanol meningkat. Proses fermentasi dengan imobilisasi sel menggunakan St-g-PAM dapat digunakan berulang.
Keyword : energi alternatif, imobilisasi, flokulasi, fermentasi, sel S. cerevisiae
HALAMAN PENGESAHAN PENGUJI TESIS ... iii
PERNYATAAN KEASLIAN DAN PUBLIKASI ... iv
LEMBAR KONSULTASI ... v
KATA PENGANTAR ... viii
ABSTRAK ... ix
DAFTAR ISI ... x
DAFTAR GAMBAR ... xiii
DAFTAR TABEL ... xiv
DAFTAR SINGKATAN ... xv
BAB I PENDAHULUAN ... 1
I.1. Latar Belakang Masalah ... 1
I.2. Rumusan Masalah ... 2
I.3. Tujuan Penelitian ... 3
I.4. Manfaat... 3
BAB II LANDASAN TEORI ... 4
II.1. Tinjauan Pustaka ... 4
II.1.1. Teori Flokulasi ... 5
II 1.2. Klasifikasi Flokulan ... 7
II.1.3. Pengadukan Pada Proses Flokulasi ... 7
II.1.4. Molases ... 9
II.1.5. Starch GraftPolycrilamide ... 9
II.2. Kerangka berpikir ... 10
II.3. Hipotesa ... 12
BAB III METODE PENELITIAN ... 13
III.1. Tempat dan Waktu Penelitian ... 13
III.2. Alat dan Bahan Penelitian. ... 14
III.3. Tatalaksana Penelitian ... 14
III.3.3. Langkah Flokulasi ... 16
III.3.3.1. Pengaruh impuritas terhadap kecepatan flokulasi ... 16
III.3.3.1.1. Flokulasi Partikel Sel ... 16
III.3.3.1.2. Flokulasi Partikel Sel dengan penambahan impuritas (kaolin) .... 16
III.3.3.2. Pengaruh konsentrasi flokulan St-g-PAM ... 16
III.3.3.2.1. Flokulasi Partikel sel ... 16
III.3.3.2.2. Flokulasi Partikel Sel dengan penambahan impuritas (kaolin) .... 16
III.3.4. Langkah Fermentasi ... 17
III.3.4.1. Pengaruh Peningkatan Konsentrasi Sel ... 17
III.3.4.2. Uji Penggunaan Ulang Sel ... 17
III.3.5. Analisa Sampel ... 17
III.3.5.1. Analisa Kadar Gula (Metode Dubois) ... 17
III.3.5.2. Analisa Kadar Etanol ... 18
III.3.5.3. Analisa Jumlah Sel ... 18
III.3.5.4. Analisa Void Fraction... 18
BAB IV HASIL PENELITIAN DAN PEMBAHASAN ... 19
IV.1. Proses Flokulasi ... 19
IV.1.1 Pengaruh Impuritas Pada Kecepatan Flokulasi ... 19
IV.1.2. Pengaruh Konsentrasi Flokulan Terhadap Efisiensi Flokulasi ... 23
IV.1.3. Pengaruh Konsentrasi Flokulan Terhadap Void Fraction Flok ... 25
IV.1.4. Efektivitas Sel Terjaring Dalam Flok ... 26
IV.2.3. Uji Penggunaan Ulang Sel (Durabilitas Sel) ... 34
BAB V KESIMPULAN DAN SARAN ... 37
DAFTAR PUSTAKA ... xvi
LAMPIRAN ... xxi
pengikatan, (b) Polymer bridging antar partikel (c) Restabilisasi
pertikel ... 6
Gambar 2.2 Skema Mekanisme Netralisasi Muatan ... 7
Gambar 2.3. Proses Pembentukan Ikatan Flok... 8
Gambar 2.4. Tahap Inisiasi ... 9
Gambar 2.5. Tahap Propagasi ... 10
Gambar 2.6. Tahap Terminasi ... 10
Gambar 2.7 Ilustrasi sel terjaring oleh flokulan ... 11
Gambar 4.1 Profil turbiditas selama proses flokulasi menggunakan flokulan St-g-PAM 40%v/v ... 20
Gambar 4.2. Pengaruh konsentrasi flokulan terhadap turbiditas selama 24 jam ... 23
Gambar 4.3 Pengaruh flokulan terhadap void fraction selama 24 jam ... 26
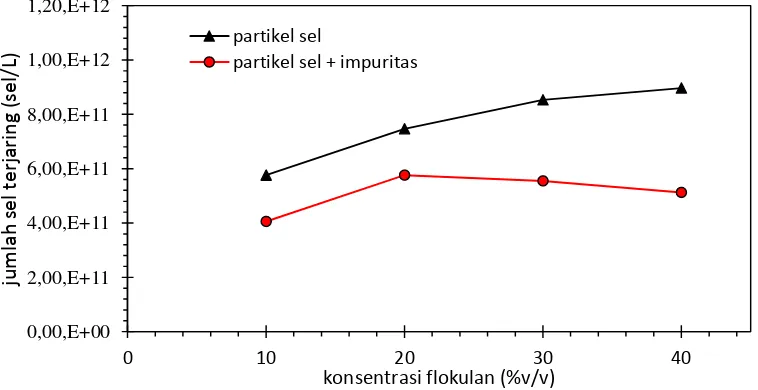
Gambar 4.4. Pengaruh konsentrasi flokulan terhadap jumlah sel terjaring ... 27
Gambar 4.5. Profil penambahan konsentrasi flokulan terhadap efektivitas sel terjaring... 28
Gambar 4.6. Profil kadar gula sisa selama fermentasi ... 29
Gambar 4.7. Profil kadar etanol selama fermentasi ... 30
Gambar 4.8. Pengaruh peningkatan konsentrasi sel terhadap yield selama fermentasi ... 31
Gambar 4.9. Profil kadar gula sisa selama fermentasi ... 35
Gambar 4.10. Profil kadar etanol selama waktu fermentasi 36 jam ... 35
Tabel 4.2. Nilai konstanta dari penurunan persamaan flokulasi ... 22
Tabel 4.3. Kecepatan flokulasi partikel... 24
Tabel 4.4. Efisiensi flokulasi ... 24
Tabel 4.5. Kecepatan konsumsi gula rata-rata selama 36 jam ... 30
Tabel 4.6. Produktivitas bioetanol menggunakan S. cereviseae variasi matrik 33
Tabel 4.7. Pengaruh peningkatan konsentrasi sel terhadap produktivitas etanol ... 33
Tabel 4.8. Pengaruh penggunaan ulang sel terhadap yield dan produktivitas selama fermentasi 36 jam ... 36
PG PVA TMEDA v/v w/v
: Pabrik Gula
: Polyvinyl Alcohol
: Tetramethylethylenediamine : volume/volume
: weight/volume
BAB I
PENDAHULUAN
I.1.Latar Belakang Masalah
Cadangan minyak bumi di Indonesia semakin menipis dan diperkirakan habis dalam jangka waktu 18 tahun lagi (Abimanyu dan Sunit, 2014), sementara konsumsi minyak bumi selalu meningkat seiring dengan pertumbuhan mesin transportasi maupun industri serta produk turunan lainnya. Oleh karena itu, pencarian sumber energi alternatif yang bersifat baru dan terbarukan sangat penting untuk dilakukan. Pemerintah telah membuat kebijakan energi nasional bahwa 17% total energi nasional pada tahun 2025 berasal dari sumber energi baru terbarukan (Peraturan Presiden RI No. 5 tahun 2006). Salah satu sumber energi baru terbarukan adalah bioetanol yang dapat digunakan sebagai campuran bensin. Peraturan Menteri ESDM No 12 Tahun 2015 menyatakan bahwa kewajiban minimal pemanfaatan bioetanol sebagai campuran BBM pada tahun 2020 sebesar 10% dan tahun 2025 sebesar 20% terhadap kebutuhan total. Kelebihan lain bioetanol adalah bahan baku mudah diperoleh dan lebih ramah lingkungan.
Pemanfaatan bioetanol sebagai sumber energi baru dan terbarukan belum maksimal disebabkan harga bioetanol belum dapat bersaing dengan energi konvensional berbasis minyak bumi, yaitu bensin. Biaya produksi bioetanol yang tinggi menjadi salah satu penyebab utama mahalnya harga bioetanol. Upaya pengurangan biaya produksi dapat dilakukan melalui peningkatan produktivitas proses fermentasinya. Berbagai penelitian menunjukkan bahwa peningkatan produktivitas dapat dilakukan dengan metode imobilisasi.
Beberapa matriks polimer yang biasa digunakan dalam imobilisasi sel adalah alginat, karagenan, dan polyacrylamide. Karakter imobilisasi sel dalam karagenan dan alginat memiliki kelemahan, yaitu bead karagenan atau alginat mengalami swelling (mengembang) selama proses fermentasi sehingga umurnya menjadi pendek. Selain itu imobilisasi sel dengan matrik padat ada hambatan pada proses difusivitas substrat maupun produk, sehingga diperlukan matrik pendukung
yang bersifat porous. Kelemahan lain proses imobilisasi menggunakan karagenan atau alginat memerlukan biaya yang cukup mahal.
Berdasarkan permasalahan tersebut maka perlu dicari teknik imobilisasi lain untuk sel S. cerevisiae. Metode yang digunakan harus dapat mengatasi masalah hambatan difusivitas dan biaya proses imobilisasi sel, dalam hal ini adalah metode flokulasi. Flokulan yang potensial digunakan adalah flokulan
starch graft polyacrilamide (St-g-PAM). Kelebihan flokulan ini adalah bahan bakunya murah dan ramah lingkungan karena akan terdegradasi oleh mikroorganisme lingkungan .
Proses flokulasi sel merupakan suatu kebaruan yang belum pernah diteliti sebelumnya. Flokulasi sel dipengaruhi adanya impuritas atau pengotor. Penelitian ini menggunakan bahan impuritas kaolin. Penambahan suspensi kaolin diharapkan dapat mempercepat flokulasi sehingga proses imobilisasi sel bisa berjalan lebih efektif.
Penelitian ini bertujuan untuk mempelajari proses flokulasi sel S. cerevisiae menggunakan flokulan St-g-PAM dan penggunaannya pada proses fermentasi bioetanol. Variabel yang dipelajari yaitu konsentrasi flokulan, dan peningkatan konsentrasi sel dalam stater.
I.2. Rumusan Masalah
Berdasarkan uraian latar belakang tersebut maka dapat disimpulkan masalah penelitian sebagai berikut:
a. Adakah perbedaan pengaruh penambahan impuritas terhadap flokulasi sel S. cerevisiae?
b. Bagaimana kinerja bioflokulan St-g-PAM ketika digunakan untuk imobilisasi sel S. cerevisiae?
c. Bagaimana pengaruh jumlah flok (sel S. cerevisiae terimobilisasi) terhadap produktivitas bioetanol?
I.3. Tujuan Penelitian
a. Mendapatkan konsentrasi flokulan terbaik sehingga diperoleh efisiensi fermentasi paling baik.
b. Mengetahui kinerja bioflokulan St-g-PAM ketika digunakan sebagai flokulan pada proses imobilisasi sel S. cerevisiae.
c. Mendapatkan pengaruh jumlah flok (sel S.cerevisiae terimobilisasi) terhadap produktivitas bioetanol.
d. Mendapatkan jumlah penggunaan ulang flok-flok sel S. cerevisiae pada medium baru secara tepat.
I.4. Manfaat Penelitian
Keberhasilan penelitian ini akan mempunyai manfaat / dampak antara lain: 1. Bagi Masyarakat
Metode imobilisasi sel dengan teknik flokulasi yang sederhana serta bahan baku yang mudah diperoleh diharapkan dapat dimanfaatkan/ diaplikasikan oleh masyarakat sehingga dapat meningkatkan produktivitas pada proses produksi bioetanol dan keuntungan produsen bioetanol.
2. Bagi IPTEK
BAB II
LANDASAN TEORI
II.1. TINJAUAN PUSTAKA
Produksi bioetanol secara fermentasi umumnya menggunakan sel mikroba bebas dalam batch fermentor dan continuous fermentor. Masalah-masalah yang timbul dengan menggunakan teknik sel mikroba bebas antara lain produktivitas bioetanol dan nilai konversi substrat menjadi bioetanol yang tinggi sulit diperoleh. Usaha untuk meningkatkan nilai tersebut telah dilakukan oleh beberapa peneliti, misalnya dengan menggunakan cell recycle system. Namun, masalah lain timbul yaitu pada flow rate yang tinggi banyak mikroba yang lolos (Jain et al., 1985). Produktivitas yang tinggi dapat dicapai antara lain dengan memperbanyak jumlah sel mikroba penghasil bioetanol (Luong, 1985), dan salah satu cara yaitu dengan mengimmobilisasi sel tersebut. Immobilisasi sel telah banyak dicoba dengan menggunakan beberapa macam matrik, seperti Rakin et al., (2009) melakukan studi perbandingan antara produksi etanol oleh yeast terimobilisasi pada Ca-alginat dengan yeast terimobilisasi pada polyvinyl alcohol (PVA), menggunakan substrat hidrolisat pati jagung dengan kadar total gula awal sebesar 176 g/L. Hasil penggunaan yeast terimobilisasi pada Ca-alginat mencapai konsentrasi 10,1% (v/v), sedangkan penggunaan yeast terimobilisasi PVA menghasilkan konsentrasi 7,2% (v/v). Penggunaan Ca-alginat pada penelitian tersebut memiliki kelemahan, yaitu mengalami degradasi pada siklus repeated-batch ke-2.
Pacheco et al., (2010) meneliti penggunaan bagas jambu mete sebagai pengimobilisasi sel S. cerevisiae dalam produksi etanol secara repeated-batch.
Treatment yang diberikan terhadap bahan tersebut sebelum digunakan adalah perendaman dalam HCl 3% selama 2,5 jam disertai pengadukan secara konstan dan dilanjutkan dengan delignifikasi menggunakan NaOH 2%. Konsentrasi bioetanol yang dihasilkan rata-rata sebesar 19,82-37,83 g/L dengan konversi 44,80%-96,50% serta efisiensi sebesar 85,30-98,52%. Hasil penelitian tersebut menunjukkan bahwa bagas jambu mete merupakan penyangga yang efisien untuk imobilisasi sel dalam memproduksi etanol.
Bangkrak et al., (2011) mengimobil yeast menggunakan kombinasi spons dengan alginat dalam produksi etanol secara kontinyu. Substrat gula palma dengan konsentrasi awal sebesar 220 g/L serta laju 0,2h-1, diperoleh produktivitas etanol sebesar 11,5 g L-1 h-1 dan konsentrasi etanol 57,4 g/L. Perlakuan pada laju berbeda (0,11 h-1), mampu menghasilkan etanol dengan konsentrasi lebih tinggi, yaitu 82,1 g/L. Akan tetapi, produktivitas yang dihasilkan lebih rendah, yaitu 9,0 g L-1h-1.
Eiadpum et al., (2012) meneliti produksi etanol oleh sel terimobilisasi menggunakan co-kultur Kluyveromyces marxianus dan Saccharomyces cerevisiae. Bahan pengimobilisasi adalah matriks loofa-alginat dan kepompong ulat sutera. Substrat yang digunakan ekstrak tebu dan molases berkonsentrasi total gula sebesar 220 g/L, diperoleh etanol dengan konsentrasi masing-masing 81,4 g/L dan 77,3 g/L. Konsentrasi etanol yang dihasilkan ini masing-masing lebih tinggi 5,9-8,7% dan 16,8-39,0% dibandingkan dengan menggunakan free cells.
Suci et al., (2018) melakukan percobaan imobilisasi sel menggunakan metode flokulasi. Hasil yang diperoleh produktivitas sel meningkat 3,6 kali dibandingkan free cell. Jenis flokulan yang digunakan pada penelitian tersebut adalah bioflokulan St-g-PAM. Kinerja bioflokulan St-g-PAM telah diteliti oleh Kaavessina et al., (2017) dimana ketika digunakan pada penjernihan air mampu memflokulasi kotoran dan terbukti tidak mempengaruhi tingkat keasaman air.
II.1.1.Teori flokulasi
Flokulasi adalah penggabungan inti flok yang berukuran kecil menjadi flok yang berukuran lebih besar yang memungkinkan partikel-partikelnya dapat mengendap dengan penambahan flokulan (Yang et al., 2012). Mekanisme flokulasi ada tiga macam, antara lain :
(i) Mekanisme Bridging
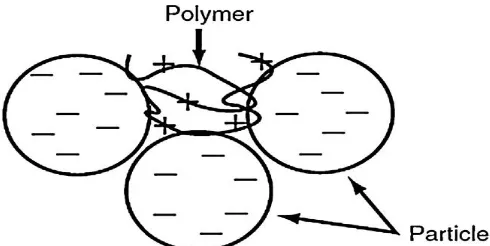
dan interaksi antar polimer dengan partikel lain, sehingga menciptakan
bridging antar partikel seperti yang ditunjukkan dalam Gambar. 2.1 (b) (Biggs et al., 2000; Blanco et al., 2002; Lee et al., 2012).
Mekanisme bridging efektif terjadi jika rantai polimer dapat menjangkau permukaan partikel yang lain. Selain itu, harus ada permukaan kosong pada partikel untuk membentuk bridging dengan partikel lainnya. Oleh karena itu jumlah polimer tidak boleh berlebihan. Permukaan partikel dipenuhi dengan polimer tidak ada tempat untuk 'menjembatani' dengan partikel lain, partikel dikatakan restabil (Sher et al., 2013) seperti ditunjukkan pada Gambar 2.1. (c).
Gambar 2.1. (a) Adsorpsi polimer dan pembentukan loop yang tersedia untuk pengikatan. (b) Polymer bridging antar partikel. (c) Restabilisasi partikel
(Sharma et al., 2006).
(ii) Netralisasi Muatan
Gambar 2.2. Skema mekanisme netralisasi muatan
(iii) Mekanisme Network
Pada model ini larutan polimer diasumsikan membentuk “network”
melalui ikatan hidrogen, ikatan van der walls, atau ikatan lainnya. Partikel tersuspensi dapat distabilkan oleh flokulasi dengan menambahkan polimer yang mempunyai berat molekul tinggi.
II.1.2. Klasifikasi Flokulan
Flokulan dapat diklasifikasikan menjadi dua kategori yaitu organik dan inorganik. Flokulan inorganik yang biasa digunakan adalah garam dari logam multivalent seperti alumunium dan besi (Joe et al., 2007). Flokulan organik dibedakan menjadi dua yaitu sintetik dan alami. Flokulan sintetik dapat dibedakan menjadi kationik, anionik, dan nonionik. Menurut gugusnya, flokulan polimer ada dua macam yaitu flokulan homopolimer dan flokulan kopolimer. Flokulan homopolimer adalah polimer yang hanya mempunyai satu jenis gugus fungsi. Flokulan kopolimer memiliki gugus fungsi lebih dari satu baik gugus ionik maupun nonionik dan memiliki karakteristik lebih baik daripada homopolimer sebagai flokulan. Flokulan alami yang banyak digunakan antara lain pati, selulosa, asam alginat, dan getah karet.
II.1.3. Pengadukan Pada Proses Flokulasi
kecil menjadi flok besar terjadi karena adanya tumbukan antar flok sehingga terbentuk ikatan atau jaringan (Gambar 2.3). Tumbukan ini terjadi akibat adanya pengadukan lambat (slow mixing) pada saat proses flokulasi berlangsung (O.P.Sahu, 2013).
Gambar 2.3. Proses pembentukan ikatan flok
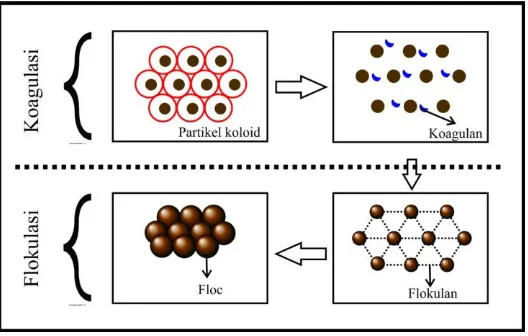
Koagulasi adalah proses penambahan zat kimia (koagulan) yang memiliki kemampuan untuk menjadikan partikel koloid tidak stabil menjadi partikel-partikel kecil stabil sehingga siap membentuk flok. Flokulasi adalah proses pembentukan dan penggabungan flok dari partikel-partikel kecil menjadi lebih besar sehingga mudah mengendap(Wagiman, 2014)
.
II.1.4. Molases
Molases merupakan produk samping dari industri pengolahan gula tebu atau gula bit yang masih mengandung gula dan asam-asam organik (Sebayang, 2006). Molases hasil dari industri gula tebu di Indonesia dikenal dengan nama tetes tebu. Kandungan sukrosa dalam molases cukup tinggi lihat tabel 2.1 sehingga dapat digunakan sebagai sumber bahan baku yang baik untuk pembuatan etanol. Molases berbentuk cairan kental berwarna cokelat. Molases dapat digunakan sebagai bahan baku alkohol, pembentuk asam sitrat, MSG, dan gasohol.
Tabel 2.1. Komposisi Molases (Sulistyaningrum, 2007)
No Komposisi Tetes tebu (%) Beet molases (%)
1. Bahan kering 78 - 85 77-84
2. Sukrosa 48,5 33,4
3. Gula invert 1,0 21,2
4. N 0,2-2,8 0,4-1,5
5. C 28 -34 28-33
6. P2O5 0,02-0,07 0,76-2
7. MgO 0,01-0,1 0,03-0,1
8. CaO 0,15-0,7 0,1-1
II.1.5. Starch Graft Polyacrylamide (St-g-PAM)
St-g-PAM adalah flokulan yang dibuat dari proses polimerisasi acrylamide
menjadi polyacrylamide kemudian di graft dengan starch (modified cassava) dengan konsentrasi tertentu. St-g-PAM mempunyai kelebihan mudah dibuat,
usefull, dan tidak mempengaruhi keasaman pada medium. Mekanisme
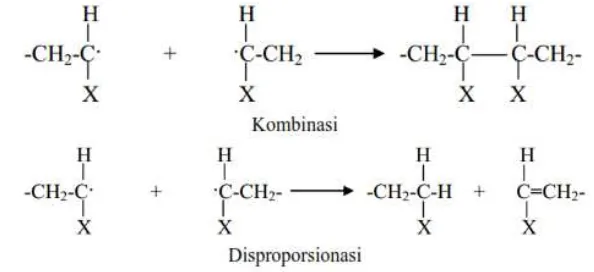
polimerisasi dengan radikal bebas menurut Nicholson (1991) meliputi tahap inisiasi, propagasi dan terminasi/disproporsionasi. Mekanisme tersebut dijelaskan sebagai berikut:
Inisiasi, adalah tahap pembentukkan fragmen yang bersifat radikal bebas. Tahap inisiasi dapat digambarkan sebagai berikut:
Propagasi, adalah penumbuhan rantai cabang pada fragmen radikal bebas yang terbentuk pada tahap inisiasi. Tahap propagasi dapat digambarkan sebagai berikut:
Gambar 2.5. Tahap Propagasi
Terminasi adalah penghentian proses propagasi. Terminasi dibedakan menjadi dua, yaitu kombinasi dan disproporsionasi. Tahap terminasi dapat digambarkan sebagai berikut:
Gambar 2.6. Tahap Terminasi
II.2. Kerangka Berpikir
Proses produksi bioetanol mengalami perkembangan, pada saat ini ada dua teknologi secara batch dan continous. Pada teknologi batch dan sel yang digunakan dalam keadaan bebas memiliki kelemahan yaitu konsentrasi pertumbuhan sel terbatas sehingga produktivitasnya rendah. Penelitian ini difokuskan pada proses peningkatan produktivitas bioethanol salah satunya menggunakan metode imobilisasi.
digunakan justru dapat menghambat difusivitas dan produktivitas substrat serta produk, sehingga dirasa metode ini kurang efektif.
Penelitian ini akan menggunakan metode imobilisasi sel S. cerevisiae
dengan teknik flokulasi yang diharapkan dapat meningkatkan konsentrasi sel sehingga produktivitas akan meningkat. Proses flokulasi menggunakan bahan flokulan yang termodifikasi dengan bahan berpati sehingga ramah lingkungan.
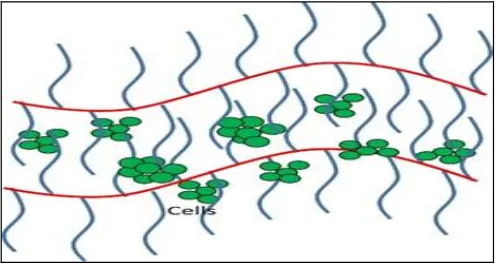
Bioflokulan St-g-PAM merupakan polimer dengan berat molekul tinggi sehingga dapat membentuk “network” melalui ikatan hidrogen, ikatan van der walls, atau ikatan lainnya. Sel S. cerevisiae yang tersuspensi di dalam medium akan terikut turun dalam jaring-jaring hasil mekanisme networking. Kondisi akan berbeda apabila pada medium ditambahkan partikel lain (impuritas). Bioflokulan St-g-PAM yang mempunyai gugus reaktif yaitu gugus amida akan mengikat/menyerang salah satu atau lebih sisi partikel dari impuritas sehingga akan terjadi mekanisme bridging. Kondisi sel terjaring dalam flok dapat dilihat pada ilustrasi Gambar 2.7.
Gambar 2.7. Ilustrasi sel terjaring oleh flokulan
Gambar 2.7. menunjukkan keberadaan sel dalam jaring-jaring flok (terimobilisasi) namun masih dapat bergerak bebas dan tidak ada hambatan difusivitas substrat maupun desorpsi produk. Flok yang terbentuk semakin lama akan bertambah besar sehingga bersama sel akan turun dan mengendap dibagian bawah.
memastikan tidak ada masalah timbul akibat bahan baku selama fermentasi. Metode flokulasi ini menggunakan bioflokulan poliacrylamide termodifikasi yang dipolimerisasi dari acrylamide.
II.3. Hipotesis
BAB III
METODE PENELITIAN
III.1. Tempat dan Waktu Penelitian III.1.1. Tempat Penelitian
Penelitian dilakukan di Laboratorium Proses Teknik Kimia UNS
III.1.2. Waktu Penelitian
No Jenis Kegiatan Bulan
Jun Jul Agt Sep Okt Nov Des Jan Feb Mar Apr Mei Jun Jul 1 Persiapan
penelitian 2 Percobaan
pendahuluan 3 Pengambilan
data
pendahuluan 4 Analisis data pendahuluan 5 Penulisan
Publikasi ilmiah I 6 Seminar
internasional (Publikasi ilmiah I) 7 Pengambilan
data penelitian 8 Analisis data
penelitian 9 Seminar
Kemajuan riset 10 Penulisan
Publikasi ilmiah II
11 Seminar hasil penelitian 12 Penulisan tesis
III.2. Alat dan Bahan Penelitian III.2.1. Alat
1. Incubator Shaker
2. Erlenmeyer 3. Gelas beaker 4. Klem dan statif
5. Magnetic stirer
6. Termometer 7. Labu leher tiga
8. Condenser
9. Neraca digital 10.Gelas ukur 11.Pendingin bola
12.Oven 13.Pipet tetes 14.Pipet volume 15.Autoclave
16.Corong kaca 17.Spektrofotometer 18.Turbidity meter 19.Mikroskop
20.Hemaecytometer
21.Kompor listrik 22.Piknometer
III.2.2. Bahan
1. Molases 2. Aquadest
3. Yeast kering (fermiol)
4. Yeast extrak
5. Glukosa 6. NH4Cl
7. MgSO4.7H2O 8. KH2PO4 9. CaCl2.2H2O 10.Phenol
11.H2SO4 12.Etanol
13.Starch graft polyacrylamide (St-g-PAM)
14.Kaolin 15.Gas Nitrogen
III.3. Tatalaksana Penelitian III.3.1. Pembuatan starter III.3.1.1. Pembuatan stater 1
glukosa 20 g/L, MgSO4.7H2O 0,25 g/L, NH4Cl 1,3 g/L, CaCl2.2H2O 0,06 g/L, dilarutkan dalam 1L aquadest. Media tersebut disterilisasi pada autoclave suhu 121oC, selama 20 menit, kemudian didinginkan sampai suhu ruangan. Yeast kering (fermiol) sebanyak 10 gram dimasukkan ke dalam media stater 1 lalu diinkubasi selama 24 jam menggunakan incubator shaker pada suhu 30oC dan 125 rpm.
III.3.1.2. Pembuatan stater 2
Medium stater 2 untuk proses flokulasi sel dibuat dari molases 30 ml diencerkan dengan aquadest menjadi 90 ml lalu dimasukkan ke dalam erlenmeyer 250 ml. Sterilisasi medium pada autoclave suhu 121oC, selama 20 menit. Stater 1 sebanyak 10 ml ditambahkan ke medium, inkubasi dalam incubator shaker
kecepatan 125 rpm, suhu 30 oC selama 24 jam.
Medium stater 2 untuk proses flokulasi sel dengan penambahan impuritas dibuat dari molases 30 ml diencerkan dengan 60 ml larutan kaolin 1 g/L (turbiditas larutan kaolin 200-300 NTU). Sterilisasi medium tersebut pada
autoclave suhu 121oC, selama 20 menit. Stater 1 sebanyak 10 ml ditambahkan ke medium, inkubasi dalam incubator shaker kecepatan 125 rpm, suhu 30 oC selama 24 jam
III.3.2. Pembuatan larutan flokulan St-g-PAM
III.3.3. Langkah Flokulasi
III.3.3.1. Pengaruh impuritas terhadap kecepatan flokulasi III.3.3.1.1 Flokulasi partikel sel
Larutan flokulan St-g-PAM sebanyak 40%v/v ditambahkan ke dalam medium stater 2 kemudian dimasukkan incubator shaker selama 5 menit. Flokulasi pada suhu ruangan lalu turbiditas diukur pada jam ke 0, 2, 4, 6, 8, 10, dan 12 jam. Flokulasi sel dilanjutkan sampai 24 jam untuk uji stabilitas flokulan.
III.3.3.1.2. Flokulasi partikel sel dengan penambahan impuritas (kaolin)
Larutan flokulan St-g-PAM sebanyak 40%v/v ditambahkan ke dalam medium stater 2 yang mengandung impuritas kaolin kemudian dimasukkan
incubator shaker selama 5 menit. Flokulasi pada suhu ruangan lalu turbiditas diukur pada jam ke 0, 2, 4, 6, 8, 10, dan 12 jam. Flokulasi sel dilanjutkan sampai 24 jam untuk uji stabilitas flok.
III.3.3.2. Pengaruh konsentrasi flokulan St-g-PAM
III.3.3.2.1 Flokulasi partikel sel
Larutan flokulan St-g-PAM dengan variasi 0%v/v, 10%v/v, 20%v/v, 30%v/v, dan 40%v/v ditambahkan pada medium stater 2 kemudian dimasukkan
incubator shaker selama 5 menit. Flokulasi pada suhu ruangan lalu turbiditas. diukur pada jam ke 0 dan jam ke 24 menggunakan turbiditymeter. Bagian fitrat dipisahkan dengan endapan (sel yang sudah terflokulasi).
III.3.3.2.2. Flokulasi partikel sel dengan penambahan impuritas (kaolin)
III.3.4. Langkah Fermentasi
III.3.4.1. Pengaruh Peningkatan Konsentrasi Sel
Media produksi yang berisi molases 30%b/b sebanyak 100 ml disterilisasi menggunakan autoclave pada suhu 121oC, selama 20 menit. Sel hasil flokulasi (larutan flokulan 40%v/v) ditambahkan ke dalam media produksi dengan variasi penambahan 1x, 2x, 3x, dan 4x. Media produksi diinkubasi menggunakan
incubator shaker dengan kecepatan 125 rpm dan suhu 30oC selama 24 jam. Sampel diambil pada jam ke 12, 24, 36, dan 48 jam untuk dianalisa kadar gula, jumlah sel, dan kadar ethanol.
III.3.4.2. Uji Penggunaan Ulang Sel (Durabilitas Sel)
Media produksi yang berisi molases 30%b/b sebanyak 100 ml disterilisasi menggunakan autoclave pada suhu 121oC, selama 20 menit. Sel hasil flokulasi (larutan flokulan 40%v/v) dari 4 buah erlemeyer ditambahkan ke dalam 100 ml medium produksi. Media produksi diinkubasi menggunakan incubator shaker
dengan kecepatan 125 rpm dan suhu 30oC selama 36 jam. Sampel diambil pada jam ke-12, 24, dan 36 jam untuk analisa pengukuran kadar gula, jumlah sel, dan kadar ethanol. Media produksi dikeluarkan dari incubator shaker lalu endapkan selama 2 jam. Sel terjaring dipisahkan dengan filtrat lalu dimasukkan ke media poduksi yang baru. Ulangi langkah tersebut pada media produksi yang baru sampai sel tidak produktif.
III.3.5. Analisa Sampel
III.3.5.1. Analisa Kadar Gula (Metode Dubois)
diukur menggunakan spektrofotometer UV-vis dengan panjang gelombang 490 nm. Kadar gula dihitung menggunakan kurva standart.
III.3.5.2. Analisa Kadar Etanol
Sampel sebanyak 2,5 ml diencerkan 4x dengan aquadest. Sampel didistilasi sampai diperoleh distilat (±7ml). Distilat ditimbang menggunakan piknometer ukuran 5 ml dan hasilnya dibandingkan dengan tabel kadar etanol pada Perry's Chemical Engineers' Handbook edisi 8 tabel 2-110 hal 2-112.
III.3.5.3. Analisa Jumlah Sel
Lensa obyektif, lensa okuler, pengatur sinar pada mikroskop dan
haemacytometer dibersihkan dengan kain flanel atau tisu kering. Cover glass di pasang di atas haemacytometer, lalu ditambahkan 1 tetes sampel yang telah diencerkan menggunakan pipet melalui tepi cover glass dan di gesek sampai ada warna pelangi. Sel di hitung secara diagonal pada 5 kotak kecil yang ada dalam
haemacytometer.
III.3.5.4. Analisa Void Fraction
19
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
IV. 1. PROSES FLOKULASI
Mekanisme pembentukan flok dapat melalui mekanisme networking dan
bridging (Pal et al., 2011; Song et al., 2011; Yang et al., 2012a, 2013). Oleh karena itu, untuk mempelajari mekanisme mana yang sesuai dengan proses flokulasi sel S. cerevisiae maka medium molases disaring sehingga bersih dari partikel padatan dan dipastikan bahwa pada saat penambahan flokulan hanya ada partikel sel dalam broth. Percobaan lain adalah mempelajari proses flokulasi dengan menambahkan bahan pengotor (impuritas) ke dalam broth. Bahan impuritas yang digunakan adalah kaolin yang sebelumnya telah diuji pada proses flokulasi menggunakan flokulan St-g-PAM. Percobaan ini dimaksudkan untuk mempelajari efektivitas flokulan dan pengaruh impuritas terhadap proses flokulasi. Efektivitas flokulan diukur dengan parameter kecepatan flokulasi, stabilitas flok, dan ruang kosong (void fraction) flok. Selain itu juga dipelajari efektivitas flokulan dalam meng-imobilisasi sel S. cerevisiae.
IV.1.1 Pengaruh Impuritas pada Kecepatan Flokulasi
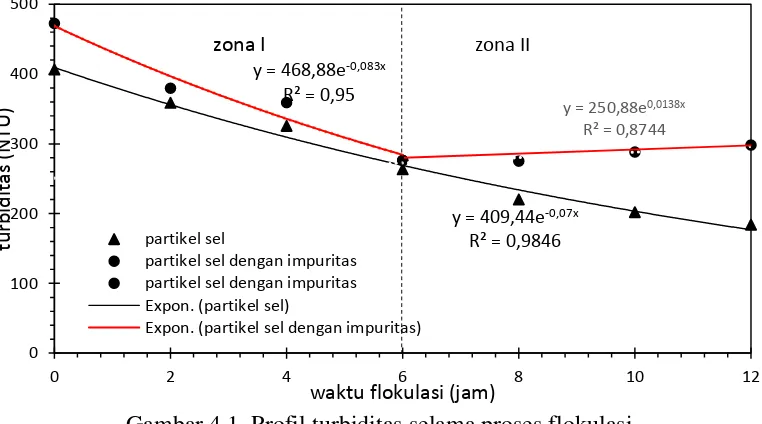
Pembentukan flok karena interaksi antara flokulan St-g-PAM dengan partikel padatan (sel) ditunjukkan oleh penurunan turbiditas dalam waktu tertentu. Pengaruh impuritas dipelajari pada konsentrasi flokulan St-g-PAM 40% v/v dan konsentrasi impuritas 1g/L. Profil turbiditas medium selama proses flokulasi ditunjukkan pada Gambar 4.1.
dibandingan penurunan di zona 1), sedangkan turbiditas partikel sel dengan impuritas justru mengalami kenaikan sebesar 22 NTU. Hal ini menunjukkan pada jam ke-6 merupakan titik balik, flok yang semula sudah terbentuk mulai rusak. Rusaknya flok diperkirakan akibat aktivitas metabolisme sel yang menghasilkan gas CO2. Akibat aktivitas tersebut menyebabkan ada tekanan gas yang mendorong flok sehingga sel terlepas ke medium dan meningkatkan turbiditas. Dari percobaan tersebut dapat disimpulkan bahwa impuritas lebih dominan terikut flok dibandingkan sel dan impuritas menghambat flokulasi sel.
Gambar 4.1. Profil turbiditas selama proses flokulasi menggunakan flokulan St-g-PAM 40% v/v
Penelitian terkait flokulasi dilakukan oleh Pal et al., (2011) menggunakan flokulan Polyacrylamide grafted carboxymethyl guar gum (CMG-g-PAM) pada media municipal sewage wastewater. Flokulan tersebut mampu menurunkan turbiditas dari 64 NTU menjadi 9 NTU. Flokulasi pada media municipal sewage wastewater juga diteliti oleh Bharti et al., (2013) dengan menggunakan flokulan
Polyacrylamide grafted oatmeal (OAT-g-PAM). Turbiditas pada media tersebut awalnya 63 NTU turun menjadi 28 NTU. Hydroxypropyl methyl cellulose grafted with polyacrylamide (HPMC-g-PAM) digunakan sebagai flokulan pada media raw mine wastewater diperoleh turbiditas awal 386,5 NTU turun menjadi 25,3 NTU (Das et al.,2013).
y = 409,44e-0,07x
R² = 0,9846 y = 468,88e-0,083x
R² = 0,95
y = 250,88e0,0138x R² = 0,8744
0 100 200 300 400 500
0 2 4 6 8 10 12
turb
id
itas
(N
TU)
waktu flokulasi (jam)
partikel sel
partikel sel dengan impuritas partikel sel dengan impuritas Expon. (partikel sel)
Expon. (partikel sel dengan impuritas)
Hubungan antara percobaan flokulasi ini dengan penelitian sebelumnya antara lain jenis flokulan dan mediumnya. Jenis flokulan sama menggunakan bahan berbasis polyacrilamide akan tetapi ada modifikasi pada bahan yang dicangkokkan (grafted). Penelitian sebelumnya menggunakan carboxymethyl guar gum, oatmeal, hydroxypropyl methyl cellulose sedangkan penelitian ini menggunakan starch. Medium pada penelitian sebelumnya menggunakan air limbah sedangkan penelitian ini molases. Bahan yang diflokulasi berbeda jika penelitian sebelumnya yang di flokulasi adalah bahan pengotor, sedangkan penelitian ini microba sel S. cerevisiae. Kesimpulannya bahwa bioflokulan berbasis polyacrilamide selain dapat digunakan pada proses penjernihan air limbah juga dapat mengimobilisasi sel
S.cerevisiae
Proses penurunan turbiditas jika dilihat dari Grafik 4.1 dapat dinyatakan dalam persamaan kecepatan flokulasi yang didekati dengan persamaan empiris sebagai berikut:
𝜏 = 𝑎𝑒
−𝑏𝑥 ... ( 4.1 )dengan,
τ = turbiditas (NTU) x = waktu (jam) a & b = konstanta
Tabel 4.1. Konstanta nilai a dan b
Sistem partikel Zona I Zona II
a b a b
sel 409,44 0,07 409,44 0,07
sel dengan penambahan impuritas 468,88 0,083 250,88 -0,0138
Berdasarkan Tabel 4.1. dapat disusun persamaan flokulasi sel sebagai berikut :
τ
= 409,44𝑒−0,07𝑥 ( 4.2 )Percobaan flokulasi sel dengan penambahan impuritas diperoleh persamaan yang berbeda antara di zona I dan di zona II, yaitu :
zona I berlaku persamaan :
zona II berlaku persamaan :
τ
= 250,88𝑒0,0138𝑥 ( 4.4 )Kecepatan flokulasi adalah penurunan turbiditas tiap satu satuan waktu. Persamaan kecepatan flokulasi dapat diperoleh dari turunan persamaan (4.1) sehingga didapat persamaan sebagai berikut.
- 𝑑𝜏
𝑑𝑥
= −𝑏𝑎𝑒
−𝑏𝑥 ... ( 4.5 )Tabel 4.2. Nilai konstanta dari penurunan persamaan flokulasi
Sistem partikel Zona I Zona II
ba b ba b
sel 28,66 0,07 28,66 0,07
sel dengan penambahan impuritas 38,92 0,083 3,46 -0,0138
Berdasarkan Tabel 4.2. dapat disusun persamaan kecepatan flokulasi : Kecepatan flokulasi partikel sel
:
𝑑𝜏
𝑑𝑥 = 28,66𝑒−0,083𝑥 ( 4.6 )
Kecepatan flokulasi partikel sel dengan penambahan impuritas di zona I :
𝑑𝜏
𝑑𝑥 = 38,92𝑒−0,083𝑥 ( 4.7 )
Kecepatan flokulasi partikel sel dengan penambahan impuritas di zona II :
𝑑𝜏
𝑑𝑥 = −3,46𝑒0,0138𝑥 ( 4.8 )
Tabel 4.3. Kecepatan flokulasi partikel
Jam ke- Kecepatan flokulasi partikel (NTU/jam) sel sel dengan penambahan impuritas
4 21,66 26,83
8 16,37 -3,86
-3,86 NTU/jam. Penurunan kecepatan tersebut menunjukkan kinerja flokulan St-g-PAM mengalami hambatan akibat penambahan impuritas kaolin.
Flokulasi selama 24 jam juga diteliti untuk menentukan waktu maksimum flokulasi. Flokulasi partikel sel menurun dari 184 NTU (12 jam) menjadi 174 NTU (24 jam), sedangkan untuk flokulasi partikel sel dengan penambahan impuritas menurun dari 298 NTU (12 jam) menjadi 275 NTU (24 jam). Pernurunan turbiditas tersebut menunjukkan saat 24 jam proses flokulasi telah mencapai waktu maksimum sehingga untuk proses selanjutnya digunakan waktu flokulasi selama 24 jam.
IV.1.2. Pengaruh Konsentrasi Flokulan Terhadap Efisiensi Flokulasi
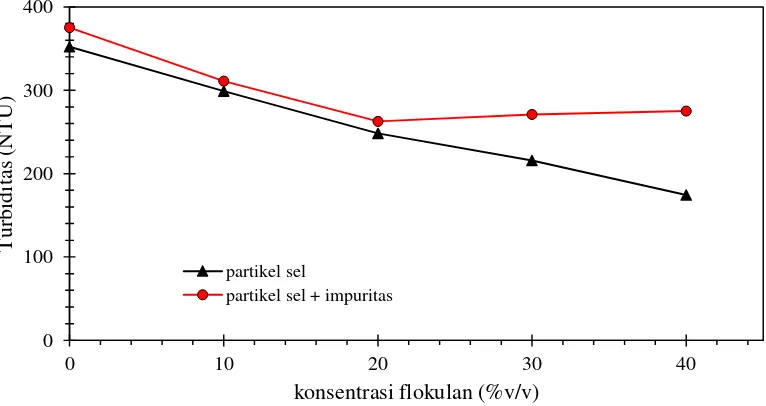
Pengaruh konsentrasi flokulan terhadap efisiensi flokulasi dipelajari menggunakan variasi konsentrasi 0%, 10%, 20%, 30%, dan 40% (v/v). Proses flokulasi dilakukan selama 24 jam. Pengaruh konsentrasi flokulan disajikan pada Gambar 4.2.
Gambar 4.2. Pengaruh konsentrasi flokulan terhadap turbiditas selama 24 jam
Gambar 4.2. menunjukkan bahwa nilai turbiditas pada flokulasi partikel sel mengalami penurunan seiring peningkatan konsentrasi flokulan. Nilai turbiditas partikel sel tertinggi saat 0% (tanpa flokulan) mencapai 352 NTU sedangkan
0 100 200 300 400
0 10 20 30 40
T
ur
bi
di
tas
(N
TU
)
konsentrasi flokulan (%v/v)
partikel sel
terendah saat penambahan flokulan 40% v/v yaitu 174. Disisi lain pada flokulasi pertikel sel dengan penambahan impuritas diperoleh nilai turbiditas saat penambahan 0%, 10%, 20% (v/v) secara berturut-turut menurun yaitu 375 NTU, 311 NTU, 263 NTU. Akan tetapi ketika konsentrasi flokulan ditambah menjadi 30% dan 40% (v/v) terjadi peningkatan turbiditas yaitu 271 NTU dan 275 NTU. Peningkatan turbiditas tersebut diperkirakan karena impuritas menghambat kinerja flokulan. Dengan kata lain flokulasi partikel sel dengan penambahan flokulan terbaik dicapai saat konsentrasi 20%.
Pengaruh konsentrasi flokulan terhadap proses flokulasi dapat dinyatakan dalam efisiensi flokulasi. Efisiensi flokulasi adalah perubahan turbiditas dibandingkan turbiditas awal dikalikan 100%.
𝜂
𝑓𝑙𝑜𝑘𝑢𝑙𝑎𝑠𝑖=
𝑡𝑢𝑟𝑏𝑖𝑑𝑖𝑡𝑎𝑠𝑎𝑤𝑎𝑙−𝑡𝑢𝑟𝑏𝑖𝑑𝑖𝑡𝑎𝑠𝑎𝑘ℎ𝑖𝑟𝑡𝑢𝑟𝑏𝑖𝑑𝑖𝑡𝑎𝑠𝑎𝑤𝑎𝑙 x 100 % ... ( 4.9 )Dengan,
𝜂
𝑓𝑙𝑜𝑘𝑢𝑙𝑎𝑠𝑖 = efisiensi flokulasi (%)Turbiditas awal = turbiditas jam ke-0 (NTU) Turbiditas akhir = turbiditas jam ke-24 (NTU)
Efisiensi flokulasi pada percobaan flokulasi sel dan flokulasi sel dengan penambahan impuritas dapat dilihat pada tabel 4.4.
Tabel 4.4. Efisiensi flokulasi
Jumlah flokulan % (v/v) Efisiensi flokulasi partikel (%)
sel sel dengan penambahan impuritas
10 32,19 32,10
20 35,16 33,16
30 45,40 27,15
40 46,03 27,70
flokulan 30% dan 40% hanya mencapai 27,15% dan 27,70%. Dengan kata lain penambahan flokulan di atas konsentrasi 20% menurunkan efisiensi flokulasi. Penurunan efisiensi tersebut diperkirakan karena impuritas menghambat kinerja flokulasi. Mekanisme bridging yang seharusnya terbentuk menjadi pudar sehingga turbiditas naik. Jadi kondisi maksimum flokulasi sel dengan penambahan impuritas terjadi ketika penambahan flokulan 20%. Melihat fenomena diatas dapat disimpulkan bahwa untuk proses flokulasi sel sebaiknya pengotor diminimalisir, karena adanya partikel pengotor (impuritas) menghambat proses flokulasi sel.
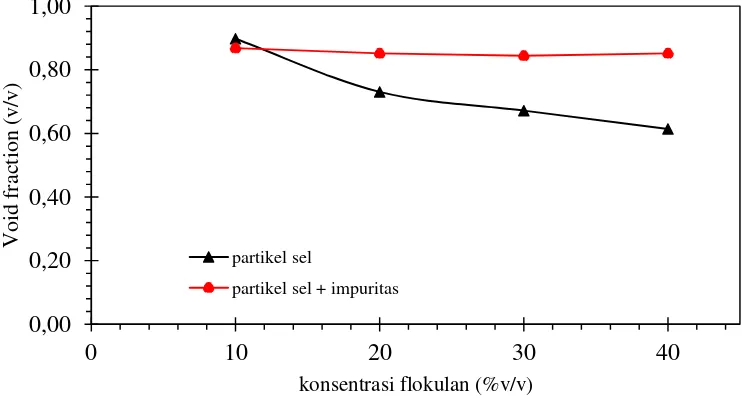
IV.1.3. Pengaruh konsentrasi flokulan terhadap void fraction flok
Void fraction adalah perbandingan antara volume ruang kosong di dalam flok terhadap volume flok keseluruhan. Perhitungan void fraction menggunakan persamaan berikut :
Void fraction
=
𝑣𝑜𝑙𝑢𝑚𝑒 𝑟𝑢𝑎𝑛𝑔 𝑘𝑜𝑠𝑜𝑛𝑔 𝑑𝑖 𝑑𝑎𝑙𝑎𝑚 𝑓𝑙𝑜𝑘𝑣𝑜𝑙𝑢𝑚𝑒 𝑓𝑙𝑜𝑘 𝑘𝑒𝑠𝑒𝑙𝑢𝑟𝑢ℎ𝑎𝑛 ... ( 5.0 )
Void fraction menjadi acuan seberapa besar rongga yang terbentuk di dalam flok dan mudah tidaknya medium masuk kedalam rongga. Matrik padat yang banyak diteliti contohnya agar-agar, gelatin, karagenan, dan alginat ketika digunakan untuk imobilisasi sel menjadi gel (padat) sehingga timbul masalah difusivitas (Mario et al, 2016). Sel S.cerevisiae ketika diflokulasi berada di tengah-tengah flok. Pada saat fermentasi terjadi mekanisme difusi substrat dalam fase cair menuju ke dalam sel yang ada di tengah-tengah flok dan sebaliknya terjadi difusi produk hasil fermentasi dari sel menuju ke substrat. Sehingga besarnya void fraction menjadi suatu ukuran seberapa mudah terjadi difusi substrat ke dalam flok dan produk ke luar dari flok.
Void fraction flokulasi partikel sel semakin turun seiring dengan penambahan konsentrasi flokulan dapat dilihat Gambar 4.3. Hal ini menunjukkan semakin besar konsentasi flokulan maka void fraction semakin kecil. Void fraction
terkecil 0,614 v/v diperoleh dari flokulan 40%v/v dan terbesar 0,9 v/v dengan konsentrasi flokulan 10%. Sebaliknya flokulasi partikel sel dengan penambahan impuritas hampir tidak ada perubahan nilai void fraction atau grafik cenderung tetap. Sehingga dapat disimpulkan bahwa keberadaan impuritas cenderung menjadi penghambat proses flokulasi sel. Dengan kata lain kondisi proses flokulasi partikel sel lebih efektiv jika tanpa kehadiran impuritas.
Gambar 4.3. Pengaruh flokulan terhadap void fraction selama 24 jam
IV.1.4. Efektivitas sel terjaring dalam flok
Efektivitas sel terjaring adalah jumlah sel terjaring oleh flok dibagi jumlah sel mula-mula dikalikan 100%. Perhitungan efektivitas sel terjaring dapat dinyatakan dalam persamaan 4.5. Pengaruh penambahan konsentrasi flokulan terhadap efektivitas sel terjaring ditunjukkan pada Gambar 4.4. Jika dinyatakan dalam efektivitas sel terjaring dapat dilihat pada Gambar 4.5.
𝜀
𝑠𝑒𝑙 𝑡𝑒𝑟𝑗𝑎𝑟𝑖𝑛𝑔=
∑ 𝑠𝑒𝑙 𝑡𝑒𝑟𝑗𝑎𝑟𝑖𝑛𝑔∑ 𝑠𝑒𝑙 𝑎𝑤𝑎𝑙 x 100 % ... ( 5.1 ) Dengan,𝜀
𝑠𝑒𝑙 𝑡𝑒𝑟𝑗𝑎𝑟𝑖𝑛𝑔 = efektivitas sel terjaring, %0,00 0,20 0,40 0,60 0,80 1,00
0 10 20 30 40
V
oi
d
fr
ac
ti
on
(v
/v
)
konsentrasi flokulan (%v/v)
partikel sel
∑ 𝑠𝑒𝑙 𝑡𝑒𝑟𝑗𝑎𝑟𝑖𝑛𝑔 = konsentrasi sel terjaring, sel/L
∑sel awal = konsentrasi sel mula-mula, sel/L
Jumlah sel terjaring pada flokulasi partikel sel menunjukkan peningkatan sebagaimana terlihat dalam Gambar 4.4. Jumlah sel total (awal) sebanyak 9,6 x 1011 sel/L, setelah penambahan flokulan dengan konsentrasi 10%, 20%, 30% dan 40% v/v diperoleh sel terjaring berturut-turut 5,76 x 1011 sel/L , 7,47 x 1011 sel/L, 8,53 x 1011 sel/L dan 8,96 x 1011 sel/L. Dengan kata lain jumlah sel yang tidak terjaring saat penambahan flokulan hanya 0,64 x 1011 sel/L. Pola yang berbeda pada flokulasi sel dengan penambahan impuritas menunjukkan ketika penambahan flokulan 10% dan 20% v/v jumlah sel terjaring meningkat, akan tetapi turun ketika penambahan flokulan 30% dan 40%v/v. Penurunan tersebut diperkirakan karena saat flokulasi terjadi kompetisi antara impuritas dengan sel, sehingga jumlah sel terjaring mengalami menjadi berkurang.
Gambar 4.4. Pengaruh konsentrasi flokulan terhadap jumlah sel terjaring
Efektivitas sel terjaring pada proses flokulasi partikel sel dengan variasi 10%, 20%, 30%, dan 40% v/v yang ditunjukkan Gambar 4.5. secara berturut-turut diperoleh 60%, 78%, 89% dan 93%. Nilai efektivitas sel terjaring tertinggi dicapai saat jumlah flokulan 40%v/v. Telah dijelaskan pada pembahasan void fraction
0,00,E+00 2,00,E+11 4,00,E+11 6,00,E+11 8,00,E+11 1,00,E+12 1,20,E+12
0 10 20 30 40
ju
m
lah
sel
te
rjari
n
g
(se
l/
L)
konsentrasi flokulan (%v/v)
partikel sel
bahwa semakin tinggi konsentrasi flokulan maka volume flok semakin tinggi, hal ini disebabkan semakin banyak jaring-jaring flok yang terbentuk. Jika ditinjau proses flokulasi sel dengan penambahan impuritas menunjukkan penambahan flokulan 10-20 %v/v mencapai efektivitas sel terjaring secara berturut turut 49% dan 69%. Efektivitas sel terjaring tersebut menunjukkan adanya kenaikan seiiring penambahan konsentrasi flokulan. Akan tetapi ketika penambahan konsentasi flokulan 30% dan 40% v/v efektivitas sel terjaringnya justru menurun yaitu secara berturut-turut 67% dan 62%. Hal ini menunjukkan penambahan impuritas menyebabkan flokulasi sel terhambat.
Gambar 4.5. Profil penambahan konsentrasi flokulan terhadap efektivitas sel terjaring
Berdasarkan analisis efektivitas sel terjaring dapat disimpulkan bahwa flokulan dengan konsentrasi 40% efektif untuk proses flokulasi partikel sel. Kesimpulan tersebut didukung analisis void fraction pada konsentrasi 40% masih terdapat ruang kosong untuk difusi substrat dan produk.
IV. 2. PROSES FERMENTASI
IV. 2.1. Pengaruh peningkatan konsentrasi sel terhadap yield etanol-gula
Keberhasilan proses flokulasi partikel sel memungkinkan untuk meningkatkan konsentrasi sel pada stater fermentasi sehingga berpeluang dalam
0 20 40 60 80 100
10 20 30 40
ef
ek
ti
v
itas
sel
te
rjari
n
g
(%
)
konsentrasi flokulan (%v/v)
partikel sel
peningkatan produktivitas bioetanol. Pengaruh peningkatan konsentrasi sel terhadap stater dipelajari selama proses fermentasi 48 jam.
Yield digunakan sebagai ukuran untuk menentukan besarnya gula
terkonsumsi dibandingkan produk bioetanol yang dihasilkan. Pengaruh konsentrasi sel terhadap kadar gula sisa selama fermentasi disajikan pada Gambar 4.6. Adapun variasi konsentrasi sel yang digunakan yaitu flok 1x, 2x, 3x dan 4x. Pengertian flok 1x adalah jumlah sel terjaring yang berasal dari 140 ml media stater II. Flok 2x adalah jumlah sel terjaring yang berasal dari 280 ml media stater II. Flok 3x adalah jumlah sel terjaring yang berasal dari 420 ml media stater II. Flok 4x adalah jumlah sel terjaring yang berasal dari 560 ml media stater II.
Gambar 4.6. Profil kadar gula sisa selama fermentasi
Gambar 4.6. menunjukkan pada saat awal fermentasi (0 jam) kadar gula mula-mula masing-masing flok berbeda-beda, karena saat memisahkan flok dengan filtrat sel tidak boleh diperlakukan secara fisik (dikeringkan, disaring). Perlakuan fisik terhadap sel dapat merusak flok dan mempengaruhi aktivitas sel, sehingga pemisahan dilakukan dengan ditiriskan/dituang perlahan-lahan. Kadar gula sisa terbesar pada kondisi flok 4x mencapai 241 g/L dan terkecil saat flok 1x yaitu 84 g/L. Pada jam ke-36 terlihat kadar gula sisa dari masing-masing percobaan mendekati nol (substrat habis) sehingga produksi etanol berhenti. Berdasarkan pengukuran kadar gula tersebut maka fermentasi efektif sampai jam ke 36, jika
0 50 100 150 200 250 300
0 12 24 36 48
k ada r g ul a si sa (g /L)
waktu fermentasi (jam)
dilanjutkan sampai 48 jam tidak akan diperoleh etanol lagi. Kecepatan konsumsi gula rata-rata ditunjukkan pada Tabel 4.5.
Tabel 4.5. Kecepatan konsumsi gula rata-rata selama 36 jam Variasi flok Konsumsi gula
(g/L)
Kecepatan konsumsi gula rata-rata (g/L/jam)
1x 80,13 2,23
2x 163,24 4,53
3x 206,48 5,74
4x 238,80 6,63
Tabel 4.3. menunjukkan masing-masing percobaan, flok mempengaruhi kecepatan konsumsi gula rata-rata. Flok 1x selama 36 jam mengkonsumsi gula sebanyak 80,13 g/L sehingga diperoleh kecepatan rata-rata pada jam tersebut adalah 2,23 g/L/jam. Kecepatan tersebut merupakan terendah, karena pada kondisi tersebut konsentrasi sel paling sedikit. Kecepatan tertinggi diperoleh ketika kondisi flok 4x yang mencapai 6,63 g/L/jam, karena konsentrasi sel paling banyak. Berdasarkan tabel tersebut dapat dihitung kecepatan konsumsi gula saat flox 4x adalah 2,98 kali lebih cepat dibandingkan flok 1x.
Sel mengkonsumsi gula dan digunakan untuk pertumbuhan, energi
maintenance, dan produksi alkohol. Profil konsentrasi etanol selama fermentasi dapat dilihat pada Gambar 4.7 .
Gambar 4.7. Profil kadar etanol selama fermentasi 0,00
4,00 8,00 12,00 16,00
0 12 24 36 48
k ada r et anol ( % b/ v )
waktu fermentasi (jam) flok 1x
Gambar 4.7 menunjukkan bahwa kadar etanol mencapai maksimum pada jam ke 36 untuk semua variasi stater (jumlah flok). Akan tetapi konsentrasi etanol produksi bervariasi mengikuti peningkatan jumlah flok yang digunakan sebagai starter, yaitu 3,80%, 8,93%, 9,86%, dan 14,09% secara berturut-turut untuk flok 1x, 2x, 3x, dan 4x. Hal tersebut menunjukkan bahwa konsentrasi sel tinggi akan memproduksi etanol dengan konsentrasi yang lebih tinggi. Untuk melihat lebih jauh apakah jumlah flok stater yang lebih tinggi akan memberikan hasil yang lebih baik maka dapat digunakan parameter yield etanol terhadap gula yang terkonsumsi. Perhitungan yield dinyatakan dalam persamaan 4.6, sedangkan pengaruh peningkatan konsentrasi sel terhadap yield(p/s) disajikan pada Gambar 4.8.
𝑦𝑖𝑒𝑙𝑑 =
𝑘𝑎𝑑𝑎𝑟 𝑒𝑡𝑎𝑛𝑜𝑙 𝑑𝑖𝑝𝑟𝑜𝑑𝑢𝑘𝑠𝑖𝑘𝑎𝑑𝑎𝑟 𝑔𝑢𝑙𝑎 𝑡𝑒𝑟𝑘𝑜𝑛𝑠𝑢𝑚𝑠𝑖 𝑥 100% ... ( 5.2 )Gambar 4.8. Pengaruh peningkatan konsentrasi sel terhadap
yield selama fermentasi
Gambar 4.8. menunjukkan bahwa jumlah flok stater (konsentrasi sel) berpengaruh terhadap yield etanol-gula. Semua percobaan menunjukkan bahwa
yield tertinggi diperoleh pada jam ke 36, yaitu masing-masing berturut-turut untuk flok 1x, 2x, 3x, dan 4x adalah 42,21%, 48,08%, 48,61%, dan 49,99%. Jika dibandingkan dengan yield etanol-gula hasil percobaan free cell (blanko) maka
yield tersebut mengalami peningkatan sebesar 4,9 – 5,8 kali yield percobaan blanko 0 10 20 30 40 50 60
0 12 24 36 48
yi el d (g et an o l/g g u la)
waktu fermentasi (jam)
(8,59%). Hal tersebut menunjukkan imobilisasi sel dengan teknik flokulasi dapat meningkatkan yield. Yield etanol-gula teoritis adalah 51%. Perbandingan yield
percobaan dengan yield teoritis biasa disebut dengan efisiensi (η)dan perhitungan efisiensi tersebut dinyatakan pada persamaan 4.7.
η
=
𝑦𝑖𝑒𝑙𝑑 𝑝𝑒𝑟𝑐𝑜𝑏𝑎𝑎𝑛𝑦𝑖𝑒𝑙𝑑 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 𝑥 100%...
( 5.3 )Efisiensi pada jam ke 36 dari masing masing percobaan flok 1x, 2x, 3x, dan 4x bila dihitung menggunkan persamaan 4.7. secara berturut–turut diperoleh 82,75%, 94,25%, 95,31%, 98,02%. Efisiensi yield tertinggi diperoleh saat percobaan flok 4x, yaitu ketika konsentrasi flok tertinggi (4x). Penelitian terkait yield telah dilakukan oleh Rattanapan et al., (2011) menggunakan sel S. cerevisiae M30 terimobilisasi dalam Thin-shell silk cocoan (TSC) menghasilkan yield 47%. Eiadpum et al., (2012) meneliti produksi etanol menggunakan co-kultur
Kluyveromyces marxianus dan S. cerevisiae dengan bahan pengimobilisasi matriks
loofa-alginat dan kepompong ulat sutera menghasilkan yield 37% dan 35,14%. Jika dibandingkan dengan penelitian Rattanapan dan Eiadpum tersebut yield sel S. cerevisiae yang diflokulasi dengan flokulan St-g-PAM lebih efisien karena dapat mencapai yield 49,99% ketika konsentrasi flok 4x.
IV.2.2. Produktivitas
Parameter yang paling sesuai untuk mengukur kinerja fermentasi adalah produktivitas. Produktivitas adalah perbandingan konsentrasi etanol yang diproduksi (g/L) dengan waktu fermentasi (jam). Perhitungan produkrivitas dapat dinyatakan dalam persamaan 4.7. Penelitian lain terkait produktivitas bioetanol dengan variasi matrik dapat dilihat pada tabel 4.6. Pengaruh peningkatan konsentrasi sel terhadap produktivitas etanol disajikan pada Tabel 4.7.
Produktivitas
=
𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑒𝑡𝑎𝑛𝑜𝑙Tabel 4.6. Produktivitas bioetanol menggunakan S. cereviseae variasi matrik No Mikroorganisme Matriks Produktivitas,
g/L/h Referensi 1 S. cerevisiae M30 Loofa-reinforced
alginate
11.5 Bangkrak et al., (2011)
2 S. cerevisiae M30 Thin-shell silk cooan 1.07 Eiadpum et al., (2012) 3 S. cerevisiae CICC
1308
Sweet sorghum stalk juice
1.54 Hui Jin et al., (2012)
4 S. cerevisiae TISTR 5048
Corn cobs piece 2.13±0.02 Laopaiboon et al.,
(2012)
5 S. cerevisiae Cashew apple 3.30-6.31 Pachecho et al., (2010) 6 S. cerevisiae NP 01 Sweet Sorghum Stalks 1.36 ± 0.05 Ariyajaroenwong et al.,
(2012) 7 S. cerevisiae MTCC
174
Sugar cane bagasse 0.42 Singh et al., (2013)
8 S. cerevisiae MTCC 174
Agar-agar cubes 0.26 Singh et al., (2013)
9 S. cerevisiae MTCC 174
Ca-alginate 0.32 Singh et al., (2013)
10 S. cerevisiae 3013 Sweet sorghum pith 0.19 Ji et al., (2012) 11 S. cerevisiae CTCRI Luffa sponge discs 0.850 Behera et al., (2011) 12 S. cerevisiae DTN Alginate-maize stem
ground tissue
2.51±0.01 Razmovski et al., (2011)
13 S. cerevisiae Lyophilized cellulose gel
0.425 Winkelhausen et al.,
(2010) 14 S. cerevisiae Sodium alginate grafted
with N-vinyl-2-pyrrolidone
8.71 Inal et al., (2011)
15 S cerevisiae NP 01 Corn cobs piece 1.89±0.06 Laopaiboon et al.,
(2012)
Berdasarkan Tabel 4.6. Produktivitas bioetanol berbeda–beda dipengaruhi oleh strain dari mikroorganisme dan jenis matriks yang dipergunakan. Dalam penelitian ini mikrorganisme yang digunakan adalah S. cerevisiae n0 DY 7221 dan untuk mengimobilisasi sel tidak digunakan matriks melainkan bioflokulan St-g-PAM .
Tabel 4.7. Pengaruh peningkatan konsentrasi sel terhadap produktivitas etanol
waktu (jam)
Produktivitas (g/L/jam)
Flok 1x Flok 2x Flok 3x Flok 4x
0 0 0 0 0
12 1,371 2,534 4,097 4,459
24 1,277 2,791 3,327 3,569
36 1,093 2,365 3,353 3,774
Tabel 4.7. menunjukkan bahwa adanya variasi flok mempengaruhi produktivitas etanol. Produktivitas masing-masing flok mengalami kenaikan pada 0-12 jam. Pada waktu fermentasi 12 jam produktivitas tertinggi dicapai pada flok 4x yaitu 4,459 g/L/jam. Sedangkan produktivitas terendah ketika flok 1x hanya mencapai 1.371 g/L/jam. Produktivitas flok 4x dibandingkan flok 1x adalah 3,25 kali lebih cepat. Produktivitas terlihat mulai menurun pada jam 24 s/d 48, karena substrat semakin lama semakin habis sehingga produktivitas juga menurun. Dapat disimpulkan bahwa produktivitas sangat dipengaruhi oleh konsentrasi sel, semakin tinggi konsentrasi sel maka produktivitasnya tinggi.
Produktivitas tertinggi pada variasi flok 4x jika dibandingkan dengan percobaanBangkrak et al.,(2010) menggunakan matriks Loofa-reinforced alginate lebih rendah 2,58 kali. Jika dibandingkan percobaan Eiadpum et al., (2012) menggunakan matriks Thin-shell silk cocoan 4,2 kali lebih cepat.
IV. 2.3. Uji Penggunaan Ulang Sel (Durabilitas Sel)
Proses fermentasi dengan imobilisasi sel mempunyai beberapa keuntungan dibandingkan teknologi konvensional. Salah satu keuntungan imobilisasi adalah kemampuan sel digunakan berulang sehingga perlu diuji berapa kali sel dapat digunakan secara berulang pada media baru. Penelitian sebelumnya terkait penggunaan ulang sel telah dilakukan oleh Ellaiah et al., (2004) bahwa produksi lipase dari Aspergilus niger yang terimobil dalam Na-alginate, k-carrageenan, dan polyacrylamide mencapai 3x ulangan, setelah itu yield menurun. Rakin et al.,
(2009) melakukan studi yeast terimobilisasi pada Ca-alginat mencapai pengulanganke-2, kemudian mengalami degradasi. Behera et al., (2010) meneliti produksi bioetanol dari bunga mahula (Madhuca latifolia L) menggunakan sel
S.cereviseae terimobilisasi dalam matrik Ca-alginate stabil sampai pengulangan ke-3.
berkelanjutan dimana sel dari percobaan pertama (ulangan 1) digunakan lagi pada percobaan kedua (ulangan 2), demikian seterusnya hingga percobaan ke lima (ulangan 5).
Gambar 4.9. Profil kadar gula sisa selama fermentasi
Selama proses fermentasi sel membutuhkan asupan makanan untuk kelangsungan hidup. Penurunan kadar gula sisa yang besar menunjukkan kinerja sel baik. Gambar 4.9 menunjukkan besarnya kadar gula sisa dalam substrat selama waktu fermentasi. Uji penggunaan ulang sel dengan pengukuran kadar gula sisa diperoleh penurunan kadar gula sisa tertinggi terjadi ketika ulangan ke-2 mencapai 227,8 g/L. Penurunan kadar gula sisa terkecil saat ulangan ke-5 hanya mencapai 0,51 g/L/jam.
Gambar 4.10. Profil kadar etanol selama waktu fermentasi 36 jam 0,0 50,0 100,0 150,0 200,0 250,0
0 12 24 36
kadar gul a si sa (g/ L )
waktu fermentasi (jam)
ulangan 1 ulangan 2 ulangan 3 ulangan 4 ulangan 5 0,00 5,00 10,00 15,00 20,00
0 12 24 36
kad ar et ano l ( % b/ v )
waktu fermentasi (jam)
Trend grafik tersebut ketika ulangan ke 1, 2, dan 3 menunjukkan kenaikan, hal yang berbeda terlihat ketika ulangan ke-4 dan 5 kadar gula cenderung datar. Hal tersebut disebabkan pada ulangan ke 1, 2, 3 sel masih aktif dan mampu memproduksi etanol paling tinggi pada waktu 36 jam secara berturut-turut sebesar 14,04%; 15,42%; 16,97% b/v. Sedangkan untuk ulangan ke-4 dan ke-5 pada waktu 36 jam hanya mencapai 2,53% dan 1,93% b/v. Fenomena itu menunjukkan saat ulangan ke-4 dan 5 sel sudah tidak aktif (mengalami kematian) sehingga tidak ada perubahan kadar etanol.
Efisiensi fermentasi diperoleh dari perbandingan yield hasil percobaan dengan yield teoritis (51 g etanol/g gula). Evaluasi pengaruh penggunaan ulang sel dengan parameter yield, produktivitas, dan efisiensi fermentasi disajikan pada Tabel 4.8.
Tabel 4.8. Pengaruh penggunaan ulang sel terhadap yield dan produktivitas selama fermentasi 36 jam
Media ulangan ke-
Yield, (g etanol/g gula)
Produktivitas, (g/L/jam)
Efisiensi, yield percobaan/yield teoritis (%)
1 49,13 3,78 96,34
2 49,13 4,11 96,34
3 45,98 4,58 90,15
4 13,71 0,71 26,88
5 3,31 0,51 6,50
37
KESIMPULAN DAN SARAN
V.1. Kesimpulan
1. Proses flokulasi sel mencapai efisiensi flokulasi terbaik 46,03%, ketika konsentrasi flokulan 40%v/v. Sedangkan untuk proses flokulasi sel dengan penambahan impuritas konsentrasi flokulan terbaik adalah 20%v/v dengan efisiensi flokulasi hanya mencapai 33,16%, hal ini disebabkan adanya impuritas mempercepat proses flokulasi akan tetapi rapuh sehingga flok mudah lepas.
2. Penambahan jumlah flokulan 10%, 20%, 30%, dan 40% v/v dapat meningkatkan efisiensi flokulasi sel dari 32,19% sampai 46,03%. Nilai void fraction sebanding dengan penambahan konsentrasi flokulan yaitu semakin tinggi konsentrasi flokulan maka flok semakin rapat. Selain itu penambahan konsentrasi flokulan juga meningkatkan efektivitas sel terjaring dalam flok dari 5,76 x 1011 sel/L sampai 8,96 x 1011 sel/L.
3. Peningkatan jumlah sel terimobilisasi (dalam bentuk flok) berakibat peningkatan produktivitas, dan diperoleh hasil terbaik ketika jumlah flok 4x dengan nilai produktivitas mencapai 4,46 g/L/jam.
4. Uji penggunaan ulang sel menunjukkan flok sel S.cereviseae dapat digunakan berulang sebanyak 3 kali , dengan efisiensi yield percobaan terhadap yield teoritis antara 90,15% - 96,34%.
V.2. Saran
1. Perlu studi lebih lanjut untuk mengetahui penyebab menurunnya kecepatan flokulasi ketika ada penambahan impuritas pada medium.
2. Perlu pengukuran yang akurat untuk mengetahui ukuran flok
Kebijakan,Edisi 1, LIPI Press.
Bangrak, P, Limtong, S., and Phisalaphong, M., 2011, Continuous ethanol production using immobilized yeast cells entrapped in loofa-reinforced
alginate carriers,Braz J Microbiol, 42 (2) : 676-84.
Behera S., Kar S.,