vi
PRAKATA
Puji syukur kepada Allah Bapa, Putra, dan Roh Kudus atas segala bimbingan, dukungan, kekuatan, kasih, dan cintanya yang senantiasa dilimpahkan kepada penulis, sehingga penulis dapat melakukan penelitian dan penyusunan skripsi yang berjudul ”Daya Hipoglikemik Produk Jamu Antidiabetes ”AD” Dibandingkan Dengan Glibenklamida Pada Tikus Putih Jantan Terbebani Glukosa” sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi (S. Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Keberhasilan penyusunan skripsi ini tidak lepas dari hikmat dan berkat dari Tuhan Yesus Kristus dan dukungan dari berbagai pihak yang telah membantu penulis hingga akhir penulisan skripsi. Penulis mengucapkan terima kasih kepada: 1. Ibu Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta
2. Bapak Yosef Wijoyo, M.Si., Apt., selaku dosen pembimbing penulis dalam penyelesaian skripsi ini. Bimbingan, nasihat, semangat dan ilmu yang telah diberikan menjadi teladan dan sumber inspirasi
3. Bapak Ipang Djunarko, S.Si., Apt., yang telah memberikan bimbingan, saran dan kritik yang membangun
vii
5. Romo Sunu yang telah membantu penulis dalam pengolahan statistik data 6. IOT. Sari Sehat – PT. Capung Indah Abadi dan Bu Lis Setyowati yang
telah mempercayakan penelitian ini kepada penulis dan tim
7. Mas Heru, Mas Kayat, Mas Parjiman, Mas Kunto dan Mas Yuwono selaku laboran dan karyawan Fakultas Farmasi USD yang telah membantu penulis selama pelaksanaan penelitian di laboratorium
8. Keluarga tercinta: papa yang selalu selalu sabar dan selalu memberikan dukungan untuk menyelesaikan skripsi ini, almarhumah mama tercinta yang menjadi inspirasi dan semangat bagi penulis, adik-adikku tercinta Devi dan Debora, serta om Joko dan tante Amik yang telah memberikan dukungan dan doa kepada penulis
9. Ratna Puspita yang telah memberikan semangat dan ketenangan hati selama penulis menyelesaikan skripsi ini
10. Feri, Liza, Dika dan Chika yang menjadi teman seperjuangan di laboratorium
11. Ivone Susanto, Erline Yusticia Hinlandou, Sri Widyastuti, Maduma,
Indah, Meidina dan Rr. Fransiska atas semua kebaikan dan persahabatan yang telah diberikan kepada penulis selama menempuh kuliah S1
12. Mbak Desi yang telah memberikan masukan dan meluangkan waktu untuk membantu penulis dalam menyelesaikan penelitian
viii
14. Teman-teman senior di Fakultas Farmasi Sanata Dharma (Andreas, Budi, Hengky, Hermanto, Irwan dan Alfian) yang telah memberikan masukan-masukan
15. Komunitas “Dolanz-Dolanz” (Boris, Rian, Ayu, Rosa, Budi, Felix, Ari, Sisil, Chandy, Rudi, Adit, Robert, Tintus, Harimawan dan Lian) atas persahabatannya
16. Teman-teman angkatan 2004 kelas FKK dan semua pihak yang tidak dapat disebutkan satu-persatu
Penulis berharap skripsi ini dapat memberi manfaat bagi para pengguna. Akhir kata, penulis menyadari bahwa kritik dan saran yang membangun akan bermanfaat untuk perbaikan bagi penulis. Tuhan Yesus memberkati.
x
INTISARI
Tujuan penelitian ini adalah untuk melihat seberapa besar daya hipoglikemik produk jamu antidiabetes “AD” pada tikus putih jantan yang dibebani glukosa. Jenis penelitian adalah eksperimental murni dan dikerjakan mengikuti rancangan acak lengkap pola searah.
Penelitian menggunakan 30 ekor tikus yang terbagi enam kelompok perlakuan, yaitu kontrol negatif yang diberi perlakuan aquades, kontrol negatif yang diberi perlakuan CMC-Na 1%, perlakuan glibenklamida sebagai kontrol positif dan kelompok perlakuan produk jamu antidiabetes dengan 3 peringkat dosis. Daya hipoglikemik produk jamu antidiabetes diuji mengikuti metode uji toleransi glukosa oral (UTGO). Kadar glukosa darah ditetapkan pada menit ke-0 sebelum UTGO dan menit ke-15, 30, 45, 60, 90, 120, 180, 240, dan 300 setelah UTGO. Kadar glukosa darah ditetapkan dengan metode enzimatik Glucose Oxidase Phenol Antipirin (GOD-PAP)
Data kadar glukosa darah pada tiap kelompok dianalisis secara statistik menggunakan metode GLM Repeated Measure, sedangkan nilai LDDK0-300 glukosa darah dianalisis secara statistik menggunakan uji Kruskal Wallis dan dilanjutkan dengan uji Mann Whitney bertaraf kepercayaan 95%.
Hasil penelitian menunjukkan bahwa ketiga peringkat dosis dari hasil saring seduhan produk jamu antidiabetes “AD” ini dapat memberikan penurunan kadar glukosa darah secara bermakna terhadap kontrol negatif aquades, tetapi tidak sebanding dengan kontrol positif glibenklamida. Perbedaan prosentase hasil saring seduhan produk jamu antidiabetes “AD” dengan dosis 16,2 ml/kgBB dari penyeduhan serbuk jamu sebanyak 7 gram/200ml, dosis 12,6 ml/kgBB dari penyeduhan serbuk jamu sebanyak 21 gram/200ml dan dosis 6,84 ml/kgBB dari penyeduhan serbuk jamu sebanyak 63 gram/200ml terhadap kontrol positif glibenklamida, berturut-turut sebesar 87,83%; 70,86% dan 59,00%.
xi
ABSTRACT
The purpose of this research is to know the hypoglycemic ability of “AD” antidiabetic jamu product on white male rat which had been given glucose. This research was purely experimental with complete random pattern design.
Thirty rat were divided into six groups with six different kinds of treatment for each group. Aquadest as negative control for jamu, CMC-Na 1% as negative control for glibenclamide, glibenclamide 0,45 mg/kg bw as positive control, and groups which treated by filtrate of antidiabetic jamu product which poured by boiling water in 3 dosage level orally. The hypoglycemic effect on male rat which had been given glucose was tested through Oral Glucose Tolerance Test (OGTT). Blood glucose level were measured on zero minute before OGTT and the 15 th, 30 th, 45 th, 60 th, 90 th, 120 th, 180 th, 240 th, dan 300 th minutes after OGTT. Blood glucose level was assayed with Glucose Oxidase Phenol Antipirin (GOD-PAP) enzymatic method.
The data of blood glucose level from each group was statistically analyzed using GLM Repeated Measure design. The AUC0-300 of blood glucose was statistically analyzed using Kruskal Wallis test and then continued with Mann Whitney test with 95% level of convidence.
The result indicated that the three level dosages filtrate of “AD” antidiabetic jamu product can decreased the concentration of blood glucose significantly to aquadest, but not comparable to glibenclamide. The percentage of different between the filtrate of antidiabetic jamu product with dosage level 16,2 ml/kg bw (from 7 gram antidiabetic jamu which poured by 200 ml boiling water), 12,6 ml/kg bw (from 21 gram antidiabetic jamu which poured by 200 ml boiling water) and 6,84 ml/kg bw (from 63 gram antidiabetic jamu which poured by 200 ml boiling water) to positive control group is 87,83%; 70,86% dan 59,00%.
xii
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI ... x
ABSTRACT ... xi
DAFTAR ISI ... xii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xviii
DAFTAR LAMPIRAN ... xix
ARTI LAMBANG, SINGKATAN DAN ISTILAH ... xx
BAB I PENGANTAR ... 1
A. Latar Belakang... 1
1. Permasalahan... 3
2. Keaslian penelitian ... 3
3. Manfaat penelitian ... 4
a. manfaat teoritis ... 4
b. manfaat praktis ... 4
xiii
1. Tujuan umum ... 4
2. Tujuan khusus ... 5
BAB II PENELAAHAN PUSTAKA ... 6
A. Obat Bahan Alam Indonesia ... 6
B. Produk Jamu Antidiabetes “AD” ... 7
1. Phellodendri cortex .... 8
2. Anemarrhenae rhizome ... 8
3. Asparagi radix ... 8
4. Ophiopogonis radix ... 9
5. Trichosanthis radix ... 9
6. Puerariae radix... 9
7. Glycyrrhizae radix... 10
8. Astragali radix ... 10
C. Transport Glukosa ... 10
D. Diabetes mellitus ... 13
1. Definisi ... 13
2. Gejala ... 13
3. Klasifikasi ... 14
4. Cara dan kriteria diagnosis ... 17
5. Terapi diabetes mellitus ... 19
E. Teknik Uji Diabetik dan Metode Penetapan Kadar Glukosa Darah .. 20
F. Glibenklamida ... 20
xiv
H. Spektrofotometri ... 23
I. Landasan Teori ... 24
J. Hipotesis ... 25
BAB III METODE PENELITIAN ... 26
A. Jenis dan Rancangan Penelitian ... 26
B. Variabel dan Definisi Operasional ... 26
1. Variabel utama ... 26
2. Variabel pengacau terkendali ... 26
3. Variabel pengacau tak terkendali ... 27
C. Bahan dan Alat Penelitian ... 27
1. Bahan penelitian ... 27
2. Alat penelitian ... 28
D. Jalannya Penelitian ... 29
1. Pembuatan dosis jamu ... 29
2. Preparasi bahan ... 31
a. pembuatan larutan asam benzoat 0,1% b/v ... 31
b. pembuatan larutan stok glukosa 10 mg/ml ... 31
c. pembuatan larutan CMC-Na 1% b/v ... 31
d. sodium oksalat 2% b/v ... 32
e. penentuan keseragaman bobot kaplet glibenklamida ... 32
f. penentuan dosis glibenklamida ... 32
g. penetapan konsentrasi pemberian larutan glibenklamida ... 33
xv
i. penetapan konsentrasi larutan glukosa monohidrat ... 34
3. Percobaan pendahuluan ... 34
a. penetapan waktu resapan stabil larutan glukosa murni ... 34
b. penetapan panjang gelombang maksimum ... 34
c. pembuatan kurva baku ... 35
d. penetapan waktu pemberian glibenklamida ... 35
e. penetapan waktu pemberian produk jamu antidiabetes “AD” 36 f. pengelompokan dan perlakuan hewan uji ... 36
4. Penetapan kadar glukosa darah ... 37
E. Analisis Hasil ... 39
BAB IV HASIL DAN PEMBAHASAN ... 41
A. Percobaan Pendahuluan ... 41
1. Waktu resapan stabil glukosa ... 41
2. Penetapan panjang gelombang maksimum ... 43
3. Pembuatan kurva baku ... 45
4. Penetapan waktu pemberian glibenklamida ... 47
5. Penetapan waktu pemberian produk jamu antidiabetes “AD”... 49
B. Efek Hipoglikemik Produk Jamu Antidiabetes “AD” ... 50
BAB V KESIMPULAN DAN SARAN ... 66
DAFTAR PUSTAKA ... 67
LAMPIRAN ... 71
xvi
DAFTAR TABEL
Tabel I. Nilai glukosa plasma puasa dan toleransi glukosa oral ... 19
Tabel II. Diagnosis diabetes mellitus gestasional dengan pemberian glukosa oral 100 g atau 75 g ... 19
Tabel III. Isi pereaksi enzim glucose GOD-PAP ... 28
Tabel IV. Keseragaman bobot tablet ... 32
Tabel V. Volume pengukuran kadar glukosa darah ... 38
Tabel VI. Data hasil penetapan waktu resapan stabil larutan glukosa standar ... 42
Tabel VII. Hubungan kadar dan resapan glukosa pada λ 502 nm ... 46
Tabel VIII. Hasil UTGO dan perhitungan prosentase selisih LDDK0-300 larutan glibenklamida ... 47
Tabel IX. Hasil UTGO dan LDDK0-300produk jamu antidiabetes “AD”... 49
Tabel X. Data kadar glukosa darah rata-rata serta LDDK0-300 tikus putih jantan pada setiap kelompok perlakuan ... 52
Tabel XI. Hasil analisis GLM Repeated Measure ... 56
Tabel XII. Pengaruh perlakuan hasil saring seduhan produk jamu antidiabetes “AD” terhadap LDDK0-300 kadar glukosa darah tikus putih jantan dan prosentase perbedaan terhadap kelompok negatif dan positif ... 57
xvii
Tabel XIV. Test Mean LDDK0-300 keenam kelompok perlakuan dengan uji Kruskal-Wallis ... 60 Tabel XV. Hasil uji Mann-Whitney LDDK0-300 glukosa darah tikus putih
xviii
DAFTAR GAMBAR
Gambar 1. Sekresi insulin akibat peningkatan kadar glukosa dalam darah 12
Gambar 2. Rumus struktur glibenklamida ... 20
Gambar 3. Bagan alur pembuatan dosis jamu ... 29
Gambar 4. Bagan alur analisis hasil kadar glukosa darah ... 39
Gambar 5. Bagan alur analisis LDDK0-300 glukosa darah ... 40
Gambar 6 Reaksi enzimatik antara glukosa dan reagen GOD-PAP ... 42
Gambar 7. Grafik hubungan resapan stabil glukosa standar ... 43
Gambar 8. Kurva panjang gelombang resapan maksimum glukosa standar ... 44
Gambar 9. Kurva baku glukosa pada λ 502 nm ... 47
Gambar 10. Diagram pengaruh waktu pemberian glibenklamida ... 48
Gambar 11. Diagram pengaruh waktu pemberian hasil saring seduhan produk jamu antidiabetes “AD”... 50
Gambar 12. Kurva hubungan antara waktu sampling dan kadar rata-rata glukosa darah tikus terbebani glukosa akibat pemberian hasil saring seduhan produk jamu antidiabetes “AD”... 53
xix
DAFTAR LAMPIRAN
Lampiran 1. Foto serbuk kering dan seduhan produk jamu
antidiabetes “AD” ... 71
Lampiran 2. Foto hewan uji percobaan (tikus putih jantan) ... 72
Lampiran 3. Foto alat penelitian ... 73
Lampiran 4. Penyiapan bahan ... 74
Lampiran 5. Data kadar glukosa darah darah pada tiap perlakuan dan waktu sampling ... 78
Lampiran 6. Hasil Uji Distribusi Data dengan Tes Kolmogorov Smirnov.. 81
Lampiran 7. Hasil Uji GLM Repeated Measure kadar glukosa darah ... 82
Lampiran 8. Hasil uji Kruskal Wallis ... 85
Lampiran 9. Hasil uji Mann Whitney ... 86
Lampiran 10. Hasil uji Anova One Way ... 91
Lampiran 11. Leaflet GOD-PAP... 92
xx
ARTI LAMBANG, SINGKATAN DAN ISTILAH
ad libitum : tanpa batas
Antikoagulan : bekerja untuk mencegah pembekuan darah; berbagai substansi yang menekan, memperlambat atau meniadakan pembekuan darah
Geoxalated : darah yang mengandung oksalat sebagai antikoagulan GOD–PAP : Glucose Oxidase - Phenol Antipirin atau Glukosa Oksidase
Phenol p-aminophenazone
1
BAB I
PENGANTAR
A. Latar Belakang
Jamu merupakan obat tradisional atau obat bahan alam yang berkembang di masyarakat Indonesia dan sebagian besar berasal dari warisan budaya masyarakat Jawa. Pengobatan tradisional Indonesia dalam bentuk jamu telah lama dikenal oleh masyarakat kita, bahkan sampai saat ini pun jamu masih dipercaya memiliki khasiat penyembuhan. Hingga kini keberadaan jamu masih tetap dipertahankan dan ditingkatkan proses pembuatannya secara modern yang dilakukan oleh perusahaan-perusahaan jamu secara berkesinambungan, baik dalam skala besar maupun kecil.
Salah satu produk jamu yang banyak beredar di Indonesia adalah jamu yang dianggap dapat menjadi obat bagi penderita diabetes. Menurut data yang dipublikasikan dalam jurnal Diabetes Care 2004, penderita diabetes di Indonesia pada tahun 2000 mencapai 8,4 juta orang dan menduduki peringkat ke-4 setelah India, Cina, dan Amerika Serikat. Jumlah tersebut diperkirakan akan meningkat lebih dari dua kalinya pada tahun 2030, yaitu menjadi 21,3 juta orang. Ini menandakan setiap tahunnya jumlah penderita diabetes akan terus meningkat, dan adanya jamu antidiabetes akan semakin dicari sebagai salah satu pengobatan alternatif.
sama. Hal ini dapat menjadi suatu keuntungan sekaligus suatu kerugian bagi masyarakat. Semakin banyaknya produk yang sejenis dalam berbagai merek yang beredar di pasaran akan membuat masyarakat mempunyai banyak pilihan. Akan tetapi produk-produk tersebut belum tentu memberikan efektivitas terapi yang sama.
Pada prakteknya, jamu memang tidak disyaratkan untuk diuji secara ilmiah, tetapi klaim khasiatnya hanya perlu dibuktikan secara empiris saja. Tetapi dengan adanya penelitian secara ilmiah, akan menjadi suatu kelebihan terhadap jamu, yaitu dapat memberikan informasi yang lebih tepat. Selain itu, hal ini juga dapat digunakan sebagai awal untuk pengembangan jamu menjadi tingkatan yang lebih baik, yaitu menjadi awal untuk dikembangkan menjadi obat herbal terstandar.
Diabetes adalah perubahan menetap dalam sistem kimiawi tubuh yang mengakibatkan kadar glukosa dalam selalu tinggi. Penyebabnya adalah kekurangan hormon insulin. Hormon adalah unsur kimia yang dibuat oleh tubuh (dalam hal ini pankreas) dan lepas ke dalam aliran darah untuk digunakan oleh bagian tubuh yang membutuhkannya. Ada orang yang sama sekali tidak dapat menghasilkan insulin seperti pada tipe 1. Namun pada tipe 2, mungkin insulin hanya diproduksi sedikit, dan respon tubuh terhadap hormon itu menurun. Ini disebut kekebalan insulin (Bilous, 2003).
memberikan informasi mengenai efektivitas terapi dari sediaan produk jamu antidiabetes “AD”. Penelitian ini juga menjadi salah satu bentuk kerjasama antara perusahaan jamu dengan institusi pendidikan khususnya fakultas farmasi.
1. Permasalahan
Masalah yang diteliti dalam penelitian ini adalah:
a. Apakah produk jamu antidiabetes “AD” memiliki efek hipoglikemik? b. Seberapa besar daya hipoglikemik produk jamu tersebut jika
dibandingkan dengan glibenklamida pada tikus putih jantan terbebani glukosa?
2. Keaslian penelitian
Sejauh penelusuran penulis, penelitian mengenai pembuktian daya hipoglikemik produk jamu antidiabetes “AD” yang berisi campuran Phellodendri cortex, Anemarrhenae rhizome, Asparagi radix, Ophiopogonis
radix, Trichosanthis radix, Puerariae radix, Glycyrrhizae radix dan Astragali
radix ini belum pernah dilakukan. Adapun penelitian yang terkait adalah:
a. Phellodendri cortex, Anemarrhenae rhizome, Trichosanthis radix, Puerariae radix dan Astragali radik telah diteliti oleh Lee, Kong, Lee dan
Kwak (1997). Dari hasil penelitian mereka diketahui bahwa bahan-bahan tersebut dapat mencegah keparahan ataupun komplikasi dari penyakit diabetes dengan cara menurunkan level kadar glukosa darah pada penderita diabetes.
Xiong (1995) terhadap 148 penderita diabetes tipe 2. Dari hasil penelitian ternyata diketahui bahwa kadar glukosa darah puasa para penderita diabetes tipe 2 tersebut telah mengalami penurunan setelah mengkonsumsi formula yang mengandung bahan-bahan di atas.
c. Ekstrak air dari Anemarrhenae radix terbukti dapat menurunkan kadar glukosa darah pada kelinci diabetes yang telah diinduksi dengan aloksan. Pada pecobaan menggunakan mencit, juga menunjukkan bahwa ekstrak yang diberikan sebanyak 0,15 g/kg i.p. pada mencit diabetes yang telah diinduksi dengan aloksan dapat memberikan penurunan kadar glukosa darah sebesar 200 mg% dalam waktu 5 jam (Anonim, 1987).
3. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat memperkaya ilmu pengetahuan dalam kefarmasian, terutama dalam bidang farmakologi.
c. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi mengenai daya hipoglikemik dari produk jamu antidiabetes “AD”.
B. Tujuan
1. Tujuan umum
Tujuan khusus
a. Mengetahui apakah produk jamu antidiabetes “AD” memiliki efek hipoglikemik
6
BAB II
PENELAAHAN PUSTAKA
A. Obat Bahan Alam Indonesia
Obat bahan alam Indonesia menurut Keputusan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia No. HK.00.05.4.2411 adalah obat bahan alam yang diproduksi di Indonesia (Anonim, 2004).
Berdasarkan cara pembuatan serta jenis klaim penggunaan dan tingkat pembuktian khasiat, obat bahan alam Indonesia dikelompokkan menjadi :
1. Jamu, yang harus memenuhi kriteria :
a. Aman sesuai dengan persyaratan yang ditetapkan b. Klaim khasiat dibuktikan berdasarkan data empiris c. Memenuhi persyaratan mutu yang berlaku
2. Obat Herbal Terstandar, yang harus memenuhi kriteria : a. Aman sesuai dengan persyaratan yang berlaku b. Klaim khasiat dibuktikan secara ilmiah/pra klinik
c. Telah dilakukan standardisasi terhadap baku yang digunakan dalam produk jadi
3. Fitofarmaka, yang harus memenuhi kriteria :
a. Aman sesuai dengan persyaratan yang ditetapkan b. Klaim khasiat harus dibuktikan berdasarkan uji klinik
d. Memenuhi persyaratan mutu yang berlaku
(Anonim, 2004) Penggunaan jamu sebagai obat yang dulunya digunakan untuk tujuan pengobatan sendiri (self-medication), kini terus dikembangkan kearah penggunaan dalam jaringan upaya pelayanan kesehatan formal sebagai bahan dan/atau perbekalan kesehatan. Perkembangan jamu kearah pelayanan formal menuntut konsekuensi yang tidak ringan mengenai khasiat dan keamanannya. Untuk itu perlu dilakukan uji klinik jamu yang pada prinsipnya uji untuk memastikan khasiat yang ditetapkan, sehingga uji klinik yang dimaksud sebenarnya adalah uji untuk mengabsahkan khasiat obat tradisional. Sebelum uji klinik, terlebih dahulu jamu tersebut harus memenuhi persyaratan uji praklinik. Terkait dengan hal tersebut, maka jamu yang akan diuji harus pula sudah pasti formulanya dan identitasnya yang jelas dengan pengulangan yang tetap (reproducible) sesuai dengan ilmu bidang kefarmasian (Hutapea, 1998).
B. Produk Jamu Antidiabetes “AD”
1. Phellodendri cortex
Merupakan bagian kulit kayu yang telah dikeringkan dari tanaman Phellodendron chinensis Schneid. dari familia Rutaceae. Dikenal dengan
nama umum Amur Cork-tree dan di Cina dikenal dengan nama Huang Bo (Anonim, 2006b).
Pada Phellodendri cortex ini memiliki kandungan senyawa Berberine, Beta-sitosterol, Guanidine, dan Manganese. Senyawa-senyawa ini
diketahui memiliki efek hipoglikemik (Duke, 2007).
2. Anemarrhenae rhizome
Merupakan bagian rhizoma dari tanaman Anemarrhena asphodeloides Bge. Tanaman ini berasal dari Cina dan Jepang dan merupakan
familia dari Liliaceae. Anemarrhenae rhizome ini di Cina dikenal dengan nama Zhimu (Anonim, 2006b).
Pada Anemarrhenae rhizome terdapat kandungan senyawa Manganese dan Nikotinic-acid yang memiliki aktivitas hipoglikemik (Duke, 2007).
3. Asparagi radix
Merupakan bagian akar dari tanaman Asparagus cochinchinensis (Lour.) Merr., dari familia Liliaceae (Tao, 2005). Nama lain dari Asparagi radix adalah Tian Dong (Anonim, 2008).
4. Ophiopogonis radix
Merupakan bagian akar dari tanaman Ophiopogon japonicus (Thunb) Ker-Gawl., dari familia Liliaceae. Mempunyai nama umum Dwarf Lilyturf Tuber dan di Cina dikenal dengan nama Mai Dong. Ophiopogonis
radix ini dapat digunakan untuk terapi bagi penderita diabetes (Anonim,
2006b).
Pada Ophiopogonis radix ini terdapat kandungan senyawa Beta-sitosterol dan Manganese yang memiliki aktivitas hipoglikemik (Duke, 2007).
5. Trichosanthis radix
Merupakan bagian akar dari tanaman Trichosanthes kirilowii Maxim (Anonim, 2006b).
Pada Trichosanthis radix terdapat kandungan senyawa Beta-sitosterol yang memiliki aktivitas hipoglikemik (Duke, 2007).
6. Puerariae radix
Merupakan bagian akar dari tanaman Pueraria lobata (Willd.) dari familia Leguminosae. Mempunyai nama umum Kudzuvine Root dan di Cina dikenal dengan nama Ge Gen. Puerariae radix dapat digunakan untuk terapi bagi penderita diabetes (Anonim, 2006b).
7. Glycyrrhizae radix
Merupakan bagian akar dari tanaman Glycyrrhiza uralensis Fisch., Glycyrrhiza inflate Bat. atau Glycyrrhiza glabra L., dari familia Leguminosae.
Mempunyai nama umum Liquorice Root dan di Cina dikenal dengan nama Gan Cao(Anonim, 2006b).
Kandungan senyawa Beta-sitosterol dan Manganese pada Glycyrrhizae radix ini memiliki aktivitas hipoglikemik (Duke, 2007).
8. Astragali radix
Merupakan bagian akar dari tanaman Astragalus membranaceus (Fisch.) Bge. Var. mongholicus (Bge.) Hsiao atau Astragalus menbrannceus (Fisch.) Bge., dari familia Leguminosae. Astragali radix dikenal dengan nama umum Milkvetch Root dan di Cina dikenal dengan nama Huang Qi (Anonim, 2006b).
Pada Astragali radix terdapat kandungan senyawa Ascorbic-acid, Beta-sitosterol, Chologenic-acid, Chromium, Coumarin, Manganese, Niacin
dan Quercetin yang memiliki efek hipoglikemik (Duke, 2007).
C. Transport Glukosa
tubuh. Glukosa yang telah diserap (diabsorpsi) oleh usus halus kemudian akan terdistribusi ke dalam semua sel tubuh melalui aliran darah (Irawan, 2007).
Glukosa di dalam tubuh selain tersimpan dalam bentuk glikogen di dalam otot dan hati, juga tersimpan pada plasma darah dalam bentuk glukosa darah (blood glucose). Di dalam tubuh glukosa berperan sebagai bahan bakar bagi proses metabolisme, dan sumber energi utama bagi kerja otak. Glukosa digunakan untuk mensintesis molekul ATP (adenosine triphosphate) melalui proses oksidasi. ATP merupakan molekul-molekul dasar penghasil energi di dalam tubuh. Dalam kebutuhan seharian, glukosa menyediakan hampir 50-75% dari total kebutuhan energi tubuh (Irawan, 2007).
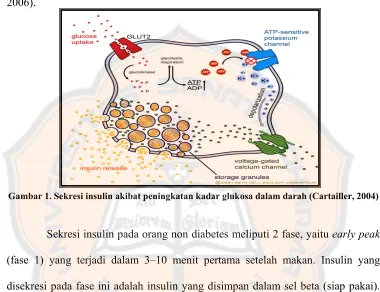
Sekresi insulin oleh sel beta tergantung oleh 3 faktor utama yaitu kadar glukosa darah, ATP-sensitive K channels dan Voltage-sensitive Calsium Channels sel beta pankreas. Mekanisme kerja faktor-faktor tersebut adalah sebagai berikut: pada keadaan puasa, kadar glukosa darah turun, ATP-sensitive K channels pada membrane sel beta akan terbuka sehingga ion kalium akan meninggalkan sel beta, dan Ca-channels tertutup, akibatnya kalsium tidak dapat masuk ke dalam sel beta, dan perangsangan sel beta untuk mensekresi insulin menurun (Merentek, 2006).
menutup terowongan kalium. Penumpukan kalium dalam sel mengakibatkan depolarisasi membran sel sehingga membuka terowongan kalsium dan kalsium akan masuk kedalam sel dan insulin akan dilepaskan ke dalam sel (Merentek, 2006).
Gambar 1. Sekresi insulin akibat peningkatan kadar glukosa dalam darah (Cartailler, 2004)
D. Diabetes Mellitus
1. Definisi
Diabetes mellitus, penyakit gula atau kencing manis adalah suatu gangguan kronis yang khususnya menyangkut metabolisme glukosa di dalam tubuh. Penyebabnya adalah kekurangan hormon insulin, yang berfungsi memanfaatkan glukosa sebagai sumber energi dan mensintesa lemak. Akibatnya ialah glukosa bertumpuk di dalam darah (hiperglikemia) dan akhirnya diekskresikan lewat kemih tanpa digunakan (glycosuria) (Tjay dan Rahardja, 2002).
2. Gejala
Gejala klasik penyakit diabetes melitus, dikenal dengan istilah trio-P, yaitu poliuria (banyak kencing), polidipsi (banyak minum), dan polifagia (banyak makan).
a. Poliuria (banyak kencing) merupakan gejala umum pada penderita diabetes melitus. Hal ini disebabkan kadar gula yang berlebihan, sehingga merangsang tubuh untuk berusaha mengeluarkannya melalui ginjal bersama air kencing. Gejala banyak kencing ini terutama menonjol pada waktu malam hari, yaitu saat kadar gula dalam darah relatif tinggi.
dalam darah belum terkontrol baik. Sehingga dengan demikian akan terjadi banyak kencing dan banyak minum.
c. Polifagia (banyak makan) merupakan gejala yang tidak menonjol. Terjadinya banyak makan ini disebabkan oleh berkurangnya cadangan gula dalam tubuh meskipun kadar gula dalam darah tinggi. Sehingga dengan demikian tubuh berusaha untuk memperoleh tambahan cadangan gula dari makanan yang diterima.
(Lanywati, 2006)
3. Klasifikasi
Pada akhir tahun 1997 American Diabetes Association (ADA) mempublikasikan suatu klasifikasi dan kriteria diagnosis yang baru. Klasifikasi yang baru ini membagi Diabetes mellitus atas empat kelompok yaitu Diabetes mellitus Tipe-1, Diabetes mellitus Tipe-2, Diabetes mellitus Bentuk Khusus, dan Diabetes mellitus Gestasional (Adam, 2000).
a. Diabetes mellitus tipe-1
yang tidak jelas (idiopatik), pada mereka ini jelas ditemukan insulinopeni tanpa petanda imun, dan mudah sekali mengalami ketoasidosis (Adam, 2000; Reasner and DeFronzo, 2006).
b. Diabetes mellitus tipe-2
Disebut juga dengan diabetes tidak tergantung insulin. Bentuk ini bervariasi, mulai yang dominan resistensi insulin defisiensi insulin relatif, sampai yang terutama defek sekresi insulin disertai resistensi insulin. Diabetes mellitus tipe-2 merupakan jenis diabetes mellitus yang paling sering ditemukan, diperkirakan sekitar 90% dari semua penderita diabetes mellitus di Indonesia. Sebagian besar diabetes mellitus tipe-2 diderita oleh orang gemuk (di negara barat sekitar 85%, di Indonesia 60%), disertai dengan resistensi insulin, dan tidak membutuhkan insulin untuk pengobatan. Sekitar 50% penderita sering tidak terdiagnosis karena hiperglikemi meningkat secara perlahan-lahan sehingga tidak memberikan keluhan (Adam, 2000).
c. Diabetes mellitus gestasional
kegemukan atau memiliki sejarah diabetes mellitus gestasi dianjurkan untuk menjalani skrining pada minggu 24-48 usia kehamilannya. Deteksi awal ini sangat penting karena dapat mengurangi angka kelahiran bayi yang abnormal, dan kematian bayi (Adam, 2000; Reasner and DeFronzo, 2006; Triplitt, Reasner, and Isley, 2005).
d. Diabetes mellitus bentuk khusus
Pada tahun 1997, The American Diabetes Association mempublikasikan klasifikasi baru dari diabetes mellitus non tipe-1 dan non tipe-2 yaitu :
1) Defek genetik fungsi sel beta
a) Chromosom 20, HNF-4alpha (formerly MODY1) b)Chromosom 7, glucokinase (formerly MODY2)
c) Dan lain-lain 2) Defek genetik insulin
a)Leprechaunism
b) Sindrom Rabson-Mendelhall c) Dan lain-lain
3) Lipoatrophic diabetes
a) Penyakit eksokrin pankreas b)Pancreatitis
c) Dan lain-lain 4) Endokrinopati
b)Pheochomocytoma
c) Dan lain-lain
5) Karena obat atau zat kimia a) Glukokortikoid
b) Diuretik Thiazid c) Dan lain-lain 6) Infeksi
a)Congential rubella
b)Cytomegalovirus
c) Dan lain-lain
7) Sebab imunologi yang jarang a) Sindrom “Stiff-man”
b) Antibodi reseptor anti-insulin
8) Sindrom genetik lain yang berkaitan dengan diabetes a)Down's syndrome
b)Turner's syndrome
(Reasner and DeFronzo, 2006; Rushakoff and Goldfine, 2006)
4. Cara dan kriteria diagnosis
Cara dan kriteria diagnosis diabetes melitus adalah sebagai berikut: a. Berdasarkan glukosa plasma vena sewaktu
menurun, glukosuria, bahkan kesadaran menurun sampai koma. Seseorang dikatakan masuk kriteria diabetes mellitus apabila kadar glukosa darah sewaktu 200 mg% (plasma vena).
b. Berdasarkan glukosa plasma vena puasa
Glukosa plasma dalam keadaan puasa dibagi atas tiga nilai, yaitu <110 mg/dl, antara >110 mg/dl sampai <126 mg/dl, dan ≥ 126 mg/dl. Kadar glukosa plasma puasa <110 mg/dl dinyatakan normal, ≥ 126 mg/dl adalah diabetes mellitus, sedangkan antara 110-126 mg/dl disebut glukosa darah puasa terganggu (GDPT). Sehingga pada mereka dengan kadar glukosa plasma vena setelah puasa sedikitnya 10 jam > 126 mg/dl sudah cukup untuk membuat diagnosis diabetes mellitus.
c. Dengan menggunakan tes toleransi glukosa oral
Apabila pada pemeriksaan glukosa darah sewaktu kadar glukosa plasma tidak normal, yaitu antara 140-200 mg/dl, maka harus dilakukan pemeriksaan tes toleransi glukosa oral untuk meyakinkan apakah diabetes mellitus atau bukan. Sesuai dengan kesepakatan WHO maka tes toleransi glukosa oral harus dilakukan dengan beban glukosa 75 g setelah berpuasa minimal 10 jam. Penilaiannya adalah sebagai berikut, toleransi glukosa normal apabila < 140 mg/dl, toleransi glukosa terganggu (TGT) apabila kadar glukosa >140 mg/dl, dan diabetes mellitus jika > 200mg/dl.
Tabel I. Nilai glukosa plasma puasa dan toleransi glukosa (Triptitt et al, 2005)
Tabel II. Diagnosis diabetes mellitus gestasional dengan pemberian glukosa oral (Triptitt et al, 2005)
5. Terapi diabetes mellitus
Dalam penanggulangan diabetes, obat hanya merupakan pelengkap dari diet. Obat hanya perlu diberikan, bila pengaturan diet secara maksimal tidak berhasil mengendalikan kadar gula darah (Handoko dan Suharto, 1995).
Penurunan berat badan merupakan tindakan yang sangat penting dalam pengendalian diabetes. Usaha penurunan berat badan harus dilakukan secara intensif terlepas dari obat apa yang diberikan (Handoko dan Suharto, 1995).
Glukosa plasma puasa
- Normal < 100 mg/dl (5,6 mmol/L)
- Glukosa plasma puasa terganggu 100 - 125 mg/dl (5,6 – 6,9 mmol/L)
- Diabetes melitus ≥ 126 mg/dl (7,0 mmol/L)
Hasil tes toleransi glukosa oral, glukosa plasma 2 jam
- Normal < 140 mg/dl (7,8 mmmol/L)
- Toleransi glukosa terganggu 140 - 200 mg/dl (7,8 - 11,1 mmol/L)
- Diabetes melitus ≥200 mg/dl (11,1 mmol/L)
Pemberian glukosa oral 100g
- Puasa ≥ 95 mg/dl (5,3 mmol/L)
- 1 jam ≥ 180 mg/dl (10 mmol/L)
- 2 jam ≥155 mg/dl (8,6 mmol/L)
- 3 jam ≥ 140 mg/dl (7,8 mmol/L)
Pemberian glukosa oral 75g
- Puasa ≥ 95 mg/dl (5,3 mmol/L)
- 1 jam ≥ 180 mg/dl (10 mmol/L)
E. Teknik Uji Diabetik dan Metode Penetapan Kadar Glukosa Darah
Pada suatu penelitian yang bertujuan untuk membuktikan khasiat suatu obat antidiabetes, hewan uji yang digunakan perlu diubah keadaannya menjadi diabetes baik DMTI maupun DMTTI. Suatu keadaan DMTI dapat dibuat secara pankreatektomi dan juga secara kimia dengan menggunakan zat kimia sebagai induktor (diabetogen) seperti aloksan, streptozosin, adrenalin, glukagon, dan EDTA yang diberikan secara parenteral. Diabetogen-diabetogen tersebut mampu menginduksi diabetes secara permanen yang ditandai dengn terjadinya hiperglikemi yang diakibatkan oleh rusaknya sel β pada pankreas. DMTTI dapat dihasilkan dengan pembebanan glukosa peroral sebagai diabetoagen pada dosis 1,75 g/kg BB hewan uji, keadaan hiperglikemi hanya berlangsung beberapa jam setelah pembebanan glukosa tersebut (Anonim, 1991).
F. Glibenklamida
Rumus struktur glibenklamida adalah sebagai berikut:
Gambar 2. Rumus struktur glibenklamida (Anonim, 1995)
Glibenklamida merupakan obat hipoglikemik oral yang digunakan secara luas di dalam pengobatan diabetes melitus tidak tergantung insulin (tipe-2). Glibenklamida merupakan sulfonilurea paling poten dan dikenal sebagai sulfonilurea ‘generasi kedua’ (Dollery, 1999).
CO Cl
OCH3
NH CH2
O2
S NH NH
Glibenklamida mempunyai aksi farmakologi yang umum seperti semua obat sulfonilurea. Efek utamanya adalah menstimulasi pelepasan insulin dengan meningkatkan fungsi sel-sel islet β pankreas. Pada terapi jangka pendek, hal ini signifikan dengan peningkatan sirkulasi konsentasi insulin, tetapi dengan penggunaan berkelanjutan biasanya terjadi penurunan kadar insulin tanpa merusak kontrol glikemik. Sebagai tambahan terdapat bukti bahwa glibenklamida mempunyai aksi pada jaringan perifer. Sulfonilurea menunjukkan peningkatan sintesis glikogen dan penghambatan glikogenolisis dan glukoneogenesis pada hati. Pada subyek normal puasa, peningkatan konsentrasi insulin dalam plasma dan penurunan glukosa plasma terjadi 15-60 menit setelah pemberian glibenklamida oral dan mencapai maksimum setelah 1-2 jam sebelum kembali ke nilai dasar setelah 3 jam (Dollery, 1999).
G. Metode Penetapan Kadar Glukosa Darah
Secara umum menurut Widowati, Dzulkarnain dan Sa’roni (1997) metode penentuan glukosa darah dapat ditentukan dengan beberapa cara yaitu: 1. metode kondensasi dengan gugus amina
Prinsip: aldosa dikondensasikan dengan orto-toluidin dalam suasana asam dan menghasilkan larutan berwarna hijau setelah dipanaskan. Kadar glukosa darah dapat ditentukan sesuai dengan intensitas warna yang terjadi diukur secara spektrofotometri.
2. metode enzimatik
Glukosa dapat ditentukan secara enzimatik, dengan menggunakan enzim glukosa oksidase (GOD). Dengan adanya glukosa oksidase, maka glukosa dioksidasi oleh udara (O2) menjadi asam glukuronat disertai pembentukan hidrogen peroksida. Dengan adanya enzim peroksidase (POD), H2O2 akan membebaskan O2 yang mengoksidasi akseptor kromogen yang sesuai serta memberikan warna merah. Akseptor kromogennya dapat berupa senyawa aminoantipirin dan fenol atau orthodianisidin, kadar glukosa darah ditentukan berdasarkan intensitas warna yang terjadi, diukur secara spektrofotometri.
3. metode oksidasi-reduksi
H. Spektrofotometri
Spektrofotometri UV-Vis adalah salah satu teknik analisis fisika-kimia yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik pada panjang gelombang 190 – 380 nm (UV) dan 380 – 780 nm (Vis) dengan memakai instrumen spektrofotometer (Mulja dan Suharman, 1995). Prinsip kerja spektrofotometri adalah berdasarkan atas interaksi antara radiasi elektromagnetik dengan materi. Materi dapat berupa atom, ion, atau molekul, sedang radiasi elektromagnetik merupakan salah satu jenis energi yang ditransmisikan dalam ruang dengan kecepatan tinggi (Khopkar, 1990). Interaksi antara molekul yang mempunyai gugus kromofor dan radiasi elektromagnetik pada daerah sinar ultraviolet dan sinar tampak (200-800 nm) akan menghasilkan spektra serapan elektronik. Spektra serapan ini dapat digunakan untuk analisis kuantitatif karena jumlah radiasi elektromagnetik yang diserap ada hubungannya dengan jumlah molekul penyerap (Skoog, 1985).
Panjang gelombang dimana terjadi eksitasi elektronik yang memberikan serapan maksimum disebut sebagai panjang gelombang serapan maksimum. Penentuan panjang gelombang pada saat serapan maksimum dapat digunakan untuk mengidentifikasi molekul (Mulja dan Suharman, 1995). Pada analisis kuantitatif, pengukuran serapan dilakukan pada panjang gelombang saat serapan maksimum, disebabkan dua alasan:
• Pada pita maksimum, perubahan yang kecil pada panjang gelombang akan memberikan perubahan serapan yang minimal (kecuali kalau pita absorpsi sangat tajam). Dengan demikian kesalahan kecil dalam meletakan tanda pemilih panjang gelombang pada instrumen tidak akan mengakibatkan kesalahan besar pada pengukuran serapan (Fatah, 1989).
I. Landasan Teori
Produk jamu antidiabetes “AD” yang memiliki komposisi Phellodendri cortex, Anemarrhenae rhizome, Asparagi radix, Ophiopogonis radix,
Trichosanthis radix, Puerariae radix, Astragali radix, Glycyrrhizae radix ini
sebenarnya dibuat berdasarkan campuran ramuan tradisional dari Cina (TCM/Traditional Chinese Medicine) yang dipercaya dan telah terbukti baik di Cina sendiri maupun dunia internasional sebagai terapi bagi penderita diabetes.
Berdasarkan penelitian yang dilakukan oleh Lee dkk (1997) Phellodendri cortex, Anemarrhenae rhizome, Trichosanthis radix, Puerariae radix dan
Astragali radix telah terbukti dapat mencegah keparahan ataupun komplikasi dari
Uji klinik terhadap suatu formula yang mengandung bahan Glycyrrhizae radix, Ophiopogonis radix dan Astragali radix telah dilakukan oleh Xiong (1995)
terhadap 148 penderita diabetes tipe 2. Dari hasil penelitian ternyata diketahui bahwa kadar glukosa darah puasa para penderita diabetes tipe 2 tersebut telah mengalami penurunan setelah mengkonsumsi formula yang mengandung bahan-bahan di atas.
Ekstrak air dari Anemarrhenae radix juga telah terbukti dapat menurunkan kadar glukosa darah pada kelinci diabetes yang telah diinduksi dengan aloksan. Pada pecobaan menggunakan mencit, juga menunjukkan bahwa ekstrak yang diberikan sebanyak 0,15 g/kg i.p. pada mencit diabetes yang telah diinduksi dengan aloksan dapat memberikan penurunan kadar glukosa darah sebesar 200 mg% dalam waktu 5 jam (Anonim, 1987).
Hampir pada semua bahan-bahan dari produk jamu antidiabetes “AD” tersebut memiliki kandungan senyawa Beta-sitosterol, yang memiliki efek hipoglikemik (Duke, 2007). Efek hipoglikemik dari Beta-sitosterol ini telah terbukti dalam penelitian yang dilakukan Ivorra, Paya dan Villar (1990), dimana Beta-sitosterol dapat meningkatkan sekresi insulin.
J. Hipotesis
26
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis penelitian yang dilakukan termasuk jenis penelitian eksperimental murni dan dikerjakan mengikuti rancangan acak lengkap pola searah. Penelitian ini dilakukan di Laboratorium Farmakokinetika–Biofarmasetika Fakultas Farmasi Universitas Sanata Dharma.
B. Variabel dan Definisi Operasional
1. Variabel utama
a. Variabel bebas
Variabel bebas dalam penelitian ini adalah variasi dosis dari produk jamu antidiabetes “AD”.
b. Variabel tergantung
Variabel tergantung dalam penelitian ini adalah kadar glukosa dalam darah yang diperoleh dari pengukuran absorbansi pada rentang waktu mulai menit ke-0 sampai menit ke-300 dan dihitung menggunakan metode trapezoid (LDDK0-300).
2. Variabel pengacau terkendali
d. Berat badan subyek uji : antara 175 – 200 gram e. Umur subyek uji : antara 2 – 3 bulan f. Cara Pemberian : peroral
3. Variabel pengacau tak terkendali
a. Keadaan patologi subyek uji
C. Bahan dan Alat Penelitian
1. Bahan penelitian
a. hewan uji
Tikus putih jantan galur Wistar, umur 2 - 3 bulan, berat badan 175-200 gram, dari Laboratorium Farmakologi Fakultas Farmasi Universitas Sanata Dharma.
b. bahan uji
Produk jamu antidiabetes “AD” yang diperoleh dari industri obat tradisional Sari Sehat.
c. senyawa pembanding
Senyawa pembanding berupa kaplet generik glibenklamida yang diproduksi oleh PT. Indofarma.
d. pereaksi untuk pengukuran kadar glukosa darah
Tabel III. Isi pereaksi enzim Glucose GOD-PAP
e. lain-lain
1) sodium oksalat p.a 2 mg/ml darah sebagai antikoagulan (Cooper and McDaniel, 1966), pada waktu pengambilan darah
2) glukosa monohidrat p.a (Merck) sebagai larutan untuk uji toleransi glukosa oral
3) asam benzoat p.a 0,1% b/v, sebagai pelarut glukosa monohidrat 4) CMC-Na 1% b/v sebagai pelarut glibenklamida
5) aquades yang diperoleh dari Laboratorium Farmakologi Fakultas Farmasi Universitas Sanata Dharma
2. Alat penelitian
a. seperangkat alat gelas (pyrex) b. jarum suntik peroral
c. mikropipet (Biohit PLC 10-100 μl, Finland) d. microtube
e. sentrifuge (Hettich EBA 8S, Germany)
f. spektrometer UV/VIS (Optima®SP300, Japan) g. kuvet
h. vortex (Janke-Kankel IKA®-Labortechnik)
i. neraca elektrik (Mettler Toledo AB204, Switzerland)
Reagen:
Phosphate buffer pH 7,5 250 mmol/l
Phenol 5 mmol/l
4-aminoantipyrine 0,5 mmol/l
Glukosa oksidase (GOD) ≥ 10 kU/l
D. Jalannya Penelitian
1. Pembuatan dosis jamu
Pemakaian jamu ini dari industrinya dibuat untuk pemakaian manusia Indonesia dengan berat rata-rata, yaitu seberat 50 kg. Aturan pakainya adalah sebagai berikut, 1 bungkus jamu (15 gram serbuk jamu) diseduh dengan 1 gelas air panas (200 ml), kemudian seduhan jamu tersebut disaring sehingga didapat jernihannya saja. Hasil saring inilah yang kemudian diminum. Berdasarkan aturan jamu tersebut maka pembuatan dosis jamu dapat dilihat pada gambar 3.
Dosis awal pada manusia 50 kg adalah 15 gram jamu diseduh dengan 200 ml air
panas ↓
Agar dapat dikonversikan ke pemberian pada tikus maka dosis jamu harus dikonversikan terlebih dahulu pada pemberian manusia 70 kg
↓
15 gram/50 kg BB → 21 gram/70 kg BB ↓
21 gram serbuk jamu diseduh dengan 200 ml air panas, kemudian hasil air
seduhan disaring ↓
Hasil saring dari seduhan inilah kemudian dikonversikan pada tikus 200 gram.
Hasil inilah sebagai dosis pemberian pada tikus
Gambar 3. Bagan alur pembuatan dosis jamu
Dosis jamu nantinya akan dibuat menjadi 3 peringkat, yang berdasarkan :
sebanyak 200 ml, kemudian disaring sehingga didapat hasil saringan sebanyak 180 ml. Dosis pada manusia adalah 180 ml/70 kg BB, kemudian dosis ini dikonversikan pada pemberian tikus 200 gram, dengan faktor konversi 0,018.
180 ml x 0,018 = 3,24 ml/200 gram BB.
Berdasarkan perhitungan maka besarnya dosis jamu peringkat I pada hewan uji tikus yaitu 16,2 ml/kg BB.
b. Peringkat II adalah 1 kali dosis penggunaan pada manusia 50 kg, yaitu 15 gram untuk manusia 50 kg, dikonversi menjadi 21 gram untuk manusia 70 kg. Kemudian 21 gram serbuk jamu tersebut diseduh dengan aquades panas sebanyak 200 ml, kemudian disaring sehingga didapat hasil saringan sebanyak 140 ml. Dosis pada manusia adalah 140 ml/70 kg BB, kemudian dosis ini dikonversikan pada pemberian tikus 200 gram, dengan faktor konversi 0,018.
140 ml x 0,018 = 2,52 ml/200 gram BB.
Berdasarkan perhitungan maka besarnya dosis jamu peringkat II pada hewan uji tikus yaitu 12,6 ml/kg BB.
dosis ini dikonversikan pada pemberian tikus 200 gram, dengan faktor konversi 0,018.
76 ml x 0,018 = 1,368 ml/200 gram BB.
Berdasarkan perhitungan maka besarnya dosis jamu peringkat III pada hewan uji tikus yaitu 6,84 ml/kg BB.
Dikarenakan keterbatasan volume pemberian untuk tikus tidak boleh melebihi 5 ml (volume maksimum). Maka, 3 larutan yang akan diberikan kepada tikus secara peroral, yaitu glibenklamida, larutan jamu dan larutan glukosa, harus disesuaikan sesuai dengan pemberian volume maksimal pada tikus.
2. Preparasi bahan
a. Pembuatan larutan asam benzoat p.a. 0,1% b/v
Serbuk asam benzoat p.a. ditimbang seksama sebanyak 0,50 gram dan dilarutkan dengan aquades panas dalam labu takar 500 ml sampai tanda. b. Pembuatan larutan stok glukosa p.a. 10 mg/ml
Glukosa monohidrat p.a. ditimbang seksama sebanyak 0,50 gram dan dilarutkan dengan asam benzoat 0,1% b/v dalam labu takar 50 ml sampai tanda.
c. Pembuatan larutan CMC-Na 1% b/v
d. Sodium oksalat p.a. 2% b/v
Sodium oksalat p.a. ditimbang sebanyak 1000 mg dan dilarutkan dengan aquades dalam labu takar 50 ml sampai tanda.
e. Penentuan keseragaman bobot kaplet glibenklamida
Penentuan keseragaman bobot kaplet glibenklamida mengacu pada Farmakope Indonesia III. Timbang 20 tablet, hitung bobot tablet. Jika ditimbang satu-satu, tidak boleh lebih dari 2 tablet yang masing-masing bobotnya menyimpang dari bobot rata-ratanya lebih besar dari harga yang ditetapkan kolom A, dan tidak ada satu tablet yang menyimpang dari bobot rata-ratanya lebih dari harga yang ditetapkan kolom B. Nilai penyimpangan bobot rata-rata kolom A dan B dapat dilihat pada tabel IV.
Tabel IV. Keseragaman bobot tablet
f. Penentuan dosis glibenklamida
Dosis glibenklamida yaitu 5 mg pada manusia dengan berat badan 70 kg, dikonversikan ke tikus 200 gram dengan faktor konversi 0,018
5 mg glibenklamida x 0,018 = 0,09 mg glibenklamida/ 200 gram = 0,45 mg glibenklamida/ kg BB Berdasarkan perhitungan maka besarnya dosis glibenklamida pada hewan uji tikus yaitu 0,45 mg/ kg BB.
Bobot rata-rata Penyimpangan bobot rata-rata dalam %
A B
25 mg atau kurang 15% 30%
26 mg sampai dengan 150 mg 10% 20%
151 mg sampai dengan 300 mg 7,5% 15%
g. Penetapan konsentrasi pemberian suspensi glibenklamida pada hewan uji Melihat keterbatasan volume pemberian untuk tikus maka perlu diadakan penetapan konsentrasi glibenklamida agar total volume pemberian zat uji tidak melebihi 5 ml (volume maksimum). Pada penelitian ini, hewan uji akan diberi 3 zat berupa glibenklamida, sediaan jamu, dan larutan glukosa secara per oral.
Volume pemberian glibenklamida ditetapkan sebesar 0,8 ml sehingga diperoleh konsentrasi sebagai berikut :
C = 0,09 mg/0,8 ml C = 0,1125 mg/ml
h. Pembuatan suspensi glibenklamida 0,1125 mg/ml
Timbang serbuk glibenklamida setara dengan 25 mg glibenklamida murni, larutkan dengan larutan CMC-Na 1% dalam labu takar 10 ml sampai tanda sebagai larutan induk glibenklamida. Buat dengan konsentrasi 0,1125 mg/ml dalam labu ukur 10 ml dari larutan induk glibenklamida tersebut. Pembuatan suspensi glibenklamida menggunakan CMC-Na sebagai pelarutnya dikarenakan menurut Farmakope Indonesia IV, kelarutan serbuk glibenklamida adalah praktis tidak larut dalam air.
) (C i Konsentras
BeratBadan Dosis
volume= ×
C
kgBB kgBB
mg
ml 0,45 / 0,200 8
,
i. Penetapan konsentrasi larutan glukosa monohidrat 1,75 g/kg BB
Melihat keterbatasan volume pemberian untuk tikus maka perlu diadakan penetapan konsentrasi larutan glukosa, agar total volume pemberian zat uji tidak melebihi 5 ml (volume maksimum).
Volume pemberian glukosa dapat dibuat seminimal mungkin sehingga ditetapkan konsentrasi glukosa sebesar 20%. Dengan demikian volume maksimum untuk tikus 200 gram adalah :
ml
3. Percobaan pendahuluan
a. Penetapan waktu resapan stabil glukosa murni
Sejumlah 25,00 μl larutan glukosa standar direaksikan dengan 2,5 ml pereaksi GOD-PAP. Campuran larutan tersebut kemudian divortex dan segera diukur resapannya pada panjang gelombang 500 nm (sesuai dengan yang tertulis dalam leaflet Glucose GOD FS*) selama 60 menit. Waktu resapan stabil yang digunakan adalah waktu inkubasi yang memberikan resapan stabil.
b. Penetapan panjang gelombang maksimum
Sejumlah 25,00 μl larutan glukosa standar direaksikan dengan 2,5 ml pereaksi GOD-PAP. Campuran larutan tersebut kemudian divortex dan diukur pada rentang panjang gelombang 400 - 600 nm.
c. Pembuatan kurva baku
Dipipet sejumlah 0,75 ml; 1,00 ml; 1,50 ml; 2,00 ml; dan 2,25 ml larutan glukosa monohidrat 1% b/v. Penetapan kadar glukosa darah dilakukan seperti pada penetapan kadar glukosa darah dengan metode GOD-PAP. Resapan diukur secara spektrofotometri pada panjang gelombang maksimum.
d. Penetapan waktu pemberian glibenklamida
Tujuan dari penetapan pemberian glibenklamida adalah untuk melihat pengaruh waktu pemberian terhadap efek hipoglikemik glibenklamida, agar pada saat uji toleransi glukosa oral (UTGO) glibenklamida sudah memberikan efek penurunan kadar glukosa darah. Orientasi ini menggunakan 12 ekor tikus yang terbagi dalam 3 kelompok. Tiap kelompok terdiri dari 4 ekor tikus, dimana masing-masing kelompok diberi perlakuan, yaitu 2 tikus sebagai perlakuan kontrol positif (glibenklamida) dan 2 tikus sebagai perlakuan kontrol negatif (CMC-Na 1%). Perlakuan tersebut dilakukan terhadap masing-masing kelompok yaitu pada menit 15 sebelum UTGO untuk kelompok kesatu, menit ke-30 sebelum UTGO untuk kelompok kedua, dan menit ke-45 sebelum UTGO untuk kelompok ketiga.
setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan harga LDDK0-300.
e. Penetapan waktu pemberian produk jamu antidiabetes “AD”
Penetapan waktu pemberian produk jamu antidiabetes “AD” digunakan untuk melihat pengaruh waktu pemberian terhadap efek penurunan kadar glukosa darah, agar pada saat dilakukan UTGO, produk jamu antidiabetes “AD” sudah memberikan efek dalam menurunkan kadar glukosa darah. Orientasi ini menggunakan 6 ekor tikus yang dibagi menjadi 3 kelompok, masing-masing kelompok diberi sediaan produk jamu antidiabetes “AD” pada menit ke-15, 30, dan 45 sebelum UTGO.
Semua pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa monohidrat 20% b/v; 1,75 g/kg BB. Pengambilan cuplikan darah dilakukan sesaat sebelum perlakuan sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 120, 180, 240, dan 300 setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan harga LDDK0-300. Penentuan waktu pemberian produk jamu antidiabetes “AD” didasarkan pada harga LDDK0-300 terendah.
f. Pengelompokan dan perlakuan hewan uji
yang sama, jauh dari kebisingan dan dihindarkan dari stress. Sebelum mendapat perlakuan, masing-masing kelompok dipuasakan selama 18 jam dengan tetap diberi minum ad libitum, lalu diberi perlakuan sebagai berikut:
Kelompok I : aquades 12,5 ml/ kg BB (kontrol negatif) Kelompok II : larutan CMC-Na 1% (kontrol negatif)
Kelompok III : suspensi glibenklamida 0,45 mg/kg BB (kontrol positif) Kelompok IV : produk jamu antidiabetes “AD” peringkat dosis I Kelompok V : produk jamu antidiabetes “AD” peringkat dosis II Kelompok VI : produk jamu antidiabetes “AD” peringkat dosis III
Semua pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa monohidrat 20% b/v; 1,75 g/kg BB. Pengambilan cuplikan darah dilakukan sesaat sebelum UTGO sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 120, 180, 240, dan 300 setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan harga LDDK0-300.
4. Penetapan kadar glukosa darah
240, dan 300 setelah UTGO. Kemudian darah geoxalated ini dipusingkan 3000 rpm selama 10 menit. Selanjutnya diambil 0,025 ml plasma darah, kemudian dilakukan pengukuran sebagai berikut:
Tabel V. Volume pengukuran kadar glukosa darah
Bahan Sampel (ml) Standar (ml) Blangko (ml) Supernatan
Larutan baku glukosa Asam benzoat 1% b/v Bahan-bahan tersebut dicampur dan diinkubasi selama operating time. Kemudian kadar glukosa darah ditetapkan secara spektrofotometri visibel menggunakan metode GOD-PAP. Resapan diukur pada panjang gelombang maksimum. Kemudian kadar glukosa darah dihitung dengan rumus:
Kadar glukosa = (As / Ast) x 100 mg%
Keterangan : As = resapan sampel Ast = resapan standar Selanjutnya dibuat kurva dengan mem-plot-kan nilai kadar glukosa darah lawan waktu ke-0 sampai menit ke 300 dengan metode trapezoid (LDDK0-300) dan rumus yang digunakan adalah sebagai berikut:
LDDK
to-tn=
t1 – t
ox (C
o+ C
1) +
t
2– t
1x (C
2+ C
1) +
E. Analisis Hasil
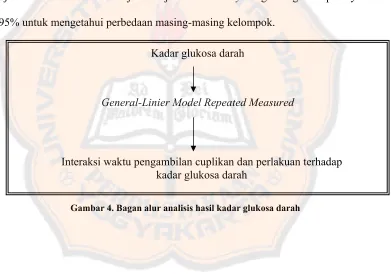
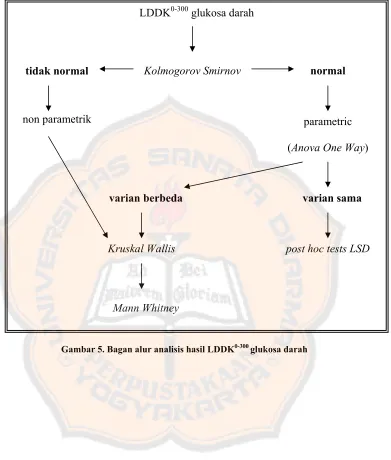
Data kadar glukosa darah pada tiap kelompok dianalisis secara statistik menggunakan metode General-Linier Model Repeated Measured. Hasil data LDDK0-300 glukosa darah dilakukan uji distribusi menggunakan uji Kolmogorov Smirnov, kemudian jika distribusinya normal maka dapat dilanjutkan dengan uji ANOVA One Way dan post hoc tests LSD dengan tingkat kepercayaan 95%. Jika
nilai LDDK0-300 glukosa darah mempunyai variansi yang berbedamaka dilakukan uji Kruskal Wallis dan dilanjutkan uji Mann Whitney dengan tingkat kepercayaan 95% untuk mengetahui perbedaan masing-masing kelompok.
Gambar 4. Bagan alur analisis hasil kadar glukosa darah Kadar glukosa darah
General-Linier Model Repeated Measured
Gambar 5. Bagan alur analisis hasil LDDK0-300 glukosa darah
Gambar 5. Bagan alur analisis hasil LDDK0-300 glukosa darah LDDK0-300 glukosa darah
Kolmogorov Smirnov normal tidak normal
non parametrik
varian berbeda
Kruskal Wallis
Mann Whitney
parametric (Anova One Way)
varian sama
41
BAB IV
HASIL DAN PEMBAHASAN
A. Percobaan Pendahuluan
1. Waktu resapan stabil glukosa
Reaksi antara glukosa dan reagen GOD-PAP merupakan reaksi enzimatis yang menghasilkan senyawa berwarna. Oleh karena itu perlu dilakukan uji stabilitas glukosa untuk mengetahui operating time (OT) dari reaksi tersebut. Penentuan operating time bertujuan untuk mengetahui waktu resapan saat senyawa berwarna yang terbentuk memberikan resapan yang stabil pada pengukuran menggunakan spekrofotometri visible. Pengukuran dilakukan pada panjang gelombang 500 nm (sesuai pada leaflet enzim GOD-PAP) selama 60 menit.
H O H
asam glukonat hidrogen
peroksida
4 amino-antipirin (berwarna merah muda)kuinonimin
Gambar 6. Reaksi enzimatik antara glukosa dan reagen GOD-PAP (DiaSys, 2007)
Data penetapan waktu resapan stabil larutan glukosa standar 100 mg/dl tampak dalam tabel berikut:
Tabel VI. Data hasil penetapan waktu resapan stabil larutan glukosa standar
Waktu (menit) Resapan
5 0,336
Waktu (menit) Resapan
Grafik hubungan resapan glukosa murni dengan waktu inkubasi seperti berikut:
Gambar 7. Grafik hubungan resapan stabil glukosa standar
Dari gambar grafik di atas dapat dilihat bahwa pada menit ke-15 sampai menit ke-30 memberikan grafik yang relatif datar, artinya pada menit tersebut terjadi reaksi yang stabil dan sempurna antara glukosa murni dengan pereaksi GOD-PAP. Hal ini berarti penetapan kadar glukosa darah dapat dilakukan pada menit ke lima belas sampai dengan menit ke tiga puluh setelah pemberian pereaksi GOD-PAP.
2. Penetapan panjang gelombang maksimum
Penetapan ini perlu dilakukan dikarenakan instrumen ukur (spektrofotometer visibel) serta kondisi yang digunakan dalam penelitian ini berbeda dengan instrumen yang digunakan oleh DiaSys. Oleh karena itu perlu dilakukan pengujian untuk mengetahui besar panjang gelombang yang
Grafik Waktu Resapan Stabil Glukosa
0,1 0,2 0,3 0,4 0,5 0,6
5 10 15 20 25 30 35 40 45 50 55 60
memberi resapan yang maksimum. Penetapan panjang gelombang maksimum diukur pada rentang panjang gelombang 400 - 600 nm.
Gambar 8. Kurva panjang gelombang resapan maksimum glukosa standar
Berdasarkan gambar di atas dapat kita lihat bahwa resapan maksimum glukosa standar pada konsentrasi 100 mg/dl dan 50 mg/dl, sama-sama terjadi pada panjang gelombang 502 nm. Pada leaflet DiaSys tertera bahwa panjang gelombang saat resapan maksimum terjadi pada panjang gelombang 500 nm. Perbedaan panjang gelombang ini dapat terjadi, dikarenakan instrumentasi yang digunakan belum tentu sama. Oleh karena itu
Panjang Gelombang Maksimum Glukosa Standar
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4
400 420 440 460 470 480 490 496 498 500 502 504 506 508 510 520 530 550 570 590 600
Panjang Gelombang Absorbansi
pada pengukuran kadar glukosa pada percobaan ini dilakukan pada panjang gelombang 502 nm.
3. Pembuatan kurva baku
Pada penelitian ini penetapan kadar glukosa darah dilakukan secara spektrofotometri sehingga harus memenuhi persyaratan hukum Lambert-Beer. Hukum Lambert-Beer menjelaskan bahwa resapan akan meningkat seiring dengan meningkatnya kadar. Oleh karena itu perlu dilakukan pembuatan kurva baku untuk menunjukkan bahwa penetapan kadar glukosa darah secara spektrofotometri ini telah memenuhi hukum Lambert-Beer, yaitu resapan akan meningkat seiring dengan meningkatnya kadar glukosa.
Pembuatan kurva baku menggunakan larutan glukosa monohidrat 10 mg/ml sebagai larutan stock glukosa. Pelarut yang digunakan adalah asam benzoat dengan tujuan untuk mengawetkan glukosa selama kurun waktu tertentu. Pengawetan ini disebabkan karena glukosa merupakan komponen penyusun mikroorganisme dan media yang baik untuk pertumbuhan mikroorganisme sehingga penggunaan asam benzoat ini diharapkan dapat meminimalkan faktor-faktor yang dapat mengganggu penetapan kadar glukosa darah.
Dari hasil pengukuran resapan larutan glukosa standar pada panjang gelombang 502 nm diperoleh data sebagai berikut:
Tabel VII. Hubungan kadar dan resapan glukosa pada λ 502 nm
Kadar (mg/dl) Resapan Persamaan Regresi Linear
75,37 100,49 150,74 200,98 226,11
0,266 0,343 0,478 0,668 0,717
A = 0,03217 B = 0,00306 r = 0,9976
y = 0,00306x + 0,03217
Dari tabel 7 di atas terlihat bahwa harga koefisien regresi hubungan kadar dan resapan glukosa pada λ 502 nm mendekati ±1, dan setelah dibandingkan dengan r tabel dengan taraf kepercayaan 95% dengan df3 (df: degree of freedom, yaitu jumlah sampel dikurangi dua) didapat bahwa r tabel sebesar
0,878. Dapat dilihat bahwa harga r hitung lebih besar dari r tabel. Hal ini berarti bahwa persamaan kurva baku tersebut memiliki linieritas yang baik.
5. Penetapan waktu pemberian hasil saring seduhan produk jamu antidiabetes “AD”
Waktu pemberian hasil saring seduhan produk jamu antidiabetes “AD” didasarkan pada prosentase penurunan harga luas daerah di daerah kurva dari menit ke-0 sampai menit ke-300 (LDDK0-300). Penetapan waktu pemberian ini menggunakan dosis 12,6 ml/kg BB dari penyeduhan serbuk jamu sebanyak 21 gram/200 ml. Hasil UTGO dan perhitungan prosentase selisih LDDK0-300 teringkas pada tabel berikut:
Tabel IX. Hasil UTGO dan LDDK0-300produk jamu antidiabetes “AD”
Waktu pemberian produk jamu antidiabetes “AD” sebelum UTGO
(menit ke-)
LDDK0-300 (mg.menit /dl)
15 35797,005
30 28881,285
45 33674,949
penyeduhan serbuk jamu sebanyak 7 gram/200 ml, kelompok II diberi hasil saring seduhan produk jamu antidiabetes dosis 12,6 ml/kg BB dari penyeduhan serbuk jamu sebanyak 21 gram/200 ml dan hasil saring seduhan produk jamu antidiabetes dosis 6,84 ml/kg BB dari penyeduhan serbuk jamu sebanyak 63 gram/200 ml.
Tabel X. Data kadar glukosa darah rata-rata serta LDDK0-300 tikus putih jantan pada setiap kelompok perlakuan
Keterangan :
Kontrol Negatif : aquades dan larutan CMC-Na 1% b/v
Kontrol Positif : glibenklamida dosis 0,45 mg/kg BB
Jamu Dosis I : hasil saring seduhan produk jamu antidiabetes “AD” dosis 16,2 ml/kg BB dari penyeduhan serbuk jamu sebanyak 7 gram/200 ml
Jamu Dosis II : hasil saring seduhan produk jamu antidiabetes “AD” dosis 12,6 ml/kg BB dari penyeduhan serbuk jamu sebanyak 21 gram/200 ml
Jamu Dosis III : hasil saring seduhan produk jamu antidiabetes “AD” dosis 6,84 ml/kg BB dari penyeduhan serbuk jamu sebanyak 63 gram/200 ml
Kelompok
160,288 127,354 159,251 151,083 134,905 121,897
30 164,160 129,357 195,821 148,178 128,830 128,434
45
138,408 105,815 189,402 139,329 119,783 119,651
60 129,128 73,570 176,109 138,471 114,303 116,152
Selanjutnya grafik hubungan antara kadar glukosa darah dan waktu sampling dari tiap-tiap kelompok perlakuan yaitu aquades, larutan CMC-Na 1%b/v, suspensi glibenklamida dan hasil saring seduhan produk jamu antidiabetes “AD”:
Gambar 12. Kurva hubungan antara waktu sampling dan kadar rata-rata glukosa darah tikus terbebani glukosa akibat pemberian hasil saring seduhan produk jamu
antidiabetes “AD”
Keterangan :
Kontrol Negatif : aquades dan larutan CMC-Na 1% b/v
Kontrol Positif : glibenklamida dosis 0,45 mg/kg BB
Jamu Dosis I : hasil saring seduhan produk jamu antidiabetes “AD” dosis 16,2 ml/kg BB dari penyeduhan serbuk jamu sebanyak 7 gram/200 ml
Jamu Dosis II : hasil saring seduhan produk jamu antidiabetes “AD” dosis 12,6 ml/kg BB dari penyeduhan serbuk jamu sebanyak 21 gram/200 ml
Jamu Dosis III : hasil saring seduhan produk jamu antidiabetes “AD” dosis 6,84 ml/kg BB dari penyeduhan serbuk jamu sebanyak 63 gram/200 ml
Gambar 12 tersebut memaparkan respon kadar glukosa darah hewan uji akibat pembebanan glukosa saat UTGO pada berbagai perlakuan. Pada kontrol
0 50 100 150 200 250
0 15 30 45 60 90 120 180 240 300
Kadar glukosa darah
(mg/dl)
Menit
Grafik Perbandingan Kadar Glukosa Darah VS Menit tiap Perlakuan
negatif menunjukkan rata-rata kadar glukosa paling tinggi dibandingkan perlakuan yang lain. Hal ini dikarenakan pada kontrol negatif, tikus hanya diberi aquades yang tidak memiliki efek terapetik, sehingga kadar glukosa darah ditentukan oleh kemampuan tubuh tikus untuk menurunkan kadar glukosa, akibatnya kelompok kontrol negatif memberikan rata-rata kadar glukosa paling tinggi jika dibandingkan dengan kelompok perlakuan yang lain.
Hasil percobaan menunjukkan bahwa pada kadar glukosa darah mencapai maksimum pada menit ke-30 sampai menit ke-45, kemudian kadar glukosa darah menurun kembali setelah dua sampai tiga jam setelah pemberian glukosa oral. Hal ini sesuai dengan teori menurut Harper, Rodwell dan Mayes (1979) dimana kadar glukosa darah pada individu normal meningkat dalam satu jam setelah pemberian glukosa oral. Absorpsi glukosa menjadi normal kembali setelah dua sampai tiga jam setelah pemberian glukosa. Ini berarti tubuh hewan uji tersebut dalam keadaan sehat karena masih dapat mentoleransi pembebanan glukosa UTGO pada tingkat normal.
Kontrol positif memberikan rata-rata kadar glukosa yang paling rendah diantara kelompok perlakuan lainnya. Hal ini disebabkan pada kontrol positif diberi perlakuan suspensi glibenklamida yang merupakan obat hipoglikemik oral golongan sulfonilurea yang memiliki efek terapetik menurunkan kadar glukosa darah.
yang paling tinggi dibandingkan perlakuan lainnya. Hal ini terlihat dari harga LDDK0-300 kelompok perlakuan tersebut paling mendekati harga LDDK0-300 kontrol positif. Urutan penurunan kadar glukosa dari yang paling besar adalah kelompok perlakuan jamu dosis III (hasil saring seduhan produk jamu antidiabetes dosis 6,84 ml/kg BB dari penyeduhan serbuk jamu sebanyak 63 gram/200 ml), kelompok perlakuan jamu dosis II (hasil saring seduhan produk jamu antidiabetes dosis 12,6 ml/kg BB dari penyeduhan serbuk jamu sebanyak 21 gram/200 ml) dan kelompok perlakuan jamu dosis I (hasil saring seduhan produk jamu antidiabetes dosis 16,2 ml/kg BB dari penyeduhan serbuk jamu sebanyak 7 gram/200 ml).
Untuk keperluan data tambahan, dari hasil tersebut (Gambar 12) juga diuji statistik pada tiap waktu pengambilan cuplikan antar perlakuan. Pengujian ini dilakukan untuk melihat pada menit keberapa, kadar glukosa darah antar perlakuan mulai menunjukkan perbedaan bermakna, khususnya perbedaan antara perlakuan jamu dengan kontrol negatifnya (aquades). Dari hasil, didapat bahwa pada menit ke-0 hingga menit ke-30 belum menunjukkan adanya perbedaan yang bermakna. Adanya perbedaan yang bermakna antara kontrol negatif aquades dengan perlakuan jamu mulai terlihat pada menit ke-45.
apabila p>0,05. Hasil analisis dapat dilihat pada lampiran 7 dan teringkas pada tabel XI.
Tabel XI. Hasil analisis GLM Repeated Measure kadar glukosa darah tikus terbebani glukosa dan diberi perlakuan produk jamu antidiabetes “AD”
Subyek variasi Jumlah kuadrat Db Rata-rata
kuadrat F p
Tes antar subyek
- Periode (waktu) 97997,365 9 10888,596 52,963 0.000BB
- Periode perlakuan 32833,390 45 729,631 3,549 0.000BB
Di antara subyek
- Perlakuan (dosis) 159659,098 5 31931,820 40,900 0.000BB
Keterangan : BB = berbeda bermakna (p < 0.05) TB = berbeda tidak bermakna (p > 0.05)
Pada tabel XI. dapat kita lihat adanya perbedaan yang bermakna (p < 0.05) antara purata kadar glukosa darah hewan uji yang dipengaruhi oleh periode waktu (p=0.000). Hal ini menunjukkan bahwa secara statistik terjadi perbedaan kadar glukosa darah yang bermakna (signifikan) dari setiap waktu sampling darah (menit ke 0-300) pada taraf kepercayaan 95%. Perbedaan yang bermakna (p<0.05) juga terlihat antara purata kadar plasma hewan uji yang dipengaruhi oleh perlakuan (dosis), sehingga perlakuan antar kelompok terbukti memberi pengaruh signifikan terhadap perbedaan kadar glukosa darah pada menit ke 0-300 dengan taraf kepercayaan 95%.