PRODUKSI BIOFLOK DAN NIL AI NUTRISINYA DAL AM SKAL A L ABORATORIUM
Gunarto dan Hidayat Suryanto Suwoyo Balai Riset Perikanan Budidaya Air Payau
Jl. Makmur Dg. Sitakka No. 129, Maros 90512, Sulawesi Selatan E-mail : [email protected]
ABSTRAK
Membandingkan teknologi produksi bioflok yang telah ada perlu dilakukan guna mengetahui efektiviitasnya masing-masing dan nilai nutrisi bioflok yang dihasilkan. Dua metode yang dibandingkan yaitu A). bioflok diproduksi menggunakan bak fiber glass kerucut volume 250 L diisi air tambak salinitas 30 ppt sebanyak 200 L yang disterilkan dengan kaporit 200 mg/L, kemudian diberikan aerasi secara kuat. Probiotik yang mengandung bakteri Bacillus subtillis dan B. cereus diberikan sebanyak 5 mg/L sebagai bakteri inokulum pembentuk flok. Mollase (kandungan C = ± 50%) dan pupuk ZA (N = 21%) setiap hari ditambahkan ke air dalam bak kerucut tersebut pada rasio C:N = 20:1. Kapur kaptan/dolomit 1 mg/L ditambahkan untuk stabilitas pH. Setelah terbentuk flok di kolom air, rasio C:N tetap dipertahankan pada 20:1 dengan cara menambahkan molase dan pupuk ZA. Metode produksi bioflok lainnya yaitu B). Untuk menumbuhkan bioflok digunakan bak fiberglas kerucut volume 250 L diisi air tambak dengan salinitas 30 ppt sebanyak 200 L yang disterilkan dengan kaporit 200 mg/L, kemudian diaerasi secara kuat. Setelah aman dari pengaruh kaporit, pakan udang dimasukkan sebanyak 1% (2,0 kg, protein = 38%, N = 6,4%, C-organik = 45%). Selanjutnya ditambahkan probiotik komersial yang mengandung Bacillus subtillis dan B. cereus sebanyak 5 mg/L sebagai inokulum bakteri pembentuk flok. Untuk meningkatkan rasio C:N = 20:1, maka molase (kandungan C = 50%) dan pupuk ZA (N = 21%) setiap hari ditambahkan ke kolom air dalam bak kerucut tersebut. Setelah terbentuk bioflok di kolom air, maka untuk stabilitas bioflok, rasio C:N tetap dipertahankan pada 20:1 dengan menambahkan molase dan pupuk ZA. Hasil penelitian menunjukkan dengan metode A produksi flok tercepat dicapai kurang dari 10 hari setelah proses aerasi. Di metode B, bioflok lambat terbentuk karena pH air media penumbuhan bioflok rendah (pH air < 7). pH air yang rendah disebabkan terlalu banyak sumber C organik (molase dan pakan) yang masuk ke dalam bak, namun setelah dibuang 90% dari total air dalam bak kerucut, selanjutnya diisi air yang steril dan diaerasi, maka dalam jangka waktu lima hari bioflok mulai terbentuk. Kadar protein bioflok cukup tinggi di metode A dan B yaitu 28,49% dan 28,73%, namun kandungan asam amino di metode B nampak lebih baik daripada kandungan asam amino di metode A. Hal ini kemungkinan karena di metode B digunakan pakan udang yang mempunyai kandungan protein tinggi 35%, sedangkan di metode A tidak digunakan pakan udang.
KATA KUNCI: bioflok, sumber C karbohidrat, Bacillus subtillis, nilai nutrisi PENDAHULUAN
Peningkatan produksi udang vaname berkorelasi dengan meningkatnya penggunaan pakan sebagai salah satu faktor produksi utama dalam kegiatan budidaya udang secara semi intensif dan intensif. Alokasi biaya pakan pada budidaya udang intensif dapat menyerap 60%-70% dari total biaya produksi. Seiring dengan semakin mahalnya biaya produksi udang, maka upaya untuk efisiensi biaya produksi harus dilakukan, satu diantaranya adalah menggunakan teknologi bioflok (Avnimelech, 1999; 2007; Schryver et al., 2008). Prinsip dari teknologi bioflok adalah menumbuhkan mikroorganisme terutama bakteri heterotrof di air media pemeliharaan yang dimaksudkan untuk menyerap komponen polutan, seperti amoniak yang ada di air. Agar terbentuk bioflok, maka rasio C/N harus dipertahankan pada level 20:1, kemudian diberi aerasi yang kuat dan merata, sehingga oksigen tidak pernah lebih rendah dari 4 mg/L. Untuk meningkatkan rasio C:N, maka sumber C-karbohidrat dapat digunakan di antaranya molase (Samocha, et al., 2006), tepung tapioka (Hari et al., 2004), glukosa dan gliserol (Ekasari, 2008), sukrosa (Kartika, 2008).
Bioflok merupakan komunitas mikroba yang terdiri atas bakteria, protozoa, dan zooplankton, dapat juga sebagai suplemen pakan udang mengandung asam amino methionin, vitamin, mineral,
dan enzim yang dapat membantu proses pencernaan pakan pada udang. Dengan demikian apabila diaplikasikan dalam tambak dengan terbentuk bioflok maka akan menghemat pakan yang diberikan pada udang karena bioflok dapat digunakan sebagai subsitusi pakan bagi udang yang dibudidayakan. Kualitas bioflok sangat dipengaruhi oleh karakteristik morfologi dan nilai nutrisinya. Beberapa aspek penting masih harus diteliti lebih lanjut meliputi seleksi bakteria yang hidup pada bioflok, mekanisme saling terikat dari satu organisme dengan organisme lain dalam satu formasi bioflok, faktor-faktor yang berpengaruh pada formasi bioflok, dan efek penggunaan bioflok pada kesehatan ikan (Schryver et al., 2008). Anonimous, 2009 dalam www.aiyushirota.com menyatakan bahwa salah satu ciri khas bakteri pembentuk bioflok adalah mampu mensintesis senyawa Poli-Hidroksi-Alkanoat (PHA) terutama poli-Beta-Hidroksi Butirat yang berfungsi sebagai pembentuk ikatan polimer antara subtansi pembentuk flok. Bakteri yang mampu membentuk bioflok di antaranya adalah Bacillus subtilis, B. Cereus, Zooglea ramigera, Escherichia intermedia, Paracolobacterium aerogenoids, Flavobacterium, Pseudomonas alcaligenes, Sphaerotillus natans, Tetrad, dan Tricoda sp.
Pemanfaatan bioflok pada budidaya udang di tambak di samping untuk mengefisienkan biaya produksi, juga diduga mampu meminimalisir risiko serangan penyakit misalnya WSSV, Mio, Vibrio, dan lainnya. Bioflok juga bisa dimanfaatkan sebagai suplemen dalam ransum pakan untuk ikan atau udang. Dengan menguasai teknologi produksi massalnya secara indoor, maka akan sangat membantu dalam penyediaan sumber protein nonikani untuk suplemen ransum pakan ikan atau udang dengan biaya yang lebih murah. Tujuan penelitian adalah untuk membandingkan teknologi produksi bioflok yang telah ada guna mengetahui efektiviitasnya masing-masing dan nilai nutrisi bioflok yang dihasilkan.
BAHAN DAN METODE Metode A
Untuk menumbuhkan bioflok digunakan bak fiber glass kerucut volume 250 L sebanyak dua unit, masing-masing bak diisi air tambak salinitas 30 ppt sebanyak 200 L yang disterilkan terlebih dahulu dengan diberikan kaporit sebanyak 200 mg/L, kemudian diberikan aerasi secara kuat terus-menerus. Probiotik yang mengandung bakteri Bacillus subtillis dan B. cereus diberikan sebanyak 5 mg/L sebagai bakteri inokulum pembentuk flok. Molase (kandungan C = ± 50%) dan pupuk ZA (N = 21%) setiap hari ditambahkan ke air dalam bak kerucut tersebut pada rasio C:N = 20:1. Kapur kaptan/dolomit 1 mg/L ditambahkan untuk stabilitas pH apabila diperlukan. Setelah terbentuk bioflok di kolom air, maka untuk stabilitas bioflok, rasio C:N tetap dipertahankan pada 20:1 dengan cara menambahkan molase dan pupuk ZA. Pada setiap 100 g pupuk ZA berarti kandungan N = 21 g, maka untuk sumber C organiknya diperlukan molase sebanyak 21 g x 20 x 2 = 840 g molase untuk setiap 100 g pupuk ZA.
Metode B
Untuk menumbuhkan bioflok di laboratorium digunakan bak fiber glass kerucut volume 250 L sebanyak dua unit, kemudian masing-masing bak diisi air tambak dengan salinitas 30 ppt sebanyak 200 L yang terlebih dahulu disterilkan dengan diberi kaporit sebanyak 200 mg/L, kemudian diberikan aerasi secara kuat terus-menerus. Setelah dua hari air dianggap sudah aman dari pengaruh kaporit, selanjutnya pakan udang dimasukkan sebanyak 1% (2,0 kg, protein = 38%, N = 6,4%, C-organik = 45%), Selanjutnya ditambahkan probiotik komersial yang mengandung Bacillus subtillis dan B. cereus sebanyak 5 mg/L sebagai inokulum bakteri pembentuk flok. Untuk meningkatkan rasio C:N = 20:1, maka molase (kandungan C = 50%) sebagai sumber C-karbohidrat dan pupuk ZA (N = 21%) sebagai sumber N setiap hari ditambahkan ke kolom air dalam bak kerucut tersebut. Setelah terbentuk flok di kolom air, maka untuk stabilitas flok, rasio C:N tetap dipertahankan pada 20:1 dengan menambahkan molase dan pupuk ZA.
Di metode B, pH air rendah sebagai akibat sumber N yang ditambahkan dari pakan jumlahnya terlalu banyak yaitu 1% dari volume total air (= 200 L) = 2 kg. Dengan perhitungan N pakan = 6,4%, maka jumlah N di media air = 128 g. C dalam pakan 45%, maka total C dalam pakan = 900 g. Maka
C/N rasio dalam pakan = 7:1. Sehingga seharusnya molase yang ditambahkan sebanyak 128 g x 13 x 2 = 3.328 g untuk mempertahankan C/N rasio = 20:1. Namun demikian karena kekurang telitian, di mana C dalam pakan tidak diperhitungkan maka molase yang ditambahkan ke wadah metode B sebanyak 128 x 20 x 2 = 5.120 g. Hal ini menyebabkan pH air menjadi rendah yaitu hanya pada kisaran 4-4,5. Penambahan dolomit sebanyak 20 mg/L sebagai upaya untuk meningkatkan pH air tidak ada pengaruhnya. Oleh sebab itu, pada hari ke-20 sebanyak 95% dari total air di dalam bak fiber glass kerucut di metode B dibuang, kemudian diganti dengan air yang baru dan steril. pH air telah mencapai 7-7,5.
Pengamatan yang dilakukan adalah komposisi, bentuk, struktur, warna, ukuran, Total Suspended Solid (TSS), Volatile Suspended Solid (VSS), Floc Volume Indices (FVI), dan nilai nutrisi bioflok (pro-tein, lemak, dan karbohidrat). Parameter kualitas air yang diamati terdiri atas suhu, salinitas, pH, oksigen terlarut, amoniak, nitrit, nitrat, dan BOT. Perhitungan TSS dan VSS adalah sebagai berikut:
di mana:
A = bobot wadah petridish kosong + contoh uji flok yang sudah disaring
B = bobot wadah petridish kosong (mg)
V = volume contoh (mL) = 10 mL
VSS (mg/L) = TSS – jumlah abu
HASIL DAN BAHASAN
Hasil penelitian menunjukkan bahwa bioflok cepat terbentuk di metode A yaitu hanya diperlukan waktu sekitar enam hari (Gambar 1). Sumber N yang ditambahkan dari pupuk Za (N = 21%). Pada penelitian ini di metode A jumlah pupuk Za yang ditambahkan sebanyak 100 g, sehingga N sebanyak 21 g (konsentrasi N dalam media air di bak fiber glass kerucut sebanyak 105 mg/L). Meskipun sebelumnya juga telah dianalisis kandungan total N dalam air di bak fiber glass sebelum ditambahkan pupuk Za, tetapi karena konsentrasinya sangat rendah, maka konsentrasi total N awal dieliminir.
C/N rasio dalam air di bak fiber glass dipertahankan pada kisaran 20:1. Untuk sumber C yang diaplikasikan adalah molase dengan kandungan C = 50%, sehingga jumlah sumber C yang ditambahkan sebanyak 21 g x 20 x 2 = 840 g. Dengan teknik yang demikian bioflok cepat terbentuk yaitu hanya selama enam hari proses aerasi, namun demikian kalau kita lihat konsentrasi N awal sangat tinggi yaitu mencapai 105 mg/L. Padahal menurut Avnimelech (2009), seharusnya konsentrasi N awal hanya
100 X V B - A (mg/L) TSS
Gambar 1. Bioflok yang terbentuk tanpa pewarnaan gram negatif setelah 6 hari proses aerasi di bak fiber
0,5-2 mg/L. Kemungkinan dengan konsentrasi N awal yang rendah, maka bioflok akan lambat terbentuk.
Di metode B, bioflok tidak terbentuk cepat, hal ini disebabkan pH air yang menurun sebagai akibat sumber N yang ditambahkan dari pakan jumlahnya terlalu banyak yaitu 1% dari volume total air (= 200 L) = 2 kg. Di samping itu, juga adanya kesalahan tidak memperhitungkan C dalam pakan sehingga molase yang ditambahkan dalam bak kerucut menjadi terlalu banyak. Hal tersebut menyebabkan pH air menjadi rendah yaitu hanya pada kisaran 4-4,5, meskipun telah ditambahkan dolomit sebanyak 20 mg/L, tetapi pH air tetap rendah. Pada hari ke-20 sebanyak 95% dari total air di dalam bak fiber glass kerucut dibuang, kemudian diganti dengan air yang baru dan steril, maka pada lima hari kemudian telah terbentuk bioflok. pH air telah mencapai 7-7,5. Dengan demikian faktor pH sangat berperan dalam terbentuknya bioflok di air media. Di samping itu, juga air media pada awal pembentukan telah disterilkan terlebih dahulu, sehingga hanya bakteri inokulan dari probiotik yang diharapkan tumbuh sebagai bioflok. Tanda-tanda mulai terbentuk bioflok adalah munculnya busa secara melimpah di permukaan air di dalam bak fiber glass kerucut dan busa tersebut akan terus ada di permukaan air (Gambar 2).
Bentuk dan ukuran bioflok bervariasi dan semakin lama semakin besar ukurannya. Menurut Avnimelech (2009), warna flok yang hitam (Gambar 3) tidak baik sebagai makanan udang, karena flok tersebut sudah mati dan mungkin juga menyebabkan menurunnya kualitas air. Kepadatan flok yang yang baik untuk budidaya udang di tambak adalah pada kisaran 2-15 mL/L (Gambar 4), selama diendapkan 15-30 menit. Pada penelitian menggunakan bak fiber glass kerucut ini untuk mencapai
Gambar 2. Munculnya busa tandai mulai terbentuknya bioflok
kisaran bioflok tersebut bisa dicapai dalam waktu yang singkat yaitu 15 hari, terutama pada perlakuan A. Juga pada perlakuan B setelah airnya diganti 95%.
Kualitas Air
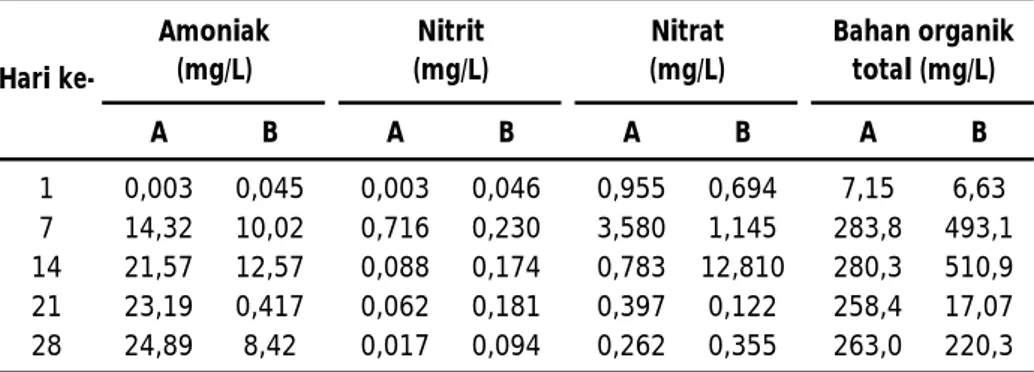
Beberapa parameter kualitas air di bak produksi bioflok yang dimonitor menunjukkan nilai yang tinggi terutama amoniak, nitrit, nitrat, dan bahan organik total (Tabel 1). Tingginya amoniak kemungkinan disebabkan karena konsentrasi awal N yang tinggi di air tambak dalam bak fiber glass yaitu mencapai 105 mg/L. Sehingga penelitian ini masih perlu dilanjutnya untuk melihat berbagai konsentrasi awal N pengaruhnya terhadap kecepatan pembentukan bioflok. Di samping itu, ekspose terhadap sinar matahari juga diduga berpengaruh terhadap kecepatan pembentukan bioflok. Namun hal tersebut juga masih perlu dibuktikan. Pada penelitian ini bak kerucut yang digunakan untuk produksi bioflok diletakkan di dalam laboratorium basah, jadi tidak terekspose ke sinar matahari secara langsung, hanya saja ada indikasi pada bak yang letaknya dekat jendela dengan kondisi lingkungan yang lebih terang diperoleh pertumbuhan bioflok yang lebih cepat terutama di perlakuan A.
Di tambak budidaya udang, pada periode persiapan tambak biasanya pemupukan dilakukan dengan pupuk urea (N = 46%) sebanyak 150 kg/ha. Dengan demikian N yang ditambahkan ke air tambak sebanyak 69 kg/ha tambak. Jika ketinggian air tambak 1 m, maka konsentrasi N di air tambak hanya 6,9 mg/L. Jika menggunakan pupuk Za (N = 21%) dengan jumlah yang sama dengan urea untuk pemupukan awal di tambak, maka konsentrasi N di air tambak sebanyak 3,15 mg/L. Menurut McIntosh (2000), flok di tambak intensif biasanya akan terbentuk pada 9-10 minggu sesudah penebaran yang artinya bahwa sudah banyak terakumulasi N yang berasal dari sisa pakan, sehingga tinggal ditambahkan sumber C karbohidrat secara rutin ke dalam air tambak, tentunya dengan mempertimbangkan dan memperhitungkan CN rasio menjadi 20:1. Berdasarkan hasil perhitungan Avnimelech (1999) jumlah sumber C karbohidrat yang harus ditambahkan sebanyak 61% dari total pakan yang diberikan di setiap hari.
Gambar 4 menunjukkan bioflok yang mengendap di tabung imhoff cone setelah air didiamkan sekitar 15-30 menit. Pada metode A volume endapan flok sekitar 10-12 mL/L. Menurut Avnimelech (2009), di air tambak umumnya volume flok sebanyak 2-40 mL/L di tambak udang dan mencapai 100 mL/L di kolam ikan. Sedangkan menurut Nyam Tow (2010, komunikasi pribadi), volume flok yang ideal untuk tambak udang adalah sebanyak 15 mL/L.
Konsentrasi awal amoniak cukup rendah di semua perlakuan yaitu masih di bawah 0,1 mg/L, namun selanjutnya pada minggu pertama setelah pemberian pupuk Za di perlakuan A dan B, konsentrasi amoniak meningkat menjadi 14,32 mg/L (A) dan 10,02 mg/L (B). Setelah enam hari proses aerasi di bak fiber glass kerucut, sudah mulai terbentuk bioflok terutama di metode A, namun demikian konsentrasi amoniak malah meningkat, padahal seharusnya konsentrasi amoniak menurun karena
dimanfaatkan untuk pembentukan protein bakteri. Hal ini disebabkan karena setiap dua hari sekali selalu ditambahkan pupuk Za sebanyak 10% (10 g) dari pupuk Za yang diberikan pada awal penelitian (100 g). Di samping pupuk Za juga ditambahkan molase yang bertujuan untuk mengatur agar C/N rasio di air dalam bak fiber glass yang diaerasi secara kuat tetap pada level 20:1. Dari kondisi amoniak yang tinggi ini maka dapat diperoleh informasi bahwa penambahan sumber C dan N ke dalam air media pembentukan bioflok yang ada di bak fiber glass tidak perlu dua hari sekali, mungkin bisa diperpanjang menjadi setiap 5 hari sekali atau lebih, atau tidak perlu selalu yang ditambahkan ke air media pembentukan bioflok harus sumber C karbohidrat dan N (Za) dengan CN rasio 20:1, tetapi karena konsentrasi amoniak di air media pembentukan bioflok masih tinggi, maka seharusnya hanya sumber C karbohidrat saja yang perlu ditambahkan setiap hari ke dalam media air pembentukan bioflok.
Tingginya konsentrasi amoniak disebabkan pupuk Za yang diberikan ke bak fiber glass cukup tinggi pada awalnya dan setelah terbentuk bioflok, setiap hari juga ditambahkan pupuk Za, di samping juga sumber C karbohidrat dari molase. Shingga flok yang terbentuk tidak mampu meminimalisir secara keseluruhan konsentrasi amoniak yang ada di bak fiber glass. Oleh karena itu, perlu diuji lagi proses pembentukan bioflok dengan konsentrasi N awal yang rendah 0,5-2 mg/L seperti disarankan oleh Avnimelech (2009). Di samping itu, penambahan pupuk ZA dan molase harus berdasarkan konsentrasi amoniak di air media pembentukan flok.
Pada minggu ketiga konsentrasi amoniak di metode B menjadi rendah kembali (0,417 mg/L). Hal ini karena telah dilakukan penggantian air sebanyak 95%, disebabkan karena pH air terlalu rendah (4-4,5) sehingga tidak terbentuk bioflok hingga hari ke-20. Setelah dilakukan penggantian air, dan terus diberi aerasi secara kuat, maka bioflok segera terbentuk setelah 5 hari proses aerasi. Konsentrasi nitrit di air dalam bak produksi bioflok juga mengalami peningkatan meskipun tidak setajam seperti peningkatan konsentrasi amoniak, begitu juga konsentrasi nitrat.
Konsentrasi BOT meningkat secara menyolok terjadi setelah tujuh hari proses produksi bioflok. Hail ini karena telah terbentuk bioflok dan relatif stabil konsentrasinya di perlakuan A yaitu yang tertinggi mencapai 283,8 mg/L. Sedangkan di perlakuan B, setelah airnya dibuang 95%, maka konsentrasi BOT menurun tajam (17,07 mg/L), kemudian pada hari ke-28 setelah terbentuk bioflok konsentrasi BOT meningkat menjadi 220,3 mg/L. Sedangkan nilai BOT yang sangat tinggi di perlakuan B pada hari ke-7 dan 14, berasal dari BOT yang asalnya dari pakan dan molase yang ditambahkan dalam jumlah yang terlalu banyak ke air media pembentukan flok.
Salinitas, pH air, konsentrasi oksigen terlarut, dan suhu air diperlihatkan pada Tabel 2. Selama proses pembentukan bioflok, salinitas air di bak fiber glass berfluktuasi di perlakuan A pada kisaran 40-42 ppt, perlakuan B pada kisaran 37-38 ppt. Hal ini menunjukkan bahwa bioflok dapat terbentuk dengan cepat pada salinitas mencapai 42 ppt, suhu air pada kisaran 29°C-29,7°C; pH air pada kisaran
Tabel 1. Konsentrasi beberapa parameter kualitas air pada produksi bioflok secara massal di bak fiber glass
A B A B A B A B 1 0,003 0,045 0,003 0,046 0,955 0,694 7,15 6,63 7 14,32 10,02 0,716 0,230 3,580 1,145 283,8 493,1 14 21,57 12,57 0,088 0,174 0,783 12,810 280,3 510,9 21 23,19 0,417 0,062 0,181 0,397 0,122 258,4 17,07 28 24,89 8,42 0,017 0,094 0,262 0,355 263,0 220,3 Bahan organik total (mg/L) Hari ke-Amoniak (mg/L) Nitrit (mg/L) Nitrat (mg/L)
6,3-7,7; oksigen terlarut pada kisaran 5-6,5. Sedangkan pH air terlalu rendah 4,5 seperti yang terjadi di metode B, bioflok tidak bisa terbentuk.
Nilai TSS, VSS, dan nilai nutrisi bioflok
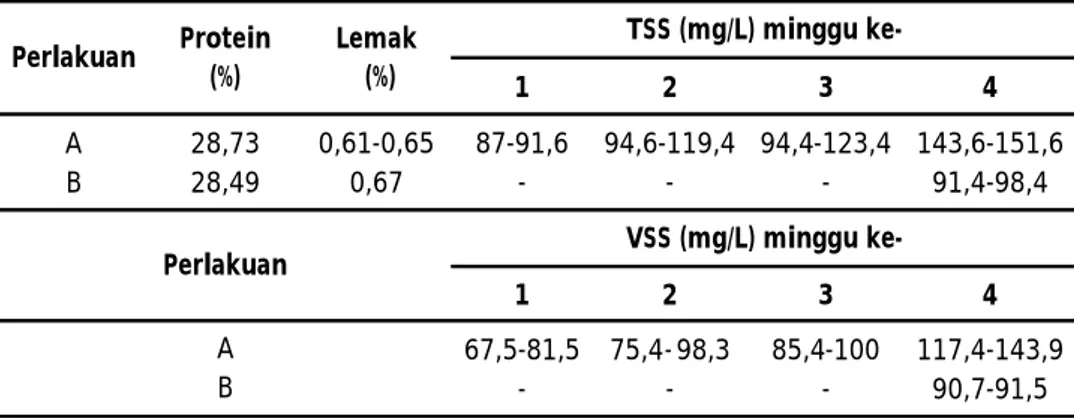
Nilai Volatil Suspended Solid (VSS) adalah cara konvensional untuk menentukan fraksi organik dari total bahan solid. Nilai TSS, VSS, dan nilai nutrisi bioflok diperlihatkan pada Tabel 3. Pada perlakuan A nilai TSS nampak makin lama semakin tinggi yaitu dari kisaran 87-91,6 mg/L pada 7 hari pertama setelah terbentuknya bioflok meningkat menjadi 143,6-151,6 mg/L pada minggu keempat. Di metode B nilai TSS pada kisaran 90-91,7 mg/L, yang diperoleh setelah terbentuk flok pada pada hari ke-28. Menurut Avnimelech (2009), nilai normal TSS pada tambak udang intensif adalah pada kisaran 50-300 mg/L, sedangkan pada kolam budidaya ikan secara intensif mencapai 1.000 mg/L.
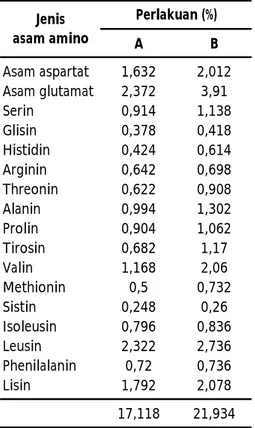
Nilai VSS perlakuan A pada minggu ke-4 (117,4-143,9 mg/L); pada perlakuan B pada kisaran 90,7-91,5 mg/L. Kandungan protein dari flok menunjukkan perbedaan yang tidak berarti, yaitu dengan nilai 28,49% (metode A) dan 28,7% (metode B). Dari nilai kandungan protein yang diperoleh tersebut menunjukkan bahwa kandungan protein flok cukup potensial untuk digunakan sebagai sub situsi pakan bagi udang/ikan yang dibudidayakan, begitu juga apabila dilihat komposisi asam aminonya (Tabel 4), nampak bahwa konsentrasi aasam amino bioflok yang dihasilkan dari metode B, sedikit lebih tinggi daripada yang dihasilkan di metode A. Hal ini kemungkinan karena di metode B digunakan pakan udang yang mempunyai kandungan protein 35%, sedangkan di metode A tidak digunakan
A B A B A B A B 1 42 37 29,7 29,5 6,7 4,5 5 3,5 7 42 38 29 29,5 6,3 4,5 6 4 14 40 37 29,1 28,9 6,7 7 5,8 5,3 21 40 37 29,7 29,5 6,3 6,8 5,8 5,2 28 41 38 29 29 6,3 6,5 5,9 5,4 Oksigen terlarut (mg/L) Hari ke-Salinitas (ppt) Suhu (°C) pH
Tabel 2. Salinitas, pH air, suhu air, konsentrasi oksigen terlarut di air dalam bak fiber glass untuk produksi bioflok
1 2 3 4 A 28,73 0,61-0,65 87-91,6 94,6-119,4 94,4-123,4 143,6-151,6 B 28,49 0,67 - - - 91,4-98,4 1 2 3 4 67,5-81,5 75,4- 98,3 85,4-100 117,4-143,9 - - - 90,7-91,5 A B Protein (%) Lemak (%) Perlakuan
Perlakuan TSS (mg/L) minggu
VSS (mg/L) minggu
pakan udang sebagai sumber C maupun N, tetapi hanya menggunakan molase sebagai sumber C karbohidrat dan pupuk ZA sebagai sumber N.
KESIMPUL AN
Di antara kedua metode teknik produksi bioflok yang diuji ternyata yang paling efisien dan efektif dalam pembentukan bioflok adalah teknik produksi bioflok metode A, karena hanya dalam tempo 6 hari sudah mulai terbentuk flok. Metode tersebut diperlukan sumber N dari pupuk Za dan sumber C dari molase, juga probiotik sebagai inokulan bakteri pembentuk flok. Kandungan protein bioflok pada metode A dan B cukup tinggi yaitu pada kisaran 28,4%-28,73% dengan konsentrasi asam amino esensial dan non esensial yang bervariasi.
SARAN
Perlu penelitian lebih lanjut produksi massal bioflok dengan konsentrasi N awal yang rendah (0,5-2 mg/L) dan dilanjutkan dengan dilakukan tes melihat penggunaan bioflok yang terbentuk untuk digunakan sebagai subsitusi pakan bagi udang/ikan.
DAFTAR ACUAN
Anonimous. 2009. Konsep Budidaya Udang Sistem Bakteri heterotroph Dengan Bioflocs. AIYU Shirotabiota Indonesia. Biotechnology Consulting & Trading Komplek Sapta Taruna PU, Blok B1 No. 13 Bandung, Jawa Barat, Indonesia, 14 hlm.
Avnimelech, Y. 1999. Carbon/Nitrogen ratio as control element in aquaculture systems. Aquaculture, 176: 227-235.
Avnimelech, Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds. Aquaculture, 264: 140-147.
Avnimelech, Y. 2009. Biofloc Technology A practical guide book. The World Aquaculture Society, Baton Rouge, Louisiana, 70803 United State of America, 182 hlm.
A B Asam aspartat 1,632 2,012 Asam glutamat 2,372 3,91 Serin 0,914 1,138 Glisin 0,378 0,418 Histidin 0,424 0,614 Arginin 0,642 0,698 Threonin 0,622 0,908 Alanin 0,994 1,302 Prolin 0,904 1,062 Tirosin 0,682 1,17 Valin 1,168 2,06 Methionin 0,5 0,732 Sistin 0,248 0,26 Isoleusin 0,796 0,836 Leusin 2,322 2,736 Phenilalanin 0,72 0,736 Lisin 1,792 2,078 17,118 21,934 Perlakuan (%) Jenis asam amino
Tabel 4. Komposisi asam amino yang terkandung di dalam bioflok
Ekasari, J. 2008. Bio-flocs technology : The effect of different carbon source, salinity and the addition of probiotics on the primary nutritional value of the bio-flocs. Thesis Master pada Ghent Univer-sity, Belgia, 91 pp.
Hari, B., Kurup, B.M., Varghese, J.T., Schrama, J.W., & Verdegem, M.C.J. 2004. Effects of carbohydrate addition on production in extensive shrimp culture systems. Aquaculture, 241: 179-194.
Kartika, A. 2008. Optimum rasio C/N medium dengan penambahan sukrose pada pembentukan bioflok untuk peningkatan kualitas air pada sistem akuakultur. Sekolah Ilmu dan Teknologi Hayati ITB, email : [email protected].
McIntosh, R.P. 2000. Changing paradigms in shrimp farming. IV. Low protein feeds and feeding strategies. Global Aquaculture ADVOCATE, April 2000, 3(2): 44-50.
Nyan, T. 2010. Komunikasi pribadi.
Samocha, T.M., Susmita, P., Burger, J.S., Almeida, R.V., Abdul-Mehdi, A., Zarrein, A., Harisanto, M., Horowitz, A., & Brock, D.L. 2006. Use of molasses as carbon source in limited discharge grow-out systems for Litopenaeus vannamei. Aquaculture America, hlm. 1-2.
Schryver, P.D., Crab, R., Devoirdt, T., Boon, N., & Verstraete, W. 2008. The basic of bioflocs technology: The added value for aquaculture. Aquaculture, 227: 125-137.