BRINE SHRIMP LETHALITY TEST FRAKSI EKSTRAK ETANOL DAUN TUMBUHAN TEMBELEKAN (Lantana camara L.) BESERTA PROFIL
KROMATOGRAFI LAPIS TIPISNYA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh :
R. Hendra Krismawan NIM : 018114123
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
INTISARI
Daun tumbuhan tembelekan (Lantana camara L.) sering dimanfaatkan oleh masyarakat sebagai obat tradisional, salah satunya untuk mengobati pembengkakan/tumor, sebagai antiseptik dan antitoksik. Telah diketahui bahwa ekstrak etanol daun tumbuhan tembelekan memiliki efek toksik terhadap larva artemia akan tetapi belum ada laporan ilmiah mengenai efek paling toksik dari fraksi ekstrak etanol. Untuk mengetahui fraksi paling toksik tersebut dilakukan penelitian dengan menggunakan metode Brine Shrimp Lethality Test (BST), yang dinyatakan dengan nilai Lethal Concentration 50 (LC50).
Penelitian ini merupakan eksperimental murni dengan rancangan posttest
only control group design. Penelitian dilakukan dengan menggunakan ekstrak
etanol dari daun tumbuhan tembelekan yang dibuat fraksi. Fraksi diperoleh dengan metode Vaccum Coloumn Chromatography (VCC). Hasil fraksinasi diperoleh 3 fraksi yaitu F2, F3, dan F4 yang kemudian diuji dengan metode BST.
Sampel uji dan kontrol dibuat seri konsentrasi yaitu F2 (100; 178; 316,84;
563,97; 1003,87) μg/ml, F3 (5; 10,5; 22,05; 43,3; 97,2) μg/ml, dan F4 (10; 32;
102,4; 327,7; 1048,6) μg/ml. Kontrol menggunakan air laut buatan, replikasi sebanyak 5 kali. Jumlah larva Artemia salina Leach yang mati pada tiap konsentrasi dihitung setelah 24 jam perlakuan. Nilai LC50 dihitung dengan analisis probit. Fraksi dikatakan toksik apabila harga LC50 ≤ 1000 μg/ml. Dari fraksi yang paling toksik dilakukan Kromatografi Lapis Tipis (KLT) untuk mengetahui profil bercak yang terkandung di dalamnya.
Hasil penelitian menunjukkan nilai LC50 dari F2 sebesar 508 μg/ml, F3
sebesar 23 μg/ml, dan F4 sebesar 101 μg/ml sehingga dapat dinyatakan bahwa F3
bersifat paling toksik. Gambaran profil bercak dari fraksi yang paling toksik dengan KLT menunjukkan bahwa bercak yang diduga menyebabkan kematian larva artemia adalah golongan terpenoid dengan Rf sebesar 0,3.
Kata kunci : Daun tumbuhan tembelekan (Lantana camara L. ), Vaccum
Coloumn Chromatography (VCC), Fraksi toksik, Brine Shrimp
ABSTRACT
People often use Tembelekan leaf (Lantana camara L) as the traditional medicine to cure tumor, as antiseptic and also as an antitoxin. It has been known that the ethanol extract and chloroform extract of Lantana camara L has toxin effect to artemia larva but there is no scientific report about the most toxicity of fraction etanol extract. To know the toxicibility of that fraction, the research using Brine Shrimp Lethality Test (BST) method which was determined with LC50.
This research was a pure experiment by applying the posttest only control group design and the etanol extract of tembelekan leaf -that was made into fraction- was used. To get the fraction, the Vaccum Coloumn Chromatography method that was applied. Three fractions to test by using BST method- those are F2, F3, F4 , were
gotten. The test and control sample were formed as concentration series-those were
F2 (100; 178; 316,84; 563,97; 1003,87) μg/ml, F3 (5; 10,5; 22,05; 43,3; 97,2) μg/ml
and F4 (10; 32; 102,4; 327,7; 1048,6) μg/ml. The control used the water with 5
replicate. The number of the dead Artemia Salina Leach on every concentration was counted after 24 hours. The percentage of LC50 was counted by using the probit analysis. Fraction was determined as toxin if the percentage of LC50 was ≤ 1000
μg/ml. To know the contents of the spotted profile, a thin layer chromatography was done to the most toxic fraction.
The result of the research showed that the LC50 percentage of F2 was 508
μg/ml, F3 was 23 μg/ml, and F4 was 101 μg/ml. So it could be said that F3 was the
most toxic fraction. The description of spotted profile of the most toxic fraction by using a Thin Layer Chromatography showed that the spot that was estimated as the causing the artemia dead is terpenoid and had Rf of 0,3
KATA PENGANTAR
Puji syukur atas setiap anugerah Tuhan sehingga penulis dapat
menyelesaikan skripsi yang berjudul ” Brine Shrimp Lethality Test Fraksi Ekstrak Etanol Daun Tumbuhan Tembelekan (Lantana camara L. ) Beserta Profil Kromatografi Lapis Tipisnya”. Selesainya skripsi ini tidak lepas dari bantuan, dukungan dan bimbingan dari berbagai pihak. Oleh karena itu penulis
mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Rita Suhadi M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Ibu Yustina Sri Hartini, M.Si., Apt selaku pembimbing pertama yang selalu
memberi dukungan, pengetahuan, kritik dan saran yang luar biasa dan selalu
sabar pada penulis.
3. Bpk. Yohanes Dwiatmaka, M.Si. selaku Dosen Pembimbing kedua yang
banyak memberi dukungan, pengetahuan, masukan dan saran yang berharga.
4. Christine Patramurti, M.Si., Apt. selaku Dosen Penguji atas masukan-masukan
dan saran yang berharga.
5. Erna Tri Wulandari, M.Si., Apt. selaku Dosen Penguji atas masukan-masukan
dan saran yang berharga.
6. Bapak Ign. Y. Kristio Budiasmoro, M.Si. Terima kasih atas diskusi, masukan
dan saran yang diberikan
7. Bapak, Ibu, juga Mas Andre dan adikku Siska terima kasih atas kepercayaan,
8. Mas Wagiran, Mas Sigit, Mas Sarwanto, Mas Andre selaku staf laboratorium.
Terima kasih atas bantuan, “guyonan” dan saran yang diberikan..
9. Team Proyek Tembelekan : Lia KKT, Novi dan Apri. Terima kasih atas
kerjasama dan bantuan serta semangat yang diberikan.
10.Rekan-rekan angkatan 2001 : Rudi Kembongce, Deny, Rima, Endah Sari,
Mario Cahyo, Delila, Wiwin, Mirah, Ade, Theo, Freddy, Prastowo, Prasojo,
Gita, Awan, Maya, Himawan, Lita, Lisa, Themy, Dio, Dewi, serta khususnya
kelompok E. Terima kasih atas semuanya.
11.Wiwid Lecek serta teman-teman Kost : Andi, Tumbur, Dian, Koeprit, Pak
Min, Tommy. Terima kasih atas kebersamaan, bantuan dan pinjaman printer.
12.Mas Bondan, Mbak Dama, Mita serta Mbak Mimin sekeluarga. Terimakasih
atas pinjaman camera juga support yang diberikan.
13.Martina Herliana Wati. Terima kasih untuk diskusi, support, bantuan, dan
kasih sayang yang pernah diberikan. Terimakasih juga telah menyalakan
kembali semangat yang hampir padam. Thank’s.
14.Rekan-rekan angkatan 2003 : Marga (thank’s), Rosa, Devi, Titin, Mitea,
Vitea, Rani, Lintang, Yohana, Nella, Doni, Wati, Hengky, Vera, Ari, Eta,
Galeh. Terima kasih atas diskusi, bantuan, dan kebersamaannya.
15.Rekan-rekan angkatan 2002 : Eddy (thank’s), Kobo, Heri, Nowo, Firman,
Bowo, Peter, Elni, Vicky, TeGe, Puri. Terima kasih atas kebersamaan, canda
tawa, “sindiran” dan diskusi yang diberikan.
16.Ibu Retno dan Bpk. Bagus Wahyuono atas pengertian dan dukungan yang
17.Semua pihak yang tidak dapat penulis sebutkan satu persatu.
Dalam kesempatan ini, tak lupa penulis memohon maaf kepada semua
pihak atas kekurangan dan kesalahan yang mungkin dilakukan penulis. Oleh
karena itu dengan rendah hati penulis mengharapkan masukan, saran dan kritik
yang membangun.
DAFTAR ISI
HALAMAN JUDUL……… i
HALAMAN PERSETUJUAN PEMBIMBING……….. ii
HALAMAN PENGESAHAN……….. iii
HALAMAN PERSEMBAHAN……….……. iv
PERNYATAAN KEASLIAN KARYA….………. v
INTISARI……… vi
ABSTRACT ………. vii
KATA PENGANTAR ….…………...……… viii
DAFTAR ISI..………. xi
DAFTAR TABEL ……….. xv
DAFTAR GAMBAR...……….……….. xvi
DAFTAR LAMPIRAN……….…….. xviii
DAFTAR SINGKATAN DAN LAMBANG………..… xx
BAB I. PENGANTAR………. 1
A. Latar Belakang ………. 1
1. Perumusan masalah... 3
2. Keaslian penelitian... 3
3. Manfaat penelitian... 4
B. Tujuan Penelitian………... 4
BAB II. PENELAAHAN PUSTAKA………. 5
1. Keterangan botani ... 5
2. Nama daerah... 5
3. Deskripsi tanaman... 5
4. Kandungan kimia... 6
5. Kegunaan... 6
6. Penelitian dengan BST... 6
B. Terpenoid... 7
C. Artemia... 8
1. Lingkungan hidup artemia... 9
2. Penggunaan artemia pada metode BST... 10
D. Uji Toksisitas Akut... 13
E. Kanker... 14
F. Penyarian... 15
G. Kromatografi Vakum kolom... 16
H. Kromatografi Lapis Tipis (KLT) 17 I. Keterangan Empiris... 19
BAB III. METODOLOGI PENELITIAN... 20
A. Jenis dan Rancangan Penelitian... 20
B. Variabel Penelitian dan Definisi Operasional... 20
1. Variabel penelitian... 20
2. Definisi Operasional... 21
C. Bahan dan Alat Penelitian... 22
2. Alat penelitian... 23
D. Tata Cara Penelitian... 24
1. Determinasi tumbuhan Tembelekan (Lantana camara L.) ... 24
2. Pengumpulan bahan... 24
3. Penyiapan bahan... 24
4. Maserasi... 24
5. Fraksinasi... 25
6. Pembuatan air laut buatan... 27
7. Penetasan telur artemia... 27
8. Pembuatan larutan sampel... 28
9. Uji toksisitas akut dengan BST... 30
10.Uji KLT fraksi toksik daun tumbuhan tembelekan... 30
11.Analisis hasil... 31
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN... 32
A. Determinasi Tanaman... 32
B. Pengumpulan Bahan ... 32
C. Maserasi Daun Tumbuhan Tembelekan... 33
D. Fraksinasi Ekstrak etanol hasil maserasi……….…………... 35
E. Pembuatan Air Laut Buatan (ALB) ... 44
F. Penetasan Telur Artemia... 44
G. Uji Toksisitas dengan Metode BST... 46
BAB V. KESIMPULAN DAN SARAN... 65
A. Kesimpulan... 65
B. Saran... 65
C. Keterbatasan Penelitian... 65
DAFTAR PUSTAKA... 66
LAMPIRAN... 69
DAFTAR TABEL
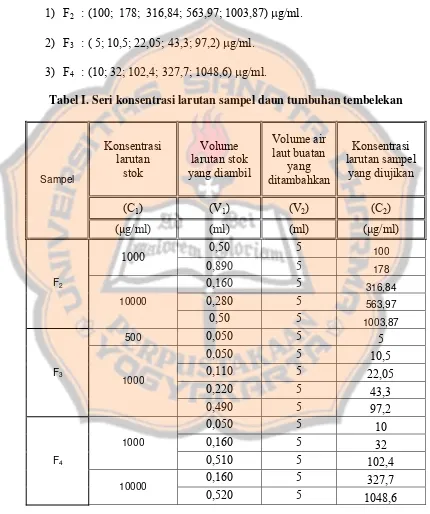
Tabel I Seri konsentrasi larutan sampel daun tumbuhan tembelekan... 29
Tabel II Penggabungan hasil fraksinasi menjadi 5 fraksi berdasarkan
data gambar 6……… 43
Tabel III Persentase kematian larva artemia akibat pemberian fraksi
ekstrak etanol daun tumbuhan tembelekan... 50
Tabel IV Data kromatogram tiga fraksi toksik... 57
DAFTAR GAMBAR
Hal.
Gambar 1. Struktur pentasiklik triterpenoid (Kaufman, Cseke,
Warbers, Duke, Brielmann, 1988)……… 7
Gambar 2. Kromatogram ekstrak etanol daun tumbuhan tembelekan
untuk panduan fraksinasi dengan perbandingan fase gerak
93:7……… 36
Gambar 3. Kromatogram ekstrak etanol daun tumbuhan tembelekan
untuk panduan fraksinasi dengan perbandingan fase gerak
90:10..……… 38
Gambar 4. Kromatogram ekstrak etanol daun tumbuhan tembelekan
untuk panduan fraksinasi dengan perbandingan fase gerak
85:15..……… 39
Gambar 5. Kromatogram ekstrak etanol daun tumbuhan tembelekan
untuk panduan fraksinasi dengan perbandingan fase gerak
80:20..……… 40
Gambar 6. Kromatogram 12 fraksi ekstrak etanol daun tumbuhan
tembelekan hasil fraksinasi dengan jarak pengembangan 15
cm……….. 42
Gambar 7. Kurva hubungan nilai probit versus log konsentrasi F2... 51
Gambar 9. Kurva hubungan nilai probit versus log konsentrasi F4... 52
Gambar 10. Kromatogram tiga fraksi toksik daun tumbuhan
tembelekan………. 56
Gambar 11. Potongan atas gambar 14, Kromatogram fraksi toksik daun
tumbuhan tembelekan... 58
Gambar 12 Potongan bawah Gambar 14, Kromatogram fraksi toksik
daun tumbuhan tembelekan... 59
Gambar 13. Potongan tengah Gambar 14, Kromatogram fraksi toksik
daun tumbuhan tembelekan.……….. 60
Gambar 14. Foto kromatogram kontrol KLTP. (A) deteksi UV 365 nm,
(B) deteksi vanilin-asam sulfat... 61
Gambar 15. Foto kromatogram KLTP bercak Rf 0,3 dari fraksi
DAFTAR LAMPIRAN
Lampiran 1. Surat keterangan determinasi tumbuhan tembelekan... 69
Lampiran 2. Foto tumbuhan tembelekan... 70
Lampiran 3. Foto bunga tumbuhan tembelekan... 70
Lampiran 4. Foto buah tumbuhan tembelekan... 71
Lampiran 5. Foto aquarium untuk uji BST... 71
Lampiran 6. Foto rangkaian alat Vaccum Coloumn Chromatography (VCC)……… 72
Lampiran 7. Foto hasil fraksinasi Vaccum Coloumn Chromatography… 72 Lampiran 8. Data fraksinasi dan penggabungan fraksi………. 73
Lampiran 9. Data orientasi untuk mendapatkan seri konsentrasi yang akan digunakan dalam pengujian serta data kematian setelah perlakuan... 74 Lampiran 10. Perhitungan data statistik SPSS 10.00 dengan menggunakan analisis probit terhadap F2 daun tumbuhan tembelekan... 83
Lampiran 11. Perhitungan data statistik SPSS 10.00 dengan
menggunakan analisis probit terhadap F3 daun tumbuhan
tembelekan... 86
Lampiran 12. Perhitungan data statistik SPSS 10.00 dengan
menggunakan analisis probit terhadap F4 daun tumbuhan
Lampiran 13. Data kromatogram dari 3 fraksi toksik... 92
Lampiran 14. Data kromatogram KLTPreparatif dari bercak Rf 0,3 pada
F3... 93
DAFTAR SINGKATAN DAN LAMBANG
1. ALB = Air Laut Buatan
2. CaCl2 = kalsium klorida
3. cm = centi meter
4. g = gram
5. KCl = kalium klorida
6. KLT = Kromatografi Lapis Tipis
7. LC50 = Median Lethal Concentration
8. m = meter
9. mg = miligram
10. MgCl2 = magnesium klorida
11. MgSO4 = magnesium sulfat
12. ml = mililiter
13. mm = milimeter
14. NaCl = natrium klorida
15. NaHCO3 = natrium hidrokarbonat
16. nm = nanometer
17. UV = ultraviolet
18. oC = derajat celcius
19. l = liter
20. % = prosen/persen
21. μg/ml = microgram per mililiter
22. μl = microliter
BAB I PENGANTAR
A. Latar Belakang
Alam Indonesia memiliki berbagai jenis tumbuhan yang layak diteliti
dan dikembangkan potensinya sebagai sumber obat. Salah satunya adalah
tumbuhan tembelekan (Lantana camara L.) yang secara luas sudah digunakan
oleh masyarakat untuk menghilangkan pembengkakan/tumor, rematik, tetanus,
malaria, sebagai antiseptik, antitoksik, dan perangsang muntah (Rana, Prasad, and
Blazquez, 2005).
Daun tumbuhan tembelekan mengandung senyawa golongan terpenoid
diantaranya 1-triacontanol, α-pinene, cadidene, cadinol, camerene, β
-caryophyllen, cineole, citral, dipentene, eugenol, furfural, γ-terpinene, geraniol,
icterogenin, isocamarene, lantadene A, lantadene B, lantanic acid, lantanine,
lantanolic acid, linalool, methyl-3-oxo-ursolate, p-cymene, phellandral,
phellandrene, phellandrone, dan terpineol.(Duke, 2001).
Penelitian dengan metode Brine Shrimp Lethality Test (BST) yang
dilakukan oleh Sugianti (2007) menggunakan ekstrak etanol daun tumbuhan
tembelekan menunjukkan bahwa ekstrak etanol daun tumbuhan tembelekan
bersifat toksik dengan nilai LC50 sebesar 60,4 μg/ml. Perlu dilakukan penelitian
lebih lanjut untuk fraksi dari ekstrak etanol tumbuhan tembelekan dengan harapan
dapat diketahui suatu fraksi yang memberikan efek paling toksik sehingga dapat
Metode fraksinasi yang digunakan adalah Vaccum Coloumn Chromatography
(VCC) karena dapat memisahkan suatu senyawa dengan cepat. Metode VCC
termasuk pemisahan senyawa secara preparatif yang dilakukan dalam suatu kolom
dan diaktifkan dengan vakum. Proses eluasi yang terjadi berdasarkan gradien
kepolaran fase gerak (Coll & Bowden, 1986).
Metode BST adalah suatu metode yang cukup praktis, murah, sederhana,
cepat tapi tidak mengesampingkan keakuratannya untuk skrining awal tanaman
berpotensi antikanker dengan menggunakan hewan uji larva Artemia salina Leach.
Prinsip metode ini adalah uji toksisitas akut terhadap artemia dengan penentuan
nilai LC50 setelah perlakuan 24 jam (Meyer, Ferrigni, Putnam, Jacobsen, Nichols,
and McLaughlin, 1982). Artemia digunakan sebagai hewan uji karena artemia
memiliki kesamaan tanggapan dengan mammalia, misalnya tipe DNA-dependent
RNA polimerase artemia serupa dengan yang terdapat pada mammalia dan
organisme ini memiliki ouabaine-sensitive Na+ and K+ dependend ATPase,
sehingga senyawa maupun ekstrak yang memiliki aktivitas pada sistem tersebut
dapat terdeteksi (Solis, Wright, Anderson, Gupta, and Phillipson, 1993).
Metode BST tidak spesifik terhadap antikanker dan sebagian aksi
fisiologis, namun metode ini dapat memonitor kemungkinan adanya efek
sitotoksik tanpa perlu menghabiskan waktu dan biaya penelitian dibandingkan
dengan pengujian sitotoksisitas umum, misalnya dengan menggunakan biakan sel
kanker. Penelitian yang dilakukan Meyer et al., (1982) dan Solis et al., (1993)
menunjukkan bahwa senyawa yang bersifat sitotoksik akan bersifat toksik bila
belum tentu bersifat sitotoksik, sehingga perlu dilakukan uji tingkat lanjut dengan
menggunakan biakan sel kanker. Suatu larutan memiliki nilai LC50 < 1000 μg/ml
maka larutan tersebut memiliki efek toksik yang besar yang nantinya diharapkan
memiliki efek sitotoksik, yang merupakan syarat utama untuk aktivitas antikanker.
Dengan demikian, diharapkan metode BST dapat digunakan sebagai langkah awal
untuk menemukan senyawa-senyawa yang memiliki efek sitotoksik.
1. Perumusan masalah
a. Fraksi manakah dari ekstrak etanol daun tumbuhan tembelekan yang
paling toksik terhadap larva artemia yang ditunjukkan dengan nilai LC50
paling kecil?
b. Bagaimanakah profil KLT fraksi paling toksik ekstrak etanol daun
tumbuhan tembelekan?
2. Keaslian penelitian
Penelitian yang pernah dilakukan dengan menggunakan daun tumbuhan
tembelekan antara lain isolasi dan identifikasi komponen kimia daun tembelekan
asal Tamalanrea Ujung Pandang oleh Aida (1990); penelitian farmakognosi dan
kandungan kimia dari daun Lantana camara oleh Soelastru (1986); pemeriksaan
flavonoid dan verbaskosid daun Lantana camara L. oleh Asterina (1994); uji
potensi antibakteri ekstrak etanol daun tembelekan terhadap Staphylococcus
aureus ATCC 25923 dan Escherichia coli ATCC 35218 oleh Asteria (2006).
Brine Shrimp Lethality test (BST) ekstrak etanol daun tumbuhan tembelekan
(Lantana camara L.) beserta profil kromatografi lapis tipisnya oleh Sugiyanti
mengenai toksisitas akut fraksi dari ekstrak etanol daun tumbuhan tembelekan
terhadap larva artemia.
3. Manfaat penelitian a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi yang berguna
bagi ilmu pengetahuan terutama dalam bidang farmasi mengenai besarnya
toksisitas fraksi dari ekstrak etanol daun tumbuhan tembelekan terhadap
larva artemia sehingga dapat dilakukan isolasi untuk mendapatkan
senyawa yang berpotensi untuk pengobatan kanker.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi kepada
masyarakat mengenai kemungkinan pengobatan alternatif penyakit kanker
menggunakan daun tumbuhan tembelekan.
B. Tujuan Penelitian
1. Mengetahui fraksi ekstrak etanol daun tumbuhan tembelekan yang paling
toksik terhadap larva artemia yang ditunjukkan dengan nilai LC50 paling kecil.
2. Mengetahui profil KLT dari fraksi paling toksik ekstrak etanol daun tumbuhan
BAB II
PENELAAHAN PUSTAKA A. Tembelekan 1. Keterangan botani
Tembelekan (Lantana camara L.) termasuk dalam familia
Verbenaceae. Tembelekan mempunyai sinonim: L. aculeata L., L. antillana
Rafin, L. mutabilis Salisb., L. polyacanthus SCH., L. scabrida Soland, L.
viburnoides Blanco (Dalimartha, 2002)
2. Nama daerah
Sumatra : Bunga pagar, kayu singapore, tahi ayam (Melayu)
Sunda : Kembang satek, saliyara, saliyere, tahi ayam, t. Kotok,
cente.
Jawa : Kembang telek, Oblo, puyengan, pucengan, tembelek,
tembelekan, teterapan, waung, weliran.
Madura : Kamanco, mainco, tamanjho.
(Dalimartha, 2002).
3. Deskripsi tumbuhan
Tembelekan berupa perdu bercabang banyak, tinggi 0,5-5 m. Batang
segi empat, batang muda penuh rambut, kelenjar kecil dan selalu dengan duri
tempel. Daun bertangkai sangat panjang, bulat telur dengan pangkal tumpul, dan
ujung runcing, bergigi, bergerigi, dari sisi atas berbulu kasar, dari sisi bawah
berbulu jarang, (5-8) kali (3,5-5) cm. Bentuk bunga bulir pendek di ketiak,
berbentuk tabung lonceng, berlekuk tidak dalam, tinggi ± 2 mm. Tabung mahkota
membengkok, panjang ± 1 cm, tepian bertaju 4-5, taju tidak sama besarnya,
orange, merah muda, merah atau putih, sering bergantian warna. Benangsari
empat, yang panjang dua. Buah batu saling berdekatan, bentuk bulat telur, berinti
satu. Tumbuhan hias atau pagar, berasal dari Amerika Tropis, sebagian besar liar,
tumbuh pada ketinggian 1-700 m di atas permukaan laut, tumbuh di daerah yang
cerah matahari sampai cukup teduh. (Van Steenis, 1975).
4. Kandungan kimia
Daun tembelekan mengandung 1-triacontanol, aldehid, α-pinene,
amylase, cadidene, cadinol, camerene, β-caryophyllen, katalase, cineole, citral,
dipentene, eugenol, furfural, γ-terpinene, geraniol, glukosidase, icterogenin,
invertase, isocamarene, lantadene A, lantadene B, lantanic acid, lantanine,
lantanolic acid, linalool, lipase, methyl-3-oxo-ursolate, oksidase, p-cymene,
phellandral, phellandrene, phellandrone, sodium, tannase, tannin, dan terpineol
(Duke, 1999)
5. Khasiat dan kegunaan
Daun tembelekan berkhasiat untuk mengatasi sakit kulit, gatal-gatal,
bisul, luka, batuk, dan perangsang muntah sedangkan akar tembelekan untuk
mengatasi influenza, TBC kelenjar, rematik, keputihan, memar, bengkak, kencing
nanah, gondongan, dan asma (Dalimartha, 2002).
6. Penelitian dengan BST
Penelitian dengan BST diketahui ekstrak etanol daun tumbuhan
tembelekan mempunyai nilai LC50 sebesar 60,4 μg/ml terhadap larva artemia.
Dugaan senyawa yang berperan dalam kematian larva artemia adalah pentasiklik
triterpenoid dan flavonoid (Sugiyanti, 2007).
B. TERPENOID
Terpenoid berasal dari molekul isoprene CH2=C(CH3)-CH=CH2.
Terpenoid terdiri atas beberapa macam senyawa mulai dari komponen minyak
atsiri yaitu monoterpenoid dan sesquiterpenoid yang mudah menguap sampai ke
senyawa yang tidak mudah menguap yaitu triterpenoid dan sterol (C30) serta
pigmen karotenoid (C40) (Harborne, 1984). Triterpen tersebar luas dalam damar
gabus, dan kutin tumbuhan (Robinson, 1991). Triterpen di alam dapat berbentuk
ester atau glikosida dan kemungkinan berstruktur alifatik, tetrasiklik atau
pentasiklik. Triterpen saponin biasanya dalam bentuk pentasiklik (Evans and
Trease, 2002). Triterpen alkohol terdapat bebas dan juga sebagai glikosida.
(Robinson, 1999).
HO
Pentasiklik triterpenoid dapat menghambat kerja enzim topoisomerase
I dan II serta menghambat RNA polymerase sehingga mengakibatkan kematian sel
(Lee, Fang, Wang, Li, Cook, 1991). Untuk mendeteksi adanya triterpenoid salah
satunya dapat dilakukan dengan metode kromatografi lapis tipis. Metode ini dapat
menggunakan fase diam silika gel dan dengan memakai pengembang seperti
heksan, etil asetat (1:1); kloroform, metanol (10:1); atau toluene : etil asetat
(93:7). Sebagai deteksi dapat digunakan penyemprotan dengan vanilin-asam sulfat
pekat, diteruskan dengan pemanasan pada 100°C - 105°C sampai pembentukan
warna sempurna (Harborne, 1984). Untuk senyawa terpenoid, akan menghasilkan
warna abu-abu, merah violet , atau ungu (Wagner, Brady, and Zgainski, 1984).
C. Artemia
Artemia termasuk dalam familia Artemidae, genus Artemia, spesies
Artemia salina Leach (Mudjiman, 1989). Istilah untuk telur artemia yang benar
adalah siste, yaitu telur yang telah berkembang lebih lanjut menjadi embrio dan
kemudian diselubungi oleh cangkang yang tebal dan kuat. Cangkang ini berguna
untuk melindungi embrio terhadap pengaruh kekeringan, benturan keras, sinar
ultraviolet dan mempermudah pengapungan. Sehingga sangat tahan terhadap
keadaan lingkungan yang buruk (Mudjiman, 1989).
Apabila telur artemia direndam dalam air laut bersuhu 25o C, maka
akan menetas dalam waktu 24-36 jam. Setelah menetas, dari dalam cangkang
keluarlah burayak atau larva/nauplius. Burayak yang baru saja menetas masih
mengandung makanan cadangan. Oleh karena itu mereka masih belum perlu
makan.
Sekitar 24 jam setelah menetas, burayak akan berubah menjadi instar
II. Pada tingkatan instar II, larva sudah mulai mempunyai mulut, saluran
pencernaan dan dubur. Oleh karena itu mereka mulai mencari makanan.
Bersamaan dengan itu, cadangan makanannya juga sudah mulai habis.
Pengumpulan makanannya mereka lakukan dengan menggerak-gerakkan antena II
nya. Selain untuk mengumpulkan makanan, antena II tersebut juga berguna untuk
bergerak.
1. Lingkungan hidup artemia
Artemia tidak dapat bertahan hidup pada suhu kurang dari 6o C atau
lebih dari 35o C, tetapi hal ini sangat tergantung pada ras dan kebiasaan tempat
hidup. Dengan demikian pertumbuhan artemia yang baik berkisar pada suhu
antara 25-30o C (Mudjiman, 1989).
Daya tahan artemia terhadap perubahan kandungan ion-ion kimia
dalam air ternyata juga sangat tinggi. Apabila kandungan ion natrium
dibandingkan dengan ion kalium di dalam air laut alami adalah 28, maka artemia
masih dapat bertahan pada perbandingan antara 8-173 (Mudjiman, 1989).
Perkembangan artemia yang baik membutuhkan kadar garam yang
tinggi sebab pada kadar garam yang tinggi itu musuh-musuhnya sudah tidak dapat
hidup lagi, sehingga artemia akan dapat aman tanpa gangguan. Untuk
pada suatu batas tertentu. Batas ini berlainan untuk setiap jenis artemia
(Mudjiman,1989).
Artemia dapat hidup dan menyesuaikan diri pada tempat yang kadar
oksigennya rendah maupun yang mengalami kejenuhan oksigen. Pengaruh pH
terhadap kehidupan artemia muda dan dewasa belum jelas namun berpengaruh
terhadap penetasan telur. Apabila pH untuk penetasan kurang dari 8, maka
efisiensi penetasan akan menurun (Mudjiman, 1989).
2. Penggunaan artemia pada metode BST
Artemia adalah hewan coba yang digunakan untuk praskrining
aktivitas antikanker di National Cancer Institude (NCI), Amerika Serikat (Meyer
et al., 1982). Metode ini sering digunakan untuk skrining awal terhadap senyawa
aktif yang terdapat di dalam ekstrak tanaman karena murah, cepat, mudah (tidak
memerlukan kondisi aseptis), dan dapat dipercaya (Meyer et al., 1982). Artemia
secara luas telah digunakan untuk pengujian aktivitas farmakologi ekstrak suatu
tanaman. Lebih dari itu, uji larva udang ini juga dapat digunakan untuk skrining
awal terhadap senyawa-senyawa yang diduga berkhasiat sebagai antitumor karena
uji ini seringkali mempunyai korelasi yang positif dengan potensinya sebagai
antitumor (Anderson, Goets, and Mc Laughin, 1991).
Penggunaan artemia ini memang tidak spesifik untuk antitumor
maupun fisiologis aktif tertentu, namun beberapa penelitian terdahulu
menunjukkan adanya korelasi yang signifikan terhadap beberapa bahan, baik
berupa ekstrak tanaman, atas aksinya sebagai antitumor secara lebih cepat
dengan biakan sel tumor (Meyer et al., 1982). Melihat adanya potensi sebagai
antitumor tersebut, maka penelitian lanjutan dapat dilakukan, yaitu dengan
mengisolasi senyawa berkhasiat yang terdapat didalam ekstrak disertai dengan
monitoring aktivitasnya dengan uji larva udang atau metode yang lebih spesifik
sebagai antitumor (Mayer et al., 1982).
Penggunaan hewan uji artemia dimaksudkan bahwa artemia memiliki
kesamaan tanggapan dengan mammalia, misalnya tipe DNA-dependent RNA
polimerase artemia serupa dengan yang terdapat pada mammalia dan organisme
ini memiliki ouabaine-sensitive Na+ and K+ dependend ATPase. Pengujian dengan
artemia terhadap tingkat ketoksikan senyawa kimia, antara lain adalah pengujian
pestisida, mikotoksin, anestetika, dan lain-lain (Meyer et al., 1982).
Artemia dapat digunakan sebagai hewan uji karena artemia memiliki
kesamaan tanggapan dengan mamalia, misalnya tipe DNA-dependent RNA
polymerases yang terdapat pada artemia serupa dengan yang terdapat pada
mamalia dan organisme ini juga memiliki ouabaine-sensitive Na+ and K+
dependent ATPase (Solis et al., 1992).
DNA-dependent RNA polymerases merupakan DNA yang
mengarahkan proses transkripsi RNA yang bergantung pada RNA polymerases.
Enzim ini membuka pilinan kedua untai DNA sehingga terpisah dan
mengkaitkannya bersama-sama nukleotida RNA pada saat nukleotida-nukleotida
ini membentuk pasangan-basa di sepanjang cetakan DNA. Eukariotik mempunyai
3 macam RNA polymerases yaitu mRNA (messenger RNA) yang merupakan
berfungsi untuk menterjemahkan kodon dan mengikat asam amino yang akan
disusun menjadi protein dan mengangkutnya ke ribosom, serta rRNA (ribosomal
RNA) yang bersama dengan protein membentuk ribosom. Jika RNA polymerases
tersebut dihambat, maka DNA tidak dapat mensintesis RNA dan RNA tidak dapat
terbentuk sehingga sintesis protein juga dihambat. Protein merupakan komponen
utama semua sel. Protein berfungsi sebagai unsur struktural, hormon,
imunoglobulin, serta terlibat dalam kegiatan transport oksigen, kontraksi otot, dan
lainnya (Nuswantari, 1998). Tidak terbentuknya protein dapat mengganggu
metabolisme sel, sehingga pada akhirnya akan menyebabkan kematian sel.
Enzim Na+ K+ ATPase merupakan enzim yang mengkatalisis hidrolisis
ATP menjadi ADP serta menggunakan energi untuk mengeluarkan 3 Na+ dari sel
dan mengambil 2 K+ ke dalam, tiap sel bagi tiap mol ATP dihidrolisis. Na+ K+
ATPase ditemukan dalam semua bagian tubuh. Aktivitas enzim ini dihambat oleh
ouabaine. Adanya ouabaine menyebabkan keseimbangan ion Na+ dan K+ tetap
terjaga (homeostasis). Selain itu, sekarang ini ouabaine juga digunakan untuk
terapi payah jantung. Di dalam jantung, Na+ K+ ATPase secara tak langsung
mempengaruhi transport Ca2+ karena Na+ ekstrasel akan ditukar dengan Ca2+
intrasel. Jika kerja Na+ K+ ATPase dihambat, maka lebih sedikit Ca2+ intrasel
dikeluarkan dan Ca2+ intrasel meningkat, sehingga memudahkan kontraksi otot
jantung (Ganong, 1995).
Suatu senyawa yang mempunyai aktivitas mengganggu kerja salah
satu enzim ini pada artemia dan menyebabkan kematian artemia, maka senyawa
BST dengan hewan uji artemia tidak dapat digunakan untuk pengujian senyawa
yang dalam mengganggu kerja salah satu enzim tersebut memerlukan aktivasi
dalam sel mamalia, seperti 6-mercaptopurine yang harus dimetabolisme terlebih
dahulu dalam sel mamalia. Sehingga jika senyawa 6-mercaptopurine diujikan
pada artemia, maka akan memberikan LC50 yang lebih besar dari 1000 (bersifat
tidak toksik pada artemia) (Solis et al.,1992)
Tingkat toksisitas dari ekstrak tanaman dapat ditentukan dengan
melihat harga LC50. Analisis data dilakukan dengan analisis probit untuk
menghitung LC50. Dari persentase data kematian larva artemia dikonversikan
probit untuk menghitung harga LC50. Apabila harga LC50 ≤ 1000 μg/ml maka
dikatakan toksik. Apabila pengujian dengan larva artemia menghasilkan harga
LC50 ≤ 1000 μg/ml dapat dilanjutkan dengan pengujian antikanker menggunakan
biakan sel kanker. Dengan cara ini akan menghemat waktu dan biaya penelitian
(Meyer et al., 1982). Keuntungan penggunaan artemia sebagai hewan uji adalah
kesederhanaan dalam pelaksanaan, waktu relatif singkat, dan konsentrasi kecil
sudah dapat menimbulkan aktivitas biologi (Meyer et al., 1982).
D. Toksisitas Akut
Pada prinsipnya metode BST merupakan uji toksisitas akut yang
dilakukan dengan menghitung jumlah kematian Artemia salina Leach untuk
menentukan besarnya efek toksik.
Toksisitas dapat didefinisikan sebagai kemampuan suatu zat untuk
menimbulkan kerusakan (Katzung, 1987). Uji toksisitas akut merupakan uji
ketoksikan suatu senyawa yang diberikan dengan dosis tunggal pada hewan uji
tertentu dan pengamatan dilakukan selama 24 jam. Maksud dari toksisitas akut
yaitu untuk menentukan suatu gejala dan tingkat kematian hewan uji akibat
pemberian senyawa tersebut. Pengamatan aktivitas biologi uji toksisitas akut
berupa pengamatan gejala klinik, kematian hewan uji atau pengamatan
histopatologi organ (Loomis, 1978).
Uji toksisitas akut dilakukan untuk mempersempit kisaran dosis dan
terakhir dilakukan uji toksisitas akut untuk mendapatkan presentase kematian.
Data yang diperoleh dari uji toksisitas akut dapat berupa data kuantitatif yang
dinyatakan dengan LD50 (median lethal dose) atau LC50 (median lethal
concentration). Harga LD50 dan LC50 suatu senyawa harus dilaporkan sesuai
dengan lamanya pengamatan. Bilamana lama pengamatan tidak ditunjukkan,
dianggap bahwa pengamatan dilakukan selama 24 jam (Loomis, 1978).
Parameter yang digunakan untuk menunjukkan adanya aktivitas
biologis suatu senyawa pada artemia adalah kematian. Keuntungan penggunaan
artemia sebagai hewan uji adalah kesederhanaan dalam pelaksanaan, waktu relatif
singkat, dan konsentrasi kecil sudah dapat menimbulkan aktivitas biologis (Meyer
et al., 1982).
E. Kanker
Kanker adalah suatu penyakit yang ditandai dengan terjadinya
pertumbuhan sel-sel jaringan tubuh yang tidak normal, cepat, dan tidak terkendali.
Sel-sel kanker akan terus membelah diri, terlepas dari pengendalian pertumbuhan,
cepat dihentikan dan diobati maka sel kanker akan terus berkembang. Sel kanker
akan tumbuh menyusup ke jaringan sekitarnya (invasive), lalu membuat anak
sebar (metastasis) ke tempat yang lebih jauh melalui pembuluh darah dan
pembuluh getah bening. Selanjutnya akan tumbuh kanker baru di tempat lain
sampai akhirnya menyebabkan kematian penderita. Pembentukan kanker dapat
dirangsang oleh karsinogen seperti senyawa kimia, faktor fisika (radiasi bom atom
dan radioterapi agresif), virus (virus hepatitis B dan C), dan hormon (Dalimartha,
2003).
F. Penyarian
Pemilihan penyari dalam penyarian merupakan hal yang harus
dipertimbangkan. Cairan penyari untuk ekstrak sebaiknya sesuai dengan zat aktif
yang berkhasiat, dalam arti dapat memisahkan zat aktif tersebut dari senyawa
lainnya dalam bahan sehingga ekstrak mengandung sebagian besar senyawa aktif
berkhasiat yang diinginkan (Anonim, 2000).
Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari
simplisia nabati atau hewani menurut cara yang cocok, di luar pengaruh cahaya
matahari langsung. Ekstrak kering harus mudah digerus menjadi serbuk (Anonim,
1979).
Maserasi merupakan cara penyarian yang sederhana. Maserasi
dilakukan dengan cara merendam serbuk simplisia ke dalam penyari. Penyari akan
menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat
aktif. Zat aktif akan larut karena adanya beda konsentrasi antara larutan di dalam
berulang sehingga terjadi keseimbangan konsentrasi antara larutan di dalam dan di
luar sel (Anonim, 1986 ).
G. Kromatografi Kolom Vakum
Kromatografi kolom vakum adalah suatu bentuk fraksinasi kolom yang
terutama bermanfaat untuk fraksinasi secara kasar dengan cepat. Metode ini
merupakan modifikasi kromatografi kinerja tinggi, sehingga dapat diperoleh
resolusi atau pemisahan senyawa yang lebih baik. Cara ini mengacu pemisahan
terpen dan campuran lipid. Kelebihan metode ini antara lain: tekniknya sederhana,
waktunya cepat, fase diam dan fase gerak yang digunakan relatif sedikit. Selain
itu, pemilihan sistem pelarut dapat dilakukan dengan sistem yang sederhana dan
murah yaitu Kromatografi Lapis Tipis (KLT). Cara ini melibatkan elusi
berdasarkan tingkat kepolaran fase gerak dan kolom diperbolehkan mengering
setelah masing-masing fraksi dikumpulkan. Sampel yang digunakan tidak kurang
dari 1 gram dan hanya 10-15 ml fraksi yang bisa dikumpulkan dari
masing-masing polaritas. Fase diam yang biasa digunakan adalah silika gel dan diisikan
ke dalam kolom dengan tinggi tidak lebih dari 5 cm (coll & bowden, 1986).
Kolom kromatografi dikemas kering dalam keadaan vakum agar
diperoleh kerapatan kemasan maksimum. Vakum dihentikan, pelarut yang
kepolarannya rendah dituangkan ke permukaan penyerap lalu di vakumkan lagi.
Kolom di hisap sampai kering dan siap dipakai. Cuplikan, dilarutkan dalam
pelarut yang cocok, dimasukkan langsung di bagian atas kolom dan dihisap
dengan campuran pelarut yang cocok, mulai dengan pelarut yang kepolarannya
rendah lalu kepolaran ditingkatkan perlahan-lahan (Hostettman & Marston, 1986)
H. Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis (KLT) ialah metode pemisahan fisikokimia.
Lapisan yang memisahkan terdiri dari bahan berbutir-butir (fase diam),
ditempatkan pada penyangga berupa pelat gelas, logam atau lapisan yang cocok
(Stahl, 1985).
Kelebihan khas KLT ialah keserbagunaan, kecepatan, dan
kepekaannya. Keserbagunaan KLT disebabkan oleh kenyataan bahwa disamping
silika, sejumlah penjerap yang berbeda-beda dapat disaputkan pada pelat kaca
atau penyangga lain. Kecepatan KLT yang lebih besar disebabkan oleh sifat
penjerap yang lebih padat bila disaputkan pada pelat dan merupakan keuntungan
bila digunakan untuk menelaah senyawa labil. Kepekaan KLT sedemikian rupa,
sehingga bila diperlukan dapat dipisahkan bahan yang jumlahnya lebih sedikit
dari ukuran µg (Harborne, 1987)
Fase diam (lapisan penjerap) dibuat dari salah satu penjerap yang
khusus digunakan untuk KLT. Penjerap yang umum digunakan ialah silika gel,
aluminium oksida, kieselgur, selulosa, dan lain-lain. Untuk analisis, tebal
penyerap 0,1-0,3 mm, biasanya 0,2 mm (Stahl, 1985).
Fase gerak ialah medium angkut yang terdiri dari satu atau beberapa
pelarut, bergerak di dalam fase diam yang merupakan lapisan berpori, yang
Deteksi senyawa pada pelat KLT biasanya dilakukan dengan
penyemprotan (Harborne, 1987). Deteksi paling sederhana adalah jika senyawa
yang menunjukkan penyerapan di daerah UV dengan panjang gelombang 254 nm
(gelombang pendek) atau jika senyawa itu dapat dieksitasi ke fluoresensi radiasi
UV gelombang pendek dan atau gelombang panjang (365 nm) (Stahl, 1985).
Jarak pengembangan senyawa pada kromatografi biasanya dapat
digunakan untuk identifikasi senyawa yang dianalisa.
Rf =
awal titik dari depan garis
Jarak
awal titik dari bercak pusat
I. KETERANGAN EMPIRIS
Penelitian ini dilakukan untuk mendapatkan data empiris tentang
toksisitas fraksi paling toksik ekstrak etanol daun tumbuhan tembelekan terhadap
larva artemia dengan metode BST yang dinyatakan dalam LC50 serta untuk
memperoleh profil kromatografi lapis tipis fraksi paling toksik daun tumbuhan
tembelekan.
Data empiris yang diperoleh melalui uji toksisitas fraksi daun
tumbuhan tembelekan ini memungkinkan untuk dilakukan eksplorasi guna
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis eksperimental murni dengan rancangan
Posttest Only Control GroupDesign.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas
Jenis fraksi dari ekstrak etanol daun tumbuhan tembelekan yang
diujikan pada metode BST.
b. Variabel tergantung
Nilai LC50 dari tiap fraksi setelah diuji dengan metode BST.
c. Variabel pengacau terkendali
1) Lingkungan tempat percobaan: sinar lampu 5 watt, suhu penetasan
25o -30o C, serta pH air laut buatan antara 7-8 dengan kadar garam 5
permil.
2) Hewan uji: Umur larva artemia adalah 48 jam.
3) Tanaman: spesies atau varietas tumbuhan tembelekan.
4) Air laut buatan : merupakan campuran dari 5 gram natrium klorida
(MgCl2), 0,3 g kalsium klorida (CaCl2), 0,2 g kalium klorida (KCl),
dan 2 g natrium hidrokarbonat (NaHCO3) dalam 1 liter aquades.
2. Definisi operasional
a. Daun tumbuhan tembelekan yang digunakan adalah daun yang masih
muda, merupakan daun ke-3 sampai 4 dari ujung tangkai, dipetik pada saat
tumbuhan sedang berbunga.
b. LC50 (lethal concentration-50) merupakan kadar senyawa uji yang mampu
mengakibatkan terbunuhnya separuh (50%) jumlah hewan uji dan
ditentukan setelah 24 jam perlakuan
c. Ekstrak etanol yang digunakan untuk proses fraksinasi merupakan ekstrak
etanol kering yang telah diketahui toksisitasnya terhadap larva artemia.
d. Fraksi merupakan hasil dari pemisahan ekstrak etanol dengan metode
Vaccum Coloumn Chromatography (VCC) yang belum diketahui LC50
-nya.
e. Fraksi toksik adalah fraksi yang diperoleh dari fraksinasi ekstrak etanol
kering dengan metode VCC menggunakan fase gerak toluen-etil asetat
(85:15 v/v) serta fase diam Silika gel GF 254, yang memiliki LC50 ≤ 1000
μg/ml dalam metode BST.
f. Fraksi paling toksik adalah fraksi yang memiliki harga LC50 paling kecil
dari semua fraksi uji dalam kisaran ≤ 1000 μg/ml dalam metode BST.
C. Bahan dan Alat Penelitian 1. Bahan penelitian
a. Bahan utama
Daun tumbuhan tembelekan diperoleh pada bulan Agustus 2006
dari tumbuhan tembelekan di belakang RSJ Grahasia, Pakem, Sleman,
Yogyakarta.
b. Bahan untuk penyarian
Bahan yang digunakan untuk penyarian berderajat pro analysis
(p.a.), kecuali bila disebutkan lain. Bahan tersebut adalah aquades (yang
diambil dari Laboratorium Farmakognosi Fitokimia Universitas Sanata
Dharma Yogyakarta).
c. Bahan untuk BST
1) Telur artemia Viper (Jeannie Hoo., LTD, China)
2) Air laut buatan dengan kadar garam 5 per mil
3) Fraksi ekstrak etanol daun tumbuhan tembelekan,
4) Ragi Saccharomyces cerevisae.
d. Bahan untuk air laut buatan
Bahan kimia yang digunakan untuk pembuatan air laut buatan
berderajat teknis. Bahan-bahan terdiri dari natrium klorida, magnesium
sulfat, magnesium klorida, kalsium klorida, kalium klorida, natrium
e. Bahan untuk KLT
Lempeng KLT dengan fase diam silika gel GF254 (MERCK),
larutan pengembang toluen, etilasetat, pereaksi semprot vanillin-asam
sulfat, ekstrak etanol dan fraksi aktif tumbuhan tembelekan.
f. Bahan untuk Fraksinasi
Fase diam silika gel GF 254 (E.merck), fase gerak Toluen, Etil
asetat, ekstrak etanol tumbuhan tembelekan.
2. Alat penelitian
a. Alat untuk penyarian
Gelas ukur (Pyrex), waterbath (Memmert), Erlenmeyer (Pyrex),
neraca analitik (Mettler Toledo AB 204), vaccum rotary evaporator (Janke
& Kunkel), batang pengaduk, sendok, cawan porselen.
b. Alat untuk uji BST
Flakon, bak penetasan artemia (lokal), mikropipet (Socorex ISBA
S.A), lampu 5 watt (dop), aerator (Niko Nk 1200), pipet tetes, neraca
analitik (Mettler Toledo AB 204), Vortex (Dijkstra).
c. Alat untuk KLT
Pipa kapiler 5 µl, bejana kromatografi, alat semprot, kertas saring,
plat kaca, lampu UV dengan panjang gelombang 254 nm dan 365 nm.
d. Alat untuk Fraksinasi
Pipa kolom, vaccum hose Buchner, Beaker glass, gelas ukur, corong,
D. Tata Cara Penelitian 1. Determinasi tumbuhan tembelekan
Determinasi tumbuhan bertujuan untuk memastikan bahwa tumbuhan
yang digunakan adalah Lantana camara L.. Determinasi tumbuhan dilakukan di
Laboratorium Kebun Obat, Fakultas Farmasi Sanata Dharma Yogyakarta dengan
menggunakan buku acuan menurut Becker and Backhuizen vol. I (1963) dan Vol
II (1965). Hasil determinasi tumbuhan berupa nama jenis (species) tumbuhan
yang digunakan dalam penelitian ini.
2. Pengumpulan bahan
Daun tumbuhan tembelekan diambil saat tumbuhan sedang berbunga
dan berbuah pada bulan Agustus 2006 di belakang RSJ Grahasia, Pakem, Sleman,
Yogyakarta.
3. Penyiapan bahan
Daun tumbuhan tembelekan yang sudah diambil dicuci dengan air bersih
yang mengalir, kemudian diangin-anginkan. Apabila sudah bersih daun tumbuhan
tembelekan dikeringkan dibawah sinar matahari secara tidak langsung dengan
ditutupi kain hitam. Daun dapat diasumsikan kering apabila daun diremas dapat
hancur. Setelah kering dipotong kecil-kecil dan diserbuk.
4. Maserasi
Serbuk daun tumbuhan tembelekan ditimbang sebanyak 30 g,
dimasukkan dalam erlenmeyer kemudian ditambahkan pelarut etanol pro analysis
(p.a) sebanyak 225 ml. Erlenmeyer ditutup dengan aluminium foil, lalu diletakkan
larutan disaring dengan kertas saring. Maserat ditampung dan disimpan pada suhu
kamar sedangkan ampasnya dimaserasi lagi dengan 225 ml etanol p.a.
menggunakan shaker 130 rpm selama 24 jam, lalu disaring dan maserat
ditampung untuk digabungkan dengan maserat hasil maserasi 24 jam pertama.
Maserat yang terkumpul lalu dipekatkan dengan vaccum rotary
evaporator sampai kental (volume kira-kira 1/3 nya). Setelah itu, dengan
menggunakan cawan porselen yang sudah ditimbang terlebih dahulu, ekstrak
diuapkan di atas waterbath dengan suhu 50°C dan dengan kipas angin sampai
didapatkan ekstrak kering.
5. Fraksinasi
Sebelumnya dilakukan KLT orientasi/panduan untuk fraksinasi. Hal ini
dilakukan untuk optimasi pemilihan fase gerak pada proses fraksinasi. Fase diam
yang digunakan adalah silika gel GF 254 dan fase gerak yang digunakan adalah
campuran toluen-etil asetat dengan perbandingan 85:15 v/v.
a. Pembuatan kolom fase diam
Serbuk silica gel dimasukkan ke dalam kolom sampai setinggi ± 5 cm,
dituang ke dalam beaker glass 200 ml, ditambahkan fase gerak sampai terendam
lalu diaduk hingga menjadi bubur homogen. Kolom dipasang di atas vaccum hose
buchner, beakerglass 100 ml diletakkan ke dalamnya, pompa vakum
dihubungkan. Bubur dituangkan ke dalam kolom, kemudian dihisap sampai tidak
b. Persiapan sampel
Ekstrak kental ditimbang 0,5 – 1 g dengan cawan porselen, ditambahkan
silica gel sesedikit mungkin, diaduk hingga menjadi serbuk kering. Serbuk sampel
dituang ke atas fase diam sampai rata. Sedikit serbuk silica gel ditaburkan di atas
serbuk sampel, ditutup dengan kertas saring sesuai dengan diameter kolom untuk
menjaga agar ekstrak tidak bergeser ketika dituangi fase gerak.
c. Proses Fraksinasi
Beaker gelas kosong ditempatkan pada posisi penampungan, fase gerak
pertama sebanyak 50 ml dituangkan secara hati-hati pada kolom, hisap dengan
pompa vakum sampai tidak menetes. Beaker gelas yang berisi larutan sampel
dipindahkan dan disimpan, diberi label no 1. Beaker gelas diganti dengan yang
baru, fase gerak kedua dituang sebanyak 50 ml ke dalam kolom secara hati-hati,
hisap dengan pompa vakum sampai tidak menetes. Pindahkan dan simpan beaker
gelas yang berisi larutan sampel, beri label no 2. Cara yang sama dilakukan untuk
sampel no 3 dan selanjutnya. Proses fraksinasi dihentikan ketika profil bercak
pada KLT fraksi sudah sesuai dengan profil bercak pada KLT orientasi.
d. Uji KLT fraksinasi
Sampel yang diperoleh kemudian dikentalkan sampai sekitar ± 30 ml,
ditotolkan 5 µl pada lempeng KLT (fase diam silica gel GF 254), dielusi pada fase
gerak toluene-etil asetat (85:15). Deteksi dengan dilihat pada UV 254 nm dan 365
nm serta dengan vanillin-asam sulfat. Kromatogram didokumentasikan. Fraksi
6. Pembuatan air laut buatan
Komposisi bahan yang digunakan untuk pembuatan air laut buatan
berkadar garam 5 per mil adalah 5 gram natrium klorida (NaCl), 1,3 g magnesium
sulfat (MgSO4), 1 g magnesium klorida (MgCl2), 0,3 g kalsium klorida (CaCl2),
0,2 g kalium klorida (KCl), dan 2 g natrium hidrokarbonat (NaHCO3) dicampur
dalam 1 liter aquades. Bahan-bahan sebagian dilarutkan dalam sebagian aquadest
dalam labu takar satu liter. Khusus untuk magnesium sulfat dilarutkan dalam air
panas, sedangkan natrium hidrokarbonat dilarutkan dengan air bebas CO2.
Kemudian ditambah aquadest sampai volume tepat 1 liter. Air laut buatan
berkadar garam 5 per mil dan pH antara 7,3 – 8,4 (Mudjiman, 1989).
7. Penetasan telur artemia
Artemia ditetaskan dari telurnya dengan media air laut buatan berkadar
5 permil. Telur artemia ditetaskan dalam aquarium yang disekat menjadi dua
bagian, bagian terang dan bagian gelap, dengan sekat berlubang. Bagian gelap
merupakan tempat telur artemia ditaburkan. Telur menetas setelah kira-kira 24-36
jam kemudian menjadi nauplius (Mudjiman, 1989). Nauplius yang aktif akan
bergerak menuju tempat yang terang melalui lubang pada sekat. Setelah 48 jam,
nauplius diambil dari bagian yang terang menggunakan pipet dan digunakan
8. Pembuatan larutan sampel
a. Pembuatan larutan A dan B ( larutan stok )
1) F2
Larutan A dengan konsentrasi 10 mg/ml (10 μg/μl) dibuat
dengan menimbang 100,0 mg ekstrak etanol daun tumbuhan tembelekan
kemudian dilarutkan dalam etanol p.a. sampai 10,0 ml. Larutan B dengan
konsentrasi 1 μg/μl dibuat dengan mengambil 1,0 ml dari larutan A
kemudian dilarutkan dalam etanol p.a. sampai 10,0 ml.
2) F3
Larutan A dengan konsentrasi 10 mg/ml atau 10 μg/μl dibuat
dengan menimbang 50,0 mg ekstrak etanol daun tumbuhan tembelekan
kemudian dilarutkan dalam etanol p.a. sampai 5,0 ml. Larutan B dengan
konsentrasi 1 μg/μl dibuat dengan mengambil 1,0 ml dari larutan A
kemudian dilarutkan dalam etanol p.a. sampai 10,0 ml. Larutan C dengan
konsentrasi 0,5 μg/μl dibuat dengan mengambil 0,5 ml dari larutan A
kemudian dilarutkan dalam etanol p.a. sampai 10,0 ml.
3) F4
Larutan A dengan konsentrasi 10 mg/ml atau 10 μg/μl dibuat
dengan menimbang 50,0 mg ekstrak etanol daun tumbuhan tembelekan
kemudian dilarutkan dalam etanol p.a. sampai 5,0 ml. Larutan B dengan
konsentrasi 1 μg/μl dibuat dengan mengambil 1,0 ml dari larutan A
b. Pembuatan larutan sampel
Dari larutan stok tersebut dibuat seri konsentrasi untuk tiap fraksi (cara
memperoleh konsentrasi lihat pada Lampiran 9).
1) F2 : (100; 178; 316,84; 563,97; 1003,87) μg/ml.
2) F3 : ( 5; 10,5; 22,05; 43,3; 97,2) μg/ml.
3) F4 : (10; 32; 102,4; 327,7; 1048,6) μg/ml.
Tabel I. Seri konsentrasi larutan sampel daun tumbuhan tembelekan
9. Uji toksisitas akut dengan BST
Uji toksisitas dilakukan dengan menggunakan larva artemia yang
berumur 48 jam (Meyer et al., 1982). Sepuluh ekor larva artemia yang berumur 48
jam diambil, dimasukkan ke dalam flakon yang telah berisi sampel dengan
konsentrasi tertentu, air laut buatan sebanyak 3 ml dan 1 tetes ragi (3mg/5ml)
sebagai makanan yang kemudian divortek. Air laut buatan ditambahkan sampai 5
ml. Setiap pengujian selalu disertai dengan kontrol dan masing-masing
konsentrasi dibuat dalam 5 kali replikasi. Flakon dijaga agar selalu mendapat
penerangan. Setelah 24 jam, jumlah larva artemia yang mati dihitung untuk
mengetahui nilai probit dan dianalisis untuk mengetahui harga LC50 (Meyer et al.,
1982).
10.Uji KLT fraksi toksik daun tumbuhan tembelekan
Uji dengan KLT ini bertujuan untuk mengetahui profil bercak dari fraksi
yang terdapat dalam fraksi daun tumbuhan tembelekan. Ekstrak kental fraksi daun
tumbuhan tembelekan dilarutkan dengan etanol dan ditotolkan pada lempeng
KLT. Lempeng KLT dimasukkan dalam bejana yang berisi fase gerak yang telah
jenuh lalu dielusi sampai jarak rambat 15 cm, kemudian diangkat dan dikeringkan.
Setelah itu elusi yang terjadi diamati dengan melihat bercak yang timbul.
Pengamatan bercak dilakukan dibawah sinar UV dengan panjang gelombang 254
nm dan 365 nm serta dengan pereaksi semprot.
Identifikasi triterpenoid, sistem KLT yang digunakan adalah sebagai berikut :
fase diam : silika gel GF 254 (MERCK)
deteksi : visibel, UV 254 nm dan UV 365 nm, dan vanillin asam sulfat
(pemanasan 100-110 °C, 10 menit)
11.Analisis hasil
Data persentase kematian larva artemia yang diperoleh dianalisis
menggunakan analisis probit SPSS untuk menghitung harga LC50. Dalam
perhitungan analisis probit secara manual, konsentrasi ditransformasikan menjadi
log konsentrasi (sebagai nilai x) dan % kematian ditransformasikan menjadi nilai
probit (sebagai nilai y). Setelah didapatkan persamaan garis data di atas, dicari
nilai LC50 dengan menghitung nilai x pada y=5. Setelah itu, nilai x di anti-log kan
untuk mendapatkan konsentrasi dimana dapat membunuh 50% hewan uji.
Jika pada kontrol ada artemia yang mati, maka persen kematian
ditentukan dengan rumus Abbot :
kontrol
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN A. Determinasi Tanaman
Determinasi dilakukan untuk memastikan kebenaran tumbuhan yang
akan digunakan dalam penelitian. Determinasi tumbuhan dilakukan secara
makroskopis dengan melihat ciri-ciri morfologi tumbuhan secara keseluruhan
mulai dari daun, bunga, batang kemudian dibandingkan dengan determinasi
tumbuhan yang terdapat dalam buku acuan menurut Backer and Bakhuizen Van
den Brink (1963 & 1965).
Berdasarkan determinasi tumbuhan yang telah dilakukan (lampiran 1),
diperoleh kesimpulan bahwa tumbuhan yang digunakan adalah benar-benar
tumbuhan Lantana camara L.
B. Pengumpulan Bahan
Daun tumbuhan tembelekan diperoleh dari tumbuhan tembelekan yang
tumbuh di belakang RSJ Grahasia, Pakem.Lokasi tumbuh diusahakan sama untuk
menghindari variasi kandungan kimia yang terlalu besar karena perbedaan kondisi
lingkungan. Pemilihan daun ke-4 sampai ke-5 dari ujung tangkai bertujuan agar
daun yang digunakan memiliki umur yang relatif sama sehingga kadar senyawa
aktifnya tidak berbeda secara bermakna (Anonim, 1985). Daun diambil dalam
keadaan tumbuhan sedang berbunga karena pada saat itu kandungan kimia
mencapai kadar optimum sehingga senyawa aktif yang terbentuk juga dalam
Pengeringan bertujuan untuk menurunkan kadar air sehingga tidak
ditumbuhi jamur, mempermudah pembuatan serbuk, dan menjamin agar
kualitasnya tetap baik sehingga dapat disimpan dalam waktu yang lebih lama.
Reaksi enzimatis serta perubahan kimiawi juga dapat diminimalkan, sehingga
senyawa aktif yang terkandung dalam daun tumbuhan tembelekan tidak hilang
terurai (Anonim, 1986).
Pembuatan serbuk bertujuan untuk memperluas permukaan yang kontak
dengan cairan penyari sehingga kandungan kimia yang terlarut dalam proses
penyarian lebih banyak dan penyarian dapat berlangsung lebih sempurna
(Anonim, 1986).
C. Maserasi Daun Tumbuhan Tembelekan
Maserasi merupakan cara penyarian yang dilakukan dengan merendam
serbuk sampel dalam cairan penyari. Penyarian merupakan peristiwa perpindahan
massa zat aktif yang semula berada di dalam sel ditarik oleh cairan penyari
sehingga di dalam cairan penyari terdapat zat aktif. Penyarian dengan cara
maserasi perlu dilakukan pengadukan untuk meratakan konsentrasi larutan di luar
serbuk sampel sehingga dengan pengadukan tersebut tetap terjaga adanya
perbedaan konsentrasi yang sebesar-besarnya antara larutan dalam sel dengan
larutan diluar sel. Makin besar perbedaan konsentrasi, makin besar pula daya
dorong untuk memindahkan massa dari dalam sel ke dalam cairan penyari
Maserasi kinetika adalah maserasi dengan menggunakan mesin shaker
yang berputar terus menerus dilakukan 6 sampai 24 jam (Anonim, 1986). Dalam
penelitian ini digunakan 30 gram serbuk daun tembelekan dan 225 ml etanol p.a.
yang dimasukkan dalam Erlenmeyer yang ditutup dengan aluminium foil. Hal ini
bertujuan agar larutan penyari (etanol p.a.) tidak menguap terlebih dahulu,
sehingga penyarian dapat maksimal.
Pada penelitian didapatkan maserat sebanyak 450 ml. Untuk
mendapatkan ekstrak etanol kering maka etanol diuapkan menggunakan vaccum
rotary evaporator hingga kental (± 100 ml), kemudian dipekatkan lagi di
waterbath dengan suhu tidak lebih 60° C menggunakan cawan. Vaccum rotary
evaporator digunakan karena dengan alat ini dapat diketahui dan diatur tekanan
alat (175 mmHg pada 40o C untuk etanol), sebab pada tekanan sebesar itu dapat
menurunkan titik didih dari etanol yang nantinya akan mempercepat penguapan
etanol tanpa membutuhkan pemberian panas tinggi. Selain itu, dengan
menggunakan alat ini dapat meningkatkan efisiensi biaya penelitian karena etanol
yang menguap dapat diperoleh kembali dalam suatu wadah penampung pada
rangkaian alat.
Pengeringan maserat didapatkan 2,27 gram ekstrak etanol kering. Cawan
porselen yang berisi ekstrak etanol kemudian ditutup dengan aluminium foil lalu
dimasukkan dalam eksikator. Dalam eksikator tidak ada air dan udara yang
masuk, karena dalam eksikator terdapat kapur tohor yang dapat menyerap air di
udara, yang dapat memungkinkan terjadinya perubahan senyawa dalam ekstrak
itu, dapat juga menarik sisa air yang mungkin masih tertinggal dalam ekstrak
karena proses pengeringan yang kurang sempurna.
D. Fraksinasi Ekstrak Etanol Hasil Maserasi
Kromatografi kolom vakum adalah suatu bentuk kolom yang terutama
bermanfaat untuk fraksinasi secara kasar dengan cepat. Fraksinasi ini tidak dapat
mengisolasi dalam bentuk suatu senyawa tunggal namun hanya mengisolasi
berdasarkan polaritas senyawa pada fase gerak. Senyawa ataupun golongan
senyawa yang diperoleh bisa lebih dari satu. Penggunaan vakum akan
mempercepat proses pengeluasian karena selain adanya gaya gravitasi juga
terdapat perbedaan tekanan pada kolom.
Ekstrak etanol dari tumbuhan tembelekan yang didapat dari metode
maserasi kemudian di fraksinasi dengan kromatografi kolom vakum. Sebelum di
fraksinasi dilakukan tahap KLT orientasi berdasarkan pemisahan senyawa
terpenoid. Hal ini didasarkan pada kandungan senyawa golongan terpenoid yang
terdapat di daun tumbuhan tembelekan. Fase gerak yang digunakan pada KLT
adalah toluen-etil asetat dengan perbandingan 93 banding 7 (v/v) dan fase diam
yang digunakan adalah silika gel. Toluen merupakan pelarut yang relatif
non-polar memiliki indeks non-polaritas 2,4 P’ dan etil-asetat merupakan pelarut yang
relatif lebih polar daripada toluen memiliki indeks polaritas 4,4 P’ (Skoog, 1985).
Campuran kedua fase gerak didapatkan indeks polaritas sebesar 2,54 P’. Silika gel
merupakan bahan penjerab yang polar. Hal ini dikarenakan adanya atom oksigen
Hasilnya pemisahan belum cukup optimal karena pada profil bercak KLT masih
terdapat beberapa bercak yang bertumpuk pada daerah awal jarak pengeluasian
(awal penotolon) yang menunjukkan bahwa beberapa bercak bersifat lebih polar
sehingga lebih berinteraksi kuat dengan fase diamnya (Gambar 2)..
Gambar 2. Kromatogram ekstrak etanol daun tumbuhan tembelekan untuk panduan fraksinasi dengan perbandingan fase gerak 93:7, jarak pengembangan 15 cm.
Keterangan :
Fase diam : silika gel GF254
Fase gerak : toluen : etil asetat (93:7 v/v) Deteksi : Sinar UV 365 nm
Bercak yang menumpuk akan mempengaruhi hasil dari proses fraksinasi
yang diharapkan akan diperoleh fraksi dengan profil bercak yang jelas serta
terpisah menurut kepolarannya. Modifikasi fase gerak diperlukan untuk bisa
mengeluasi bercak yang bertumpuk hingga bercak terpisah dan juga untuk
mendapatkan kerapatan jarak antar bercak yang teratur. Melihat sifat bercak yang
polar maka modifikasi fase gerak dibuat menjadi lebih polar daripada sebelumnya
yang non polar. Fase gerak non polar, dalam hal ini toluen, dikurangi
konsentrasinya dan fase gerak yang lebih polar, etil asetat, konsentrasinya
ditambah. Perbandingan fase gerak dibuat toluen (90) : etil asetat (10), indeks
polaritas campuran 2,6 P’.
Setelah dilakukan proses eluasi, hasil pemisahan dengan perbandingan
ini masih belum memuaskan karena masih terdapat bercak yang menumpuk dan
Gambar 3. Kromatogram ekstrak etanol daun tumbuhan tembelekan untuk panduan fraksinasi dengan perbandingan fase gerak 90:10, jarak pengembangan 15 cm.
Keterangan :
Fase diam : silika gel GF254
Fase gerak : toluen : etil asetat (90:10 v/v) Deteksi : Sinar UV 365 nm
Modifikasi selanjutnya dirubah pada perbandingan toluen (85) : etil
asetat (15), indeks polaritas campuran fase gerak 2,7 P’. Pemisahan becak sudah
baik karena bercak sudah tidak menumpuk dan diperoleh kerapatan jarak antar
Gambar 4. Kromatogram ekstrak etanol daun tumbuhan tembelekan untuk panduan fraksinasi dengan perbandingan fase gerak 85:15, jarak pengembangan 15 cm..
Keterangan :
Fase diam : silika gel GF254
Fase gerak : toluen : etil asetat (85:15 v/v) Deteksi : Sinar UV 365 nm
Hasil dengan perbandingan 85:15 sudah baik, namun dirasa masih perlu
dilakukan modifikasi lebih lanjut untuk mendapatkan hasil yang lebih baik lagi.
Perbandingan selanjutnya yang digunakan adalah toluen (80) banding etil asetat
bercak sudah merata dan namun terdapat bercak yang menumpuk pada posisi
akhir jarak pengeluasian(Gambar 5).
Gambar 5. Kromatogram ekstrak etanol daun tumbuhan tembelekan untuk panduan fraksinasi dengan perbandingan fase gerak 80:20, jarak pengembangan 15 cm.
Keterangan :
Fase diam : silika gel GF254
Melihat profil dari ke empat KLT orientasi di atas maka diputuskan
untuk memakai fase gerak toluen-etil asetat dengan perbandingan 85:15 v/v.
Setelah diperoleh sistem pemisahan dari KLT orientasi, kemudian
diaplikasikan ke metode Vaccum Coloumn Chromatography (VCC) atau disebut
juga Kromatografi Kolom Vakum. Volume fase gerak yang digunakan untuk
setiap kali fraksinasi sebanyak 50 ml karena diharapkan dapat mengeluasi bercak
berdasarkan urutan kepolarannya. Pada perbandingan fase gerak 85:15, indeks
polaritas campuran dari kedua senyawa tersebut adalah 2,7 P’ yang masuk dalam
kategori fase gerak yang relatif non-polar. Bercak/senyawa yang bersifat non
polar akan terfraksinasi terlebih dahulu. Berturut-turut selanjutnya akan
didapatkan bercak/senyawa yang cenderung lebih polar. Senyawa-senyawa yang
non-polar akan berinteraksi dengan fase gerak yang non-polar sehingga lebih
cepat tereluasi sedangkan senyawa yang relatif lebih polar akan berinteraksi
dengan fase diam sehingga waktu eluasinya lebih lama.
Fase diam yang digunakan adalah silika gel yang dibuat menjadi bubur
dengan pelarut fase gerak yang akan digunakan. Pembuatan bubur ini bertujuan
untuk memudahkan dalam pemasukan ke dalam kolom serta untuk menghindari
terjadinya rongga udara pada kolom yang dapat mengganggu dalam proses
fraksinasi. Penghisapan pelarut bubur dalam kolom dimaksudkan untuk lebih
memampatkan fase diam sehingga diperoleh kerapatan fase diam yang kompak
dan merata.
Fraksinasi dengan menggunakan kromatografi vakum-cair didapatkan 12
Gambar 6. Kromatogram 12 fraksi ekstrak etanol daun tumbuhan tembelekan hasil fraksinasi dengan jarak pengembangan 15 cm.
Keterangan :
Fase diam : silika gel GF254
Fase gerak : toluen : etil asetat (85:15 v/v) Deteksi : Sinar UV 365 nm
Proses fraksinasi dapat dihentikan karena sudah didapatkan profil bercak
yang sesuai dengan KLT orientasi. Pada fraksi no 1 didapatkan profil bercak yang
berwarna hijau pada UV 365 nm. Profil bercak ini sudah sesuai dengan profil
bercak pada KLT orientasi yang tereluasi pertama kali yang juga memberikan
warna hijau pada UV 365 nm. Akhir pengeluasian pada profil bercak KLT
orientasi juga ditandai dengan bercak yang berwarna hijau pada UV 365 nm dan
Fraksi-fraksi yang mempunyai kesamaan bercak kemudian digabung.
Selain itu penggabungan bercak juga didasarkan pada bercak yang dominan pada
fraksi. Bercak dominan adalah bercak yang mempunyai area relatif lebih lebar dan
terlihat lebih tebal. Fraksi yang mempunyai kesamaan bercak yaitu pada fraksi no
8 sampai 12 yang kemudian digabung menjadi satu. Profil bercak pada fraksi no 3
sampai 7 mempunyai profil yang hampir sama dalam rentang panjang bercak
pengeluasiannya. Namun, profil bercak pada fraksi no 4 sampai 7 lebih dominan
pada bercak bagian bawah pengeluasian (polar) sehingga fraksi no 4 sampai 7
digabung menjadi satu. Fraksi no 1 sampai 3 tidak digabung karena mempunyai
karakteristik bercak dominan yang berbeda. Penggabungan ini bertujuan untuk
mendapatkan profil fraksi dari yang nonpolar sampai ke fraksi yang polar. Selain
itu untuk mendapatkan profil dari fraksi yang memiliki efek toksik pada larva
artemia.
Tabel II. Penggabungan hasil fraksinasi menjadi 5 fraksi berdasarkan data gambar 6
Penggabungan Fraksi
no nama dan berat fraksi gabungan 1 F1 berat 40 mg
2 F2 berat 150 mg
3 F3 berat 60 mg
4 sampai 7 F4 berat 150 mg
8 sampai 12 F5 berat 20 mg
Hasil penggabungan didapatkan lima fraksi yaitu F1, F2, F3, F4, F5. Tabel
penggabungan fraksi menunjukkan berat dari fraksi gabungan. Berat fraksi yang
besar ditunjukkan pada F2 dan F4. Lima fraksi gabungan tersebut, tiga fraksi yang