Bab 4
Hasil dan Pembahasan
4.1
Pemilihan Elektrolit
Pada penelitian ini digunakan empat jenis elektrolit yang berbeda, yaitu KCl, KNO3, NaCl dan KF. Pemilihan keempat elektrolit tersebut ini didasarkan pada mobilitas ioniknya
Tabel 4.1 Mobilitas ionik dalam air pada suhu 298 K
Ion Mobilitas ionik
(10-8 m2 s-1 V-1) K+ 7,62 Na+ 5,19 Cl- 7,91 NO3- 7,40 F- 5,70
Keempat elektrolit dipilih atas kombinasi mobilitas ioniknya. KCl dan KNO3 mempunyai perbandingan mobilitas ionik yang hampir sama. NaCl , mobilitas ionik kationnya lebih kecil daripada mobilitas ionik anionnya. KF, mobilitas ionik anionnya lebih kecil daripada mobilitas ionik kationnya. Namun dalam penelitian, KF tidak dipergunakan lagi karena penggunaan elektrolit tersebut menimbulkan endapan pada sambungan jembatan garam dan larutan kedua kompartemen.
4.2
Spektroskopi Impedansi Elektrokimia (SIE)
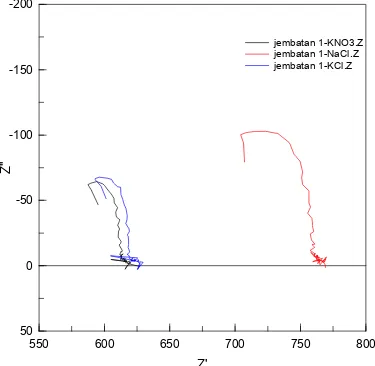
Gambar 4.1., 4.2., menunjukkan kurva Nyquist dari sel dengan tiga elektrolit yang berbeda yaitu KCl, NaCl dan KNO3. Pengukuran dilakukan dengan menggunakan dua jembatan garam yang mempunyai dimensi yang sama, jembatan 1 dan jembatan 2. Kurva Nyquist yang diperoleh dari pengukuran dianggap terjadi pada saat sel galvanik berada dalam kondisi
garam yang baru dan setiap elektroda diampelas dan dibilas dengan aqua bidestilasi sehingga tercipta permukaan aktif baru yang bebas dari lapisan oksida ataupun pengotor lainnya.
550 600 650 700 750 800 -200 -150 -100 -50 0 50 Z' Z' ' jembatan 1-KNO3.Z jembatan 1-NaCl.Z jembatan 1-KCl.Z
Gambar 4.1 Kurva Nyquist sel dengan variasi
elektrolit menggunakan jembatan garam 1 550 600 650 700 750 800 -200 -150 -100 -50 0 50 Z' Z' ' jembatan 2-KNO3.Z jembatan 2-NaCl.Z jembatan 2-KCl.Z
Gambar 4.2 Kurva Nyquist sel dengan variasi
elektrolit menggunakan jembatan garam 2
Semi-lingkaran da reaksi elektrokimia
dalam baterai (Cheng, 1999). Da aran SEI sel dengan
lam kurva Nyquist menggambarkan impedansi dari ri kurva dapat terlihat, plot semi-lingk
elektrolit KCl dan sel dengan elektrolit KNO3 berada pada daerah yang sama yang
mengindikasikan nilai impedansi selnya tidak berbeda jauh. Plot semilingkaran SEI sel dengan elektrolit NaCl terletak lebih ke kanan yang mengindikasikan nilai impedansinya lebih besar daripada kedua elektrolit yang lainnya.
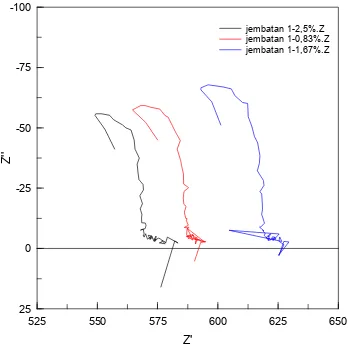
Gambar 4.3 Kurva Nyquist sel dengan variasi
konsentrasi agar menggunakan jembatan garam 1 525 550 575 600 625 650 -100 -75 -50 -25 0 25 Z' Z' ' jembatan 1-2,5%.Z jembatan 1-0,83%.Z jembatan 1-1,67%.Z
525 550 575 600 625 650 -100 -75 -50 -25 0 25 Z' Z' ' jembatan 2-2,5%.Z jembatan 2-0,83%.Z jembatan 2-1,67%.Z
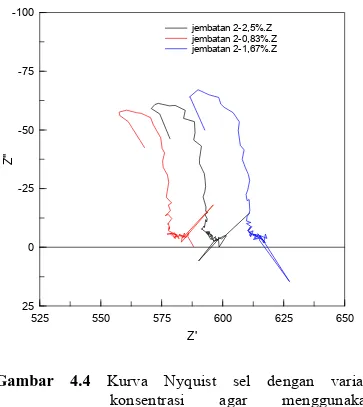
Gambar 4.4 Kurva Nyquist sel dengan variasi
konsentrasi agar menggunakan jembatan garam 2
Untuk menginvestigasi pengaruh variasi konsentrasi agar, dilakukan pengukuran dengan menggunakan elektrolit KCl pada konsentrasi agar 0,83%; 1,67%; dan 2,5% (b/v). Hasil pengukuran SIE ditunjukkan gambar 4.3 dan 4.4
Sirkuit ekivalen yang diusulkan untuk merepresentasikan keadaan sel ditunjukkan pada gambar 4.5. Rlar merepresentasikan hambatan total ohmik dari larutan, elektrolit dalam
jembatan garam dan elektroda. Rtm adalah hambatan transfer muatan pada antarmuka
elektroda. Clrl adalah kapasitansi lapis rangkap listrik yang terbentuk pada antar muka larutan
dengan elektroda. Rlar termasuk hambatan sepanjang jalur konduksi jembatan garam yang
mengandung elektrolit. Pada sel yang diuji yang membedakannya hanyalah elektrolit dalam
jembatan garam, oleh karena itu Rlar berhubungan langsung dengan hambatan yang
ditimbulkan elektrolit.
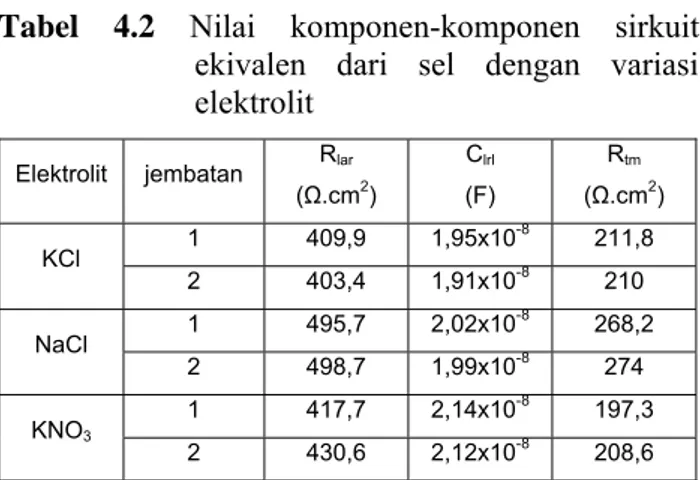
Analisis kuantitatif dilakukan dengan bantuan perangkat lunak Zview menggunakan
pendekatan Complex non-linear least squares (CNLS). Nilai dari masing-masing komponen
listrik pada variasi elektrolit dan variasi konsentrasi agar ditampilkan Tabel 4.2 dan Tabel 4.3.
Tabel 4.2 Nilai komponen-komponen sirkuit
ekivalen dari sel dengan variasi elektrolit Rlar Clrl Rtm Elektrolit jembatan (Ω.cm2) (F) (Ω.cm2) 1 409,9 1,95x10-8 211,8 KCl 2 403,4 1,91x10-8 210 1 495,7 2,02x10-8 268,2 NaCl 2 498,7 1,99x10-8 274 1 417,7 2,14x10-8 197,3 KNO3 2 430,6 2,12x10-8 208,6
Tabel 4.3 Nilai komponen-komponen sirkuit ekivalen
dari sel dengan variasi konsentrasi agar
Konsentrasi
agar jembatan Rlar Clrl Rtm (b/v) (Ω.cm2) (F) (Ω.cm2) 1 392,7 1,95x10-8 196,6 0,83% 2 386,8 1,97x10-8 193,6 1 409,9 1,95x10-8 211,8 1,67% 2 403,4 1,91x10-8 210,0 1 387,5 2,10x10-8 183,6 2,5% 2 394,9 1,94x10-8 200,6
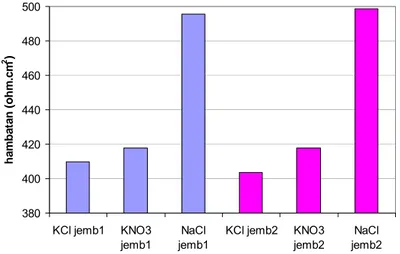
Nilai hambatan total ohmik larutan (Rlar) dengan variasi elektrolit ditunjukkan pada gambar 4.6. Dapat dilihat, baik pada jembatan garam 1 maupun 2 terlihat bahwa KCl mempunyai nilai Rlar yang paling rendah diikuti oleh KNO3 dan NaCl. Nilai Rlar KCl yang kecil diperkirakan disebabkan oleh mobilitas ioniknya yang relatif seimbang. Dengan mobilitas ionik yang seimbang, maka jumlah ion yang berpindah dalam waktu yang sama seimbang
pula. KNO3 mempunyai perbandingan mobilitas ionik yang hampir sama dengan KCl,
namun hasil analisis menunjukkan KNO3 mempunyai nilai impedansi larutan yang lebih
besar. Hal ini dikarenakan mobilitas ionik NO3- sedikit lebih kecil dibanding mobilitas ionik
Cl-, sehingga mempengaruhi nilai impedansinya keseluruhan sel. Sel dengan elektrolit NaCl
memiliki nilai Rlar yang paling besar, hal ini dikarenakan nilai mobilitas ionik kation dan
anionnya yang relatif tidak berimbang. Mobilitas ionik anionnya (Cl-) lebih besar daripada
380 400 420 440 460 480 500 KCl jemb1 KNO3 jemb1 NaCl jemb1 KCl jemb2 KNO3 jemb2 NaCl jemb2 h a mb at an ( o h m .c m 2 )
Gambar 4.6 Nilai Rlar sel galvanik Cu/Zn dengan variasi
elektrolit pada dua sampel jembatan garam
385 390 395 400 405 410 415 0 1 2 3 4 % agar (b/v) R la r ( ohm .c m 2 ) jembatan 1 jembatan 2
Gambar 4.7 Nilai Rlar sel galvanik Cu/Zn dengan variasi konsentrasi
agar pada dua sampel jembatan garam
Dapat dilihat pada Gambar 4.7 nilai Rlar seiring konsentrasi agar naik kemudian turun
kembali. Hal ini tidak diketahui pasti penyebabnya. Deduksi yang diambil adalah semakin besar konsentrasi agar, semakin kecil mobilitas ion dalam larutan sehigga impedansinya semakin besar. Pada rentang konsentrasi 0,83%-1,67%, hasil yang diamati sesuai dengan deduksi. Namun pada konsentrasi di atas 1,67% diduga terdapat faktor lain yang mempunyai pengaruh lebih dominan selain pengaruh kenaikan konsentrasi agar.
4.3
Rapat arus Maksimum Pada Potensial Nominal
Metode Voltametrik Siklik Galvano dengan perubahan logaritmik digunakan untuk menentukan rapat arus maksimum yang dapat diberikan suatu baterai pada potensial nominalnya. Pada sebuah baterai, potensial nominal yang dimaksud adalah nilai potensial yang tertera dalam kemasan baterai. Dalam kasus ini, potensial nominal yang dijadikan acuan adalah nilai tengah antara potensial maksimum dan potensial minimum yang dicapai sel. Nilai potensial yang diperoleh adalah 1,06 volt. Arus yang diaplikasikan pada sel
dimulai pada angka 1 µAcm-2 secara bertahap dengan kenaikan logaritmik hingga mencapai
arus maksimum 100 µAcm-2, kemudian diturunkan kembali hingga mencapai nilai semula, 1
µAcm-2. Respons yang diukur adalah potensial baterai pada setiap nilai arus yang diberikan.
0 0.5 1 1.5 2 2.5 0 200 400 600 w aktu (sekon) po te ns ia l ( V ) log r apat ar us ( m ik ro A cm -2)
log rapat arus potensial NaCl potensial KCl potensial KNO3
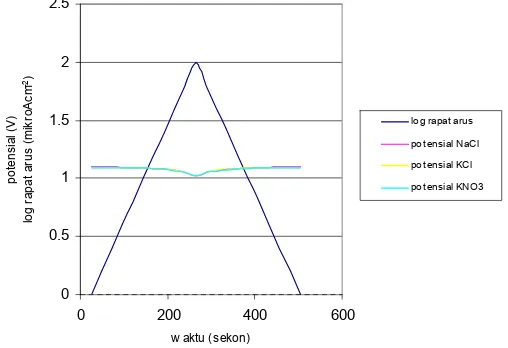
Gambar 4.8 Tipikal kurva voltametri siklik galvano
Gambar 4.8 menunjukkan tipikal kurva yang diperoleh dari setiap pengukuran. Supaya terlihat lebih jelas sebagian kurva potensial diperbesar pada daerah puncak seperti yang terlihat pada Gambar 4.9-4.10 dan 4.12-4.13
1 1.02 1.04 1.06 1.08 1.1 0 200 400 600 w aktu (sekon) potens ia l ( V ) log r apat a rus ( m ik ro A cm -2)
log rapat arus potensial NaCl potensial KCl potensial KNO3
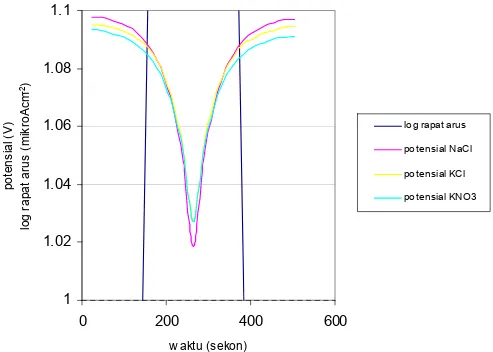
Gambar 4.9 Kurva potensial dan log rapat arus terhadap waktu pada
sel dengan variasi elektrolit menggunakan jembatan garam 1 1 1.02 1.04 1.06 1.08 1.1 0 200 400 600 w aktu (sekon) potens ia l ( V ) log rapat ar us ( m ik ro A cm -2)
log rapat arus potensia NaCl potensial KCl potensial KNO3
Gambar 4.10 Kurva potensial dan log rapat arus terhadap waktu pada sel
dengan variasi elektrolit menggunakan jembatan garam 2
Dari gambar 4.9 dan 4.10 dapat terlihat perbedaan yang tipis antara kurva potensial sel ketiga elektrolit. Hal ini menandakan sel dengan elektrolit jembatan garam yang berbeda tidak memberikan perbedaan signifikan terhadap arus yang dapat dihasilkan baterai.
30 35 40 45 50 55 KCl jemb1 KNO3 jemb1 NaCl jemb1 KCl jemb2 KNO3 jemb2 NaCl jemb2 rapat a rus m ak s (m ik roA /c m 2 )
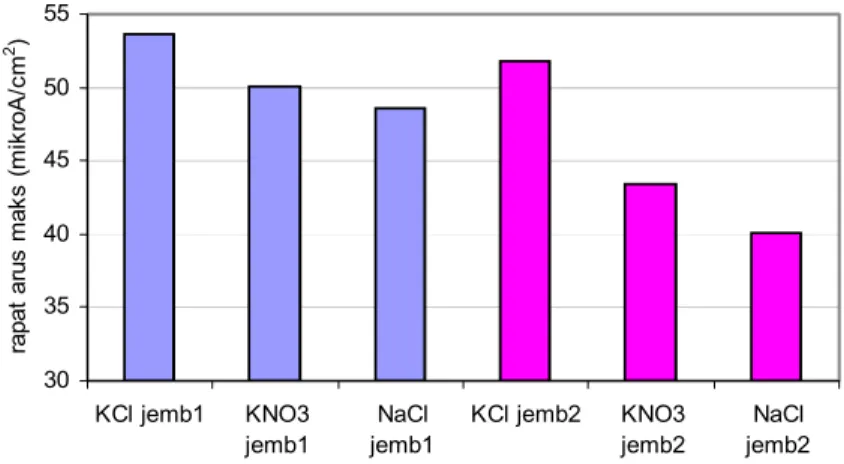
Gambar 4.11 Rapat arus maksimum yang dapat dihasilkan sel dengan
variasi elektrolit pada nilai potensial 1,06 V
Nilai rapat arus maksimum yang dihasilkan baterai pada nilai potensial sel 1,06 volt ditunjukkan pada Gambar 4.11. Dari gambar dapat terlihat rapat arus maksimum kedua sampel jembatan garam mempunyai tren yang sama. Nilai rapat arus maksimum terbesar adalah sel dengan elektrolit KCl, diikuti KNO3 dan NaCl. Data ini konsisten dengan nilai Rlar
sel. Sel dengan nilai Rlar terkecil mempunyai nilai rapat arus maksimum paling besar dan
sebaliknya. Hal ini sesuai dengan hukum Ohm bahwa nilai hambatan (R) berbanding terbalik dengan nilai arus listrik (I)
I
1 1.02 1.04 1.06 1.08 1.1 0 200 400 600 w aktu (sekon) potens ia l ( V ) log r apat ar us ( m ik ro A cm -2)
log rapat arus potensial [agar] 0,83% potensial [agar] 1,67% potensial [agar] 2,5%
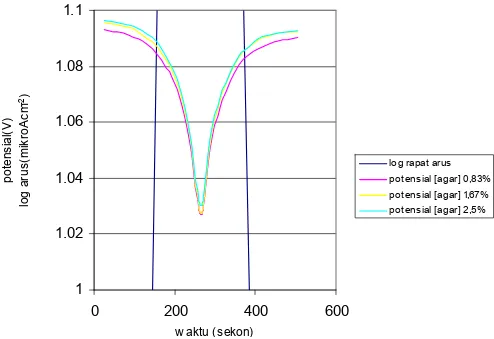
Gambar 4.12 Kurva potensial dan log arus terhadap waktu pada sel dengan
elektrolit KCl menggunakan jembatan garam 1 pada konsentrasi agar yang berbeda
1 1.02 1.04 1.06 1.08 1.1 0 200 400 600 w aktu (sekon) po te ns ia l(V ) lo g ar us (m ik ro A cm -2)
log rapat arus potensial [agar] 0,83% potensial [agar] 1,67% potensial [agar] 2,5%
Gambar 4.13 Kurva potensial dan log arus terhadap waktu pada sel dengan
elektrolit KCl menggunakan jembatan garam 2 pada konsentrasi agar yang berbeda
Gambar 4.12 dan 4.13 menunjukkan kurva potensial sel dari konsentrasi agar yang berbeda. Hal yang sama pada variasi elektrolit diamati juga pada konsentrasi agar, bahwa perbedaan
arus maksimum yang dihasilkan antara ketiga konsentrasi agar yang berbeda tidak menunjukkan perbedaan yang signifikan.
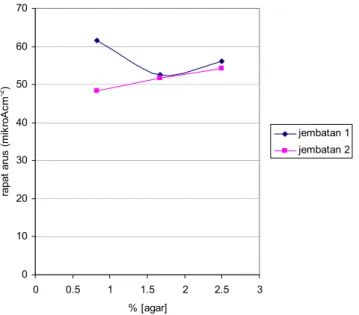
0 10 20 30 40 50 60 70 0 0.5 1 1.5 2 2.5 3 % [agar] ra pa t ar us ( m ik ro A cm -2) jembatan 1 jembatan 2
Gambar 4.14 Rapat arus maksimum yang dapat dihasilkan
sel dengan variasi konsentrasi agar pada nilai potensial 1,06 V
Nilai rapat arus maksimum terhadap konsentrasi agar ditunjukkan pada Gambar 4. 14. Dari gambar dapat dilihat tidak terdapat tren yang sama yang dapat diamati dari kedua jembatan garam. Deduksi yang diambil adalah semakin besar konsentrasi agar maka semakin kecil mobilitas ion-ion dalam larutan. Bila mobilitas ion semakin sel, arus yang dapat dihasilkan sel semakin kecil. Jadi semakin besar konsentrasi agar semakin kecil rapat arus yang dihasilkan. Namun hal ini tidak terlihat dari kurva. Salah satu dugaannya adalah rentang konsentrasi variasi agar yang sempit (0,83%-2,5%) tidak memberikan perbedaan yang signifikan terhadap rapat arus yang dihasilkan sel.