VALIDASI METODE PENETAPAN KADAR ETANOL HASIL
PRODUKSI “CIU” RUMAHAN DUSUN SENTULDESA BEKONANG
KABUPATEN SUKOHARJO DENGAN METODE KROMATOGRAFI GAS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Alberthus Djanu Rombang
NIM: 088114126
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
VALIDASI METODE PENETAPAN KADAR ETANOL HASIL
PRODUKSI “CIU” RUMAHAN DUSUN SENTULDESA BEKONANG
KABUPATEN SUKOHARJO DENGAN METODE KROMATOGRAFI GAS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Alberthus Djanu Rombang
NIM: 088114126
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
vii INTISARI
Bekonang merupakan daerah penghasil Ciu. Produksi menggunakan bahan baku tetes tebu yang difermentasikan dan didestilasikan secara sederhana sampai diperoleh Ciu yang digunakan sebagai bahan pembuatan etanol medis. Metode Kromatografi Gas merupakan metode yang dipilih untuk menetapkan kadar etanol yang dihasilkan tersebut.
Penelitian ini merupakan penelitian non eksperimental-deskriptif. Kadar etanol ditetapkan dengan metode Kromatografi Gas pada kondisi optimal yaitu dengan penggunakan kolom kapiler Cp-Wax 52 CB (25m, i.d. 0,32mm), tekanan kolom 10 psi, suhu awal kolom 70oC dengan kenaikan suhu kolom 30oC/menit sampai suhu kolom maksimal 220oC, detektor FID (Flame Ionization Detector), sehingga diperoleh pemisahan yang baik dan hasil yang diperoleh memenuhi parameter validitas yang ditentukan yaitu: selektivitas, linearitas, akurasi, presisi, batas kuantifikasi, batas deteksi, dan rentang.
Hasil penelitian menunjukkan metode ini memiliki nilai selektivitas (Rs) > 1,5. Linearitas etanol standar diperoleh dengan nilai r 0,9996, nilai rata-rata %
recovery untuk kadar rendah, sedang dan tinggi berturut-turut adalah 103,7%; 101,8 %; 101,9%; nilai % CV yang diperoleh untuk kadar rendah, sedang dan tinggi berturut-turut adalah 1,62%; 1,26%, 0,73%. Sedangkan untuk batas kuantifikasi diperoleh nilai 1,729%v/v, dan batas deteksi diperoleh nilai 0,518%v/v dengan rentang kadar sampel yang dapat diukur diantara level kadar 6%v/v sampai dengan 10%v/v. Berdasarkan hasil tersebut maka metode Kromatografi Gas dengan settingan instrumen yang dioptimalkan dapat digunakan untuk menetapkan kadar etanol pada hasil produksi pembuatan Ciu di Dusun Bekonang dengan hasil yang dapat dipercaya.
viii ABSTRACT
Bekonang is a place where Ciu is produced. The Ciu production uses the raw material molasses which is simply fermented and distillated until getting the Ciu which is used as the substance to make the medical ethanol. Chromatography method was the method chosen to determine the level of ethanol.
This research was a non-experimental-descriptive research. The level of ethanol was determined by chromatography method in optimal condition by using capillary Cp-Wax 52 CB (25m, i.d. 0,3mm) column, with its column pressure 10
psi and its temperature 70oC and the temperature raised up to 30oC per second
with maximum column temperature 220oC and FID (Flame Ionization Detector). The process produced a good result, it could achieve the validity parameter; selectivity, linearity, accuracy, precision, quantification limit, detection limit and range.
The research result showed that the chromatography method had selectivity score which was (Rs) > 1,5.The standard of ethanol linearity was gained with score r 0.9996, The order of the percentage of median for the low, medium and high level of recovery were 103.7%; 101.8%; 101.9%. The order for CV percentage score which was gained for the low, medium and high level were 1.62%, 1.26%, 0.73%. While the obtained quantification limit score was 1.728% v/v and the detection limit score was 0.518% v/v with its level sample which could be measured between range 6% v/v up to 10% v/v. According to its result, thus the chromatography method which set the optimal adjustment could be used to decide the level of ethanol of the Ciu production in the Bekonang village with a reliable result.
ix
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah Bapa Yang Maha Kuasa
atas segala limpahan berkatdan kasih-Nya sehingga penelitan dan penyusunan
skripsi yang berjudul “Validasi Metode Penetapan Kadar dan Profil Kandunga
Ciu Hasil Produuksi Industri Rumahan Di Daerah Sukoharjo Secara Kromatografi
Gas” dapat diselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat
untuk meraih gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi, Universitas
Sanata Dharma, Yogyakarta.
Dalam pelaksaaan penelitian hingga selesainya penyusunan skripsi ini,
penulis mendapat banyak dukungan dan bantuan dari berbagai pihak. Oleh karena
itu, penulis mengucapkan terima kasih kepada:
1. Ibu Aris Widayati, Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Bapak Jeffry Julianus, M.Si. selaku dosen pembimbing yang dengan
sabar memberikan pengarahan, masukan, kritik dan saran baik selama
penelitian maupun penyusunan skripsi ini.
3. Bapak Jeffry Julianus, M.Si. selaku dosen penguji yang telah
memberikan saran dan kritik yang membangun dalam penyusunan
skripsi.
4. Bapak Enade Perdana Istyastono, Ph.D., Apt.Apt selaku dosen penguji
yang telah memberikan saran dan kritik yang membangun dalam
x
5. Bapak Florentinus Dika Octa Riswanto, M.Sc. selaku dosen penguji yang
telah memberikan saran dan kritik yang membangun dalam penyusunan
skripsi.
6. Ibu Christofori Maria Ratna Rini Nastiti, selaku dosen pembimbing
akademik atas bimbingan dan semangat yang telah diberikan selama ini.
7. Ibu Rini Dwi Astuti, M.Sc, Apt. selaku Kepala Laboratorium Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta.
8. Seluruh Dosen Fakultas Farmasi Universitas Sanata Dharma yang telah
memberikan ilmu yang bermanfaat demi kemajuan mahasiswa dalam
bidang farmasi.
9. Seluruh staff laboratorium kimia Fakultas Farmasi Universitas Sanata
Dharma: Mas Bimo, Mas Parlan, yang telah banyak membantu selama
penelitian di laboratorium.
10. Semua pihak yang tidak dapat disebutkan satu per satu yang telah
membantu penulis dalam mewujudkan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan
skripsi ini, sehingga segala kritik dan saran yang membangun sangat penulis
harapkan. Semoga skripsi ini membantu dan bermanfaat bagi pembaca pada
khususnya dan ilmu pengetahuan pada umumnya.
Yogyakarta, 27 Agustus 2014
xi DAFTAR ISI
Halaman
HALAMAN JUDUL……….. i
HALAMAN PERSETUJUAN PEMBIMBING……….... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN... iv
PERNYATAAN KEASLIAN KARYA... v
HALAMAN PERSETUJUAN PUBLIKASI... vi
INTISARI... vii
ABSTRACT... viii
KATA PENGANTAR... ix
DAFTAR ISI... xi
DAFTAR TABEL... xv
DAFTAR GAMBAR………. xvi
DAFTAR LAMPIRAN... xvii
BAB I PENDAHULUAN……….. 1
A. Latar Belakang………... 1
1. Permasalahan……….... 4
2. Keaslian Penelitian………... 4
3. Manfaat Penelitian……….... 4
a. Manfaat praktis………... 4
b. Manfaat metodologis……….. 4
B. Tujuan Penelitian………... 5
BAB II PENELAAHAN PUSTAKA………... 6
xii
B. Etanol………. 6
C. Kromatografi Gas……….. 7
1. Sistem Injeksi Sampel………. 8
2. Gas Pembawa……….. 9
3. Kolom……….. 10
a. Kolom kemas………. 10
b. Kolom kapiler……… 11
4. Fase Diam……… 11
5. Detektor………... 13
6. Pengaturan Suhu……….. 15
D. Validasi Metode………. 15
1. Selektivitas………... 16
2. Linearitasdan rentang ………... 17
3. Akurasi………... 17
4. Presisi………... 18
5. Limit Of Quantitation(LOQ) dan Limit Of Detection(LOD)……….... 19
E. LandasanTeori……….. 19
F. Hipotesis……….... 21
BAB III METODOLOGI PENELITIAN……….. 22
A. Jenis dan Rancangan Penelitian………. 22
B. Variable Penelitian………. 22
1. Variabel bebas……….. 22
2. Variabeltergantung……….. 22
xiii
C. Definisi Operasional……….. 23
D. Bahan-bahan Penelitian………. 23
E. Alat Penelitian……….... 23
F. Tata Cara Penelitian………... 24
1. Pemilihan sampel dan pengambilan………. 24
2. Preparasi sampel……….. 24
3. Pembuatan larutan baku………... 24
4. Penetapankurva baku………... 24
5. PenentuanrecoverydanCoefficient of Variation(CV) larutanbaku……….. 25
6. PenentuanLimit of QuantitationdanLimit of Detection baku……….. 25
G. Analisis Hasil………. 25
BAB IV HASIL DAN PEMBAHASAN………... 28
A. Pemilihan Sampel………... 28
B. Preparasi Sampel……… 28
C. Pembuatan LarutanBaku………... 29
D. PenetapanKurva Baku………... 29
E. Validasi Metode Analisis……… 32
1. Selektivitas……….... 33
2. Linearitas……….. 35
3. Akurasi……….. 35
4. Presisi……… 36
xiv
6. Rentang……… 38
BAB V Kesimpulan Dan Saran……….. 39
A. Kesimpulan……….. 39
B. Saran……… 39
DAFTAR PUSTAKA………. 40
LAMPIRAN………... 42
xv
DAFTAR TABEL
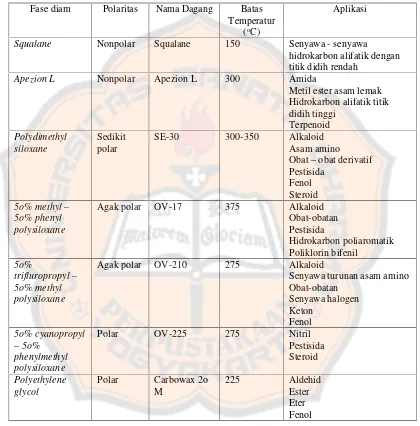
Tabel I Jenis fase diam dan penggunaannya………... 12
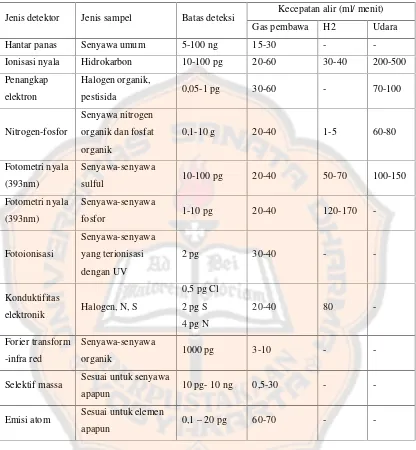
Tabel II Jenis detektor danpenggunaannya………. 14
Tabel III Parameter analisis validasi metode……….... 16
Tabel IV Kriteria %recoveryyang diijinkan untuk konsentrasi analit
yang berbeda………... 18
Tabel V Kriteria presisi yang diijinkan untuk konsentrasi analit yang
berbeda………... 18
Tabel VI Data replikasi larutan seri baku etanol………... 30
Tabel VII Data rasio AUC……….. 31
Tabel VIII PerbandinganRetention Timebaku etanol dan standar internal
n-butanol………. 33
Tabel IX Data %recovery………. 36
xvi
DAFTAR GAMBAR
Gambar 1 Skema Instrumen Kromatografi Gas... 8
Gambar 2 Kolom kemas (a) dan kolom kaplier (b)... 11
Gambar 3 Hubungan antara konsentrasi etanoal dengan
AUC (replikasi III)... 32
Gambar 4 Kromatogram pengukuran sampel pada kondisi optimal….. 34
Gambar 5 Kromatogram baku etanol konsentrasi 600 µl... 34
xvii
DAFTAR LAMPIRAN
Lampiran 1 Sertifikat analisis etanol………. 43
Lampiran 2 Sertifikat analisis n-butanol……… 45
Lampiran 3 Parameter Instrumen Kromatografi Gas……… 47
Lampiran 4 Kromatogram seri baku etanol replikasi I……….. 48
Lampiran 5 Kromatogram seri baku etanol replikasi II………. 50
Lampiran 6 Kromatogram seri baku etanol replikasi III………... 53
Lampiran 7 Kromatogram seri baku etanol replikasi IV..……… 55
Lampiran 8 Kromatogram seri baku etanol replikasiV……… 58
Lampiran 9 Kromatogram validasi metode………... 60
Lampiran 10 Data perhitungan konsentrasi seri larutan baku etanol………... 68
Lampiran 11 Persamaan kurva baku dan gambar baku etanol……… 70
Lampiran 12 Nilai AUC etanol dan perhitungan recovery etanol…………... 70
Lampiran 13 PerhitunganCoefficient of Variations(CV) etanol……… 73
1
BAB I PENDAHULUAN
A. Latar Belakang
Desa Bekonang yang terletak di kecamatan Sukoharjo merupakan tempat
penghasil etanol. Masyarakat sekitar mengenal etanol hasil produksi ini dengan
nama ‘Ciu’. Produksi Ciu dibuat dari molase atau tetes tebu sisa hasil produksi
gula tebu yang difermentasikan dan kemudian didestilasi atau disuling sehingga
dihasilkan Ciu. Hasil produksi terdiri dari dua macam yaitu: Ciu dengan tingkat
kadar 30-34% dan dengan tingkat kadar yang lebih tinggi (sekitar 90%). Sebagian
besar warga di Bekonang merupakan produsen industri rumahan pembuatan Ciu
(Sabariyono, 2012).
Fermentasi atau peragian Ciu dilakukan dengan bantuan spesies ragi
tertentu seperti Saccharomyces cerevisiae. Ragi ini akan memetabolisme gula
tanpa oksigen menghasilkan etanol dan CO2. Peragian oleh warga Bekonang
dilakukan dengan takaran 1 kantong kecil ragi Saccharomyces cerevisiae untuk
250 L bahan dasar tetes tebu di dalam wadah drum. Satu kali proses peragian
tersebut memerlukan waktu 5-6 hari dan dapat dilihat fermentasi tidak berjalan
lagi jika sudah tidak ada gelembung yang terbentuk (Sabariyono, 2012).
Proses penyulingan selanjutnya dilakukan untuk mendapatkan hasil
produksi. Pada tahun 1940-1970 warga Bekonang masih menggunakan bambu
dan kelenting untuk menyuling tetes tebu yang difermentasikan. Kelenting
dari tetes tebu yang dipanaskan. Pada tahun 1971 warga mulai menggunakan
metode destilasi untuk menyuling hasil fermentasi tetes tebu sehingga dapat
diperoleh Ciu dengan kadar etanol lebih tinggi dibandingkan dengan cara
terdahulu (Sabariyono, 2012).
Paguyuban produsen Ciu di Bekonang menyalurkan hasil produksi ke
produsen pabrik. Ciu yang disalurkan baik yang masih tingkat kadar 30-34% dan
yang sudah dimurnikan lagi kadarnya (90%). Hanya 3 produsen di Bekonang
yang memasok Ciu dengan kadar tinggi (90%) kepada produsen pabrik,
selebihnya memasok dengan kadar 30-34%. Hal ini dikarenakan untuk
mendapatkan Ciu dengan kadar yang lebih tinggi diperlukan tahapan lebih lanjut
yang memakan biaya lebih besar. Penelitian ini lebih diutamakan kepada para
produsen Ciu yang memproduksi dengan kadar 30-34% karena merupakan
mayoritas dilakukan warga Bekonang (Sabariyono, 2012).
Ciu yang dipasok kepada produsen pabrik ini digunakan untuk keperluan
medis yang nantinya digunakan masyarakat luas. Perlu diadakan penelitian
mengenai kandungan etanol dan kandungan lainnya. Sehingga dapat dipastikan
Ciu hasil produksi industri rumahan di desa Bekonang aman untuk digunakan
dalam keperluan Ciu medis.
Etanol dapat ditetapkan kadarnya secara kromatografi gas karena
senyawa ini merupakan senyawa organik yang mudah menguap serta tahan
terhadap pemanasan tinggi. Prinsip dasar penetapan kadar dengan kromatografi
gas adalah sampel yang diinjeksikan pada tempat injeksi diuapkan dengan
detektor. Ketika sampel melewati kolom, komponen-komponen sampel akan
mengalami pemisahan oleh fase diam dan menghasilkan resolusi. Komponen
senyawa terdeteksi oleh detektor dan dicatat oleh recorder. Hasil pencatatan akan
keluar berupa data kromatogram. Dari data kromatogram, kadar suatu senyawa
dapat dideteksi dengan menghitung luas atau tinggi kromatogram.
Penelitian penetapan kadar etanol dari Ciu hasil produksi industri
rumahan di daerah Sukoharjo menggunakan metode kromatografi gas yang telah
dilakukan optimasi. Sebelum melakukan penelitian penetapan kadar etanol hasil
produksi Ciu Bekonang perlu diadakan serangkaian pengujian lebih lanjut untuk
memastikan metode Kromatografi gas yang dipilih memiliki validitasi yang baik
dan dapat memisahkan sampel Ciu dari komponen lainnya dengan baik. Pengujian
tersebut didasarkan pada parameter akurasi, presisi, selektivitas, Limit of
Quantitation (LOQ) dan Limit of Detection (LOD), serta linearitas dan rentang
yang dihasilkan. Metode kromatografi gas dikatakan layak untuk digunakan dan
memiliki validitas yang baik apabila berdasarkan penggujian tersebut memenuhi
nilai-nilai parameter yang ditentukan, dan hasil yang diperoleh pada penggujian
1. Permasalahan
Apakah metode kromatografi gas yang telah dioptimasi untuk penetapan
kadar etanol hasil produksi “Ciu” rumahan dusun Sentul desa Bekonang
kabupaten Sukoharjo memenuhi parameter-parameter validasi yaitu selektivitas,
linearitas, akurasi, presisi, rentang, batas kuantitasi (LOQ), serta batas deteksi
(LOD)?
2. Keaslian Penelitian
Berdasarkan sumber informasi yang diperoleh pernah dilakukan
penelitian mengenai perbandingan metode kromatografi gas dan berat jenis pada
penetapan kadar etanol dalam minuman anggur (Mardoni, 2006). Namun sejauh
penelusuran belum dilakukan penelitian mengenai validasi metode penetapan
kadar etanol hasil produksi‘Ciu’rumahan dusun Sentul kecamatan Sukoharjo.
3. Manfaat Penelitian
a. Manfaat praktis
Dengan penelitian ini diharapkan dapat memberikan informasi mengenai
akurasi, presisi, selektivitas, sensitivitas, linearitas, batas kuantitasi (LOQ) serta
batas deteksi (LOD) metode kromatografi yang dipilih untuk menetapkan kadar
etanol hasil produksi industri rumahan desa Bekonang.
b. Manfaat metodologis
Penelitian ini dapat memberikan sumbangan ilmiah dan sebagai acuan
mengenai penetapan kadar dan profil kandungan etanol dalam Ciu dengan metode
B. Tujuan Penelitian
Untuk mengetahui metode kromatografi gas yang telah dioptimasikan
memenuhi parameter-parameter validasi dilihat dari nilai: selektivitas, linearitas,
akurasi, presisi, Limit of Quantitation (LOQ), Limit of Detection (LOD), serta
rentang sehingga dapat memberikan hasil yang dapat dipercaya untuk menetapkan
kadar etanol dan profil senyawa dari hasil produksi “Ciu” industri rumahan di
6 BAB II
PENELAAHAN PUSTAKA
A. Ciu produksi industri rumahan
Ciu hasil produksi industri rumahan di daerah Sukoharjo desa Bekonang
dibuat dari tetes tebu (molase) yang difermentasikan. Proses fermentasi dilakukan
dengan menggunakan ragi sepertiSaccharomyces cerevisiaeyang memetabolisme
gula tanpa menggunakan oksigen dan menghasilkan etanol, gas CO2, dan senyawa
lain. Untuk menghasilkan kadar Ciu 30-34% dilakukan proses destilasi (Widodo,
2004).
Tetes tebu (Molase) merupakan hasil samping yang berasal dari
pembuatan gula tebu (Saccharum officianarumL). Tetes tebu berupa cairan kental
dan diperoleh dari tahap pemisahan kristal gula. Molase tidak dapat lagi dibentuk
menjadi sukrosa mineral. Tingginya kandungan gula dalam molase sangat
potensial dimanfaatkan sebagai bahan baku etanol (Juwita, 2012).
B. Etanol
Etanol adalah cairan yang bening, tidak berwarna, mudah mengalir,
mudah menguap, titik didih 78oC, higroskopik, mudah terbakar dengan api biru
tanpa asap. Campur dengan air, kloroform, eter, gliserol, dan hampir semua
pelarut organik lainnya. Penyimpanan pada suhu 8-15oC, jauh dari api di dalam
wadah kedap udara. Dilindungi dari cahaya. Nama lain dari etanol adalah:
Etanol diperoleh dari peragian karbohidrat yang berkataliskan enzim.
Satu tipe enzim mengubah karbohidrat ke glukosa, kemudian ke etanol, tipe yang
lain menghasilkan cuka (asam asetat), dengan etanol sebagai zat antara
(Fessenden dan Fessenden, 1986).
C. Kromatografi Gas
Kromatografi gas adalah teknik yang dipilih untuk memisahkan
komponen-komponen senyawa organik yang mudah menguap dan tahan terhadap
pemanasan tinggi (Dean, 1995). Kromatografi gas menggunakan gas sebagai fase
geraknya. Ada dua jenis kromatografi gas, yaitu kromatografi gas-cair (KGC)
yang fase diamnya berupa cairan yang diikatkan pada suatu pendukung sehingga
solut akan terlarut dalam fase diam; dan kromatografi gas-padat (KGP) yang fase
diamnya berupa padatan dan kadang-kadang berupa polimerik (Rohman, 2009).
Komponen dasar kromatografi gas adalah sebagai berikut.
1. Tempat injeksi dan kemungkinan disertaisplitter
2. Suplai gas pembawa dengan pengatur tekanan dan pengendali aliran
3. Kolom
4. Detektor
5. Oven dengan pengendali termostatis yang juga bisa diprogram untuk
berbagai tingkat pemanasan
6. Recorderatau alat pencatat lainnya
Gambar 1. Skema Instrumen Kromatografi Gas (Miller dan McNair, 1998)
Senyawa-senyawa yang dapat ditetapkan dengan kromatografi gas sangat
banyak, namun ada batasan-batasannya. Senyawa tersebut harus mudah menguap
dan stabil pada temperatur pengujian, utamanya dari 50-300oC. Jika senyawa
tidak mudah menguap atau tidak stabil pada temperatur pengujian, maka senyawa
tersebut bisa diderivatisasi agar dapat dianalisis dengan kromatografi gas
(Christian, 2004).
1. Sistem Injeksi Sampel
Fungsi tempat penginjeksian adalah untuk menyediakan jalan masuk
bagi syringe dan juga sampel ke dalam aliran gas pembawa dan untuk
menyediakan panas yang cukup untuk menguapkan sampel (Dean, 1995).
Sampel dimasukkan ke dalam ruang suntik melalui gerbang suntik yang
suntik harus dipanaskan tersendiri (terpisah dari kolom) dan biasanya 10-15oC
lebih tinggi daripada suhu kolom maksimum (Gandjar dan Rohman, 2007).
Pada dasarnya, ada 4 jenis injektor pada kromatografi gas, yaitu:
a. Injeksi langsung (direct injection), yang mana sampel yang
diinjeksikan akan diuapkan dalam injektor yang panas dan 100%
sampel masuk menuju kolom.
b. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan
diuapkan dalam injektor yang panas dan selanjutnya dilakukan
pemecahan.
c. Injeksi tanpa pemecahan (splitness injection), yang mana hamper
semua sampel diuapkan dalam injektor yang panas dan dibawa ke
dalam kolom karena katup pemecah ditutup.
d. Injeksi langsung ke kolom (on column injection), yang mana ujung
semprit dimasukkan langsung ke dalam kolom (Rohman, 2009).
2. Gas Pembawa
Gas pembawa merupakan fase gerak yang berfungsi untuk membawa
cuplikan melewati kolom. Gas yang biasa digunakan adalah helium, nitrogen,
hidrogen, dan argon. Gas-gas ini relatif tidak mahal, bisa didapatkan dengan
mudah, tidak begitu berbahya serta bersifat tidak reaktif sehingga tidak bereaksi
dengan molekul-molekul cuplikan pada tekanan dan suhu kromatografi (Christian,
Gas pembawa biasanya mengandung gas helium, nitrogen, hidrogen, atau
campuran argon dan metana. Pemilihan tipe gas ini tergantung penggunaan
spesifik dan jenis detektor yang digunakan. Helium merupakan tipe gas pembawa
yang sering digunakan karena memberikan efisiensi kromatografi gas yang lebih
baik (mengurangi pelebaran pita) (Gandjar dan Rohman, 2007).
3. Kolom
Kolom merupakan tempat terjadinya proses pemisahan karena di
dalamnya terdapat fase diam. Oleh karena itu, kolom merupakan komponen
sentral pada kromtatografi gas (Gandjar dan Rohman, 2007).
Pada kromatografi gas terdapat dua jenis kolom yang umumnya
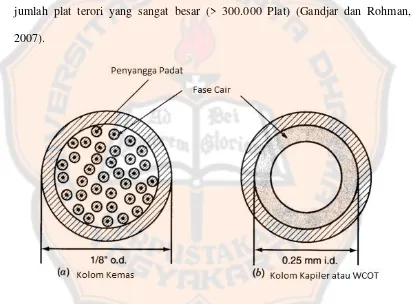
digunakan yaitu: kolom kemas dan kolom kapiler
a. Kolom kemas
Kolom kemas terbuat dari gelas silanized, kolom dikemas dengan
partikel kecil yang dilapisi dengan fase diam cair. Diameter dalam kolom
umumnya antara 2-5 mm dengan panjang kolom yang bervariasi sekitar 2-3 m
(Watson, 1999).
Kolom dapat berbentuk apapun selama masih dapat mengisi tempat
pemanas. Biasanya kolom berbentuk U dan W tetapi yang paling sering
b. Kolom kapiler
Kolom kaplier terbuat dari campuran silika yang dilapisi dengan
polyamide untuk memberikan feleksibilitas kolom. Diameter dalam 0.15–0.5 mm
(Watson, 1999).
Jenis kolom kapiler berbeda dengan kolom kemas, dan kolom kapiler
lebih sering digunakan dikarenakan kemampuan kolom kapiler memberikan harga
jumlah plat terori yang sangat besar (> 300.000 Plat) (Gandjar dan Rohman,
2007).
Gambar 2. Kolom Kemas (a) dan Kolom Kapiler (b) (Miller dan McNair, 1998)
4. Fase Diam
Fase diam dipilih berdasarkan polaritas sampel yang akan diujikan
dengan prinsip “Like dissolve like”, oleh karena itu fase diam yang bersifat polar
diam yang bersifat nonpolar akan berinteraksi dengan senayawa yang lebih
nonpolar (Christian, 2004).
Tabel I. Jenis fase diam dan penggunannya (Harvey, 2000)
Fase diam Polaritas Nama Dagang Batas Temperatur
(oC)
Aplikasi
Squalane Nonpolar Squalane 150 Senyawa - senyawa hidrokarbon alifatik dengan titik didih rendah
Apezion L Nonpolar Apezion L 300 Amida
Metil ester asam lemak Hidrokarbon alifatik titik Obat–obat derivatif Pestisida
Agak polar OV-17 375 Alkaloid
Obat-obatan
Agak polar OV-210 275 Alkaloid
Senyawa turunan asam amino Obat-obatan
Polar OV-225 275 Nitril
Pestisida
Untuk dapat memisahkan sampel, komponen-komponen sampel harus
dapat tertahan oleh fase diam. Dalam gas kromatografi, gas pembawa yang inert
tidak mempengaruhi selektitifitas sampel walaupun itu mempengaruhi resolusi.
Selektivitas sampel dapat divariasikan dengan merubah polaritas fase diam atau
5. Detektor
Detektor merupakan prangkat yang berada di ujung kolom tempat
keluarnya fase gerak yang membawa sampel yang telah dipisahkan menjadi
komponennya (Gandjar dan Rohman, 2007).
Detektor yang digunakan harus peka terhadap komponen-komponen
yang terpisahkan di dalam kolom serta mengubah kepekaannya menjadi sinyal
listrik. Kuat lemahnya sinyal bergantung pada laju aliran massa sampel bukan
pada konsentrasi sampel gas penunjang (Khopkar, 1990).
Detektor harus mempunyai karakteristik sebagai berikut:
1. Sensitivitas yang tinggi.
2. Tingkatnoiseyang rendah.
3. Respon yang linier pada rentang dinamis yang lebar.
4. Respon yang baik pada semua komponen organik.
5. Tidak sensitif pada variasi aliran dan perubahan suhu.
6. Stabil danruggedness.
Tabel II. Jenis detektor dan penggunaannya (Gandjar, 2007)
Jenis detektor Jenis sampel Batas deteksi Kecepatan alir (ml/ menit)
Gas pembawa H2 Udara
Hantar panas Senyawa umum 5-100 ng 15-30 -
-Ionisasi nyala Hidrokarbon 10-100 pg 20-60 30-40 200-500
Penangkap
elektron
Halogen organik,
pestisida 0,05-1 pg 30-60 - 70-100
Nitrogen-fosfor
Senyawa nitrogen
organik dan fosfat
organik
0,1-10 g 20-40 1-5 60-80
Fotometri nyala
(393nm)
Senyawa-senyawa
sulful 10-100 pg 20-40 50-70 100-150
Fotometri nyala
(393nm)
Senyawa-senyawa
fosfor 1-10 pg 20-40 120-170
-Fotoionisasi
elektronik Halogen, N, S
0,5 pg Cl
Selektif massa Sesuai untuk senyawa
apapun 10 pg- 10 ng 0,5-30 -
-Emisi atom Sesuai untuk elemen
apapun 0,1–20 pg 60-70 -
-Flame Ionization Detector (FID) mengukur jumlah atom karbon dan
dapat digunakan untuk mendeteksi hampir semua senyawa organik (Gandjar dan
Rohman, 2007). Detektor ini memberikan sensitifitas yang sangat baik, mampu
mengukur kadar komponen pada rentang konsentrasi part per billion (ppb)
6. Pengaturan Suhu
Kromatografi gas didasarkan pada 2 sifat senyawa yang dipisahkan yaitu:
kelarutan senyawa dalam cairan tertentu dan tekanan uapnya. Karena tekanan uap
berbanding langsung dengan suhu, maka suhu merupakan faktor utama dalam
kromatografi gas (Gandjar dan Rohman, 2007).
Suhu pada ruang injeksi, komponen kolom dan detektor harus dimonitor
dan diatur. Pada ruang injeksi, suhu yang diatur harus dapat menguapkan sampel
dengan cepat sehingga tidak terjadi dekomposisi dan fraksinasi sampel. Suhu pada
kolom tidak boleh melebihi titik didih sampel supaya sampel tetap berada pada
fase uap. Suhu pada detektor harus cukup tinggi supaya eluen tidak mengalami
kondensasi (Dean, 1995).
D. Validasi Metode
Validasi metode merupakan proses untuk menyatakan suatu prosedur
analisis yang digunakan pada pengujian tertentu sesuai dan dapat digunakan untuk
mendapatkan hasil yang dapat dipercaya dalam pengujian tersebut (Nash dan
Wachter, 2003).
Validasi metode dilakukan untuk menjamin bahwa metode analisis
bersifat akurat, spesifik, reprodusibel, dan tahan pada kisaran analisis yang akan
dianalisis (Rohman, 2009).
Beberapa parameter analisis harus dipertimbangkan dalam validasi
deteksi dan batas kuantitasi. Menurut United States Pharmacopeia 30th tahun
2007, metode analisis dibedakan menjadi empat kategori, yaitu:
a. Kategori I, mencakup prosedur analisis kuantitatif, untuk menetapkan
kadar komponen utama bahan obat atau zat aktif dalam sediaan farmasi.
b. Kategori II, mencakup prosedur analisis kualitatif dan kuantitatif yang
digunakan untuk menganalisis impurities dalam sediaan farmasi.
c. Kategori III, mencakup prosedur analisis yang digunakan untuk
menentukan karakteristik penampilan suatu sediaan farmasi, misalnya
disolusi dan pelepasan obat.
d. Kategori IV, mencakup uji identifikasi.
Setiap kategori metode analisis memiliki persyaratan validasi yang
berbeda-beda seperti yang tercantum pada tabel III
Tabel III. Parameter analisis validasi metode (United States Pharmacopeial Convention, 2007) Parameter
kinerja analisis
Kategori I
Kategori II Kategori III Kategori IV Kuantitatif Batas Tes * = Mungkin diperlukan (tergantung sifat spesifik tes)
1. Selektivitas
Selektivitas merupakan kemampuan suatu metode analisis untuk
mengukur analit yang dituju secara tepat dan spesifik dengan adanya
komponen-komponen lain dalam matriks sampel seperti adanya pengganggu, prekursor
2. Linearitas dan Rentang
Linearitas merupakan kemampuan metode analisis untuk mendapatkan
hasil yang secara langsung atau dengan rumusan matematika yang sesuai,
proporsional dengan konsentrasi (jumlah) analit di dalam sampel dalam rentang
area pengukuran yang diberikan sehingga memberikan nilai koefisien korelasi
yang lebih besar daripada nilai koefisien korelasi pada tabel statistik (United
States Pharmacopeial, 2007).
Koefisien korelasi (r) merupakan nilai yang digunakan untuk mengukur
baik buruknya liniearitas yang dimiliki. Suatu metode dikatakan memiliki nilai
linearitas yang baik jika nilai r > 0,99 atau r20,997 (Chan dkk, 2004).
Rentang merupakan interval konsentrasi pada level terendah dan level
tertinggi dalam suatu sampel yang dapat diukur secara kuantitatif dan dapat
diterima akurasi dan presisinya (Jones, 2002).
3. Akurasi
Akurasi dapat didefinisikan dengan tepat sebagai kedekatan suatu nilai
terukur dengan nilai sebenarnya, yaitu nilai yang diharapkan tanpa adanya
kesalahan. Akurasi dari suatu metode analisis umumnya dijelaskan sebagai
kedekatan nilai yang diamati (dianalisis) dengan nilai yang diharapkan (Jones,
2002).
Menurut United States Pharmacopeial Convention penentuan akurasi
dapat dilakukan dengan aplikasi metode analisis terhadap analit yang telah
diketahui kadarnya (misalnya suatu standar) atau dengan membandingkan suatu
recovery dari pengujian sejumlah analit dalam sampel yang diketahui jumlahnya
atau sebagai perbedaan antara nilai rata-rata tehadap nilai sebenarnya yang
diterima, bersama dengan taraf kepercayaan.
Tabel IV. Kriteria %recoveryyang diijinkan untuk konsentrasi analit yang berbeda (United States Pharmacopeial Convention, 2007)
Analit pada matrik
Presisi merupakan ukuran kedekatan antar serangkaian hasil analisis
yang diperoleh dari beberapa kali pengukuran pada sampel homogen yang sama.
Konsep presisi diukur dengan simpangan baku. Komisi eropa membagi presisi
menjadi dua kategori yaitu keterulangan (repeatability) dan ketertiruan
(reproducibility) (Miller dan Ermer, 2005).
Koefisien variasi (KV) merupakan nilai yang digunakan untuk
menyatakan baik buruknya persisi yang dimiliki dalam penelitian. Suatu metode
dinyatakan memiliki presisi yang baik apabila memiliki KV ≤ 2% (Mulja dan
Hanwar, 2003).
Tabel V. Kriteria presisi yang diijinkan untuk konsentrasi analit yang berbeda (United States Pharmacopeial Convention,2007)
5. Limit of Quantitation(LOQ) danLimit of Detection(LOD)
Batas kuantitasi didefinisikan sebagai konsentrasi analit terendah dalam
sampel yang dapat diterima pada kondisi operasional metode yang digunakan.
Batas deteksi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang
masih memberikan respon signifikan dibandingkan dengan blangko (Miller dan
Ermer, 2005).
Ada dua pendekatan yang dapat digunakan dalam menentukan batas
kuantitifikasi dan batas deteksi, yaitu pendekatan signal-to-noise dan pendekatan
standard deviation. Pendekatan signal-to-noise diartikan konsentrasi dari sampel
akan memberikan rasio signal-to-noise 10:1 untuk batas kuantitasi dan rasio
signal-to-noise 3:1 untuk batas deteksi. Pendekatan standard deviationdilakukan
dengan menghitung respon standar deviasi pada konsentrasi rendah denggan
menggunakan persamaan QL = 10 x dan DL 3 x (Chan dkk, 2004).
E. Landasan Teori
Produsen ‘Ciu’ di desa Bekonang menggunakan tetes tebu (molase) sebagai bahan baku produksi. Ciu dihasilkan dengan cara memfermentasikan tetes
tebu dengan katalis ragi Saccharomyces cerevisiae dan yang dapat memetabolis
gula tanpa bantuan oksigen dan menghasilkan etanol, gas CO2dan senyawa lain.
Etanol merupakan senyawa golongan Ciu yang memiliki titik didih 70oC,
mudah menguap dan tahan terhadap pemanasan tinggi. Berdasarkan sifat fisika
kromatografi gas. Metode kromatografi gas merupakan metode analisis dengan
pemisahan senyawa berdasarkan perbedaan titik didih antar komponen dalam
sampel dan terjadi pada suhu kolom yang tinggi, umumnya digunakan untuk
anailsis senyawa-senyawa yang mudah menguap, titik didih 50–300oC, serta tahan
terhadap pemanasan tinggi.
Dengan dikondisikan berdasarkan settingan hasil optimasi, metode
kromatografi Gas yang digunakan untuk penetapan kadar etanol dalam minuman
keras ‘Ciu’ akan memberikan hasil yang tepat dan dapat dipercaya. Untuk
mengetahui kemampuan pemisahan sampel dengan metode kromatografi gas yang
telah dioptimasikan untuk digunakan dalam mengukur kadar etanol, perlu
dilakukan validasi metode Kromatografi Gas. Parameter validasi metode
didasarkan antaralain pada nilai linaritas, akurasi, presisi, batas kuantifikasi
(LOQ), batas deteksi (LOD), linearitas, serta rentang. Nilai linearitasi dianalisis
berdasarkan koefisien determinasi (r) > 0,99, nilai perolehan kembali berdasarkan
mean % recovery antara 98–102% dan presisi dianalisis berdasarkan CV
(Coefficient of Variation) ≤2%, batas kuantifikasi dianalisis berdasarkan LOD ≤
F. Hipotesis
Berdasarkan landasan teori, dapat disusun hipotesis bahwa metode
kromatografi gas untuk penetapan kadar etanol hasil produksi Ciu rumahan dusun
Sentul desa Bekonang memiliki validitas yang baik pada parameter akurasi,
persisi, selektivitas, batas kuantifikasi (LOQ), batas deteksi (LOD), serta linearitas
22 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian noneksperimental deskriptif
dikarenakan tidak dilakukan manipulasi terhadap subjek uji dan hanya
mendeskripsikan keadaan yang ada.
B. Variabel Penelitian 1. Variabel bebas
Variabel bebas dalam penelitian ini adalah sistem Kromatografi Gas yang
telah dioptimasi, yaitu suhu dan tekanan.
2. Variabel tergantung
Variabel tergantung dalam penelitian ini adalah parameter validasi yaitu:
selektivitas, akurasi, presisi, Limit of Quantitation (LOQ), Limit of Detecion
(LOD), serta linearitas dan rentang.
3. Variabel pengacau terkendali
Variabel pengacau terkendali dalam penelitian ini adalah:
Pelarut, untuk mengatasinya digunakan pelarut pro analisis dengan
C. Definisi Operasional
1. Sampel yang digunakan adalah Ciu hasil produksi fermentasi tetes tebu yang
sudah didestilasi dan disaring sebanyak tiga kali penyaringan.
2. Penetapan kadar digunakan sistem kromatografi gas dengan cara
penginjeksian sampel, suhu injektor, suhu kolom, suhu detektor dan kecepatan
alir gas pembawa berdasarkan hasil optimasi.
3. Parameter validasi yang digunakan adalah selektivitas, linearitas, akurasi,
presisi,Limit of Quantitation(LOQ),Limit of Detection(LOD) serta rentang.
4. Kadar etanol dinyatakan dalam satuan % v/v.
D. Bahan-bahan Penelitian
Bahan yang digunakan dalam penelitian adalah Ciu hasil pengolahan
fermentasi tetes tebu, baku etanol p.a.(E. Merck), n-butanol p.a (E. Merck),
aquabidest (Fakultas Farmasi Universitas Sanata Dharma), gas hydrogen HP
99,995% (CV Perkasa), udara tekan HP 99,9995% (CV Perkasa), gas nitrogen HP
99,9995% (CV Perkasa).
E. Alat Penelitian
Alat yang digunakan dalam penelitian ini meliputi seperangkat alat
Kromatografi Gas (HP 5890) dengan Flame Ionization Detector (FID), kolom
kapiler CP-Wax (25 m, i.d. 0,32 mm), alat-alat gelas yang umum dalam analisis
F. Tata Cara Penelitian 1. Pemilihan dan pengambilan sampel
Dipilih sebanyak 14 dari total 70 populasi produsen Ciu di desa
Bekonang secara acak melalui sistem pengundian. Produsen Ciu yang terpilih
secara acak akan diambil sampel Ciu sebanyak 600,0 ml. Pengambilan dilakukan
sebanyak tiga kali dalam satu minggu pengambilan sampel.
2. Preparasi sampel
Sampel Ciu yang diperoleh masing - masing diambil sebanyak 100,0 ml
dan dimasukkan ke dalam wadah. Sampel di dalam wadah dicampur homogen dan
diambil sebanyak 100,0 ml.
Sampel homogen disaring dengan kertas whatman no 1 agar lebih jernih
kemudian sampel disimpan dalam botol tertutup untuk menghindari penguapan.
3. Pembuatan larutan baku
Diambil sejumlah 200 µl, 400 µl, 600 µl, 800 µl, dan 1000 µl etanol p.a
dan masing-masing dimasukkan ke dalam labu ukur 10,0 ml kemudian
ditambahkan standar internal larutan n-butanol sejumlah 600 µl ke dalam
masing-masing labu ukur, diencerkan dengan aquabidest hingga tanda batas dan gojog
homogen sehingga diperoleh konsentrasi 2 % v/v, 4 % v/v, 6 % v/v, 8 % v/v, dan
10 % v/v. Replikasi dilakukan sebanyak lima kali.
4. Penetapan kurva baku
Diambil sebanyak 1 mikroliter (µl) masing-masing konsentrasi seri
larutan baku dan kemudian suntikkan ke dalam kolom melalui tempat injeksi ke
kromatogram etanol dan n-butanol. Kurva baku dibuat dengan memplotkan luas
puncak dari etanol/n-butanol vs kadar etanol lalu dicari persamaan regresi
linearnya.
5. PenentuanrecoverydanCoefficient of Variations(CV) larutan baku
Diambil sejumlah 200 µl, 600 µl, dan 1000 µl etanol p.a dan diberi
perlakuan seperti pada poin F.3 sehingga diperoleh konsentrasi 2 % v/v, 6 % v/v,
dan 10 % v/v, dilakukan replikasi sebanyak lima kali . Hitung kadar terukur
dengan menggunakan persamaan kurva baku yang telah dibuat pada poin F.4.
Recoverydan CV ditentukan berdasarkan data yang diperoleh.
6. PenentuanLimit of QuantitationdanLimit of Detectionbaku
Dihitung nilai LOQ dan LOD baku dengan menggunakan persamaan
sebagai berikut:
LOQ = dan LOD =
Dimana Sb merupakan simpangan baku dari kelima replikasi seri larutan
baku dan s merupakan slope dari persamaan regresi linear yang paling
G. Analisis Hasil 1. Selektivitas
Selektivitas dinyatakan dengan nilai resolusi yaitu kemampuan memisah
antara komponen-komponen sampel. Selektivitas dikatakan baik jika nilai resolusi
(Rs) lebih besar atau sama dengan 1,5.
2. Linearitas
Linearitas metode analisis dinyatakan dengan nilai koefisien korelasi.
Suatu metode analisis dikatakan memiliki linearitas yang baik jika nilai r > 0,999.
3. Akurasi
Akurasi metode analisis dinyatakan dengan % recovery atau perolehan
kembali yang dihitung dengan cara:%recovery= 100%.
4. Presisi
Presisi dinyatakan dengan % CV (koefisien korelasi) yang dihitung
dengan cara: % CV = 100%.
5. Limit Of Ouantitation(LOQ)
LOQ dapat dihitung dengan rumus: LOQ = , dimana SD merupakan
simpangan baku dan S merupakanslopekurva baku.
6. Limit Of Detection(LOD)
7. Rentang
Rentang merupakan interval konsentrasi analit yang diperoleh pada level
rendah dan level tinggi yang dapat diukur secara kuantitatif dan dapat
28
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan Sampel
Penelitian ini menggunakan sampel Ciu dari hasil produksi industri
rumahan yang terdapat di dusun Sentul desa Bekonang, Kabupaten Sukoharjo,
Jawa Tengah. Dari total 70 produsen yang ada memproduksi Ciu, dilakukan
pengambilan sampel secara acak dengan melakukan pengundian terhadap 70
produsen dan sebanyak 14 dari populasi produsen dijadikan sebagai tempat
pengambilan sampel. Melalui hasil pengundian acak diperoleh 14 rumah produksi
yang dijadikan tempat pengambilan sampel. Masing-masing industri rumahan
yang terpilih diambil sampel akohol sebanyak 600,0 ml selama tiga kali masa
produksi dalam satu minggu. Dengan penggundian ini, sampel yang terpilih
merupakan sampel yang repersentatif/mewakili dari populasi yang ada karena
setiap rumah produksi memiliki kesempatan yang sama untuk terambil dalam
pengundian.
B. Preparasi Sampel
Untuk mengecilkan jumlah sampel maka dari sampel 600,0 ml dari
masing-masing rumah produksi yang terpilih diambil sebanyak 100,0 ml dari
setiap bagian wadah kemudian dicampur menjadi satu sehingga diperoleh 1400,0
ml sampel dari berasal dari 14 rumah produksi. Untuk pengujian, pada penelitian
wadah. Pada penelitian ini tidak dilakukan destilasi untuk mendapat sampel yang
lebih murni karena ingin diketahui kadar Ciu dan kandungan senyawa lain yang
terdapat dalam sampel.
C. Pembuatan Larutan Baku
Pada penelitian ini menggunakan 5 seri konsenterasi larutan baku etanol
yaitu 2 % v/v, 4 % v/v, 6 % v/v, 8 % v/v, dan 10 % v/v. Pemilihan seri konsentrasi
ini disesuaikan dengan respon detektor terhadap sinyal (peak) yang dihasilkan dan
tidak tergganggun oleh noise yang dihasilkan alat. Selain itu pemilihan seri
konsentrasi ini juga bertujuan agar respon analit dalam sampel dapat masuk dalam
respon seri larutan baku yang dibuat, sehingga persamaan kurva baku yang
diperoleh dapat digunakan dalam penetapan kadar analit dalam sampel.
Pada optimasi diketahui bahwa AUC sampel yang dihasilkan tidak
memberikan hasil yang stabil dikarenakan jumlah sampel yang diinjeksikan tidak
selalu tepat dengan sistem injeksi sampel secara manual. Selain itu pengguapan
sampel dalam instrumen kromatografi gas tidak bisa diatur sehingga kecepatan
penguapan sampel pada setiap injeksi berbeda-beda. Oleh karena itu diperlukan
suatu pengkoreksi berupa standar internal, pada penelitian ini digunakan faktor
pengkoreksi standar internal n-butnol.
D. Penetapan Kurva Baku
Tujuan penetapan kurva baku adalah untuk mendapatkan persamaan
penetapan akurasi dan presisi. Penetapan kurva baku etanol dilakukan replikasi
tiga kali untuk mendapatkan korelasi yang paling baik, yaitu nilainya yang paling
mendekati 0,99 karena menunjukkan adanya korelasi yang linear antara kosentrasi
dengan respon yang dihasilkan, yaitu berupa Area Under Curve(AUC).
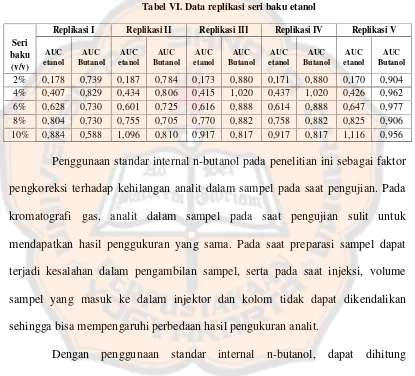
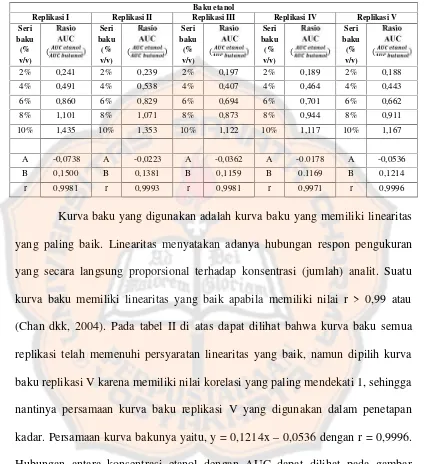
Tabel VI. Data replikasi seri baku etanol
Seri baku
(v/v)
Replikasi I Replikasi II Replikasi III Replikasi IV Replikasi V
AUC
2% 0,178 0,739 0,187 0,784 0,173 0,880 0,171 0,880 0,170 0,904 4% 0,407 0,829 0,434 0,806 0,415 1,020 0,437 1,020 0,426 0,962 6% 0,628 0,730 0,601 0,725 0,616 0,888 0,614 0,888 0,647 0,977 8% 0,804 0,730 0,755 0,705 0,770 0,882 0,758 0,882 0,825 0,906 10% 0,884 0,588 1,096 0,810 0,917 0,817 0,917 0,817 1,116 0,956
Penggunaan standar internal n-butanol pada penelitian ini sebagai faktor
pengkoreksi terhadap kehilangan analit dalam sampel pada saat pengujian. Pada
kromatografi gas, analit dalam sampel pada saat pengujian sulit untuk
mendapatkan hasil penggukuran yang sama. Pada saat preparasi sampel dapat
terjadi kesalahan dalam pengambilan sampel, serta pada saat injeksi, volume
sampel yang masuk ke dalam injektor dan kolom tidak dapat dikendalikan
sehingga bisa mempengaruhi perbedaan hasil pengukuran analit.
Dengan penggunaan standar internal n-butanol, dapat dihitung
perbandingan/rasio Area Under Curve (AUC) etanol:n-butanol sehingga dapat
Tabel VII. Data rasio AUC
Baku etanol
Replikasi I Replikasi II Replikasi III Replikasi IV Replikasi V
Seri
10% 1,435 10% 1,353 10% 1,122 10% 1,117 10% 1,167
A -0,0738 A -0,0223 A -0,0362 A -0.0178 A -0,0536
B 0,1500 B 0,1381 B 0,1159 B 0.1169 B 0,1214
r 0,9981 r 0,9993 r 0,9981 r 0,9971 r 0,9996
Kurva baku yang digunakan adalah kurva baku yang memiliki linearitas
yang paling baik. Linearitas menyatakan adanya hubungan respon pengukuran
yang secara langsung proporsional terhadap konsentrasi (jumlah) analit. Suatu
kurva baku memiliki linearitas yang baik apabila memiliki nilai r > 0,99 atau
(Chan dkk, 2004). Pada tabel II di atas dapat dilihat bahwa kurva baku semua
replikasi telah memenuhi persyaratan linearitas yang baik, namun dipilih kurva
baku replikasi V karena memiliki nilai korelasi yang paling mendekati 1, sehingga
nantinya persamaan kurva baku replikasi V yang digunakan dalam penetapan
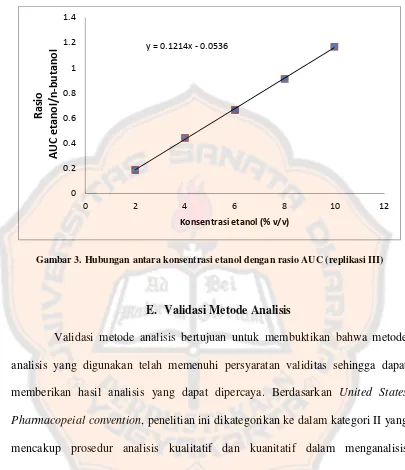
kadar. Persamaan kurva bakunya yaitu, y = 0,1214x – 0,0536 dengan r = 0,9996.
Hubungan antara konsentrasi etanol dengan AUC dapat dilihat pada gambar
Gambar 3. Hubungan antara konsentrasi etanol dengan rasio AUC (replikasi III)
E. Validasi Metode Analisis
Validasi metode analisis bertujuan untuk membuktikan bahwa metode
analisis yang digunakan telah memenuhi persyaratan validitas sehingga dapat
memberikan hasil analisis yang dapat dipercaya. Berdasarkan United States
Pharmacopeial convention, penelitian ini dikategorikan ke dalam kategori II yang
mencakup prosedur analisis kualitatif dan kuanitatif dalam menganalisis
impurities dalam sediaan farmasi sehingga parameter validasi pada penelitian ini
meliputi selektivitas, linearitas, akurasi, presisi, rentang,limit of detection,limit of
quantitation, dan batas kuantitasi. Validasi dilakukan dengan tiga seri konsentrasi
dan direplikasikan sebanyak lima kali. Konsentrasi yang digunakan merupakan
kosentrasi rendah, sedang, dan tinggi dari konsentrasi seri baku yang dibuat yaitu
0,2% v/v, 0,6% v/v, dan 1,0% v/v. Digunakan tiga konsentrasi tersebut karena
mewakili konsentrasi seri baku lainnya.
y = 0.1214x - 0.0536
1. Selektivitas
Selektivitas merupakan kemampuan suatu metode untuk mengukur
dengan akurat respon analit di antara seluruh komponen sampel yang mungkin
ada dalam matriks sampel. Selektivitas dinyatakan dengan parameter resolusi
yaitu dengan mengukur kemampuan memisah antara peak baku etanol dengan
peakstandar internal n-butanol.
Menurut Grob dan Eugene (2004), jika dalam suatu pengujian,
pemisahan antara dua senyawa yang muncul pada kromatogram berjarak 4 s maka
nilai resolusi yang digunakan adalah Rs = 1, dan jika pemisahan dua senyawa
pada kromatogram berjarak 6 s maka nilai resolusi yang digunakan adalah Rs ≥
1,5. Pada penelitian ini jarak yang dihasilkan pada pemisahan etanol dan
n-butanol lebih dari 6 s, maka digunakan parameter nilai resolusi Rs≥ 1,5.
Tabel VIII. Perbandingan waktu retensi (tR) baku etanol dan standar internal n-butanol Konsentrasi seri
larutan baku etanol
(v/v)
tRetanol tRn-butanol Resolusi
2% 254 324 15,7
6% 254 324 12,9
10% 254 324 14,0
Berdasarkan tabel di atas dapat dilihat bahwa resolusi antar peak analit
(etanol) dengan peak terdekat telah memenuhi persyaratan resolusi yang baik
Peak Start tR Max tR End tR
1 252 254 256
2 321 324 326
Gambar 4. Kromatogram pengukuran sampel pada kondisi optimal
Peak Start tR Max tR End tR
1 254 256 260
2 324 327 329
Gambar 5. Kromatogram baku etanol konsentras 600µL
Berdasarkan kedua gambar, dapat dilihat kromatogram hasil pengukuran
baku dan kromatogram hasil pengukuran sampel pada kondisi optimasi
menunjukkan waktu retensi yang tidak jauh berbeda. Dengan demikian dapat
dipastikan peak 1 pada kromatogram sampel merupakan etanol dan peak 2
merupakan standar internal n-butanol. Oleh karena itu, metode kromatografi gas
yang digunakan untuk pengukuran kadar etanol mempunyai selektivitas yang baik
dan dapat memisahkan komponen dalam sampel dengan baik.
2. Linearitas
Linearitas suatu metode menunjukkan proporsionalitas dari nilai kadar
terhadap respon (absorbansi, luas area, tinggi puncak). Linearitas ditunjukkan oleh
nilai koefisien korelasi (r). Menurut Chan dkk (2004), suatu metode analisis
dikatakan memenuhi parameter linearitas yang baik apabila memiliki nilai
korefisien korelasi r > 0,99.
Berdasarkan data yang diperoleh dari pembuatan kurva baku, didapatkan
nilai untuk replikasi I = 0,9981 ; replikasi II = 0,9993 ; replikasi III = 0,9981,
replikasi IV = 0,9971; dan replikasi V = 0,9996. Nilai r untuk kelima replikasi
tersebut sudah memenuhi persyaratan dan dipilih nilai r yang paling mendekati 1
yaitu nilai r pada replikasi V. Oleh karena itu, metode Kromatografi Gas ini telah
memenuhi persyaratan linearitas yang baik untuk menetapkan kadar etanol dalam
sampel Ciu hasil produksi industri rumahan di Dusun Bekonang.
3. Akurasi
Akurasi dinyatakan sebagai % recoveryatau % perolehan kembali. Nilai
% recovery diperoleh dengan cara membandingkan kadar yang terukur terhadap
kadar sebenarnya. Penetapan % recovery dilakukan dengan mengukur tiga seri
kosentrasi rendah (2% v/v), seri baku konsentrasi sedang (6% v/v), dan seri baku
konsentrasi tinggi (10% v/v). Ketiga seri konsentrasi baku ini dipilih karena
dianggap mewakili kelima seri konsentrasi baku yang diggunakan.
Berdasarkan United States Pharmacopeial Convention untuk kategori
pengujian dengan jumlah analit pada matriks sampel lebih besar dari 10% maka
rentang % perolehan kembali yang diijinkan pada penelitian ini adalah 98-102%
sehingga metode tersebut dapat dikatakan memiliki parameter akurasi yang baik.
Tabel IX. Data %recovery
Kadar
2% 105,10 103,10 105,10 104,10 101,10 103,7
6% 103,77 102,60 101,17 100,76 100,76 101,8
10% 101,30 101,80 102,50 101,70 102,50 101,9
Berdasarkan tabel di atas, nilai recovery yang masuk pada rentang
akurasi yang baik (98-102%) adalah pada konsentrasi level sedang (6% v/v) dan
konsetrasi level tinggi (10% v/v).
4. Presisi
Presisi merupakan parameter untuk menyatakan metode yang digunakan
dalam suatu penelitian dapat memberikan hasil yang reprodusibel atau
memberikan keterulangan hasil yang sama dalam setiap pengujian dengan kondisi
dan perlakuan yang sama. Presisi dinyatakan dengan Coefficient of Variation
(CV) yang menunjukkan kedekatan nilai data yang satu dengan yang lain dalam
Berdasarkan United States Pharmacopeial Convention untuk kategori
pengujian dengan jumlah analit pada matriks sampel sama dengan atau lebih besar
dari 1% maka %Coefficient of Variation(CV) yang diijinkan adalah CV≤ 2.
Tabel X. DataCoefficient of Variation(CV) Kadar etanol
(V/V)
Rata-rata kadar (v/v) SD CV (%)
2% 2,072% 0,034 1,62
6% 6,110% 0,077 1,26
10% 10,19% 0,061 0,59
Dari hasil yang diperoleh dapat dilihat pada konsentrasi 2% v/v, 6% v/v,
dan 10% v/v telah memenuhi syarat presisi yang baik dengan nilai CV kurang dari
2%. Dengan demikian, metode ini memiliki presisi yang baik dalam menetapkan
kadar etanol.
5. LOQ dan LOD
Nilai batas kuantifikasi (LOQ) yang diperoleh adalah 0,4047% v/v.
Berdasarkan nilai tersebut kadar sampel yang digunakan pada tidak boleh lebih
rendah dari kadar 0,4047%v/v, sehingga pada penelitian ini penggunaan kadar
terkecil 2%v/v masih memenuhi persyaratan akurasi dan presisi.
Nilai batas deteksi (LOD) yang diperoleh adalah 0,2747% v/v.
Berdasarkan nilai tersebut dapat diketahui jika metode kromatografi gas yang
digunakan masih dapat mengukur etanol sampai batas kadar terkecil 0,2747% v/v
6. Rentang
Rentang merupakan interval antara konsentrasi analit pada level rendah
dan level tinggi dalam suat sampel yang masih memenuhi parameter akurasi,
presisi dan linearitas. Rentang yang ditetapkan dalam pengujian dapat digunakan
untuk mengarahkan jumlah sampel saat penetapan kadar ke level sampel yang
memenuhi rentang sehingga dapat memberikan hasil dengan akurasi dan presisi
yang baik.
Gambar 6. Rentang konsentrasi pengukuran etanol
Pada gambar tersebut dapat dilihat bahwa pada kosentrasi sedang (6%
v/v) dan konsentrasi tinggi (10% v/v) memenuhi parameter akurasi dan presisi
sehingga penetapan kadar etanol dapat dilakukan pada rentang konsentrasi
tersebut.
Konsentrasi etanol (% v/v) Akurasi
39 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Metode Kromatografi Gas dengan instrumen HP 5890, kolom Cp-Wax
52 CB (25m, i.d. 0,32mm) fase diam polyethylene glycol, gas pembawa nitrogen
(N2), tekanan kolom 10 psi, suhu kolom terprogram (gradient temperature)
memiliki selektivitas, linearitas, dan presisi yang baik pada konsentrasi 6-10%
v/v, nilai LOQ yang diperoleh adalah 0,4047% v/v dan nilai LOD 0,2747% v/v.
Berdasarkan hasil tersebut, maka metode kromatografi gas ini memiliki validitas
yang baik untuk menetapkan kadar etanol yang terdapat pada hasil produksi Ciu
oleh produsen di dusun Sentul desa Bekonang kabupaten Sukoharjo.
B. Saran
Perlu dilakukan penetapan kadar etanol yang terdapat pada hasil produksi
Ciu oleh produsen industri rumahan di desa Bekonang kecamatan Sokoharjo
40
DAFTAR PUSTAKA
Adamovics, 1997, Chromatographic Analysis of Pharmaceuticals, 2nd Edition, Marcel Dekker, New York, pp. 5–11.
Chan, C.C., Lam, H., Lee, Y.C., and Zhang, X., 2004, Analytical Method Validation and Instrumen Performance Verification, Jhon Wiley & Sons, Inc., USA, Pp. 12–26.
Christian, G. D., 2004 Analytical Chemistry, Sixth Edition, Jhon wiley & Sons, Inc., United States of America, pp. 65–66, 575–588.
Dean, J. A., 1995, Analyticl Chemistry Handbook, Mc Graw-Hill, Inc., United States of America, pp. 5.2–5.22, 5.32, 5.46, 5.50–5.51.
Fessenden, R. J. dan Fessenden, J. S., 1986. Kimia Organik, Edisi Ketiga, diterjemahkan oleh Aloysius Hadyana Pudjaatmaka, Penerbit Erlangga, Jakarta, 267.
Gandjar, I.G. dan Rohman, A., 2007, Kimia Farmasi Analisis, Pustaka Pelajar, Yogyakarta, pp. 420–429, 433.
Grob. L. R., and Eugene. F. B., 2004, Modern Practice of Gas Chromatography, Fourth Edition, Jhon wiley & Sons, Inc., United States of America, pp 98–99.
Harmita, 2004, Petunjuk Validasi Metode dan Cata Perhitungannya, Departemen Farmasi-FMIPA UI, Jakarta.
Harvey. D., 2000, Modern Analytical Chemistry, McGraw Hillcompanies, Inc, USA. pp. 536–576.
Jones, D. S., 2002, Pharmaceutical Statistics, diterjemahkan oleh Hesty Utami Ramadaniati dan H. Harrizul Rivai, Penerbit Buku Kedokteran EGC, Jakarta, pp. 31–32.
Juwita, R., 2012,Studi Produksi Ciu Dari Tetes Tebu (Saccharum Officinarum L) Selama Proses Fermentasi. Skripsi Universitas Hasanudin Makasar, 3.
Khopkar, S. M., 1990, Konsep Dasar Analitik, diterjemahkan oleh A. Saptorahardjo, Penerbit Universitas Indonesia, Jakarta, pp. 163–165.
Miller. J. H., and Ermer. J., 2005,Method Validation in Pharmaceutical Analyisis, Wiley-VCH Varleg GmBH & Co. KGaA, Germany, pp. 4 – 5, 21 –
25, 63, 80–81, 99.
Mulja, H. M., dan Suharman, 1995, Analisis Instrumenal, Airlangga University Press, Surabaya, pp. 102.
Mulja, H.M. dan Hanwar, 2003, Prinsip Cara Berlaboratorium yang Baik (Good Laboratory Practice),Majalah Farmasi Airlangga, Vol III, No.2, 71–
76.
Nash. R. A., and Wachter. A. H., 2003, Pharmaceutical Process Validatiion, Third Edition, Marcel Dekker, Inc., New York.
Pharmaceutical Press, 2009, Martindale The Complete Drug Refrence, 36th Edition, edited by Kathleen Parfitt, Pharmaceutical Press, London, UK, pp. 1625, 2024.
Rohman, A., 2009,Kromatografi untuk Analisis Obat, Edisi Pertama, Graha Ilmu, Yogyakarta, pp 183, 188, 217–240.
United States Pharmacopeial Convention, 2007,The United States Pharmacopeia,
30th edition, United States Pharmacopeial Convention Inc., New York.
Waskito, A. A. P., 2014, Optimasi Metode Penetapan Kadar Etanol Dan Profil Senyawa Yang Terdapat Dalam Hasil Produksi “Ciu” Rumahan Dusun Sentul Kabupaten Sukoharjo Dengan Metode Kromatografi Gas,Skripsi (In Progress), Universitas Sanata Dharma.
Watson, D. G., 1999,Pharmaceutical Analysis A Textbook for Pharmacy Students and PharmaceuticalChemists, Churchill Livingstone, London, United Kingdom, pp. 211–212.
Widodo, Arif, 2004, Tinjauan Sosiologi Kesehatan Mengenai Kebiasaan
Minu-Minuman Keras (“CiuBekonang”) Di Daerah Sukoharjo dan Upaya
Lampiran 3. Parameter Instrumen Kromatogrfi Gas
Parameter diperoleh berdasarkan hasil optimasi instrumen Kromatografi Gas
Gas Nitrogen, Hidrogen, Udara
Column Cp-Wax 52 CB, 25m x
032mm
Column Head Presure 10 psi
Press. Udara 4 bar
Press. Hidrogen 2.2 bar
Press. Nitrogen 1.5 bar
Split Vent 99.0 ml/min
Purge Vent 3.22 ml/min
Flow Total Flow Udara Flow Hidrogen
Flow Nitrogen Carier
Init temp 70
Init time 2 menit
Rate 30 deg/min
Fnal temp 220
Final Time 2 menit
Injector B 200
Detector A 250
Range 2
Lampiran 4. Kromatogram seri baku etanol replikasi I 1. Kromatogram seri baku etanol 2%
Peak Start tR Max tR End tR
1 254 256 259
2 324 326 326
2. Kromatorgam seri baku etanol 4 %
Peak Start tR Max tR End tR
1 254 256 263
3. Kromatogram seri baku etanol 6 %
Peak Start tR Max tR End tR
1 254 256 258
2 323 326 328
4. Kromatogram seri baku etanol 8 %
Peak Start tR Max tR End tR
1 254 255 257
5. Kromatogram seri baku etanol 10 %
Peak Start tR Max tR End tR
1 254 256 258
2 324 326 328
Lampiran 5. Kromatogram seri baku etanol replikasi II 1. Kromatogram seri baku etanol 2%
Peak Start tR Max tR End tR
1 255,1 256,2 258,6
2. Kromatogram seri baku etanol 4%
Peak Start tR Max tR End tR
1 254 256 257
2 324 326 329
3. Kromatogram seri baku etanol 6%
Peak Start tR Max tR End tR
1 253 255 258
4. Kromatogram seri baku etanol 8%
Peak Start tR Max tR End tR
1 253 255 262
2 323 325 328
5. Kromatogram seri baku etanol 10%
Peak Start tR Max tR End tR
1 254 255 265
Lampiran 6. Kromatogram seri baku etanol replikasi III 1. Kromatogram seri baku etanol 2%
Peak Start tR Max tR End tR
1 253 254 256
2 323 325 327
2. Kromatogram seri baku etanol 4%
Peak Start tR Max tR End tR
1 254 256 262
3. Kromatogram seri baku etanol 6%
Peak Start tR Max tR End tR
1 254 255 258
2 324 326 329
4. Kromatogram seri baku etanol 8%
Peak Start tR Max tR End tR
1 254 255 258
5. Kromatogram seri baku etanol 10%
Peak Start tR Max tR End tR
1 253 255 258
2 323 325 328
Lampiran 7. Kromatogram seri baku etanol replikasi IV 1. Kromatogram seri baku etanol 2 %
Peak Start tR Max tR End tR
1 255 258 262
2. Kromatogram seri baku etanol 4 %
Peak Start tR Max tR End tR
1 255 257 259
2 325 327 330
3. Kromatogram seri baku etanol 6%
Peak Start tR Max tR End tR
1 255 257 261
4. Kromatogram seri baku etanol 8 %
Peak Start tR Max tR End tR
1 254 257 259
2 324 326 328
5. Kromatogram seri baku etanol 10%
Peak Start tR Max tR End tR
1 254 257 265
Lampiran 8. Kromatogram seri baku etanol replikasi V 1. Kromatogram seri baku etanol 2%
Peak Start tR Max tR End tR
1 253 255 258
2 323 326 329
2. Kromatogram seri baku etanol 4%
Peak Start tR Max tR End tR
1 254 255 259
3. Kromatogram seri baku etanol 6%
Peak Start tR Max tR End tR
1 254 255 259
2 324 327 329
4. Kromatogram seri baku etanol 8%
Peak Start tR Max tR End tR
1 254 256 259
5. Kromatogram seri baku etanol 10%
Peak Start tR Max tRtR End tR
1 254 256 259
2 324 327 329
Lampiran 9. Kromatogram validasi metode 1. Konsentrasi rendah
Peak Start tR Max tR End tR
1 254 255 257
2 324 326 328
b. Replikasi II
Peak Start tR Max tR End tR
1 253 255 258
2 323 325 327
c. Replikasi III
Peak Start tR Max tR End tR
1 253 255 257
d. Replikasi IV
Peak Start tR Max tR End tR
1 253 255 258
2 323 325 329
e. Replikasi V
Peak Start tR Max tR End tR
1 254 255 258
2. Konsentrasi sedang a. Replikasi I
Peak Start tR Max tR End tR
1 254 256 258
2 324 326 328
b. Replikasi II
Peak Start tR Max tR End tR
1 254 256 257
c. Replikasi III
Peak Start tR Max tR End tR
1 254 256 258
2 324 326 328
d. Replikasi IV
Peak Start tR Max tR End tR
1 254 256 262
e. Replikasi V
Peak Start tR Max tR End tR
1 254 256 260
2 324 327 329
3. Konsentrasi tinggi a. Replikasi I
Peak Start tR Max tR End tR
1 254 256 258
b. Replikasi II
Peak Start tR Max tR End tR
1 254 256 258
2 324 326 328
c. Replikasi III
Peak Start tR Max tR End tR
1 253 255 260
d. Replikasi IV
Peak Start tR Max tR End tR
1 254 256 265
2 323 326 328
e. Replikasi V
Peak Start tR Max tR End tR
1 254 256 259