WASTU AYU DIAMAHESA
SKRIPSI
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
EFEK SUPLEMENTASI CRUDE ENZIM CAIRAN RUMEN PADA PAKAN IKAN
NILA Oreochromis niloticus BERBASIS SUMBER PROTEIN NABATI
WASTU AYU DIAMAHESA SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
EFEK SUPLEMENTASI CRUDE ENZIM CAIRAN RUMEN PADA PAKAN IKAN
NILA Oreochromis niloticus BERBASIS SUMBER PROTEIN NABATI.
Adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2010
WASTU AYU DIAMAHESA C14052413
Judul Skripsi : Efek Suplementasi Crude Enzim Cairan Rumen Pada Pakan Ikan Nila Oreochromis niloticus Berbasis Sumber Protein Nabati.
Nama : Wastu Ayu Diamahesa
NIM : C14052413
Disetujui
Pembimbing I Pembimbing II
Dr. Muhammad Agus Suprayudi Dr. Dedi Jusadi
NIP.19650418199103 1 003 NIP.19621026198803 1 001
Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Indra Jaya NIP 19610410198601 1 002
Puji dan syukur penulis panjatkan kepada Allah SWT atas berkah, rahmat dan karunia yang telah diberikan sehingga skripsi ini dapat diselesaikan. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Bapak Dr. M. Agus Suprayudi sebagai Pembimbing I sekaligus Pembimbing Akademik atas segala bimbingan dan arahannya selama studi dan penelitian hingga penyusunan skripsi ini.
2. Bapak Dr. Dedi Jusadi sebagai Pembimbing II atas arahannya selama penelitian hingga penyusunan skripsi ini.
3. Ibu Dr. Dinamella Wahjuningrum sebagai Dosen tamu dalam ujian akhir skripsi dan arahannya selama penyusunan skripsi ini.
4. Kedua Orang Tua yang sangat penulis sayangi dan banggakan, Kakanda Mega Putri Armanesa, S.Pi dan Ricky Putra Armando, S.P, serta Adinda Mardian Putri dan Nerissa Arviana yang selalu mendukung satu sama lain. 5. Ibu Indira Fitriliyani M.Si atas kebersamaannya selama penelitian.
6. Bapak Wasjan dan Ibu Retno atas bimbingannya selama di laboratorium. 7. Bapak Maryanta, Ibu Yuli, Bapak Asep dan Bapak Adhi saat mengurus
administrasi studi hingga lulus.
8. Teknisi BDP Bapak Henda, Bapak Aam, dan Bapak Cecep atas bantuannya selama persiapan penelitian.
9. Rekan-rekan BDP 42, khususnya Anita, Widy, Nurul, Siti Maryam, Astriwana, Azizah, Bayu, Asep, Tyas, Ratna Yunita, Johan, Fuadi, Dodi, Angga K yang selalu membantu dan kompak dalam segala sesuatu.
10. Keluarga Besar WBA, khususnya Ida, Ima, Ema, dan Uyung.
Bogor, Maret 2010
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Padang, 1 Maret 1987 dari pasangan Bapak Arsyam dan Ibu Asnimar. Penulis merupakan anak ketiga dari lima bersaudara.
Penulis memulai pendidikannya di SD Tanah Tinggi II pada tahun 1993, dan lulus pada tahun 1999, kemudian di SLTP Negeri 19 Bekasi lulus tahun 2002, dan selanjutnya di SMU Negeri 10 Bekasi dan lulus pada tahun 2005. Pada tahun 2005 penulis diterima di Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI) dan pada tahun 2006 penulis diterima di Program Studi Teknologi dan Manajemen Perikanan Budidaya.
Selama mengikuti perkuliahan penulis aktif pada beberapa organisasi kemahasiswaan. Diantaranya penulis aktif sebagai pengurus Pengembangan Sumber Daya Manusia Himpunan Mahasiswa Akuakultur HIMAKUA (2006-2007), Sekretaris Umum Himpunan Mahasiswa Akuakultur HIMAKUA (2007-2008), dan Anggota Unit Kegiatan Mahasiswa Voli IPB (2007-2009). Penulis juga pernah menjadi Kontingen IPB dalam Pekan Ilmiah Mahasiswa Nasional (PIMNAS) ke- 21 di Semarang tahun 2008 sebagai Penyaji PKMP dan Kontingen IPB Pekan Ilmiah Mahasiwa Nasional ke-22 di Malang tahun 2009 sebagai Penyaji PKMP. Mahasiswa Berprestasi Departemen Budidaya Peraiaran 2009 dan Runner-Up Mahasiswa Berprestasi Fakultas Perikanan dan Ilmu Kelautan 2009. Selain itu, Penulis juga pernah menjadi asisten pada mata kuliah Ikhtiologi (2007), Fisiologi Reproduksi Organisme Akuatik (2008-2009), Nutrisi Ikan (2009), Teknologi Produksi Plankton Bentos dan Alga (2009), Industri Perbenihan Organisme Akuatik (2009), Teknologi Produksi Pakan Alami (2009) Diploma, dan Teknologi Pembuatan dan Pemberian Pakan Ikan (2009).
Dalam usaha menambah wawasan dan pengetahuan di bidang akuakultur, penulis melakukan kegiatan magang di Loka Riset Sukamandi-Subang (2007), Vizan Fish Farm Cibinong (2008), dan Praktek lapangan pembenihan Udang Vannameidi PT. Centra Pertiwi Bahari Lampung (2008).
Untuk menyelesaikan studi, penulis menyelesaikan skripsi yang berjudul
“Efek Suplementasi Crude Enzim Cairan Rumen Pada Pakan Ikan Nila Oreochromis niloticus Berbasis Sumber Protein Nabati.”
Pada Pakan Ikan Nila Oreochromis niloticus Berbasis Sumber Protein Nabati. Dibimbing oleh MUHAMMAD AGUS SUPRAYUDI dan DEDI JUSADI.
Distiller Dried Grains With Solubles (DDGS) dan Palm Kernel Meal (PKM) adalah hasil samping agroindustri memiliki kriteria dari segi kualitas, kuantitas, kontinuitas, harga murah dan tidak berkompetisi dengan kebutuhan manusia sebagai bahan baku alternatif dalam pakan. DDGS adalah hasil samping pada proses pembuatan bioetanol yang sebagian besar berasal dari jagung. Sedangkan PKM adalah hasil samping pada proses pembuatan minyak kelapa sawit. Kedua bahan tersebut memungkinkan digunakan untuk budidaya ikan nila, karena ikan nila adalah ikan omnivora yang cenderung herbivora. Protein nabati memiliki kandungan serat kasar yang tinggi. Salah satu usaha untuk mengatasi kecernaan serat yang rendah adalah penggunaan enzim eksogen untuk menghidrolisis serat tersebut. Crude enzim dari cairan rumen domba diharapkan dapat menghidrolisis serat kasar yang berada dalam pakan berbasis sumber protein nabati. Penelitian ini dilakukan untuk mengkaji efektifitas penambahan
crude enzim cairan rumen pada pakan berbasis sumber protein nabati.
Penelitian ini dilaksanakan pada bulan Juli sampai dengan bulan Nopember 2009 bertempat di Laboratorium Nutrisi Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dengan lima perlakuan dan masing-masing tiga ulangan. Pakan perlakuan yang diberikan adalah pakan berbasis sumber protein nabati dengan penambahan
crude enzim cairan rumen domba dosis 0 ml/kg pakan, 200 ml/kg pakan, 400 ml/kg pakan, 600 ml/kg pakan serta satu perlakuan pakan komersil. Ikan uji yang digunakan adalah ikan nila Oreochromis niloticus dengan bobot awal rata-rata 6,10 0,49 g dengan padat tebar 8 ekor/akuarium. Pemberian pakan secara at satiation dengan frekuensi pemberian pakan 3 kali sehari yakni pukul 08.00 WIB, 12.00 WIB dan 16.00 WIB.
Hasil penelitian menunjukkan bahwa penambahan crude enzim (0 ml/kg, 200 ml/kg, 400 ml/kg, 600 ml/kg) pada pakan berbasis bahan nabati serta satu perlakuan pakan komersial tidak memberikan pengaruh yang berbeda nyata pada jumlah konsumsi pakan, efisiensi pakan, laju pertumbuhan spesifik, dan retensi protein. Sedangkan terdapat perbedaan yang nyata pada parameter retensi lemak dan kelangsungan hidup.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA 2.1 Biologi Ikan Nila Oreochromis niloticus ... 3
2.2 Kebutuhan Nutrisi Ikan Nila ... 4
2.3 Distiller Dried Grains With Solubles (DDGS) ... 6
2.4 Palm Kernel Meal (PKM) ... 6
2.5 Cairan Rumen dan Pemanfaatannya ... 8
2.6 Enzim Pencernaan dan Peranannya dalam Pencernaan ... 9
III. BAHAN DAN METODE 3.1. Pakan Uji ... 12
3.2 Pemeliharaan Ikan dan pengumpulan Data ... 13
3.3 Analisis Kimia ... 15
3.4 Analisis Biologi ... 15
3.4.1 Jumlah Konsumsi Pakan ... 15
3.4.2 Laju Sintasan ... 15
3.4.3 Laju Pertumbuhan Spesifik ... 15
3.4.4 Efisiensi Pakan ... 16
3.4.5 Retensi Lemak ... 16
3.4.6 Retensi Protein ... 16
3.4 Analisis Statistik ... 16
IV. HASIL DAN PEMBAHASAN 4.1 Hasil ... 17
4.2 Pembahasan ... 18
V. KESIMPULAN ... 23
DAFTAR PUSTAKA ... 24
DAFTAR TABEL
Halaman
1. Komposisi enzim cairan rumen domba ... 9
2. Nilai Aktivitas enzim cairan rumen domba ... 12
3. Komposisi pakan perlakuan ... 13
4. Komposisi proksimat pakan perlakuan ... 13
5. Komposisi proksimat tubuh ikan nila ... 17
6. Jumlah konsumsi pakan (JKP), laju pertumbuhan spesifik (LPS), Efisiensi pakan (EP), retensi protein (RP), retensi lemak (RL), Laju sintasan (SR) ... 18
viii
DAFTAR GAMBAR
Halaman 1. Tata letak akuarium penelitian ... 14 2.Grafik biomass rata-rata awal dan akhir ikan uji ... 17
DAFTAR LAMPIRAN
Halaman
1. Hasil proksimat bahan baku (% bobot kering) ... 28 2. Produksi perikanan budidaya menurut komoditas utama ... 28 3. Prosedur analisis proksimat (Takeuchi, 1988) ... 29 4. Jumlah konsumsi pakan (JKP), laju pertumbuhan spesifik (LPS),
efisiensi pakan (EP), retensi protein (RP), retensi lemak (RL),
dan laju sintasan (SR) selama 54 hari pemeliharaan... 32 5. Gambar pakan perlakuan, DDGS, PKM dan crude enzim cairan
I.PENDAHULUAN
1.1 Latar Belakang
Budidaya ikan secara intensif sangat bergantung pada pakan buatan. Pakan juga merupakan biaya variabel terbesar dalam proses produksi sekitar 30% - 60% dari total biaya variabel (Webster dan Lim, 2002). Kenaikan harga pakan akan meningkatkan biaya produksi dan menurunkan laba usaha budidaya ikan. Oleh karena itu, harus dikembangkan formulasi pakan yang memiliki efisiensi pakan yang tinggi dengan biaya produksi pakan yang serendah mungkin. Formulasi tersebut harus menyediakan nutrien yang sesuai dengan jenis ikan yang dibudidayakan.
Selama ini perkembangan pakan ikan komersial umumnya masih bertumpu pada tepung ikan sebagai sumber protein utama. Penurunan produksi tepung ikan dan meningkatnya permintaan tepung ikan menyebabkan terjadinya peningkatan harga tepung ikan secara signifikan (Tacon 1993, dalam Hernandez
et al., 2010). Oleh karena itu perlu dicari bahan pakan alternatif untuk menggantikan atau mengurangi penggunaan tepung ikan. Kriteria yang harus dipenuhi bahan pakan alternatif tersebut adalah memiliki nutrien-nutrien yang dibutuhkan ikan dalam jumlah yang cukup, lebih murah, bahan baku tersedia dalam jumlah besar, tidak berkompetisi dengan kebutuhan manusia dan terjamin kontinuitasnya.
Hasil samping agroindustri umumnya dapat memenuhi kriteria tersebut karena tersedia dalam jumlah besar, tidak berkompetisi dengan kebutuhan manusia, kontinuitasnya terjamin dan harga yang relatif murah. Distiller Dried Grains With Solubles (DDGS) dan Palm Kernel Meal (PKM) adalah hasil samping agroindustri yang memenuhi kriteria tersebut. DDGS adalah hasil samping pada proses pembuatan bioetanol yang sebagian besar berasal dari jagung. Sedangkan PKM adalah hasil samping pada proses pembuatan minyak kelapa sawit. Kedua bahan tersebut memungkinkan digunakan untuk budidaya ikan nila, karena ikan nila adalah ikan omnivora yang cenderung herbivora sehingga lebih mudah beradaptasi dengan jenis pakan yang dicampur dengan sumber bahan nabati seperti DDGS dan PKM.
Namun pemanfaatan PKM sebagai bahan baku pakan dibatasi
penggunaanya, karena kandungan yang tinggi dari serat kasar 20,79%. Selain itu, profil asam amino esensial tepung kelapa sawit rendah akan lisin dan
metionin (Hertrampf dan Pascual, 2000). Menurut Hertrampf dan Pascual (2000),
DDGS dapat berfungsi sebagai sumber protein maupun energi. Penambahan lisin dibutuhkan pada DDGS yang berbahan dasar jagung. Sedangkan DDGS memiliki kadar serat kasar 18,27%. DDGS merupakan sumber fosfor yang baik, namun rendah akan kalsium. DDGS mengandung 0.15 % kalsium dan 0.7 % fosfor. Santiago dan Lovell (1988) menyatakan bahwa defisiensi asam amino esensial dapat diatasi dengan menambahkan asam amino esensial yang menjadi pembatas.
Salah satu usaha untuk mengatasi kecernaan serat yang rendah adalah penggunaan enzim eksogen untuk menghidrolisis serat tersebut. Penggunaan enzim yang berasal dari isi rumen diharapkan dapat menghidrolisis serat kasar dalam pakan yang menggunakan bahan nabati berserat tinggi, sehingga dapat memacu kinerja pertumbuhan dari ikan nila. Produk yang diekstraksi dari cairan rumen ini diharapkan dapat secara langsung digunakan sehingga jauh lebih efisien dibanding harus menggunakan enzim komersial.
1.2 Tujuan
Penelitian ini bertujuan untuk mengkaji efektifitas penambahan crude
enzim cairan rumen pada pakan berbasis sumber protein nabati untuk ikan nila yang berukuran 6,10 ± 0,49 gram.
II. TINJAUAN PUSTAKA
2.1 Biologi Ikan Nila Oreochromis niloticus
Pada awalnya dalam klasifikasi ikan nila memiliki genus Tilapia yang akhirnya mengalami perubahan oleh Dr. Trewavas. Perubahan klasifikasi ini menyebabkan genus Tilapia terbagi menjadi tiga genus yaitu, genus
Oreochromia, genus Sarotherodon dan genus Tilapia. Penggolongan ini berdasarkan perilaku kepedulian induk ikan terhadap telur dan anak-anaknya. Adapun klasifikasi lengkap yang telah dirumuskan oleh Trewavas (1982) adalah sebagai berikut : Filum : Chordata Sub-filum : Vertebrata Kelas : Osteichtyes Sub-kelas : Acanthoptherigii Ordo : Percomorphi Sub-ordo : Percoidea Famili : Cichlidae Genus : Oreochromis
Spesies : Oreochromis niloticus
Ikan nila termasuk kelompok Tilapia yang memiliki bentuk tubuh memanjang, ramping dan relatif pipih. Ikan nila dapat hidup di perairan yang dalam dan luas maupun di kolam yang sempit dan dangkal. Ikan nila juga dapat hidup di sungai yang tidak terlalu deras alirannya, di waduk, danau, rawa, sawah, tambak air payau atau di dalam jaring terapung. Salah satu sifat biologi ikan nila yang penting sehingga ikan ini cocok untuk dibudidayakan adalah respon yang luas terhadap pakan yakni dapat tumbuh dengan memanfaatkan pakan alami serta pakan buatan (Khoironi, 1996).
Walaupun ikan nila termasuk ikan air tawar, ikan ini bersifat euryhaline dan dapat bertahan, tumbuh, dan beberapa spesies dapat memijah pada perairan yang bersalinitas 40 mg/l. Aktivitas makan ikan akan berkurang pada suhu di bawah 20oC dan berhenti makan pada suhu 16oC (Lovell, 1989). Nila adalah spesies akuakultur yang cukup menarik karena pertumbuhannya cepat, trofik level feeding-nya rendah sehingga dapat digunakan sebagai filter feeder, reproduksinya cepat dan mampu menstabilkan kelimpahan fitoplankton (Turker
2.2 Kebutuhan Nutrisi Ikan Nila
Kebutuhan nutrisi ikan akan terpenuhi dengan adanya pakan. Komponen pakan yang berkontribusi terhadap penyediaan materi dan energi tumbuh adalah protein, karbohidrat dan lemak. Kebutuhan ikan akan protein dipengaruhi oleh berbagai faktor diantaranya ukuran ikan, temperatur air, kadar pemberian pakan, kandungan energi dalam pakan yang dapat dicerna dan kualitas protein (Furuichi, 1988).
Protein merupakan molekul kompleks yang terdiri dari asam amino esensial dan non esensial. Protein adalah nutrien yang sangat dibutuhkan untuk perbaikan jaringan tubuh yang rusak, pemeliharaan protein tubuh untuk pertumbuhan, materi untuk pembentukan enzim dan beberapa jenis hormon, dan juga sebagai sumber energi (NRC, 1993). Sekitar 65-75 % dari tubuh ikan dalam berat kering merupakan protein (Halver, 1989). Ikan menggunakan protein secara efisien sebagai sumber energi (Lovell, 1989).
Pertumbuhan maksimum pada ikan nila didapat dengan level protein 35-50%, tetapi level optimum dalam pakan komersil untuk ikan nila juvenil sampai dengan dewasa biasanya 25-35% (Popma and Lovshin, 1996). Sedangkan pada kolam atau tambak yang memiliki pakan alami yang dapat menyumbangkan protein bagi ikan, maka kadar protein dalam pakan yang memadai untuk ikan dapat berkisar antara 20-25% (Newman, et.al., 1979: Lovell, 1980 dalam Webster dan Lim, 2002).
Jika ikan kekurangan sumber protein, maka pertumbuhan akan terhambat dikarenakan protein yang dimakan oleh ikan akan digunakan untuk mempertahankan fungsi jaringan tubuh yang lebih penting. Hal ini bahkan dapat menyebabkan terjadinya penurunan bobot ikan karena protein yang terkandung dalam jaringan tubuh ikan dipecah kembali untuk mempertahankan fungsi jaringan tubuh yang lebih penting tersebut (NRC, 1993; Halver, 1989).
Lemak sebagai salah satu makronutrien bagi ikan karena selain berfungsi sebagai sumber energi non protein dan asam lemak essensial, juga berfungsi memelihara bentuk dan fungsi fosfolipid, membantu dalam absorbsi vitamin yang larut dalam lemak dan mempertahankan daya apung tubuh (NRC,1993).
Lemak pakan merupakan sumber asam lemak esensial (essential fatty acid
=EFA) yang dibutuhkan ikan untuk pertumbuhan, pemeliharaan dan metabolisme tubuh (NRC, 1993). Dalam satu gram lemak memiliki energi dalam pakan (gross
5
energy) sebesar 9,4 kkal, sedangkan dalam protein dan karbohidrat sebesar 5,6 dan 4,1 kkal (Watanabe, 1988).
Jenis asam lemak yang dibutuhkan ikan diantaranya asam lemak 3 dan
6, berupa asam linolenat (18:3 3), asam linoleat (18:2 6), asam
eicosapentaenoic (EPA, 20:5 3), dan decosahexaenoic (DHA, 22:6 3)
(Millamena dalam SEADFEC, 2002). Akan tetapi menurut Takeuchi et al (1983) dalam Watanabe (1988), jenis asam lemak esensial yang dibutuhkan oleh ikan nila adalah 18:2 6 0,5% asam lemak linoleat. Kadar lemak dalam pakan sebesar 5% sudah mencukupi untuk kebutuhan ikan nila, tetapi jika kadar lemak dalam pakan ditingkatkan menjadi 12% akan memberi pengaruh berupa perkembangan maksimal pada ikan nila (Chou dan Shiau, 1996 dalam Webster, 2002).
Menurut Takeuchi, Satoh, dan Watanabe (1983) dalam Lovell (1989) Sumber lemak yang baik untuk ikan nila adalah berasal dari minyak nabati seperti minyak jagung atau minyak kedelai yang memiliki kandungan 18:2 6 (linoleat) yang ditunjukkan dengan pertumbuhan yang baik pada ikan dibandingkan dengan minyak ikan yang memiliki kandungan asam lemak 20:5 3 (EPA). Kekurangan kadar asam lemak omega 3 dan omega 6 pada pakan dapat menyebabkan nafsu makan ikan menurun, pertumbuhan yang lambat, dan pembengkakan pada ikan, pucat, dan lemak pada hati (Lovell, 1989).
Karbohidrat merupakan sumber energi yang murah dan dapat menggantikan atau menghemat penggunaan protein (protein sparing effect)
yang lebih mahal sebagai sumber energi (Millamena dalam SEADFEC, 2002). Karbohidrat dalam pakan dapat berupa serat kasar serta bahan ekstrak tanpa nitrogen (BETN) (NRC, 1993). BETN mengandung banyak gula dan pati yang bersifat mudah dicerna sedangkan serat kasar kaya akan lignin dan selulosa yang sukar untuk dicerna. Sedangkan Lovell (1989) mengemukakan bahwa pemberian tingkat energi optimum dalam pakan sangat penting karena kelebihan dan kekurangan energi dapat menurunkan pertumbuhan ikan.
Pemanfaatan karbohidrat oleh ikan berbeda-beda bergantung kepada kompleksitas karbohidrat. Kadar optimum karbohidrat dalam pakan ikan sulit untuk ditentukan karena protein dan lemak mendahului fungsi karbohidrat sebagai sumber energi (Furuichi, 1988). Ikan-ikan karnivora tidak mampu memanfaatkan karbohidrat kompleks seperti glukosa, sukrosa dan laktosa sebagai energi utama dalam pakannya pada level yang tinggi. Ikan-ikan omnivora dan herbivora dapat mencerna karbohidrat yang berasal dari
tumbuh-tumbuhan (Yamada, 1983). Ikan-ikan karnivora dapat memanfaatkan karbohidrat optimum pada tingkat 10 - 20% dalam pakannya sedangkan ikan-ikan omnivora mampu memanfaatkan karbohidrat optimum sebesar 30 - 40% dalam pakan (Furuichi, 1988).
Komponen lain yang dibutuhkan dalam pakan ikan yaitu vitamin dan mineral. Jumlah yang dibutuhkan dari vitamin dan mineral dalam pembuatan pakan sangatlah kecil namun kehadirannya dalam pakan sangat penting karena dibutuhkan tubuh ikan untuk tumbuh dan menjalani beberapa fungsi tubuh. NRC (1993) menjelaskan bahwa mineral merupakan senyawa yang digunakan untuk proses respirasi, osmoregulasi, dan pembentukan kerangka tulang. Vitamin merupakan senyawa organik kompleks yang diperlukan untuk tumbuh secara normal, reproduksi, kesehatan, dan metabolisme secara umum.
2.3 Distillers Dried Grains With Solubles (DDGS)
Distillers Dried Grains with Solubles (DDGS) merupakan hasil samping pada industri penyulingan etanol. Sebagian besar DDGS berbahan dasar jagung. Pada proses pembuatan etanol terdapat residu yang diperoleh setelah jagung yang telah digiling dan difermentasikan oleh ragi Saccharomyces cerevisiae
mengalami proses destilasi. Residu tersebut kemudian dipadatkan dan dikeringkan hingga menjadi 75 % dari bobot awal (Hertrampf dan Pascual, 2000). Komposisi kimia DDGS dipengaruhi oleh bahan dasarnya, proses, dan alat yang digunakan pada saat destilasi. DDGS yang berasal dari jagung mengandung protein 27,8 % , lemak 10 % , abu 4,7 % , serat kasar 10,9 % , dan kadar air sebesar 9,2 % (Hertrampf dan Pascual, 2000).
Menurut Hertrampf dan Pascual (2000), DDGS dapat berfungsi sebagai sumber protein maupun energi. Penambahan lysine dibutuhkan pada DDGS
yang berbahan dasar jagung. Variasi kandungan mineral dari DDGS sangat tinggi. DDGS merupakan sumber fosfor yang baik, namun rendah akan kalsium.
DDGS mengandung 0.15 % kalsium dan 0.7 % fosfor. Secara umum DDGS
dapat digunakan untuk ikan dengan jumlah 10-35 % (Hertrampf dan Pascual, 2000).
2.4 Palm Kernel Meal (PKM)
Perkembangan produksi kelapa sawit di Indonesia terus meningkat. Pada tahun 2005 pangsa ekspor minyak sawit Indonesia mencapai 39,35% dari ekspor
7
minyak sawit dunia, dan pada periode yang sama, pangsa ekspor minyak sawit Malaysia sekitar 50,68%. Pada tahun 2006 pangsa ekspor minyak sawit Indonesia mencapai 39,18% dari ekspor minyak sawit dunia dan Malaysia sekitar 50,31%. Dengan demikian, pangsa pasar Malaysia cenderung menurun, sebaliknya pangsa pasar Indonesia makin meningkat seiring dengan peningkatan produksi minyak sawit Indonesia (Anonim, 2007)
Pada tahun 2010 jumlah ekspor minyak sawit Indonesia diproyeksikan akan menyamai Malaysia dan sedikit di atas jumlah ekspor Malaysia pada tahun-tahun berikutnya. Dalam periode 2006-2010, harga minyak sawit di pasar Eropa diperkirakan relatif stabil pada kisaran USD 388,48-USD 521,85/ ton. Stabilitas harga ini tidak terlepas dari berkembangnya pasar minyak sawit, terutama di negara-negara berkembang (Anonim, 2007).
Melihat kenyataan ini bungkil kelapa sawit cukup potensial untuk dimanfaatkan sebagai bahan pakan ikan. Protein tepung kelapa sawit berkisar antara 13 - 22% (Sundu et al., 2003). Berdasarkan hasil analisis ini terlihat bahwa kandungan protein kasar dari bungkil kelapa sawit cukup baik dijadikan sebagai bahan pakan ikan. Profil asam amino pada tepung kelapa sawit rendah akan lisin dan metionin (Hertrampf dan Pascual, 2000). Kadar serat yang tinggi yaitu 23% bobot kering (Tang, 2004) membuat kecernaannya rendah, selain itu dalam PKM terdapat karbohidrat yang sebagian besarnya berupa 78% mannan
yang bersifat tidak tercerna dan tidak larut dalam air (Sundu dan Dingle, 2003). Bahan baku pakan yang berasal dari biji-bijian tumbuhan seperti biji gandum dan minyak tumbuhan mengandung jumlah protein yang signifikan dan berpotensi untuk menggantikan tepung ikan. Namun jika dibandingkan dengan tepung ikan dan tepung daging, kandungan karbohidrat yang dikandung biji-bijian jauh lebih besar, walaupun masih sangat sedikit dimanfaatkan oleh berbagai spesies ikan (Stone, 2003).
Penggunaan PKM 20% (bobot kering) dalam pakan ikan nila tilapia (Oreochromis sp) tidak menunjukkan pengaruh negatif terhadap pertumbuhan dan efisiensi pakan bila dibandingkan dengan pakan kontrol yang menggunakan tepung ikan 21,19% dan tepung bungkil kedelai 30,73% sebagai sumber protein. Namun jika PKM diberikan dengan menggunakan enzim maka penggunaan PKM 40% akan memberikan pertumbuhan yang lebih baik dari penggunaan PKM tanpa ada perlakuan enzim. Semakin tinggi penggunaan PKM dalam pakan ikan
nila tilapia (Oreochromis sp) akan semakin menurunkan tingkat kecernaan protein, lemak dan energi (Ng, 2002).
Penelitian yang dilakukan oleh Lim (2001) pada ikan tilapia (Oreochromis mossambicus) menunjukkan bahwa penggunaan PKM 30% dalam pakan memberikan pertumbuhan yang tidak berbeda nyata dengan ikan yang diberi pakan kontrol yang menggunakan tepung ikan 43% dan tepung bungkil kedelai 20,75% sebagai sumber protein walaupun tingkat kecernaan proteinnya lebih rendah dari pakan kontrol.
2.5 Cairan Rumen dan Pemanfaatannya
Perut hewan ruminansia terdiri atas rumen, retikulum, omasum, dan abomasum. Volume rumen pada ternak sapi dapat mencapai 100 liter atau lebih dan untuk domba berkisar 10 liter. Rumen diakui sebagai sumber enzim pendegradasi polisakarida. Polisakarida dihidrolisis di rumen disebabkan pengaruh sinergis dan interaksi dari kompleks mikroorganisme, terutama sellulase dan xillanase (Trinci et el., 1994). Ada dua grup jenis mikroorganisme yang diyakini pada cairan rumen (liquid phase) dan yang menempel pada digesta rumen. Enzim yang aktif mendegradasi struktural polisakarida hijauan kebanyakan aktif pada mikroorganisme yang menempel pada partikel pakan.
Di dalam retikulo rumen terdapat mikroba rumen yang terdiri atas protozoa dan bakteri yang berfungsi melaksanakan fermentasi untuk mensintesis asam amino, vitamin B-komplek dan vitamin K sebagai sumber zat makanan bagi hewan induk (Hungate, 1966). Mikroba-mikroba rumen mensekeresikan enzim-enzim pencernaan ke dalam cairan rumen untuk membantu mendegradasi partikel makanan. Enzim-enzim tersebut antara lain enzim yang mendegradasi
substrat selulosa, yaitu selulase, hemiselulosa/xylosa adalah
hemiselulase/xylanase, pati adalah amilase, pektin adalah pektinase, lipid/lemak adalah lipase, protein adalah protease dan lain-lain (Kamra, 2005). Aktivitas enzim dalam cairan rumen juga tergantung dari komposisi atau perlakuan makanan (Moharery dan Das, 2001).
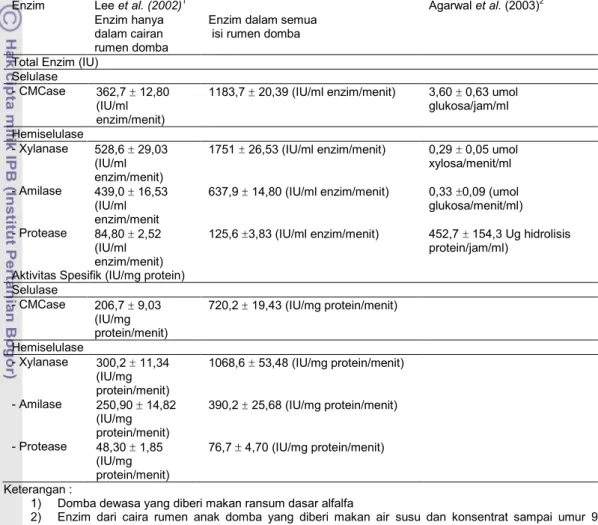
Lee et al. (2002) memetakan enzim-enzim dalam cairan rumen domba. Enzim-enzim yang terdapat dalam cairan rumen domba antara lain adalah enzim-enzim selulotik terdiri atas beta-D-endoglukanase, beta-D-exoglukanase, beta-D-glukosidase dan beta-D-fucosida fucohydrolase, enzim-enzim xylanolitik terdiri atas beta-D-xylanase, beta-D-xylosidase, acethyl esterase dan
alfa-L-9
arabinofuranosidase, enzim-enzim pektinolitik terdiri atas polygalakturonase, pectate lyase dan pectin lyase, dan enzim-enzim lain yang terdiri atas beta-amilase, endo-arabilase, beta-D-gluanase (laminarinase), beta-D-glucanase (Lichenase), beta-D-glucanase (Pechimanase) dan protease. Beberapa enzim dalam cairan rumen dan aktivitas enzimnya disajikan pada Tabel 1.
Tabel 1. Komposisi enzim cairan rumen domba
Enzim Lee et al. (2002)1 Agarwal et al. (2003)2
Enzim hanya dalam cairan rumen domba
Enzim dalam semua isi rumen domba Total Enzim (IU)
Selulase
- CMCase 362,7 12,80 (IU/ml enzim/menit)
1183,7 20,39 (IU/ml enzim/menit) 3,60 0,63 umol glukosa/jam/ml Hemiselulase
- Xylanase 528,6 29,03 (IU/ml enzim/menit)
1751 26,53 (IU/ml enzim/menit) 0,29 0,05 umol xylosa/menit/ml - Amilase 439,0 16,53
(IU/ml enzim/menit
637,9 14,80 (IU/ml enzim/menit) 0,33 0,09 (umol glukosa/menit/ml) - Protease 84,80 2,52
(IU/ml enzim/menit)
125,6 3,83 (IU/ml enzim/menit) 452,7 154,3 Ug hidrolisis protein/jam/ml)
Aktivitas Spesifik (IU/mg protein) Selulase - CMCase 206,7 9,03 (IU/mg protein/menit) 720,2 19,43 (IU/mg protein/menit) Hemiselulase - Xylanase 300,2 11,34 (IU/mg protein/menit) 1068,6 53,48 (IU/mg protein/menit) - Amilase 250,90 14,82 (IU/mg protein/menit) 390,2 25,68 (IU/mg protein/menit) - Protease 48,30 1,85 (IU/mg protein/menit) 76,7 4,70 (IU/mg protein/menit) Keterangan :
1) Domba dewasa yang diberi makan ransum dasar alfalfa
2) Enzim dari caira rumen anak domba yang diberi makan air susu dan konsentrat sampai umur 9 minggu
Sumber : (Moharrery and Das, 2001).
2.6 Enzim Pencernaan dan Peranannya dalam Proses Pencernaan
Pemanfaatan materi dan energi pakan untuk pertumbuhan terlebih dahulu melalui suatu proses pencernaan dan metabolisme. Dalam proses pencernaan, makanan yang tadinya merupakan senyawa kompleks akan dipecah menjadi senyawa yang lebih sederhana sehingga mudah diserap malalui dinding usus dan disebarkan ke seluruh tubuh melalui sistem peredaran darah. Protein terhidrolisis manjadi asam amino bebas dan peptida-peptida pendek, karbohidrat dipecah menjadi gula-gula sederhana dan lemak menjadi asam-asam lemak dan
gliserol. Proses-proses di atas dilakukan oleh enzim-enzim pencernaan (Tillman
et al. 1991).
Enzim adalah katalisator biologis dalam reaksi kimia yang sangat dibutuhkan dalam kehidupan. Enzim adalah protein, yang disintesis di dalam sel dan dikeluarkan dari sel yang membentuknya melalui proses eksositosis. Enzim yang disekresikan ke luar sel digunakan untuk pencernaan di luar sel (di dalam rongga pencernaan) atau disebut extra celluler digestion, sedangkan enzim yang dipertahankan di dalam sel digunakan untuk pencernaan di dalam sel itu sendiri atau disebut intra celluler digestion (Affandi et al, 1992).
Enzim pencernaan yang disekresikan dalam rongga pencernaan berasal dari sel-sel mukosa lambung, pilorik kaeka, pankreas, dan mukosa usus. Oleh karena itu, perkembangan sistem pencernaan erat kaitannya dengan perkembangan aktivitas enzim di dalam rongga saluran penceranan (Watford dan Lam, 1993). Enzim-enzim tersebut berperan sebagai katalisator dalam hidrolisis protein, lemak dan karbohidrat menjadi bahan-bahan yang sederhana. Sel-sel mukosa lambung menghasilkan enzim protease dengan suatu aktivitas proteolitik optimal pada pH rendah. Pilorik kaeka yang merupakan perpanjangan usus terutama mensekresikan enzim yang sama seperti yang dihasilkan pada bagian usus yaitu enzim pencernaan protein, lemak, dan karbohidrat yang aktif pada pH netral dan sedikit basa. Cairan pankreatik kaya akan tripsin, yaitu suatu protease yang aktivitasnya optimal sedikit di bawah pH basa. Selain itu, cairan ini juga mengandung amilase, maltase, dan lipase. Ikan yang tidak memiliki lambung dan pilorik kaeka, aktivitas proteolitik terutama berasal dari cairan pankreatik.
Kemampuan ikan dalam mencerna makanan sangat bergantung pada kelengkapan organ pencernaan dan ketersediaan enzim pencernaan. Perkembangan saluran pencernaan tersebut berlangsung secara bertahap dan setelah mencapai ukuran/umur tertentu saluran pencernaan mencapai kesempurnaannya. Perkembangan struktur alat pencernaan ini diikuti oleh perkembangan enzim pencernaan dan perubahan kebiasaan makan (food habit). Kandungan nutrien pakan nampaknya berpengaruh pada aktivitas enzim pencernaan. Kuzmina (1996) mengungkapkan bahwa tersediannya substrat merupakan faktor yang nyata dalam pengaturan aktivitas enzim pada ikan dan mamalia. Kandungan protein pakan yang tinggi dikaitkan dengan kandungan selulosa yang rendah umumnya meningkatkan aktivitas protease pada ikan
11
rainbow trout (Hepher, 1990). Peningkatan proporsi pati kentang dalam pakan dari 10 menjadi 90% yang diiukuti penurunan proporsi tepung ikan akan meningkatkan aktivitas enzim maltase dan amilase pada ikan mas, dan adaptasi enzim karbohidrase ini terhadap komposisi pakan sudah terlihat kurang dari satu minggu (Kawai dan Ikeda, 1972).
Stickney dan Shumway (1974) menyatakan bahwa enzim selulosa diproduksi oleh mikroflora usus, yang dihubungkan dengan aktivitas selulase dalam usus dengan jumlah selulase/bakteri selulotik. Das dan Tripathi (1991) mendapatkan kemunduran drastis dalam aktivitas selulase ketika ikan grass carp diberi pakan dari makanan yang mengandung tetrasiklin. Beberapa penelitian telah melaporkan bahwa ikan tidak memiliki enzim selulosa dan kemungkinan adanya populasi mikroba selulotik di saluran pencernaan ikan juga masih menjadi kontrofersi di kalangan peneliti (Stickney dan Shumway, 1974).
Enzim protease menguraikan rantai-rantai peptida dari protein. Bergantung pada letak ikatan peptida pada tengah atau akhir molekul, peptidase diklasifikasikan menjadi endopeptidase dan eksopeptidase. Endopeptidase menghidrolisis protein dan peptida rantai panjang menjadi peptida-peptida pendek. Endopeptida-peptidase antara lain pepsin yang dihasilkan dari zimogen pepsinogen, tripsin dan tripsinogen, dan kimotripsin dari kimotripsinogen. Eksopeptidase menghidrolisis peptida menjadi asama amino. Karboksipeptidase, aminopeptidase, dan dipeptidase termasuk dalam kelompok eksopeptidase. Alfa amilase adalah enzim yang bertanggung jawab menghidrolisis pati menjadi glukosa. Enzim ini memutuskan ikatan 1,4 -glukosidik dan mengubah pati menjadi glukosa dan maltosa. Sedangkan lipase adalah enzim penting dalam pencernaan lemak. Lipase memecah lemak menjadi gliserol dan asam lemak (Steffens, 1989; Hepher, 1990).
Enzim berperan dalam mengubah laju reaksi sehingga kecepatan reaksi yang diperlihatkan dapat dijadikan ukuran kreativitas enzim. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim adalah jumlah yang menyebabkan pengubahan 1 mikromol substrat permenit pada suhu 25oC pada keadaan pengukuran optimal (Lehninger, 1982). Aktivitas enzim bergantung pada konsentrasi enzim dan substrat, suhu, pH, dan inhibitor (Poedjiadi, 1994).
3.1 Pakan Uji
Pakan yang digunakan adalah pelet kering berbasis sumber protein nabati yang berjenis tenggelam dengan campuran crude enzim dari rumen domba. Pakan uji yang diberikan adalah sebagai berikut :
1. Pakan A : Pakan dengan campuran enzim 000 ml/kg 2. Pakan B : Pakan dengan campuran enzim 200 ml/kg 3. Pakan C : Pakan dengan campuran enzim 400 ml/kg 4. Pakan D : Pakan dengan campuran enzim 600 ml/kg 5. Pakan E : Pakan komersil dengan merek laju
Sebelum pakan uji dibuat terlebih dahulu dilakukan isolasi dan produksi enzim dari rumen domba. Cairan rumen yang diambil diusahakan selalu dalam kondisi dingin. Selanjutnya cairan rumen disentrifugasi dengan kecepatan 12.000 rpm selama 20 menit pada suhu 4 C, kemudian cairan (supernatan) yang terbentuk dapat diambil sebagai sumber crude enzim. Nilai aktivitas enzim cairan rumen domba disajikan dalam Tabel 2.
Tabel 2. Nilai aktivitas enzim cairan rumen domba
Aktivitas Enzim Total Enzim (IU/ml.menit)
Protease 0,0067
Amilase 0,0436
Lipase 1,6295
Sellulase 0,8516
Bahan penyusun pakan dicampurkan dan dicetak dalam bentuk pelet dengan ukuran diameter 2 mm. Komposisi dari pakan perlakuan disajikan pada Tabel 3 dan hasil analisa proksimat pakan pada Tabel 4.
Pakan penelitian ini dibuat dengan mencampurkan seluruh bahan-bahan pakan sesuai dengan komposisi pakan di Tabel 3. Setelah itu, ditambahkan cairan rumen dengan dosis sesuai dengan perlakuan masing-masing. Bahan pakan yang telah dicampurkan tersebut didiamkan selama 24 jam untuk melihat kinerja dari pemberian rumen tersebut. Setelah 24 jam, bahan pakan tersebut dicetak kemudian dioven. Pakan yang telah dibuat kemudian dianalisis kembali untuk mengetahui pemenuhan target protein, energi protein rasio, maupun jumlah energi pakan yang ada.
13
Tabel 3. Komposisi pakan perlakuan
Bahan Baku Perlakuan
A (0) B (200) C (400) D (600) E (komersil)
Hewani : poultry by product meal (PBM) 8 8 8 8 -
Nabati : a. Distiller Dried Grains with Soluble (DDGS)
b. Tepung Bungkil Kelapa Sawit c. Tepung Bungkil Kedelai d. Pollard
88.7 88.7 88.7 88.7 -
Minyak Ikan dan Jagung 1 1 1 1 -
Vitamin dan Mineral Mix 0.3 0.3 0.3 0.3 -
Feed Additive 1.5 1.5 1.5 1.5 -
Carboxy Methyl Cellulose 0.5 0.5 0.5 0.5 -
TOTAL (%) 100 100 100 100 -
GE(kkal/100g pakan)* 404.74 404.74 404.74 404.74 -
C/P (kkal/100g)** 14.62 14.62 14.62 14.62 -
Ekstrak Crude Enzim (ml/kg) 0 200 400 600 -
Keterangan :
BETN = Bahan Ekstrak Tanpa Nitrogen. *GE = Gross Energy.
1 gram protein = 5,6 kkal GE 1 gram karbohidrat/BETN = 4,1 kkal GE
1 gram lemak = 9,4 kkal GE (Watanabe, 1988). ** C = energi ; P = protein.
Tabel 4. Komposisi proksimat pakan perlakuan
Komposisi Proksimat Perlakuan enzim(ml/kg pakan)
A (0) B (200) C (400) D (600) E (komersil) Protein kering 27.89 28.92 28.84 34.24 26.51 Lemak kering 10.36 10.46 10.56 10.62 7.91 Abu 8.29 7.95 7.83 8.25 10.61 Serat kasar 10.88 9.84 9.57 9.45 6.18 BETN 36.98 37.75 36.31 29.19 42.63 GE(kkal/100g pakan)* 405.19 415.06 405.58 405.88 397.58 C/P (kkal/100g)** 14.52 14.35 14.06 11.85 14.99 Kadar Air 5.60 5.08 6.89 8.25 6.16 Keterangan :
BETN = Bahan Ekstrak Tanpa Nitrogen. *GE = Gross Energy.
1 gram protein = 5,6 kkal GE 1 gram karbohidrat/BETN = 4,1 kkal GE
1 gram lemak = 9,4 kkal GE (Watanabe, 1988). ** C = energi ; P = protein.
3.2 Pemeliharaan Ikan dan Pengumpulan Data
Hewan uji yang digunakan adalah Ikan Nila Oreochromis niloticus yang berasal dari Sempur, Bogor dengan bobot rata-rata awal 6,10 ± 0,49 gram. Sebelum digunakan ikan diadaptasikan terlebih dahulu dalam akuarium pemeliharaan selama 14 hari. Perlakuan pakan uji dimulai pada tanggal 28 Agustus – 21 Oktober 2009. Ikan yang dipelihara dalam akuarium adaptasi, diambil secara acak dengan mempertimbangkan keseragaman bobot individu.
Selanjutnya ikan-ikan tersebut ditebar dalam akuarium pemeliharaan dengan kepadatan 8 ekor/akuarium.
Pemeliharaan ikan selama penelitian dilakukan di Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan. Wadah yang digunakan yaitu akuarium berukuran 35x40x50 cm dengan ketinggian air 30 cm. Setiap akuarium perlakuan sebelumnya disterilisasi menggunakan kaporit 30 ppm. Sisa kaporit dihilangkan dengan pemberian tiosulfat 10 ppm dan diaerasi kuat selama 4 hari. Ikan uji dimasukkan ke dalam 5 perlakuan dengan masing-masing perlakuan dilakukan 3 kali ulangan. Tiap ulangan diwakili dalam satu buah akuarium dengan padat penebaran 8 ekor/akuarium. Akuarium diset membentuk suatu sistem resirkulasi yang dilengkapi dengan filter fisik berupa zeolit dan kapas sedangkan filter biologi berupa bioball dan 1 buah bak fiber sebagai tandon. Akuarium diaerasi selama 24 jam. Pemasangan jaring di atas akuarium dilakukan untuk mencegah ikan loncat keluar akuarium.
Sehari sebelum dilakukan penebaran untuk diberi pakan perlakuan, ikan dipuasakan terlebih dahulu. Pemuasaan dilakukan untuk menghindari ikan stress ketika dilakukan penimbangan dan pengukuran bobot. Selain itu, pemuasaan ikan juga bertujuan untuk menyeragamkan kondisi ikan, yaitu lambung yang kosong sehingga ketika dilakukan penimbangan berat yang didapatkan benar-benar merupakan berat bobot tubuh ikan, bukan karena pakan yang masih terdapat di dalam lambung ikan.
Ikan dipelihara selama 54 hari dan dilakukan sampling bobot biomass awal dan akhir. Pakan diberikan secara at satiation dengan frekuensi pemberian tiga kali sehari yakni pukul 08.00 WIB, pukul 12.00 WIB dan pukul 16.00 WIB. Jumlah konsumsi pakan (JKP) didapat dengan menghitung jumlah pakan yang dimakan setiap hari. Skema dan tata letak akuarium terdapat dalam gambar 1.
Pengamatan harian yang dilakukan meliputi pencatatan pemberian pakan dan penimbangan ikan yang mati. Pengukuran bobot ikan uji dilakukan pada awal dan akhir pemeliharaan.
Gambar 1. Tata Letak Akuarium Penelitian. Keterangan :
A, B, C, D, E = Label Pakan Perlakuan 1, 2, 3 = Ulangan Perlakuan T = Tandon.
A3 C2 C1 B2 E3 D2 B1
15
3.3 Analisis Kimia
Analisa proksimat yang dilakukan meliputi analisa protein, lemak, kadar air, kadar abu, dan serat kasar. Analisa proksimat dilakukan terhadap bahan penyusun pakan, pakan uji, tubuh awal dan akhir ikan. Analisa protein dilakukan dengan metode Kjehldahl, analisa lemak pakan menggunakan metode ekstraksi dengan alat Soxhlet, sedangkan analisa lemak ikan menggunakan metode Folch, kadar air dengan metode pengeringan dalam oven pada suhu 110±1oC, kadar abu dengan pemanasan dalam tanur bersuhu 600oC, serat kasar menggunakan metode pelarutan sampel dengan asam dan basa kuat. Analisis proksimat ini dilakukan dengan metode Takeuchi (1988). Analisis proksimat secara keseluruhan terdapat pada Lampiran 3.
3.4 Analisis Biologi
3.4.1 Jumlah Konsumsi Pakan (JKP)
Jumlah konsumsi pakan ditentukan dengan menimbang pakan yang diberikan pada ikan uji setiap hari selama percobaan dilakukan. Pada akhir percobaan, pakan yang telah diberikan dijumlahkan dan dikurangi sisa pakan yang telah dikeringkan menjadi data konsumsi pakan.
3.4.2 Laju Sintasan
Laju sintasan dihitung berdasarkan persamaan yang dikemukakan Huisman (1987), yaitu
%
100
x
No
Nt
SR
Keterangan :Nt = Jumlah ikan pada akhir penelitian (ekor) No = Jumlah ikan pada awal penelitian (ekor).
3.4.3 Laju Pertumbuhan Spesifik
Laju pertumbuhan spesifik ikan uji dihitung berdasarkan persamaan yang dikemukakan oleh Huisman (1987), yaitu:
% 100 1 x Wo Wt t Keterangan:
= Laju pertumbuhan spesifik (%)
Wt = Rata-rata bobot individu pada waktu akhir pemeliharaan (g) Wo = Rata-rata bobot individu pada waktu awal pemeliharaan (g)
3.4.4. Efisiensi Pakan (EP)
Efisiensi pakan dihitung dengan menggunakan rumus sebagai berikut:
EP = {[(Wt + D) – Wo]/ F} x 100%
Keterangan:
EP = Efisiensi pakan (%)
F = Jumlah pakan yang diberikan selama pemeliharaan (gram)
Wt = Biomassa ikan pada waktu akhir pemeliharaan (gram)
Wo = Biomassa ikan pada awal pemeliharaan (gram)
D = Bobot ikan yang mati selama pemeliharaan (gram).
3.4.5 Retensi Lemak
Nilai retensi lemak dihitung berdasarkan persamaan Takeuchi (1988) :
RL = [(F-I)/L] x 100%
Keterangan:
RL = Retensi lemak (%)
F = Jumlah lemak tubuh ikan pada akhir pemeliharaan (gram)
I = Jumah lemak tubuh ikan pada awal pemeliharaan (gram)
L = Jumlah lemak yang dikonsumsi ikan (gram).
3.4.6 Retensi Protein
Nilai retensi protein dihitung berdasarkan persamaan Takeuchi (1988) :
RP = [(F-I)/P] x 100%
Keterangan:
RP = Retensi protein (%)
F = Jumlah protein tubuh ikan pada akhir pemeliharaan (gram) I = Jumah protein tubuh ikan pada awal pemeliharaan (gram) P = Jumlah protein yang dikonsumsi ikan (gram).
3.5 Analisa Statistik
Penelitian ini menggunakan rancangan percobaan berupa Rancangan Acak Lengkap dengan tiga ulangan. Data yang diperoleh dianalisis dengan menggunakan SPSS 16.0. Analisis ragam dilakukan dengan tingkat kepercayaan 95 %. Sedangkan untuk melihat perbedaan perlakuan maka dilakukan uji lanjut dengan uji Duncan.
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
Gambar 2 menunjukkan adanya penambahan biomass dari masing-masing ikan uji. Biomass rata-rata awal ikan uji perlakuan A (0 ml/kg) adalah sebesar 46,9 g sedangkan pada akhir pemeliharaan menjadi 297,7 g atau terjadi penambahan biomass sekitar 6,4 kali lipat. Pada perlakuan B (200 ml/kg) memiliki biomass rata-rata awal sebesar 52,7 g dan biomass rata-rata akhir 317,5 g atau terjadi peningkatan sebesar 6,1 kali lipat. Perlakuan C (400 ml/kg) memiliki biomass rata-rata awal sebesar 47,3 g dan biomass rata-rata akhir 268 g atau terjadi peningkatan biomass sebesar 5,7 kali lipat. Perlakuan D (600 ml/kg) memiliki biomass rata-rata awal sebesar 49,8 g dan biomass akhir 341,5 atau terjadi peningkatan biomass sebesar 6,9 kali lipat. Pada perlakuan E (komersil) terjadi peningkatan biomass sekitar 6,9 kali lipat dimana biomass rata-rata awal sebesar 48,3 g dan bioamass akhir sebesar 332,1 g.
Gambar 2. Grafik biomass rata-rata awal dan akhir ikan uji.
Tabel 5. Komposisi proksimat tubuh ikan nila
Parameter
Awal Perlakuan (ml/kg pakan)
0 200 400 600 komersil
Protein 11.37 15.09±3.84a 15.43±1.12a 15.80±0.80a 16.02±1.26a 15.32±2.31a Lemak 4.46 5.21±0.38a 6.05±0.54a 5.48±0.26a 5.40±0.51a 5.50±1.00a
Air 75.24 74.16±0.94a 73.93±3.57a 73.09±0.68a 73.11±1.48a 73.13±0.77a 1. Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata
(p<0.05).
Hasil penelitian menunjukkan bahwa adanya pemakaian pakan berbasis bahan nabati dengan penambahan crude enzim (0 ml/kg, 200 ml/kg, 400 ml/kg, 600 ml/kg) dan pakan komersil tidak memberikan pengaruh yang berbeda nyata pada jumlah konsumsi pakan, efisiensi pakan, laju pertumbuhan spesifik, dan retensi protein (P>0,05). Sedangkan terdapat perbedaan yang nyata pada parameter retensi lemak dan kelangsungan hidup (P<0,05). Parameter yang diukur selama penelitian disajikan pada Tabel 6.
Tabel 6.Jumlah konsumsi pakan (JKP), laju pertumbuhan spesifik (LPS), efisiensi pakan (EP), retensi protein (RP), retensi lemak (RL), dan laju sintasan (SR) selama 54 hari pemeliharaan.
Parameter Perlakuan A (0 ml/kg) B (200 ml/kg) C (400 ml/kg) D (600 ml/kg) Komersil JKP(gram) 356.4±6.9a 342±20.1a 308 ± 11.8a 351 ± 21.9a 409.4±12.1a EP (%) 70.5± 7.5a 77.1 ± 11.2a 71.5 ± 5.7a 83.2 ±13.1a 69.4 ±7.6a LPS (%) 3.5± 0.2a 3.4± 0.1a 3.3 ± 0.2a 3.6 ±0.3a 3.6 ±0.2a RP (%) 41.8 ± 9.1a 43.4±4.9a 46.5 ± 3.9a 48.6 ±5.6a 42.8 ±1.4a RL (%) 41.3±8.2a 52.9± 7.5ab 43.2 ± 1.2ab 51.6± 4.3ab 56.5±0.9b SR (%) 91.7±7.2bc 87.5±0.0b 91.7 ±7.2bc 100 ±0.0c 70.83 ±7.2a 1. Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata p<0,05. 2. Nilai yang tertera merupakan nilai rata-rata + simpangan baku. Analisis statistik terdapat pada Lampiran 5.
4.2 Pembahasan
Setelah pemeliharaan selama 54 hari terlihat adanya penambahan bobot biomass rata-rata individu ikan nila Oreochromis niloticus pada setiap perlakuan (Gambar 2). Ikan nila merupakan ikan yang efisien dalam menggunakan pakan, bersifat omnivora sehingga dapat mengkonsumsi pakan dalam bentuk pelet yang diberikan. Selain itu, ikan nila juga merupakan ikan yang cepat tumbuh. Pada awal pemeliharaan bobot rata-rata ikan sebesar 6,09 ± 0,46 gram, sedangkan pada akhir pemeliharaan berkisar antara 35,60 ± 3,81 gram – 47,95 ± 1,39 gram. Peningkatan bobot rata-rata ikan pada setiap perlakuan menunjukkan bahwa pakan dapat dimanfaatkan oleh ikan.
Hasil pengujian menunjukkan pemakaian pakan berbasis bahan nabati dengan penambahan crude enzim (0 ml/kg, 200 ml/kg, 400 ml/kg, 600 ml/kg) dan pakan komersil tidak memberikan pengaruh yang berbeda nyata pada jumlah konsumsi pakan (p>0,05). Hal inilah yang menyebabkan efisiensi pakan dan laju pertumbuhan spesifik pada masing-masing perlakuan menjadi tidak berbeda nyata. Nilai efisiensi pakan berkisar antara 69,38 – 83,16%, sedangkan laju pertumbuhan spesifik berkisar antara 3,26 – 3,63%. Jumlah konsumsi pakan yang tidak berbeda nyata menunjukkan bahwa pallatabilitas dan energi yang
19
terkandung dalam pakan perlakuan cenderung sama. Nilai energi yang terkandung dalam pakan (gross energy) perlakuan berkisar antara 397,58 – 415,06 kkal/100 g pakan. Menurut Affandi dan Tang (2002) kebutuhan energi untuk metabolisme harus dipenuhi terlebih dahulu, baru apabila berlebih maka kelebihannya akan digunakan untuk pertumbuhan.
Protein nabati merupakan salah satu sumber energi pada pakan yang relatif murah dibandingkan dengan protein hewani. Dalam formula pakan uji terdapat empat jenis bahan baku sumber protein nabati meliputi Distiller Dried Grains with Sollubles (DDGS), tepung bungkil kelapa sawit (Palm Kernel Meal), tepung bungkil kedelai dan pollard. DDGS dan PKM merupakan sumber protein nabati utama dalam pakan uji. Secara umum menurut Hertrampf dan Pascual (2000) DDGS dapat digunakan untuk ikan dengan jumlah 10 - 35 %. Penelitian yang dilakukan oleh Lim (2001) pada ikan tilapia Oreochromis niloticus
menunjukkan bahwa penggunaan PKM 30% dalam pakan memberikan pertumbuhan yang tidak berbeda nyata dengan ikan yang diberi pakan kontrol yang menggunakan tepung ikan 43% dan SBM 20,75% sebagai sumber protein.
Pemanfaatan PKM sebagai bahan baku pakan dibatasi penggunaanya, karena kandungan yang tinggi dari serat kasar 20,79%. Selain itu, profil asam amino esensial tepung kelapa sawit rendah akan lisin dan metionin (Hertrampf dan Pascual, 2000). Menurut Hertrampf dan Pascual (2000), DDGS dapat berfungsi sebagai sumber protein maupun energi. Penambahan lysine
dibutuhkan pada DDGS yang berbahan dasar jagung. Sedangkan DDGS
memiliki kadar serat kasar 18,27%. DDGS merupakan sumber fosfor yang baik, namun rendah akan kalsium. DDGS mengandung 0.15 % kalsium dan 0.7 % fosfor. Santiago dan Lovell (1988) menyatakan bahwa defisiensi asam amino esensial dapat diatasi dengan menambahkan asam amino esensial yang menjadi pembatas.
Pakan uji yang digunakan diberi perlakuan penambahan crude enzim dari cairan rumen domba. Rumen diakui sebagai sumber enzim pendegradasi polisakarida. Polisakarida dihidrolisis di rumen disebabkan pengaruh sinergis dan interaksi dari kompleks mikroorganisme, terutama sellulase dan xillanase (Trinci
et el, 1994). Di dalam retikulo rumen terdapat mikroba rumen yang terdiri atas protozoa dan bakteri yang berfungsi melaksanakan fermentasi untuk mensintesis asam amino, vitamin B-komplek dan vitamin K sebagai sumber zat makanan bagi hewan induk (Hungate, 1966). Mikroba-mikroba rumen mensekeresikan
enzim-enzim pencernaan ke dalam cairan rumen untuk membantu mendegradasi partikel makanan. Enzim-enzim tersebut antara lain adalah enzim yang mendegradasi substrat selulosa yaitu selulase, hemiselulosa/xylosa adalah hemiselulase/sylanase, pati adalah amilase, pektin adalah pektinase, lipid/lemak adalah lipase, protein adalah protease dan lain-lain (Kamra, 2005).
Aktivitas enzim dalam cairan rumen tergantung dari komposisi atau perlakuan makanan (Moharrery dan Das, 2001). Perlakuan dosis enzim 0 ml/kg, 200 ml/kg, 400 ml/kg dan 600 ml/kg dalam pakan uji tidak memberikan pengaruh yang berbeda nyata terhadap parameter biologis penelitian yang meliputi jumlah konsumsi pakan, laju pertumbuhan spesifik, efisiensi pakan, dan retensi protein. Hal ini dikarenakan aktivitas enzim dari cairan rumen domba yang digunakan masih belum maksimal. Nilai aktivitas enzim protease sebesar 0,0067 unit/ml.menit, amilase 0,0436 unit/ml.menit, lipase 1,6295 unit/ml.menit dan sellulase 0,8516 unit/ml.menit. Nilai aktivitas enzim dari cairan rumen domba dalam penelitian jauh lebih lebih rendah apabila dibandingkan dengan nilai aktivitas enzim yang telah dipetakan oleh Lee et al (2002) dalam Tabel 1.
Selain itu, menurut Moharerry dan Das (2001) usia domba akan mempengaruhi nilai aktivitas enzim cairan rumen. Nilai aktivitas yang lebih rendah tersebut diduga disebabkan oleh domba yang digunakan adalah domba yang dipotong untuk dijadikan sate dengan usia 5-6 bulan. Sedangkan aktivitas yang lebih tinggi telah dipetakan oleh Lee et al (2002) terdapat pada domba dewasa yang berusia lebih dari 2 tahun.
Aktivitas enzim bergantung pada konsentrasi enzim dan substrat, suhu, pH dan inhibitor (Poedjiadi, 1994). Dalam penelitian ini, substrat yang dihidrolisa adalah pakan berbasis bahan nabati berupa DDGS, PKM, tepung bungkil kedelai dan pollard. Serat kasar yang terkandung dalam DDGS yaitu hemiselulosa, PKM yaitu mannan, Pollard yaitu arabinoxylan dan bungkil kedelai yaitu selulosa. Jika dihubungkan dengan aktivitas enzim yang terdapat dalam cairan rumen (Tabel 2), maka bahan-bahan yang dapat dihidrolisa oleh enzim cairan rumen adalah tepung bungkil kedelai. Hal ini disebabkan oleh keberadaan selulase dalam cairan rumen domba sehingga diduga bahan tersebut terhidrolisa. DDGS, pollard dan PKM diduga tidak terhidrolisa karena di dalam crude enzim cairan rumen domba tidak terdapat aktivitas hemiselulase, xylanase dan mannase.
Xylanase merupakan enzim yang mampu menghidrolisis ikatan 1,4-yang terdapat pada hemiselulosa dalam hal ini ialah xilan atau polimer dari
21
xilosa dan xilooligosakarida (Richana, 2002). Xilanase juga mengubah hemiselulosa menjadi gula sederhana sehingga nutrisi yang awalnya terjerat dalam dinding sel hemiselulosa akan dilepaskan dan dapat dimanfaatkan oleh tubuh. Mannan bisa dihidrolisa menjadi mannosa maupun manno-oligosakarida yang berfungsi sebagai prebiotik oleh enzim endo -mannanase (1,4- -D-mannan -D-mannanohydrolase dan exo -manosidase ( -D--D-mannanopyranoside hydrolase (Puls and Scuseill, 1993). Untuk proses hidrolisa mannan tersebut selain mannanase diperlukan enzim glukosidase atau galaktosidase (McCleary, 1988).
Salah satu komponen pakan yang berkontribusi terhadap penyediaan materi dan energi tumbuh adalah protein. Retensi protein merupakan gambaran dari banyaknya protein yang diberikan, yang dapat diserap dan dimanfaatkan untuk membangun dan memperbaiki sel tubuh yang rusak, serta dimanfaatkan tubuh bagi metabolisme harian (Halver, 1989). Pemberian enzim dalam pakan berbasis bahan nabati tidak memberikan pengaruh terhadap nilai retensi protein dari ikan uji. Hal ini dibuktikan dengan tidak adanya perbedaan yang nyata pada nilai komposisi proksimat protein tubuh ikan (Tabel 5).
Selain protein, lemak merupakan penyumbang energi bagi kelangsungan hidup ikan. Kandungan energi lemak paling besar dibandingkan dengan energi yang terkandung dalam protein atau karbohidrat (NRC, 1993). Kadar lemak yang terkandung pada pakan uji berkisar antara 7.91 – 10.62%. Jumlah lemak dalam pakan uji diduga telah mencukupi kebutuhan lemak untuk ikan nila. Hal ini sesuai dengan Chou dan Shiau (1996) dalam Webster (2002) bahwa kadar lemak dalam pakan sebesar 5% sudah mencukupi untuk kebutuhan ikan nila.
Nilai retensi lemak dari pakan berbasis sumber protein nabati dengan penambahan crude enzim 0 ml/kg, 200 ml/kg, 400 ml/kg dan 600 ml/kg tidak memberikan pengaruh yang berbeda nyata. Namun, nilai retensi lemak pakan komersil berbeda nyata dengan pakan berbasis nabati 0 ml/kg. Hal ini diduga nilai karbohidrat dalam bentuk Bahan Ekstrak Tanpa Nitrogen pakan komersil lebih tinggi yaitu sebesar 42,63% dibandingkan dengan pakan berbasis sumber protein nabati tanpa enzim sebesar 36,98%.
Pada proses pencernaan makanan, karbohidrat mengalami proses hidrolisis, baik dalam mulut, lambung maupun usus. Hasil akhir proses pencernaan karbohidrat ini ialah glukosa, fruktosa, galaktosa dan manosa serta monosakarida lainnya. Senyawa – senyawa ini kemudian diabsorbsi melalui
dinding usus dan dibawa ke hati oleh darah. Glukosa atau monosakarida akan dioksidasi menjadi asam piruvat, kemudian asam piruvat akan mengalami dekarboksilasi menjadi Asilkoenzim A (Poedjiadi,1994). Selanjutnya, apabila kadar karbohidrat dalam pakan berlebih, maka asilkoenzim A akan masuk ke jalur metabolisme lemak (lipogenesis) dan menghasilkan asam lemak. Sehingga akan menyebabkan nilai retensi lemak perlakuan pakan komersil lebih tinggi.
Hasil pengujian terhadap kelangsungan hidup dari masing-masing ikan uji, menunjukkan bahwa perlakuan pakan komersil memiliki nilai kelangsungan hidup yang lebih rendah yaitu sebesar 70,83% dan berbeda nyata dengan pakan berbasis sumber protein nabati baik ataupun tidak dengan penambahan crude
enzim (P<0,05). Hal ini diduga karena pakan komersil yang digunakan disimpan dalam waktu yang lama dari distributor dan pengecer sehingga memungkinkan berkurangnya kandungan vitamin, akhirnya ikan mengalami stress dan mati.
23
V. KESIMPULAN DAN SARAN 5.1 Kesimpulan
Penambahan crude enzim cairan rumen pada pakan berbasis sumber protein nabati untuk ikan nila yang berukuran 6,10 ± 0,49 gram tidak memberikan pengaruh yang berbeda nyata pada parameter jumlah konsumsi pakan, efisiensi pakan, laju pertumbuhan spesifik, dan retensi protein.
5.2 Saran
Perlu dilakukan penelitian dengan menggunakan bahan yang mudah dihidrolisa oleh crude enzim cairan rumen domba. Selain itu, cairan rumen berpotensial untuk diujicobakan dan digunakan secara langsung sebagai campuran bahan pakan tanpa mengekstraksi crude enzim terlebih dahulu sehingga akan lebih praktis ketika diaplikasikan.
DAFTAR PUSTAKA
Affandi R, Sjafei DS, Rahardjo MF dan Sulistiono. 1992. Fisiologi Ikan (Pencernaan). Bogor : Institut Pertanian Bogor, Pusat Antar Universitas Ilmu Hayat.
Affandi R dan Tang UM. 2002. Fisiologi Hewan Air. Universitas Riau. Riau
Agarwal. 2003. Role of Protein Dynamics in Reaction Rate Enhancement by Enzymes. American. Chemical 127(43):15248-56.
Anonim. 2007.Perkebunan Kelapa Sawit Indonesia Masih Berpotensi Dikembangkan. Warta Penelitian dan Perkembangan Pertanian. Vol 29 No. 2. Lembaga Riset Perkebunan Indonesia. Bogor.
Das KM and Tripathi SD. 1991. Studies on Digestive Enzymes of Grass Carp
Ctenopharyngodon idella (Val.), Aquaculture 92 : 11-21.
Effendi H. 2003. Telaah Kualitas Air. Kanisius. Jakarta
Furuichi M. 1988. Dietary vity of Carbohydrates. In: Fish Nutrition and Mariculture. Watanabe, T. Departement of Aquatic Biosciences Tokyo University of Fishes. Tokyo: p 1-77.
Halver JE. 1989. Fish Nutrition. Second Edition. Academy Press Inc, New York.
Hepher B. 1990. Nutrition of Pond Fishes. New York : Cambridge, Cambridge University Press.
Hertrampf J. W. and Piedad-Pascual. 2000. Handbok on Ingredients for Aquaculture Feeds. Kluwer Academic Publishers. Dordrecht. Boston.
Hernandez C, Olvera-Novoa MA, Hardy RW, Reyes AH, Gonzalez B. 2008. Complete replacement of fish meal by porcine and poultry by-product meals in practical diets for fingerling nile tilapia Oreochromis niloticus: digestibility and growth performance. Aquaculuture nutrition. 16;44-53. London.
Huisman EA. 1987. Principle of Fish Production. Departement of Fish Culture and Fisheries. Wageningen Agricultural University, The Netherlands.
Hungate R. 1966. The Rumen and its Microbes. London and New York : Academic Press.
Kamra DN. 2005. Special Section Microbial Diversity: Rumen microbial ecosystem. Current Science 89: 124-135.
Kawai S and Ikeda S. 1972. Studies on Digestive Enzymes of Fishes-II. Effect of Dietary Change on The Activities of Digestive Enzymes in Carp Intestine.
25
Khoironi. 1996. Kelangsungan Hidup dan Pertumbuhan Benih Ikan Nila Merah (Oreochromis sp.) pada Suhu Media 28±0,25°C dengan Salinitas 0, 10 dan 20 ppt. Skripsi. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Kuzmina W. 1996. Influence of Age on Digestive Enzyme Activity in Some Freshwater Teleostei. Aquaculture 148:25-37.
Lee SS, CH Kim, JK Ha, YH Moon, NJ Choi and KJ Cheng. 2002. Distribution and Activities of Hydrolytic Enzymes in the Rumen Compartements of Hereford Bulls Fed Alfalfa Based Diet. Asian-Aust. Animal Science 15: 1725-1731.
Lehninger AL. 1982. Dasar Dasar Biokimia Jilid 1. Maggy Thenawijaya, penerjemah. Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry
Lim HA, Ng WK, Lim SL, and Ibrahim CO. 2001. Contamination of Palm Kernel Meal with Aspergillus flavus affects its Nutritive Value In Pelleted Feed for Tilapia (Oreochromis mossambicus). Aquaculture Research 32 : 895-905.
Lovell T. 1989. Nutrition ang Feeding of Fish. Van Nostrand Reinhold. New York.
McCleary BV. 1988. Galatosidase from Lucerne and guar seed. Methods Enzymology, 160 : 627-632
Millamena OM, RM Coloso, and FP Pascual. 2002. Nutrition in Tropical Aquaculture. SEAFDEC. Tigbauanm Iloilo, Philippines. 221pp. p:127.
Moharrey A and TK Das. 2002. Correlation Between Microbial Enzyme Activities in The Rumen Fluid of Sheep Under Different Treatments. Repord. Nutr. Dev., 41:513-529.
National Research Council (NRC). 1993. Nutrient Requirements of Fish. Washington DC : National Academy of Sciences.
Ng WK and Chong KK. 2002. The Nutritive Value of Palm Kernel Meal and Effect of Enzyme Supplementation In practical Diets for Red Hybrid Tilapia (Oreochromis niloticus). Asian Fisheries Science 15 : 167-176.
Poedjiadi A. 1994. Dasar - Dasar Biokimia. Universitas Indonesia. Jakarta.
Popma T and LL. Lovshin. 1996. Worldwide Prospect For Commercial Production of Tilapia. Research and Development Series No. 41. Department of Fisheries and Allied Aquacultures Auburn University, Alabama.
Puls J and J Scuseill. 1993. In hemicellulose and hemicellulases Coughlan, M.P. and Hazlewood, G. P., eds. Portland Press, New York., pp. 1-27
Santiago CB and Lovell RT. 1988. Amino Acid Requirement for Growth of Nile Tilapia. Journal of Nutrition 118 : 1540-1546.
Steffens W. 1989. Principles of Fish Nutrition. Halsted Press: a Division of John Wiley & Sons. New York. 384 pp.
Stickney RR and Shumway SE. 1974. Occurrence of Cellulose Activity in The Stomachs. Journal of Fish Biology 6 : 779-790.
Stone David AJ. 2003. Dietary Carbohydrates Utilization by Fish. Reviews In Fisheries Science, Volume 11 (4) : 337-69.
Sundu, Burhanudin and J Dingle. 2003. Use of Enzyme to Improve The Nutritional Value of Palm Kernel Meal and Copra Meal. Proc. Quensland Poult. Sci. Symp. Australia. Vol: 11, (14) 1-15.
Takeuchi T. 1988. Laboratory Work Chemical Evaluation of Dietary Nutrients. Di dalam: Watanabe T (Editor). Fish Nutrition and Mariculture. Department of Aquatic Bioscience. Tokyo University of Fisheries. JICA.
Tillman AD., S Reksohadiprojo dan S Prawirokusumo. 1991. Ilmu Makanan Ternak Dasar. Gadjah Mada University Press. Fakultas Peternakan Universitas Gajah Mada. Yogyakarta
Trewavas E. 1982. Tilapia: Taxonomy and Specification. In: Pullin, R.S.V. and Lowe-Mc-Connel, R.H. (eds) The biology and culture of Tilapias. ICLARM, Manila, the Philippines, pp. 3-14.
Trinci APJ, DR Davies, K Gull, ML Lawrence, BB Nielsen, A Rickers and MK Theodorou. 1994. Anaerobic Fungi in Herbivorous Animals. Myco. Res 98: 129-152.
Turker H, AG Eversole, and DE Brune. 2003. Filtration of green algae and cyanobacteria by Nile tilapia, Oreochromis niloticus, in the Partitioned Aquaculture System. Aquaculture. 215: 93–101
Watanabe T. 1988. Nutrition and Mariculture. Department of Aquatic Bioscience. Tokyo University of Fisheries. JICA.
Watford JT. and Lam TJ. 1993. Development of Digestive Tract and Proteolitic Enzyme ACTIVITY in seabass (Lates calcarifer) Larvae and Juveniles.
Aquaculture 109 : 187-205.
Webster CD. and C Lim. 2002. Nutrien Requirement and Feeding of Finfish for Aquaculture. Aquaculture Research Center. Kentucky State University.
Yamada R. 1983. Pond Production Systems: Feeds and Feeding Practices in Warmwater Fish Ponds. In Lannan JE, RO. Smitherman dan G. Tchobanoglous (Editors): Principles and Practices of Pond Aquaculture, A State of The Art Review. Pond Dynamics/Aquaculture CRSP, Program Management Office, Oregon State University, Marine Science Center, Oregon. p: 117-144.
27
Lampiran 1. Hasil proksimat bahan baku (% bobot kering)
BAHAN Kadar Abu Serat
Kasar
Kadar Protein Kering **
Kadar Lemak
Kering ** BETN* Tepung Bungkil Kelapa
Sawit
4.88 20.79 14.64 11.12 41.08
DDGS 4,21 18,27 27,80 9,69 32.06
Tepung bungkil kedelai 8,32 8,8 44,56 8,81 19,03
PBM 21.52 2.81 54 11.80 5.03
Tepung pollard 3,50 7,16 10.43 13.91 55.45
Keterangan :
*BETN : Bahan Ekstrak Tanpa Nitrogen ** Kadar Air (%) :
Tepung Bungkil Kelapa Sawit : 7.48%
Tepung PBM : 4.84%
Tepung Bungkil Kedelai : 10,48%
Tepung Pollard : 9,44 %
DDGS : 7.97%.
Lampiran 2. Produksi perikanan budidaya menurut komoditas utama
(Satuan : Ton) No Rincian 2004 2005 2006 2007 2008 Kenaikan Rata-rata 2004-2008 2007-2008 1 Patin 23.962 32.575 31.490 36.755 52.470 23,02 42,76 2 Rumput Laut 410.570 910.636 1.374.462 1.728.475 1.944.800 52,75 12,52 3 Nila 07.116 148.249 169.390 206.904 220.900 23,96 6,76 4 Gurame 23.758 25.442 28.710 35.708 37.100 12,05 3,90 5 Bandeng 241.438 254.067 212.883 263.139 253.000 2,19 -3,85 6 Lele 51.271 69.386 77.272 91.735 108.200 20,84 17,95 7 Kerapu 6.552 6.493 4.021 8,035 8.800 17,59 9,52 8 Kekerangan 12.991 16.348 18.896 15.623 16.200 6,95 3,69 9 Ikan Mas 192.462 216.920 247.633 264.349 290.100 10,84 9,74 10 Udang 238.857 280.629 327.610 358.925 410.000 14,50 14,23 11 Kakap 4.663 2.935 2.183 4.418 4.200 8,69 -4,93 12 Kepiting 3.015 4.583 5.525 6.631 7.750 27,36 16,88 13 Lainnya 161.955 195.411 182.521 172.866 178.200 2,96 3,09 Jumlah 1.468.610 2.163.674 2.682.596 3.193.563 3.531.720 25,24 10,59 Sumber : Departemen Kelautan dan Perikanan (2009)
29
Lampiran 3. Prosedur analisis proksimat (Takeuchi, 1988)
Lampiran 3.1 Prosedur analisis kadar air
Kadar Air =
1
2
x
100
%
A
X
A
X
Lampiran 3.2 Prosedur analisis kadar serat kasar
Kadar serat kasar =
2
3
1
x
100
%
A
X
X
X
Cawan dan bahan dipanaskan selama 4 jam pada suhu 105-110 C, dinginkan dan timbang (X2) Panaskan cawan pada suhu 105-110 C selama 1 jam, dinginkan dalam desikator dan timbang (X1)
Timbang bahan 2-3 gram (A) lalu masukkan ke dalam cawan
Timbang bahan 0,5 gram (A) lalu masukkan ke dalam erlenmeyer 250
ml
Panaskan cawan porselin pada suhu 105-110 C
selama 1 jam lalu dinginkan
Lakukan penyaringan larutan bahan dengan pembilasan secara berurutan sebagai berikut :
1. 50 ml air panas 2. 50 ml H2SO4 0,3 N
3. 50 ml air panas 4. 25 ml Aceton
Masukkan kertas saring hasil penyaringan ke dalam cawan porselin
Panaskan dalam tanur pada suhu 600 C hingga berwarna putih, netralkan panas daam oven, dinginkan dan timbang (X3)
Panaskan pada suhu 105-110 C selama 1 jam, dinginkan dan timbang (X2)
Panaskan kertas saring dalam oven, dinginkan dan timbang (X1) Tambahkan 50 ml H2SO4 0,3 N
lalu panaskan di atas hotplate
Setelah 30 menit tambahkan 25 ml NaOH 1,5 N lalu panaskan kembali selama 30
menit
Pasang kertas saring pada labu Buchner yang telah terhubung dengan vacuum pump