LAPORAN
PRAKTIKUM DASAR TEKNIK KIMIA
SEMESTER GANJIL TAHUN AKADEMIK 2012/2013
DISUSUN OLEH :
GILANG RHEZA P
121100064
DEDY RADIYAN P
121100109
LABORATORIUM PRAKTIKUM DASAR TEKNIK KIMIA
PRODI TEKNIK KIMIA
FAKULTAS TEKNOLOGI INDUSTRI
UNIVERSITAS PEMBANGUNAN NASIONAL “VETERAN” YOGYAKARTA
2012
LEMBAR PENGESAHAN
LAPORAN PRAKTIKUM DASAR TEKNIK KIMIA ACARA
DIFUSIVITAS INTEGRAL
Laporan ini disusun untuk syarat Praktikum Dasar Teknik Kimia
Yogyakarta, Desember 2012 Disetujui
Asisten Pembimbing,
INTISARI
Salah satu bentuk transfer massa adalah difusi dengan mekanisme kecepatannya dipengaruhi oleh gaya dorong ( driving force ) yang disebabkan oleh gradien suhu, konsentrasi, tekanan dan kecepatan aliran. ercobaan ini bertujuan untuk mencari harga koefisien difusivitas campuran biner asam oksalat – air dengan variabel konsentrasi dan waktu. Asam oksalat dengan konsentrasi tertentu dimasukkan ke dalam pipa kapiler, kemudian pipa kapiler dimasukkan ke dalam bak air dan dialiri air. Pada selang waktu tertentu pipa kapiler tersebut diambil dan konsentrasi asam oksalat yang tersisa dianalisa dengan cara titrasi menggunakan NaOH yang telah distandarisasi untuk mengetahui konsentrasi asam oksalat setelah difusi.
Dari percobaan yang dilakukan pada Asam Oksalat X1, diperoleh harga koefisien difusivitas sebesar 0.0618 cm2/det dengan persamaan pendekatan secara linier Y= 0.110352x + 3.89 dengan persen kesalahan rata – rata sebesar 1.06 %. Sedangkan pada Asam Oksalat X2, diperoleh harga koefisien difusivitas sebesar
0.043925 cm2/det dengan persamaan pendekatan secara linier Y = 0.0282853x + 3.7417 dengan persen kesalahan rata – rata sebesar 5.86 %.
KATA PENGANTAR
Puji syukur penyusun panjatkan kehadirat Tuhan Yang Maha Kuasa yang telah memberikan rahmat dan hidayah-Nya, sehingga penyusun dapat menyelesaikan laporan praktikum dasar teknik kimia ini dengan baik.
Rangkaian ucapan terima kasih penyusun sampaikan kepada :
1. Ir. Gogot Haryono, M.T., selaku Kepala Laboratorium Dasar Teknik Kimia Fakultas Teknologi Industri Jurusan Teknik Kimia UPN “Veteran” Yogyakarta
2. Ir. Wasir Nuri, M.T., selaku asisten pembimbing yang telah banyak membantu selama pelaksanaan praktikum.
3. Rekan – rekan yang telah membantu, sehingga penyusunan laporan ini dapat diselesaikan dengan baik.
4. Petugas dan staf laboratorium yang telah memberikan bantuan yaitu dengan menyediakan alat-alat maupun sarana sehingga praktikum dapat berjalan dengan semestinya.
5. Serta berbagai pihak yang tidak dapat penyusun sebutkan satu persatu. Dalam penyusunan laporan ini, kami menyadari sepenuhnya bahwa membuat laporan yang baik dan akurat adalah hal yang cukup sulit. Oleh karena itu dalam penyusunan laporan ini Akhirnya penyusun berharap semoga laporan ini dapat memberikan manfaat serta mampu menambah wacana pengetahuan kita.
Yogyakarta, Desember 2012
DAFTAR ISI Halaman HALAMAN JUDUL ……….………..….. LEMBAR PENGESAHAN ……….………….. INTISARI ...………...………….... KATA PENGANTAR ...………...……….. DAFTAR ISI ………..………...……....………… DAFTAR TABEL ………..………….……….…………. DAFTAR GAMBAR ………..……….……...….. DAFTAR LAMBANG……….………....……….. i ii iii iv v vi vii BAB I PENDAHULUAN 1.1. Tujuan Percobaan …………...………..……… 1 1.2. Latar Belakang ……….…………..…….. 1 1.3. Tinjauan Pustaka ………….……….……..….. 1
BAB II PELAKSANAAN PERCOBAAN 2.1 Bahan-bahan ……….……..………... 8
2.2 Alat-alat ………..……….…..……… 8
2.3 Gambar Alat …..……….……….….…. 9
2.4 Cara Kerja ……….…………...….. 10
2.5 Diagram Alir Kerja ... 11
2.6 Analisis Perhitungan ... 14
BAB III HASIL PERCOBAAN DAN PEMBAHASAN 3.1 Hasil Percobaan ... 16 3.2 Pembahasan ... 18 BAB IV KESIMPULAN ... 22 DAFTAR PUSTAKA ... 23 LAMPIRAN……… 24
DAFTAR TABEL
Halaman Tabel 1. Volume pipa kapiler ……….….. 24 Tabel 2. Volume asam standart dan normalitas
NaOH ………..
24
Tabel 3.1 Volume NaOH sebelum dan setelah difusi untuk asam oksalat X1...
25
Tabel 3.2 Volume NaOH sebelum dan setelah difusi untuk
asam oksalat X2 ...
25
Tabel 4.1 Hubungan normalitas asam oksalat X1 sebelum dan
setelahdifusi dengan persentase
sisa asam oksalat ………...…..
26
Tabel 4.2 Hubungan normalitas asam oksalat X2 sebelum dan
setelah difusi dengan persentase
sisa asam oksalat ………...…
27
DAFTAR GAMBAR
Halaman
Gambar 1. Mekanisme terjadinya difusi dari sistem
biner ...
3
Gambar 2. Rangkaian alat difusivitas
integral…...…...………...…
9
Gambar 3. Grafik hubungan antara Log (t/L2) dan 2Log (100-E) untuk normalitas asam oksalat
X1...
18
Gambar 4. Grafik hubungan antara Log (t/L2) dan 2Log (100-E) untuk normalitas asam oksalat
X2 ...
DAFTAR LAMBANG
C = Konsentrasi (mol/L)
D = Koefisien Difusivitas (cm2/det) DA = Koefisien difusi A ( cm2/det)
DAB = Difusivitas massa komponen A melalui B (cm2/det)
dZ dCA
= Gradien konsentrasi A dalam arah Z (g/cm2)
dY dCA
= Gradien konsentrasi A dalam arah Y (g/cm2)
dY dCB
= Gradien konsentrasi Bdalam arah Z (g/cm2)
E = Prosen Asam Oksalat dalam pipa kapiler ( % ) JA, JB = Kecepatan transfer massa A, B (g/cm2.det)
JAZ = Fluks molar A dalam arah Z (g/cm2. det)
L = Panjang pipa kapiler (cm) N = Normalitas (N)
t = Waktu (detik) V = Volume cairan (ml)
BAB I PENDAHULUAN
1.1 Tujuan Percobaan
Menentukan koefisien difusivitas integral (DAB) yang merupakan
perbandingan luas dengan waktu dalam satuan cm2/detik dari larutan asam oksalat yang berbeda ke air.
1.2 Latar Belakang
Transfer massa banyak dijumpai dimana – mana, di dalam kehidupan sehari – hari, di dalam ilmu pengetahuan dan teknik. Misalnya yaitu, asap dari cerobong asap mengepul ke udara sekeliling dengan jalan difusi. Sama halnya dengan gula yang dimasukkan ke dalam air the akan melarut dan menyebar di dalam air teh dengan jalan difusi.
Dengan mengetahui difusivitas ( koefisien difusi ) suatu zat, maka akan dapat diketahui kemampuan penyebaran massa zat tersebut ke dalam fase yang lain atau dalam suatu fase. Semakin besar harga difusivitas suatu zat maka akan dapat dikatakan zat tersebut mempunyai kemampuan transfer massa yang besar pula. Dalam industri kimia koefisien difusi berperan dalam perhitungan waktu proses, yang selanjutnya digunakan dalam perancangan kapasitas alat.
1.3 Tinjauan Pustaka
Difusi adalah salah satu bentuk transfer massa yang disebabkan oleh adanya gaya dorong ( driving force ) yang timbul karena gerakan-gerakan molekul atau elemen fluida. Difusivitas cairan tergantung pada sifat – sifat komponen, temperatur serta konsentrasi dari cairan tersebut tetapi dalam pelaksanaan percobaan ini faktor temperatur diabaikan karena perbedaan temperatur yang kecil akan menyebabkan perbedaan densitas yang kecil, sehingga menyebabkan massa tidak berubah.
Transfer massa berlangsung secara difusi antara dua fase atau lebih, kebanyakan dalam operasi pemisahan konstituen dari campuran terdapat dua fase yang saling bersinggungan yang dinamakan sebagai kontak fase.
Dinamika sistem sangat berpengaruh terhadap kecepatan transfer massa. Sehingga dalam transfer massa dapat digolongkan menjadi dua, yaitu: 1. Difusi molekuler yaitu transfer massa yang disebabkan oleh gerakan
molekul secara acak dalam fluida yang diam atau bergerak secara laminer. Difusi molekuler juga merupakan difusi yang berhubungan dengan gerakan molekul-molekul melalui sesuatu zat yang disebabkan oleh tenaga panasnya. Kecepatan rata-rata molekul tergantung pada suhunya. Molekul bergerak melalui lintasan yang sangat zig-zag, sehingga kecepatan difusinya, yaitu jarak bersih yang ditempuh dalam satu arah, hanya merupakan bagian kecil dari panjang lintasan yang sesungguhnya. Sehingga difusi molekuler berjalan dengan sangat lambat.
2. Difusi olakan yaitu transfer massa yang terjadi apabila ada suatu fluida yang mengalir melalui sebuah permukaan dengan aliran turbulen, atau transfer massa yang dibantu oleh dinamika aliran.
Dalam aliran fluida yang turbulen, mekanisme proses alir yang meliputi gerakan olakan di inti turbulen tidaklah diketahui sepenuhnya. Sebaliknya mekanisme difusi molekuler, sekurang-kurangnya untuk gas, sudah diketahui dengan baik. Oleh karena itu sudah sewajarnya, apabila orang berusaha untuk melukiskan kecepatan transfer massa melalui tiga zone, yaitu zone laminer, buffer, dan turbulen seperti pada zone laminer itu sendiri.
Jika ditinjau sebuah gas yang mengalir secara turbulen melalui sebuah permukaan dalam keadaan tetap, dan pada saat yang sama dalam aliran tersebut terjadi difusi equimolar arus berlawanan. Komponen A mendifusi dari permukaan dinding ke badan utama gas, sedangkan komponen B mendifusi dari badan utama gas ke permukaan dinding.
Dalam mengamati aliran laminer dalam percobaan, prinsip – prinsip yang harus kita ketahui adalah partikel – partikel fluida mengalir secara teratur dan sejajar dengan sumbu tabung, hal ini dapat dilihat dari besarnya bilangan Reynold ( Re ) pada aliran fluida tersebut. Sedangkan sifat aliran turbulen partikel – partikel tidak lagi mengalir secara teratur ( Re > 2000 ).
( Brown, 1950)
Dalam teori kinetik yang disederhanakan sebuah molekul bergerak secara garis lurus dengan kecepatan yang seragam sampai bertumbukan dengan molekul lain, maka terjadi perubahan kecepatan baik besarnya maupun arahnya. Molekul bergerak secara zig – zag namun tetap menuju arah tertentu sesuai dengan perbedaan konsentrasi yang menyebabkannya. Karena gerakannya berliku – liku, menyebabkan waktu difusi menjadi lama dengan adanya penurunan tekanan jumlah tumbukan akan berkurang sehingga kecepatannya akan bertambah. Demikian pula dengan adanya penambahan temperatur akan menyebabkan gerakan molekul bertambah cepat.
Mekanisme terjadinya difusi dari sistem biner ( dua komponen ) yang berbeda konsentrasinya dapat digambarkan dengan gambar sebagai berikut :
CA K CB
Arah difusi dari A ke B pada awalnya mempunyai konsentrasi yang berbeda, karena adanya fluks massa yaitu banyaknya suatu komponen baik dalam satu satuan massa atau dalam satuan mol yang melintasi satu satuan luas permukaan dalam satu satuan waktu, maka konsentrasi massa A akan semakin berkurang dan konsentrasi B akan bertambah. Apabila proses difusi berlangsung dalam waktu yang relatif lama, maka konsentrasi A dan B akan seimbang atau CA = - CB.
Difusivitas adalah suatu faktor perbandingan yaitu difusivitas massa atau komponen yang mendifusi melalui komponen pendifusi. Zat yang terlarut akan mendifusi dari larutan yang konsentrasinya tinggi ke daerah yang konsentrasinya rendah. Kecenderungan zat untuk mendifusi dinyatakan dengan koefisien difusi. Koefisien difusi merupakan sifat spesifik sistem yang tergantung pada suhu, tekanan dan komposisi sistem. DAB adalah
koefisien difusi untuk komponen A yang mendifusi melalui B. Dari hubungan dasar difusi molekuler yaitu fluks molar relatif terhadap kecepatan rata-rata molar JA. Yang pertama kali ditemukan oleh Fick untuk sistem
isotermal dan isobarik.
Yang dimaksud dengan fluks sendiri adalah banyaknya suatu komponen, baik dalam satuan massa atau mol, yang melintasi satu satuan luas permukaan dalam satu satuan waktu. Fluks dapat ditetapkan berdasarkan sutatu koordinat yang tetap di dalam suatu ruangan, suatu koordinat yang bergerak dengan kecepatan rata-rata massa, atau suatu koordinat yang bergerak dengan kecepatan rata-rata molar.
Koefisien difusi dapat dijumpai pada persamaan hukum Fick :
JAx = - DAB
dx dCA
dimana :
JAx : Fluks molar A dalam arah X ( g/cm2.detik )
DAB : Difusivitas massa A melalui B ( cm2/detik )
dx dCA
: Gradien konsentrasi ( mol/Cm4)
Tanda negatif menunjukkan bahwa difusi terjadi dengan arah yang sejalan dengan penurunan konsentrasi.
Neraca Massa :
Massa Masuk – Massa Keluar – Massa Yang Bereaksi = Massa Akumulasi.
dx dC x A dx dC A D dx dC A D A x x A AB x A AB 0
Persamaan ( 2 ) dibagi dengan A dx, maka :
dx dC dx dC dx d D A A AB dx dC dx C d D A A AB 2 2 dx dC D dx C d A AB A 1 2 2
Bila dalam percobaan digunakan asam oksalat
Konsentrasi asam oksalat mula – mula dalam pipa kapiler adalah CAo
pada : x = x t = 0 CA = CAo
Konsentrasi asam oksalat dalam pipa kapiler pada waktu t = ~ : x = x
t = ~ CA = 0
Pada ujung pipa kapiler yang tertutup tidak ada transfer massa : x = 0
t = t
dx dCA
= 0
Konsentrasi asam oksalat pada ujung kapiler pada setiap saat : x = L
t = t CA = CA
……….. ( 2 )
Penyelesaian persamaan differensial dari persamaan ( 3 ) adalah :
2 2 2 1 4 ) 1 2 ( exp ) 2 ( ) 2 ( cos ) 1 2 ( ) 1 ( 4 L t D n L L n n C AB n n A dimana :CA = Konsentrasi asam oksalat (mol/L)
DAB = Difusivitas asam oksalat (g/cm2.detik)
t = Waktu difusi (menit) L = Panjang pipa (cm)
Menghitung asam oksalat setelah difusi : N = CA . V
dN = CA . dV + V . dCA ; CA = tetap
dN = CA . A . dx
N = CA . A . dx
Jumlah asam oksalat mula – mula dalam pipa kapiler adalah : No = CAo . A . L
Prosentase asam oksalat setelah difusi dalam pipa kapiler adalah :
E = 0 N N 100% E =
L A C dx C A Ao L A 0 100% E =
dx L C C L Ao A 0 100% ... ( 4 ) ... ( 5 )Persamaan ( 4 ) disubstitusikan ke persamaan ( 5 ), sehingga diperoleh : E =
2 2 2 2 2 2 4 ) 1 2 ( exp ) 1 2 ( 1 800 L t D n n AB n Untuk DAB yang tetap dan DAB . t/L2 kecil, maka persamaan ( 6 ) dapat
didekati dengan : E = 100 – 200 L t
D
AB 2 100 – E = 200 L tD
AB 2 log ( 100 – E ) = log ( 200
D
AB.π. ) + 2 1Log 2
L t
2 log ( 100 – E ) = 2 log ( 200
D
AB.π. ) + Log 2L t
...( 7 )
dengan :
E = Perbandingan asam oksalat yang tertinggal t = Waktu (menit)
L = Panjang pipa kapiler (cm) DAB = Koefisien difusi (g/cm2.detik)
Sehingga persamaan dapat dibuat grafik hubungan antara Log 2
L t
terhadap
Log ( 100-E ) dan juga persamaan diatas dapat diselesaikan dengan metode Least Square, dengan persamaan pendekatan secara garis lurus sebagai berikut : y = a + b x dimana : y = 2 log ( 100 – E ) a = 2 log ( 200
D
AB. ) x = Log 2 L t b = tan α = gradien = 1 ... ( 6 )BAB II
PELAKSANAAN PERCOBAAN
2.1 Bahan-bahan
Air dalam bak difusi sebagai media pendifusi, Larutan asam oksalat ( H2C2O4
) sebagai zat yang akan ditentukan koefisien difusivitasnya, Aquadest, Larutan NaOH, Indikator PP
2.2 Alat-alat
Tangki Penampung Air, Kran Pengatur, Bak Difusi, Pipa – pipa kapiler, Alat Suntik, Buret, Erlenmeyer, Corong, Stopwatch, Penggaris, Termometer.
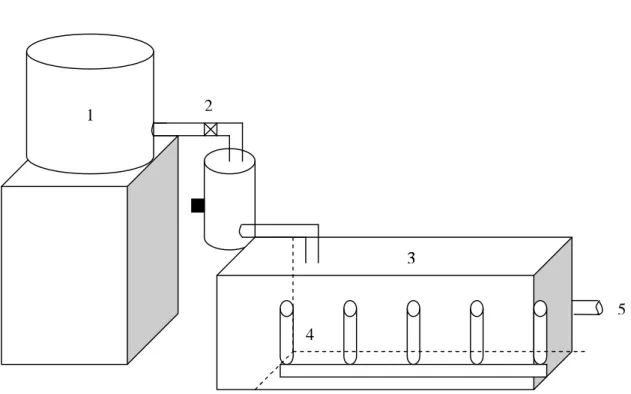
2.3 Gambar Rangkaian alat
Gambar 2. Rangkaian alat difusivitas integral
Keterangan gambar: 1. Bak penampung air 2. Kran pengatur aliran 3. Bak difusi 4. Pipa kapiler 5. Outlet 1 2 3 4 3 5
2.4 Cara Kerja
Menentukan Volume Pipa Kapiler, dengan mula-mula menimbang berat pipa kosong. Kemudian menimbang berat pipa yang telah diisi dengan aquades dan kemudian menghitung berat aquades. Setelah itu mengukur panjang pipa. Lalu mengukur suhu aquades serta mencari densitas aquades pada suhu terukur. Selanjutnya menghitung volume pipa.
Mengukur tinggi masing-masing pipa kapiler dari ujung atas yang terbuka sampai dasar pipa kapiler yang tertutup dimana masih dapat diisi aquadest.
Standarisasi larutan NaOH, pertama mengambil asam standart 10 ml larutan, kemudian memasukkannya dalam erlenmeyer dan menambahnya dengan indikator PP, setelah itu dititrasi dengan larutan NaOH. Kemudian mencatat volume NaOH yang digunakan untuk titrasi dan melakukanya sebanyak 3 kali.
Standarisasi asam oksalat, dengan mula-mula mengambil 10 ml larutan asam oksalat (X1) kemudian ditambahkan dengan indikator PP dan menitrasinya
dengan larutan NaOH. Kemudian mencatat volume NaOH yang digunakan sebagai volume NaOH sebelum difusi.
Melakukan hal yang sama untuk asam oksalat (X2). Percobaan difusi,
dengan mula-mula mengisi pipa kapiler dengan asam oksalat dan mengusahakan tidak ada gelembung udara. Lalu menyusun pipa kapiler dalam bak air dengan mengurutkan dari posisi tertinggi ke rendah, lalu mengalirkan air dan mengatur agar alirannya laminer. Pada saat air mencapai puncak pipa kapiler waktu dicatat sebagai t = 0 .kemudian mengambil pipa kapiler setiap selang waktu 5 menit secara berurutan.selanjutnya mengambil asam oksalat yang terdapat pada pipa kapiler dengan menggunakan jarum suntik, memasukkannya ke dalam erlenmeyer dan menambahkan aquades hingga volumenya mencapai 10 ml kemudian menambahkan indikator PP dan menitrasinya dengan NaOH. Setelah itu percobaan diulangi untuk asam oksalat X2
2.5 Diagram Alir Kerja
a. Menentukan volume pipa kapiler
Menimbang berat pipa kapiler kosong
Menimbang berat pipa yang diisi dengan aquades, sehingga bisa diperoleh berat aquades
Mengukur panjang pipa
Mengukur suhu aquades
Mencari densitas aquades berdasarkan suhu yang telah diukur
Menghitung volume pipa
Setelah menghitung volume pipa, dilanjutkan dengan mengukur tinggi masing-masing pipa kapiler
b. Standardisasi larutan NaOH
Mengambil asam standard 10 ml larutan
Memasukkan asam standard ke dalam erlenmeyer dan menambahkannya dengan indikator PP
Menitrasi larutan standard dengan larutan NaOH
Mencatat volume NaOH yang digunakan untuk titrasi
Melakukan percobaan sebanyak tiga kali
c. Standardisasi asam oksalat
Memasukkan sebanyak 10 ml larutan asam oksalat (X1) ke dalam
erlenmeyer dan menambahkannya dengan indikator PP
Menitrasi asam oksalat (X1) dengan larutan NaOH
Mencatat volume NaOH yang digunakan untuk titrasi
d. Percobaan difusi
Mengisi pipa kapiler dengan asam oksalat (X1) dan mengusahakan tidak ada
gelembung udara
Menyusun pipa kapiler dalam bak air dari posisi tertinggi ke yang terendah
Mengalirkan air dan mengatur agar alirannya laminer
Mencatat sebagai t = 0 pada saat air mencapai puncak pipa kapiler yang tertinggi
Mengambil pipa kapiler setiap selang waktu 5 menit secara berurutan dari yang tertinggi ke yang terendah
Mengambil asam oksalat (X1) dalam pipa kapiler dengan jarum suntik dan
memasukkannya ke dalam gelas ukur terlebih dahulu
Menambahkan aquades hingga volumenya mencapai 10 ml
Memasukkan asam oksalat (X1) yang telah dicampur dengan aquades, ke
dalam erlenmeyer
Menambahkan indikator PP, lalu menitrasinya dengan NaOH
2.6 Analisis Perhitungan
1. Volume pipa
m V
Dimana : V = Volume pipa (ml) m = Berat aquadest (gr) ρ = Densitas aquadest (gr/ml)
2. Menentukan Normalitas NaOH V1 x N1 = V2 x N2
Dimana : V1 = Volume asam standart (ml)
N1 = Normalitas asam standart (N)
V2 = Volume NaOH (ml)
N2 = Normalitas NaOH (N)
3. Menentukan Normalitas asam oksalat sebelum dan setelah difusi V1 x N1 = V2 x N2
Dimana : V1 = Volume asam standart (ml)
N1 = Normalitas asam standart (N)
V2 = Volume NaOH (ml)
N2 = Normalitas NaOH (N)
4. Menentukan prosentase asam oksalat
Untuk menentukan prosentase asam oksalat sisa (sebelum dan setelah difusi) dapat dilihat dari perbedaan normalitas asam oksalat sebelum dan setelah difusi.
E = 10000 No
N
Dimana : E = % sisa asam oksalat
N = Normalitas asam oksalat setelah difusi No= Normalitas asam oksalat sebelum difusi
5. Menentukan Difusivitas Dapat ditentukan dari rumus:
2 . . 200 100 L t D E AB
Yang dijabarkan menjadi:
) 200 ( 2 ) 100 ( 2 2 Log DAB L t Log E Log
Persamaan diatas dapat diselesaikan dengan metode Least Square: y = a + bx
dimana : y = 2 log (100-E)
x = log ( 2
L t
)
b = intercept = 2 log (200 DAB )
dengan : E = Perbandingan asam oksalat yang tertinggal t = waktu
L = panjang pipa kapiler DAB = koefisien difusivitas
6. Menentukan persen kesalahan
0 0 0 0 100 Ydata Yhitung Ydata Kesalahan
BAB III
HASIL PERCOBAAN DAN PEMBAHASAN
3.1 Hasil Percobaan3.1.1 Menentukan Volume Pipa Kapiler
- Suhu aquadest : 28 0C
- Densitas aquadest : 0.996233 g/ml
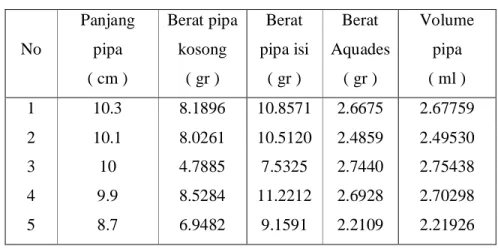
Tabel 1. Volume pipa kapiler
No Panjang pipa Berat pipa kosong Berat pipa isi Berat Aquades Volume pipa ( cm ) ( gr ) ( gr ) ( gr ) ( ml ) 1 10.3 8.1896 10.8571 2.6675 2.67759 2 10.1 8.0261 10.5120 2.4859 2.49530 3 10 4.7885 7.5325 2.7440 2.75438 4 9.9 8.5284 11.2212 2.6928 2.70298 5 8.7 6.9482 9.1591 2.2109 2.21926
3.1.2 Standarisasi Larutan NaOH
- Normalitas asam standard = 0.1 N
Tabel 2. Volume asam standart dan Normalitas NaOH
No
Volume
NaOH Volume Asam Normalitas ( ml ) Standard ( ml ) NaOH ( ml )
1 33.5 10 0.029851
2 32.8 10 0.030488
Volume NaOH rata-rata = 33.15 ml Normalitas NaOH rata-rata = 0.0301695 N
3.1.3 Standarisasi Asam Oksalat
Normalitas NaOH = 0.0301695 N Selang Waktu = 5 menit
Volume asam oksalat = volume pipa kapiler
Maka dengan asam oksalat normalitas X1 diperoleh:
Tabel 3.1. Volume NaOH sebelum dan setelah difusi Asam Oksalat (X1 )
No waktu Volume NaOH ( ml ) Volume Asam
Normalitas Asam Oksalat (menit) Sebelum Difusi Sesudah Difusi Oksalat ( ml ) Sebelum Difusi Sesudah Difusi 1 5 10.1 2.8 10 0.030471 0.008447 2 10 9.6 1.6 10 0.028963 0.004827 3 15 10.5 2.7 10 0.031678 0.008146 4 20 10.2 1.6 10 0.030773 0.004827 5 25 10.1 1.9 10 0.030471 0.005732
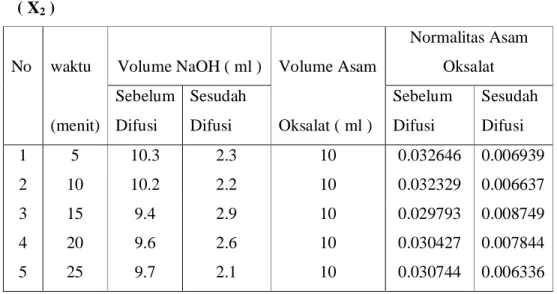
Tabel 3.2.Volume NaOH Sebelum dan setelah Difusi Asam Oksalat ( X2 )
No waktu Volume NaOH ( ml ) Volume Asam
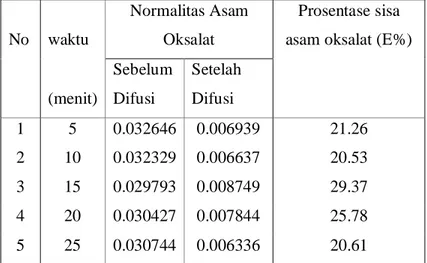
Normalitas Asam Oksalat (menit) Sebelum Difusi Sesudah Difusi Oksalat ( ml ) Sebelum Difusi Sesudah Difusi 1 5 10.3 2.3 10 0.032646 0.006939 2 10 10.2 2.2 10 0.032329 0.006637 3 15 9.4 2.9 10 0.029793 0.008749 4 20 9.6 2.6 10 0.030427 0.007844 5 25 9.7 2.1 10 0.030744 0.006336
3.2 Pembahasan
1. Harga normalitas dan harga koefisien difusifitas asam oksalat X1
Harga normalitas asam oksalat X1 sebelum dan setelah difusi dan harga
koefisien difusifitas asan oksalat X1 dapat diperoleh berdasarkan table 3.1
Maka diperoleh:
Tabel 4.1 Hubungan Normalitas asam oksalat X1 sebelum dan setelah difusi
dengan % sisa asam oksalat
No waktu
Normalitas Asam Oksalat
Prosentase sisa asam oksalat (E%) (menit) Sebelum Difusi Setelah Difusi 1 5 0.030471 0.008447 27.72 2 10 0.028963 0.004827 16.67 3 15 0.031678 0.008146 25.72 4 20 0.030773 0.004827 15.69 5 25 0.030471 0.005732 18.81
Dan dapat dibuat grafik seperti gambar 3.
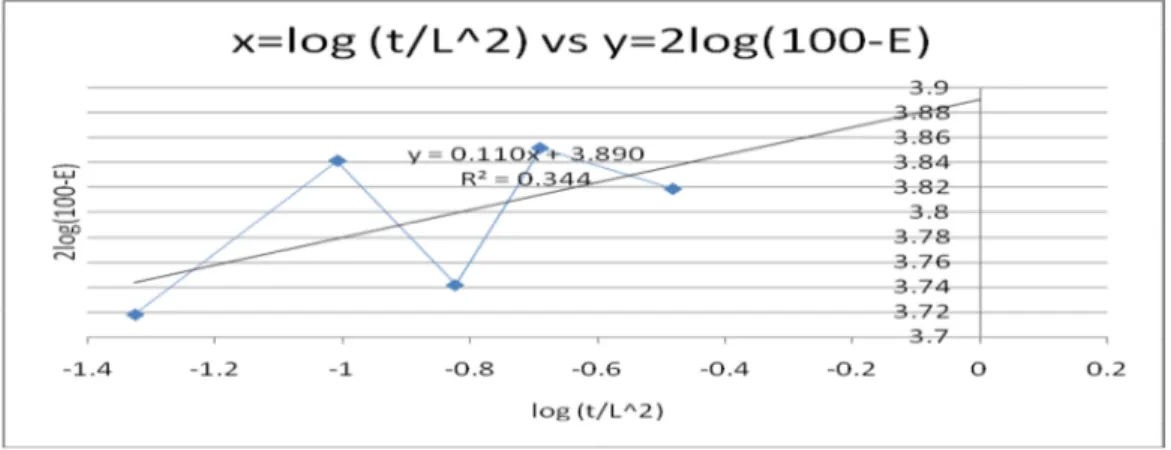
Gambar 3. Grafik hubungan antara Log (t/L2) dengan 2 Log (100-E) Asam Oksalat X1
Hubungan antara Log (t/L2) dengan 2 Log (100-E) pada gambar menghasilkan persamaan dengan metode least square Y = 0.110352x + 3.89 . Dari persamaan yang diperoleh dapat diketahui persen kesalahan sebesar 1.06 %, dan DAB sebesar
0.0618 cm2/det.
2. Harga normalitas dan harga koefisien difusivitas asam oksalat X2
Harga normalitas asam oksalat X2 sebelum dan setelah difusi dan harga
koefisien difusivitas asam oksalat X2 dapat diperoleh berdasarkan data Tabel
3.2. Maka diperoleh:
Tabel 4.2 Hubungan Normalitas asam oksalat X2 sebelum dan setelah
difusi dengan % sisa asam oksalat
No waktu
Normalitas Asam Oksalat
Prosentase sisa asam oksalat (E%)
(menit) Sebelum Difusi Setelah Difusi 1 5 0.032646 0.006939 21.26 2 10 0.032329 0.006637 20.53 3 15 0.029793 0.008749 29.37 4 20 0.030427 0.007844 25.78 5 25 0.030744 0.006336 20.61
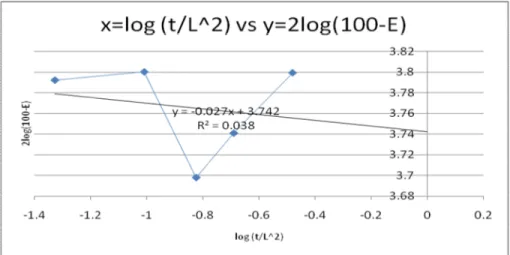
Gambar 4. Grafik hubungan antara Log (t/L2) dengan 2 Log (100-E) asam Oksalat X2
Hubungan antara Log (t/L2) dengan 2 Log (100-E) pada gambar menghasilkan persamaan dengan metode least square Y = 0.0282853x + 3.7417 . Dari persamaan yang diperoleh dapat diketahui persen kesalahan sebesar 5.86 %, dan DAB sebesar 0.043925 cm2/det.
Percobaan ini bertujuan untuk menentukan koefisien difusivitas cairan ( DAB ). Dimensi difusivitas cairan adalah panjang berpangkat dua dibagi
dengan waktu. Koefisien difusivitas tergantung pada temperatur, tekanan dan komposisi sistem. Pada percobaan yang telah dilakukan yang berbeda adalah konsentrasi sistemnya, sedangkan temperatur dan tekanan tetap. Dari percobaan didapat hubungan antara asam oksalat yang terdifusi dengan waktu difusi, sehingga dengan persamaan :
) 200 ( 2 ) 100 ( 2 2 Log DAB L t Log E Log
Didapat grafik berupa garis lurus yaitu grafik hubungan
antara2 (100 ) 2
L t VsLog E
Log dengan intercept = 2 log (200 DAB ). Perhitungan konstantanya dengan menggunakan metode Least Square.
Dari percobaan yang telah dilakukan serta dari perhitungan interceptnya maka harga koefisien difusivitas dapat dicari. Dari percobaan dapat diketahui bahwa konsentrasi yang besar, maka akan diperoleh harga difusivitas yang besar pula. Hal ini dapat dijelaskan sebagai berikut :
Pada konsentrasi yang lebih besar, maka fluks molar yang melintasi satu satuan luas permukaan dalam satu satuan waktu semakin besar, maka semakin besar pula kemampuan molekul itu untuk menyebar atau mendifusi.
Penggunaan aquades hingga volume larutan asam oksalat yang akan dititrasi sebanyak 10 ml dimaksudkan untuk mempermudah proses titrasi, karena sedikitnya asam oksalat yang dapat diambil dari pipa kapiler yang disebabkan oleh kecilnya volume pipa kapiler.
Dari percobaan diketahui pada konsentrasi yang lebih besar diperoleh harga difusivitas yang besar pula.
BAB IV KESIMPULAN
1. Larutan asam oksalat X1 diperoleh N rata-rata sebelum difusi = 0.030471 N
dan sesudah difusi = 0.006395934 N. Harga koefisien difusivitas sebesar 0.0618 cm2/det dengan metode Least Square : Y= 0.110352x + 3.89 dengan
persen kesalahan rata – rata sebesar 1.06 %.
2. Larutan asam oksalat X2 diperoleh N rata-rata sebelum difusi = 0.031188 N
dan sesudah difusi = 0.007301019 N. Harga koefisien difusivitas sebesar
0.0145 Cm2/det dengan metode Least Square : Y = 0.0282853x + 3.7417
dengan persen kesalahan rata – rata sebesar 5.86 %.
3. Persamaan yang didapat merupakan fungsi linier dari 2 Log (100 – E) vs Log (t/L2) yang menunjukkan semakin lama waktu operasi difusi maka akan semakin banyak asam oksalat yang terdifusi ke dalam air.
4. Pada percobaan kami semakin kecil normalitas suatu larutan atau senyawa maka koefisien difusivitasnya semakin kecil.
DAFTAR PUSTAKA
Hardjono. 1989. “ Diktat Kuliah Operasi Teknik Kimia II “. Hal 1 – 4. Fakultas Teknik Jurusan Teknik Kimia. UGM Yogyakarta.
LAMPIRAN
1. Menentukan volume pipa kapiler
Suhu aquadest : 28 oC
Densitas aquadest : 0.996233 g/ml
Berat aquadest = Berat pipa isi – berat pipa kosong = (10.8571-8.1896) gram
= 2.6675 gr
Volume pipa kapiler =
uadest DensitasAq
est BeratAquad
Volume pipa kapiler =
0.996233 2.6675
= 2.67759 ml
Dengan cara yang sama diperoleh Tabel 1 NO Panjang pipa (cm) Berat pipa
kosong (gr) Berat pipa isi (gr) Berat Aquadest (gr) Volume pipa (ml) 1 10.3 8.1896 10.8571 2.6675 2.67759 2 10.1 8.0261 10.5120 2.4859 2.49530 3 10 4.7885 7.5325 2.7440 2.75438 4 9.9 8.5284 11.2212 2.6928 2.70298 5 8.7 6.9482 9.1591 2.2109 2.21926
2. Menentukan Normalitas NaOH
Normalitas asam standart = 0.1 N Volume asa satandart = 10 ml V1 x N1 = V2 x N2 N2 =
V
N
V
2 1 1Dimana :
V1 = Volume asam standart (ml)
N1 = Normalitas asam standart (N)
V2 = Volume NaOH (ml)
N2 = Normalitas NaOH (N)
Pada sampel 1, jika volume NaOH = 33.5 ml
N2 = 5 . 33 1 . 0 10 x = 0.029851 N
Dengan cara yang sama diperoleh Tabel 2 NO V1 asam standart (ml) Normalitas
asam standart (N) V2 NaOH (ml) Normalitas NaOH (N) 1 10 0.1 33.5 0.029851 2 10 0.1 32.8 0.030488
Normalitas NaOH rata-rata = 0.0301695 N
3. Menentukan Normalitas asam oksalat sebelum difusi ( N2 )
Normalitas NaOH rata-rata = 0.0301695 N Volume NaOH rata-rata = 33.15 ml
V1 x N1 = V2 x N2
Dimana :
V1 = Volume NaOH sebelum difusi
N1 = Normalitas NaOH
V2 = Volume asam oksalat
N2 = Normalitas asam oksalat
Jika pada sampel 1 ,volume NaOH (V1 ) = 10.1 ml
Maka Normalitas asam oksalat pada sampel 1 adalah V1 x N1 = V2 x N2
10.1 x 0.0301695 = 10 x N2
N2 = 0.030471 N
Analog dengan cara perhitungan diatas, diperoleh Tabel 3.1 dan Tabel 3.2 NO Volume NaOH (ml) Volume asam oksalat X1
(ml) Normalitas asam oksalat X1 (N) 1 10.1 10 0.030471 2 9.6 10 0.028963 3 10.5 10 0.031678 4 10.2 10 0.030773 5 10.1 10 0.030471
NO Volume NaOH (ml) Volume asam oksalat X2
(ml) Normalitas asam oksalat X2 (N) 1 10.3 10 0.032646 2 10.2 10 0.032329 3 9.4 10 0.029793 4 9.6 10 0.030427 5 9.7 10 0.030744
4.Menentukan Normalitas asam oksalat sesudah difusi ( N2 )
Asam oksalat X1
NO Ukuran pipa Volume asam oksalat X1
(ml)
Volume NaOH setelah difusi (ml) 1 10.3 10 2.8 2 10.1 10 1.6 3 10 10 2.7 4 9.9 10 1.6 5 8.7 10 1.9
Perhitungan normalitas asam oksalat X1 sesudah difusi pada sampel 1
Normalitas NaOH rata-rata = 0.0301695 N Volume asam oksalat = 10 ml
Volume NaOH setelah difusi pada sampel 1 = 2.8 ml Dengan rumus :
V1 x N1 = V2 x N2
Dimana :
V1 = Volume NaOH sesudah difusi
N1 = Normalitas NaOH rata-rata
V2 = Volume asam oksalat
N2 = Normalitas asam oksalat
Maka Normalitas asam oksalat pada sampel 1 adalah V1 x N1 = V2 x N2
2.8 x 0.0301695 = 10 x N2
N2 = 0.008447 N
Analog dengan cara perhitungan diatas, diperoleh Tabel 3.1 dan Tabel 3.2 NO Ukuran pipa Volume asam oksalat X1 (ml) Volume NaOH setelah difusi (ml) Normalitas asam oksalat (N) 1 10.3 10 2.8 0.008447 2 10.1 10 1.6 0.004827 3 10 10 2.7 0.008146 4 9.9 10 1.6 0.004827 5 8.7 10 1.9 0.005732
Asam oksalat X2
NO Ukuran pipa Volume asam oksalat X1
(ml)
Volume NaOH setelah difusi (ml) 1 10.3 10 2.3 2 10.1 10 2.2 3 10 10 2.9 4 9.9 10 2.6 5 8.7 10 2.1
Perhitungan normalitas asam oksalat X2 sesudah difusi pada sampel 1
Normalitas NaOH rata-rata = 0.0301695 N Volume asam oksalat = 10 ml
Volume NaOH setelah difusi pada sampel 1 = 2.3 ml Dengan rumus :
V1 x N1 = V2 x N2
Dimana :
V1 = Volume NaOH sesudah difusi
N1 = Normalitas NaOH rata-rata
V2 = Volume asam oksalat
N2 = Normalitas asam oksalat
Maka Normalitas asam oksalat pada sampel 1 adalah V1 x N1 = V2 x N2
2.3 x 0.0301695 = 10 x N2
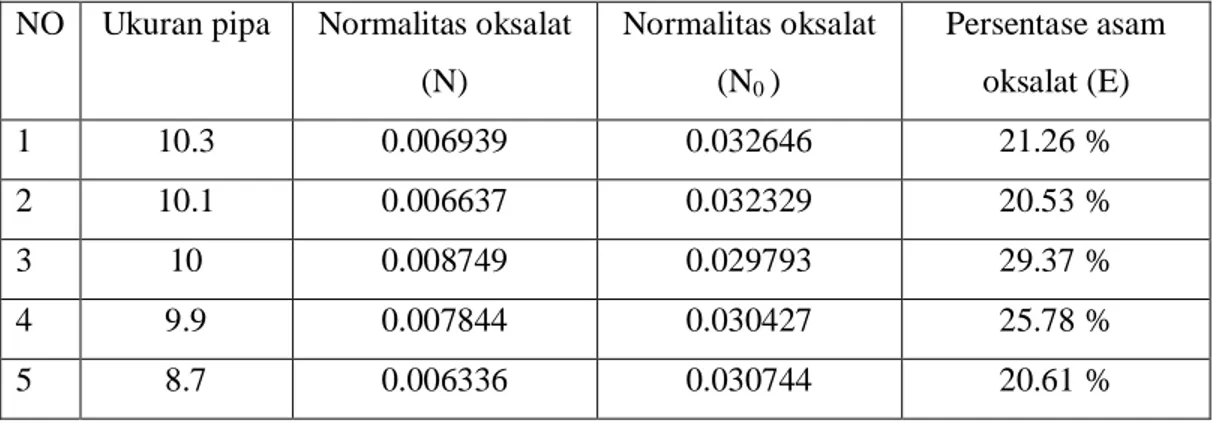
Analog dengan cara perhitungan diatas, diperoleh Tabel 3.1 dan Tabel 3.2 NO Ukuran pipa Volume asam oksalat X1 (ml) Volume NaOH setelah difusi (ml) Normalitas asam oksalat (N) 1 10.3 10 2.3 0.006939 2 10.1 10 2.2 0.006637 3 10 10 2.9 0.008749 4 9.9 10 2.6 0.007844 5 8.7 10 2.1 0.006336
5. Menentukan persentase asam oksalat sisa (E)
E
=N
N
x 100%
Dimana : E = % Sisa asam oksalat
N = Normalitas asam oksalat setelah difusi No = Normalitas asam oksalat sebelum difusi Untuk Asam Oksalat X1
Jika N = 0.008447 N No = 0.030471 N E = N 0.030471 N 0.008447 x 100% = 21.26 %
Dengan cara yang sama diperoleh Tabel 4.1 dan 4.2
NO Ukuran pipa Normalitas oksalat (N) Normalitas oksalat (N0 ) Persentase asam oksalat (E) 1 10.3 0.008447 0.030471 27.72 % 2 10.1 0.004827 0.028963 16.67 % 3 10 0.008146 0.031678 25.72 % 4 9.9 0.004827 0.030773 15.69 % 5 8.7 0.005732 0.030471 18.81 %
Untuk Asam Oksalat X2 Jika N = 0.006939 N No = 0.032646 N E = N 0.032646 N 0.006939 x 100% = %
Dengan cara yang sama diperoleh Tabel 4.1 dan 4.2
NO Ukuran pipa Normalitas oksalat (N) Normalitas oksalat (N0 ) Persentase asam oksalat (E) 1 10.3 0.006939 0.032646 21.26 % 2 10.1 0.006637 0.032329 20.53 % 3 10 0.008749 0.029793 29.37 % 4 9.9 0.007844 0.030427 25.78 % 5 8.7 0.006336 0.030744 20.61 %
6. Menentukan koefisien difusifitas ( DAB )
Untuk menghitung DAB asam oksalat normalitas X1 diperoleh data seperti :
Tabel 5.1 Harga Log 2
L t
Vs 2Log(100-E) asam oksalat X1
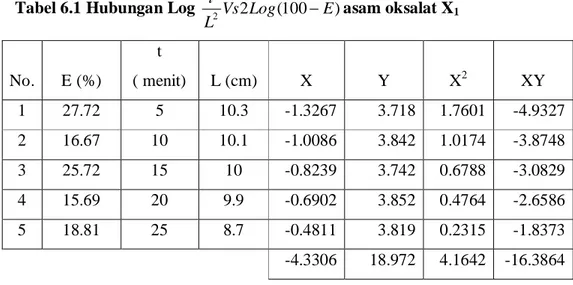
No. E % t(menit) L (cm) 2Log(100-E)
log 2 L t 1 27.72 5 10.3 3.718 -1.3267 2 16.67 10 10.1 3.842 -1.0086 3 25.72 15 10 3.742 -0.8239 4 15.69 20 9.9 3.852 -0.6902 5 18.81 25 8.7 3.819 -0.4811
Tabel 5.2 Harga Log 2 L
t
Vs 2Log(100-E) asam oksalat X2
No. E % t(menit) L (cm) 2Log(100-E)
log 2 L t 1 21.26 5 10.3 3.792 -1.3267 2 20.53 10 10.1 3.800 -1.0086 3 29.37 15 10 3.698 -0.8239 4 25.78 20 9.9 3.741 -0.6902 5 20.61 25 8.7 3.800 -0.4811
Dari data Tabel 5.1 dan 5.2 dan rumus dibawah ini :
E = 100 – 200 L π.t
D
AB 2 . 100 – E = 200 L π.tD
AB 2 .log ( 100 – E ) = log ( 200
D
AB.π. ) + 2 1 logL
t 22 log ( 100 – E ) = 2 log ( 200
D
AB.π. ) + logL
t 2 Y = a + b X Y = 2 log ( 100 – E ) X = logL
t 2 a = 2 log ( 200D
AB.π. ) Untuk X1 : a = 3.89 2 log ( 200 ) =D
AB.π. 3.89log ( 200 ) = 1.945 ( ) = 0.44052 DAB π = 0.194058 DAB = 0.0618 cm2/det Untuk X2 : DAB = 0.043925 cm2/det
7. Mencari persamaan garis dengan Metode Least Square:
2 . . 200 100 L t D E AB ) 200 ( 2 ) 100 ( 2 2 Log DAB L t Log E Log Y = a + b X
Dimana : Y = 2 log (100-E)
X = log ( 2 L t ) a = intercept = 2 log (200 DAB )
D
AB.π.D
AB.π.Tabel 6.1 Hubungan Log 2Vs2Log(100 E) L t asam oksalat X1 No. E (%) t ( menit) L (cm) X Y X2 XY 1 27.72 5 10.3 -1.3267 3.718 1.7601 -4.9327 2 16.67 10 10.1 -1.0086 3.842 1.0174 -3.8748 3 25.72 15 10 -0.8239 3.742 0.6788 -3.0829 4 15.69 20 9.9 -0.6902 3.852 0.4764 -2.6586 5 18.81 25 8.7 -0.4811 3.819 0.2315 -1.8373 -4.3306 18.972 4.1642 -16.3864
Dengan metode Least Square diperoleh :
2 2 x x n y x xy n b
2 4.3306 -4.1642 5 18.972 4.3306 -16.3864 -5 b = 2.8534 n x b y a
5 4.3306 -8534 . 2 18.972 a = 5.1464Sehingga diperoleh persamaan garis : Y = a + b X
Y = 5.1464 + 2.8534 X
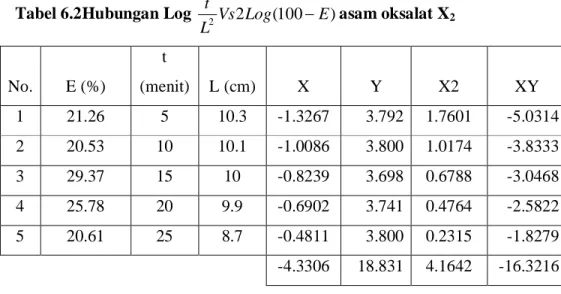
Tabel 6.2Hubungan Log 2Vs2Log(100 E) L t asam oksalat X2 No. E (%) t (menit) L (cm) X Y X2 XY 1 21.26 5 10.3 -1.3267 3.792 1.7601 -5.0314 2 20.53 10 10.1 -1.0086 3.800 1.0174 -3.8333 3 29.37 15 10 -0.8239 3.698 0.6788 -3.0468 4 25.78 20 9.9 -0.6902 3.741 0.4764 -2.5822 5 20.61 25 8.7 -0.4811 3.800 0.2315 -1.8279 -4.3306 18.831 4.1642 -16.3216
Dengan Metode Least Square diperoleh : a = 3.2502
b = 0.9964
Sehingga diperoleh persamaan garis : Y = 3.2502 + 0.9964x
8. Mencari Persen Kesalahan
Dari persamaan Y = 5.1464 + 2.8534 X Dapat diperoleh persen kesalahan
0 0 0 0 100 Ydata Yhitung Ydata Kesalahan
Tabel 7.1 % Kesalahan pada persamaan asam oksalat X1
% kesalahan rata-rata = 6.2784 % No X Y Yhit % Kesalahan 1 -1.3267 3.718 3.3732 9.27 2 -1.0086 3.842 3.6913 3.91 3 -0.8239 3.742 3.8760 3.59 4 -0.6902 3.852 4.0097 4.10 5 -0.4811 3.819 4.2188 10.47 Σ -4.3306 18.972 Rata-rata 6.27
Dari persamaan Y = 3.2502 + 0.9964x Dapat diperoleh persen kesalahan
0 0 0 0 100 Ydata Yhitung Ydata Kesalahan
Tabel 7.2 % Kesalahan pada persamaan asam oksalat X2
No X Y Yhit % Kesalahan 1 -1.3267 3.792 3.3512 11.63 2 -1.0086 3.800 3.6692 3.45 3 -0.8239 3.698 3.8540 4.22 4 -0.6902 3.741 3.9876 6.59 5 -0.4811 3.800 4.1968 10.46 Σ -4.3306 18.831 Rata-rata 7.27 % kesalahan rata-rata = 7.27 %
HASIL DISKUSI
1. Jelaskan tentang aliran laminar dan turbulen?
Aliran laminar merupakan aliran fluida yang tidak terjadi olakan dan sifatnya mendekati linera dan biasanya akibat tidak terjadinya perubahan penampang yang tiba-tiba.
Aliran turbulen merupakan aliran fluida yang terjadi olakan atau gumpalan ataupun gelombang saat mengalir. Penyebab terjadinya turbulence sangat banyak. Namun yang pasti ketika fluida mengalir dari suatu penampang 1 ke penampang yang lebih kecil maka besar kemungkinan akan terjadi turbulence.
2. Mengapa pada gambar grafik yang didapat berbentuk seperti itu dan apa itu R?
Karena skala yang digunakan pada gambar kecil maka grafik yang didapat terlihat zig-zag, dan mungkin bila skala diperkecil skala gambar mungkin grafik dapat terlihat menjadi semakin naik. Kemudian R didalam grafik berarti persen kesalahan grafik terhadap garis linear. Karena R semakin mendekati 1 maka percobaan dinyatakan mendekati benar.
3. Kenapa pipa tingginya berbeda-beda dan kenapa saat menjalankan waktu saat pipa tertinggi tercelup air?
Karena tinggi pipa tersebut menyatakan perbedaan terjadinya difusi pada tiap tinggi dimana saat percobaan dimulai.
Pipa tertinggi berposisi pada t=0,karena akan menjadi awal difusi antara cairan bak dengan larutan yang berada didalam pipa.