PENAPISAN DETEKSI PCR ACC DEAMINASE DAN
ANALISIS PRODUKSI AUKSIN RHIZOSFER TANAMAN
PADI DAERAH PESISIR
ANNISYIA ZARINA PUTRI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA* Dengan ini saya menyatakan bahwa skripsi Penapisan Deteksi PCR ACC
Deaminase dan Analisis Produksi Auksin Rhizosfer Tanaman Padi Daerah Pesisiradalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Annisyia Zarina Putri
v
ABSTRAK
ANNISYIA ZARINA PUTRI. Penapisan Deteksi PCR ACC Deaminase dan Analisis Produksi Auksin Rhizosfer Tanaman Padi Daerah Pesisir. Dibimbing oleh DJAROT SASONGKO dan DWI NINGSIH SUSILOWATI.
Cekaman salinitas dan kekeringan mengakibatkan produksi etilen. Bakteri rhizosfer menekan produksi etilen melalui aktivitas 1-aminocycopropane-1-carboxylate (ACC) deaminase. Penelitian ini bertujuan menyeleksi sejumlah isolat rhizobakteria untuk mendeteksi keragaman gen acdS dan mampu menghasilkan fitohormon auksin (asam indol-3-asetat). Pada penelitian ini dilakukan pengujian bakteri rhizosfer dari lahan sawah daerah pesisir. Metode yang digunakan adalah uji aktivitas acc deaminase dilakukan pada media Dworkin – Foster (DF) dan PCR gen acdS menggunakan primer spesifik ACC serta analisis kuantitatif produksi auksin (IAA). Dari 47 isolat bakteri didapatkan 8 isolat yang positif yang memiliki aktivitas acdS. Hasil positif ditunjukkan dengan adanya amplikon sebesar 1080 bp Analisis kuantitatif auksin didapatkan hasil tertinggi sebesar 10,6 ppm. Hasil membuktikan bahwa terdapat beberapa bakteri asal sawah pesisir mempunyai aktivitas acc deaminase.
Kata kunci: bakteri rhizosfer, ACC deaminase, auxin, gen acdS
ABSTRACT
ANNISYIA ZARINA PUTRI. Screening of Coastal Rice Plant Rhizosphere, Detection of ACC-Deaminase (Acds) Gen and Analysis of Auxin. Supervised by DJAROT SASONGKO and DWI NINGSIH SUSILOWATI.
Salinity and drought stress results in the production of ethylene. Rhizosphere bacterial activity suppresses the production of ethylene through the activity of 1-aminocycopropane-1-carboxylate (ACC) deaminase. In this study, a sampel of rhizosphere bacteria from coastal rice plant area was tested. The method used was acc deaminase activity test performed on Dworkin - Foster (DF) media and PCR acdS gene using specific primers of ACC and a quantitative analysis of the production of auxin (IAA). Of 47 isolates obtained, 8 were positively have acdS activity. The positive result was indicated by the presence of 1080 bp amplicon. Quantitative analysis showed the highest yield of 10.6 ppm of auxin. The results prove that there are some bacteria originated from coastal rice plant area which have acc deaminase activity.
vii
PENAPISAN DETEKSI PCR ACC DEAMINASE DAN
ANALISIS PRODUKSI AUKSIN RHIZOSFER TANAMAN
PADI DAERAH PESISIR
ANNISYIA ZARINA PUTRI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Skripsi : Penapisan Deteksi PCR ACC Deaminase dan Analisis Produksi Auksin Rhizosfer Tanaman Padi Daerah Pesisir
Nama : Annisyia Zarina Putri NIM : G84100069
Disetujui oleh
Dr Djarot Sasongko Hami Seno, MS Pembimbing I
Dwi N. Susilowati, STP MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika MAppSc Ketua Departemen
PRAKATA
Puji dan syukur kepada Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Penapisan Deteksi PCR ACC Deaminase dan Analisis Produkisi Auksin Rhizosfer Tanaman Padi Daerah Pesisir. Penulis mengucapkan terima kasih kepada bapak Dr Djarot Sasongko Hami Seno, MS dan Ibu Dwi N. Susilowati, S.TP, M.Si selaku dosen pembimbing yang telah memberikan saran, kritik, dan bimbingan selama penyusunan karya ilmiah ini. Terimakasih penulis ucapkan kepada kedua orang tua yang telah memberikan dukungan dan kasih sayang, kepada sahabat dan teman-teman yang selalu memberikan semangat.
Penulis menyadari masih banyak terdapat kekurangan dalam penyusunan usulan penelitian ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk memperbaiki penulisan selanjutnya. Semoga penelitian ini dapat bermanfaat baik bagi penulis maupun pembaca.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL ix DAFTAR GAMBAR DAFTAR LAMPIRAN xi PENDAHULUAN 1 METODE 2Bahan dan Alat 2
Metode Penelitian 2
HASIL 6
Uji Aktivitas acdS pada Media DF. 6
Uji Produksi Auksin 6
Amplikon PCR gen acdS. 7
Analisis Pohon Filogenetik 7
PEMBAHASAN 10
Uji Aktivitas acdS pada Media DF 10
Uji Produksi Auksin 11
Amplifikasi PCR gen acdS. 11
Sekuensing DNA Isolat Bakteri dan Analisis Filogenetik 12
SIMPULAN DAN SARAN 13
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR TABEL
1 Hasil analisis kuantitatif aktivitas AIA 10
2 Hasil analisis sekuens DNA dengan menggunakan program blast N 11
DAFTAR GAMBAR
1 Hasil Uji ACC Deaminase 6
2 Amplikon PCR 7
3 Produk DNA PCR 16S RNA 8
4 Gambar Pohon Filogenetik 9
DAFTAR LAMPIRAN
1 Isolat-isolat bakteri rhizosfer yang digunakan dalam penelitian 17
PENDAHULUAN
Pemanasan global berdampak pada berbagai aspek, menyebabkan kenaikan muka air laut, baik akibat bertambahnya volume air laut karena naiknya suhu air laut, maupun mencairnya es di kutub utara dan selatan. Potensi kenaikan muka air laut bervariasi dari 60cm sampai 100cm, sampai dengan tahun 2010 (BAPPENAS 2010). Adapun tiga faktor utama yang terkait dengan perubahan iklim global, yang berdampak terhadap sektor pertanian adalah: 1) perubahan pola hujan, 2) meningkatnya kejadian iklim ekstrim (banjir dan kekeringan), dan 3) peningkatan suhu udara dan permukaan air laut (Salinger 2005).
Kenaikan muka air laut berdampak serius pada sektor pertanian seperti penyempitan lahan pertanian di pesisir pantai misalnya Jawa, Bali, Sumatera Utara, Lampung, dan Kalimantan, kerusakan infrastruktur pertanian, dan peningkatan salinitas lahan yang mempengaruhi perkembangan dan produktivitas tanaman (Las 2007). Wilayah pesisir merupakan wilayah yang sangat potensial untuk perkembangan ekonomi, namun sangat rentan terhadap kenaikan muka air laut. Lahan rawa pasang surut yang merupakan lahan yang terletak di daerah pesisir merupakan daerah yang sangat rentan dengan berbagai kondisi yang marginal (Suwignyo 2003). Peningkatan salinitas lahan sawah di daerah pesisir disebabkan oleh akumulasi garam sebagai akibat adanya pergerakan dan penguapan air dari muka air tanah sehingga garam tertinggal di tanah karena pencucian unsur hara oleh air yang rendah (Grattan 2005).
Rhizosfer merupakan bagian tanah yang berada di sekitar perakaran tanaman dan berperan sebagai pertahanan luar bagi tanaman terhadap serangan patogen akar. Populasi mikroorganisme di rhizosfer biasanya lebih banyak dan beragam dibandingkan pada tanah bukan rhizosfer (Lynch 1990; Carlile et al. 2001). Menurut Foster (1985) dalam Hornby (1990), beberapa mikroorganisme rizosfer berperan penting dalam siklus hara dan proses pembentukan tanah, pertumbuhan tanaman, mempengaruhi aktivitas mikroorganisme serta sebagai pengendali hayati terhadap patogen akar. Rhizobakteri merupakan bakteri yang hidup di daerah perakaran dan mengkolonisasi sistem perakaran tanaman. Sejumlah bakteri ini mampu mengendalikan penyakit dan pemacu pertumbuhan tanaman (Plant Growth Promoting Rhizobacteria) sehingga dapat digunakan sebagai inokulan biofertilizer (Kennedy et al.2004). Secara langsung, PGPR (Plant Growth Promoting Rhizobacteria) merangsang pertumbuhan tanaman dengan menghasilkan hormon pertumbuhan, vitamin dan berbagai asam organik serta meningkatkan asupan nutrien bagitanaman. Beberapa jenis rizobakteri yang saat ini banyak dikembangkan sebagai agen biofertilazer diantaranya adalah spesies Pseudomonas, Bacillus, Streptomyces, Azospirillum, Agrobacterium,
Rhizobium, Alkaligenes, Burkholderia, Beijerinkia.
Pemanfaatan mikroba pengendali cekaman lingkungan ekstrim seperti salinitas tinggi, khususnya bakteri penghasil enzim 1-aminosiklopropona-1-carboxylate (ACC) deaminase (E.C.4.1.99.4), belum pernah dilaporkan. ACC deaminase adalah enzim sitoplasma yang diproduksi beberapa bakteri tanah untuk mendegradasi ACC (prekursor hormon etilen pada tanaman) menjadi amonia dan α-ketobutirat yang merupakan sumber N dan karbon bagi bakteri (Jacobsen et al. 1995). Degradasi ACC oleh enzim ACC deaminase akhirnya akan mengurangi biosintesis etilen dalam tubuh tanaman dan kerusakan tanaman dapat direduksi
2
(Grichko & Glick 2001). Dari hasil penelitian di negara-negara seperti Canada, USA, India, dan Korea pada tanaman hortikultura, gandum, dan kacang-kacangan, penggunaan bakteri ACC deaminase mampu meningkatkan kebugaran tanaman dan meningkatkan daya tahan tanaman terhadap cekaman lingkungan ekstrim dan serangan patogen (Glick et al.2007).
Indonesia memiliki prospek yang menjanjikan untuk mengurangi kehilangan produksi padi pada sawah-sawah berkadar garam tinggi seperti di daerah pasir pantai Pulau Jawa. Hasil penelitian penggunaan bakteri ACC deaminase asal indonesia pada tanaman kedelai sudah terbukti mampu meningkatkan pertumbuhan bibit kedelai dan memiliki prospek untuk dikembangkan pada lahan pertanian dengan tingkat cekaman lingkungan ekstrim (Husen et al.2008; 2009). Rhizobakteri dapat berfungsi sebagai pemacu pertumbuhan dengan mensintesis dan mengatur konsentrasi berbagai zat pengatur tumbuh (fitohormon) seperti asam indol asetat (AIA), giberelin, sitokinin, dan etilen dalam lingkungan akar, sebagai penyedia hara dengan menambat nitrogen dari udara secara asimbiosis dan melarutkan hara fosfat yang terkait dalam tanah, dan sebagai pengendali patogen yang berasal dari tanah (Cattelan et al.1999; Kloepper 1993).
Keragaman gen penyandi acdS tanaman sawah daerah pesisir belum pernah dilaporkan, oleh karena itu penelitian ini bertujuan menyeleksi sejumlah isolat rhizobakteria untuk mendeteksi keragaman gen acdS dan mampu menghasilkan fitohormon auksin (asam indol-3-asetat). Penggalian potensi isolat rhizobakteria ini diharapkan mampu memberikan kontribusi bagi pertanian di lahan pesisir guna mengantisipasi dampak meningkatnya muka air laut akibat perubahan iklim.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah isolat bakteri rhizosfer berasal dari lahan sawah di pesisir jawa dengan jumlah 47 (kode-kode isolat dirujuk pada lampiran 1) koleksi Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-BIOGEN) Bogor, komponen PCR: GoTaq DNA polimerase, loading dye 6x, nuclease free water, akuades, penanda ukuran 1kb, Kit isolasi DNA wizard DNA genom purification kitt. Primer asds, agarose, buffer TAE, Kit untuk kloning.
Peralatan yang digunakan pada penelitian ini adalah mesin PCR, inkubator, lemari es, microwave, lamina Air Flow, autoklaf, waterbath, shacker, sentrifus, elektroforesis agarosa, UV-Translluminator, dan peralatan lainnya yang biasa digunakan di laboratorium.
Metode Penelitian
Peremajaan dan Pemurnian Isolat Bakteri (Ding et al. 2005). Peremajaan dan pemurnian isolat bakteri dilakukan dengan cara 1 ose koloni bakteri diambil dari kultur stok dan ditumbuhkan pada media SEA (soil extract
3 7 hari. Isolasi DNA. Isolasi DNA genom bakteri dilakukan dengan menggunakan Promega wizard genomic DNA purification KIT. Kultur bakteri yang telah ditumbuhkan pada media LB dipindahkan ke tabung mikro sebanyak 1.5 mL, kemudian disentrifus selama 2 menit pada kecepatan 14000 rpm. Pelet yang terbentuk diambil dan supernatan dibuang. Pada pellet isolat bakteri gram negatif langsung dilakukan proses lisis sel sedangkan untuk pelet bakteri gram positif terlebih dahulu diresuspensikan dengan EDTA 50 mM sebanyak 480µl. Selanjutnya ditambahkan lisozim sebanyak 120 µL dan diinkubasi pada suhu 37°C selama 45 menit. Sampel disentrifus kembali pada kecepatan 14000 rpm selama 2 menit. Pelet yang terbentuk diambil dan supernatan dibuang.Tahap selanjutnya adalah lisis sel bakteri. Lisis sel bakteri dilakukan dengan cara ditambahkan nuclei lysis solution sebanyak 600 µl ke dalam sampel dan diinkubasi pada suhu 80°C selama 5 menit. RNase ditambahkan sebanyak 3 µl ke dalam sampel dan diinkubasi pada suhu 37°C selama 45 menit.
Tahap selanjutnya adalah proses penghilangan protein. Protein dihilangkan dengan caramenambahkan 200 µl protein precipitation solution, divorteks kemudian diinkubasi pada suhu es selama 5 menit. Setelah diinkubasi, sampel disentrifus pada kecepatan 14000 rpm selama 3 menit. Supernatan yang terbentuk diambil dan dipindahkan ke dalam tabung mikro baru dan ditambahkan 600 µl isopropanol pada suhu ruang kemudian divorteks. Sampel disentrifus kembali pada kecepatan 14000 rpm selama 2 menit, supernatan dibuang sedangkan pelet yang terbentuk ditambahkan etanol 70% sebanyak 600 µl. Sampel disentrifus kembali pada kecepatan 14000 rpm selama 2 menit. Buang supernatan, pelet dikeringkan dengan cara diangin-anginkan di udara selama 10-15 menit. Tahap terakhir sampel ditambahkan 100 µl rehydration solution dan diinkubasi pada suhu 65°C selama 1 jam.
Uji Aktivitas acdS pada Media DF. Media yang digunakan adalah media garam minimal Dworkin-Foster (DF) (Dworkin & Foster 1958) yang diperkaya dengan substrat 1-aminosiklopropona-1-carboxylate (ACC) atau ammoniumsulfat sebagai sumber nitrogen mengikuti prosedur Glick et al. (1995).
Komposisi media DF adalah 4g KH2PO4;6 g Na2HPO4; 0,2 g
MgSO4.7H2O; 1 mg FeSO4.7H2O; 10 μg H3BO3; 10 μg MnSO4; 70 μg ZnSO4; 50
μg CuSO4; 10 μg MoO3; 2 g glukosa; 2 g asam glukonat, 2 g asam sitrat; 12 g
agar (untuk media padat) yang dilarutkan dalam 1000 ml akuades. Jumlah ACC atau amonium sulfat yang ditambahkan ke dalam media DF, masing-masing adalah 0.3033 g ACC atau 2 g amonium sulfat. Kecuali bahan ACC yang tidak tahan panas (heat-labile), semua bahan media disterilisasi dengan autoklaf selama 15 menit pada suhu 121oC dan tekanan 0,1 Mpa. Bahan ACC disterilisasi dengan membran filter berukuran 0.2 μm sebelum ditambahkan (dicampurkan) ke dalam bahan yang sudah disterilkan.
Biakan isolat ditumbuhkan dalam media Trypticase Soy Broth (TSB) selama 24 jam. Sel selanjutnya dipanen dengan cara sentrifugasi dengan kecepatan 8000 rpm selama 5 menit. Pelet sel dibilas dengan 1.5 µl air steril dan selanjutnya diinokulasikan ke media cair dan padat DF, DF + ACC, dan DF + amonium sulfat, masing-masing sebanyak 1 ml (1 x 109 sel/ml). Pertumbuhan isolat pada media cair dimonitor tiap 6 jam selama 48 jam dengan mengukur kerapatan optik biakan pada panjang gelombang 600 nm mengadaptasi metode yang dijelaskan oleh Wang et al. (2000). Nilai kerapatan optik 0,05 atau lebih,
4
khususnya isolat yang ditumbuhan pada media DF + ACC, mengindikasikan bahwa isolat memiliki aktivitas enzim ACC deaminase. Isolat yang mampu tumbuh pada salah satu media DF + ACC atau DF + amonium sulfat menjadi indikasi adanya aktivitas enzim ACC deaminase. Penggunaan media DF saja (tanpa ACC maupun amonium sulfat) digunakan sebagai kontrol untuk mengetahui apakah isolat yang digunakan tergolong bakteri diazotrof yang mampu mendapatkan sumber N dengan menambat N2 dari udara.
Uji Produksi Auksin. Analisis kuantitatif AIA dilakukan dengan metode Gupta et al. (2012). Sebanyak satu ose koloni bakteri yang telah diremajakan dimasukkan dalam media NB M-26, kemudian diinkubasi di atas orbital shaker dengan kecepatan 150 rpm pada suhu ruang selama 24 jam. Sebanyak 100 μl kultur bakteri tersebut selanjutnya dipipet dan dipindahkan ke media minimal salt kemudian diinkubasi di atas orbital shaker dengan kecepatan 120 rpm selama 48 jam.
Setelah melalui proses inkubasi 48 jam, kultur bakteri dalam media
minimal salt tersebut diambil sebanyak 3 ml untuk dimasukkan dalam tabung
Eppendorf steril dan disentrifugasi pada kecepatan 8000 rpm dengan suhu 4°C selama 10 menit. Supernatan dari hasil sentrifugasi dipisahkan dari pelletnya. Sebanyak 2 ml supernatan tersebut dipipet ke dalam tabung reaksi kemudian ditambahkan pereaksi Salper dan dikocok dengan vortex lalu diinkubasi pada suhu ruang selama 25 menit.Pereaksi Salper dibuat dengan melarutkan 0.5 M FeCl3
dengan 50 mL asam perklorat 35%. Setelah proses inkubasi selesai, campuran tersebut dibaca nilai absorbansinya pada panjang gelombang 530 nm. Nilai absorbansi yang terbaca kemudian disubstitusikan ke dalam kurva standar sehingga konsentrasi AIA dapat diketahui.
Amplifikasi PCR gen acdS. PCR amplifikasi acdSgen menggunakan dua
primer yaitu primer DegACCf (5’-
GGBGGVAAYAARMYVMGSAAGCTYGA-3’) dan primer DegACCr (5’-TTDCCHYKRTANACBGGRTC-3’) (Glick 2005). PCR yang digunakan sebanyak 25 µl. Komposisi reaksi PCR yang digunakan adalah sebagai berikut: Gotaq DNA polimerase 12.5 µl, primer reverse 1 µl, primer foward 1µl,water
nuclease free 8.5 µl dan DNA hasil isolasi 2 µl. Proses amplifikasi dilakukan pada
kondisi suhu denaturasi awal 95°C selama 3 menit dengan 30-35 siklus, denaturasi 95°C selama 30 detik, penempelan 46°C selama 1 menit, dan elongasi 72°C selama 1 menit, ekstensi akhir 72°C selama 5 menit dengan 1 siklus. Selanjutnya, DNA hasil amplifikasi dikeluarkan dari mesin PCR dan divisualisasi menggunakan elektroforesis gel agarosa.
Amplifikasi gen 16S rRNA. Gen penyandi protein 16S rRNA diamplifikasi dengan metode PCR menggunakan primer 63F
(5’CAGGCCTAACACATGCAAGTC’3) dan 1387R
(5’GGGCGGWGTGTACAAGGC’3). Komposisi reaksi PCR yang digunakan antara lain GoTaq DNA polimerase 12.5 µl, primer reverse 1 µl, primer forward 1µl , ddH2O 8.5 µl dan DNA hasil isolasi 2 µl. Proses amplifikasi dilakukan
dengan suhu denaturasi 94°C selama 5 menit; suhu annealing 94°C selama 30 detik, 50°C selama 30 detik, 72°C selama 1 menit; tahap annealing dilakukan sebanyak 10 siklus. Tahap ekstensi dilakukan pada suhu 94°C selama 30 detik, 55°C selama 30 detik, 72°C selama 1 menit; tahap ekstensi ini dikerjakan sebanyak 30 siklus. Tahap ekstensi diakhiri pada suhu 72°C selama 7 menit, dan
5 15°C selama 5 menit. DNA hasil amplifikasi divisualisasi menggunakan elektroforesis gel agarosa 1%. Terlihatnya pita DNA yang berukuran ±1500pb menandakan gen 16S rRNA telah teramplifikasi (modifikasi Jha et al.2012).
Sekuensing Gen 16S rRNA. Sekuensing dilakukan melalui jasa perusahaan sekuensing 1st Base Malaysia. Sekuens DNA selanjutnya disejajarkan
dengan data base dari GeneBank menggunakan blast n dari situs NCBI (National
Center for Biotechnology Information) melalui http://www.ncbi.nlm.nih.gov.
(modifikasi Jha et al. 2012).
HASIL
Aktivitas acdS pada Media DF
Hasil pengujian aktivitas ACC deaminase disajikan pada Gambar 1. Isolat ditumbuhkan pada tiga media yaitu media DF (Dworkin-Foster) sebagai kontrol negatif (1) ditunjukkan dengan tidak adanya bakteri yang tumbuh, media (2) DF + AS (amonium sulfat) sebagai kontrol positif ditunjukkan dengan tumbuhnya isolat dan isolat yang mampu tumbuh pada DF + ACC (C) menjadi indikasi adanya aktivitas enzim ACC deaminase ditunjukkan dengan adanya lingkaran putih yang tebal. Terdapat 4 isolat yang memiliki aktivitas ACC deaminase.
Gambar 1Hasil Uji ACC Deaminase,1: DF, 2: DF + amonium sulfat, 3:DF +ACC
Produksi Auksin
Isolat bakteri rhizosfer diremajakan pada media kemudian dianalisis kuantitatif produksi AIA. Tabel 1 menunjukkan hasil dari analisis kuantitatif produksi AIA sebanyak delapan isolat. Kadar auksin yang diproduksi isolat rhizosfer dari lahan sawah adalah sekitar 3.6 – 10.6 ppm. Hasil analisis produksi auksin pada (Tabel 1) menunjukkan aktivitas tertinggi sebesar 10.6 ppm.
Er II B1.2 ErII.B2.15 Er B3. 5 Er B3.5 Er B3.6 1 2 3
6
Tabel 1 Hasil analisis kuantitatif aktivitas AIA
Isolat AcdS Produksi AIA (ppm) Er II B2.5 + 3.6 Er I B1.8 + 47.3 Er I B3.6 + 4.1 Er II B2.13 + 10.6 Er II B2.10 + 2.3 Er II B2.4 + 10.35 Er II B2.15 + 3.4 Er II B1.2 + 6.05
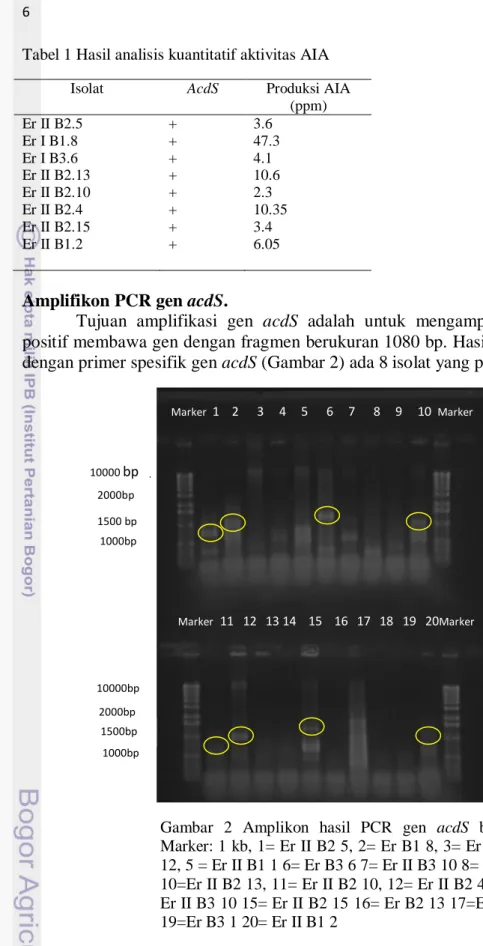
Amplifikon PCR gen acdS.
Tujuan amplifikasi gen acdS adalah untuk mengamplifikasi gen yang positif membawa gen dengan fragmen berukuran 1080 bp. Hasil amplifikasi PCR dengan primer spesifik gen acdS (Gambar 2) ada 8 isolat yang positif.
Gambar 2 Amplikon hasil PCR gen acdS berukuran 1080 bp Marker: 1 kb, 1= Er II B2 5, 2= Er B1 8, 3= Er B2 2, 4= Er II B2 12, 5 = Er II B1 1 6= Er B3 6 7= Er II B3 10 8= Er B2 3, 9= Er B1 7 10=Er II B2 13, 11= Er II B2 10, 12= Er II B2 4, 13= Er B3 10 14= Er II B3 10 15= Er II B2 15 16= Er B2 13 17=Er B2 1 18= Er B2 6 19=Er B3 1 20= Er II B1 2 Pohon Filogenetik
Tahap terakhir dilakukan identifikasi spesies bakteri yang terdekat dengan sampel unggul dari data pada GeneBank menggunakan program blast N dari situs NCBI (National Center for Biotechnology Information). Setelah data didapatkan, dilakukan pembuatan pohon filogenetiknya menggunakan program Mega 5 agar
Marker 1 2 3 4 5 6 7 8 9 10 Marker Marker 11 12 13 14 15 16 17 18 19 20Marker 10000 bp 2000bp 1500 bp 1000bp 10000bp 2000bp 1500bp 1000bp
7 dapat terlihat kedekatan antara sampel unggul dengan data dari GeneBank. Hasil amplifikasi 16s rDNA menunjukkan hasil yang positif pada (Gambar 3). Hasil sekuen 16s rDNA kemudian diidentifikasi spesies bakteri yang terdekat dengan dengan sampel unggul dari data pada GeneBank menggunakan program blast N dari situs NCBI (National Center for Biotechnology Information). Hasil analisis filogenetik dapat dilihat pada (Tabel 2) dan hasil blast menunjukkan bahwa kekerabatan terdekat dimiliki oleh sampel ErII B2.13 (Bacillus safensis) dengan ErII B1.2 (Bacillus Pumilus).
Gambar 3 Produk DNA PCR 16S RNA
Tabel 2Hasil analisis sekuens DNA sampel dengan menggunakan program blast N
Isolat Sekuens bakteri yang homolog % identitas No. Akses Er IIB2. 13 Bacillus safensis
gene for 16S ribosomal RNA, partial sequence
99% FO-036b.
Er II B2. 4 Bacillusaerophilusstrain
KUDC1727 16S ribosomal RNA gene, partial sequence
98% KC414706
Er II B1.2 Bacillus_pumilus isolate FM10
16S ribosomal RNA gene, partial sequence
99 % DQ289077.1
Er II B2.5 Microbacterium arborescens.
IARI-KPI 16S ribosomal RNA gene, partial sequence
99% KF712889.1
ER I B1. 8 Er I B3.6
Bacillus amyloliquefaciens strain
YCG37 16S ribosomal RNA gene, partial sequence
Stenotrophomonas maltophilia1
16S ribosomal RNA gene, partial sequence 98% 90 % JF775416.1 1 kb 1 1 2 3 4 5 6 7 8 9
8
Gambar 4 Pohon filogenetik sampel unggul dan data dari GeneBank dengan metode Neighbor Joining (NJ) dengan bootstrap 100x
PEMBAHASAN
Aktivitas acdS pada Media DF
Enzim 1-aminosiklopropana-1-karboksilat (ACC) deaminase terdeteksi secara kualitatif dengan uji tumbuh bakteri pada media Dworkin dan Foster (DF) minimal garam (Dworkin dan Foster 1958). Pertumbuhan strain bakteri pada media DF merupakan indikasi produksi ACC deaminase. Penentuan kuantitatif ACC deaminase dengan uji bakteri dilakukan dengan menentukan jumlah amonia yang dihasilkan oleh hidrolisis enzimatik ACC (Jacobson et al.1994). Kandungan protein dalam supernatan diukur dengan menggunakan metode Bradford (1976). Aktivitas ACC deaminase dinyatakan sebagai jumlah amonia yang dikeluarkan per mg protein per jam.
Hasil pengujian aktivitas ACC deaminase terhadap 20 isolat yang mempunyai aktivitas ACC deaminase dapat dilihat pada Gambar 2. Sebanyak 2 isolat dari 20 isolat Pseudomonas tersebut memiliki aktivitas ACC deaminase. Hal ini ditunjukkan oleh kemampuan isolat tersebut tumbuh dalam media garam minimal Dworkin-Foster (DF) baik yang diperkaya dengan amonium sulfat maupun dengan ACC sebagai sumber nitrogen (Gambar 1). Aktivitas ACC deaminase juga ditunjukkan oleh nilai kerapatan optik (600 nm) 0,05 atau lebih dalam media DF yang diperkaya ACC. Hal itu mengindikasikan bahwa isolat mampu mendegradasi substrat ACC sebagai satu-satunya sumber N. Media garam minimal DF tanpa sumber N tidak memiliki isolat yang mampu tumbuh,
(ER II B2.13)
(Er II B1.2)
9 mengindikasikan bahwa isolat tidak tergolong bakteri diazotrof yang dapat menambat N2 udara (Husen 2012)
Khandelwal (2013) melakukan uji aktivitas ACC pada 18 isolat bakteri
Pseudomonas dengan media Dworkin dan Foster (DF). Uji tersebut menunjukkan
pertumbuhan yang baik pada media dengan tambahan amonium sulfat setelah diinkubasi selama 3 hari dan hanya menumbuhkan 8 isolat bakteri yang memiliki aktivitas ACC. Penelitian yang telah dilakukan ini hanya menumbuhkan 4 bakteri pada media DF ACC. Hasil penelitian ini memiliki jumlah isolat bakteri yang tumbuh lebih sedikit dibandingkan penelitian Khandelwal (2013).
Produksi Auksin
Analisis AIA pada penelitian ini dilakukan dengan metode kolorimetri. Analisis AIA dengan metode ini mempunyai keunggulan, yaitu mudah, cepat, dan dapat dikerjakan untuk menganalisis sampel dalam jumlah banyak. Sebanyak 8 jenis bakteri telah diketahui mampu memproduksi AIA tetapi dengan jumlah kandungan yang bervariasi mulai dari 3.6-10.36 ppm (Tabel 2). Bakteri tunggal yang menghasilkan AIAtertinggi adalah Bacillus stratosphericu dan Bacillus sp. Bakteri Bacillus sp. memiliki kemampuan untuk menghasilkan hormon tumbuh seperti hormon AIA (Antonius et al. 2009 dan kumari et al. 2009). Bacillus sp. merupakan bakteri gram positif, berbentuk batang dan memiliki endospora.
Bacillus sp. termasuk kelompok bakteri yang memiliki banyak potensi karena
mampu memproduksi AIA, melarutkan fosfat, dan berperan sebagai agen biokontrol dan menginduksi sistem kekebalan tanaman serta menghasilkan antibiotik (Compant et al. 2005).
Hasil yang diperoleh ini tidak jauh berbeda dengan hasil penelitian Susilawati et al. (2003) pada isolat bakteri endofit yang diisolasi dari batang padi menghasilkan hormon AIA tertinggi sebesar 8.295 ppm selama 5 sampai 7 hari inkubasi dengan penambahan 5 Mml triptofan. Konsentrasi AIA pada penelitian ini lebih rendah dibandingkan dengan konsentrasi AIA yang dihasilkan Bacillus
indigenusdari tanah rhizosfer sebesar 67.2 ppm pada medium LB yang diperkaya
TRP yang diinkubasi selama 48 jam (Widayanti 2007). Menurut Patten & Glick (2001) penambahan triptofan dengan konsentrasi bervariasi dapat menghasilkan konsentrasi AIA yang berbeda. Jika konsentrasi triptofan yang ditambahkan semakin tinggi maka konsentrasi AIA yang dihasilkan juga akan semakin tinggi. Kemampuan triptofan meningkatkan produksi AIA mengindikasikan bahwa triptofan merupakan prekursor untuk biosintesis AIA oleh bakteri tersebut (Patten & Glick 2002).
Hasil uji secara kolorimetri menggunakan spektrofotometer menunjukkan bahwa seluruh bakteri pada kultur supernatan yang diuji menghasilkan hormon AIA dengan konsentrasi yang berbeda-beda. Perbedaan kadar produksi AIA mungkin disebabkan oleh perbedaan spesies dan strain yang diuji, kondisi kultur, tahap pertumbuhan dan ketersediaan AIA substrat (Mirza et al.2001). Faktor lain yang juga mempengaruhi perbedaan kadar AIA seperti susunan genetik, laju pertumbuhan, aktivitas enzim, kemampuannya dalam mengkonversi triptofan yang terkandung dalam media menjadi AIA, dan waktu inkubasi kultur (Khalid et
10
Amplifikon PCR gen acdS
Deteksi keberadaan gen ACC deaminase dapat dilakukan dengan menggunakan metode polymerase chain reaction (PCR) berdasarkan 47 sampel didapatkan 8 hasil positif yaitu isolat Er II B2, Er II B2. 13, Er B1 8, Er II B2. 10, Er II B2. 4, Er B3. 6, Er II B1. 2 dan Er II B2. 15. Hasil positif ditunjukan dengan DNA pada ukuran 1080 bp dengan primer spesifik ACCf dan ACCr. Produksi ACC deaminase sangat efisien dan penting bagi endofit untuk merangsang tanaman inang.
Gen acdS penelitian ini diperoleh pada amplikon 1080 bp sama seperti penelitian yang telah dilakukan oleh Yan Jun Jia et al.(2000) dengan hasil sebesar 1080 bp pada salah satu bakteri rhizosfer yaitu Pseudonomas sp. Menurut Jin Duan et al. (2008) dari 27 isolat bakteri yang diamplifikasi dengan PCR menggunakan primer khusus untuk ACC didapatkan 17 isolat yang positif ACC deaminase. Hal itu ditandai dengan keberadaan pita DNA pada amplikon 1020 bp. Hasil penelitian Jin Duan tidak berbeda nyata dengan penelitan ini yaitu 1080 bp. Gangaravapu (2013) melaporkan bahwa bakteri tanah di India yang diuji dengan primer spesifik ACC menunjukan hasil 1080 bp pada agarosa setelah di PCR. Hasil penelitian Mattos et al.(2008), menunjukkan bahwa bakteri endofitmampu meningkatkan jumlah akar lateral dan rambut akar tanaman padi.
Menurut Huang et al. (2013) lima strain tanaman rhizobakteri pertumbuhan (PGPR) dengan 1-aminosiklopropona-1-karboksilat (ACC) aktivitas deaminase diisolasi dari tanah anyelir dan akar menggunakan ACC sebagai satu-satunya nitrogen sumber dengan amplicon pada PCR sekitar 1000 bp. C. Sarathambal et al.(2013) melaporkan hasil yang diperoleh menunjukkan bahwa isolat bakteri toleran garam yang mengandung ACC deaminase Pseudomonas
fluorescens dan Bacillus sp. Bacillus sp. meningkatkan tanaman pertumbuhan,
baik normal dan di bawah tekanan garam. Seperti yang dilakukan oleh Mayak et
al. (2004) bahwa Achromobacter piechaudii memiliki aktivitas ACC deaminase
signifikan meningkatkan segar dan kering.
Beberapa PGPR penghasil ACC deaminase mampu mengurangi pengaruh negatif etilen bagi pertumbuhan tanaman. PGPR memiliki kemampuan lain seperti melindungi tanaman dari berbagai cekaman lingkungan (genangan) dan memfasilitasi produksi senyawa organik volatil untuk fitoremediasi tanah-tanah tercemar logam berat (Glick dan Penrose 2006). Penelitian Galamerio et al. (2010) menyatakan bahwa simbiosis jamur mikoriza dan bakteri penghasil ACC deaminase dapat memperbaiki pertumbuhan mentimun dalam kondisi stres salinitas. Mikroorganisme tanah penghasil enzim 1-aminosiklopropana-1-karboksilat (ACC) deaminase (E.C.4.1.99.4) terbukti mampu membantu tanaman menghadapi stres (cekaman) biotik dan abiotik pada tanah pertanian yang bermasalah. ACC deaminase merupakan enzim sitoplasma yang diproduksi beberapa bakteri tanah untuk mendegradasi ACC (prekursor hormon etilen pada tanaman) menjadi amonia dan ketobutirat yang merupakan sumber N dan karbon bagi bakteri. Degradasi ACC oleh bakteri ini mengurangi biosintesis hormon etilen. Hormon etilen dapat menguntungkan tanaman tetapi biosintesis etilen yang terlalu tinggi akan menyebabkan cekaman lingkungan. Hal itu akan menghambat pertumbuhan akar tanaman dan melemahkan ketahanan tanaman terhadap berbagai stresor (Glick 1995).
11 Bakteri penghasiil ACC deaminase juga mampu mensekresi hormon AIA (Indole acetic acid)/AIA (Patten & Glick 2002). Enzim ACC deaminase yang dihasilkan bakteri mampu menurunkan kadar ACC yang meningkat akibat stres salinitas sehingga produksi etilen dapat dikontrol (Glick 1998). Produksi etilen berkurang menyebabkan pertumbuhan akar lebih baik saat terjadi salinitas.
Urutan DNA Isolat Bakteri dan Pohon Filogenetik
Sekuensing DNA sampel dilakukan untuk mengetahui kekerabatan sampel dengan spesies bakteri terdekat berdasarkan database yang ada. Hasil sekuen yang diperoleh dibandingkan dengan sekuen DNA yang tersedia pada databasedi NCBI melalui proses penyejajaran (blast). Hasil blast menunjukkan bahwa kekerabatan terdekat dimiliki oleh sampel ErII B2.13 (Bacillus safensis) dengan ErII B1.2 (Bacillus Pumilus) menurut Desai et al. (2007) isolat Bacillus pumilis (IM-3) terbukti meningkatkan bobot segar akar dan berat kering. Sampel lainnya, yaitu Er 1B3.6 Stenotrophomonas maltophilia (98%) memiliki kekerabatan terdekat dengan Pseudomonassp menurut penelitian Jasom et al. (2013) (Pseudomonas
sp.) ditemukan positif untuk ACC deaminase produksi seperti yang ditunjukkan
oleh pertumbuhan di media.
Isolat Er II B2.5 merupakan bakteri Microbacterium arborescens ( 99%). Pada tahun 2009 sheng et al. melaporkan bahwa Microbacterium sp G16 diisolasi akar menunjukkan aktivitas ACC deaminase dan menurut Shrivastavaet al. (2013)
Microbacterium sp ECI-12A menunjukkan aktivitas deaminase ACC isolat ini
diisolasi dari lahan sawah rizosfer.
Beberapa penelitian telah membuktikan bahwa bakteri yang berasal dari spesies Bacillus memiliki kompleks aktivitas ACC Deaminase. Salah satu penelitian yang membuktikan hal tersebut adalah penelitian yang dilakukan oleh
B a igiet al. (2011) yang menyatakan bahwa enam strain Bacillus memiliki
dominan baik aktivitasACC deaminase termasuk Bacillus amyloliquefaciens isolat
ER II B2. 4. Pohon filogenetik dibuat dengan tujuan untuk mengetahui
kekerabatan antar sampel unggul. Berdasarkan pohon filogenetik didapatkan kekerabatan terdekat antar sampel terdapat pada sampel Er II B2.13 dengan dengan Er II B1.2. Hal ini sesuai dengan hasil analisis menggunakan blast bahwa Er II B2.13 dan Er IIB1.2 keduanya memiliki kekerabatan terdekat dengan bakteri dari genus Bacillus walaupun dari spesies yang berbeda untuk keduanya. Kekerabatan terjauh di dapatkan oleh sampel ER B3.6 dan ER B2.5, kedua sampel berada dalam tangkai yang berbeda dan berada pada posisi yang berjauhan.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dengan menggunakan 47 isolat bakteri rhizofer diperoleh 8 isolat yang mempunyai amplikon sebesar 1080 bp dengan primer spesifik ACCf dan ACCr. Bakteri tersebut memproduksi auksin (AIA) dengan konsentrasi 3.5 ppm hingga 10.6 ppm. Hasil uji aktivitas ACC deaminase pada media DF menunjukkan hasil positif yaitu Er B3.5 dan Er II B2.5. Hasil
12
blast menunjukkan bahwa kekerabatan terdekat dimiliki oleh sampel ErII B2.13
(Bacillus safensis) dengan ErII B1.2 (Bacillus pumilus).
Saran
Penelitian lebih lanjut dengan menginokulasi tanaman secara langsung perlu dilakukan agar terlihat pengaruh gen ACC deaminase yang dihasilkan oleh isolat bakteri unggul terhadap pertumbuhan tanaman. Uji patogenisitas pada bakteri unggul tersebut perlu dilakukan untuk penelitian selanjutnya.
13
DAFTAR PUSTAKA
Abeles FBPW, Morgan, ME Saltveit. 1992. Ethylene in Plant Biology 2nd
edition. San Diego: Academic Press.
Belimov AA, Safronova VI, Mimura T . 2002. Response of spring rape (Brassica
napus var. oleifera L.) to inoculation with plant growth promoting
rhizobacteria containing 1-aminosiklopropona-1-carboxylate deaminase depends on nutrient status of the plant. Can J Microbiol 48: 189-199. Carlile MJ, Watkinson SC, Goodday GW. 2001. The Fungi. 2nd. NewYork,
London : Academic Press
Clarridge JE. 2004. Impact of 16S rRNA gene sequence for identification of bacteria on clinical microbiology and infections disease. Clinical
Microbiology Reviews 17(4): 840--862.
Culligan EP, Hill C, RD. Sleator. 2009. Probiotics and gastrointestinal disease: successes, problems and future prospects. Gut Pathogens 1(19): 1-12. Foster RC. 1985. The Biology of the rhizosphere. In: Parker CA, Rovira AD,
More KJ, Wong PTW, Kollmorgen JF, editors. Ecology And Management of Soilborne Plant Pathogens, Prosiding 1st and 5st International Congress of Plant Pathology, Australia, 10-11 and 17-24 August 1983. Minnesota (USA): The America Phytopathologycal Society.
Glick BR, Todorovic B, Czarny J, Cheng Z, Duan J. 2007. Promotion of plant growth by bacterial ACC deaminase. Crit. Rev. Plant Sci. 26: 227- 242 Glick BR, Penrose DM, J Li. 1998. A model for the lowering of plant
ethylene concentrations by plant growth promoting bacteria. J. Theor.
Biol.190:63-68.
Grattan SR. 2005. Irrigation water salinity and crop production. ANR Publication 8066. University of California Agriculture and Natural Resources in partnership with Natural Resources Conservation Service Grichko VP, Glick BR. 2001. Amelioration of flooding stress by ACC
deaminase-containing plant growth promoting bacteria. Plant Physiol
Biochem 39: 11-17
Gupta M, Shashi K, Arvind G, Bikram S, Rupinder T.2012. Isolation and identification of phosphate solubilizing bacteria eble to enhance the growth and aloin-A biosynthesis of Aloe barbadensis Miller.
Microbiological Research 167: 358-363.
Hornbyn D. 1990. Root diseases. In Lynch JM, editor. The Rhizosphere. New York: John Willey & Sons.
Husen E, Wahyudi AT, Suwanto A, and Saraswati R. 2008. Prospective use of ACC deaminase-producing bacteria for plant growth promotion a defense against biotic and abiotic stresses in peat-soil-agriculture. Microbiol. Indonesia. 2 :107-111. hydrocarbons. Can J Microbiol 51: 1061-1069 Innis MA, Gelfand DH, Sninsky JJ, White JT. 1990. PCR Protocols, A guide to
Metods and Applications. San Diego: Academic Press Inc.
Jacobson CB, Pasternak JJ, Glick BR. 1994. Partial purification and characterization of ACC deaminase from the plant growth promoting
14
rhizobacterium Pseudomonas putida GR12-2. Can. J. Microbiol. 40: 1019 1022
Jin Duan, Kristen M, Trevor C, Charles, Susanne. 2008. ACC Deaminase Genes in Rhizobia From Southern Saskatchewan.
Kennedy IR, ATMA. Choudhury, ML. Kecskes. 2004. Non-symbiotic bacterial diazotrophs in crop-farming systems: can their potential for plant growth promo-tion be better exploited. Soil Biol. Biochem.
Las I, Unadi A, Subagyono K, Syahbuddin H, Runtunuwu E. 2007. Atlas
Kalender Tanam Pulau Jawa. Skala 1:1.000.000 dan 1:250.000 . Balai
Penelitian Agroklimat dan Hidrologi, Bogor.
Lieberman M, Kunishi AT. 1972. Thoughts on the role of ethylene in plant growth and development. p 549-560 In: D.J. Carr (ed.) Plant Growth Substances. Springer-Verlag. New York
Long HH, Schmidt DD, Baldwin IT. 2008. Native Bacterial Endophytes Promote Host Growth in a Species-Specific Manner; Phytohormone Manipulations Do Not Result in Common Growth Responses.
http://www.plosone.org/article/info:doi/10.1371/journal.pone.0002702. Madigan MT, Martinko JM, Parker J. 2010. Brock Biology Of Microorganisms.
Prentice-Hall Inc. Upper Saddle River: xix + 991 hlm
Mattos KA, Pádua VLM, Romeiro A, Hallack LF , Neves BC, Ulisses T MU,Barros CF, Todeschini1 AR, Previato JO , Mendonça Previato L. 2008. Endophytic Colonization of Rice (Oryza sativa L) by the Diazotrophic Bacterium Burkholderia kururiensis and Its Ability to Enhance Plant Growth. http://www.scielo.br/aabc
Mayak S, Tirosh T,. Glick BR. 2004. Plant growth-promoting bacteria that confer resistance to water stress in tomato and pepper. Plant Sci 166: 525-530 microbes. Appllication Microbiology and Biotechnology 75: 955—962 Nagatsu T,. Yagi K. 1966. A 24 Simple Assay Of Monoamine Oxidase And D
- Amino Acid Oxidase By Measuring Ammonia. J. Biochemistry 60(2): 219- 221.niloticus) cultured in brakish water in Saudi Arabia
Ojala JC, Jarrel WM, Menge JA, Johnson ELV. 1983. Influence of Mycorrizal Fungion the Mineral Nutrition and Yield of Onion in SalineSoil. Agron. 75 : 255 – 259
Ose T, Fujino A, Yao M, Watanabe N, Honma M, Tanaka I. 2003. Reaction Intermediate Structures of 1-Aminosiklopropona-1-carboxylate Deaminase, Insight into PLP-dependent cyclopropane ring reaction. J.
Biol. Chem 278(42): 41069–41076
Pangastuti A. 2006. Definisi spesies prokaryota berdasarkan urutan basa gen penyandi 16S rRNA dan gen penyandi protein. Biodiversitas 7(3): 292--296. Pseudomonas putida under gnotobiotic conditions. Can. J. Microbiol. 33:390 395.
Reed MIE, Glick BR. 2005. Growth of canola (Brassica napus) in the presence of plant growth-promoting rhizobacteria and either copper or polycyclic aromatic hydrocarbons. Can J Microbiol 51: 1061-1069.
15 Nagatsu T, Yagi K. 1966. A 24 simple assay of monoamine oxidase and
D-amino acid oxidase by measuring ammonia. J. Biochemistry 60(2): 219-221
Salinger MJ. 2005. Climate variability and change: past, present, and future over view. Climate Change
Saravanakumar DR. Samiyappan. 2007. ACC deaminase from Pseudomonas fluorescens mediated saline resistance in groundnut (Arachis hypogea) plants. Journal of Appl. Microbiol. 102:1283–1292
Suwignyo P. 2003. Ekosistem Perairan Pedalaman, Tipologi dan Permasalahannya. Manajemen Bioregional Jabodetabek : Profil dan Strategi Pengelolaan Situ, Rawa dan Danau. Pusat Penelitian
Biologi-LIPI, Bogor.
Wang C, E Knill, BR Glick, G Défago. 2000. Effect of transferring 1 aminosiklopropona-1-carboxylic acid (ACC) deaminase gene into Pseudomonas fluorescens Strain CHA0 and its gacA derivative CHA96 on their growth-promoting and disease-suppressive capacities. Can. J.
Microbiol. 46:898-907
Yan Jun JIA, Hiroyuki ITO, Hirokazu Matsui. 2000.ACC Deaminase Induced by ACC Synthesized and Accumulated in Penicillum citrinum Intracellular http://www.tandfonline.com
/doi/abs/10.1271/bbb.64.299
16
Lampiran 1 Isolat bakteri rhizosfer yang digunakan dalam penelitian
No Kode Isolat Gram
1. ER B1. 2 + 2. ER B1. 3 + 3. ER B1. 4 + 4. ER B1.5 + 5. ER B1.6 + 6. ER B1.7a - 7. ER B1.8 + 8. ER B1.9 - 9. ER B2. 1 + 10. ER B2.2 + 11. ER B2.3 + 12. ER B2.4 + 13. ER B2.5 - 14. ER B2.7 + 15. ER B2.8 + 16. ER B2.9 + 17. ER B2.10 - 18. ER B2.11 + 19. ER B2.12 + 20. ER B2.13 + 21. ER B2.14 + 22. ER B3.1 + 23. ER B3.5 - 24. ER B3.6 - 25. ER B3.7 + 26. ER B3.8 + 27. ER B3.10 + 28. ER B3.12 + 29. ER B3.15 - 30. ER II B1.2 + 31. ER II B1.3 + 32. ER II B1.5 - 33. ER II B1.6 - 34. ER II B1.7 + 35. ER II B2.2 + 36. ER II B2.4 + 37. ER II B2.5 + 38. ER II B2.10 + 39. ER II B2.12 + 40. ER II B2.13 - 41. ER II B2.14 + 42. ER II B3.8 + 43. ER II B3.10 - 44. ER II B3.11 + 45. ER II B3.12 + 46. ER II B3.15 +
17
Lampiran 2 Diagram alir penelitian
isolat bakteri Peremajaan dan pemurnian isolatbakteri
Bakteri tidak tumbuh Bakteri tumbuh Isolasi DNA PCR dengan Primer acdS Analasis AIA Sequensing 16s Bakteri tumbuh Analisis data sequence Pohon filogenetik Screening pada media DF
18
RIWAYAT HIDUP
Penulis dilahirkan di Payakumbuh pada tanggal 16April 1993 dari ayah bernama Novizar dan ibu bernama Rina Marnita.Penulis merupakan anak pertama dari 2 bersaudara.Pendidikan penulis dimulai dari SD Dian Andalas Padang, kemudian melanjutkan pendidikan ke jenjang Sekolah Menengah Pertama di SMP IT AdzkiaPadang. Tahun 2010 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA SIKL (Sekolah Indonesia Kuala Lumpur) dan pada tahun yang sama lolos seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan penulis pernah menjadi Staff Badan Eksekutif Mahasiswa MIPA tahun 2012. Penulis juga pernah aktif dalam beberapa kepanitian seperti panitia TPB CUP2011, AWAN 2011, Pesta Sains Nasional 2011, SPIRIT FMIPA 2012, ISEE 2012,Gebyar Nusantara 2012, IPB Art Contest 2012,ComDay 2013, SAFE International Confrence 2014. Bulan Juli-Agustus 2013 penulis melakukan Praktik Lapang di Laboratorium Kultur Jaringan UPTD Balai Pengembangan Perbenihan Tanaman Pangan dan Hortikultura Yogyakarta, dengan judul Perbanyakan Tanaman Pisang (Musa paradisiaca L.) dengan Teknik Kultur Jaringan.