commit to user
i
UJI EFEKTIVITAS PROSEDUR DISINFEKSI TINGKAT TINGGI ENDOSKOPI SALURAN CERNA RSUD Dr. MOEWARDI
SKRIPSI
Untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran
AVIADDINA RAMADHANI G.0009035
FAKULTAS KEDOKTERAN UNIVERSITAS SEBELAS MARET
commit to user
iv
ABSTRAK
Aviaddina Ramadhani, G0009035, 2012. Uji Efektivitas Prosedur Disinfeksi
Tingkat Tinggi Endoskopi Saluran Cerna RSUD Dr. Moewardi. Skripsi. Fakultas
Kedokteran Universitas Sebelas Maret, Surakarta.
Latar Belakang: Risiko infeksi yang berhubungan dengan endoskopi masih menjadi topik yang menarik. Permasalahan ini kemungkinan berhubungan dengan teknik disinfeksi atau kepatuhan terhadap prosedur disinfeksi tingkat tinggi. Teknik disinfeksi endoskopi saluran cerna dapat bervariasi di setiap unit. Penelitian ini bertujuan untuk mengetahui efektivitas disinfeksi tingkat tinggi endoskopi saluran cerna di Rumah Sakit Umum Daerah (RSUD) Dr. Moewardi.
Metode: Sebuah studi observasional dengan rancangan cross sectional dilakukan di RSUD Dr. Moewardi. Tiga puluh sampel dari usap endoskopi saluran cerna setelah proses disinfeksi tingkat tinggi dengan penyimpanan selama 24 jam dan tanpa penyimpan diambil dengan teknik convenience sampling. Data dari penelitian ini dianalisis secara deskriptif dan diuji menggunakan uji Chi Square.
Hasil: Mikroorganisme terdeteksi di 11/14 sampel endoskopi saluran cerna setelah penyimpanan 24 jam dan 3/16 dari endoskopi saluran cerna tanpa proses penyimpanan. Mikroorganisme tersebut adalah Bacillus sp, Staphylococcus aureus, Staphylococcus non-aureus, dan Clostridium sp. Terdapat hubungan yang signifikan antara proses penyimpanan setelah disinfeksi tingkat tinggi endoskopi saluran cerna dengan kontaminasi mikroorganisme.
Simpulan: Disinfeksi tingkat tinggi endoskopi saluran cerna RSUD Dr. Moewardi belum efektif. Ada hubungan yang signifikan antara penyimpanan endoskopi saluran cerna selama 24 jam dengan efektivitas disinfeksi tingkat tinggi endoskopi saluran cerna.
commit to user
v
ABSTRACT
Aviaddina Ramadhani, G0009035, 2012. The Effectiveness Test of Gastrointestinal Endoscope High-Level Disinfection at RSUD Dr. Moewardi. Mini Thesis. Medical Faculty of Sebelas Maret University, Surakarta.
Background: The risk of infection associated with gastrointestinal endoscope remains a topic of interest. This vexation may be related to reliability of the disinfecting techniques or the compliances with the guideline laid down for high-level disinfection. Gastrointestinal endoscope disinfecting techniques may vary from site to site. This study was to examine the effectiveness of gastrointestinal endoscope high-level disinfection at Rumah Sakit Umum Daerah (RSUD) Dr. Moewardi.
Methods: An observational study using cross sectional design was conducted at RSUD Dr. Moewardi. Thirty samples from gastrointestinal endoscope swab after high-level disinfection process with 24 hours storage and without storage was sampled with convenience sampling technique. Data from this research were analyzed descriptively and tested using Chi square test.
Results: Microorganism were detected in 11/14 samples of gastrointestinal endoscope after 24 hours storage and 3/16 samples of gastrointestinal endoscope without storage process. The microorganisms were Bacillus sp, Staphylococcus aureus, Staphylococcus non-aureus, and Clostridium sp. Significant relationship was detected between storage processes after gastrointestinal endoscope high-level disinfection with microorganism contamination.
Conclusions: High-level disinfection of gastrointestinal endoscopes RSUD Dr. Moewardi is not yet effective. There was a significant relationship between gastrointestinal endoscopy storage for 24 hours with the effectiveness of high-level disinfection of gastrointestinal endoscopes.
commit to user
vi
PRAKATA
Puji syukur senantiasa penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Uji Efektivitas Prosedur Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna RSUD Dr. Moewardi”.
Skripsi ini disusun sebagai salah satu syarat kelulusan tingkat sarjana di Fakultas Kedokteran Universitas Sebelas Maret Surakarta. Kendala dalam penyusunan skripsi ini dapat teratasi atas pertolongan Allah SWT dan melalui bimbingan dan dukungan banyak pihak. Untuk itu, perkenankan penulis mengucapkan terima kasih kepada:
1. Prof. Dr. Zainal Arifin Adnan, dr., Sp.PD-KR-FINASIM, selaku Dekan Fakultas Kedokteran Universitas Sebelas Maret.
2. Muthmainah, dr., M.Kes., selaku Ketua Tim Skripsi Fakultas Kedokteran Universitas Sebelas Maret.
3. Marwoto, dr., M.Sc., Sp.MK, selaku Pembimbing Utama yang telah meluangkan waktu untuk memberikan bimbingan dan saran mulai dari penyusunan proposal sampai selesainya skripsi ini.
4. Leli Saptawati, dr., Sp.MK, selaku Pembimbing Pendamping yang telah meluangkan waktu untuk memberikan bimbingan, koreksi, dan motivasi mulai dari penyusunan proposal sampai selesainya skripsi ini.
5. Afiono Agung Prasetyo, dr., PhD, selaku Penguji Utama yang telah memberi saran dan kritik demi kesempurnaan skripsi ini.
6. T. Yuli Pramana, dr., Sp.PD-KGEH, selaku Anggota Penguji yang telah memberi saran dan kritik demi kesempurnaan skripsi ini.
7. Sri Enny Narbrietty, S.H., M.H., dan Sunardi selaku tim skripsi FK UNS, dokter dan staf bagian endoskopi saluran cerna RSUD Dr. Moewardi, serta staf Lab. Mikrobiologi FK UNS yang telah membantu penulis dalam pengambilan data.
8. Bapak, Ibu, Nafis, TW, Dahniar, Fian, Sabila, Tya, Anin, dan Devina yang telah memberikan doa, dukungan, dan bantuan dalam menyelesaikan skripsi ini.
9. Keluarga besar Kastrat de Geneeskunde, Asisten Mikrobiologi, Redaksi Embun, dan Aktivis Bakti Nusa atas dukungan dan pengertian yang luar biasa.
10. Saudara, sahabat, rekan seperjuangan Pendidikan Dokter 2009 dan semua pihak atas segala bantuan dan kerjasamanya dalam penyelesaian skripsi ini Meskipun tulisan ini masih belum sempurna, penulis berharap skripsi ini dapat bermanfaat bagi pembaca. Saran, pendapat, koreksi, dan tanggapan dari semua pihak sangat diharapkan.
Surakarta, 11 Juli 2012
commit to user
a. Pengertian Sterilisasi dan Disinfeksi ... 5
b. Metode Sterilisasi dan Disinfeksi ... 6
2. Endoskopi Saluran Cerna ... 13
a. Pengertian Endoskopi... 13
b. Bagian Endoskopi... 14
c. Penggunaan Endoskopi Saluran Cerna ... 15
d. Efek Samping Prosedur Endoskopi Saluran Cerna ... 16
3. Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna... 16
a. Prosedur Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna... 16
b. Prosedur Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna RSUD Dr. Moewardi ... 20
c. Faktor yang Mempengaruhi Efektivitas Prosedur Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna . 20 B. Kerangka Pemikiran ... 25
commit to user
viii
BAB III METODE PENELITIAN ... 27
A. Jenis Penelitian ... 27
B. Lokasi dan Waktu Penelitian ... 27
C. Subjek Penelitian ... 27
D. Teknik Sampling ... 27
E. Rancangan Penelitian... 28
F. Identifikasi Variabel Penelitian ... 28
G. Definisi Operasional Variabel ... 29
H. Alat dan Bahan Penelitian ... 30
I. Cara Kerja... 30
J. Teknik Analisis Data ... 31
BAB IV HASIL PENELITIAN ... 32
BAB V PEMBAHASAN ... 37
BAB VI PENUTUP ... 46
A. Simpulan ... 46
B. Saran ... 46
DAFTAR PUSTAKA ... 48
commit to user
ix
DAFTAR TABEL
Tabel 2.1 Daya Hambat Disinfeksi terhadap Mikroorganisme ... 5
Tabel 2.2 Variasi Endoskopi ... 13
Tabel 2.3 Kelebihan dan Kekurangan Masing-Masing Disinfektan ... 22
Tabel 4.1 Sebaran Sampel Menurut Sumber Pengambilan Sampel ... 32
Tabel 4.2 Sebaran Sampel Menurut Pertumbuhan Bakteri ... 33
Tabel 4.3 Sebaran Sampel Positif Menurut Jumlah Jenis Bakteri ... 34
Tabel 4.4 Sebaran Sampel Positif Menurut Pengecatan Gram ... 35
commit to user
x
DAFTAR GAMBAR
Gambar 2.1 Skema Kerangka Pikir... 25
Gambar 3.1 Skema Rancangan Penelitian... 28
Gambar 5.1 Penyimpanan Endoskopi Saluran Cerna RSUD Dr.
commit to user
xi
DAFTAR LAMPIRAN
Lampiran 1. Standar Operasional Prosedur Sterilisasi dan Disinfeksi Endoskopi Saluran Cerna RSUD Dr. Moewardi
Lampiran 2. Surat Ijin Penelitian untuk Direktur RSUD Dr. Moewardi
Lampiran 3. Surat Ijin Penelitian untuk Kepala Tim Inos
Lampiran 4. Surat Ijin Penelitian untuk Kepala Sub. Bag Gastroenterologi RSUD Dr. Moewardi
Lampiran 5. Surat Ijin Penelitian untuk Laboratorium Mikrobiologi FK UNS
Lampiran 6. Dokumentasi Kegiatan dan Hasil Penelitian
commit to user BAB I PENDAHULUAN
A. Latar Belakang Masalah
Dewasa ini terjadi perkembangan dan peningkatan penggunaan
endoskopi sebagai alat diagnostik dan terapi yang handal. Endoskopi
merupakan alat berupa pipa pipih panjang dengan kamera di ujungnya yang
digunakan untuk melihat keadaan organ tubuh bagian dalam. Dengan
kemampuan melihat organ tubuh bagian dalam tersebut, endoskopi dapat
menyederhanakan tindakan terapi operatif dan dapat mendiagnosis penyakit
saluran cerna dengan lebih akurat (Cotton dan Williams, 2008; Schwab dan
Singh, 2010).
Seiring dengan meningkatnya pemanfaatan endoskopi, semakin
meningkat pula risiko terjadinya infeksi. Peningkatan risiko infeksi dapat
terjadi karena adanya kontaminasi. Endoskopi dapat mengalami kontaminasi
akibat kontak dengan membran mukosa atau lapisan kulit yang tidak utuh.
Kontak tersebut dapat mengakibatkan menempelnya berbagai mikroorganisme
baik patogen maupun apatogen di permukaan endoskopi (Ribeiro et al., 2004).
Endoskopi saluran cerna merupakan penyebab tersering terjadinya
infeksi yang berkaitan dengan pemakaian peralatan medis di bidang
gastroenterologi. Beberapa penelitian menunjukkan adanya infeksi akibat
transmisi mikroorganisme di endoskopi seperti Salmonella sp, Staphylococcus
epidermidis, Streptococcus alfa-hemoliticus, Eschericia coli, Staphylococcus
commit to user
aureus, Klebsiella pneumoniae, Enterococcus faecalis, Candida sp,
Pseudomonas aeruginosa, dan Helicobacter pylori (Ribeiro et al., 2004;
Heudorf dan Exner, 2006). Infeksi tersebut berkaitan erat dengan kualitas
prosedur disinfeksi tingkat tinggi endoskopi (Rutala dan Weber, 2004; Alfa et
al., 2011).
Proses disinfeksi tingkat tinggi endoskopi saluran cerna dapat dilakukan
secara manual maupun dengan mesin otomatis (Martiny et al., 2004).
Disinfeksi tingkat tinggi secara manual maupun dengan mesin memiliki
tahapan yang sama, meskipun dilakukan dengan metode berbeda. Tahap
tersebut meliputi pencucian manual dengan menyikat untuk menghilangkan
kotoran dan material organik, perendaman dalam disinfektan untuk proses
disinfeksi tingkat tinggi, pembilasan dengan air steril, pembilasan dengan
alkohol 70%, pengeringan dengan udara bertekanan, dan penyimpanan
(Willis, 2006; Muscarella, 2006; Cotton dan Williams, 2008).
Beberapa faktor dapat mempengaruhi proses disinfeksi tingkat tinggi
endoskopi saluran cerna. Pemilihan prosedur disinfeksi tingkat tinggi yang
berbeda serta prosedur disinfeksi tingkat tinggi yang tidak adekuat dapat
menjadi penyebab meningkatnya potensi transmisi patogen di endoskopi
saluran cerna. Faktor tersebut seperti pemilihan disinfektan yang tidak tepat,
kegagalan disinfeksi tingkat tinggi, pengeringan yang tidak maksimal,
maupun penyimpanan yang tidak sesuai prosedur (Rutala dan Weber, 2004;
commit to user
Risiko infeksi pada pasien yang menjalani proses endoskopi saluran
cerna dapat ditekan dengan penerapan kebijakan pengendalian infeksi dan
peningkatan keterampilan petugas kesehatan di masing-masing unit (Barbosa
et al., 2010). Pedoman pelaksanaan disinfeksi tingkat tinggi endoskopi saluran
cerna berbeda-beda untuk setiap negara dan disesuaikan untuk masing-masing
unit berdasarkan petunjuk dari tim pengendalian infeksi (Cotton dan Williams,
2008; Alfa et al., 2011). Hal ini berlaku pula di Rumah Sakit Umum Daerah
(RSUD) Dr. Moewardi. Rumah sakit tersebut memiliki standar operasional
prosedur tersendiri mengenai disinfeksi tingkat tinggi endoskopi saluran
cerna. Namun, standar operasional tersebut belum pernah diuji efektivitas
disinfeksinya. Oleh karena itu, dibutuhkan uji efektivitas dan program
surveilans jangka panjang. Dengan adanya uji efektivitas ini diharapkan dapat
menjadi acuan penetapan kebijakan yang tepat untuk mencegah transmisi
mikroorganisme penyebab infeksi.
B. Perumusan Masalah
Bagaimanakah efektivitas disinfeksi tingkat tinggi endoskopi saluran
cerna RSUD Dr.Moewardi?
C. Tujuan Penelitian
Untuk mengetahui efektivitas disinfeksi tingkat tinggi endoskopi saluran
commit to user D. Manfaat Penelitian
1. Manfaat teoritis
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah
dan bukti empiris mengenai efektivitas disinfeksi tingkat tinggi endoskopi
saluran cerna.
2. Manfaat aplikatif
Hasil penelitian ini diharapkan dapat memberikan manfaat aplikatif
antara lain:
a. Menyajikan data ilmiah sebagai masukan prosedur disinfeksi tingkat
tinggi endoskopi saluran cerna RSUD Dr. Moewardi.
b. Mendorong penelitian selanjutnya mengenai efektivitas disinfeksi
commit to user BAB II
TINJAUAN PUSTAKA
A.Tinjauan Pustaka
1. Sterilisasi dan Disinfeksi
a. Pengertian Sterilisasi dan Disinfeksi
Sterilisasi adalah proses membunuh segala bentuk kehidupan
mikroorganisme yang ada dalam suatu sampel, alat, atau lingkungan
tertentu (Rahardjo, 2010). Sterilisasi dapat membunuh semua bentuk
mikroorganisme meliputi virus, jamur, parasit, kista, bakteri, dan bagian
bakteri seperti spora (Spicer, 2008). Sterilisasi berbeda dengan disinfeksi.
Disinfeksi merupakan tindakan/upaya untuk mendestruksi atau
membunuh mikroba patogen dalam bentuk vegetatif dan bukan spora
bakteri. Metode disinfeksi dapat dilakukan dengan memanfaatkan bahan
kimia atau secara fisik (Tortora et al., 2007; Bauman et al., 2011).
Berdasarkan daya hambat terhadap mikroorganisme, disinfeksi
dibedakan menjadi tiga yaitu disinfeksi tingkat tinggi, menengah, dan
rendah (Spicer, 2008).
Tabel 2.1 Daya Hambat Disinfeksi terhadap Mikroorganisme
commit to user b. Metode Sterilisasi dan Disinfeksi
Sterilisasi dapat dilakukan dengan tiga metode yaitu secara fisika,
mekanik, dan kimia. Sterilisasi secara fisika dilakukan dengan pemanasan
dan radiasi, sterilisasi mekanik dilakukan dengan filtrasi, sedangkan
sterilisasi kimia dilakukan dengan cairan disinfektan (Goering et al.,
2008; Spicer, 2008; Levinson, 2010).
1) Sterilisasi Fisika
a) Pemanasan
Sterilisasi panas bekerja dengan prinsip mendenaturasi protein
sel dan asam nukleat serta merusak membran sel. Sterilisasi panas
dapat dilakukan dengan tiga cara yaitu panas basah (merebus dan
autoklaf), panas kering, dan pasteurisasi (Madigan dan Martinko,
2006; Bauman et al., 2011).
Sterilisasi panas basah dengan merebus pada suhu 100oC
selama 2-3 menit dapat membunuh semua bakteri kecuali bentuk
spora. Agar dapat membunuh spora, diperlukan suhu yang lebih
tinggi. Untuk itu digunakan teknik sterilisasi panas basah
bertekanan dengan autoklaf. Penguapan dengan autoklaf dapat lebih
cepat membunuh bakteri karena uap dapat menyebarkan panas ke
semua bagian tabung sterilisasi. Uap dipertahankan selama 15 menit
pada tekanan 15 lb/sq di atas tekanan atmosfer untuk mencapai suhu
121oC sehingga dapat membunuh spora (Tortora et al., 2007;
commit to user
Sterilisasi panas kering dilakukan untuk bahan yang harus
tetap kering dengan oven listrik untuk mengedarkan panas. Karena
panas kurang efektif untuk bahan kering, dibutuhkan suhu
160-170oC dengan waktu 1 jam atau lebih untuk proses sterilisasi
(Brooks et al., 2008; Goering et al., 2008).
Pasteurisasi digunakan untuk sterilisasi larutan seperti susu
pada suhu 62,8-65,6oC selama 30 menit atau pada suhu 71,7oC
selama 15 detik dengan segera diikuti pendinginan pada suhu di
bawah 10oC. Tindakan ini ditujukan untuk menekan pertumbuhan
bakteri. Sterilisasi larutan digunakan untuk membunuh sel vegetatif
dalam susu tetapi tidak untuk mencapai keadaan steril (Madigan dan
Martinko, 2006; Levinson, 2010).
b) Radiasi
Radiasi dapat menggunakan sinar ultraviolet (UV) dan
sinar-X. Aktivitas antimikroba untuk membunuh mikroorganisme yang
ditransmisikan melalui udara membutuhkan sinar-UV dengan
panjang gelombang 250 sampai 260 nm. Sinar-X memiliki kekuatan
penetrasi lebih kuat dibandingankan sinar-UV dan dapat
menyebabkan perubahan DNA sehingga terjadi mutasi dan
kematian sel (Bauman et al., 2011).
2) Sterilisasi Mekanik
Sterilisasi secara mekanik dilakukan dengan cara filtrasi. Filtrasi
commit to user
penyaring yang memiliki pori-pori kecil untuk menahan
mikroorganisme dengan ukuran tertentu. Saringan akan tercemar,
sedangkan cairan atau gas yang melaluinya akan steril (Goering et al.,
2008). Filtrasi biasanya menggunakan nitroselulosa dengan ukuran
pori-pori 0,22 µm. Ukuran ini hanya akan menjaring semua bakteri
dan spora sehingga cairan atau gas yang disaring masih mengandung
mikoplasma dan virus (Tortora et al., 2007; Spicer, 2008).
3) Sterilisasi Kimia
Sterilisasi kimia dengan disinfektan bekerja dengan tiga macam
mekanisme yaitu merusak membran atau dinding sel, memodifikasi
protein, atau memodifikasi asam nukleat (Brooks et al., 2004;
Levinson, 2010).
a) Merusak membran atau dinding sel
Membran sel bekerja sebagai sawar yang selektif yaitu
memungkinkan beberapa zat terlarut untuk melewatinya dan
menahan zat lainnya. Senyawa yang ditranspor secara aktif melalui
membran akan terkonsentrasi dalam sel. Membran juga merupakan
tempat enzim yang terlibat dalam biosintesis komponen selubung
sel. Zat yang terkumpul di permukaan sel dapat mengubah sifat
fisika dan kimia membran. Hal ini menyebabkan membran tidak
dapat berfungsi dengan normal sehingga akan membunuh atau
commit to user
Dinding sel bekerja sebagai struktur pemberi bentuk sel dan
melindungi sel terhadap lisis osmosis. Oleh karena itu, berbagai
agen yang menghancurkan dinding atau mencegah sintesis
normalnya dapat menimbulkan lisis sel (Brooks et al., 2008).
Beberapa disinfektan yang bekerja dengan prinsip merusak
membran dan dinding sel antara lain:
(1) Alkohol
Etanol digunakan untuk membersihkan kulit sebelum
imunisasi dan pungsi vena. Etanol akan lebih optimal apabila
dicampur air dan paling baik dalam konsentrasi 70% (Goering et
al., 2008, Levinson, 2010).
(2) Deterjen
Deterjen merupakan senyawa organik yang dapat
berikatan dengan air dan molekul organik non-polar. Molekul
deterjen memiliki satu ujung hidrofilik yang dapat bercampur
dengan air dan satu ujung hidrofobik yang dapat menempel pada
lemak di membran sel organisme. Ikatan tersebut akan
menyebabkan membran sel menjadi rusak (Levinson, 2010).
(3) Fenol
Fenol merupakan disinfektan tingkat menengah dan
rendah yang dapat mendenaturasi protein dan merusak membran
commit to user
b) Memodifikasi protein
Protein memiliki bentuk tiga dimensi dan berlipat-lipat yang
ditentukan ikatan disulfida kovalen intramolekul dan sejumlah
ikatan nonkovalen seperti ikatan ion, hidrofobik, dan hidrogen.
Ikatan tersebut mudah terganggu oleh sejumlah agen kimia dan fisik
yang menyebabkan terjadi perubahan bentuk protein dan protein
menjadi tidak berfungsi. Adanya perubahan bentuk dan hilangnya
fungsi protein disebut sebagai denaturasi (Brooks et al., 2008).
Beberapa disinfektan yang bekerja dengan prinsip
memodifikasi protein antara lain:
(1) Klorin
Klorin dikenal sebagai deodoran dan disinfektan yang
sangat baik untuk pemurnian air minum dan kolam renang.
Senyawa hipoklorit paling banyak dipakai untuk tujuan
disinfeksi dan menghilangkan bau di rumah dan rumah sakit. Di
rumah sakit klorin dipakai untuk disinfeksi ruangan, permukaan,
serta alat non-bedah. Klorin berikatan dengan gugus sulfhidril
pada protein sehingga menyebabkan denaturasi protein
(Levinson, 2010).
(2) Iodin
Iodin dalam air maupun dalam alkohol merupakan
antiseptik kulit paling efektif digunakan dalam tindakan
commit to user
merupakan oksidan yang menginaktivasi sulfhidril pada enzim
(Tortora et al., 2007).
(3) Derivat logam berat
Logam berat berperan sebagai antimikroba karena dapat
mempresipitasi enzim atau protein esensial lain dalam sel
dengan cara berikatan dengan gugus sulfhidril. Logam berat
yang umum digunakan adalah Hg, Ag, As, Zn, dan Cu. Logam
berat yang paling sering digunakan dalam bidang kesehatan dan
memiliki aktivitas antibakteri paling besar adalah merkuri dan
silver (Tortora et al., 2007).
(4) Hidrogen peroksida
Hidrogen peroksida akan terurai menjadi air dan oksigen
apabila dipanaskan. Selama pembentukan oksigen, dibentuk
pula radikal superoksida (O2-) yang akan bereaksi dengan
kompleks bermuatan negatif di dalam protein yang selanjutnya
akan menginaktivasi enzim. Hidrogen peroksida mempunyai
aktivitas spektrum luas melawan virus, bakteri, ragi, dan spora
bakteri. Aktivitas sporisidal memerlukan konsentrasi H2O2 yang
lebih tinggi (10-30%) dan waktu kontak yang lebih lama
(Brooks et al., 2008).
(5) Formaldehid dan glutaraldehid
Glutaraldehid digunakan untuk disinfeksi endoskopi dan
commit to user
glutaraldehid 2% untuk mencapai aktivitas sporisidal.
Formaldehid bersifat bakterisidal, sporisidal, dan virusidal
(Brooks et al., 2008; Goering et al., 2008).
(6) Etilen oksida
Gas etilen oksida digunakan untuk sterilisasi alat
kedokteran yang peka terhadap panas seperti plastik, karet, dan
alat-alat bedah (Goering et al., 2008, Spicer, 2008).
(7) Asam dan basa
Asam dan basa kuat bekerja dengan cara mendenaturasi
protein. Asam lemah seperti asam benzoat, asam propionat, dan
asam sitrat digunakan pada makanan karena bersifat
bakteriostatik (Levinson, 2010).
c) Memodifikasi asam nukleat
Sejumlah agen antimikroba bekerja dengan cara merusak
DNA. Berbagai agen pengalkil dan senyawa lain bereaksi secara
kovalen dengan basa pirin dan pirimidin sehingga bergabung
dengan DNA atau membentuk ikatan silang antaruntai. Lesi DNA
yang diinduksi secara kimia akan membunuh sel terutama dengan
cara menganggu replikasi DNA (Brooks et al., 2008). Salah satu
disinfektan yang bekerja dengan cara memodifikasi DNA adalah
kristal violet (gentian violet) yang digunakan untuk antiseptik kulit
commit to user 2. Endoskopi Saluran Cerna
a. Pengertian Endoskopi
Endoskopi merupakan gabungan dua kata dari bahasa Yunani yaitu
endon yang berarti di dalam dan skopeo yang berarti melihat pada
sesuatu. Maka, endoskopi dapat diartikan sebagai peralatan untuk melihat
rongga tubuh dan organ dalam. Endoskopi adalah sebuah pipa panjang,
pipih, dan fleksibel yang dilengkapi dengan lampu dan sebuah kamera di
ujungnya. Kamera tersebut mengambil gambar dari organ dalam tubuh
dan akan ditampilkan di layar televisi (Cotton dan Williams, 2008;
Schwab dan Singh, 2010). Beberapa macam variasi endoskopi dapat
dilihat dalam tabel 2.2.
Tabel 2.2 Variasi Endoskopi
Sistem tubuh
Nama endoskopi Organ tubuh yang dilihat
Gastro-intestinal
Oesophagogastro- duodenoskopi (OGD)
Oesophagus, gaster, duodenum
Enteroskopi Duodenum, jejunum, ileum
Kolonoskopi Colon, ileum bagian distal
Sigmoidoskopi Sigmoid colon, rectum
Endoskopik ultrasound (EUS) Sistem pencernaan atas dan saluran empedu
Sistem biliaris Endoscopic retrograde cholangiopancreato-graphy (ERCP)
Pancreas, ductus biliaris, ductus hepaticus
Koledokoskopi Ductus biliaris
Respirasi Bronkoskopi Trachea, bronchus
THT Rhinoskopi Hidung
Laryngoskopi Larynx
Urologi Cystoskopi Urethra, vesica urinaria
Uretroskopi Ureter
Ginekologi Histeroskopi Uterus
Falloskopi Tuba fallopii
commit to user b. Bagian Endoskopi
Secara umum semua endoskopi memiliki bagian yang sama.
Perbedaan pada masing-masing endoskopi disebabkan oleh panjang,
diameter, kekakuan dari tabung insersi, nomor dan ukuran instrumen
tambahan, serta konfigurasi dari ujung distal tabung insersi yang berbeda.
Perbedaan ini mempengaruhi ergonomi, kedalaman endoskopi dapat
dimasukkan, ukuran, serta tipe aksesoris yang dapat digunakan di
endoskopi (Bosco et al., 2003; Varadarajulu et al., 2011).
1) Bagian Kontrol
Bagian kontrol dipegang dengan tangan kiri. Bagian ini memiliki
dua tombol untuk menentukan arah yaitu ke atas atau bawah dan ke
kiri atau kanan. Tombol ini dapat dikunci pada posisi tertentu. Bagian
kontrol juga dilengkapi katup untuk biopsi serta menghisap udara atau
air di bagian depan atas. Terdapat tombol untuk menangkap gambar di
bagian atas. Bagian ini juga dihubungkan dengan instrumen di bagian
depan bawah (Bosco et al., 2003; Schwab dan Singh, 2010;
Varadarajulu et al., 2011)
2) Tabung Insersi
Tabung insersi merupakan bagian yang masuk ke dalam tubuh
pasien dan terpasang dengan bagian kontrol. Panjang, diameter, dan
kekakuan dari tabung insersi berbeda-beda di setiap model. Tabung
insersi terdiri dari satu/dua saluran instrumen, satu/dua serat optik
commit to user
Kabel angulasi akan membelokkan bagian lentur dari tabung insersi
hingga defleksi maksimum antara 180-230o (Bosco et al., 2003;
Varadarajulu et al., 2011).
Ujung tabung insersi berisi perangkat untuk pembangkit warna
gambar, cahaya, saluran terbuka untuk udara dan air, air untuk
membersihkan lensa, dan lensa objektif. Lensa ini dapat mengambil
gambar di depan, samping, dan bersilangan tergantung dengan tipe
endoskopi (Varadarajulu et al., 2011).
3) Bagian Konektor
Bagian konektor dari endoskopi terdiri dari penunjuk cahaya,
saluran udara, dan kontak listrik dengan sumber cahaya atau prosesor.
Bagian ini menghubungkan endoskopi dengan monitor, sumber listrik
dan cahaya, sumber udara atau CO2, dan kontainer air (Bosco et al.,
2003; Varadarajulu et al., 2011).
c. Penggunaan Endoskopi Saluran Cerna
Endoskopi saluran cerna dapat digunakan sebagai alat untuk
diagnosis, surveilans, biopsi, skrining, dan terapi. Endoskopi saluran
cerna digunakan dalam diagnosis gejala seperti dispepsia, disfagia,
anoreksia, dan lain-lain. Sebagai fungsi surveilans, endoskopi saluran
cerna digunakan untuk mengklarifikasi status dari penyakit yang telah
diketahui seperti varises, Barett’s esophagus, atau setelah polipektomi dan
operasi kanker. Endoskopi saluran cerna juga dapat digunakan untuk
commit to user
malabsorbsi. Untuk skrining sistem pencernaan bagian atas, endoskopi
saluran cerna dapat digunakan untuk skrining keganasan pada pasien
yang diduga memiliki risiko kanker seperti pada familial adenomatous
polypopsis. Alat ini juga digunakan sebagai terapi pada hemostatis,
dilatasi, polipektomi, gastrotomi, maupun hemoragi (Cotton dan
Williams, 2008; Jechart dan Messmann, 2008; Schwab dan Singh, 2010).
d. Efek Samping Prosedur Endoskopi Saluran Cerna
Beberapa komplikasi utama penggunaan endoskopi saluran cerna
bagian atas meliputi masalah cardiopulmonary (aspirasi, depresi respirasi,
hipotensi, aritmia), perforasi, perdarahan, dan injuri pada gigi.
Penggunaan endoskopi pada sistem pencernaan bagian bawah memiliki
risiko komplikasi berupa perdarahan (0,2-2,1%), perforasi (≤0,1%), rasa
tidak nyaman pada abdomen (5,4%), dan infeksi (0,2%) (Schwab dan
Singh, 2010; Varadarajulu et al., 2011).
3. Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna
a. Prosedur Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna
Proses sterilisasi dan disinfeksi pada peralatan medis berbeda-beda
sesuai dengan tingkat risikonya. Peralatan medis dikategorikan dalam tiga
klasifikasi yaitu berisiko tinggi (critical), menengah (semi-critical), dan
rendah (non-critical). Peralatan medis yang berisiko tinggi merupakan
peralatan yang kontak langsung dengan jaringan atau darah sehingga
membutuhkan keadaan steril melalui proses sterilisasi. Peralatan medis
commit to user
membran mukosa atau kulit yang tidak intak dan membutuhkan teknik
disinfeksi tingkat tinggi. Peralatan yang berisiko rendah merupakan
peralatan yang hanya kontak dengan kulit yang utuh sehingga cukup
dilakukan teknik disinfeksi tingkat rendah. Berdasarkan risiko tersebut,
endoskopi saluran cerna termasuk dalam peralatan medis dengan risiko
menengah sehingga membutuhkan teknik disinfeksi tingkat tinggi (Cotton
dan Williams, 2008; Spicer, 2008).
Proses disinfeksi tingkat tinggi endoskopi saluran cerna dibedakan
menjadi tiga tahap. Ketiga tahap tersebut yaitu: 1) sebelum proses,
meliputi pencucian manual; 2) proses, berupa teknik disinfeksi tingkat
tinggi dan pembilasan; 3) setelah proses, berupa pengeringan dan
penyimpanan (Spaun et al., 2010).
1) Pencucian
Pencucian secara manual dilakukan pada permukaan bagian
dalam dan bagian luar. Mula-mula endoskopi saluran cerna direndam
dan dibilas untuk menghilangkan kotoran, darah, maupun jaringan
yang menempel. Proses pencucian meliputi menyikat bagian dalam
dan membilas dengan air dan deterjen atau pembersih yang
mengandung enzim. Pencucian merupakan langkah utama sebelum
disinfeksi secara manual maupun otomatis. Penyikatan endoskopi
saluran cerna dilakukan menggunakan kain lembut, spon, atau sikat
sampai tidak terdapat sisa kotoran pada sikat (Rutala dan Weber, 2004;
commit to user
2) Disinfeksi Tingkat Tinggi
Endoskopi saluran cerna direndam dalam cairan disinfektan
untuk proses disinfeksi tingkat tinggi dalam waktu tertentu. Semua
bagian endoskopi dipastikan harus terpapar dengan cairan disinfektan.
Menurut Food and Drug Administration (FDA), disinfektan yang bisa
digunakan untuk endoskopi saluran cerna antara lain glutaraldehid,
glutaraldehid dengan fenol, orto-phthalaldehid, hidrogen peroksida,
asam parasetik, dan penggunaan hidrogen peroksida dan asam
parasetik sekaligus (Food and Drug Administration, 2003).
Glutaraldehid dengan konsentrasi lebih dari 2,4% merupakan
disinfektan yang paling banyak digunakan. Glutaraldehid digunakan
pada suhu 25oC dengan waktu perendaman 45 menit. Beberapa
prosedur menyebutkan penggunaan glutaraldehid dapat dilakukan
selama 20 menit pada suhu 20oC (Greenwald, 2007).
3) Pembilasan
Endoskopi saluran cerna dibilas dengan air steril atau air yang
telah melalui proses filtrasi menggunakan filter dengan ukuran 0,2 µm.
Kemudian dilanjutkan dengan pembilasan menggunakan 70-90% etil
atau isopropil alkohol. Pembilasan dilakukan untuk menghilangkan
cairan disinfektan pada endoskopi saluran cerna dan mengurangi
commit to user
4) Pengeringan
Endoskopi saluran cerna dikeringkan dengan udara bertekanan
setelah disterilisasi dan sebelum disimpan. Pengeringan merupakan
salah satu cara untuk mencegah transmisi penyakit melalui air akibat
adanya air yang menggenang di endoskopi saluran cerna (Rutala dan
Weber, 2004; Greenwald, 2007).
5) Penyimpanan
Endoskopi saluran cerna disimpan dalam lemari yang terjaga dari
kontaminasi. Endoskopi saluran cerna digantung dengan posisi vertikal
untuk membantu proses pengeringan (Rutala dan Weber, 2004;
Greenwald, 2007).
Endoskopi saluran cerna harus dalam keadaan steril apabila
digunakan dalam proses operasi, meskipun secara umum endoskopi
saluran cerna hanya membutuhkan teknik disinfeksi tingkat tinggi.
Untuk mencapai keadaan steril diperlukan prosedur tambahan dalam
proses disinfeksi tingkat tinggi endoskopi saluran cerna. Setelah
dilakukan disinfeksi tingkat tinggi, endoskopi saluran cerna dikirim ke
bagian sterilisasi alat operasi untuk dilakukan proses sterilisasi.
Endoskopi saluran cerna yang telah disterilisasi kemudian diletakkan
dalam kontainer steril tertutup dan dibawa ke ruang operasi. Peralatan
aksesoris seperti botol air dan tabung harus melalui proses autoklaf
commit to user
b. Prosedur Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna RSUD Dr. Moewardi
Prosedur disinfeksi tingkat tinggi endoskopi saluran cerna RSUD
Dr. Moewardi memiliki tujuan untuk menghilangkan kotoran, darah,
lendir, dan sisa bekuan protein yang melekat pada endoskopi saluran
cerna baik yang di dalam lumen maupun di luar lumen sehingga bebas
dari mikroorganisme. Proses ini tidak hanya bersih, tetapi mampu
membunuh bakteri, virus/fungi, dan parasit serta mikroorganisme baik
secara kimiawi maupun mekanik.
Skop endoskopi saluran cerna dapat didisinfeksi dengan cairan
disinfektan tingkat tinggi, yaitu cairan yang mempunyai spektrum luas
dalam aktivitasnya untuk membunuh bakteri serta virus dalam beberapa
menit. Tahap disinfeksi tingkat tinggi endoskopi saluran cerna yang
dilakukan di RSUD Dr. Moewardi meliputi pembersihan secara manual,
pembilasan, disinfeksi, pembilasan akhir, pengeringan, dan penyimpanan.
Prosedur tersebut lebih lanjut dapat dilihat pada lampiran 1.
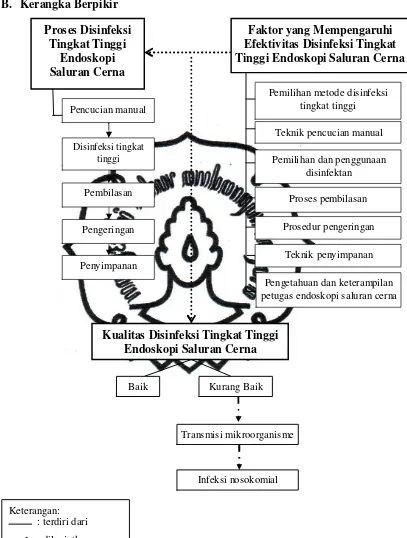
c. Faktor yang Mempengaruhi Efektivitas Disinfeksi Tingkat Tinggi Endoskopi Saluran Cerna
Menurut Association for Professionals in Infection Control and
Epidemiology (APIC), infeksi eksogen di endoskopi saluran cerna
berkaitan dengan proses disinfeksi tingkat tinggi (Association for
Professionals in Infection Control and Epidemiology, 2011). Hal ini
commit to user
Beberapa faktor yang mempengaruhi efektivitas disinfeksi tingkat
tinggi endoskopi saluran cerna adalah sebagai berikut:
1) Pemilihan Metode Disinfeksi Tingkat Tinggi
Pemilihan metode disinfeksi tingkat tinggi dengan mesin
otomatis dapat mengurangi kemungkinan terjadinya transmisi hingga
11% keluhan dibandingkan dengan metode disinfeksi tingkat tinggi
secara manual yaitu 67% atau semi-otomatis yaitu 60%. Hal ini
dikarenakan mesin otomatis memiliki validasi untuk volume dan
tekanan air, suhu, pH, waktu paparan dan, dosis disinfektan, sedangkan
metode manual tidak memiliki standar yang pasti (Zuhlsdorf et al.,
2002). Penggunaan mesin otomatis juga tetap dapat menjadi masalah
apabila proses awal secara mekanik seperti predisinfeksi, pencucian,
pembilasan, maupun pemasangan dan pelepasan alat tidak sesuai
prosedur (Martiny et al., 2004).
2) Teknik Pencucian Manual
Pencucian merupakan cara efektif untuk mengurangi
mikroorganisme. Teknik pencucian yang tidak menyeluruh dapat
menjadi penyebab transmisi penyakit, misalnya tidak membersihkan
tabung bagian dalam, tanpa deterjen, tidak diulang hingga 2 atau 3
kali, tidak memastikan bahwa semua bagian endoskopi saluran cerna
terendam dalam deterjen, atau tidak mengalirkan deterjen ke dalam
commit to user
3) Pemilihan dan Penggunaan Disinfektan
Pemilihan disinfektan yang digunakan untuk proses disinfeksi
tingkat tinggi sangat mempengaruhi kondisi endoskopi saluran cerna.
Setiap unit memiliki kebijakan untuk menentukan disinfektan yang
akan digunakan. Setiap disinfektan tersebut memiliki kelebihan dan
kekurangan masing-masing seperti yang dijelaskan dalam tabel 2.3.
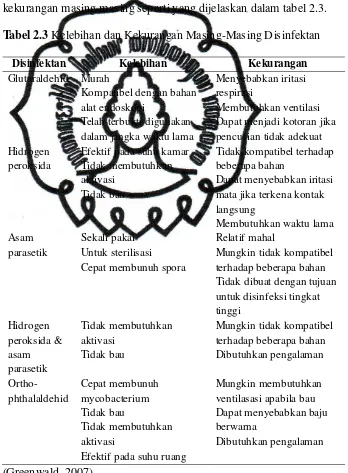
Tabel 2.3 Kelebihan dan Kekurangan Masing-Masing Disinfektan
Disinfektan Kelebihan Kekurangan
commit to user
Selain pemilihan disinfektan yang digunakan, teknik yang
diterapkan dalam proses disinfeksi tingkat tinggi juga mempengaruhi
efektivitas disinfeksi tingkat tinggi. Cara penggunaan disinfektan yang
dapat menyebabkan proses disinfeksi tingkat tinggi menjadi tidak
efektif antara lain tidak memastikan bahwa semua bagian endoskopi
saluran cerna terendam disinfektan dan waktu perendaman yang terlalu
singkat (Barbosa et al., 2010).
4) Proses Pembilasan
Hanya mencuci bagian luar dan tidak membilas bagian dalam
menjadi salah satu penyebab proses disinfeksi tingkat tinggi endoskopi
saluran cerna menjadi tidak efektif (Barbosa et al., 2010). Air yang
digunakan untuk membilas dalam metode disinfeksi tingkat tinggi
mesin otomatis juga dapat menjadi masalah tersendiri. Air yang
digunakan seperti air kran merupakan air yang tidak bebas kuman. Air
tersebut dapat menjadi media pertumbuhan bakteri sehingga
menyebabkan kontaminasi ulang pada endoskopi saluran cerna
(MacKay et al., 2002).
5) Prosedur Pengeringan
Proses pengeringan dapat mempengaruhi efektivitas disinfeksi
tingkat tinggi endoskopi saluran cerna. Penggunaan bahan pengeringan
maupun cara pengeringan hanya mengeringkan bagian luar dan tidak
menggunakan udara bertekanan menjadi penyebab proses disinfeksi
commit to user
6) Teknik Penyimpanan
Menurut Czech Hygiene Authorities, endoskopi saluran cerna
yang telah disimpan selama 12 jam harus dilakukan proses disinfeksi
tingkat tinggi ulang (Czech Hygiene Authorities, 1999). Kondisi almari
yang tidak kering, tidak bersih, dan tidak didesain dengan ventilasi
khusus, maupun peletakan endoskopi saluran cerna tidak dalam
keadaan vertikal dapat menjadi penyebab lain proses disinfeksi tingkat
tinggi menjadi tidak efektif (Pineau et al., 2008).
7) Pengetahuan dan Keterampilan Petugas Endoskopi Saluran Cerna
Petugas yang melakukan tindakan dengan endoskopi saluran
cerna maupun melakukan proses disinfeksi tingkat tinggi harus
memiliki kompetensi dan pengetahuan mengenai penggunaan bahan
kimia terkait biologis, kimia, dan lingkungan. Setiap petugas yang
melakukan tindakan dengan endoskopi saluran cerna hendaknya
memakai peralatan sebagai proteksi seperti sarung tangan, jas lab,
penutup mata, dan masker. Petugas yang tidak melakukan proteksi diri
dapat menjadi salah satu jalur transmisi penyakit (Barbosa et al.,
commit to user B. Kerangka Berpikir
Gambar 2.1 Skema Kerangka Pikir
commit to user C. Hipotesis
Proses disinfeksi tingkat tinggi endoskopi saluran cerna RSUD Dr.
commit to user BAB III
METODE PENELITIAN
A.Jenis Penelitian
Jenis penelitian ini merupakan penelitian observasional dengan
pendekatan cross sectional yaitu suatu pendekatan dimana observasi hanya
dilakukan satu kali pada saat yang sama (Taufiqurrohman, 2008).
B.Lokasi dan Waktu Penelitian
Lokasi penelitian dilakukan di RSUD Dr. Moewardi dan Laboratorium
Mikrobiologi Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
Penelitian dilaksanakan pada bulan April-Mei 2012.
C.Subjek Penelitian
1. Populasi
Populasi penelitian ini adalah endoskopi saluran cerna RSUD Dr.
Moewardi setelah dilakukan proses disinfeksi tingkat tinggi baik melalui
proses penyimpanan 24 jam maupun tanpa melalui proses penyimpanan.
2. Besar Sampel
Besar ukuran sampel dalam penelitian ini yaitu sebanyak 30 subjek
penelitian. Penentuan ini berdasarkan beberapa pertimbangan termasuk
biaya, tenaga, dan waktu.
D.Teknik Sampling
Pengambilan sampel penelitian ini menggunakan teknik convenience
sampling, yaitu pengambilan sampel tanpa didasari sistematika tertentu.
commit to user
Sampel diambil karena terjangkau untuk dijadikan subjek dalam penelitian
hingga mendapatkan jumlah sampel yang dibutuhkan (Taufiqurrohman, 2008).
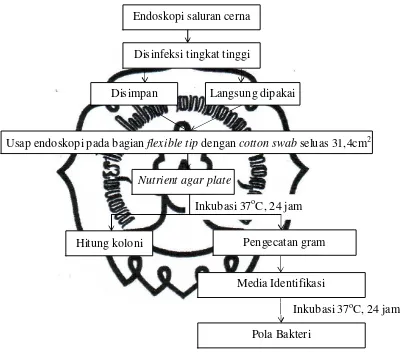
E.Rancangan Penelitian
Gambar 3.1 Skema Rancangan Penelitian
F.Identifikasi Variabel Penelitian
1. Variabel Bebas : Disinfeksi tingkat tinggi endoskopi saluran cerna
2. Variabel Terikat : Jumlah dan pola bakteri
3. Variabel Luar :
a. Terkendali : Suhu inkubasi
b. Tak terkendali : Kualitas udara, suhu ruangan, kelembaban udara
Inkubasi 37oC, 24 jam Endoskopi saluran cerna
Usap endoskopi pada bagian flexible tip dengan cotton swab seluas 31,4cm2
Pengecatan gram Disinfeksi tingkat tinggi
Inkubasi 37oC, 24 jam
Media Identifikasi
Pola Bakteri
Nutrient agar plate
Hitung koloni
commit to user G.Definisi Operasional Varibel Penelitian
1. Disinfeksi Tingkat Tinggi
Disinfeksi tingkat tinggi yang dimaksud dalam penelitian ini adalah
disinfeksi tingkat tinggi endoskopi saluran cerna yang sesuai dengan Standar
Operasional Prosedur (SOP) disinfeksi tingkat tinggi endoskopi saluran
cerna di RSUD Dr. Moewardi. Disinfeksi tingkat tinggi tersebut dibedakan
menjadi dua kelompok yaitu dengan melalui proses penyimpanan selama 24
jam maupun tanpa melalui proses penyimpanan.
Skala : Nominal
Kategori : a. Disinfeksi tingkat tinggi endoskopi saluran cerna dengan proses
penyimpanan 24 jam.
b. Disinfeksi tingkat tinggi endoskopi saluran cerna tanpa
melalui proses penyimpanan.
2. Jumlah Bakteri
Jumlah bakteri dihitung dari ada tidaknya koloni bakteri pada hasil
usapan endoskopi saluran cerna RSUD Dr. Moewardi.
Skala : Nominal
Kategori : a. Ada bakteri
b. Tidak ada bakteri
3. Pola Bakteri
Pola bakteri dilihat apabila ditemukan koloni bakteri dari hasil usapan
commit to user H.Alat dan Bahan Penelitian
Dalam penelitian ini, alat dan bahan yang diperlukan adalah sebagai
berikut: 1) Tabung reaksi; 2) Cotton swab; 3) Sarung tangan steril; 4) Masker;
5) Inkubator; 6) Oshe jarum; 7) Oshe kolong; 8) Pipet; 9) Cawan petri; 10)
Object glass, 11) Cat Gram; 12) Rak tabung; 13) Mikroskop; 14) Lampu
spiritus; 15) NaCl; 16) Nutrient agar plate; 17) Media identifikasi.
I. Cara Kerja
1. Pengambilan Sampel
Sampel diambil dari usap endoskopi saluran cerna. Usap dilakukan
terhadap endoskopi saluran cerna yang sudah disimpan selama 24 jam
maupun endoskopi saluran cerna yang langsung dipakai ulang tanpa proses
penyimpanan. Usapan dilakukan menggunakan kapas lidi steril pada bagian
flexible tip seluas 31,4cm2. Setelah itu sampel ditanam di Nutrient agar plate
dan diinkubasi selama 24 jam pada suhu 37oC.
2. Penghitungan Koloni
Apabila terdapat pertumbuhan bakteri, koloni bakteri yang ditemukan
di Nutrient agar plate dihitung secara manual.
3. Pengecatan Gram
Bila terdapat pertumbuhan bakteri di media pertumbuhan, dilanjutkan
proses pewarnaan Gram untuk mengetahui sifat bakteri apakah termasuk
commit to user
4. Identifikasi Bakteri
Bakteri yang telah diketahui sifat Gramnya dilakukan identifikasi.
Bakteri Gram negatif dapat ditanam di media KIA, SIM, Urea agar, dan
Simon Citrat. Bakteri Gram positif dapat dilakukan uji katalase dan
koagulase, serta penanaman di media MSA khususnya untuk Staphylococcus
sp, sedangkan bakteri batang Gram positif tidak dilakukan identifikasi.
Setelah penanaman, media identifikasi diinkubasi selama 24 jam pada suhu
37oC dan diidentifikasi berdasarkan sifat-sifat biokimianya (Brooks, 2008).
J. Teknik Analisis Data
Analisis data dilakukan secara deskriptif dan analitik. Analisis deskriptif
dilakukan untuk menggambarkan keseluruhan data yang diteliti. Analitik
dilakukan menggunakan uji Chi Square yang diolah dengan program Statistical
Program for Social Science (SPSS) versi 17 untuk mengetahui hubungan
efektivitas disinfeksi tingkat tinggi endoskopi saluran cerna setelah
commit to user BAB IV
HASIL PENELITIAN
Pada penelitian ini sampel diambil dari usap endoskopi saluran cerna RSUD
Dr. Moewardi yang telah mengalami proses disinfeksi tingkat tinggi. Jumlah
sampel yang diambil yaitu sebanyak 30 sampel. Sampel tersebut dibedakan
menjadi dua kelompok yaitu 14 sampel usap endoskopi saluran cerna setelah
disinfeksi tingkat tinggi serta mengalami proses penyimpanan 24 jam, dan 16
sampel usap endoskopi saluran cerna setelah disinfeksi tingkat tinggi tanpa
melalui proses penyimpanan.
Tabel 4.1 Sebaran Sampel Menurut Sumber Pengambilan Sampel
Usap endoskopi saluran cerna N %
Tanpa penyimpanan 16 53,3
Setelah penyimpanan 24 jam 14 46,6
Total 30 100
Tabel 4.1 menunjukkan sebaran sampel menurut sumber pengambilan.
Perbedaan sumber pengambilan memiliki hubungan dengan pertumbuhan bakteri.
Hubungan antara sumber pengambilan sampel dengan pertumbuhan bakteri diuji
menggunakan uji Chi Square seperti pada tabel 4.2.
commit to user
Tabel 4.2 Sebaran Sampel Menurut Pertumbuhan Bakteri
Pertumbuhan bakteri
tanpa penyimpanan terdapat 13 sampel disinfeksi tingkat tinggi efektif dan 3
sampel tidak efektif. Pada usap endoskopi saluran cerna setelah penyimpanan dari
14 sampel didapatkan 3 sampel efektif dan 11 sampel tidak efektif. Hasil dari
tabel 4.2 memenuhi syarat untuk dilakukan uji Chi Square dengan rancangan tabel
2 x 2 karena tidak ada nilai expected yang kurang dari 5.
Hasil analisis Chi Square menunjukkan nilai p value < 0,005. Nilai yang
dipakai adalah nilai Pearson Chi Square yaitu 0,001. Oleh karena itu dapat
disimpulkan bahwa terdapat hubungan bermakna antara penyimpanan endoskopi
saluran cerna selama 24 jam dengan efektivitas disinfeksi tingkat tinggi endoskopi
saluran cerna RSUD Dr. Moewardi.
Hasil penghitungan OR menunjukkan nilai OR adalah 15,9 dengan IK 95%
2,7 – 95,2 yang berarti OR dapat terletak antara 2,7 – 95,2. Dengan demikian,
commit to user
mengalami penyimpanan 24 jam akan memiliki risiko 15,9 kali lebih besar untuk
ditemukan pertumbuhan bakteri.
Pada sampel ditemukan pertumbuhan jumlah jenis bakteri yang berbeda.
Sebaran sampel berdasarkan jumlah jenis bakteri dapat dilihat pada tabel 4.3.
Tabel 4.3 Sebaran Sampel Positif Menurut Jumlah Jenis Bakteri
Jumlah jenis bakteri
Usap endoskopi saluran cerna Total
Tanpa penyimpanan Setelah penyimpanan ∑ %
Tunggal 3 8 11 78,6%
Campuran 0 3 3 21,4%
14 100%
Tabel 4.3 memperlihatkan pada 3 sampel positif usap endoskopi saluran
cerna tanpa penyimpanan ditemukan jenis bakteri tunggal tanpa ada bakteri
campuran. Jenis bakteri campuran ditemukan pada sampel usap endoskopi saluran
cerna setelah penyimpanan yaitu sebanyak 3 sampel dan jenis bakteri tunggal
sebanyak 8 sampel dari total 11 sampel positif. Dengan demikian dari 14 sampel
positif ditemukan 11 sampel dengan jenis bakteri tunggal yaitu sebanyak 78,6%
dan 3 sampel dengan jenis bakteri campuran yaitu sebanyak 21,4%.
Selanjutnya dilakukan proses pengecatan Gram dari koloni bakteri yang
ditemukan untuk mengetahui sifat Gram positif atau negatif. Sebaran sifat bakteri
commit to user
Tabel 4.4 Sebaran Sampel Positif Menurut Pengecatan Gram
Pengecatan Gram
Usap endoskopi saluran cerna Total
Tanpa penyimpanan Setelah penyimpanan ∑ %
Positif 3 11 14 100%
Negatif 0 0 0 0%
14 100%
Tabel 4.4 menunjukkan bahwa dari 3 sampel positif usap endoskopi saluran
cerna tanpa penyimpanan didapatkan hasil pengecatan Gram berupa bakteri Gram
positif. Pada usap endoskopi saluran cerna dengan penyimpananan didapatkan 11
sampel bakteri Gram positif dari seluruh sampel. Dengan demikian hasil
pengecatan Gram untuk sampel positif didapatkan bakteri Gram positif sebanyak
100%.
Setelah itu dilakukan uji identifikasi dari koloni bakteri yang tumbuh untuk
mengetahui spesies bakteri. Sebaran spesies bakteri yang ditemukan dapat dilihat
pada tabel 4.5.
Tabel 4.5 Sebaran Sampel Positif Menurut Spesies Bakteri
Spesies Bakteri Usap endoskopi saluran cerna
Tanpa penyimpanan Setelah penyimpanan
Bacillus sp 1 9
Staphylococcus aureus 2 2
Staphylococcus non-aureus 0 2
commit to user
Berdasarkan tabel 4.5 diketahui bahwa pada sampel positif usap endoskopi
saluran cerna tanpa penyimpanan didapatkan 1 sampel positif Bacillus sp dan 2
sampel positif Staphylococcus aureus. Pada sampel positif usapan endoskopi
saluran cerna dengan penyimpanan didapatkan 9 sampel positif Bacillus sp, 2
sampel positif Staphylococcus aureus, 2 sampel positif Staphylococcus
commit to user BAB V PEMBAHASAN
Berdasarkan data penelitian diketahui bahwa jumlah sampel yang dapat
digambarkan yaitu sebanyak 30 sampel usap endoskopi saluran cerna. Sampel
terbagi menjadi dua kelompok yaitu 14 sampel usap endoskopi saluran cerna
setelah disinfeksi tingkat tinggi serta mengalami proses penyimpanan 24 jam dan
16 sampel usap endoskopi saluran cerna setelah disinfeksi tingkat tinggi tanpa
melalui proses penyimpanan. Adanya perbedaan jumlah sampel di setiap
kelompok dipengaruhi oleh teknik pengambilan sampel yang digunakan yaitu
convenience sampling. Teknik pengambilan sampel ini dilakukan tanpa didasari
sistematika tertentu dimana sampel diambil karena terjangkau untuk dijadikan
subjek dalam penelitian hingga mendapatkan jumlah sampel yang dibutuhkan
(Taufiqurrohman, 2008).
Hasil penelitian menunjukkan bahwa dari 14 sampel usap endoskopi saluran
cerna setelah penyimpanan didapatkan 78,6% (11/14) sampel positif ditemukan
koloni bakteri. Dari 16 sampel yang diambil dari usap endoskopi saluran cerna
tanpa penyimpanan didapatkan 18,8% (3/16) sampel positif.
Secara teori, endoskopi saluran cerna merupakan alat semi-critical sehingga
membutuhkan proses disinfeksi tingkat tinggi dimana dapat menghilangkan
bakteri, virus, jamur, tanpa mampu menghilangkan spora bakteri (Cotton dan
Williams, 2008; Spicer, 2008). Ditemukannya koloni bakteri pada usap endoskopi
saluran cerna RSUD Dr. Moewardi menunjukkan bahwa proses disinfeksi tingkat
commit to user
tinggi belum mampu menghilangkan bakteri. Proses disinfeksi tingkat tinggi
dikatakan efektif apabila mampu menghilangkan mikroorganisme kecuali spora
(Zuhlsdorf et al., 2002). Dengan demikian proses disinfeksi tingkat tinggi
endoskopi saluran cerna RSUD Dr. Moewardi dapat dikatakan belum efektif.
Proses disinfeksi tingkat tinggi masih dikatakan efektif apabila yang
ditemukan hanya spora bakteri tanpa mikroorganisme yang lain. Spora lebih
resisten dibandingkan mikroorganisme lain karena dinding spora bersifat
impermeabel dan asam ribonukleat di dalam protoplasma memiliki ketahanan
yang lebih tinggi terhadap disinfektan. Spora dapat hilang apabila dilakukan
proses sterilisasi dengan panas bertekanan seperti autoklaf yaitu pada suhu di atas
100oC pada tekanan 15 lb/sq selama 15 menit (Brooks et al., 2008; Goering et al.,
2008). Karena proses disinfeksi endoskopi saluran cerna tidak menggunakan
autoklaf dan hanya sebatas disinfeksi tingkat tinggi, maka spora bakteri masih
dapat ditemukan pada endoskopi saluran cerna.
Adanya bakteri pada usap endoskopi saluran cerna dapat dipengaruhi oleh
beberapa faktor. Association for Professionals in Infection Control and
Epidemiology (APIC) menyebutkan bahwa infeksi eksogen pada endoskopi
saluran cerna dapat disebabkan oleh tidak adekuatnya pencucian manual,
disinfektan yang lemah, pembilasan, pengeringan, dan penyimpanan (Association
for Professionals in Infection Control and Epidemiology, 2011).
Dari berbagai tahapan disinfeksi tingkat tinggi, proses pencucian manual
endoskopi saluran cerna RSUD Dr. Moewardi sudah dilakukan sesuai dengan
commit to user
pembilasan sesuai prosedur memiliki kemungkinan kecil terjadinya kontaminasi
bakteri pada endoskopi saluran cerna.
Salah satu faktor yang sangat berpengaruh yaitu pemilihan disinfektan.
Proses disinfeksi tingkat tinggi endoskopi saluran cerna RSUD Dr. Moewardi
menggunakan cidex opa dengan kandungan ortho-phthalaldehid 5,75% sebagai
bahan disinfektan. Larutan ini mulai digunakan sejak RSUD Dr. Moewardi
menyediakan pelayanan endoskopi saluran cerna. Penggunaan disinfektan dengan
jenis yang sama dalam jangka waktu lama dapat menjadi penyebab resistensi
bakteri terhadap disinfektan. Ortho-phthalaldehid dapat tetap digunakan selama 2
tahun apabila disimpan pada suhu 15 – 30oC dalam keadaan masih tertutup.
Apabila botol sudah dibuka, ortho-phthalaldehid mampu bertahan hingga 75 hari
(Johnson and Johnson Company, 2010).
Adanya kontaminasi pada endoskopi saluran cerna dapat disebabkan oleh
penggunaan disinfektan dalam jangka waktu lama. Selain itu dapat dipengaruhi
oleh faktor penyimpanan yang dapat mengurangi efektivitas larutan disinfektan.
Untuk mengantisipasi adanya resistensi bakteri terhadap disinfektan yang sudah
lama digunakan dapat dilakukan penggantian disinfektan dengan memperhatikan
parameter pH dan konsentrasi. Penggunaan disinfektan tersebut dilakukan dengan
mempertimbangkan suhu dan lama paparan. Beberapa bahan disinfektan yang
biasa digunakan untuk proses sterilisasi dan disinfeksi endoskopi saluran cerna
selain ortho-phthalaldehid adalah glutaraldehid, hidrogen peroksida, asam
parasetik, dan kombinasi hidrogen peroksida dengan asam parasetik (Greenwald,
commit to user
Faktor lain yang ikut berpengaruh terhadap efektivitas disinfeksi tingkat
tinggi endoskopi saluran cerna adalah proses penyimpanan. Berdasarkan hasil uji
Chi Square diketahui bahwa terdapat hubungan yang bermakna antara angka
pertumbuhan bakteri usap endoskopi saluran cerna setelah penyimpanan 24 jam
dengan tanpa melalui proses penyimpanan. Setelah disimpan selama 24 jam
endoskopi saluran cerna dapat memiliki risiko 15,9 kali lebih besar untuk terkena
kontaminasi mikroorganisme. Tingginya angka pertumbuhan bakteri pada usap
endoskopi saluran cerna setelah penyimpanan kemungkinan disebabkan oleh
proses penyimpanan yang kurang adekuat.
Penyimpanan endoskopi saluran cerna dilakukan dengan cara
menggantungkan endoskopi saluran cerna dengan posisi vertikal dalam lemari
dengan ventilasi khusus (Rutala dan Weber, 2004; Greenwald, 2007).
Penyimpanan endoskopi saluran cerna yang tepat dapat membantu mengurangi
pertumbuhan mikroorganisme. Berdasarkan penelitian Rejchart et al. (2004)
diketahui bahwa tidak ada peningkatan jumlah kontaminasi bakteri pada
endoskopi saluran cerna setelah mengalami proses penyimpanan hingga 5 hari,
sedangkan proses penyimpanan endoskopi saluran cerna selama 24 jam di RSUD
Dr. Moewardi telah memberikan hubungan yang signifikan terhadap pertumbuhan
bakteri. Hal ini menunjukkan bahwa proses penyimpanan endoskopi saluran cerna
RSUD Dr. Moewardi belum adekuat.
Adanya bakteri setelah penyimpanan endoskopi saluran cerna RSUD Dr.
Moewardi selama 24 jam dapat dipengaruhi oleh beberapa hal. Menurut penelitian
commit to user
bersih, dan tidak didesain dengan ventilasi khusus, maupun peletakan endoskopi
tidak dalam posisi vertikal dapat mengurangi sterilitas endoskopi saluran cerna.
Gambar 5.1 Penyimpanan endoskopi saluran cerna RSUD Dr. Moewardi Penyimpanan endoskopi saluran cerna di RSUD Dr. Moewardi sudah
dilakukan dengan cara menggantung vertikal. Kondisi lemari juga sudah bersih
dan kering. Namun lemari penyimpanan belum didesain dengan ventilasi khusus.
Proses penyimpanan endoskopi saluran cerna juga dibalut dengan kassa.
Kemungkinan kassa yang digunakan bukan merupakan kassa steril dapat menjadi
salah satu faktor penyebab kontaminasi endoskopi. Oleh karena itu dibutuhkan
sarana dan prasarana yang lebih mendukung proses penyimpanan endoskopi
saluran cerna sehingga dapat menjaga efektivitas disinfeksi. Sesuai dengan
rekomendasi dari Czech Hygiene Authorities, endoskopi saluran cerna yang telah
mengalami proses penyimpanan lebih dari 12 jam dapat dilakukan proses
sterilisasi dan disinfeksi ulang sebelum digunakan pada pasien (Czech Hygiene
Authorities, 1999).
Data hasil penelitian menunjukkan bahwa dari jumlah sampel positif
commit to user
campuran pada usap endoskopi saluran cerna setelah penyimpanan. Pada usap
endoskopi saluran cerna tanpa penyimpanan didapatkan ketiga sampel positif
terdiri dari jenis bakteri tunggal. Adanya jenis bakteri campuran pada usap
endoskopi saluran cerna setelah penyimpanan kemungkinan dipengaruhi oleh
proses penyimpanan.
Semua bakteri yang ditemukan bersifat Gram positif. Hasil penelitian ini
serupa dengan hasil penelitian Alfa et al. (2011) yang melakukan penelitian
terhadap 20 sampel usap endoskopi saluran cerna. Dari 20 sampel ditemukan 18
sampel dengan bakteri Gram positif, 1 sampel Gram negatif, dan 1 jamur.
Ditemukannya bakteri Gram positif pada usap endoskopi saluran cerna
sesuai dengan teori sifat bakteri. Bakteri Gram positif memiliki lapisan
peptidoglikan yang tebal (20-80 nm). Peptidoglikan memiliki struktur
polisakarida dan asam amino yang bersifat sangat polar sehingga bakteri memiliki
lapisan hidrofilik yang tebal. Struktur ini menyebabkan bakteri bersifat resisten
terhadap asam empedu sehingga bakteri Gram positif masih dapat ditemukan di
sistem saluran pencernaan (Goering et al., 2008).
Pada usap endoskopi saluran cerna setelah penyimpanan ditemukan Bacillus
sp, Staphylococcus aureus, Staphylococcus non-aureus, dan Clostridium sp. Pada
usap endoskopi saluran cerna tanpa penyimpanan ditemukan Bacillus sp dan
Staphylococcus aureus. Ditemukannya bakteri pada endoskopi saluran cerna
RSUD Dr. Moewardi memiliki kemiripan dengan hasil penelitian yang dilakukan
Ribeiro et al. pada tahun 2004. Dalam penelitian tersebut ditemukan adanya
commit to user
Eschericia coli, Staphylococcus aureus, Klebsiella pneumoniae, Enterococcus
faecalis, Candida sp dan Pseudomonas aeruginosa (Ribeiro et al., 2004)
Bacillus sp adalah bakteri batang berspora yang bersifat Gram positif
dengan letak spora berada di tengah. Bacillus dapat bertahan lama dalam bentuk
spora yang dorman. Adanya Bacillus dalam usap endoskopi saluran cerna
dimungkinkan karena terdistribusinya spora dorman Bacillus di udara (Toy et al.,
2008).
Genus Bacillus memiliki lebih dari tujuh puluh spesies. Dua spesies penting
yang patogen bagi manusia adalah Bacillus anthracis dan Bacillus cereus,
sedangkan spesies lain bersifat oportunistik dan jarang menyebabkan penyakit.
Bacillus anthracis dapat menyebabkan pustula maligna, anthrax pneumonia, dan
anthrax intestinal. Bacillus cereus sering menyebabkan keracunan makanan
(Spicer, 2008; Goering et al., 2008).
Staphylococcus sp adalah bakteri berbentuk kokus Gram positif dengan
posisi bergerombol seperti anggur. Staphylococcus aureus merupakan spesies
Staphylococcus sp yang memiliki enzim koagulase dan mampu meragi manitol.
Pada media MSA Staphylococcus aureus akan meragi manitol sehingga media
berubah warna dari merah menjadi kuning, sedangkan Staphylococcus non-aureus
akan tetap berwarna merah (Nath dan Revankar, 2006; Harvey et al., 2007).
Staphylococcus sp merupakan bakteri oportunistik. Staphylococcus aureus
dapat menyebabkan berbagai macam infeksi seperti lesi kulit, pneumonia,
mastitis, phlebitis, meningitis, keracunan makanan, dan infeksi saluran kemih.
commit to user
pencernaan. Ditemukannya Staphylococcus sp pada usap endoskopi saluran cerna
kemungkinan disebabkan adanya kontak dengan flora normal. (Vesterlund et al.,
2006; Bhalla et al., 2007).
Clostridium sp merupakan bakteri batang Gram positif penghasil spora
dengan letak spora di salah satu ujung. Bakteri ini tersebar di tanah dan saluran
pencernaan manusia maupun hewan. Adanya Clostridium sp dalam usap
endoskopi saluran cerna kemungkinan karena adanya kontaminasi Clostridium
yang berasal dari saluran pencernaan manusia (Kumala, 2004; Prasetyo, 2004).
Terdapat lebih dari sembilan puluh spesies Clostridium sp. Spesies yang
berhubungan dengan patogen pada manusia antara lain Clostridium perfringens,
Clostridium tetani, Clostridium difficile, dan Clostridium botulinum. Clostridium
perfringens merupakan flora normal di usus manusia dan hewan, namun dapat
menyebabkan keracunan makanan dan enteritis nekrotikan. Clostridium tetani
menyebabkan penyakit tetanus. Clostridium difficile merupakan flora normal
usus, namun dapat menjadi penyebab infeksi nosokomial seperti kolitis akibat
penggunaan antibiotik. Clostridium botulinum menyebabkan penyakit botulism
akibat mengonsumsi makanan berkaleng (Ferreira, 2003; Toy et al., 2008).
Penelitian ini memiliki beberapa kelemahan. Spora yang ditemukan tidak
diketahui apakah berada dalam bentuk sel vegetatif atau bentuk spora pada
endoskopi saluran cerna. Disinfeksi tingkat tinggi endoskopi saluran cerna masih
dikatakan efektif apabila yang ditemukan pada endoskopi saluran cerna adalah
bentuk spora bakteri dan bukan bentuk sel vegetatif. Hal ini dikarenakan proses
commit to user
tingkat tinggi endoskopi saluran cerna akan dikatakan tidak efektif jika terdapat
sel vegetatif bakteri yang mampu menghasilkan spora pada hasil usapan (Brooks
et al., 2008; Goering et al., 2008).
Penelitian ini juga belum dapat menjelaskan secara pasti bagaimana bakteri
tersebut dapat ditemukan pada usap endoskopi saluran cerna. Berbagai
kemungkinan sumber kontaminasi dipaparkan berdasarkan tinjauan pustaka. Oleh
karena itu, perlu adanya penelitian lebih lanjut untuk memastikan sumber