Tabel 1 Hasil analisis oligosakarida madu menggunakan GC-MS (Ruiz-Matute et al. 2010)
Oligosakarida Sampel madu (mg/ 100g)
maksimum minimum Rafinosa 209.7 0.0 6-kestosa 148.9 11.7 1-kestosa+neo-kestosa 845.3 23.2 Erlosa 1214.8 30.8 Planteosa 70.4 0.0 Melezitosa 246.5 21.5 Teanderosa 301.3 33.6 Glc-(11)-Glc-(1x)-Glc (x=3 atau 4) 29.9 8.4 Glc-Glc-Glc 134.7 15.2 Glc-Glc-Glc 113.5 14.7 Glc-(1x)-Glc-(12)-Glc+Fru-(2x)-Glc-(13)-Fru 58.9 Tr Fru-(2x)-Glc-(13)-Fru 60.5 0.0 Fru-(2x)-Glc-(13)-Fru 120.4 0.0 Maltotriosa 124.2 0.0 Glc-Glc-Glc 23.2 0.0 α-3’-Glukosil-isomaltosa 291.4 0.0 α-glc-(1x)-α-Glc-(11)-Fru,1+α-Glc-(16)-α-Glc-(12)-Glc E 810.8 19.8 α-glc-(1x)-α-Glc-(11)-Fru,2 407.4 6.1
Cincin pereduksi tersubtitusi pada C6 turunan dari isomaltosa 127.9 0.0
Panosa 863.2 17.4 Glc-(1x)-Glc-(16)-Glc (x=3 atau 4) 142.7 0.0 Glc-Glc-Glc 152.6 0.0 α-Glc-(16)-α-Glc-(12)-Glc Z 58.8 0.0 Isomaltotriosa 534.3 0.0 Nistosa 166.8 0.0 Turunan sukrosa 47.5 0.0 Turunan sukrosa 23.9 0.0 Turunan sukrosa 16.0 0.0 Turunan sukrosa 27.1 0.0 Tetrasakarida 28.4 0.0 Turunan sukrosa 230.0 0.0 Tetrasakarida 24.2 0.0 Turunan sukrosa 27.2 0.0
Kromatografi gas (GC) memberikan hasil yang paling baik untuk analisis kualitatif. Pada kromatografi gas, oligosakarida yang akan dianalis dibuat senyawa turunannya. Dua jenis cara membuat senyawa turunan oligosakarida, yang pertama yaitu dengan trimetilsilil (TMS). Senyawa turunannya berasal langsung dari senyawa oligosakarida. Metode yang kedua adalah alditol asetat. Semua karbohidrat direduksi menjadi alditol dengan natrium borohidrida (Wetzel & Charalombous 1998).
Perkembangan penggunaan GC dalam analisis madu dilakukan oleh Ruiz-Matute et al.(2010). Dalam studinya dilakukan analisis kandungan enam madu asal Spanyol dan enam madu asal Selandia Baru menggunakan Kromatografi Gas-Spektroskopi Massa (GC-MS. Hasil analisis ditemukan bahwa erlosa dan panosa sebagai komponen trisakarida
terbesar. Keseluruhan hasil yang didapat ditampilkan pada Tabel 1.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini antara lain adalah sampel madu yang berasal dari Hutan Kampung Bukit Gunung Tambora, Bima, Pulau Sumbawa. Bahan yang digunakan dalam isolasi dan deteksi oligosakarida adalah arang aktif, etanol 10%, 50%, dan 80%, air deioinisasi, millipore 0.22 μm, lempeng KLT Whatman K6F silika 250μm (Merck), lempeng KLT PLC silika gel 60 F254r0.5mm (Merck), akuades, N*(1-naftil)
etilendiamina dihidroklorida (Merck), metanol, n-butanol, asam sulfat, piridin, asam asetat, glukosa, fruktosa, dan standar
karbohidrat DP 3 maltotriosa (AppliChem) dan DP 4 maltotetraosa (AppliChem).
Alat yang digunakan dalam penelitian ini adalah peralatan gelas, oven, neraca analitik OHAUS GA 200, vakum, kertas alumunium, pengering rambut, chamber KLT, botol semprot, pipet mikro, pipet kapiler, pengaduk magnetik, kertas saring Whatman No.1, dan instrumen Liquid Chromatography-Mass Spectrometry (LC-MS) Waters di PT Omega Farma Medika Jakarta.
Metode
Preparasi oligosakarida madu hutan
Gunung Tambora Sumbawa melalui
adsorpsi arang aktif dan pengadukan dalam etanol (Morales et al. 2006)
Preparasi Oligosakarida. Preparasi karbohidrat dengan perlakuan arang aktif terbagi ke dalam dua proses yaitu pemisahan mono- dan disakarida serta perolehan kembali oligosakarida dengan menggunakan pelarut etanol-air yang memiliki konsentrasi 50%. Seluruh perlakuan dilakukan dengan dua kali ulangan.
Eliminasi monosakarida. Sebanyak 5 g
sampel madu dilarutkan dalam 1000 mL etanol 10% (v/v). Ke dalam larutan tersebut ditambahkan 30 g arang aktif 100 mesh. Larutan selanjutnya diaduk menggunakan pengaduk magnetik dengan kecepatan 800 rpm selama 30 menit. Setelah itu, larutan disaring menggunakan kertas saring Whatman No.1 dalam kondisi vakum. Kemudian residu dibilas menggunakan 250 mL pelarut yang sama.
Pemulihan oligosakarida. Residu hasil
pemisahan mono- dan disakarida dilarutkan kembali dengan 1000 mL pelarut etanol dengan konsentrasi 50% (Morales et al. 2006) dan 80% (Wichiencot et al. 2010). Larutan diaduk menggunakan pengaduk magnetik selama 30 menit dengan kecepatan 800 rpm. Setelah itu larutan disaring menggunakan kertas Whatman No.1 dalam keadaan vakum. Filtrat yang didapatkan kemudian dievaporasi dalam keadaan vakum pada suhu 400C. Efektivitas konsentrasi etanol 50% dan 80% diuji secara kualitatif dengan KLT selanjutnya. Proses preparasi dilakukan sebanyak dua kali ulangan.
Deteksi dan isolasi oligosakarida dengan
Kromatografi Lapis Tipis (KLT)
modifikasi metode Vergara et al. (2010) serta Optimasi Eluen yang Digunakan.
Hasil preparasi sampel madu yang diperoleh dideteksi dengan KLT Whatman K6F lempeng silika dengan ketebalan 250μm. Jumlah spot yang terbentuk dapat digunakan untuk membandingkan konsentrasi etanol yang lebih baik dalam proses perolehan kembali oligosakarida pada saat preparasi sampel sebelumnya. Untuk proses deteksi digunakan lempeng KLT ukuran panjang x lebar 10 x 5 cm. Sebanyak 10μL ditotolkan ke lempeng KLT dengan jarak 0.5 cm dari bagian bawah lempeng. Lempeng dielusi dengan campuran pelarut yang terdiri atas butanol: asam asetat: air (3:1:1 v/v) (Kim et al. 1995) dan butanol: etanol: air (4:3:3 v/v) (Schneider et al. 1993) (Campuran eluen yang menghasilkan spot dengan keterpisahan yang lebih baik yang akan digunakan pada tahap KLT preparatif). Lempeng kemudian disemprot dengan larutan indikator yang berisi 0.3g/100 mL N*(1-naftil) etilendiamina dihidroklorida pada suatu sistem pelarut yang terdiri atas metanol: H2SO4 (97:3 v/v).
Lempeng dipanaskan pada oven dengan suhu 1200C hingga spot dapat terlihat yakni sekitar 8-10 menit. KLT juga dilakukan terhadap sampel madu yang belum mengalami isolasi.
Isolasi oligosakarida selanjutnya dilakukan terhadap sampel yang menghasilkan spot terbaik pada saat deteksi oligosakarida. Urutan kerja yang dilakukan sama seperti pada saat deteksi, namun mengikuti kaidah teknik KLT preparatif, dilakukan dengan plat berukuran 20 x 20 cm dan aplikasi sampel dilakukan pada jarak 2 cm dari bawah lempeng. Setelah lempeng KLT dipanaskan dalam oven, pita yang terbentuk diukur Rf-nya. Pita yang memiliki Rf> dari standar DP 2 dikerok. Selanjutnya, silika hasil pengerokan di larutkan dalam 40 mL etanol dengan konsentrasi yang sama pada saat pemulihan oligosakarida yang menghasilkan keterpisahan spot terbaik, dan kemudian larutan diaduk dengan kecepatan 600 rpm selama 10 menit. Selanjutnya, larutan disentrifugasi dengan kecepatan 5000 rpm selama 30 menit. Supernatan dipisahkan dengan penyaringan menggunakan millipore 0.22 μm kemudian dievaporasikan dalam keadaan vakum pada suhu 400C.
Identifikasi oligosakarida menggunakan LC-MS (modifikasi HPLC Astwood et al. 1998)
Madu murni dan isolat oligosakarida yang didapatkan dilarutkan dalam air nanofiltrasi dan sebanyak 20µL (20 mg/mL) diinjeksikan ke dalam sistem LC-MS yang memiliki
spesifikasi sebagai berikut: Ultra Pressure Liquid Chromatography (UPLC) dengan kolom Waters TQD Acquity UPLC® BEH Shield RP 18 1,7µm ( 2,1 x 100mm ) dan detektor MS. Elusi dilakukan menggunakan air deionisasi dengan laju alir 0.5 mL/menit. Standar yang digunakan adalah kelompok senyawa karbohidrat DP 1 (glukosa), DP 3 (maltotriosa), dan DP 4 (maltotetraosa).
HASIL DAN PEMBAHASAN
Madu Hutan Gunung Tambora Sumbawa dan Rendemennya
Hutan Gunung Tambora Sumbawa merupakan salah satu pusat penghasil madu alam di Indonesia. Madu alam merupakan madu yang berasal dari proses alami tanpa campur tangan manusia. Madu hutan Gunung Tambora Sumbawa dihasilkan oleh lebah Apis dorsata dari beberapa nektar bunga disekitar sarang lebah, antara lain bunga akasia (Acacia sp.), samu, loa (Ficus racemosa), luhu, duwet (Eugenia cumini Merr.), mangga (Mangifera indica), jambu (Psidium guajava), kemiri (Aleurites moluccana), dan pala (Myristica fragrans). Madu hutan Gunung Tambora Sumbawa yang digunakan pada penelitian ini diambil pada Februari 2010 (musim penghujan) dengan bantuan penduduk sekitar.
Madu hutan Gunung Tambora Sumbawa memiliki warna coklat kehitaman. Warna pada madu dipengaruhi oleh senyawa fenolik ataupun mineral yang terkandung didalamnya. Semakin gelap warna suatu madu maka semakin banyak pula senyawa fenolik dan mineral yang dikandungnya (Bogdanov 2009). Madu hutan Gunung Tambora Sumbawa yang digunakan ditampilkan pada Gambar 2.
Preparasi madu Hutan Gunung Tambora Sumbawa dilakukan dengan menggunakan pelarut etanol 10% untuk menghilangkan monosakarida dan kemudian digunakan 50% dan 80% etanol untuk melakukan perolehan kembali oligosakarida yang sebelumnya terjerap di arang aktif (Morales et al. 2006, Wichienchot et al. 2010). Hasil fraksinasi madu hutan Gunung Tambora Sumbawa ditampilkan pada Tabel 2.
Rendemen yang dihasilkan oleh etanol 80% lebih besar dibandingkan etanol 50%. Hal ini mungkin disebabkan oleh kandungan oligoskarida yang unik. Madu hutan Gunung Tambora Sumbawa kemungkinan memiliki kandungan oligosakarida dengan DP>6 yang lebih banyak dibandingkan dengan oligosakarida dengan DP 3-6. Menurut
Morales et al. (2006), etanol 50% merupakan konsentrasi optimum untuk perolehan kembali oligosakarida dengan DP 3-6. Semakin tinggi konsentrasi etanol yang digunakan maka akan meningkatkan konsentrasi perolehan karbohidrat dengan DP>6 namun akan semakin mengurangi perolehan karbohidrat dengan DP <6.
Gambar 2 Sampel madu hutan Gunung Tambora Sumbawa
Tabel 2 Rendemen madu Hutan Gunung Tambora Sumbawa
Pelarut % rendemen
Etanol 50% 2,09
Etanol 80% 7,62
Deteksi Oligosakarida dengan Kromatografi Lapis Tipis (KLT) serta
Optimasi Eluen yang Digunakan
Glukosa (DP 1) dan maltosa (DP 2) digunakan sebagai standar dalam tahap ini. Spot yang menghasilkan Rf lebih rendah dibanding maltosa diasumsikan sebagai oligosakarida dengan DP>2. Sampel yang digunakan terdiri atas S5 (isolat hasil pemulihan oligosakarida menggunakan etanol 50%) dan S8 (isolat hasil pemulihan oligosakarida menggunakan etanol 80%). Penotolan sampel dilakukan sebanyak 2 ulangan untuk melihat konsistensi spot yang dihasilkan. Dalam tahap ini juga ditentukan campuran pelarut terbaik, yang dapat menghasilkan spot yang lebih terpisah yang selanjutnya digunakan dalam KLT preparatif. Kromatogram yang dihasilkan ada pada Gambar 3a dan 3b.
Kromatogram 3a merupakan kromatogram yang menggunakan campuran eluen butanol: etanol: air (4:3:3 v/v). Kromatogram 3b merupakan kromatogram yang menggunakan campuran eluen butanol: asam asetat: air (3:1:1 v/v). Kedua eluen yang digunakan dipilih berdasarkan kemampuan pemisahan oligosakarida yang telah dibuktikan oleh penelitian terdahulu. butanol: etanol: air (4:3:3
v/v) mampu memisahkan karbohidrat hingga DP≥11 (Schneider et al. 1993), sedangkan campuran eluen butanol: asam asetat: air (3:1:1 v/v) mampu memisahkan karbohidrat hingga DP≥7 (Kim et al. 1995).
Kromatogram 3a menghasilkan spot glukosa dan maltosa dengan Rf 0.65 dan 0.61. Pada kromatogram ini tidak terbentuk spot sampel yang terpisah. Baik spot pada S5 maupun S8 memiliki Rf 0.63. Spot dengan Rf 0.63 tersebut mungkin terbentuk akibat tidak terpisahnya mono- dan disakarida. Spot tersebut membentuk ekor yang diperkirakan merupakan oligosakarida dengan DP>2.
Kromatogram 3b menghasilkan spot glukosa dan maltosa masing-masing memiliki Rf 0.65 dan 0.61. Sampel S5 pada kedua ulangan memiliki 4 spot yang konsisten yang relatif terpisah. Spot pertama memiliki Rf yang sama dengan glukosa yaitu 0.65, spot kedua memiliki spot yang mewakili maltosa dengan Rf 0.62, spot ketiga dan keempat memiliki Rf yang lebih kecil dari maltosa yaitu 0.55 dan 0.48. Sampel S8 membentuk 3 spot yang agak rapat pada salah satu ulangan, dengan nilai Rf masing-masing 0.65, 0.62, dan 0.55. Spot glukosa yang memiliki Rf 0.65 pada sampel S8 terlihat jauh lebih tipis dibandingkan yang terditeksi pada sampel S5. Hasil tersebut dapat diartikan bahwa sampel S8 memiliki tingkat pengurangan kuantitas glukosa yang lebih baik dibandingkan S5. Sampel S8 dalam kromatogram 3b ini tidak memiliki keterulangan yang baik jika dibandingkan dengan sampel S5.
Sampel S5 dan S8 masih mengandung monosakarida. Keadaan ini menunjukkan bahwa preparasi sampel yang dilakukan belum efektif untuk menghilangkan monosakarida. Sampel S8 memiliki spot yang relatif lebih tipis dibanding dengan S5 pada dua kromatogram yang dihasilkan. Hal tersebut mungkin dapat diakibatkan oleh dua faktor. Pertama, kuantitas senyawa yang sama yang dihasilkan dengan preparasi S8 lebih sedikit dibanding S5 sehingga tidak terdeteksi. Faktor kedua, S8 mengandung senyawa yang berbeda dengan S5 yang tidak bisa terpisah atau terelusi sebaik sampel S5 pada eluen yang sama.
Sampel S5 memiliki konsentrasi perolehan monosakarida yang lebih tinggi dibanding S8 jika dilihat dari ketebalan spot yang dihasilkan. Hasil keterulangan yang lebih baik dari S8, sedangkan preparasi S5 memiliki peluang keberhasilan lebih besar untuk mendapatkan isolat oligosakarida dengan DP
3 – 4. Hasil ini sesuai dengan temuan Morales et al. (2006).
Campuran eluen yang digunakan pada kromatogram 3b memberikan keterpisahan spot yang lebih baik dibanding dengan 3a. Preparasi S5 menghasilkan keterulangan yang lebih baik dibandingkan S8 yang dapat langsung dilihat secara visual. Berdasarkan hasil tersebut, isolasi oligosakarida dengan KLT preparatif pada tahap selanjutnya digunakan sampel S5 dan menggunakan campuran pelarut butanol: asam asetat: air (3:1:11v/v)
(a) (b)
Gambar 3 Kromatogram KLT deteksi oligosakarida dengan berbagai pelarut. (a) Kromatogram deteksi isolat oligosakarida madu Hutan Gunung Tambora Sumbawa dengan pelarut butanol:etanol:air (4:3:3), (b) Kromatogram isolat oligosakarida madu hutan Gunung Tambora Sumbawa dengan pelarut butanol:asam asetat: air (3:1:1). Std: Standar, G: glukosa, M: maltosa, S5: isolat hasil pemulihan oligosakarida menggunakan etanol 50%, S8: isolat hasil pemulihan oligosakarida menggunakan etanol 80%.
Isolasi Oligosakarida Menggunakan Kromatografi Lapis Tipis Preparatif
Kromatografi lapis tipis preparatif oligosakarida dilakukan dengan menggunakan larutan pengembang butanol: asam asetet: air (3:1:1) yang memberikan hasil terbaik pada tahap deteksi yang dilakukan sebelumnya. Sampel yang diterapkan pada tahap ini merupakan sampel yang dihasilkan dari preparasi yang menggunakan etanol 50%.
Hasil isolasi oligosakarida yang dilakukan dapat dilihat pada Gambar 4. Spot yang
S5 S8 Std Std S5 S8 G M G M 0,65 0,61 0,650,62 0,650.62 0,55 0,48 0.65 0,62 0,55 0,63 0,63
dihasilkan oleh standar Glukosa dan maltosa masing-masing memiliki Rf 0.38 dan 0.31. Pita yang terbentuk dibawah spot standar maltosa yang memiliki Rf 0.22 (pita berwarna merah kehitaman) diduga merupakan oligoskarida dengan DP>2. Pita dengan Rf 0.22 tersebut kemudian dikerok dan diidentifikasi menggunakan LC-MS.
Gambar 4 Kromatogram KLT preparatif isolat oligosakarida madu dengan eluen butanol: asam asetat: air (3:1:1). Nomor pada kromatogram berturut-turut: (1) standar DP 1, (2) standar DP 2, dan (3) oligosakarida DP>2.
Identifikasi Oligosakarida Menggunakan LC-MS
Identifikasi oligosakarida menggunakan LC-MS diawali dengan tahap pengkondisian alat dan dilanjutkan dengan tahap analisis. Pada tahap pengkondisian alat dilakukan beberapa percobaan yang bertujuan untuk mengkondisikan sistem LC-MS terhadap sampel yang akan dianalisis (analit), sehingga analisis dapat berjalan optimal sesuai metode yang diinginkan.
Pengkondisian instrumen tidak bisa dilakukan tanpa adanya standar. Pengkondisian alat dilakukan hingga detektor MS dapat memberikan serapan maksimum pada bobot molekul standar yang telah diketahui. Adapun molekul dengan derajat polimerisasi (DP) dan bobot molekul standar yang digunakan pada studi ini antara lain glukosa (DP 1,BM 180), Maltotriosa (DP 3, BM 504,4), dan Maltoteraosa (DP 4, BM 666,6). Data pengkondisian alat yang didapat kemudian disimpan dan digunakan sebagai basis data pada saat analisis.
Hasil identifikasi oligosakarida menggunakan LC-MS dapat dilihat di Tabel 3 sedangkan kromatogram yang dihasilkan dapat dilihat pada Gambar 5, 6, dan 7. Data
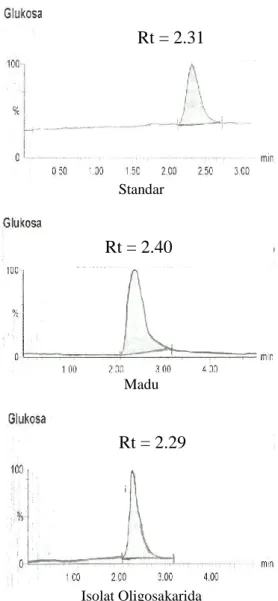
hasil analisis menunjukan bahwa oligosakarida DP 3 dan DP 4 terdapat baik pada madu murni maupun isolat oligosakarida yang diuji, sehingga metode isolasi dapat memenuhi sebagaimana yang ditujukan dalam penelitian ini.
Isolat oligosakarida madu masih mengandung glukosa yang tidak diharapkan dengan kadar 12,75%. Keberadaan glukosa tersebut membuktikan bahwa masih perlu optimasi metode isolasi yang harus dilakukan. Tabel 3 juga memperlihatkan bahwa kadar maltotriosa (DP 3) dan maltotetraosa (DP 4) berturut-turut antara lain 38,48% dan 510,23%.
Standar
Madu
Isolat Oligosakarida
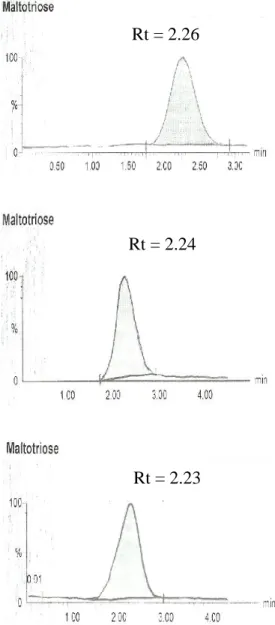
Gambar 5 Kromatogram LC-MS maltotriosa dari senyawa standar, madu murni, dan isolat oligosakarida.
Rt = 2.26
Rt = 2.24
Rt = 2.23
1 2 3 0.22 0.38 0,31Standar
Madu
Isolat Oligosakarida
Gambar 6 Kromatogram LC-MS maltotetraosa dari senyawa standar, madu murni, dan isolat oligosakarida. Konsentrasi maltotetraosa pada isolat yang lebih tinggi dibanding pada madu murni tersebut menunjukkan bahwa proses yang dilakukan berhasil mengisolasi oligosakarida dengan DP 4 pada konsentrasi yang signifikan. Hasil yang berbeda terjadi pada maltotriosa dengan DP 3, dimana konsentrasi oligosakarida tersebut menurun setelah proses isolasi dilakukan.
Standar
Madu
Isolat Oligosakarida
Gambar 7 Kromatogram LC-MS glukosa dari senyawa standar, madu murni, dan isolat oligosakarida.
Penurunan konsentrasi DP 3 tidak mendukung sebagaimana yang disebutkan dalam Karimah (2010) bahwa konsentrasi oligosakarida dengan DP>2 berada pada konsentrasi yang lebih signifikan setelah madu mengalami proses isolasi. Penurunan konsentrasi perolehan oligosakarida DP 3 setelah isolasi memberikan alasan tambahan perlunya dilakukan optimasi metode isolasi yang digunakan.
Tabel 3 Hasil identifikasi kandungan oligosakarida madu murni dan isolat oligosakarida menggunakan LC-MS
Standar Konsentrasi (µg/mL) Kadar senyawa isolat/madu murni (%) Madu murni Isolat
Glukosa (DP 1) 2182,96 278,34 12,75 Maltotriosa (DP 3) 246,94 95,03 38,48 Maltotetraosa (DP 4) 23,27 118,71 510,23
Rt = 2.24
Rt = 2.24
Rt = 2.22
Rt = 2.31
Rt = 2.40
Rt = 2.29
Tabel 4 Jenis-jenis trisakarida (C18H32O16, BM = 504.4) dalam madu (Ruiz-Matute et. al 2010)
Nama Senyawa Rumus Molekul
Centosa α-D-Glcp-(1→4)-α-D-Glcp-(1→2)-D-Glcp Erlosa α-D-Glcp-(1→4)-α-D-Glcp-(1↔2)-β-D-Fruf Isomaotriosa α-D-Glcp-(1→6)-α-D-Glcp-(1→6)-D-Glcp Isomelezitosa α-D-Glcp-(1→6)-β-D-Fruf-(2↔1)-α-D-Glcp Isopanosa α-D-Glcp-(1→4)-α-D-Glcp-(1→6)-D-Glcp 1-Kestosa β-D-Fruf-(2→1)-β-D-Fruf-(2↔1)-α-D-Glcp 6-Kestosa β-D-Fruf-(2→6)-β-D-Fruf-(2↔1)-α-D-Glcp Laminaritriosa β-D-Glcp-(1→3)-β-D-Glcp-(1→3)-D-Glcp Maltotriosa α-D-Glcp-(1→4)-α-D-Glcp-(1→4)-D-Glcp Melezitosa α-D-Glcp-(1→3)-β-D-Fruf-(2↔1)-α-D-Glcp Neokestosa β-D-Fruf-(2→6)-α-D-Glcp-(1↔2)-β-D-Fruf Panosa α-D-Glcp-(1→6)-α-D-Glcp-(1→4)-D-Glcp Planteosa α-D-Galp-(1→6)-β-D-Fruf-(2↔1)-α-D-Glcp Raffinosa α-D-Galp-(1→6)-α-D-Glcp-(1↔2)-β-D-Fruf Theanderosa α-D-Glcp-(1→6)-α-D-Glcp-(1↔2)-β-D-Fruf Isomaltosylglukosa α-D-Glcp-(1→6)-α-D-Glcp-(1→3)-D-Glcp 4-α-Gentobiosilglukosa (sorborosa) β-D-Glcp-(1→6)-α-D-Glcp-(1→4)-D-Glcp
Tabel 5 Jenis-jenis tetrasakarida (C24H42O21, BM = 666.6) dalam madu (Astwood et al. 1998;
Rittig 2001; Ruiz Matute et al 2010).
Nama Senyawa Rumus Molekul
α-4’-glukosilerlosa α-D-Glcp-(1→4)-α-D-Glcp-(1→4)-α-D-Glcp-(1↔2)-β-D-Fruf α-6’-glukosilerlosa α-D-Glcp-(1→6)-α-D-Glcp-(1→4)-α-DGlcp-(1↔2)-β-D-Fruf Fruktosilisomelezitosa Fru-(?→?)-α-D-Glcp-(1→6)-β-D-Fruf-(2↔1)-α-D-Glcp Isomaltotetraosa α-D-Glcp-(1→6)-α-D-Glcp-(1→6)-α-DGlcp-(1→6)-D-Glcp Maltotetraosa α-D-Glcp-(1→4)-α-D-Glcp-(1→4)-α-DGlcp-(1→4)-D-Glcp Nistosa β-D-Fruf-(2→1)-β-D-Fruf-(2→1)-β-D-Fruf-(2↔1)-α-D-Glcp Stakiosa α-D-Galp-(1→6)-α-D-Galp-(1→6)-α-DGlcp-(1↔2)-β-D-Fruf
Metode identifikasi oligoskarida menggunakan LC-MS pada studi ini belum cukup untuk menentukan jenis oligosakarida DP 3 & DP 4 yang terkandung dalam madu hutan Gunung Tambora Sumbawa secara spesifik. Modifikasi metode lain diperlukan seperti GC-MS dalam Ruiz-Matute et al (2010) ataupun instrumen tambahan seperti Matrix Assisted Laser Desoprtion Ionisatian-Time of flight Mass Spectrometry (MALDI-TOF-MS). Tabel 4 dan 5 memperlihatkan jenis-jenis DP 3 dan DP 4 dari madu mancanegara yang telah berhasil diidentifikasi sampai saat ini.
Komposisi Oligosakarida,
Pembentukannya, serta Potensinya sebagai Prebiotik
Komposisi kimia madu, termasuk kandungan oligosakarida di dalamnya dapat bervariasi bergantung pada tanaman sumber nektar, pengaruh musim dan iklim, serta letak geografis dari sumber nektar. Senyawa senyawa dalam madu berasal dari: pematangan dari madu, penambahan dari lebah, dan lainnya merupakan derivat dari tanaman (Bogdanov 2009). Lebih dari 95%
padatan di dalam madu merupakan karbohidrat di alam dan 85-95% nya adalah fruktosa dan glukosa sebagai pembentuk oligosakarida (Bogdanov 2009). Oligosakarida pada madu merupakan produk proses enzimatik yang dilakukan oleh beberapa enzim, yaitu: α-Glukosidase, β-Glukosidase, dan Invertase ragi ( Pontoh 2001,Pontoh & Low 2002, Balasubramanyam 2011).
Enzim α-Glukosidase merupakan enzim yang bertanggung jawab pada proses hidrolisis nektar hingga menjadi glukosa dan sukrosa. Enzim α-Glukosidase ini merupakan enzim yang ditambahkan oleh lebah madu ke dalam madu, yang bertanggung jawab atas hidrolisis sukrosa (DP 2) pada nektar menjadi glukosa dan fruktosa. Enzim ini juga memiliki fungsi transglikosilasi (Pontoh 2001). Transglikosilasi merupakan proses pemindahan gugus α-D-glukosil dari molekul sukrosa baik menuju molekul air membentuk glukosa bebas, ataupun menuju molekul gula lain untuk membentuk oligosakarida yang lebih kompleks di dalam madu seperti maltulosa, nigerosa, maltosa, kojibiosa, turanosa, ataupun isomaltosa. Erlosa sebagai