BAB I PENDAHULUAN Latar belakang
Dalam kimia, sebuah logam (bahasaYunani: Metallon) adalah sebuah unsur kimia yang siap membentuk ion (kation) dan memiliki ikatan logam, dan kadang kala dikatakan bahwa ia mirip dengan kation di awan elektron. Metal adalah salah satu dari tiga kelompok unsur yang dibedakan oleh sifat ionisasi dan ikatan, bersama dengan metaloid dan nonlogam. Dalam tabel periodik, garis diagonal digambar dari boron (B) ke polonium (Po) membedakan logam dari nonlogam. Unsur dalam garis ini adalah metaloid, kadang kala disebut semi-logam; unsur di kiri bawah adalah logam; unsur kekanan atas adalah nonlogam.
Logam berat adalah unsur-unsur kimia dengan bobot jenis lebih besar dari 5 gr/cm3, terletak di sudut kanan bawah sistem periodik, mempunyai afinitas yang tinggi terhadap unsur S dan biasanya bernomor atom 22 sampai 92 dari perioda 4 sampai 7. Sebagian logam berat seperti timbal (Pb), kadmium (Cd), dan merkuri (Hg) merupakan zat pencemar yang berbahaya.Kadmium, timbal, dan tembaga terikat pada sel-sel membran yang menghambat proses transpormasi melalui dinding sel. Logam berat juga mengendapkan senyawa fosfat biologis atau mengkatalis penguraiannya.
Logam berat masih termasuk golongan logam-logam dengan kriteria-kriteria yang sama dengan logam-logam yang lain. Perbedaannya terletak dari pengaruh yang dihasilkan bila logam berat ini berikatan dan atau masuk kedalam tubuh organisme hidup. Sebagai contoh, bila unsur logam besi (Fe) masuk dalam tubuh, meski dalam jumlah agak berlebihan biasanya tidaklah menimbulkan pengaruh yang buruk terhadap tubuh karena unsur besi (Fe) dibutuhkan dalam darah untuk mengikat oksigen. Sedangkan unsur logam berat baik itu logam berat beracun yang dipentingkan seperti tembaga (Cu), bila masuk ke dalam tubuh dalam jumlah berlebihan akan menimbulkan pengaruh-pengaruh buruk terhadap fungsi fisiologis tubuh.
Niebor dan Richardson menggunakan istilah logam berat untuk menggantikan pengelompokan ion-ion logam ke dalam kelompok biologi dan kimia (bio-kimia). Pengelompokan tersebut adalah sebagai berikut:
1. Logam-logam yang dengan mudah mengalami reaksi kimia bila bertemu dengan juga dengan unsur oksigen atau disebut juga dengan oxygen-seeking metal.
2. Logam-logam yang dengan mudah mengalami reaksi kimia bila bertemu dengan unsur nitrogen dan atau unsur belerang (sulfur) atau disebut juga nitrogen/sulfur seeking metal.
Rumusan Masalah
1. Bagaimana sifat fisik dan kimia logam Cd, Cr dan Ti?
2. Apa saja reaksi-reaksi penting logam Cd, Cr dan Ti?
3. Bagaimana proses ekstraksi logam Cd, Cr dan Ti?
4. Apa saja aplikasi dari logam Cd, Cr dan Ti?
Tujuan Masalah
1. Mengetahui sifat fisik dan sifat kimia dari logam Cd, Cr dan Ti.
2. Mengenal reaksi reaksi penting logam Cd, Cr dan Ti.
3. Mengetahui proses ekstraksi logam Cd, Cr dan Ti.
BAB II PEMBAHASAN Sifat Fisik Dan Kimia Logam Cd
Kadmium (Cd) ini pertama kali ditemukan oleh seorang ilmuwan Jerman yang bernama Friedric Strohmeyer pada tahun 1817. Logam Cd ini ditemukan dalam bebatuan Calamine (Seng Karbonat). Nama kadmium sendiri diambil dari nama latin dari “calamine” yaitu “Cadmia”.
Logam kadmium adalah unsur kimia yang dalam sitem periodik memiliki nomor atom 48 dan berat atom 112,41 g/mol serta memiliki titik lebur 321 derajat celcius. Logam kadmium dapat larut dengan lambat dalam asam encer dengan melepaskan hidrogen sebab potensial elektrodanya yang negatif.
Logam kadmium membentuk ion divalent yang tidak bewarna.
Halnya unsur-unsur kimia lainnya terutama golongan logam, logam kadmium mempunyai sifat fisika dan sifat kimia tersendiri. Berdasarkan pada sifat-sifat fisiknya, Cd merupakan logam lunak, bewarna putih seperti putih perak. Logam ini akan kehilangan kilapnya bila berada dalam udara yang basah atau lembab serta akan cepat mengalami kerusakan bila terkontaminasi oleh uap ammonia (NH3) dan sulfur hidroksida. Sedangkan sifat kima dari logam kadmium yaitu senyawa yang dibentuknya merupakan yang mempunyai bilangan valensi 2+ dan hanya sedikit yang mempunyai bilangan valensi 1+. Bila ion-ion Cd2+ dimasukan kedalam larutan yang mengandung ion OH- maka akan mengalami proses pengendapat, endapat yang terbentuk dari ion-ion Cd2+ dalam larutan OH- biasanya dalam bentuk senyawa terhidratasi yang bewarna putih.
d) Bereaksi dengan halogen dan nonlogam seperti S, Se, P e) Cd adalah logam yang cukup aktif
f) Dalam udara terbuka, jika dipanaskan akan membentuk asap coklat CdO g) Memiliki ketahanan korosi yang tinggi
h) CdI2 larut dalam alkohol
Reaksi Cd dengan udara
Gas arsenik bereaksi dengan padatan Cd membentuk Cd3As2 pada suhu sekitar 7000 C
3 Cd(s) + 2 As(g) Cd3As2(s)
Reaksi Cd dengan halogen
Cd(s) + F2(g) CdF2(s) [putih]
Cd bereaksi langsung dengan Cl2(aq)
Cd(s) + Cl2(aq) Cd2+(aq) + 2 Cl−(aq)
Cd bereaksi langsung dengan Br2 pada 450 °C
Cd(s) + Br2(aq) Cd2+(aq) + 2Br−(aq)
Cd(s) + Br2(g) CdBr2(s) [kuning pucat]
Padatan Cd tidak bereaksi dengan I2(g) tetapi bereaksi dengan I2(aq). Dalam fase gas
Cd dan I2 akan bereaksi membentuk CdI2. Pada temperatur dan tekanan yang tinggi
ekuivalen Cd dan I2 akan bereaksi membentuk CdI.
Cd(s) + I2(aq) Cd2+(aq) + 2I−(aq)
Cd(g) + I2(g) CdI2(g)
2 Cd(g) + I2(g) 2CdI(g)
Reaksi Cd dengan Asam
Cd bereaksi dengan HBr membentuk CdBr2
Cd(s) + 2 HBr(aq) CdBr2(s) + H2(g)
Cd bereaksi dengan HCl membentuk CdCl2
Cd(s) + 2 HCl(aq) CdCl2(s) + H2(g)
Cd bereaksi dengan HF membentuk CdF2
Cd(s) + 2 HF(aq) CdF2(s) + H2(g)
Reaksi Cd dengan Hidrogen
Cd biasanya tidak bereaksi dengan H2(g). Pada 450o C H2 teradsorbsi ke dalam logam.
Saat logam mencapai suhu maksimalnya. Temperatur adsorpsi akan meningkat dan Cd akan bereaksi dengan H2.
Cd(s) + H2(g) CdH(s) + H·
Reaksi Cd dengan Air
Cd(s) + H2O(g) CdO(s)
Proses Ekstraksi Logam Cd
Umumnya kadmium terdapat bersama-sama dengan Zn dalam bijinya, sehingga kadmium diperoleh sebagai hasil sampingan produksi seng. Karena titik didihnya rendah, kadmium dapat dipisahkan dari seng melalui penyulingan bertahap. Dalam metode reduksi elektrolisis dan penyulingan seng maka sebelum terjadi reaksi :
Katode : Zn2+
(aq) + 2e- Zn(s)
Anoda : H2O ½ O2(g) + 2H+(aq) + 2e–
SO42-(aq) SO42-(aq)
setimbang : Zn2+ + SO42- + H2O Zn(s) +2H+ + SO42- + ½ O2
larutan yang mengandung Zn2+ diberi serbuk seng, yang larut (sebagai Zn2+) dan kemudian
menggantikan Cd2+. Reaksinya sebagai berikut :
Zn(s) + Cd2+
(aq) Zn2+(aq) + Cd(s)
Kemudian Cd disaring, dilarutkan dalam larutan asam dan dielektrolisis menghasilkan cadmium murni.
Kadmium merupakan suatu hasil sampingan yang tidak banyak ragamnya dan biasanya dapat dipisahkan dari Zn dengan destilasi atau dengan pengendapan dari larutan sulfat dengan debu Zn.
Aplikasi dari Logam Kadmium
Senyawa kadmium digunakan dalam fosfor tabung TV hitam-putih dan fosfor hijau dalam TV bewarna.
Di gunakan dalam penyepuhan kayu, CdO. Sebagai katalis.
Digunakan dalam elektroplating.
Kadmium adalah komponen dari beberapa senyawa semikonduktor, yang dapat digunakan untuk cahaya.
Obat – obatan seperti sipilis dan malaria. Penambangan timah hitam dan bijih seng.
Salah satu logam transisi yang penting adalah kromium. Kromium berhasil diisolasi oleh seorang ilmuwan Prancis, L.N Vauquelin pada tahun 1778. Pada tahun 1797 L.N Vauquelin menemukan oksida unsur baru dalam suatu mineral dari Siberia yaitu krokoit (crocoite) yang kemudian dikenal sebagai PbCrO4. Satu tahun kemudian, yaitu sekitar tahun 1798 unsur
logam baru ini (PbCrO4) dapat diisolasi dengan mereduksi mineral tersebut dengan batu bara
(charcoal) dan diberi nama dalam bahasa Yunani kroma (croma) yang artinya warna. Nama tersebut didasarkan pada salah satu sifat fisik logam, yaitu mengandung banyak macam warna dalam senyawanya.
Logam kromium relatif jarang ditemukan dan kandungannya dalam kerak bumi diduga kira-kira hanya 0,0122% atau 122 ppm, lebih rendah daripada vanadium (136 ppm) dan klorin (126 ppm). Sehingga kromium tergolong unsur paling melimpah ke-21 di kulit bumi. Bijih kromium yang pada umumnya penting hanya kromit FeCr2O4 yang banyak terdapat di Rusia
dan Afrika Selatan (kira-kira 96% cadangan kromium dunia), dan Pilipina.. Kromit mempunyai struktur spinel, pada struktur ini atom-atom O disusun dalam lapisan ccp dengan Fe(II) pada seperdelapan lubang tetrahedral yang tersedia dan Cr(III) pada seperempat lubang oktahedral.
Kromit terlihat mengkilau kehitaman dengan lapisan kecoklatan dan memiliki sifat sedikit magnetik. Produksi kromit di dunia pada tahun 1988 sebanyak 11.7 juta ton dengan kandungan Cr 3.4 juta ton. Selain kromit PbCrO4 (krokoit) dan Cr2O3 (krom kuning tua) juga dihasilkan, namun dalam jumlah yang kecil.
Kromium mempunyai konfigurasi elektron 3d54s1, sangat keras, mempunyai titik leleh dan
titik didih tinggi di atas titik leleh dan titik didih unsur-unsur transisi deret pertama lainnya. Bilangan oksidasi yang terpenting adalah +2, +3, dan +6, apabila dalam keadaan murni dapat larut dengan lambat sekali dalam asam encer membentuk garam kromium(II) (Hiskia, 2001). Kromium(II) bersifat mereduksi, Kromium(III) sangat stabil dan penting, dan Kromium(VI) bersifat sangat mengoksidasi. Kromium tahan korosi, oleh karena itu digunakan sebagai lapisan pelindung pada pelapisan elektrolitik. Kromium mudah larut dalam HCl, H2SO4, dan HClO4 tetapi menjadi pasif oleh HNO3 (Cotton dan Wilkinson, 2007).
Beberapa sifat fisik kromium dapat dilihat pada tabel berikut
M+2(aq) + 2e M(s)
Kromium adalah logam keras, berwarna abu-abu, mengkilap, yang mudah pecah. Logam ini memiliki titik leleh 1.900 ° C (3,450 ° F) dan titik didih 2.642 ° C (4,788 ° F). Kepadatannya adalah 7,1 gram per sentimeter kubik. Salah satu khasiat penting adalah kromium bisa dipoles hingga bersinar terang.
Sifat kimia
Kromium adalah logam yang cukup aktif. Logam ini tidak bereaksi dengan air, tapi bereaksi dengan kebanyakan asam. Crom bergabung dengan oksigen pada suhu kamar untuk membentuk oksida kromium (Cr2O3). Kromium oksida membentuk lapisan tipis pada
permukaan logam, melindunginya dari korosi lebih lanjut (berkarat).
Reaksi-Reaksi Penting Logam Cr
Reaksi dan persenyaawan kromium meliputi kromium dengan bilangan oksidasi +2, +3, dan +6
Kromium +2
Logam kromium dapat larut dalam larutan asam klorida atau asam sulfat membentuk larutan [Cr(H2O)6]2+, berwarna biru langit
Cr(s) + 2H+(aq) Cr2+(aq) + H 2(aq)
Ion kromium (II), Cr2+ dapat juga terbentuk jika larutan kromium (VI) (misalnya kromat atau
dikromat) atau ion kromium (III) direduksi oleh seng dan asam klorida. Pembentukan dari dikromat(VI) disertai perubahan warna yang menarik.
Di dalam larutan ion kromium (II) adalah reduktor kuat dan mudah dioksidasi di udara menjadi senyawa kromium (III).
Cr3+(aq) + e Cr2+(aq) E = -0,41 Vɵ
Oleh karena itu ion ini mudah dioksidasi oleh udara,
2Cr2+(aq) + 4H+(aq) + O
2(g) 2Cr3+(aq) + H2O(l)
Ion Cr2+(aq) dapat juga bereaksi dengan H+(aq) dan juga dengan air apabila trdapat katalis
2Cr2+(aq) + H
2O(l) 2Cr3+(aq) + 2OH–(aq) + H2(g)
2Cr2+ + 2H+(aq) 2Cr3+(aq) + H 2(g)
Kromium +3
Ion kromium(III) adalah ion yang paling stabil diantara kation logam dan transisi yang mempunyai bolangan oksidasi +3. Dalam larutan, ion ini terdapat sebagai [Cr(H2O)6]3+
dengan warna ungu. Jika H2O diganti dengan ion klorida maka akan terjadi perubahan warna.
Misalnya: ion [Cr(H2O)5]2+ berwarna hijau muda, sedangkan ion [Cr(H2O)4Cl2]+ berwarna
hijau tua.
Kromium +6
Kromium(VI) oksida, CrO3, bersifat asam sehingga dapat bereaksi dengan basa membentuk
ion kromat(VI),
CrO3(s) + 2OH(aq) Cr2O4(aq) + H2O(l)
Kromium(III) hidroksida dioksidasi dengan Na2O2 menghasilkan ion kromat yang berwarna
kuning,
2Cr(OH)3 + 3 Na2O2 + 2H+(aq) 2CrO42- (aq) + 6Na+(aq) + 4H2O (l)
Dalam larutan asam, ion kromat ataupun ion dikromat bersifat oksidator kuat.
Cr2O72-(aq) + 14H+(aq) + 6e 2Cr3+(aq) + 7H2O(l) E = +1,33 Vɵ
sedangkan reaksi yang terjadi dalam larutan bersifat basa,
CrO42-(aq) + 4H2O(l) + 3e Cr(OH)4–(aq) + 4OH–(aq) E = -0,13 Vɵ
Etanol, C2H5OH, dapat mereduksi ion kromat yang berwarna jingga menjadi ion
kromium(III) yang berwarna hijau. Tahapan perubahan reaksi ditandai dengan perubahan warna coklat campuran antara warna hijau dan jingga,
2Cr2O72-(aq) + 3C2H5OH(g) + 16H+(aq) 4Cr3+(aq) + 3CH3COOH(aq) + 11H2O(l)
Proses Ekstraksi Logam Cr
Sumber kromium diantaranya dari biji kromit ( FeCrO4 ), krokoit ( PbCrO4 ), dan oker kroma
( Cr2O3 )
1. Sebagai paduan ferokrom
2. Sebagai logam murni kromium
Langkah – langkah ekstraksinya :
1. Sebagai ferokrom
Dibuat dari reduksi kromit dengan batu bara coke dalam tanur listrik. Ferokrom dengan kandungan C rendah dapat diperoleh dari reduksi kromit dengan menggunakan ferosilikon, sebagai ganti batu bara coke. Hasil paduan Fe-Cr dapat digunakan langsung sebagai bahan paduan baja kromium steinless.
Reaksi :
FeCr2O4 + C 2Cr3+ + Fe3+ + 4CO
2. Sebagai logamnya
Bijih kromit dalam lelehan alkali karbonat dioksida dalam udara untuk memperoleh Na2CrO4.
FeCrO4 + Na2CO3 + O2 2Na2CrO4 + 2 CO2 + Fe
Na2CrO4 yang terbentuk kemudian diluluhkan dan dilarutkan dalam air yang dilanjutkan
dengan pengendapan sebagai Na2CrO4
2Na2CrO4 + H2O Na2Cr2O4 + 2 NaOH
Na2Cr2O4 ( dikromat ) kemudian direduksi dengan menggunakan karbon sehingga terbentuk
oksidanya, Cr2O3
Na2Cr2O4 + 2C Cr2O3 + Na2CO3 + CO
Cr2O3 dengan Al melalui proses aluminatenik atau silikon dihasilkan logam kromium murni.
Cr2O3 + 2Al 2Cr + Al2O3
2Cr2O3 + 3Si 4Cr + 3Si2O2
Aplikasi Dari Logam Krom
Dua kegunaan utama kromium lainnya adalah lempeng listrik dan pembuatan batu bata tahan api. Elektroplating adalah proses dimana arus listrik dilewatkan melalui larutan air senyawa metalik. Arus menyebabkan material terurai menjadi dua bagian.
Kromium bebas yang dihasilkan dalam reaksi diletakkan dalam lapisan tipis di permukaan logam lain, seperti baja. Kromium melindungi baja dari korosi dan memberinya permukaan yang terang dan mengkilap. Banyak peralatan dapur “yang dilapisi krom” dengan cara ini.
Beberapa krom juga digunakan untuk membuat batu bata tahan api. Bahan tahan api dapat menahan suhu yang sangat tinggi dengan merefleksikan panas. Bahan tahan api digunakan untuk melapisi oven suhu tinggi.
Sifat Fisik Dan Kimia Logam Titanium
Titanium adalah suatu unsur kimia biasanya ditandai dalam bentuk yang paling murni, dengan kilau dan warna metalik-putih. Nama titanium berasal bahasa Yunani yaitu TITANOS, demi menghormati legenda Titans dari mitologi Yunani. Titanium berada dalam jumlah yang besar di Matahari dan meteorit, dan merupakan unsur paling melimpah ke-9 di kerak bumi.
Pada tahun 1946, 155 tahun setelah penemuannya, William Justin Kroll menunjukkan bahwa adalah mungkin untuk menghasilkan titanium dengan mereduksi titanium tetraklorida dengan magnesium. Selama periode tersebut, elemen telah memperoleh pengakuan secara luas, dan sebagian besar dari penghargaan ini adalah ke penggunaannya, yang tampaknya akan meningkat dengan waktu.
Titanium dan paduannya memiliki kekuatan yang sangat menguntungkan untuk rasio massa. Titanium juga tahan terhadap korosi karena lapisan oksida permukaannya mengembangkan tipis, tapi sangat ulet. Sehingga logam digunakan barang yang membutuhkan kekuatan, ringan dan tahan terhadap korosi. Meskipun penggunaan titanium dibatasi oleh biaya tinggi, proses yang baru bisa muncul yang mungkin untuk mengurangi biaya secara signifikan, memungkinkan titanium dan paduannya untuk lebih banyak digunakan.
Sifat fisik
Titanium murni merupakan logam putih yang sangat bercahaya. Ia memiliki berat jenis rendah, kekuatan yang bagus, mudah dibentuk dan memiliki resistansi korosi yang baik.
Titanium bersifat paramagnetik (lemah tertarik dengan magnet) dan memiliki konduktivitas listrik dan konduktivitas termal yang cukup rendah.
Sifat Fisik Keterangan
Fasa Padat
Titik didih 3560 K(32870C, 59490F)
Sifat kimia dari titanium yang paling terkenal adalah ketahanan terhadap korosi yang sangat baik (pada suhu biasa membentuk oksida, TiO2), hampir sama seperti platinum, resistan terhadap asam, dan larut dalam asam pekat. Diagram Pourbaix menunjukkan bahwa titanium adalah logam yang sangat reaktif, tetapi lambat untuk bereaksi dengan air dan udara.
Titanium murni diketahui dapat menjadi radioaktif setelah dibombardir dengan deuterons. Radiasi yang dihasilkan adalah positrons dan sinar gamma. Ketika sinar gamma ini direaksikan dengan oksigen, dan ketika mencapai suhu 550 ° C (1022 ° F) , sinar tersebut bereaksi dengan klorin. Sinar ini kemudian bereaksi dengan halogen yang lain dan menyerap hidrogen.
Logam ini dimorphic. Bentuk alfa heksagonal berubah menjadi bentuk beta kubus secara perlahan-lahan pada suhu 8800C. Logam titanium tidak bereaksi dengan fisiologi tubuh manusia (physiologically inert). Titanium oksida murni memiliki indeks refraksi yang tinggi dengan dispersi optik yang lebih tinggi daripada berlian.
Reaksi-Reaksi Penting Logam Titanium
Reaksi dengan Air
Titanium akan bereaksi dengan air membentuk Titanium dioksida dan hydrogen.
Ti(s) + 2H2O(g) → TiO2(s) + 2H2(g)
Reaksi dengan Udara
Titanium dilapisi lapisan tipis oksida yang membuatnya menjadi
tidak reaktif. Akan tetapi saat titanium mulai terbakar di udara, titanium akan terbakar dengan nyala putih yang spektakuler. Ketika Titanium dibakar di udara akan menghasilkan Titanium dioksida dan ketika dibakar dengan Nitrogen murni akan menghasilkan Titanium Nitrida.
Ti(s) + O2(g) → TiO2(s)
Reaksi dengan Halogen
Reaksi Titanium dengan Halogen menghasilkan Titanium Halida. Reaksi dengan Fluor berlangsung pada suhu 200°C.
Ti(s) + 2F2(s) → TiF4(s)
Ti(s) + 2Cl2(g) → TiCl4(s)
Ti(s) + 2Br2(l) → TiBr4(s)
Ti(s) + 2I2(s) → TiI4(s)
Reaksi dengan Asam
Logam Titanium tidak bereaksi dengan asam mineral pada temperatur normal tetapi dengan asam hidrofluorik yang panas membentuk kompleks anion
(TiF6)3-2Ti(s) + 2HF (aq) → 2(TiF6)3-(aq) + 3 H2(g) + 6 H+(aq)
Reaksi dengan basa
Titanium tidak bereaksi dengan alkali pada temperatur normal, tetapi pada keadaan panas. Titanium terbakar di udara ketika dipanaskan menjadi 1200 ° C (2190 ° F) dan pada oksigen murni ketika dipanaskan sampai 610 ° C (1130 ° F) atau lebih , membentuk titanium dioksida. Sebagai hasilnya, logam tidak dapat dicairkan dalam udara terbuka sebelum titik lelehnya tercapai, jadi mencair hanya mungkin terjadi pada suasana inert atau dalam vakum. 2 ] Titanium juga merupakan salah satu dari sedikit elemen yang terbakar di gas nitrogen murni (Ti terbakar pada 800 ° C atau 1.472 ° F dan membentuk titanium nitrida). Titanium tahan untuk melarutkan asam sulfat dan asam klorida, bersama dengan gas klor, larutan klorida, dan sebagian besar asam-asam organik.
Proses Ekstraksi Logam Titanium
Titanium terdiri 0,63% dari kerak bumi dan logam struktural paling berlimpah keempat, setelah aluminium, besi dan magnesium.
Deposito titanium yang dapat ditambang secara ekonomis ditemukan di seluruh dunia. Bijih utama adalah rutil (TiO2) dan ilmenit (FeTiO3) dalam deposito pasir pantai (Australia Barat),
ilmenit-haematite (Kanada), dan ilmenit-magnetit (Ukraina) di deposito hard rock. Meskipun rutil adalah langka dan lebih mahal daripada ilmenit, itu lebih sering digunakan karena tidak mengandung senyawa besi dan karena itu dapat lebih mudah diproses. Namun, ilmenit kadang-kadang diproses untuk menghilangkan zat besi dan membuat rutil ‘sintetis’.
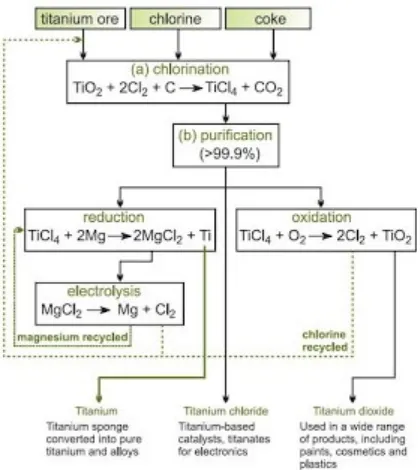
The Kroll Proses
Kebanyakan titanium diproduksi dari bijih yang mengandung titanium dioksida menggunakan proses empat tahap yang panjang:
a) klorinasi bijih menjadi titanium (IV) klorida
c) reduksi titanium (IV) klorida menjadi titanium spons
d) pengolahan titanium spons
(a) Klorinasi bijih untuk titanium (IV) klorida
Titanium dioksida adalah stabil dengan pengaruh suhu dan sangat tahan terhadap serangan kimia. Tidak dapat direduksi dengan menggunakan karbon, karbon monoksida atau hidrogen, dan reduksi oleh logam lebih elektropositif tidak lengkap. Jika oksida diubah menjadi titanium (IV) klorida, maka pembuatan titanium menjadi mungkin, karena klorida yang lebih mudah direduksi.
Bijih kering dimasukkan ke chlorinator bersama dengan kokas dibentuk bedfluida. Setelah bedtelah dipanaskan, panas reaksi dengan klorin cukup untuk mempertahankan suhu di 1300 K.
(b) Pemurnian titanium (IV) klorida
Titanium (IV) klorida mentah dimurnikan dengan distilasi, setelah perlakuan kimia dengan hidrogen sulfida atau minyak mineral untuk menghilangkan vanadium oksiklorida, VOCl3,
yang mendidih pada suhu yang sama seperti titanium (IV) klorida. Produk akhir mempunyai kemurnian (> 99,9%) titanium (IV) klorida yang dapat digunakan baik untuk membuat titanium atau dioksidasi untuk memberikan titanium dioksida untuk pigmen.
Tangki penyimpanan harus benar-benar kering karena produk mengalami hidrolisis cepat dengan adanya air, menghasilkan asap putih padat hidrogen klorida:
(c) Reduksi titanium (IV) klorida menjadi titanium spons
Titanium (IV) klorida adalah cairan yang mudah menguap. Dipanaskan untuk menghasilkan uap yang akan dilewatkan ke dalam reaktor stainless steel mengandung magnesium cair (berlebih), dipanaskan sampai sekitar 800 K dalam suasana argon. Reaksi eksotermik akan menghasilkan titanium (III) dan titanium (II) klorida yang menyebabkan kenaikan suhu yang cepat ke sekitar 1100 K. klorida ini menjalani pengurangan perlahan, sehingga suhu dinaikkan ke 1300 K untuk menyelesaikan proses reduksi. Meski begitu, itu adalah proses yang panjang:
magnesium klorida. Dalam metode alternatif yang digunakan di Jepang, magnesium klorida, bersama-sama dengan magnesium yang tidak bereaksi akan dihilangkan dari titanium dengan destilasi vakum suhu tinggi.
Magnesium klorida dielektrolisa untuk menghasilkan magnesium untuk tahap reduksi dan klorin didaur ulang untuk tahap bijih klorinasi.
Titanium yang dimurnikan dengan distilasi vakum suhu tinggi. Logam titaniumnya adalah yang dalam bentuk granul berpori yang disebut spons. Ini yang dapat diproses dipabrik, atau dijual ke perusahaan lain untuk konversi ke produk titanium.
Gambar Ringkasan konversi bijih titanium menjadi produk yang berguna.
(d) Pengolahan titanium spons
Titanium spons mudah bereaksi dengan nitrogen dan oksigen pada suhu tinggi, spons harus diproses dalam vakum atau suasana inert seperti argon. Pada tahap ini scrap titanium dapat dimasukkan, dan logam lainnya dapat ditambahkan jika paduan titanium diperlukan. Sebuah metode yang umum adalah untuk memampatkan bahan bersama-sama untuk membuat blok besar yang kemudian menjadi elektroda dalam wadah mencair busur listrik. Sebuah bentuk busur antara wadah dan elektroda, menyebabkan elektroda mencair ke dalam wadah di mana didinginkan dan membentuk ingot besar. Ini dapat diulang untuk menghasilkan “lelehan kedua” ingot kualitas yang lebih tinggi.
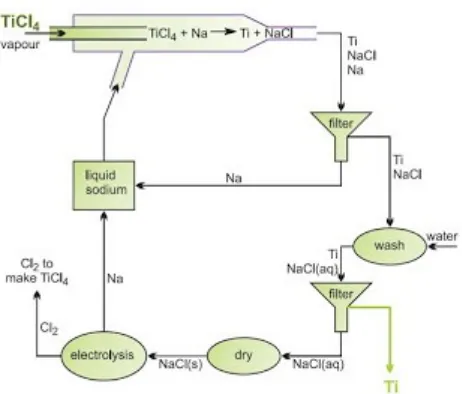
Proses TP Armstrong
Gambar Proses kontinyu untuk pengurangan titanium (IV) klorida.
Uap Titanium (IV) klorida dimasukan ke dalam aliran natrium cair, dan klorida direduksi menjadi logam. Titanium dan natrium klorida terbentuk sebagai padatan, dan diekstrak dari aliran natrium dengan menyaring. Setelah menghilangkan sisa natrium, logam titanium dapat dipisahkan dari garam dengan pencucian sederhana. Natrium klorida dikeringkan, dipanaskan sampai cair dan dielektrolisis, menghasilkan natrium untuk digunakan kembali dan klorin untuk tahap klorinasi awal.
Jika adonan titanium (IV) klorida dicampur secara menyeluruh dengan proporsi yang benar dengan logam klorida lainnya sebelum dimasukkan ke dalam aliran cairan natrium, hasilnya adalah sangat paduan bubuk titanium dengan kualitas yang sangat tinggi, merupakan salah satu keuntungan utama dari proses ini. Misalnya, Ti-6Al-4V diproduksi yang melibatkan aluminium klorida dan vanadium (IV) klorida dalam perbandingan yang tepat.
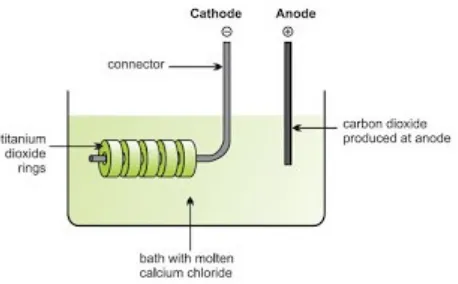
Proses FFC Cambridge
Gambar Reduksi elektrolit dari titanium (IV) oksida.
Jika tegangan yang lebih tinggi diterapkan dengan mekanisme yang berbeda. Kalsium akan mengumpul pada katoda dan bereaksi dengan titanium dioksida untuk membentuk titanium dan ion kalsium ion diperbarui.
Proses ini jauh lebih sederhana daripada metode yang ada, yang beroperasi pada suhu yang lebih rendah (hemat biaya energi), dan memiliki dampak lingkungan yang lebih rendah. Ini memiliki potensi untuk mengurangi biaya produksi secara signifikan, sehingga memungkinkan akan memberi keuntungan dari logam titanium untuk diterapkan pada produk akhir yang lebih luas.
Proses ini juga sedang dipertimbangkan untuk produksi logam lainnya, misalnya, tantalum.
Aplikasi Dari Logam Titanium
Hampir semua titanium digunakan sebagai paduan dengan logam lain. Di antara paduan logam yang paling penting adalah aluminium, vanadium, molibdenum, mangan, besi, timah, kromium dan zirkonium. Salah satu yang paling sering digunakan memiliki komposisi 90% titanium, 6% aluminium, 4% vanadium yang sering direpresentasikan sebagai Ti-6AI-4V.
Industri kedirgantaraan adalah pengguna terbesar dari paduan titanium, menggunakan mereka di badan pesawat utama (body) dari pesawat, dan di berbagai bagian mesin, roda pendaratan dan tubing hidrolik .
Karena kekuatan dan ketahanan terhadap serangan kimia mereka, logam dan paduan digunakan di mana bahan lainnya (bahkan stainless steel) dengan cepat bisa memburuk, seperti dalam air laut. Mereka digunakan dalam baling-baling kapal dan pada pabrik desalinasi dan juga di reaktor pabrik kimia dan pipa.
membantu mengurangi gesekan. Bola duduk dalam cangkir. Hidroksiapatit adalah bentuk alami dari kalsium fosfat, mirip dengan yang terjadi secara alami tulang. Ini mendorong mengikat antara titanium dan tulang alami yang sangat berdekatan.
Titanium yang digunakan adalah paduan, Ti-6Al-4V. Di seluruh dunia ada sekitar 1 juta sendi (lutut ditambah pinggul) diganti setiap tahun. Mereka juga digunakan dalam implan gigi sebagai akar untuk gigi pengganti, dan untuk kasus alat pacu jantung.
BAB III PENUTUP Kesimpulan
1. Logam kadmium adalah unsur kimia yang dalam sitem periodik memiliki nomor atom 48 dan berat atom 112,41 g/mol serta memiliki titik lebur 321 derajat celcius. Logam kadmium dapat larut dengan lambat dalam asam encer dengan melepaskan hidrogen sebab potensial elektrodanya yang negatif.
2. Kromium adalah logam yang kuat dan bercahaya serta sangat tahan terhadap korosi. Karena itu, logam ini dipakai untuk pelindung besi dari proses korosi. Lapisan kromium pada besi dapat dibuat dengan elektrolisis (penyepuhan). Kromium terdapat dalam baja anti karat (stainless steel) yang biasa mengandung 19% kromium, 9% nikel, dan yang lainnya besi.
DAFTAR PUSTAKA
Achmad, Hiskia. 2001. Kimia unsur dan radio kimia. Bandung : PT Citra Aditya Bakti
Palar. 2008. Pencemaran Dan Toksikologi Logam Berat. Jakarta : Rineka Cipta