1
UJI PERBANYAKAN SACCHAROMYCES CEREVISIAE PADA BERBAGAI
MEDIA DAN ANTAGONISNYA TERHADAP PATOGEN ANTRAKNOSA
(COLLETOTRICHUM SP.) PADA CABAI
Aris Kinandar1), Ika Rochdjatun Sastrahidayat2), Anton Muhibuddin3)
Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Brawijaya Email: [email protected]
Abstrak
Saccharomyces cerevisiae merupakan salah satu mikroorganisme yang dapat digunakan sebagai agens hayati. Pembiakan S. cerevisiae secara massal untuk aplikasinya di lapangan mengalami kendala terutama dari segi biaya yang tinggi, oleh karena itu dibutuhkan medium alternatif yang murah dan mudah didapat sebagai medium pertumbuhannya. Tujuan penelitian ialah memiliki isolat S. cerevisiae untuk menekan pertumbuhan Colletotrichum sp. serta menganalisis pertumbuhannya dalam medium tumbuh berbahan dasar hasil produk pertanian YPD cair, ekstrak cabai, ekstrak taoge, air leri, air limbah tahu, dan air kelapa. Biakan S. cerevisiae hasil perbanyakan diuji antagonis secara in vitro terhadap Colletotrichum sp.. Hasil penelitian menunjukan bahwa S. cerevisiae yang diinkubasi pada rotary shaker selama 4 hari diberbagai media menghasilkan air kelapa sebagai media terbaik. Media air kelapa memiliki kerapatan sel tertinggi dibandingkan media laiinya yaitu dengan nilai absorbansi sebesar 1,596. Perlakuan antagonis khamir terhadap patogen menunjukkan bahwa P1 memiliki persentase hambatan relatif tertinggi pada hari ke-9 pengamatan yaitu sebesar 23,67%. P1 merupakan perlakuan dimana inokulasi khamir dan patogen dilakukan pada waktu yang sama yaitu pada 0 HSI.
Keywords: Saccharomyces cerevisiae, Colletotrichum sp., Khamir, Perbanyakan, Antagonis
1. PENDAHULUAN
Saccharomyces cerevisiae merupakan khamir yang umum digunakan dalam fermentasi yang banyak terdapat dalam ragi pasar. S. cerevisiae dapat berkembang biak dalam gula sederhana seperti glukosa, maupun gula kompleks disakarida yaitu sukrosa. Menurut Aditiwi dan Kusnadi (2003) Khamir dapat tumbuh pada habitat yang mengandung gula seperti pada buah-buahan, bunga, dan pada bagian gabus dari pohon. Khamir memerlukan substrat atau medium yang mengandung gula sebagai tempat tumbuhnya. Menurut Amaria, dkk (2001) S. cerevisiae sangat mudah ditumbuhkan pada berbagai media asalkan terdapat sumber karbon, nitrogen, hidrogen, oksigen, sulfur, kalsium, vitamin, mineral serta air.
Pembiakan khamir membutuhkan biaya produksi yang tinggi karena medium pembiakan khamir cukup mahal dan sulit didapatkan. Medium tumbuh alternatif agens hayati dalam bentuk formulasi dengan bahan dasar limbah
organik telah banyak diteliti dan diproduksi secara massal. Ratdiana (2007) dan Rismawan (2011) membuat formulasi medium berasal dari limbah organik cair dan limbah cair ternak sebagai medium untuk Pseudomonas fluorescens. Serta Indratmi (2012) yang membuat medium yang mudah didapat seperti biji trembesi, jagung, cabai dan kentang.
2 Antraknosa merupakan penyakit utama
yang menyebabkan kerugian secara ekonomi di seluruh pertanaman cabai di dunia dan merupakan penyakit penting di daerah tropis maupun subtropis (Sangdee et al. 2011). Penyakit ini berkembang pesat pada kondisi kelembaban yang relatif tinggi. Menurut Yani (2003) umumnya serangan antraknosa pada tanaman cabai di Indonesia akan mengakibatkan kehilangan panen sebesar 14-30 %. Cendawan penyebab penyakit ini adalah Colletotrichum sp. Berdasarkan permasalahan tingginya intensitas penyakit pascapanen antraknosa pada cabai yang disebabkan cendawan Colletotrichum sp., serta mahal dan sulitnya mendapatkan medium pertumbuhan khamir maka dibuat suatu gagasan untuk menjadikan S. cerevisiae sebagai biokontrol patogen Colletotrichum sp. dan bahan-bahan hasil produk pertanian sebagai media pembiakan khamir Saccharomyces cerevisiae. Penelitian ini bertujuan mengevaluasi kemampuan isolat S. cerevisiae dalam menekan pertumbuhan Colletotrichum sp. serta menentukan pertumbuhannya pada media yang mudah didapat.
2. METODE PENELITIAN
Khamir dan Media Pertumbuhan
Khamir yang digunakan dalam penelitian ini adalah Saccharomyces cerevisiae yang diperoleh dari Laboratorium Pengujian Mutu dan Keamanan Pangan Fakultas Teknologi Pertanian Universitas Brawijaya. Khamir tersebut dipurifikasi pada media YPD. Pre-culture dilakukan pada media YPD cair (1 g/ml yeast extract, 2 g/ml pepton, 2 g/ml glukosa) untuk persiapan inokulum. Sedangkan pengamatan pertumbuhan secara makroskopis dan mikroskopis dilakukan pada media YPD agar.
Pembuatan media pertumbuhan khamir dengan menggunakan 6 bahan yaitu YPD, buah cabai, toage, air leri, air limbah tahu dan air kelapa. Untuk pembuatan media kontrol (YPD cair) yaitu yeast extract sebanyak 2 g, pepton 4 g, dekstrosa 20 g, dan akuades 200 ml dicampur dan diaduk hingga rata sambil dipanaskan di atas kompos hingga mendidih, lalu masukkan ke dalam tabung erlenmeyer.
Untuk pembuatan media ekstrak cabai dan taoge, pertama-tama bahan dicuci dengan air sampai bersih, kemudian potong kecil-kecil bahan yang akan digunakan sekitar + 2 cm. Cuci kembali bahan, timbang sebanyak 50 g lalu masukkan ke dalam panci dan tambahkan akuades sebanyak 200 ml. Setelah itu rebus di atas kompor sampai pada kondisi setengah matang, lalu saring dan ambil ekstraknya. Selanjutnya sari bahan dimasukkan ke dalam botol selai.
Sedangkan untuk pembuatan media air leri, air limbah tahu dan air kelapa, yaitu dengan memanaskan bahan sebanyak 200 ml hingga mendidih. Kemudian bahan yang sudah dipanaskan, dimasukkan ke dalam botol selai 250 ml. Setelah itu semua media yang telah dimasukkan ke dalam botol selai disterilisasi dengan autoklaf pada suhu 121 oC dengan tekanan 1 atm untuk menghilangkan kontaminasi mikroorganisme yang tidak diinginkan.
Perbanyakan Khamir S. cerevisiae
Pengujian dilakukan dengan menumbuhkan khamir pada media yang telah dibuat sebelumnya yaitu YPD cair, ekstrak buah cabai, ekstrak toage, air leri, air limbah tahu, dan air kelapa. Perbanyakan dilakukan dengan inokulasi isolat S. cerevisiae yang telah dilakukan penyamaan nilai OD sebelunya sebanyak 1 ml ke dalam botol selai yang berisi 200 ml media. tutup kembali erlenmeyer menggunakan aluminium foil dan plastik wrapping, setelah itu inkubasi media yang berisi khamir di atas orbital shaker selama 4 hari.
Isolasi dan Identifikasi Patogen
Colletotrichum sp.
5-3
7 hari pada suhu ruang. Setelah dilakukan inkubasi, Selanjutnya pemurnian dilakukan dengan mengambil kultur dan dibiakkan lagi dalam media PDA baru hingga menjadi kultur murni.
Identifikasi secara makroskopis dengan mengamati pertumbuhan koloni jamur pada cawan petri, warna koloni, tekstur koloni, pola sebaran dan ada tidaknya lingkaran konsentris. Identifikasi juga dilakukan secara mikroskopis sampai klasifikasi tingkat genus. Sebelum melakukan pengamatan secara mikroskopis perlu dilakukan pembuatan preparat patogen yang dilakukan dengan cara menetesi preparat dengan sedikit aquades steril, kemudian tempelkan solasi pada patogen agar konidia jamur menempel pada solasi, Selanjutnya tempelkan solasi pada preparat yang telah ditetesi aquades steril. Pengamatan morfologi dilakukan dengan bantuan mikroskop cahaya yang kemudian membandingkannya dengan buku kunci identifikasi jamur.
Antagonis S. cerevisiae dengan Jamur
Colletotrichum sp.
Uji antagonis isolat khamir S. cerevisiae dengan Colletotrichum sp. dilakukan secara in-vitro pada media PDA. Khamir yang diujikan yaitu S. cerevisiae hasil perbanyakan pada berbagai media. Uji antagonis isolat khamir dengan jamur Colletotrichum sp. ini menggunakan Rangcangan Acak Lengkap (RAL) dengan 4 perlakuan yang diulang sebanyak 5 kali. Metode pengujian antagonisme khamir secara in vitro mengacu pada Shofiana et al. (2015) yang dimodifikasi. Dimana terdapat tiga perlakuan yaitu khamir dan patogen diinokulasikan pada waktu yang sama (P1), khamir diinokulasi 3 HSI patogen (P2), dan khamir diinokulasi 6 HSI patogen (P3).
Perlakuan diulang sebanyak 5 kali sehingga didapatkan 20 unit percobaan antagonis terhadap Colletotrichum sp.. Pengujian isolat khamir yang diperoleh dilakukan dengan cara menggoreskan khamir pada media PDA tepat ditengah petridis berdiameter 9 cm dengan posisi tegak lurus sebanyak 1 lup inokulasi. Kemudian biakan Colletotrichum sp. yang didapat dari Balittas diambil dengan cork borer dan diletakkan pada sisi kanan dan kiri goresan khamir dengan jarak ± 3 cm kemudian
diinkubasi pada suhu kamar dan diamati selama 9 hari dengan cara mengukur lebar zona hambat khamir terhadap Colletotrichum sp. pada setiap harinya.
Pengamatan Mekanisme Antagonis dengan
Scanning Electron Microscope (SEM)
Metode yang digunakan mengacu pada Hastuti (2016) yaitu hasil uji antagonis dipreparasi terlebih dahulu dengan cara menyiapkan cover glass steril dan diletakkan pada cawan steril. Lalu mengiris 2 x 2 mm pada zona antagonis dan diletakkan diatas cover glass steril yang telah disiapkan. Kemudian dilakukan pengeringan atau dehidrasi bertingkat menggunakan konsentrasi larutan etanol 30%, 50%, 70%, 80%, 90%, dan 96% dengan cara disemprotkan kurang lebih dengan jarak 30 cm. Setiap penyemprotan konsentrasi etanol dilakukan dengan jarak waktu ± 5 menit untuk pengeringan.
Setelah isolat dikeringkan kemudian diletakkan pada alat pemegang spesimen (alumunium stub) dengan perekat koloid pasta perak dan dilapisi logam emas (Au) (ketebalan logam ± 15 mm) dengan mengikuti proses evaporasi. selanjutnya diamati menggunakan mikroskop elektron skanning.
Variabel Pengamatan:
1. Perbanyakan Khamir
a. Kerapatan sel
Kerapatan sel diukur menggunakan metode spektrofotometri. Variabel pengamatan berupa sifat biologi dilakukan dengan mengukur nilai OD (Optical Density). Pengukuran nilai OD dilakukan dengan mengambil contoh substrat pada perbanyakan setiap 24 jam sekali yang masing-masingnya sebanyak 3 ml selama 4 hari pengamatan. Jumlah sel dihitung menggunakan spektrofotometer UV-VIS dengan panjang gelombang 600 nm (Sholikah et al., 2012).
b. Suhu dan pH
4 sekali (Widyanti, 2013). Pada penggunaan pH
meter setiap kali mengukur pH medium biakkan, terlebih dahulu elektroda dibenamkan dalam aquades, dibersihkan dengan tisue, kemudian dicelupkan lagi kemedium biakkan berikutnya, begitu seterusnya sampai medium biakkan terakhir sesuai jumlah perlakuan. Dilanjutkan dengan menghitung jumlah koloni sel.
Uji Antagonis
a. Tingkat Hambatan Relatif
Persentase Tingkat Hambatan Relatif dari uji antagonis khamir S. cerevisiae terhadap patogen Colletotrichum sp. akan dihitung setelah 7 HSI. Persentase Tingkat Hambatan Relatif dihitung menggunakan rumus Begum et al. (2008):
THR = dk−dp
dk x 100% Keterangan:
THR = Tingkat hambatan relatif terhadap pertumbuhan patogen
R1 = jumlah jari-jari koloni (r1+r2) patogen tanpa perlakuan khamir (kontrol)
R2 = jumlah jari-jari koloni (r1+r2) patogen yang diberi perlakuan.
b. Pengamatan Scanning Electron Microscope (SEM)
Cara kerja dari mikroskop elektron skanning adalah sinar dari lampu dipancarkan pada lensa kondensor, sebelum masuk pada lensa kondensor ada pengatur dari pancaran sinar elektron yang ditembakkan. Sinar yang melewati lensa objektif diteruskan pada spesimen yang diatur miring pada pencekamnya,
spesimen ini disinari oleh deteksi x-ray yang menghasilkan sebuah gambar yang diteruskan pada layar monitor (Respati, 2008). Pengamatan dilakukan secara visual terhadap hasil fotomikograf yang diproses dengan foto hitam putih Fuji film.
3. HASIL DAN PEMBAHASAN
Pengaruh Perbanyakan Khamir terhadap Kerapatan Sel
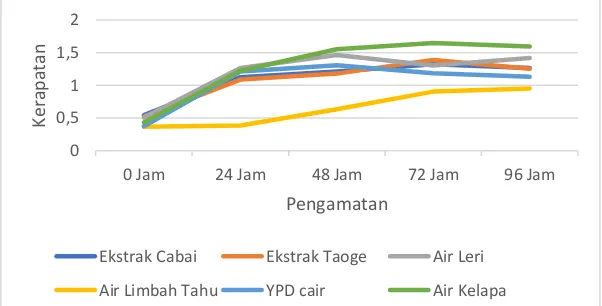
Pembiakan S. cerevisiae pada media tumbuh YPD cair, ekstrak cabai, ekstrak taoge, air leri, air limbah tahu, dan air kelapa menunjukkan bahwa khamir S. cerevisiae dapat tumbuh pada 6 media perbanyakan. Selain itu terlihat juga adanya kondisi fluktuatif pada hasil kerapatan selnya. Rerata kerapatan sel tertinggi pada pengamatan beberapa media perbanyakan ditunjukkan pada perlakuan media air kelapa dengan nilai absorbansi 1,596. Sedangkan perlakuan yang menunjukkan kerapatan sel terendah pada pengamatan hari ke-1 sampai hari ke-4 adalah perlakuan air limbah tahu dengan absorbansi 0,950.
Hal ini sesuai dengan Sahayaraj dan Namasivayam (2008) yang menyatakan bahwa pertumbuhan dan produksi sel pada media air kelapa lebih tinggi dari pada media dari produk pertanian lain. S. cerevisiae hanya dapat menggunakan karbohidrat sederhana seperti yang terdapat pada air kelapa. Menurut Nuraida dkk. (1996) air kelapa mengandung karbohidrat sederhana seperti glukosa, sukrosa, fruktosa, inositol, dan sorbitol yang dapat digunakan oleh S. cerevisiae sebagai sumber karbon.
Gambar 1. Rerata Kerapatan sel S. cerevisiae yang Diperbanyak pada Media YPD Cair, ekstrak cabai, ekstrak taoge, air leri, air limbah tahu, dan air kelapa
0 0,5 1 1,5 2
0 Jam 24 Jam 48 Jam 72 Jam 96 Jam
Ker
ap
at
an
Pengamatan
Ekstrak Cabai Ekstrak Taoge Air Leri
5
Selama pembiakan 96 jam, S. cerevisiae mengalami pertumbuhan yang cepat karena nutrien yang terkandung dalam medium tersedia dalam jumlah yang berlebih untuk dimanfaatkan S. cerevisiae bagi pertumbuhannya. S. cerevisiae memanfaatkan protein, karbon, dan mineral dalam medium sebagai substrat metabolisme untuk sintesis komponen sel. Protein, karbon, dan mineral tersebut dapat diperoleh dari ekstrak khamir, pepton, dekstrosa, limbah cair tahu, air leri, ekstrak cabai, ekstrak taoge, dan air kelapa.
Waktu pembiakan 96 jam pada semua medium memberikan jumlah sel yang terbanyak, karena pada masa tersebut laju pertumbuhan memasuki akhir fase logaritmik. Menurut Fardiaz (1992) fase logaritmik merupakan fase pada saat mikroorganisme membelah dengan cepat. Pada fase ini kecepatan pertumbuhan sangat dipengaruhi oleh medium tempat tumbuhnya seperti pH dan kandungan nutrien, juga kondisi lingkungan termasuk suhu dan kelembaban udara. Selain itu, pada fase ini mikroorganisme membutuhkan energi lebih banyak daripada fase lainnya.
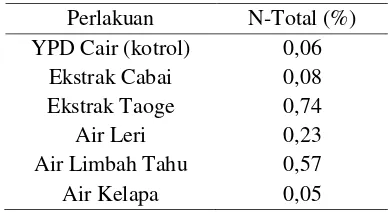
Perbedaan jumlah sel S. cerevisiae pada berbagai medium yang digunakan disebabkan oleh persediaan zat-zat nutrien yang terdapat dalam masing-masing medium tersebut. Menurut Amaria dkk. (2001), untuk tumbuh dan berkembangbiak, S. cerevisiae memerlukan unsur-unsur seperti C, H, O, N, S, P, K, dan berbagai mineral seperti Fe, Mg, Na, dan Mn. Semakin baik nutrien di dalam substrat tempat tumbuhnya, maka pertumbuhan sel semakin cepat sehingga akan meningkatkan kadar protein sel (Fardiaz, 1992). Hasil analisis nitrogen total media YPD cair, ekstrak cabai, ekstrak taoge, air leri, air limbah tahu, dan air kelapa disajikan pada (Tabel 1).
Tabel 1. Hasil analisis N-total media sebelum perbanyakan
Perlakuan N-Total (%) YPD Cair (kotrol) 0,06
Ekstrak Cabai 0,08 Ekstrak Taoge 0,74
Air Leri 0,23
Air Limbah Tahu 0,57
Air Kelapa 0,05
Pertumbuhan dari perbanyakan khamir pada media pertumbuhan tergantung pada isolat khamir dan komponen sumber karbon serta protein sebagai nutrisi yang digunakan dalam media kultur (Geo et al., 2007). Nitrogen merupakan salah satu unsur dalam pembentukan protein menurut Febrianto (2013) Protein adalah polimer dari asam amino yang dihubungkan dengan ikatan peptida yang mengandung unsur-unsur C, H, O, dan N. Dengan proporsi karbon 50-55%, hidrogen 7-6%, oksigen 20-23%, dan nitrogen 12-19%.
Dari hasil analisa N-total (Tabel 1) menunjukkan bahwa media ekstrak taoge memiliki persentase tertinggi yaitu 0,74 %, sedangkan persentase N-total terendah terjadi pada media air kelapa yaitu 0,05 %. Hasil ini tentu tidak sesuai dengan hasil kerapatan sel dimana air kelapa memiliki hasil kerapatan tertinggi. Hal ini dimungkinkan karena air kelapa memiliki nutrisi lainnya yang lebih dibutuhkan S. cerevisiae. Selain itu juga S. cerevisiae lebih mudah memanfaatkan nutrisi dalam bentuk yang sederhana.
Menurut Nuraida dkk. (1996) air kelapa mengandung karbohidrat sederhana seperti glukosa, sukrosa, fruktosa, inositol, dan sorbitol yang dapat digunakan oleh S. cerevisiae sebagai sumber karbon. Berdasarkan hasil analisa proksimat air kelapa mengandung 3,72 % karbohidrat, 0,16 % protein, dan 94,67 % kadar air (Laboratorium Teknik Kimia, ITN, malang, 2016). Hasil analisa proksimat itu menunjukkan bahwa karbohidrat memiliki persentase cukup tinggi. Hal inilah yang mungkin menyebabkan air kelapa menjadi media terbaik untuk pertumbuhan S. cerevisiae.
Pengaruh Perbanyakan Khamir terhadap Suhu Medium
6 Tabel 2. Rerata Pengamatan Suhu media Perbanyakan S. cerevisiae
Perlakuan Pengamatan Suhu
0 Jam 24 Jam 48 Jam 72 Jam 96 Jam
YPD cair (kontrol) 27,4 oC 27,6 oC 27,0 oC 26,6 oC 27,1 oC Ekstrak Cabai 27,3 oC 27,7 oC 27,2 oC 26,6 oC 27,1 oC Ekstrak Taoge 27,5 oC 27,6 oC 27,1 oC 26,6 oC 27,0 oC Air Leri 27,1 oC 27,6 oC 27,2 oC 26,7 oC 27,1 oC Air Limbah Tahu 27,6 oC 27,7 oC 27,2 oC 26,7 oC 27,2 oC Air Kelapa 27,6 oC 27,7 oC 27,2 oC 26,6 oC 27,2 oC
Berdasarkan data pada tabel 2 menunjukkan bahwa S. cerevisiae tidak dapat mempengaruhi naik turunnya suhu pada media pertumbuhannya. Kisaran suhu optimum untuk pertumbuhan dan perkembangan khamir pada umumnya yaitu 28-30 oC (Nurhidayat dkk, 2006). Hasil penelitian telah dilakukan oleh Sukoso dan Wiyanto (2003), menunjukkan bahwa S. cerevisiae mampu tumbuh dengan baik pada media cair maupun padat pada suhu kamar (25-28 oC). Sehingga dengan demikian pertumbuhan S. cerevisiae tetap dapat tumbuh dengan baik.
Pengaruh Perbanyakan Khamir terhadap pH Medium
Dari hasil pada (Tabel 3) tersebut menunjukkan tidak ada pengaruh yang signifikan pada pengamatan pH dari fermentasi S. cerevisiae yang diperbanyak pada media YPD Cair, ekstrak cabai, ekstrak taoge, air leri, air limbah tahu, dan air kelapa yaitu berkisar pada 6,6-6,7. Nilai pH terendah terjadi pada pengamatan ke-0 jam yaitu 6,60 pada media
pertumbuhan ekstrak taoge, air limbah tahu dan air kelapa. Sedangkan nilai dengan pH tertinggi terjadi pada pengamatan ke-96 jam yaitu 6,70 pada media pertumbuhan air limbah tahu dan air kelapa.
Nilai pH medium tersebut masih berada dalam batas normal untuk pertumbuhan S. cerevisiae yaitu 2,5-8,5, sehingga perubahan pH pada semua medium tidak menghambat pertumbuhan S. cerevisiae. Pada medium pertumbuhan, pH mempunyai peran yang sangat penting. Dari tabel 3 tersebut dapat dilihat pH pada medium terus mengalami peningkatan dari jam ke-0 sampai jam ke-96. Hal ini disebabkan sumber karbon dalam medium mulai tidak mencukupi sehingga terjadi pembongkaran protein dalam medium untuk aktivitas metabolismenya. Proses metabolisme tersebut akan menghasilkan metabolit-metabolit hasil degradasi protein seperti urea dan ion-ion amonium yang dapat menyebabkan kenaikan pH (Kuswardani dan Wijajaseputra, 1998).
Tabel 3. Rerata Pengamatan pH media Perbanyakan S. cerevisia
Perlakuan Pengamatan pH
0 Jam 24 Jam 48 Jam 72 Jam 96 Jam
YPD cair (kontrol) 6,63 6,62 6,66 6,69 6,69
Ekstrak Cabai 6,65 6,61 6,66 6,68 6,69
Ekstrak Taoge 6,60 6,62 6,67 6,69 6,69
Air Leri 6,65 6,62 6,66 6,69 6,69
Air Limbah Tahu 6,60 6,62 6,66 6,69 6,70
7
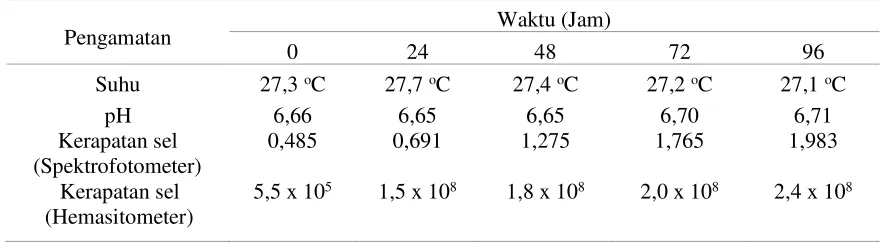
Tabel 4. Pengamatan Perbanyakan S. cerevisiae yang Diperbanyak pada Media Air Kelapa dengan Metode Aerator
Pengamatan Waktu (Jam)
0 24 48 72 96
Suhu 27,3 oC 27,7 oC 27,4 oC 27,2 oC 27,1 oC
pH 6,66 6,65 6,65 6,70 6,71
Kerapatan sel (Spektrofotometer)
0,485 0,691 1,275 1,765 1,983
Kerapatan sel (Hemasitometer)
5,5 x 105 1,5 x 108 1,8 x 108 2,0 x 108 2,4 x 108
Perbanyakan S. cerevisiae pada Media Air Kelapa dengan Metode Aerator
Perbanyakan mikroba dengan menggunakan metode aerator merupakan sistem pertumbuhan mikroba yang mendapatkan energi melalui respirasi aerob. S. cerevisiae merupakan jenis mikroba fakultatif anaerob. Jika ada udara, maka energi atau tenaga diperoleh melalui respirasi aerob, hal tersebut tidak digunakan dalam pembentukan alkohol melainkan untuk pertumbuhan dan perkembangan sel. Sedangkan tenaga yang diperoleh melalui respirasi anaerob sebagian digunakan untuk pembentukan alkohol (Judoamidjojo, 1990). Hasil pengamatan perbanyakan S. cerevisiae pada media air kelapa dengan metode aerator disajikan pada (Tabel 4). Dari hasil pada tabel 4 menunjukkan pada pengamatan suhu dan pH tidak terdapat perbedaan yang signifikan dari hasil pengamatan jam ke-0 sampai jam ke-96. Pada pengamatan suhu setelah hari pertama pengamatan suhu terus menurun hingga hari keempat, namun penurunannya tidak berpengaruh terhadap pertumbuhan khamir karena nilainya masih pada kondisi optimum untuk pertumbuhan S. cerevisiae. sedangkan pada pengamatan nilai pH nilainya cendrung meningkat hingga hari keempat. Nilai pH dari jam 0 sampai jam ke-96 terlihat telah melewati dari kondisi optimum untuk pertumbuhan S. cerevisiae. Menurut Nurhidayat dkk (2006) khamir memerlukan media dengan suasana asam, yaitu anatara pH 4,8 – 5,0. Namun nilai pH medium tersebut masih berada dalam batas normal untuk pertumbuhan S. cerevisiae yaitu 2,5-8,5, sehingga perubahan pH pada semua medium tidak menghambat pertumbuhan S. cerevisiae.
Pada pengamatan kerapatan sel dilakukan dengan 2 metode, yaitu spektrofotometer dan hemasitometer. Dari hasil kedua metode tersebut terlihat nilai kerapatan sel terus meningkat hingga pengamatan terakhir pada hari keempat. Pada perbanyakan dengan metode aerator menunjukkan bahwa jumlah kerapatan sel pada hari terakhir pengamatan lebih besar dibandingkan dengan metode shaker. Hal ini membuktikan bahwa khamir S. cerevisiae dapat tumbuh lebih baik pada kondisi aerob.
Menurut johnson (2008), aerasi dengan cara air bubble cukup efektif untuk meningkatkan kadar oksigen terlarut dalam cairan fermentasi. Saccharomyces sp. bersifat fakultatif aerobik, dimana pada kondisi aerobik, oksigen berperan sebagai akseptor elektron terakhir pada jalur reaksi bioenergetiknya. Menurut Meyer (1978), pada kondisi aerobik pemanfaatan gula menghasilkan penambahan biomassa sel dengan reaksi:
C6H12O6 CO2 + H2O + Biomassa sel
Dengan pemberian aerasi diharapkan terjadi perbanyakan sel S, cerevisiae var. Ellipsoideus secara maksimal. Pada kondisi aerob gula akan dikonversi menjadi energi melalui siklus Krebs, energi ini diperlukan sel untuk memperbanyak diri.
Isolasi dan identifikasi patogen
Colletotrichum sp.
8 keabu-abuan dengan tekstur agak kasar,
memiliki lingkaran konsentris dan pola sebaran koloni yang beraturan. Jamur ini memenuhi cawan petri dalam waktu 10 hari. Berdasarkan morfologi tersebut, dapat diketahui bahwa jamur yang diisolasi telah sesuai dengan yang dideskripsikan oleh Benyahia (2003) bahwa koloni jamur Colletotrichum sp pada media PDA awalnya berwarna putih kemudian menjadi putih keabu-abuan hingga abu-abu gelap kehitaman.
Gambar 2. Colletotrichum sp.; A) Makroskopis pada media PDA; B) Mikroskopis (1) hifa, (2)
konidiofor, (3) konidia;
Mikroskopis. Secara mikroskopis jamur ini memiliki miselium bersekat, konidiofor tidak bercabang, konidia berbentuk hialin, serta terdapat apresoria dan seta. Menurut Singh (1998) secara mikroskopis jamur Colletotrichum sp. memiliki sel uniseluler berbentuk hialin yang berada pada ujung konidiofor yang tidak bercabang, memiliki setae, apressoria, miselium yang terdiri dari beberapa septa, serta intra interseluler hifa.
Uji Antagonis S. cerevisiae terhadap Patogen
Colletotrichum sp.
Tabel 5. Rerata persentase hambatan khamir S. cerevisiae terhadap pertumbuhan patogen
Colletotrichum sp. pada 9 HSI
Berdasarkan hasil analisis menggunakan uji BNT pada taraf kesalahan 0,05 (Tabel 5) menunjukkan pengaruh beda nyata antara
perlakuan dengan kontrol dalam menghambat pertumbuhan patogen Colletotrichum sp.. Pada perlakuan P1, P2, dan P3 dari hari ke-1 sampai hari ke-8 pengamatan tidak menunjukkan pengaruh yang berbeda nyata. Namun pada pengamatan hari ke-9 terdapat pengaruh yang berbeda nyata antar perlakuan, dimana perlakuan P2 dan P3 berbeda nyata dengan dengan perlakuan kontrol, yang masing-masing persentase hambatannya yaitu 17,33% dan 17,67%.
Sedangkan perlakuan P1 menunjukkan pengaruh yang berbeda nyata dengan perlakuan P2 dan P3 dengan persentase hambatan yaitu sebesar 23,67%. Berdasarkan hasil antagonis tersebut P1 memiliki nilai hambatan tertinggi, dimana P1 merupakan perlakuan khamir dan patogen diinokulasikan pada waktu yang sama atau pada hari ke-0 pengamatan. Berikut hasil dokumentasi uji antagonis khamir S. cerevisiae terhadap patogen Colletotrichum sp. yang diisolasi dari buah cabai pada 9 HSI (Gambar 3).
Gambar 3. Hasil uji antagonis khamir S. cerevisiae terhadap patogen Colletotrichum sp.
dari buah cabai pada 9 HSI Keterangan:
A: Kontrol patogen Colletotrichum sp., B: P1 (0 HSI), C: P2 (3 HSI), D: P3 (6 HSI)
Dari gambar di atas terlihat jelas perbedaan antara kontrol dengan perlakuan, dimana pada perlakuan menunjukkan patogen dapat tumbuh mendekati khamir tetapi hifa yang semakin dekat dengan khamir terlihat semakin
A B
C D
PERLAKUAN Rerata Persentase
hambatan (%)
Kontrol 0,00a
P1 23,67c
P2 17,33b
9
transparan. Pada perlakuan P1 juga terlihat khamir mengeluarkan cairan atau zona bening yang diduga digunakan untuk menghambat pertumbuhan patogen. Hal ini membuktikan bahwa terjadi mekanisme antagonis antara khamir dengan patogen. Kemampuan khamir dalam menekan kejadian penyakit diduga karena khamir menghasilkan enzim yang mampu mendegradasi dinding sel patogen. Khamir memiliki mekanisme antagonis berupa kompetisi nutrisi dan ruang, parasitisme dan produksi enzim litik serta induksi ketahanan sehingga mampu mengendalikan beberapa patogen pasca panen (Nunes, 2012). Menurut Wilia et.,al, (2012) Terbentuknya zona hambatan yang diduga merupakan mekanisme enzimatik yang dihasilkan oleh khamir sebagai akibat dari adanya kompetisi makanan dan tempat hidup antara khamir dengan patogen.
Mekanisme antagonis yang dihasilkan yaitu antibiosis dan kompetisi. Antibiosis merupakan salah satu mekanisme antagonis oleh khamir dengan menghasilkan senyawa penghambat pertumbuhan mikroorganisme lain (Madigan dkk, 2012). Beberapa contoh senyawa tersebut adalah enzim litik, senyawa volatil, siderofor, serta killer toksin (Haggag & Mohamed, 2007). Sedangkan kompetisi ditunjukkan dengan adanya perbedaan kecepatan tumbuh antara khamir dengan koloni patogen. Mekanisme
kompetisi ruang dan nutrisi merupakan mekanisme yang umum dilakukan oleh khamir dalam mendominasi habitat karena pertumbuhannya yang lebih cepat. Khamir dapat tumbuh cepat, mendominasi dan mengkolonisasi di habitat baru dengan sumberdaya terbatas (Bellows, 1999).
Pengamatan Mekanisme Antagonis dengan
Scanning Microscope Electron (SEM)
Pada pengamatan secara mikroskopis menggunakan SEM (Gambar 4) khamir S. cerevisiae tidak mengkoloni jamur Colletotrichum sp., namun menyebabkan malformasi pada hifa. Malformasi hifa yaitu penyusutan ukuran hifa sehingga hifa terlihat kurus dan belekuk. Menurut Shalehah (2017) hifa jamur yang terserang oleh khamir dapat mengalami perubahan bentuk seperti penyusutan ukuran hifa sehingga hifa terlihat kurus dan berlekuk-lekuk. Pada hasil tersebut tidak terlihat senyawa antibiosis yang dikeluarkan oleh S. cerevisiae dalam menhambat pertumbuhan Colletotrichum sp.. Mekanisme lainnya yang berperan dalam aktivitas biokontrol khamir terhadap jamur diantaranya adalah kompetisi ruang dan nutrisi, produksi senyawa toksik, volatil, produksi enzim kitinase, antibiosis dan adanya aktivitas kinolitik.
10 4. KESIMPULAN
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan bahwa uji perbanyakan S. cerevisiae pada berbagai media dengan metode shaker menghasilkan air kelapa sebagai media dengan kerapatan sel tertinggi. Selain itu validasi perbanyakan dengan metode aerotor pada media air kelapa menghasilkan kerapatan sel khamir lebih tinggi dibandingkan dengan metode shaker. Berdasarkan pengujian antagonisme khamir dengan jamur Colletotrichum sp. yang telah dilakukan dapat disimpulkan bahwa pada perlakuan P1 khamir memiliki kemampuan antagonisme sebesar 23,67%, perlakuan P2 memiliki kemampuan antagonisme sebesar 17,33%, dan perlakuan P3 memiliki kemampuan antagonisme sebesar 17,67%.
5. REFERENSI
Aditiwati, P. Dan Kusnadi. 2003. Kultur Campur dan Faktor Lingkungan Mikroorganisme yang Berperan dalam Fermentasi “Tea -Cider”. PROC. ITB Sains & Tek. 35 A (2) : 147-162
Amaria, Isnawati, Rini, dan Tukiran. 2001. Biomassa Saccharomyces cerevisiae dari limbah buah dan sayur sebagai sumber vitamin B. Himpunan Makalah Seminar Nasional Teknologi Pangan. 138-150 Begum, M.M., M. Sariah, M.A. Zainal, et al.
2008. Antagonistic Potensial of Selected Fungal and Bacterial Biocontrol Agents against Colletotrichum truncatum of Soybean Seeds. Pertanika Journal Tropic Agriculture Science 31 (1): 45-53
Bellows, T. S. and F. W., Fisher. 1999. Biological Control Priciples and Aplications of Biological Control. Academic Press
Benyahia, H. 2003. First Report of Colletotrichum gloeosporioides causing withertip on Twigs and Tears Stain of Fruit of Citrus in Morocco. National Institute of Agronomic Research
Fardiaz, S. 1992. Mikrobiologi Pangan I. Gramedia Pustaka Utama, Jakarta
Haggag, W. M., and H. Mohamed. 2007. Biotechnological Aspects of Microorganisms Used in Plant Biological
Control. American-Eurasian Journal of Sustainable Agriculture 1, 7-12
Indratmi, D. 2012. Penggunaan Debaryomyces sp. Dan Schizosaccharomyces sp. Dengan Adjuvant Untuk Pengendalian Penyakit Antraknosa Pada Mangga. Jurnal Gamma 5 Johnson, F. L. dan Cheddington B. 2008. Effectiveness of Various Methods of Wort Aeration.
http://cdn2.libsyn.com/basicbrewing/Aerati onMethods.pdf
Judoamidjojo, E. 1990. Teknologi Fermentasi. Jakarta: Penerbit Rajawali Press. hal. 57 Kuswardani, I dan A. I. Wijajaseputra. 1998.
Produksi Protein Sel Tunggal Phanerochaete chrysosporium pada media limbah cair tahu yang diperkaya: kajian optimasi waktu panen. Prosiding Seminar Nasional Teknologi Pangan dan Gizi. 604-613
Madigan, M. T., Martinko, J. M., Stahl, D. A., dan Parker, J. 2012. Brock: Biology of Microorganism. 13 th Edition. Pearson Education, Inc., United States of America. Halaman : 3
Meyer, H. L. 1978. Food Chemistry. Reinhold Publishing Corporation, New York
Nuraida, L., S. H. Sihombing, dan S. Fardiaz, 1996. Produksi karotenoid pada limbah cair tahu, air kelapa dan onggok oleh kapang Neurospora sp. Buletin Teknologi dan Industri Pangan 7 (1): 67-74
Ratdiana. 2007. Kajian pemanfaatan air kelapa dan limbah cair peternakan sebagai media alternatif perbanyakan Pseudomonas fluorescens serta uji potensi antagonismenya terhadap Ralstonia rolfsii [skripsi]. Bogor: Institut Pertanian Bogor Respati, S. M. B. 2008. Macam-macam
Mikroskop dan Cara Penggunaan. Jurnal Momentum 4(2): 42-44
Rismawan AK. 2011. Keefektifan formulasi Pseudomonas fluorescens dalam limbah organik sebagai pestisida hayati dan pemicu pertumbuhan tanaman cabai [skripsi]. Bogor: Institut Pertanian Bogor
11
Fungi Using Agricultural Products and by Products. African Journal of Biotechnology 7 (12):1907-1910
Sangdee A, Sachan S, Khankhum S. 2011. Morphological, pathological and molecular variability of Colletotrichum capsici causing anthracnose of chilli in the North-east of Thailand. Afr J Microbiol Res. 5(25):4368–4372. DOI:10.5897/ AJMR11.476. DOI: http://dx.doi.org/10. 5897/AJMR11.476
Shalehah, N. A. 2017. Eksplorasi Khamir dan Bakteri sebagai Kandidat Agens Antagonis Penyebab Penyakit Busuk Pangkal Batang (Botryodiploidi theobromae Pat.). Skripsi. Institut Pertanian Bogor. Bogor
Singh, R. S. 1998. Plant Diseases. Seventh Edition. Oxford & IBH Publishing CO. PVT. LTD. New Delhi. Hal 640
Shofiana R. H. 2015. Eksplorasi Jamur Endofit dan Khamir pada Tanaman Cengkeh (Syzygium aromaticum) Serta Uji Potensi Antagonismenya terhadap Jamur Akar Putih (Rigidopus micoporus). Skripsi. Universitas Brawijaya. Malang
Widiyanti, 2013. Pembangunan Kebun Bibit Batang Bawah Karet (Hevea brasilliensis). Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan Surabaya
Wiyanto, Sukoso dan Arumingtyas E.L., 2003. Karakterisasi Marine Yeast dari Perairan Laut Jawa Melalui Pendekatan Fisiologi dan Molekuler. Tesis. Program Pascasarjana. Universitas Brawijaya. Malang