KAJIAN TRANSLOKASI BEBERAPA CLADE ZOOXANTHELLAE TERHADAP SINTASAN DAN PERTUMBUHAN KARANG
Goniastrea aspera
Abstrak
Teknik translokasi zooxanthellae antar inang pada biota karang merupakan salah satu upaya untuk memberikan pembuktian terhadap teori adaptasi Buddemeier dan Fautin (1983). Di samping itu, maraknya perdagangan karang akhir-akhir ini perlu diantisipasi masalisasi produk karang melalui teknik-tektik buatan dengan tanpa menggantungkan sepenuhnya pada sediaan alamiah. Bioteknik translokasi zooxanthellae pada karang diperkirakan dapat memberikan pemecahan masalah tersebut. Dengan demikian, kajian translokasi dapat memberikan jawaban mendasar tentang pemulihan terumbu karang.
Penelitian translokasi zooxanthellae ini bertujuan untuk : a) Mengevaluasi efek pengkayaan zooxanthellae terhadap perkembangan zooxanthellae pada jaringan polip Goniastrea aspera; b) Mengevaluasi efek pengkayaan zooxanthellae terhadap perkembangan zooxanthellae pada jaringan polip
Goniastrea aspera, b) Mengevaluasi efek pengkayaan zooxanthellae terhadap
translokasi pada jaringan polip binatang karang dan c) Mengkaji pengaruh translokasi terhadap pertumbuhan karang. Penelitian bersifat eksperimental. Biota uji adalah karang jenis Goniastrea aspera, sedang jenis zooxanthellae yang diperkaya dalam media inkubasi karang adalah jenis clade A, B dan C hasil pemurnian. Pengeraman bersifat resirkulasi pada lapangan indor Balai Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara. Penelitian berlangsung selama 30 minggu. Penelitian dilakukan di BBPBAP Jepara dalam lingkungan perairan binaan maupun di perairan alami lingkungan kawasan terumbu karang Pulau Panjang Jepara mulai Maret 2007 – Agustus 2008.
Hasil penelitian menunjukkan bahwa : a) Translokasi yang terkendali oleh kondisi lingkungan khususnya temperatur memberikan respon positif terhadap proses relokasi dan pertumbuhan zooxanthellae pada jaringan polip Goniastrea
aspera, b) Translokasi zooxanthellae pada Goniastrea aspera pasca bleaching
pada lingkungan binaan terjadi pada hari ke 17, sedangkan di perairan alami dapat terjadi lebih dini; c) Proses pengenalan, penempatan dan pertumbuhan zooxanthellae memungkinkan karang Goniastrea aspera dapat tumbuh secara normal di media alami.
Abstract
Inter-host translocation technique of zooxanthellae was attempted to prove Buddemeier and Fautin (1983) theory on adaptation. The recent trend of coral products trading must be anticipated by its mass production through artificial techniques, the alternation of natural resources. Translocation bio-technique of zooxanthellae on coral was expected to resolve the problem and the translocation study should provide fundamental answer to coral reclamation.
The study of zooxanthellae translocation was proposed to: a) Evaluate the effect of zooxanthellae enrichment on its growth on Goniastrea aspera polyp tissue; b) Evaluate the effect of zooxanthellae enrichment on its translocation on coral polyp tissue, and c) Investigate the effect of translocation on coral growth. The research was experimental, involving coral species Goniastrea aspera, and purified zooxanthellae clade A, B and C with circulating incubation condition in Main Center of Brackishwater Aquaculture Development Jepara indoor area. The experiment took place for 30 weeks in both model environment waters and natural environment waters of Jepara Pulau Panjang coral area from March 2007 to August 2008.
The research showed that: a) In the controlling of temperature environment on translocation provided positive response of Goniastrea aspera’s normal life,
relocation and growth rate of zooxanthellae as in nature, b) In the artificial waters, translocation zooxanthellae to polyp tissue of Goniastrea aspera occured at day 17 and more fast in the natural waters and c) recognition, resettlement, and growth process of zooxanthellae made it possible for Goniastrea aspera to grow normally in natural waters.
Pendahuluan
Terumbu karang merupakan ekosistem yang mempunyai keanekaragaman hayati tinggi dan memainkan peranan penting dalam siklus biogeokimia laut. Secara spesifik ekosistem ini dibentuk oleh species kunci yaitu karang. Karang sebagai penyusun utama terumbu mampu menyediakan nutrien sehingga menjadikan wilayah ini sebagai perairan yang subur. Penentuan produktivitas yang tinggi ini terutama disumbangkan secara bersama dengan simbionnya yaitu zooxanthellae. Hubungan timbal balik secara fisiologis ini dimanfaatkan oleh zooxanthellae memproduksi bahan-bahan organik dan terkonstribusi kepada karang untuk reproduksi, pertumbuhan (dalam bentuk deposit CaCO3) serta rekolonisasi. Sebaliknya karang menjadi suatu gudang
nutrisi bagi perkembangan zooxanthellae.
Keberhasilan hubungan simbiosis antara karang dan zooxanthellae dapat dilihat dari besarnya keragaman dan usia karang yang sangat tua, berevolusi pertama kali lebih dari 200 juta tahun yang lalu (Burke et al., 2002). Pada dua dekade terakhir hubungan simbiosis ini mengalami ujian yang sangat berarti dan mengancam eksistensinya sebagai ekosistem yang mempunyai keanekaragaman hayati tinggi yaitu berupa pemutihan. Kejadian pemutihan pada karang memberikan tekanan baik kepada inang maupun simbion sekaligus. Tekanan ini diimplementasikan dengan keluarnya atau terlepasnya zooxanthellae dari jaringan
ikat sel baik pada endoderm maupun mesoglea. Kemampuan pulih dari tekanan akibat temperatur ini dibuktikan dengan persyaratan masih tertahannya zooxanthellae di sebagian jaringan polip sebagaimana pada uji degradasi jaringan polip dan ketahanannya. Hal yang sama juga diinformasikan oleh Glasson (1993).
Proses simbiosis zooxanthellae dan karang dikemukakan oleh Coffort dan Santos (2005) bahwa sebagian besar transduksi terjadi sejak masa embrionik karang. Pengamatan yang dilakukan oleh La Jeunesse et al., (2003) dan Pochon
et al., (2001) mengindikasikan hal yang sama. Dalam hal ini type zooxanthellae
C17 hanya ditemukan pada Montipora Spp; C22 hanya ditemukan pada
Turbinaria Spp dan C27 ditemukan hanya pada Pavona varian pada kedalaman
10 meter. Pochon et al., (2001) menemukan bahwa Foraminifera ditransduksi terutama oleh Symbiodinium type clade F. Pengamatan ini diindikasikan oleh hanya ditemukannya clade tunggal zooxanthellae pada karang yang sudah dapat teridentifikasi. Namun demikian dalam perkembangannya, dinyatakan oleh Schwarz et al., (2008) bahwa justru terjadinya transduksi secara turunan hanya sebagian kecil yang dialami oleh karang. Dalam penelitiannya terhadap keberadaan zooxanthellae pada berbagai stage perkembangan karang, dikemukakan bahwa zooxanthellae hanya sedikit ditemukan pada masa telur
Acropora palmata dan Montastraea faveolata. Namun dalam perkembangannya
menjadi planula justru transduksi dari alam yang lebih banyak ditemukan.
Coffroth et al., (2001) menyatakan bahwa jenis yang awalnya tertransduksi oleh clade tertentu mungkin akan berkembang simbionnya hingga dewasa. Namun dalam perkembangannya apabila secara terbuka terjadi transduksi
clade baru, maka clade baru ini akan menyusun bentuk baru memperkaya clade
sebelumnya. Selanjutnya berkenaan dengan analisis ragam jenis dan ragam inang diperoleh keterangan dari hasil uji DNA yang dilakukan oleh Rowan dan Powers (1991) bahwa tidak hanya satu jenis zooxanthellae di perairan dan di samping itu juga diinformasikan Pocillopopra damicornis dan Pocillopora meandrina
mempunyai 2 (dua) clade zooxanthellae yang sama. Ini berarti bahwa ditemukan genotip algae yang sama pada inang yang berbeda. Keterangan ini mungkin sudah cukup untuk membuktikan bahwa ada kemungkinan silang simbiont antar karang satu dengan lainnya, serta tidak menutup kemungkinan silang antar invertebrate
laut khususnya organisme yang hidup dalam satu ekosistem seperti Sea Anemon dan Tridacna.
Karang yang mengalami tekanan temperatur dan terjadi pemutihan secara parsial yang oleh kondisi lingkungannya mengalami pemutusan efek. Pada kondisi dapat bertahan hidup maka biota ini mempunyai potensi tertransduksi oleh simbion lain. Hal ini didasarkan pada potensi transduksi sebagaimana dinyatakan oleh Coffroth et al., (2001). Di samping itu, juga diketemukan bahwa potensi transduksi yang semakin meningkat pada perkembangan stadianya dibandingkan dengan masa stadia awal yaitu telur dan planula (Schwarz et al., 2008). Jeda waktu pemulihan memberikan peluang terjadinya pengenalan dan transduksi. Dasar inilah yang melatarbelakangi adanya kajian translokasi antar clade.
Penelitian ini merupakan penggabungan dari dua tahap penelitian sebelumnya yang berdiri secara parsial. Keduanya merupakan dukungan terhadap kajian translokasi yang diteliti pada tahap akhir. Berkenaan dengan hal tersebut, maka penelitian translokasi zooxanthellae ini bertujuan untuk :
1. Mengevaluasi efek pengkayaan zooxanthellae terhadap perkembangan zooxanthellae pada jaringan polip Goniastrea aspera;
2. Mengevaluasi efek pengkayaan zooxanthellae terhadap translokasi pada jaringan polip binatang karang;
3. Mengkaji pengaruh translokasi terhadap pertumbuhan karang. Metodologi
Penelitian tentang translokasi beberapa clade zooxanthellae dan efek lanjutnya tehadap pertumbuhan karang Goniastrea aspera merupakan seri ketiga dari penelitian sekuensial sebelumnya tentang uji keragaman genetik zooxanthellae dan kajian pertumbuhannya di lingkungan binaan dan uji degradasi polip karang dan ketahanan biota karang pasca pemutihan. Berkenaan dengan hal tersebut maka diperlukan perangkat metodologi sebagaimana uraian berikut. Peralatan Percobaan
Peralatan yang dipergunakan dalam penelitian ini secara rinci diuraikan sebagai berikut : Peralatan kejut temperatur berupa thermoregulator kapasitas 25– 40oC; set peralatan bak penangkaran, aerator yang dilengkapi dengan batu aerasi
dan selangnya; pencahayaan neon hijau. Peralatan inkubasi karang dan pemassalan zooxanthellae : bak 5 ton, aerator yang dilengkapi dengan batu aerasi dan selangnya; pencahayaan neon hijau. Peralatan uji diversitas zooxanthllae seperangkat peralatan PCR (Polymerase Chain Reaction) mencakup PCR thermocycler, elektrophoresis chamber dan UV transiluminator. Peralatan analisis kualitas air media : seperangkat penangas (water heater dan stirer) dan filter air,
deionyzed water instrument; thermometer skala 50oC, refraktometer dan
spectrophotometer. Peralatan untuk penerapan temperatur adalah thermoregulator. Bahan Percobaan
Bahan uji adalah zooxanthellae clade A, B dan C yang dimurnikan dari kombinasi berbagai sumber inang tridacna, sea anemon, karang Acropora, Favites
dan Gonistrea aspera. Jenis clade yang dipergunakan dalam percobaan tahap ini
sebelumnya telah dilakukan pentahapan pemurnian mengikuti tata cara sebagaimana dihasilkan pada percobaan penumbuhan massal. Di samping itu juga didasarkan peneraan genetiknya. Bahan ini dipergunakan sebagai bahan penyilang untuk translokasi di dalam media pengeraman karang.
Karang yang akan dipergunakan sebagai bahan percobaan adalah jenis
Gonistrea aspera. Jenis ini selain dipergunakan sebagai penera translokasi juga
dipergunakan untuk telaah respon pertumbuhannya. Alyzarin red sebagai bahan pewarna untuk pertumbuhan karang dan plastik pembungkus. Bahan analisis kualitas air untuk analisis oksigen terlarut, nitrit, ammonia, ammonium dan orthofosfat, bahan analisis untuk diversitas zooxanthellae sebagaimana dirinci dalam prosedur analisis zooxanthellae sebagaimana diinformasikan pada Bab III. Tahapan Penelitian
Untuk mengarahkan kepada tujuan yang hendak dicapai, maka dilakukan beberapa langkah kegiatan yang dirinci sebagaimana diuraikan berikut.
a. Penataan Peralatan
Percobaan translokasi merupakan percobaan sekuensial akhir dari serangkaian percobaan sebelumnya. Sebagai percobaan sekuensial, maka perlakuan yang akan diterapkan bergantung kepada hasil dari dua percobaan sebelumnya, yaitu :
Hasil percobaan penumbuhan massal dan ragam genetik zooxanthellae dihasilkan tiga jenis clade serta pengaturan peubah utama optimum berdasarkan hasil penelitian seri pertama. Clade yang ditemukan adalah jenis A, B dan C, sedangkan peubah utama media yang perlu dipertahankan adalah pengaturan lingkungan indoor, temperatur <25oC dengan pencahayaan hijau (green).
Hasil percobaan parsial seri kedua yaitu uji degradasi dan pulih diri jaringan polip goniastrea aspera terhadap terapan berbagai taraf temperatur menghasilkan terapan kejut temperatur 36oC dalam waktu 6 jam.
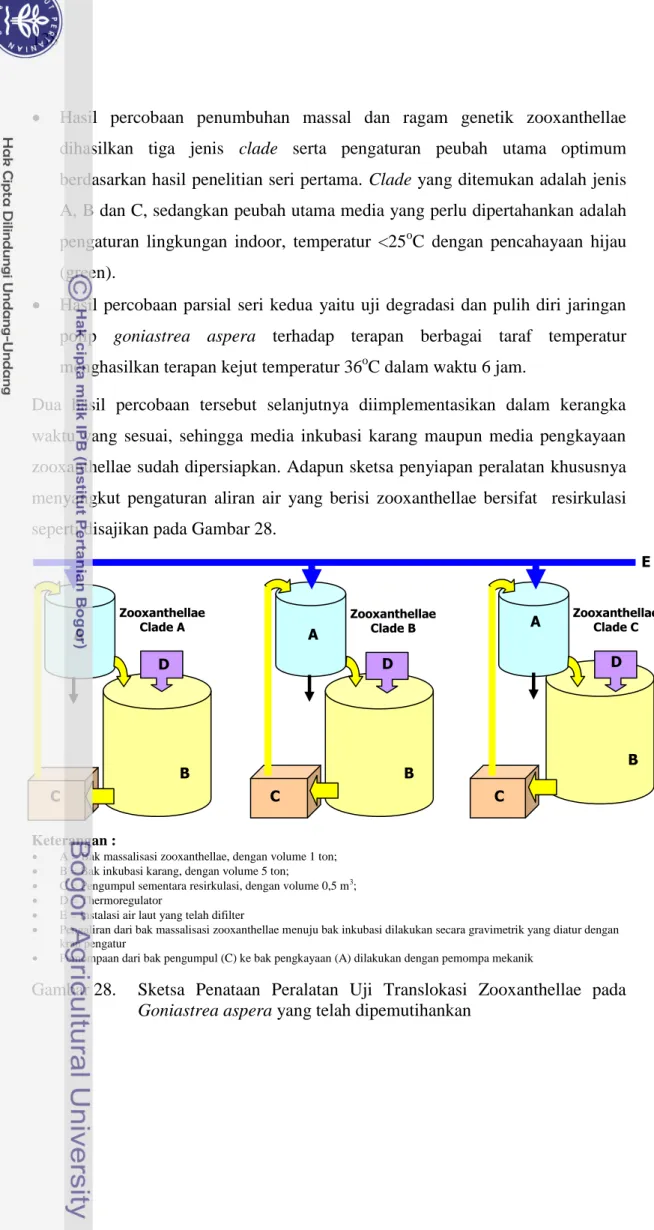
Dua hasil percobaan tersebut selanjutnya diimplementasikan dalam kerangka waktu yang sesuai, sehingga media inkubasi karang maupun media pengkayaan zooxanthellae sudah dipersiapkan. Adapun sketsa penyiapan peralatan khususnya menyangkut pengaturan aliran air yang berisi zooxanthellae bersifat resirkulasi seperti disajikan pada Gambar 28.
Keterangan :
A = Bak massalisasi zooxanthellae, dengan volume 1 ton; B = Bak inkubasi karang, dengan volume 5 ton;
C = Pengumpul sementara resirkulasi, dengan volume 0,5 m3; D = Thermoregulator
E = Instalasi air laut yang telah difilter
Pengaliran dari bak massalisasi zooxanthellae menuju bak inkubasi dilakukan secara gravimetrik yang diatur dengan kran pengatur
Pemompaan dari bak pengumpul (C) ke bak pengkayaan (A) dilakukan dengan pemompa mekanik
Gambar 28. Sketsa Penataan Peralatan Uji Translokasi Zooxanthellae pada
Goniastrea aspera yang telah dipemutihankan
A A A B B B C C C Zooxanthellae Clade B Zooxanthellae
Clade A Zooxanthellae Clade C
D D D
b. Pelaksanaan Penelitian Translokasi b.1. Aklimatisasi
Specimen karang sebelum dimasukkan ke dalam masing-masing unit translokasi dimasukkan dalam bak ukuran 10 ton untuk aklimatisasi selama 2 hari di dalam ruang indoor. Pengisian airnya telah difilter dengan ukuran 0,2 m dan air lautnya telah ditreatment dengan UV untuk mencegah masuknya pengaruh nutriphilik phytoplankton dan bakteri. Fluktuasi temperatur di media specimen tersebut berkisar antara 20-25oC. Jenis karang yang nantinya akan dicobakan adalah jenis karang yang tidak ada perubahan warna, produksi mukus, penjuluran polip atau ciri lain yang menunjukkan adanya tekanan faali pada specimen. Ciri-ciri tersebut dideteksi selama masa aklimatisasi (Nordemar et al., 2003).
Aklimatisasi dimaksudkan untuk mendapatkan contoh yang sehat sehingga dapat mengeliminasi pengaruh lain selain dari efek perlakuan. Dalam hal ini aklimatisasi dilakukan kepada spesimen yang akan dicobakan dengan jumlah dan skenario analisis sebagaimana diperlihatkan pada Tabel berikut.
Tabel 14. Pengelolaan Sample Tiap Perlakuan
Sampling pada minggu ke Jumlah sample (koloni) Analisis 0 2 2 Densitas Jaringan
DNA (4 koloni diambil 2 dari sisa analisis densitas zooxanthellae dan 2 sisa analisis jaringan polip karang)
3 2
6 5
Densitas
DNA (kukurangan 2 koloni diambil 2 dari sisa analisis densitas zooxanthellae) Pertumbuhan 6 2 2 4 Densitas Jaringan
DNA (kukurangan 4 koloni diambil 2 dari sisa analisis densitas zooxanthellae dan 2 koloni dari sisa analisis jaringan) 9 2 Densitas 12 2 Densitas 15 2 Densitas 17 2 Densitas Jumlah 33 b.2. Kejut Temperatur
Kejut temperatur yang diberlakukan pada tahap ini adalah temperatur 36oC selama 6 jam. Kejut temperatur ini dilakukan secara bersamaan pada tiga seri bak inkubasi karang yang telah dipersiapkan sebelumnya. Media bak inkubasi karang
selama penerapan kejut temperatur adalah air laut tanpa aliran zooxanthellae. Setelah 6 jam media yang diberlakukan penerapan temperatur 36oC, thermoregulator dimatikan dan dilepas. Setelah jeda beberapa waktu hingga temperatur menjadi normal diikuti dengan pengaliran zooxanthellae dari bak pemassalannya.
b.3. Pengkayaan Zooxanthellae
Pengkayaan zooxanthellae yang dialirkan ke dalam bak inkubasi karang yang telah diputihkankan dimaksudkan untuk melakukan upaya terjadinya translokasi melalui peningkatan peluang acak bagi bertemunya zooxanthellae dengan karang. Peluang acak merupakan salah satu cara terjadinya transduksi simbion dengan inang (Hoegh-Guldberg dan Hinde, R. 1986). Selanjutnya menurut Lenhoff (1974) bahwa peluang acak merupakan peristiwa awal dari proses translokasi atau yang dinyatakan sebagai proses pengenalan (recognition).
Untuk mendapatkan konsentrasi zooxanthellae maksimum maka sesuai dengan hasil percobaan seri pertumbuhan zooxanthellae diperlukan tahap-tahap pemassalan sebagaimana telah dilakukan pada percobaan pertumbuhan zooxanthellae. Dalam hal ini diperoleh kadar zooxanthellae maksimum untuk masing-masing bak adalah :
Clade A sebesar 18,26 x 105 ind/liter
Clade B sebesar 21,19 x 105 ind/liter
Clade C sebesar 19,84 x 105 ind/liter
Ketiganya tidak mempunyai perbedaan pertumbuhan, meskipun diaplikasikan pada bak yang lebih besar.
Air yang telah diperkaya zooxanthellae dari bak pemassalannya kemudian dialirkan ke dalam bak inkubasi karang setelah 6 jam masa pemutihan dan air telah dikeluarkan sebanyak 80%. Selanjutnya dilakukan pengurangan aliran dari bak massalisasi zooxanthellae menuju bak inkubasi karang dengan sebesar sekitar debit 2 liter/menit. Air buangan setelah pemutihan karang dibuang, sedangkan air setelah pengkayaan zooxanthellae dialirkan kembali ke dalam bak massalisasi zooxanthellae setelah ditampung di dalam bak penampung dengan debit yang sama dengan mempergunakan mesin pengisap. Sistem yang dipakai adalah sistem resirkulasi.
Waktu pengeraman Goniastrea aspera selama pengkayaan zooxanthellae dilakukan selama waktu yang diperkirakan cukup bagi terjadinya transduksi. Hal ini juga didasarkan bahwa dalam kurun waktu 1 minggu dari hasil percobaan tahap pertama yaitu uji ketahanan karang, Goniastrea aspera memperlihatkan potensi tetap bertahan hidup di perairan alami. Oleh sebab itu, untuk menghindari tekanan bagi obyek penelitian (Goniastrea aspera) maka sistem sirkulasi air seminimal mungkin diupayakan terkena kontak dengan media lain. Dalam hal ini hanya penambahan air dari air laut yang telah difilter secara bertingkat di lingkungan laboratorium.
Setelah masa pengeraman dilakukan maka sebagian contoh dipindahkan ke lingkungan perairan terumbu karang selatan Pulau Panjang Jepara. Jumlah contoh yang dipindahkan ini adalah seperti diperlihatkan pada tabel pengelolaan contoh. Pada kondisi diperoleh kepastian translokasi yang diindikasikan oleh tertransduksinya zooxanthellae media ke jaringan polip karang yang dieramkan pasca pemutihan maka dilakukan pemisahan 5 contoh karang pada masing-masing media pengeraman untuk dilakukan kajian pertumbuhan mempergunakan teknik pewarnaan (Sya’rani, 1993).
b.4. Percobaan Pertumbuhan
Percobaan pertumbuhan dimaksudkan untuk mengetahui pertumbuhan karang pasca pemutihan dan pasca translokasi. Pertumbuhan karang itu sendiri merupakan penambahan deposit CaCO3 akibat proses kalsifikasi yang dilakukan
oleh polip karang. Dengan kemampuan untuk tumbuh dari karang tersebut, maka diduga biota tersebut dapat bertahan hidup serta terjadi proses penataan pengalokasian tumbuhnya zooxanthellae di dalam jaringan tubuhnya. Apabila ditemukan jenis zooxanthellae non endemik bagi biota tersebut diperkirakan translokasi dapat mewarnai proses pengalokasian atau replacement ke dalam jaringan endoderm polip yang mengalami pertumbuhan tersebut.
Untuk percobaan pertumbuhan ini, maka contoh specimen karang diwarnai dengan mempergunakan Alyzarin Red (Stoddart, 1978; Sya’rani, 1993). Dalam hal ini Alyzarin red yang dipergunakan sebanyak 1 gr pada plastik berukuran 10 liter. Pewarnaan dilakukan dalam waktu 6 sampai 7 jam dengan cara memasukkan koloni dalam plastik yang telah dipersiapkan zat warnanya, setelah itu plastik
dibuka dan rangka terwarnai sebagai awal pertumbuhan. Contoh Goniastrea
aspera yang diwarnai kemudian ditaruh kembali di perairan alami.
Peubah Uji
a. Pengukuran pertumbuhan koloni
Untuk maksud percobaan pertumbuhan maka akan dilakukan pendekatan kajian penambahan deposit CaCO3 (Stoddart, 1978; Sya’rani, 1993). Pengukuran
dilakukan selama tiga bulan. Contoh yang diambil dari perairan alami (perairan terumbu karang Selatan Pulau Panjang Jepara) sebanyak 5 koloni selanjutnya direndam dalam larutan Sodium Hipochlorit (NaClO) 25% (Sya’rani, 1993) selama 2 jam. Specimen Goniastrea aspera yang telah direndam, diangkat dan dibilas dengan semprotan air tawar. Dengan penyemprotan ini maka akan nampak warna putih penambahan deposit CaCO3 dan warna pemisah awal akibat
pengeraman dengan Alyzarin red beberapa waktu sebelumnya. Pengukuran pertumbuhan dilakukan dengan cara mengukur pertambahan panjang deposit CaCO3 tiap corralite pada specimen Goniastrea aspera, sebanyak 15 buah setiap
specimen. Pengukuran pertambahan panjang deposit CaCO3 diukur dari pangkal
warna merah pada koloni tersebut di bawah mikroskop monokuler dengan perbesaran 100 kali.
b. Konsentrasi Zooxanthellae
Dalam hal ini pengukuran konsentrasi zooxanthllae dilakukan dalam periode tiga minggu. Untuk keperluan ini, maka diambil tiga buah koloni dan dilakukan prosedur pengukuran seperti telah diuraikan pada Bab IV. Contoh ini dipergunakan secara bersama dengan uji histologis.
c. Evaluasi Histologis
Di samping kajian terhadap perubahan densitas zooxanthellae juga akan dilakukan pengukuran histologis dari jaringan polip karang. Pembuatan sayatan histologis polip karang ini selain dimaksudkan untuk mengevaluasi bentuk visual tingkat kepadatan zooxanthellae dalam jaringan juga untuk mengevaluasi proses
replacement zooxanthellae di dalam jaringan polip karang. Pengukuran histologis
melalui tahapan sebagaimana dilakukan oleh Nordemar et al., (2003). Adapun tahapan untuk mendapatkan sayatan histologis yang siap untuk pemotretan adalah
sebagai telah diuraikan pada Bab IV. Untuk keperluan ini maka pembuatan sayatan dilakukan pada awal pasca pengkayaan zooxanthellae.
d. Diversitas DNA
Uji diversitas DNA zooxanthellae dilakukan pada period yang sama dengan analisis histologis, yaitu pada awal pasca translokasi atau akhir pemutihan serta pada akhir inkubasi baik di bak inkubasi maupun di perairan alami. Analisis keragaman DNA zooxanthellae mempergunakan metoda RLFP dengan dengan teknik sebagaimana diinformasikan pada Bab III.
d. Analisis Kualitas Air
Adapun data penunjang adalah beberapa peubah kualitas air. Untuk memberikan deskripsi tentang perubahan kondisi lingkungan maka dilakukan pengukuran secara periodik terhadap beberapa peubah lingkungan, baik di lingkungan perairan alami tempat diletakkannya specimen pasca translokasi maupun di lingkungan bak inkubasi karang. Rincian tentang jenis peubah, metoda pengukuran dan periode pengukuran faktor lingkungan pendukung ini adalah sebagaimana disajiikan pada Tabel 15.
Tabel 15. Peubah yang diukur, metoda dan periode pengukuran
No Peubah Satuan Metoda Periode Ukur
Bak Inkubasi Laut 1 Temperatur oC Thermometer Mingguan Mingguan 2 Salinitas o/oo Refraktometer Mingguan Mingguan 3 Ammonia mg/l Spectrophotometer Mingguan Mingguan 4 Nitrit mg/l Spectrophotometer Mingguan Mingguan
5 pH - pH meter Mingguan Mingguan
6 Oksigen terlarut mg/l Tetrimetrik Mingguan Mingguan Waktu dan Tempat
Percobaan dilaksanakan dalam dua seria secara berurutan. Proses pengeraman dilakukan di Laboratorium Pakan Alami dan Genetika Balai Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara. Setelah proses pengeraman, materi diinkubasi di lingkungan perairan terumbu karang Selatan Pulau Panjang Jepara. Waktu pelaksanaan kajian ini dilaksanakan dalam dua tahap, Tahap satu yaitu masa inkubasi 10 hari dilakukan pada Maret 2007 hingga September 2008. Tahap kedua yaitu masa inkubasi 17 hari dilaksanakan antara
Maret 2008 sampai dengan Agustus 2008. Jeda waktu antara tahap pertama dan kedua disebabkan karena pengaruh musim.
Evaluasi Data
Evaluasi terhadap uji translokasi zooxanthellae pada jaringan polip binatang karang akan ditelusur dengan pertumbuhan karang, sintasan karang, perkembangan densitas zooxanthellae, transduksi zooxanthellae non endemik (lain), profil penempatan (replacement)zooxanthelae secara histologis. Data yang terkumpul tersebut menjadi tolok ukur dari keberhasilan tranlokasi. Oleh sebab itu, evaluasi data didasarkan kepada kajian deskriptif maupun kuantitatif. Data kuantitatif terhadap kadar zooxanthellae dianalisis melalui analisis ragam. Demikian juga dengan pertumbuhan antar media pengkayaan dilakukan pengujian analisis ragam. Pembeda ragam DNA pada contoh Goniastrea aspera yang diputihkan untuk menentukan kekerabatan akibat transduksi pengkayaan dikaji dengan menerapkan analisis cluster.
Hasil Percobaan
Dalam penelitian ini, yang dimaksud dengan proses translokasi zooxanthellae adalah suatu proses teralokasikannya jenis zooxanthellae dari suatu inang ke inang lain (Goniastrea aspera) melalui suatu tahapan transduksi. Proses penyebab translokasi tersebut diimitasi dari kejadian alam terutama adanya perubahan temperatur yang ekstrim. Akibat perubahan temperatur yang ekstrim ini menyebabkan terjadinya pemutihan pada karang. Informasi mengenai pemutihan pada karang akibat temperatur telah banyak didokumentasikan baik di alam maupun laboratorium (Coles dan Jokiel, 1976; Hoegh-Guldberg dan Smith, 1989). Dalam beberapa kasus setelah mengalami pemutihan, karang dapat pulih kembali dalam kurun waktu yang lambat. Meskipun demikian, proses pemulihan di alam masih sulit dijelaskan (Fitt et al. 2000).
Dua pendekatan penelitian yang dilakukan, yaitu uji ketahanan dan uji translokasi zooxanthellae yang dilakukan merupakan penjelasan potensi pemulihan baik dalam bentuk kuantitatif maupun kualitatif khususnya terkait dengan batasan waktu. Bentuk kuantitatif dijelaskan oleh perubahan densitas
zooxanthellae, sintasan dan pertumbuhan, sedangkan bentuk kualitatif dijelaskan oleh perkembangan penempatan(resettlement) zooxanthellae dalam jaringan polip karang hasil pengkayaan. Atas dasar hal tersebut, maka proses translokasi dalam penelitian ini akan mempergunakan tolok ukur kuantitatif tersebut serta bentuk visual pada indikasi proses penempatanpada jadingan polip.
Diversitas Zooxanthellae dan replacement-nya pada jaringan polip
Ekosistem terumbu karang merupakan salah satu habitat di laut yang mempunyai keanekaragaman tinggi di bumi. Terbentuknya keragaman yang tinggi tersebut tidak lepas dari pengaruh hubungan simbiosis mutualistiknya dengan simbion dinoflagellata (Hallock, 2001). Simbion ini adalah algae bersel tunggal yang umum dinamakan zooxanthellae serta secara dominan merupakan genus dinoflagellata. Hubungannya sangat luas dengan berbagai inang seperti
protiss, Porifera, Cnidaria dan molusca (Glynn, 1996; Lobban et al., 2002;
Rowan, 1998; Trench, 1993). Pada sebagaian besar kasus kehidupannya, maka aglae ini (zooxanthellae) terjadi secara intraselluler dalam jaringan polip karang. Keberadaannya dalam dalam jaringan polip karang tersebut adalah bergerombol atau membentuk suatu kompleks di sekitar vacuole sel inang (Colley dan Trench, 1983; Wakefield dan Kempf, 2001). Pada beberapa invertebrata lain (genera
Hippopus dan Tridacna), simbion zooxanthellae ini berada dalam suatu sistem
tubular (Norton et al., 1992).
Berkaitan dengan percobaan translokasi ini, maka telah diukur diversitas zooxanthellae berdasarkan keragaman DNA. Pengukuran DNA zooxanthellae sebagai dasar tercapainya proses translokasi tidak dapat ditempuh dalam satu kali percobaan, mengingat bahwa informasi aplikasi pendukung terhadap efek pengkayaan zooxanthellae belum diinformasikan secara terinci. Indikasi awal yang dijadikan ukuran adalah adanya potensi pemulihan (recovery) dari karang yang telah diputihkan pada percobaan degradasi jaringan polip karang dan uji ketahanannya setelah mengalami pemutihan sebagaimana dikaji pada tahap penelitian sebelumnya. Dalam hal ini diperoleh keterangan bahwa penerapan temperatur 36oC selama 6 jam dapat pulih kembali pada minggu ke 2. Oleh sebab itu tingkat translokasi akibat efek pengkayaan zooxanthellae tersebut dilakukan dalam beberapa tahap :
Tahap I : Diversitas DNA zooxanthellae jaringan polip Goniastrea aspera
pasca Pemutihan berdasarkan waktu inkubasi 10 hari dalam media pengkayaan zooxanthellae;
Uji diversitas DNA zooxanthellae pada Goniastrea aspera pasca pemutihan berdasarkan waktu inkubasi dilakukan dengan cara mengeramkan obyek penelitian pada media yang telah diperkaya kepadatan zooxanthellae selama kurun waktu tertentu. Inkubasi Goniastrea aspera pasca pemutihan pada periode pertama ini dilakukan dalam kurun waktu waktu 10 hari. Waktu inkubasi pendek selama 10 hari didasarkan kepada hasil analisis pada uji degradasi jaringan polip karang dan ketahanannya pasca pemutihan pada sekuen penelitian sebelumnya. Dalam hal ini indikasi pemulihan (recovery) dapat berlangsung dalam kurun waktu 2 minggu, sementara itu Lenhoff (1974) mengemukakan bahwa proses recognisi zooxanthellae hingga transduksinya pada jaringan polip karang yang terjadi secara acak dapat berlangsung selama 7 hari. Hal yang sama diinformasikan oleh Glasson (1993) meskipun tidak menyebutkan waktu bahwa dalam kondisi terjadi pemutihan parsial dengan dukungan ketersediaan nutrisi dan menurunnya tekanan lingkungan maka dengan cepat karang dapat pulih kembali.
Hewan uji yang telah dikenakan pengeraman pada media yang diperkaya zooxanthellae dalam kurun waktu 10 hari selanjutnya dipisahkan dalam dua kondisi, yaitu lingkungan perairan alami (daerah terumbu karang di Selatan Pulau panjang Jepara) dan di lingkungan binaan yang disesuaikan dengan kondisi alami. Setelah tiga (3) minggu dan enam (6) minggu sejak awal inkubasi pasca pengeraman dilakukan analisis diversitas DNA untuk mengevaluasi keberhasilan translokasi. Penempatan contoh pasca pengeraman di lingkungan perairan alami kawasan terumbu karang selatan Pulau Panjang Jepara dilakukan pada lokasi kedalaman antara 3 meter hingga 5 meter.
Dari hasil amplifikasi PCR terhadap contoh DNA zooxanthellae yang diekstrak dari masing-masing media pengkayaan zooxanthellae diperoleh pita-pita yang bervariasi (Gambar 29).
A. Minggu Awal
B. Minggu Ketiga setelah mengalami pengkayaan zooxanthellae
Pengkayaan Clade A
Pengkayaan Clade B
Pengkayaan Clade C
C. Minggu Keenam setelah mengalami pengkayaan zooxanthellae
Pengkayaan Clade A Pengkayaan Clade B Pengkayaan Clade C
Gambar 29. Pola Pita DNA Zooxanthellae pada Jaringan Polip Goniastrea
aspera yang diperkaya dengan Zooxanthellae Clade A, B dan C
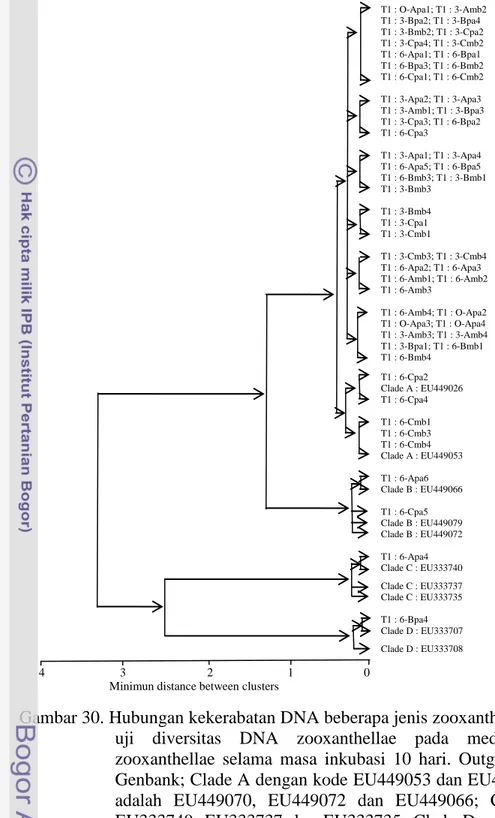
Dari pita pemotretan analisis DNA dapat diketahui besarnya pasangan basa masing-masing contoh. Analisis phylogenik untuk mengetahui kekerabatan DNA contoh dilakukan terhadap semua tahapan pengujian DNA, yaitu waktu pengujian awal, minggu ketiga dan minggu keenam. Hasil analisis phylogenik tersebut didasarkan kepada indikasi pasangan basa dari masing-masing pengukuran DNA dengan pembandingan nilai pasangan basa beberapa clade yang diperoleh dari Genbank. Kode akses pembanding adalah EU449053 (Clade A); EU449026 (Clade A); EU449070 (Clade B); EU449072 (Clade B); EU449066
(Clade B); EU333740 (Clade C); EU333737 (Clade C); EU333735 (Clade C);
EU333707 (Clade D) dan EU333708 (Clade D). Hasil analisis phylogenik tersebut adalah seperti terlihat pada Gambar 30.
Hasil analisis phylogenik di atas memperlihatkan bahwa konsentrasi tipe zooxanthellae lebih dominan dari jenis Clade A, yaitu sebesar 94,7% dari keseluruhan zooxanthellae yang diuji sejak dari awal pengujian hingga minggu keenam setelah inang Goniastrea aspera diinkubasikan di perairan alami maupun binaan. Clade B, Clade C dan Clade D hanya ditemukan tertransduksi pada 4 inang Goniastrea aspera atau 5,3% dari total pengujian DNA. Hasil rekapitulasi analisis phylogenik berdasarkan waktu pengujian, media pengkayaan serta lokasi inkubasi adalah sebagaimana disajikan pada Tabel 16.
Tabel 16. Diversitas DNA pada Polip Goniastrea aspera pasca pemutihan dalam masa pengeraman 10 hari media Pengkayaan Zooxanthellae
Waktu Pengukuran Media Berdasarkan
Jenis Clade Lokasi Inkubasi
Diversitas DNA pada Contoh :
1 2 3 4
Awal Pasca pemutihan Media Binaan A A A A
Minggu III A Perairan Alami A A A A
Media Binaan A A A A
B Perairan Alami A A A A
Media Binaan A A A A
C Perairan Alami A A A A
Media Binaan A A A A
Minggu VI A Perairan Alami A A A/C A/B
Media Binaan A A A A
B Perairan Alami A A A/D A
Media Binaan A A A A
C Perairan Alami A A A A/B
Media Binaan A A A A
Keterangan :
1. Contoh diinkubasi pada perairan alami terumbu karang selatan Pulau Panjang Jepara. Contoh 1 dan 2 diinkubasi pada kedalaman 3 meter, sedangkan contoh 3 dan 4 diinkubasi pada kedalaman 5 meter. 2. Uji diversitas didasarkan kepada sekuen pembacaan hasil penghitungan nilai pasangan basa serta analisis
T1 : O-Apa1; T1 : 3-Amb2 T1 : 3-Bpa2; T1 : 3-Bpa4 T1 : 3-Bmb2; T1 : 3-Cpa2 T1 : 3-Cpa4; T1 : 3-Cmb2 T1 : 6-Apa1; T1 : 6-Bpa1 T1 : 6-Bpa3; T1 : 6-Bmb2 T1 : 6-Cpa1; T1 : 6-Cmb2 T1 : 3-Apa2; T1 : 3-Apa3 T1 : 3-Amb1; T1 : 3-Bpa3 T1 : 3-Cpa3; T1 : 6-Bpa2 T1 : 6-Cpa3 T1 : 3-Apa1; T1 : 3-Apa4 T1 : 6-Apa5; T1 : 6-Bpa5 T1 : 6-Bmb3; T1 : 3-Bmb1 T1 : 3-Bmb3 T1 : 3-Bmb4 T1 : 3-Cpa1 T1 : 3-Cmb1 T1 : 3-Cmb3; T1 : 3-Cmb4 T1 : 6-Apa2; T1 : 6-Apa3 T1 : 6-Amb1; T1 : 6-Amb2 T1 : 6-Amb3 T1 : 6-Amb4; T1 : O-Apa2 T1 : O-Apa3; T1 : O-Apa4 T1 : 3-Amb3; T1 : 3-Amb4 T1 : 3-Bpa1; T1 : 6-Bmb1 T1 : 6-Bmb4 T1 : 6-Cpa2 Clade A : EU449026 T1 : 6-Cpa4 T1 : 6-Cmb1 T1 : 6-Cmb3 T1 : 6-Cmb4 Clade A : EU449053 T1 : 6-Apa6 Clade B : EU449066 T1 : 6-Cpa5 Clade B : EU449079 Clade B : EU449072 T1 : 6-Apa4 Clade C : EU333740 Clade C : EU333737 Clade C : EU333735 T1 : 6-Bpa4 Clade D : EU333707 Clade D : EU333708 4 3 2 1 0 Minimun distance between clusters
Gambar 30. Hubungan kekerabatan DNA beberapa jenis zooxanthellae pada tahap uji diversitas DNA zooxanthellae pada media pengkayaan zooxanthellae selama masa inkubasi 10 hari. Outgrup diakses dari Genbank; Clade A dengan kode EU449053 dan EU449026; Clade B adalah EU449070, EU449072 dan EU449066; Clade C adalah EU333740, EU333737 dan EU333735; Clade D adalah EU333707 dan EU333708. T1 = Tahap 10 hari; 0 = peneraan awal; 3 = peneraan minggu ketiga dan 6 = peneraan minggu keenam. A, B dan C = media dengan pengkayaan Clade A, Clade B dan Clade C terhadap Goniastrea aspera pasca pemutihan; pa merupakan tempat inkubasi pada perairan alami; bm merupakan tempat inkubasi pada media binaan, pa merupakan tempat inkubasi di perairan alami dan 1, 2 ... merupakan jumlah contoh biota uji.
Hasil analisis diversitas DNA yang tertransduksi pada Goniastrea aspera
berdasarkan periode pengeraman 10 hari dan inkubasi 3 serta 6 minggu berbagai tingkat clade diperoleh keterangan bahwa :
1. Pada awal pemutihan tingkat kualitas DNA homogen yaitu clade A 2. Pada media clade A terjadi transduksi alami dengan clade B dan C 3. Pada media clade B terjadi transduksi alami dengan clade D 4. Pada media clade C terjadi transduksi alami dengan clade B 5. Pada media binaan (laboratorium) tidak terjadi transduksi 6. Terdapat konsistensinya kandungan clade A
7. Transduksi alami terjadi pada kedalaman 5 meter, sedang pada kedalaman 3 meter tidak terjadi transduksi alami
Hasil analisis diversitas tahap ini sebagaimana diperlihatkan pada tabel di atas menunjukkan bahwa masa pengeraman selama 10 hari belum memperlihatkan potensi transduksi secara buatan. Namun demikian selama periode 6 minggu diindikasikan terjadi transduksi alami. Transduksi terjadi pada perairan alami terumbu karang pada kedalaman 5 meter.
Tahap II : Diversitas DNA zooxanthellae pada Goniastrea aspera
berdasarkan aplikasi kombinasi tahapan waktu inkubasi 17 hari dan peletakan inkubasi kedalaman di perairan alami.
Tahap II tentang diversitas DNA zooxanthellae pada Goniastrea aspera
berdasarkan aplikasi kombinasi tahapan waktu inkubasi dan peletakan tingkat inkubasi kedalaman di perairan alami dilakukan setelah terdapat jedah waktu 5 bulan dari tahap I akibat musim. Uji tahap ini memberlakukan waktu inkubasi 17 hari masa pengeraman hewan uji Goniastrea aspera pada tiap pemasalan clade
zooxanthellae. Perpanjangan masa pengeraman didasarkan oleh hasil tahap I bahwa transduksi alami memberikan indikasi adanya potensi waktu transduksi dalam lingkungan binaan, kedua memberikan keleluasaan waktu bagi karang untuk melakukan proses regenerasi internalnya. Pada kondisi demikian diharapkan akan terjadi proses recognisi secara lebih lama sehingga memberikan peluang acak bagi clade eksternalnya untuk tertranslokasi.
Inkubasi alami pada tahap ini dilakukan pada kedalaman 5 meter dengan pertimbangan bahwa pada tingkat kedalaman tersebut terdapat indikasi transduksi alami sebagaimana diperoleh pada penelitian tahap I. Transduksi alami
mengindikasikan bahwa peluang recovery lebih tinggi, sehingga memberikan peluang hidup hewan uji yang lebih besar. Adapun untuk menguji potensi transduksi dari proses pengeraman maka di lingkungan binaan juga akan dilakukan pengeraman pada media yang tidak diperkaya oleh zooxanthellae perlakuan.
Berdasarkan tipe restriksi DNA dalam bentuk pita-pita amplifikasi DNA dari pengujian DNA zooxanthellae yang diekstrak dari biota uji Goniastrea
aspera memperlihatkan veriasi yang lebih luas dibandingkan dengan kajian tahap
pertama sebelumnya (Gambar 31). Hal ini ditandai dengan makin kompleksnya tingkat transduksi baik yang berasal dari media pengkayaan maupun akibat transduksi secara alami di lingkungan inkubasi obyek penelitian di perairan alami.
A. Minggu Awal
B. Minggu Ketiga setelah mengalami pengkayaan zooxanthellae
Pengkayaan Clade A
Pengkayaan Clade B
Pengkayaan Clade C
C. Minggu Keenam setelah mengalami pengkayaan zooxanthellae
Pengkayaan Clade B
Pengkayaan Clade C
Gambar 31. Pola Pita DNA Zooxanthellae pada Jaringan Polip Goniastrea aspera
yang diperkaya dengan Zooxanthellae Clade A, B dan C pada masa
inkubasi 17 hari.
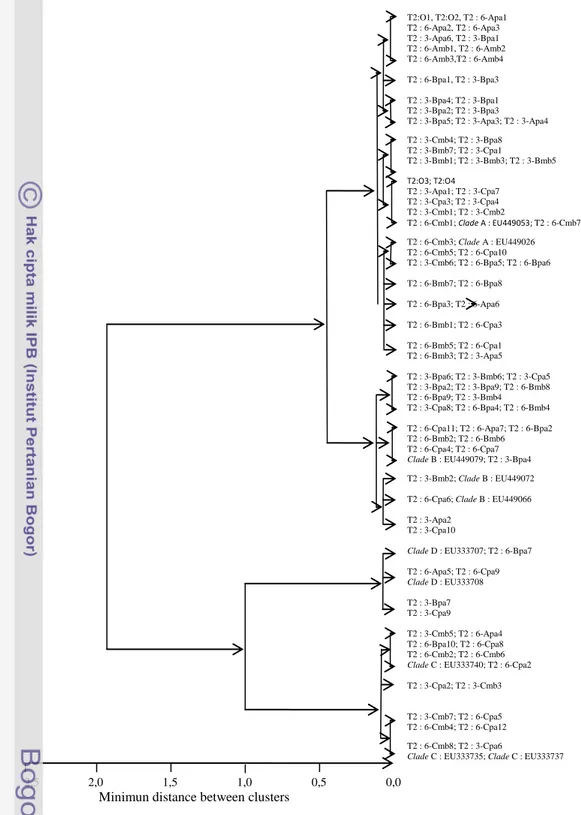
Dari pasangan basa yang dihitung berdasarkan pita RPLF hasil amplifikasi PCR selanjutnya diuji tingkat kekerabatannya. Pengujian phylogenik pasangan basa hasil restriksi enzim pada pengujian DNA zooxanthellae dan padanan clade
dari Genbank pada tahap kajian pengeraman selama 17 hari adalah seperti terlihat pada Gambar 32.
Hasil rekapitulasi analisis phylogenik uji diversitas DNA pada tahap ini adalah sebagaimana disajikan pada tabel berikut.
Tabel 17. Diversitas DNA pada Polip Goniastrea aspera pasca pemutihan dalam masa pengeraman 17 hari media Pengkayaan Zooxanthellae
Waktu Pengukuran
Media Berdasarkan Jenis
Clade
Lokasi Inkubasi
Diversitas DNA pada Contoh :
1 2 3 4
Awal A Perairan Alami A A A A
Media Binaan A A A A
B Perairan Alami A A A A
Media Binaan A A A A
C Perairan Alami A A A A
Media Binaan A A A A
Minggu III A Perairan Alami A/D A A/B A
Media Binaan(1) A A A A
B Perairan Alami A/B A/B A/B/C A/B
Media Binaan A/B A/B A/B A
C Perairan Alami A/C A A/B/C A/B/C/D
Media Binaan A A/C A/C A/C
Minggu VI A Perairan Alami A A A/C/D A/B
Media Binaan A A A A
B Perairan Alami A/B A/B A/B/D A/B/C
Media Binaan A/B A/B A/B A/B
C Perairan Alami A/C A/B/C A/B/C/D A/B/C
Media Binaan A/C A/C A/C A/C
Keterangan :
1. Contoh diinkubasi pada perairan alami terumbu karang selatan Pulau Panjang Jepara. Contoh diinkubasi pada kedalaman 5 meter.
2. Uji diversitas didasarkan kepada sekuen pembacaan hasil penghitungan nilai pasangan basa serta analisis phylogenik.
T2:O1, T2:O2, T2 : 6-Apa1 T2 : 6-Apa2, T2 : 6-Apa3 T2 : 3-Apa6, T2 : 3-Bpa1 T2 : 6-Amb1, T2 : 6-Amb2 T2 : 6-Amb3,T2 : 6-Amb4 T2 : 6-Bpa1, T2 : 3-Bpa3 T2 : 3-Bpa4; T2 : 3-Bpa1 T2 : 3-Bpa2; T2 : 3-Bpa3 T2 : 3-Bpa5; T2 : 3-Apa3; T2 : 3-Apa4 T2 : 3-Cmb4; T2 : 3-Bpa8 T2 : 3-Bmb7; T2 : 3-Cpa1 T2 : 3-Bmb1; T2 : 3-Bmb3; T2 : 3-Bmb5 T2:O3; T2:O4 T2 : 3-Apa1; T2 : 3-Cpa7 T2 : 3-Cpa3; T2 : 3-Cpa4 T2 : 3-Cmb1; T2 : 3-Cmb2 T2 : 6-Cmb1; Clade A : EU449053; T2 : 6-Cmb7 T2 : 6-Cmb3; Clade A : EU449026 T2 : 6-Cmb5; T2 : 6-Cpa10 T2 : 3-Cmb6; T2 : 6-Bpa5; T2 : 6-Bpa6 T2 : 6-Bmb7; T2 : 6-Bpa8 T2 : 6-Bpa3; T2 : 6-Apa6 T2 : 6-Bmb1; T2 : 6-Cpa3 T2 : 6-Bmb5; T2 : 6-Cpa1 T2 : 6-Bmb3; T2 : 3-Apa5 T2 : 3-Bpa6; T2 : 3-Bmb6; T2 : 3-Cpa5 T2 : 3-Bpa2; T2 : 3-Bpa9; T2 : 6-Bmb8 T2 : 6-Bpa9; T2 : 3-Bmb4 T2 : 3-Cpa8; T2 : 6-Bpa4; T2 : 6-Bmb4 T2 : 6-Cpa11; T2 : 6-Apa7; T2 : 6-Bpa2 T2 : 6-Bmb2; T2 : 6-Bmb6 T2 : 6-Cpa4; T2 : 6-Cpa7
Clade B : EU449079; T2 : 3-Bpa4 T2 : 3-Bmb2; Clade B : EU449072 T2 : 6-Cpa6; Clade B : EU449066 T2 : 3-Apa2
T2 : 3-Cpa10
Clade D : EU333707; T2 : 6-Bpa7 T2 : 6-Apa5; T2 : 6-Cpa9 Clade D : EU333708 T2 : 3-Bpa7 T2 : 3-Cpa9 T2 : 3-Cmb5; T2 : 6-Apa4 T2 : 6-Bpa10; T2 : 6-Cpa8 T2 : 6-Cmb2; T2 : 6-Cmb6
Clade C : EU333740; T2 : 6-Cpa2 T2 : 3-Cpa2; T2 : 3-Cmb3
T2 : 3-Cmb7; T2 : 6-Cpa5 T2 : 6-Cmb4; T2 : 6-Cpa12 T2 : 6-Cmb8; T2 : 3-Cpa6
Clade C : EU333735; Clade C : EU333737
2,5 2,0 1,5 1,0 0,5 0,0
Minimun distance between clusters
Gambar 31. Hubungan kekerabatan DNA dari beberapa jenis zooxanthellae berdasarkan Analisis Cluster pada tahap uji diversitas DNA zooxanthellae dari jaringan polip Goniastrea aspera pasca pemutihan dalam 17 hari waktu inkubasi pada media pengkayaan zooxanthellae. Clade A diakses dari GenBank dengan kode EU449053 dan EU449026; Clade B adalah EU449070, EU449072 dan EU449066; Clade C adalah EU333740, EU333737 dan EU333735; Clade D adalah EU333707 dan EU333708. T2 : tahap kajian diversitas DNA kedua; 0 merupakan pengujian awal; 3 : pengujian minggu ketiga dan 6 : pengujian minggu keenam. A, B dan C merupakan media dengan pengkayaan Clade A, Clade B dan Clade C terhadap Goniastrea aspera pasca pemutihan; pa merupakan tempat inkubasi pada perairan alami; bm merupakan tempat inkubasi pada media binaan, pa merupakan tempat inkubasi di perairan alami dan 1, 2 ... merupakan jumlah contoh biota uji.
Hasil analisis diversitas DNA berdasarkan periode pengeraman 17 hari berbagai tingkat clade diperoleh keterangan bahwa :
1. Pada awal pemutihan mempunyai tingkat kualitas DNA homogen yaitu clade
A
2. Baik pada media clade A, B maupun C selain terjadi transduksi bawaan pada masa pengeraman juga terjadi transduksi alami dengan clade B, C dan D 3. Pada media binaan (laboratorium) terjadi transduksi sesuai dengan clade
media eksternalnya
4. Terdapat konsistensinya kandungan clade A
5. Kehomogenan awal menunjukkan tidak terkontaminasinya transduksi diindikasikan konsistensinya diversitas DNA awal dengan minggu III.
6. Tidak adanya transduksi non media eksternal pada media binaan selain jenis
clade pada media eraman
Berdasarkan hasil penelitian dalam dua tahap sebagaimana disajikan di atas, maka obyek penelitian yaitu jenis karang Goniastrea aspera bukan merupakan jenis yang mempunyai preferensi transduksi spesifik terhadap clade
simbion tertentu. Hasil identifikasi berjenjang terhadap karang Goniastrea aspera
sebagaimana diinformasikan pada kajian keragaman clade seperti pada Uji Penumbuhan Zooxanthellae, jenis clade yang dijumpai sebagai simbion adalah zooxanthellae adalah Clade A dan B. Setelah dilakukan proses pemutihan, maka diperoleh mono simbion yaitu jenis A yang ditelusur dari 15 contoh. Proses translokasi yang dilakukan memberikan penjelasan bahwa terjadi hasil positif baik dari lingkungan binaan maupun alami. Transduksi dari lingkungan alami dicirikan oleh ditemukannya jenis simbion non pengeraman.
Perkembangan Kadar Zooxanthellae Pasca Translokasi
Perkembangan zooxanthellae pada polip merupakan suatu akumulasi dari keberadaannya dalam jaringan polip melalui tahapan replacement. Hasil uji degradasi zooxanthellae menghasilkan informasi bahwa pemutihan total menyebabkan kematian. Dalam hal ini kejut temperatur 40oC menyebabkan peluluhan zooxanthellae secara total yang selanjutnya menyebabkan kematian karang pada inkubasinya di lingkungan perairan alami. Dengan diperlakukan kejut temperatur yang lebih rendah (36oC) pada media inkubasi karang Goniastrea
dimungkinkan karang untuk tetap hidup. Penggunaan kejut lintas temperatur mulai dari 36oC hingga 28oC telah memberikan bukti bahwa terjadi recovery pada karang melalui proses petumbuhan zooxanthellae pada jaringan polip karang.
Uji translokasi dimaksudkan untuk memberikan peluang yang lebih besar terhadap transduksi zooxanthellae pada polip yang mendapat tekanan kejut temperatur. Untuk keperluan ini dilakukan pengukuran densitas zooxanthellae selama 4 bulan dengan selang pengukuran 3 minggu, dilanjutkan pengukuran hingga minggu ke 17. Hasil pengukuran tersebut adalah seperti terlihat pada Gambar 33. 0 750000 1500000 2250000 3000000 3750000 4500000 0 5 10 15 20 Waktu (minggu) D e n si ta s (i n d ivi d u /cm2 )
Sumber P engkayaan Clade A Sumber P engkayaan Clade B Sumber P engkayan Clade C
Gambar 33. Perkembangan Zooxanthellae pada Goniastrea
aspera dalam Masa Inkubasi di Perairan Alami
Perkembangan densitas zooxanthellae pada inang Goniastrea aspera selama masa inkubasi di perairan terumbu karang Pulau Panjang Selatan Jepara memperlihatkan dalam masa perkembangan. Hasil analisis statistik densitas minggu ke 15 dan ke 17 masing-masing menunjukkan bahwa perkembangan zooxanthellae tidak berbeda antar pengkayaan sumber clade (ά < 0,01)(Lampiran 6).
Perkembangan tersebut mengindikasikan bahwa Goniastrea aspera pasca pemutihan masih dapat bertahan dan mampu melaksanakan aktifitas faalinya. Hal ini juga ditunjang oleh sintasan contoh pada masa inkubasi. Hasil pengamatan lapang menunjukkan bahwa seluruh contoh masih dapat bertahan hidup (Sintasan =100%). Dengan kemampuannya untuk bertahan hidup dan dengan adanya
kegiatan faalinya selama masa inkubasi maka setelah pemutihan karang
dimungkinkan terjadi proses pemulihan sel yang diikuti oleh pertumbuhan zooxanthellae secara signifikan.
Perubahan Tampilan Jaringan Polip
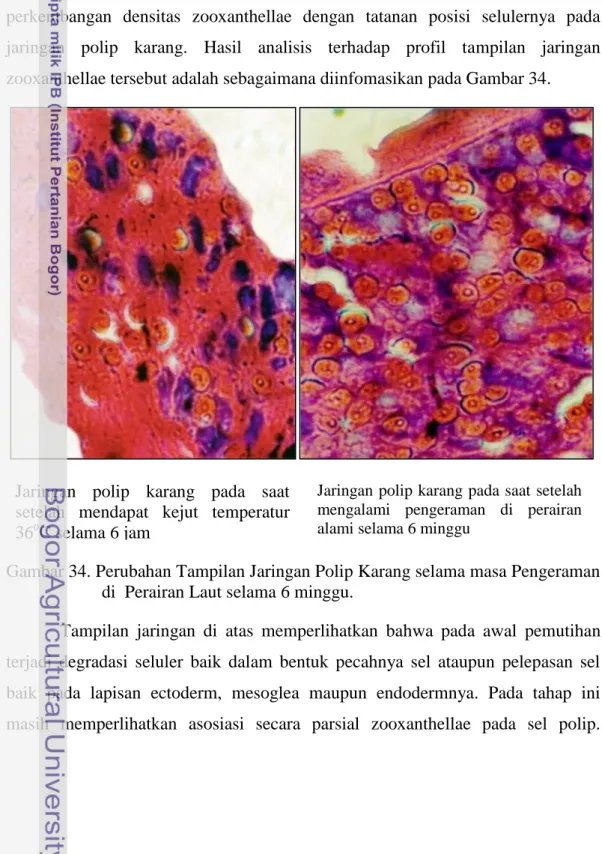
Indikasi lain selain perkembangan densitas zooxanthellae dari potensi respon faali dari polip karang pasca pemutihan adalah tertatanya kembali sejumlah zooxanthllae yang telah berkembang di dalam jaringan polipnya. Hasil penelitian ini memperlihatkan bahwa terdapat korelasi yang positif dari perkembangan densitas zooxanthellae dengan tatanan posisi selulernya pada jaringan polip karang. Hasil analisis terhadap profil tampilan jaringan zooxanthellae tersebut adalah sebagaimana diinfomasikan pada Gambar 34.
Gambar 34. Perubahan Tampilan Jaringan Polip Karang selama masa Pengeraman di Perairan Laut selama 6 minggu.
Tampilan jaringan di atas memperlihatkan bahwa pada awal pemutihan terjadi degradasi seluler baik dalam bentuk pecahnya sel ataupun pelepasan sel baik pada lapisan ectoderm, mesoglea maupun endodermnya. Pada tahap ini masih memperlihatkan asosiasi secara parsial zooxanthellae pada sel polip.
Jaringan polip karang pada saat setelah mendapat kejut temperatur 36oC selama 6 jam
Jaringan polip karang pada saat setelah mengalami pengeraman di perairan alami selama 6 minggu
Dengan dikembalikannya polip pada lingkungan yang normal yaitu lingkungan perairan alami terumbu karang di Selatan Pulau Panjang Jepara, maka dimungkinkan polip bertahan. Perkembangan selanjutnya pada minggu ke 15 sudah memperlihatkan pembentukan teaniolae dan sudah tersusun kembali jaringan normal pada polip. Pada hari ke 17 sudah memperlihatkan perkembangan normal dimana hampir 100 % perkembangan jaringan telah memperlihatkan taraf yang sempurna. Demikian pula dengan respon lanjutnya yaitu dalam proses pembentukan deposit CaCO3.
Pertumbuhan Goniastrea aspera
Pertumbuhan karang yang dimaksudkan disini adalah terbentuknya deposit CaCO3 pada rangka Goniastrea aspera, sehingga akan menambah panjang
dan melebarnya koloni karang tersebut secara dimensional. Perhitungan pertumbuhan karang ini didasarkan pada peningkatan panjang pada 15 corralite
pada permukaan tumbuh optimum setelah peneraan dengan teknik pewarnaan. 15 corralite yang dihitung perkembangan deposit CaCO3 dipilih pada karang dengan
bagian permukaannya terkena cahaya secara langsung. Pada permukaan karang dimungkinkan terjadi proses metabolisme zooxanthellae yang optimum sehingga memberikan dukungan terhadap proses kalsifikasi (Rogers, 1979; Marubini dan Thake, 1999). Lebih jauh dikemukakan oleh Lough dan Barnes (1999) bahwa bagian permukaan karang yang terkena cahaya secara langsung di habitatnya mempunyai perbedaan pertumbuhan yang signifikan dengan bagian permukaan karang yang terlindungi.
Perhitungan pertumbuhan Goniastrea aspera ini dilakukan pada karang yang telah tertransduksi melalui tahap translokasi sebagaimana dimaksudkan dalam penelitian ini. Dalam hal ini adalah jenis contoh yang tertransduksi pada media pengkayaan Clade A, Clade B dan Clade C. Hasil pengukuran terhadap pertumbuhan karang Goniastrea aspera pasca pengeraman dalam kurun waktu 17 minggu adalah sebagaimana diperlihatkan pada Gambar 35.
0.000 2.000 4.000 6.000 8.000 Sumber Pengkayaan Clade A Sumber Pengkayaan Clade B Sumber Pengkayaan Clade C Sumber Pengkayaan Clade
P e rt um bu ha n (m m ) 1 2 3 4 5 Rerata
Gambar 35. Pertumbuhan Specimen Goniastrea aspera Berdasarkan Sumber Pengkayaan Clade
Hasil perhitungan pada lima specimen pada 15 corralite-nya secara rata-rata pada asal sumber pengkayaan clade A adalah sebesar 5,663 mm; pada sumber pengkayaan Clade B adalah 5,3 mm dan pada sumber pengkayaan Clade C adalah 5,563 mm. Selanjutnya berdasarkan uji satu arah terhadap fenomena pertumbuhan antar clade tersebut diperoleh keterangan bahwa pertumbuhan specimen
Goniastrea aspera adalah tidak menunjukkan perbedaan (σ<0,01). Ini
memberikan arti bahwa perbedaan transduksi zooxanthellae tidak memberikan pengaruh terhadap pertumbuhan karang.
Pembahasan
Pola pemindahan obyek penelitian dari lingkungan binaan ke lingkungan alami setelah proses pemanasan dan dilanjutkan dengan pengeraman dalam media pengkayaan zooxanthellae selama 17 hari memberikan respon positif terjadinya proses translokasi. Proses translokasi zooxanthellae terjadi akibat transduksi bawaan dan alami. Hasil ini berbeda dengan hasil translokasi dengan masa pengeraman 10 hari, yang dalam hal ini translokasi hanya terjadi akibat transduksi alami.
Pada beberapa kasus pasangan inang dan simbiont terjadi secara bervariasi sebagai bentuk respon dari lingkungan secara holobiont. Dua dari banyak variable lingkungan yang berkorelasi dengan distribusi pasangan inang dan simbiont
spesifik adalah temperatur dan cahaya. Rowan dan Knowlton (1995) menemukan variasi hubungan simbiont dengan species Montastrea pada beberapa gradient temperatur dan irradiance. Endosimbion clade A dan B ditemukan pada perairan dangkal (shallow waters < 6 m), sementara simbion clade C terbatas di perairan dalam. Dalam suatu studi diversitas simbion Symbiodinium dalam scleractinia di Great Barrier Reef (LaJeunesse et al., 2003) mengidentifikasi 9 species inang dimana tipe simbion bervariasi antara kedalaman 10 meter (perairan cukup dalam) dan 3 meter (perairan dangkal) Stylopora pistillata bersimbiosis dengan clade C1 (kedalaman <3 meter) dan pada kedalaman 10 meter jenis tersebut Stylopora
pistillata bersimbiosis dengan clade C27. Kenyataannya identitas genetik
Symbiodinium dapat mempengaruhi distribusi dari species inang. Sebagaimana
diilustrasikan oleh Pocillopora verrucosa dan Pavona gigantea pada terumbu karang Pasifik Selatan, dimana pada perairan dangkal 0 – 6 meter komunitas karang didominasi oleh Pocillopora verrucosa; sementara pada perairan lebih dalam (6–14 m), Pavona gigantean yang lebih dominant. Symbiodinium dari tipe
clade D1 (berdasarkan ITS2) adalah eksklusif pada Pocillopora verrucosa;
sementara clade C1 pada Pavona gigantean (Iglesias-Prieto et al., 2004); diperlihatkan dalam studi tersebut bahwa identitas simbion memainkan peranan penting dalam distribusi tersebut. Hasil dari pengukuran fotosintetik dan percobaan transplantasi mendukung hipotesis tersebut, dengan berturut-turut P.
verrucosa - clade D1; P. gigantean – Clade C1 dibatasi kualitas efek penaungan
(shade effect) (Iglesias-Prieto et al., 2004).
Studi yang lain menerangkan distribusi simbion pada koloni karang di sekitar perairan dangkal hanya terjadi suatu koloni inang tunggal. Hal ini menguatkan argument bahwa distribusi simbion merupakan respon perubahan tingkat irradiance (Rowan et al., 1997). Dalam koloni tunggal Montastrea
anularis dan M. faveolala, clade A dan B tertransduksi pada keduanya dalam
suasana irradiance tinggi, sementara clade C ditemukan pada areal terlindung
(shade area) (Rowan, et al., 1997). Van Oppen et al., (2001) juga mengamati
dalam struktur koloni yang mengandung populasi simbion dengan berbagai intensitas cahaya. Pada studi mereka, type C2 (didasarkan atas ITS1) ditemukan
pada Acropora tenuis yang terbuka dengan cahaya, sementara C1 ditemukan di shaded area (area terlindung) pada koloni yang sama.
Ulstrup dan van Oppen (2003) melaporkan variasi intra koloni pada
Acropora Spp. Pada studi tersebut lokasi simbion dalam individu Acropora tenuis
bervariasi pada semua lokasi, sementara pada lokasi lain trend tersebut tidak teramati. Perbedaan regional dan latitude (lintang) bagi keberadaan simbion adalah akibat turunan dari respon terhadap lingkungan. Diduga pencahayaan dan temperatur yang berbeda sebagai aspek penyebab dari diversitas pasangan inang dan simbiont. Hal yang berkebalikan, pada survey 35 species octocorallia Goulet dan Cofforth (2004) tidak menemukan variasi antara Symbiodinium clade B pada koloni dari suatu kisaran wilayah dan kedalaman. Pada studi ini posisi koloni yang ditransplantasi pada suatu kisaran lingkungan dengan variasi tingkat cahaya dan komunitas ini diamati selama periode 20 bulan. Analisis menggunakan
finger-printing DNA yang mempunyai validitas tinggi. Hasilnya menerangkan bahwa
populasi simbion dalam koloni individu inang tidak berubah selama masa transplantasi tersebut (Goulet dan Cofforth, 2004). Sedikit studi telah memonitor diversitas simbion secara temporal pada suatu lingkungan perairan yang berfluktuasi. Studi tersebut menerangkan bahwa sebagian besar tidak terdeteksi adanya variasi diversitas pada individu inang dalam suatu kurun waktu tertentu (Goulet dan Cofforth, 2004).
Fleksibilitas tipe Symbiodinium yang tertransduksi pada berbagai tingkat inang nampak jelas; dimana variasi tipe simbion tersebut telah diobservasi pada skala yang luas dalam lingkup biogeografi region. Pada variasi lintang, pasangan inang dan simbiont telah diobservasi terhadap sejumlah species inang. Sebagai contoh, inang-inang di bagian utara Australia (tropis) berkecenderungan bersimbiosis dengan clade C, sementara inang tertentu di lintang temperate (beriklim sedang) (Bagian Selatan Australia) bersimbiosis dengan clade B (Rodriquez-Laretty et al,. 2001). Kemiripan studi ini juga dilaporkan oleh LaJeunesse et al (2003) yang menginformasikan adanya perbedaan dominansi
clade tipe C3h, dimana keberadaan simbion ini jarang ditemukan pada terumbu di
lintang tinggi tetapi mempunyai prevalensi pada terumbu lintang tengah. Distribusi pasangan inang dan simbiont secara lintang mempunyai kaitan dengan
perubahan temperatur dan faktor lingkungan lain yang terjadi sepanjang transek tersebut. Variasi pasangan inang dan simbiont juga telah didokumentasikan secara genetik dengan tipe Symbiodinium (Santos dan Coffort, 2003). Dalam hal ini dilakukan transek sepanjang 450 km di Bahama. Santos et al., (2003) mengambil contoh sebanyak 575 individu Pseudopterogorgia elisabethae dan mengidentifikasi 23 tipe Symbiodinium B1/B184 yang bervariasi dengan koloni tersebut. Dalam bagian ini struktur populasi secara frekuansial atau parsial menyolok pada satu terumbu dari terumbu lain, demikian seterusnya.
Korelasi parameter lingkungan dengan distribusi simbion memberi kesan terhadap perbedaan fisiologi diantara tipe simbion. Kondisi ini akan menghasilkan atau mempengaruhi diversitas pasangan inang dan simbiont. Karakteristik respon fisiologis dari berbagai taksa Symbiodinium terhadap perbedaan parameter lingkungan adalah dalam masa pertumbuhan, tetapi nampak bahwa variasi fisiologis ini tetap berlangsung dan mendapat respon setidaknya pada beberapa pasangan inang dan simbiont. Tipe Synbiodinium berubah-ubah dalam responnya terhadap perubahan lingkungan (Iglesias-Preto dan Trench, 1997; Rowan et al., 1997; Warner et al, 1996) seperti toleransinya terhadap temperatur (Bhagoii dan Hidaka, 2004; Perez et al., 2001; Rowan, 2004). Montipora digitata yang resisten terhadap pemutihan mengandung tipe simbion C15 (berdasar ITS2); sementara
Montipora lainnya pemutihan lebih cepat dengan kandungan clade C (La Jeunesse
et al., 2003). Beberapa peneliti melaporkan bahwa Symbiodinium clade D
mempunyai toleransi terhadap panas (Baker et al., 2004; Chen et al., 2003; Fabricus et al., 2004; Rowan, 2004). Studi-studi tersebut melaporkan bahwa simbion clade D dominant bersimbiosis di lapangan dengan kondisi temperatur tinggi yang rutin (Fabricus et al., 2004) dan pada terumbu yang sebelumnya diselidiki mengalami pemutihan (Baker et al., 2004).
Studi yang ditunjukkan oleh Fitt et al., (1993) memperlihatkan bahwa biomassa jaringan dari karang Montastrea anularis pulih kembali dengan laju yang lebih lambat dibandingkan dengan perkembangan algae simbion zooxanthellae setelah kejadian pemutihan di Karibia pada 1987. Sementara itu Szmant dan Gassman (1990) dan Gleason (1993) menginformasikan bahwa sebagian besar karang di Carysfort Reef mengandung kadar normal densitas
zooxanthellae sebesar 1-3x106 individu/cm2 dalam kurun waktu 10 bulan pasca pemutihan.
Pemutihan karang yang terjadi secara timbul tenggelam dalam kurun waktu satu tahun menyebabkan timbul tenggelamnya pula hidup karang. Kejadian dimana karang-karang yang demikian dapat bertahan hidup meskipun temperatur lingkungan luarnya masih cukup tinggi dicirikan oleh : (a) pemutihan yang tidak komplit (parsial pemutihan), dimana zooxanthellae masih normal dalam jaringan polip hidup baik dalam posisi maupun jumlahnya (Hoegh-Guldberg and Smith, 1989; Porter et al., 1989); (b) repopulasi zooxanthellae terjadi secara cepat (Hoegh-Guldberg and Smith, 1989; Jaap, 1985; Szmant dan Gassmann, 1990). Sebaliknya pemutihan yang terjadi secara total secara signifikan menyebabkan kematian karang yang dicirikan oleh pemutihan secara komplit. Kejadian yang sama juga terjadi selama penelitian ini berlangsung dengan dibahas dalam kajian ketahanan pada bagian sebelumnya.
Dengan segera setelah pemutihan, karang dan simbiotik invertebrate secara normal melakukan kegiatan fotosintetiknya dan melakukan aktivitas nutrisional (Cole dan Jokiel, 1978; Glynn et al., 1985; Hoegh-Guldberg and Smith, 1989; Porter et al., 1989). Sebaliknya, pertumbuhan akan berhenti apabila bleching atau faktor yang mempengaruhinya terus berlangsung (McClanahan, 2000). Dengan keterangan lain dapat dinyatakan bahwa kejadian pemutihan dapat menyebabkan mortalitas selektif dan tekanan terhadap species yang terkena pengaruh. Gleason (1993) melaporkan hasil penelitiannya bahwa koloni-koloni karang yang mengalami pemutihan komplit pada bulan April 1991 di Pulau Moorea tidak mengalami perkembangan dan mati semua hingga Agustus 1991. Koloni-koloni yang hanya mengalami pemutihan parsial mempunyai kemampuan pulih secara komplit.
Jika kejadian pemutihan terjadi secara hebat dengan frekuensi tinggi, maka faktor ini akan dengan kuat menentukan komposisi species dan merupakan sumber bagi penyediaan ruang untuk recruitment baru. Hal ini akan menyebabkan terjadinya pengisian ruang baru dengan sifat persaingan yang rendah antar species, khususnya species yang tahan terhadap pemutihan Gleason (1993). Dalam tingkat yang lebih spesifik, ketika tingkat pemutihan bervariasi sangat
besar diantara sesama species yang berdekatan, ada peluang besar mempengaruhi variasi genotip atau variasi kerentanan (Fisk dan Done, 1985; Harriot, 1985 dan Lang et al., 1988). Pemutihan juga dapat mempengaruhi struktur komunitas karang yang dikenainya jika pengaruh sekunder terjadi seperti meningkatnya kelimpahan algae dan sea urchin, sehingga menghasilkan pemulihan karang yang lemah (Glynn, 1990). Hoegh-Guldberg and Smith (1989) menemukan bahwa pemulihan pasca pemutihan pada karang setelah terkena pengaruh temperatur 32oC selama 7 jam adalah 23 hari.
Gleason (1993) mengemukakan bahwa zooxanthellae yang tersisa setelah kejadian pemutihan dalam habitat intraselluler yang masih kaya akan nutrien akan relatif tumbuh secara cepat dibandingkan dengan karang dengan densitas yang besar. Namun demikian, hal ini masih bergantung kepada status kondisional dari zooxanthellae itu sendiri. Hal ini sebagaimana dinyatakan oleh Glynn (1984), bahwa kematian karang yang mengalami pemutihan parsial mungkin masih akan dapat bertahan dengan asumsi bahwa kondisi zooxanthellae tidak terpengaruh secara esktrim oleh pengaruh temperatur serta kondisi seluler dari polip. Namun sebaliknya apabila pengaruh temperatur atau faktor eksternal lain secara kuat terus-menerus yang mengakibatkan tidak terkontrolnya kondisi lingkungan oleh polip karang, meskipun secara fisiologis zooxanthellae masih toleran maka hal ini akan menyebabkan lepasnya zooxanthellae dari polip dan karang akan mati (Savina, 1991; Porter dan Meier, 1992).
Kondisi lingkungan pengeraman alami dilakukan pada lingkungan terumbu karang selatan Pulau Panjang Jepara pada kedalaman sekitar 3 hingga 6 meter. Hasil pengukurannya adalah seperti terlihat pada Tabel 18.
Tabel 18. Hasil analisis Beberapa Peubah Lingkungan Pengeraman Biota Uji
Goniastreas aspera
No Peubah Satuan Kisaran Hasil Pengukuran di Lingkungan Perairan Alami Minggu ke :
0 3 6 9 12 15 17 1 Temperatur oC 28,4– 29,4 28,2-28,8 28,0 – 28,5 28,4 – 28,6 28,3 – 28,8 28,2 – 28,5 28,0 – 28,4 2 Salinitas o/oo 32,6 - 33,2 32,7-33,3 32,0 – 32,6 32,2 – 32,7 32,5 – 32,8 32,2 – 32,5 32,0 – 32,3 3 Ammonia mg/l 0 – 0,0014 0 – 0,0008 0 – 0,0010 0 – 0,0006 0 0 0 – 0,0012 4 Nitrit mg/l 0 – 0,0005 0 – 0,0004 0 – 0,0002 0 – 0,0002 0 0 0 5 pH - 7,1 – 7,2 7,0 – 7,3 7,0 – 7,2 7,2 – 7,5 7,1 – 7,3 7,1 – 7,3 7,2 6 Oksigen terlarut mg/l 5,25 – 5,66 4,52 – 5,44 4,68 – 5,22 5,05 – 5,42 4,85 – 5,32 4,50 -5,22 5,22 – 5,50
Di lingkungan perairan alami, kisaran beberapa peubah kualitas air yang dipantau memperlihatkan tingkat homogenitas yang stabil selama 17 minggu. Hal ini memberikan dukungan bagi biota uji untuk dapat bertahan dan melangsungkan kegiatan faalinya.
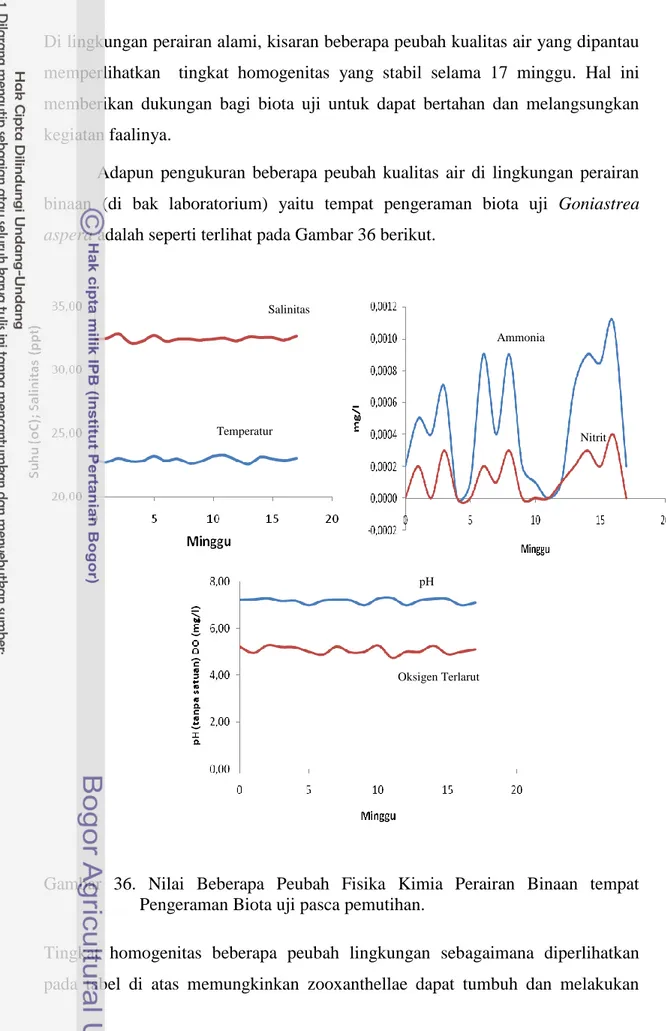
Adapun pengukuran beberapa peubah kualitas air di lingkungan perairan binaan (di bak laboratorium) yaitu tempat pengeraman biota uji Goniastrea
aspera adalah seperti terlihat pada Gambar 36 berikut.
Gambar 36. Nilai Beberapa Peubah Fisika Kimia Perairan Binaan tempat Pengeraman Biota uji pasca pemutihan.
Tingkat homogenitas beberapa peubah lingkungan sebagaimana diperlihatkan pada tabel di atas memungkinkan zooxanthellae dapat tumbuh dan melakukan
Salinitas Temperatur Ammonia Nitrit pH Oksigen Terlarut
proses penataan faali untuk mengisi struktur jaringan pada polip karang
Goniastreas aspera.
Zooxanthellae di dalam tubuh polip pada dasarnya mempunyai jumlah yang stabil, namun tetap terjadi perubahan akibat pertukaran individu. Keadaan ini dialami karang bila kondisi lingkungan tidak mengalami deviasi terlalu lebar sebagaimana hasil pantauan selama penelitian ini berlangsung atau dalam keadaan normal (Drew, 1972). Di alam tidak dapat dihindari perubahan densitas zooxanthellae di dalam jaringan polip karang, dimana densitas zooxanthellae yang dikandung karang berfluktuasi sepanjang waktu. Hal ini disebabkan karena di alam berbagai faktor lingkungan yang dapat mempengaruhi densitas zooxanthellae dapat ditemukan setiap waktu. Perubahan peubah fisika kimia laut yang relatif kecil saja secara konsekuensial dapat mempengaruhi stabilitas zooxanthellae di dalam jaringan polip karang (Glynn, 1990).
Hasil studi terhadap proses penempatan zooxanthellae pada jaringan polip yang diikuti oleh pertumbuhannya merupakan pencerminan dari mekanisme pemulihan biota uji pasca mendapatkan tekanan temperatur. Sinergisme keduanya ternyata secara konsisten ditunjang oleh sekuensi dua aspek. Yang pertama adalah ditemukannya beberapa tipe clade dalam rentang waktu pemeliharaan pada dua tipe pengeraman dan kedua adalah kemampuan tumbuh karang. Meskipun tidak dapat diperhitungkan proporsi sumbangan tiap clade zooxanthellae dalam jaringan polip karang.
Seperti telah diketahui bahwa setiap koloni hermatyphic corals
mengandung zooxanthellae yang hidup bersimbiosis dengan koloni karang. Zooxanthellae yang hidup di koloni karang ini memproduksi karbon sebagai sumber energi. Energi yang dihasilkan ini ditransfer ke polyp karang yang mendukung produksi kalsium karbonat (kapur) atau klasifikasi, untuk membentuk bangunan karang. Sehingga karang jenis ini disebut reef building coral atau jenis karang yang dapat membuat bangunan karang dari kapur. Goreau (1959) menyatakan bahwa zooxanthellae merupakan faktor yang esensial dalam proses kalsifikasi atau produksi kapur bagi hermatypic corals atau reef building corals. Kecepatan kalsifikasi ini tidak sama untuk setiap spesies. Spesies-spesies tertentu tumbuhnya sangat cepat, yaitu bisa >2cm/bulan (umumnya branching corals),