UNIVERSITAS INDONESIA
PENGATURAN LAJU HISAP FILTER DALAM SISTEM
PRODUKSI BIOMASSA
Nannochloropsis
sp. MENGGUNAKAN
TEKNIK FILTRASI KONTINYU DALAM ALIRAN
SIRKULASI KULTUR MEDIA
SKRIPSI
GESTI APRILIA FITRIANI
0806319652
FAKULTAS TEKNIK
PROGRAM STUDI TEKNOLOGI BIOPROSES
DEPOK
ii
Universitas Indonesia
UNIVERSITAS INDONESIA
PENGATURAN LAJU HISAP FILTER DALAM SISTEM
PRODUKSI BIOMASSA
Nannochloropsis
sp. MENGGUNAKAN
TEKNIK FILTRASI KONTINYU DALAM ALIRAN
SIRKULASI KULTUR MEDIA
SKRIPSI
Diajukan untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik di Departemen Teknik Kimia FTUI
GESTI APRILIA FITRIANI
0806319652
FAKULTAS TEKNIK
PROGRAM STUDI TEKNOLOGI BIOPROSES
DEPOK
JUNI 2012
iv
Universitas Indonesia Pengaturan laju..., Gesti aprilia Fitriani, FTUI, 2012
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas karunianya, sehingga penulis dapat menyelesaikan skripsi ini tepat pada waktunya. Berkat rahmat-Nya, penulis dapat menyelesaikan makalah seminar dengan judul “Pengaturan Laju Hisap Filter dalam Sistem Produksi Biomassa Nannochloropsis sp. Menggunakan Teknik Filtrasi Kontinyu dalam Aliran Sirkulasi Kultur Media” untuk memenuhi tugas skripsi, salah satu syarat untuk mencapai gelar Sarjana Teknik pada Departemen Teknik Kimia Fakultas Teknik Universitas Indonesia.
Penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak, dari masa perkuliahan sampai pada penyusunan skripsi ini, sangatlah sulit bagi penulis untuk menyelesaikan skripsi ini. Oleh karena itu, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
(1) Ir. Dianursanti, MT selaku dosen pembimbing yang telah menyediakan waktu, tenaga, dan pikiran untuk mengarahkan saya dalam penyusunan skripsi ini;
(2) Ir. Rita Arbianti, M.Si., selaku dosen pembimbing akademik yang telah menyediakan waktu dan membantu permasalahan akademik perkuliahan selama ini;
(3) Ir. Yuliusman M.Eng selaku kordinator skripsi Teknik Kimia FTUI;
(4) Para dosen Departemen Teknik Kimia FTUI yang telah memberikan ilmu dan wawasannya;
(5) Orangtua yang selalu memberi dukungan dan semangat selama mengerjakan skripsi ini di rumah;
(6) Rekan satu bimbingan: Destya Nilawati, Prima A., Ingrid C. E. Inthe, Harnadiemas F., Prima Ernest, Ni’matulloh, dan Bhakti Yoga yang sudah membantu dalam pencarian sumber dan saling bertukar wawasan serta informasi yang ada;
vi
Universitas Indonesia (8) Yunia Selviliana selaku teman terdekat saya yang selalu memberi semangat
dan kasih sayangnya kepada saya;
(9) Semua teman-teman yang tidak dapat disebutkan satu demi satu, yang selalu memberikan informasi dan bantuan semangat;
(10)Semua pihak yang telah membantu penyusunan makalah skripsi ini secara langsung maupun tidak langsung;
Penulis menyadari bahwa dalam makalah skripsi ini masih terdapat banyak kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun sehingga dapat menyempurnakan skripsi ini dan melaksanakan perbaikan di masa yang akan datang. Semoga tulisan ini dapat bermanfaat bagi para pembaca dan bagi dunia pendidikan dan ilmu pengetahuan.
.
Depok, 11 Juli 2012
Penulis
viii
Universitas Indonesia ABSTRAK
Nama : Gesti Aprilia Fitriani Program Studi : Teknologi Bioproses
Judul : Pengaturan Laju Hisap Filter dalam Sistem Produksi Biomassa
Nannochloropsis sp. Menggunakan Teknik Filtrasi Kontinyu dalam Aliran Sirkulasi Kultur Media
Topik penelitian mengenai mikroalga menjadi perhatian utama para ilmuwan karena kemampuannya terhadap fiksasi CO2 dan juga kandungan biomassa yang
dapat dimanfaatkan dalam berbagai kepentingan. Mikroalga yang diusulkan pada penelitian ini adalah Nannochloropsis sp. karena merupakan salah satu mikroalga yang potensial dan memiliki kandungan biomassa yang besar. Fokus penelitian ini adalah peningkatan produksi biomassa dengan mengatur laju hisap filter pada perlakuan teknik filtrasi kontinyu dalam sistem kultivasi Nannochloropsis sp. Hasil penelitian menunjukkan bahwa dalam rangka upaya meningkatkan produktivitas biomassa Nannochloropsis sp. pada ukuran reaktor yang lebih besar, teknik filtrasi kontinyu terbukti berhasil meningkatkan produksi biomassa hingga 1,71 kali dari proses kultivasi kontrol (tanpa filtrasi).
Kata kunci:
Nannochloropsis sp., produksi biomassa, Teknik Filtrasi, sistem kultivasi, fotobioreaktor
ABSTRACT
Name : Gesti Aprilia Fitriani Study Program : Teknologi Bioproses
Title : Arrangement of Filter Suction Rate in Biomass Production Using Continuous Filtration Technique in Media Culture Circulation Flow
Topics of research on microalgae major concern scientists because of its ability to CO2 fixation and also the content of the biomass that can be utilized in a
variety of interests. Microalgae are proposed in this study were Nannochloropsis
sp. because it is one of the potential of microalgae and has a large biomass content. The focus of this study is the increase in biomass production by regulating the rate of suction filter in the treatment of continuous filtration techniques in the cultivation system of Nannochloropsis sp. The results showed that in an effort to increase the biomass productivity of Nannochloropsis sp. on the size of the larger reactor, continuous filtration technique proved successful in increasing the production of biomass to 1.71 times that of the control cultivation.
Key words:
Nannochloropsis sp., biomass production, filtration method, cultivation system, photobioreactor
x
Universitas Indonesia DAFTAR ISI
HALAMAN PERNYATAAN ORISINALITAS iii
HALAMAN PENGESAHAN iv
KATA PENGANTAR v
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS
AKHIR UNTUK KEPENTINGAN AKADEMIS vii
ABSTRAK viii
ABSTRACT ix
DAFTAR ISI x
DAFTAR GAMBAR xii
DAFTAR TABEL xiii
BAB 1 PENDAHULUAN 1 1.1. Latar Belakang 1 1.2. Rumusan Masalah 5 1.3. Tujuan Penelitian 5 1.4. Batasan Masalah 5 1.5. Sistematika Penulisan 5
BAB 2 TINJAUAN PUSTAKA 7
2.1. Mikroalga Nannochloropsis sp. 7
2.2. Fotobioreaktor 9
2.3. Fase Pertumbuhan Mikroalga 10
2.3.1.Fase Tunda (Lag Phase) 10
2.3.2.Fase Eksponensial (Log Phase) 10
2.3.3.Fase Penurunan Laju Pertumbuhan 11
2.3.4.Fase Stasioner 11
2.3.5.Fase Kematian 11
2.4. Faktor-faktor yang Mempengaruhi Pertumbuhan
Nannochloropsis sp.
12
2.4.1.Jenis Medium/Nutrisi 12
2.4.2.Pencahayaan 12
2.4.3.Kondisi Operasi 13
2.5. Fotosintesis Pada Mikroalga 15
2.5.1.Definisi Fotosintesis 15
2.5.2.Proses Fotosintesis 15
2.6. Teknik Filtrasi 18
BAB 3 METODE PENELITIAN 21
3.1.Diagram Alir Penelitian 21
3.2.Alat dan Bahan Penelitian 22
3.3.Variabel dalam Penelitian 23
3.3.1.Variabel Bebas 23
3.3.2.Variabel Terikat 23
3.3.3.Variabel Tetap 23
3.4.Prosedur Penelitian 24
3.4.1.Tahap Perangkaian Fotobioreaktor 24
3.4.2.Sterilisasi Peralatan 24
3.4.3.Pembuatan Medium Walne 25
3.4.4.Pembiakan Kultur Murni 26
3.4.5.Penentuan Jumlah Inokulum Nannochloropsis sp. 26
3.4.6.Pembuatan Kurva Kalibrasi 28
3.4.7.Pelaksanaan Penelitian 28
3.4.8.Pengambilan Data 29
3.5.Pengolahan Data 30
BAB 4 HASIL DAN PEMBAHASAN 36
4.1.Pembahasan Umum 36
4.2.Data Penelitian 38
4.2.1.Penentuan Laju Hisap Filter 38
4.2.2.Pengaruh Perlakuan Filtrasi Terhadap Pertumbuhan
Nannochloropsis sp.
40
4.2.2.1. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan Filtrasi terhadap Berat Kering Sel (X)
40
4.2.2.2. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan Filtrasi terhadap Laju Pertumbuhan (µ)
42
4.2.2.3. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan Filtrasi terhadap [HCO3-] dalam
medium
43
4.2.2.4. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan Filtrasi terhadap Fiksasi CO2 oleh
Nannochloropsis sp.
45
4.2.2.5. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan Filtrasi terhadap CTR oleh
Nannochloropsis sp.
45
4.2.2.6. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan Filtrasi terhadap qCO2 oleh
Nannochloropsis sp.
47
4.2.3. Analisis Kandungan Biomassa dari Sel
Nannochloropsis sp. Hasil Kultivasi
48
BAB 5 KESIMPULAN 50
5.1. Kesimpulan 50
5.2. Saran 51
xii
Universitas Indonesia DAFTAR GAMBAR
Gambar 2.1. Nannochloropsis sp. 7
Gambar 2.2. Ilustrasi Morfologis Sel Nannochloropsis sp. 8
Gambar 2.3. Fase Pertumbuhan Mikroalga 10
Gambar 2.4. Fotosintesis Pada Mikroalga 15
Gambar 2.5. Proses Reaksi Terang 15
Gambar 2.6. Siklus calvin 15
Gambar 3.1. Diagram Alir Penelitian 21
Gambar 3.2. Skema peralatan 24
Gambar 4.1. Berat Kering Sel (X) pada Berbagai Laju Hisap Filter 39 Gambar 4.2. Laju Pertumbuhan Maksimum (µmax) pada Berbagai Laju
Hisap Filter 40
Gambar 4.3. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan
Filtrasi terhadap Berat Kering Sel Nannochloropsis sp. 41 Gambar 4.4. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan
Filtrasi terhadap Laju Pertumbuhan Nannochloropsis sp. 43 Gambar 4.5. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan
Filtrasi terhadap [HCO3-] Nannochloropsis sp.
44
Gambar 4.6. Konsentrasi CO2 yang Masuk dan Keluar pada Metode Filtrasi
dan Kontrol 45
Gambar 4.7. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan
Filtrasi dan Kontrol terhadap CTR Nannochloropsis sp. 46 Gambar 4.8. Pengaruh Pengaturan Laju Hisap Filter dalam Perlakuan
Filtrasi dan Kontrol terhadap qCO2Nannochloropsis sp.
47
DAFTAR TABEL
Tabel 1.1. Komposisi Biomassa Mikroalga 2
Tabel 1.2. Beberapa Jenis Produk Berbasis Mikroalga 2 Tabel 1.3. Kandungan Biomassa Mikroalga Nannochloropsis sp. 3 Tabel 2.1. Perbandingan Antara Penggunaan Sistem Open Pond dengan
Sistem Photobioreactor 9
Tabel 2.2. Jejak Rekam Penelitian Budidaya Alga dalam Sistem Filtrasi 20
Tabel 3.1. Komposisi Walne 26
Tabel 3.2. Penentuan kadar protein dengan metode Lowry 32 Tabel 4.1. Hasil Uji Kandungan Biomassa Nannochloropsis sp. 48
1
Universitas Indonesia BAB 1
PENDAHULUAN
1.1. Latar Belakang Masalah
Topik penelitian tentang mikroalga telah menjadi perhatian utama di kalangan ilmuwan beberapa tahun belakangan ini dalam rangka mengurangi efek pemanasan global. Mikroalga pada tahun-tahun mendatang diprediksi akan semakin menonjol mengingat semakin banyak pihak yang tertarik pada pembudidayaan mikroorganisme fotosintetik ini. Selain karena mempunyai nilai ekonomi yang tinggi, mikroalga mudah didapat dan dikembangkan. FBR (fotobioreaktor) merupakan reaktor yang dirakit dari bahan tembus pandang yang dilengkapi dengan instalasi suplay media dan emisi gas untuk membudidaya mikroalga dalam rangka penyerapan gas CO2. Teknologi FBR yang diterapkan
pada mikroalga dinilai efektif mereduksi emisi CO2 karena kemampuan mikroalga
dalam mengabsorbsi CO2 dalam proses fotosintesisnya (Chen et al., 2006).
Beberapa keuntungan penggunaan mikroalga dalam proses pengolahannya berjalan alami seperti prinsip ekosistem alam sehingga sangat ramah lingkungan dan tidak menghasilkan limbah sekunder. Keunggulan lainnya adalah pada proses ini daur ulang nutrien berjalan sangat efisien dan menghasilkan biomassa (protein, karbohidrat, protein, klorofil, beta karoten, dan mineral) yang dapat dimanfaatkan untuk berbagai kepentingan (De la noue et al., 1992). Tabel 1.1 dan 1.2 merupakan total biomass dari beberapa mikroalga dan manfaat biomassa mikroalga.
Tabel 1.1. Komposisi Biomassa Mikroalga
Mikroalga Komposisi biomassa (% bobot kering)
Protein Karbohidrat Lemak
Scenedesmus obliquus 50-56 10-17 12-14 Chlorella vulgaris 51-58 12-17 14-22 Spirogyra sp. 6-20 33-64 11-21 Nannochloropsis sp. 52,11 16 27,64 Dunaliella salina 57 32 6 Tetraselmis maculata 52 15 3 Spirulina platensis 46-63 8-14 4-9 Spirulina maxima 60-71 13-16 6-7 (Sumber: Becker, 1994 dan Riedel, 2008)
Tabel 1.2. Beberapa Jenis Produk Berbasis Mikroalga
Produk Aplikasi
Biomassa Biomassa Makanan sehat
Functional food Pakan tambahan Aquakultur Remediasi tanah Pewarna dan antioksidan Xantofil Lutein Β-karoten Vitamin C dan E Makanan tambahan Pakan tambahan Kosmetik Asam lemak (fatty acid)
Arachidonic acid (AA)
Eicosapentaenoicacid (EPA)
Docosahexaenoicacid (DHA)
ɣ-linoleicacid (GLA)
Linoleicacid (LA)
Makanan tambahan
Polimer Polisakarida Pati
Makanan tambahan Pakan tambahan (Sumber: Spolaore, P., et al., 2006)
Pada penelitian yang diusulkan, mikroalga yang digunakan adalah
Nannochloropsis sp., salah satu spesies potensial yang tergolong dalam Family Eustigmatophyceae karena kandungan biomassa yang tinggi apabila dibandingkan dengan mikroalga lain. Tabel 1.2. di bawah ini menjelaskan tentang persentase kandungan biomassa dari mikroalga Nannochloropsis sp.
3
Universitas Indonesia Tabel 1.3. Kandungan Biomassa Mikroalga Nannochloropsis sp.
Komposisi % dari berat kering mg dari 100 g berat kering
Lipid 18,4 Protein 28,8 Karbohidrat 37,6 Mineral: Ca 972 K 533 Na 659 Mg 316 Zn 103 Fe 136 Mn 3,4 Cu 35 Ni 0,22 Co < 0,1
(Sumber: M. M. Rebolloso-Fuentes et al, 2001)
Dengan demikian, dengan adanya pembudidayaan mikroalga
Nannochloropsis sp. ini dapat membawa dampak yang positif untuk menghasilkan biomassa yang dapat dijadikan sumber alternatif dan juga fiksasi CO2. Dalam
pertumbuhannya mikroalga Nannochloropsis sp. memanfaatkan energi cahaya menjadi energi ATP dan pembentukan senyawa karbon Setiap jenis mikroalga memiliki kekhasan tersendiri dalam menunjukkan kepekaannya terhadap sistem pencahayaan yang diberikan, yang ditunjukkan melalui kemampuan memproduksi biomassanya. Oleh karena itu, cahaya merupakan faktor penting untuk pertumbuhan Nannochloropsis sp.
Pada saat mengkultur mikroalga dalam fotobioreaktor, efek self-shading
(peristiwa penutupan satu sel oleh sel lain yang menyebabkan tidak meratanya cahaya dan CO2 yang didapatkan mikroalga) dalam kultur akan tercapai pada
rentang waktu tertentu. Hal itu dapat mengakibatkan laju pertumbuhan tidak maksimum. Pada penelitian sebelumnya, mikroalga Chlorella vulgaris dikultivasi dengan intensitas cahaya tetap serta tanpa perlakuan apapun, dan biomassa yang diproduksi pada jam ke-100 sebesar 3,13 g/L (Rachma N, 2008).
Pada penelitian ini akan difokuskan upaya peningkatan produksi biomassa dengan menggunakan teknik filtrasi kontinyu dimana merupakan teknik memerangkap sel secara kontinyu untuk meminimalkan adanya pengaruh self-shading yang terjadi saat kultivasi. Perlakuan ini bertujuan untuk mengatur
densitas sel dalam kultur mikroalga yang dapat meratakan pemberian cahaya dan dapat mencukupi kebutuhan sel selama kultivasi. Perlakuan serupa juga pernah dilakukan oleh Rachma pada tahun 2008 dengan perlakuan filtrasi dan berhasil meningkatkan biomassa sebesar 1,22 kali lipat dari perlakuan tanpa filtrasi.
Selain perlakuan filtrasi, pada penelitian ini juga akan dilakukan pengaturan laju hisap filter pada aliran sirkulasi kultur media. Perlakuan ini akan dilakukan variasi laju hisap filter yang terus ditingkatkan sesuai dengan peningkatan pertumbuhan mikroalga pada fotobioreaktor. Hal ini dilakukan untuk mengurangi terjadinya penutupan sel satu dan lainnya yang terjadi pada kultur dan juga menjaga agar cahaya yang diberikan dapat terserap baik oleh sel Nannochloropsis
sp. Pengaturan laju hisap filter ini akan mempengaruhi besarnya sel yang terperangkap di dalam filter yang dapat mempengaruhi kepadatan sel, sehingga intensitas cahaya yang selalu konstan dapat mereduksi penggunaan cahaya serta didapatkan laju pertumbuhan yang maksimum (Heru D, 2010) dan juga diharapkan mikroalga Nannochloropsis sp. dapat tersaring lebih optimal sehingga kemungkinan mikroalga untuk lolos dari penyaringan sangat kecil.
Di Departemen Teknik Kimia Universitas Indonesia, perlakuan yang sama pernah dilakukan oleh Dianursanti pada tahun 2009 pada mikroalga Chlorella vulgaris. Hasil yang didapat dengan perlakuan filtrasi secara kontinyu dalam fotobioreaktor menghasilkan peningkatan produksi yang lebih besar yaitu sebesar 1,25 kali dari proses kultivasi kontrol. Hal ini menunjukkan bahwa perlakuan filtrasi telah berhasil mengatur kondisi densitas sel sedemikian rupa sehingga intensitas cahaya yang diberikan dapat tetap mencukupi kebutuhan sel selama proses kultivasi. Dalam hal ini, dapat pula dikatakan bahwa perlakuan filtrasi ini terbukti dapat meminimalkan efek self-shading.
Penelitian ini dilakukan tidak hanya berhenti pada peningkatan produksi biomassa, namun juga akan dilakukan pengujian kandungan biomassa dari mikroalga Nannochloropsis sp. untuk mengetahui efek dari perlakuan metode filtrasi dengan pengaturan laju hisap filter terhadap peningkatan jumlah mikroalga
Nannochloropsis sp. Diharapkan dari hasil penelitian ini dapat dijadikan salah satu bahan acuan untuk diterapkan dalam skala yang lebih besar atau skala industri.
5
Universitas Indonesia 1.2. Rumusan Masalah
Berdasarkan latar belakang tersebut, hal yang menjadi permasalahan adalah bagaimana menentukan laju hisap filter optimum agar kondisi densitas sel
Nannochloropsis sp. dalam filter dapat dijaga pada intensitas cahaya yang diberikan dan menghasilkan produk biomassa yang besar dan juga fiksasi CO2
yang efisien?
1.3. Tujuan Penelitian
Berdasarkan latar belakang dan rumusan masalah, tujuan dari penelitian ini, yaitu:
Mendapatkan laju hisap filter optimum untuk meningkatkan produksi biomassa Nannochloropsis sp.
Mendapatkan biomassa Nannochloropsis sp. yang optimum dengan menggunakan teknik filtrasi kontinyu.
Menguji kandungan biomassa Nannochloropsis sp. pada perlakuan teknik filtrasi kontinyu.
1.4. Batasan Masalah
Batasan masalah pada penelitian ini, yaitu:
Jenis mikroalga yang digunakan pada penelitian ini adalah Nannochloropsis
sp.
Jenis medium yang digunakan adalah Walne.
Sistem reaktor yang digunakan adalah fotobioreaktor tunggal dengan volume 18 L.
Metode pencahayaan yang digunakan adalah pencahayaan kontinyu. 1.5. Sistematika Penulisan
Sistematika penulisan yang digunakan adalah sebagai berikut: Bab I Pendahuluan
Pada bab pendahuluan ini terdiri atas latar belakang, rumusan masalah, tujuan penelitian, batasan masalah, dan sistematika penulisan.
Bab II Tinjauan Pustaka
Tinjauan pustaka berisikan ulasan mengenai Nannochloropsis sp., fotobioreaktor, fotosintesis, dan metode pemanenan.
Bab III Metode Penelitian
Pada bab ini berisi tentang diagram alir penelitian, alat dan bahan yang digunakan, dan prosedur penelitian.
Bab IV Pembahasan
Bab ini berisikan mengenai analisis penelitian, baik dari data yang diperoleh, hasil pengamatan dan pembahasan untuk tiap metode pemanenan serta pengaruhnya terhadap nutrisi yang dikandung. Bab V Kesimpulan dan Saran
Bab kesimpulan dan saran terdiri atas kesimpulan yang dapat ditarik dari penelitian ini dan saran yang dapat diberikan untuk penelitian selanjutnya.
7
Universitas Indonesia BAB 2
TINJAUAN PUSTAKA
2.1.Mikroalga Nannochloropsis sp.
Mikroalga adalah alga kecil (ukuran 2-20µm) berupa tanaman talus yang memiliki klorofil sehingga mampu melakukan fotosintesis. Mikroalga bereproduksi secara aseksual melalui pembelahan sel. Mikroalga terdiri dari banyak spesies yang hampir semuanya merupakan organisme akuatik. Mikroalga ini banyak dikultur diberbagai negara terutama negara yang memiliki industri akuakultur seperti Indonesia, Thailand, Taiwan, Jepang, Ekuador dan beberapa negara di kawasan benua Eropa. Terdapat begitu banyak spesies dari mikroalga, diantaranya adalah Nannochloropsis sp.
Nannochloropsis sp. adalah alga bersel satu yang termasuk dalam kelas Eustigmatophyceae yang di kenal sebagai marine chlorella dan umumnya dibudidayakan di pembenihan-pembenihan ikan sebagai pakan rotifer.
Nannochloropsis sp. mempunyai peranan penting dalam suatu kegiatan pembenihan karena kandungan nutrisinya yang tinggi (Wisnu, 2006).
Gambar 2.1.Nannochloropsis sp. (Sumber: Diadié Diouf et al., n.d)
Klasifikasi sel Nannochloropsis sp. digolongkan sebagai berikut (Adehoog, 2001 dan Fitzsimmons, 2001):
Kingdom : Protista
Super Divisi : Eukaryotes Divisi : Chromophyta Sub Divisi : Alga
Kelas : Eustigmatophyceae Genus : Nannochloropsis
Spesies : Nannochloropsis sp.
Ilustrasi morfologi Nannochloropsis sp. dapat dilihat pada Gambar 2.1.
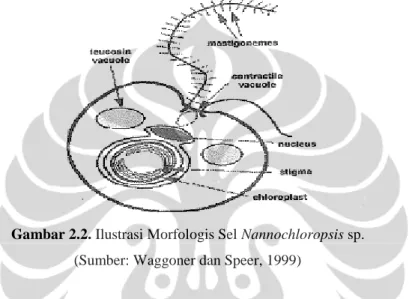
Gambar 2.2. Ilustrasi Morfologis Sel Nannochloropsis sp. (Sumber: Waggoner dan Speer, 1999)
Sel Nannochloropsis sp. berukuran 2 - 4 mikron, berwarna hijau, bentuk bulat memanjang, memiliki kloroplas yang mengandung klorofil a dan c serta pigmen fucoxanthin (Reed Mariculture Inc., 2001). Dinding sel Nannochloropsis sp. terbuat dari komponen selulosa yang kuat dan merupakan karbohidrat komplek yang bermanfaat untuk mengikat zat-zat toksik sehingga dapat dikeluarkan dari dalam tubuh serta mempunyai kemampuan mengikat aktivitas sistem kekebalan tubuh, juga memiliki 2 flagel (heterokontous) yang salah satu flagel berambut tipis, sehingga dapat bergerak aktif (Waggoner dan Speer, 1999). Sel
Nannochloropsis sp. memiliki kloroplas dan nukleus yang dilapisi oleh membran dan tidak selalu terdapat di perairan umum. Kloroplas ini memiliki stigma (bintik mata) di sitoplasma yang sensitif terhadap cahaya (Bold dan Wynne, 1985). Sel
Nannochlorpsis sp. berkembang baik secara aseksual dengan cara pembelahan sel atau pemisahan autospora dari sel induknya dan mempunyai toleransi terhadap lingkungan sangat tinggi. Menurut Wahyuni et al. (2001), bahwa sel
9
Universitas Indonesia 5000-200.000 lux (sesuai dengan volume budidaya), suhu 23-36oC dan salinitas 15-45 ppt.
2.2.Fotobioreaktor
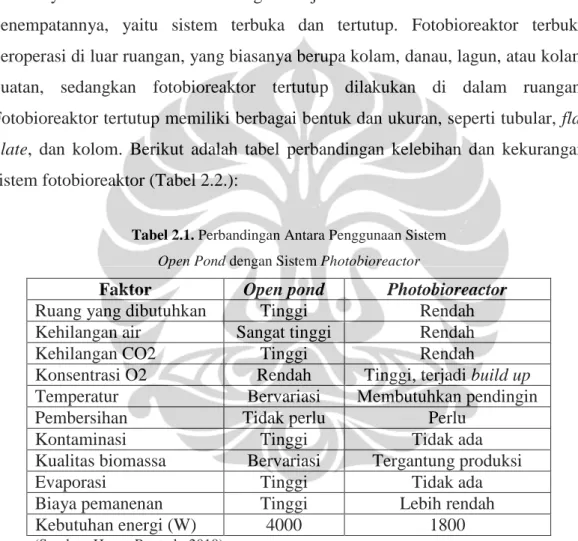
Fotobioreaktor adalah reaktor yang digunakan sebagai tempat perkembangbiakan mikroalga yang dirancang dengan sistem yang diberikan pencahayaan. Fotobioreaktor dibagi menjadi dua sistem berdasarkan letak penempatannya, yaitu sistem terbuka dan tertutup. Fotobioreaktor terbuka beroperasi di luar ruangan, yang biasanya berupa kolam, danau, lagun, atau kolam buatan, sedangkan fotobioreaktor tertutup dilakukan di dalam ruangan. Fotobioreaktor tertutup memiliki berbagai bentuk dan ukuran, seperti tubular, flat plate, dan kolom. Berikut adalah tabel perbandingan kelebihan dan kekurangan sistem fotobioreaktor (Tabel 2.2.):
Tabel 2.1. Perbandingan Antara Penggunaan Sistem Open Pond dengan Sistem Photobioreactor
Faktor Open pond Photobioreactor
Ruang yang dibutuhkan Tinggi Rendah
Kehilangan air Sangat tinggi Rendah
Kehilangan CO2 Tinggi Rendah
Konsentrasi O2 Rendah Tinggi, terjadi build up
Temperatur Bervariasi Membutuhkan pendingin
Pembersihan Tidak perlu Perlu
Kontaminasi Tinggi Tidak ada
Kualitas biomassa Bervariasi Tergantung produksi
Evaporasi Tinggi Tidak ada
Biaya pemanenan Tinggi Lebih rendah
Kebutuhan energi (W) 4000 1800
(Sumber: Harun R.et al., 2010)
2.3.Fase Pertumbuhan Mikroalga
Gambar 2.3. Fase Pertumbuhan Mikroalga (Sumber: Wirosaputro, 2002)
2.3.1. Fase Tunda (Lag Phase)
Lag phase adalah suatu tahap setelah pemberian inokulum ke dalam media kultur dimana terjadi penundaan pertumbuhan yang dikarenakan Nannochloropsis
sp. memerlukan pembelahan. Pada fase ini laju pertumbuhan spesifik adalah pada level sub-maksimum yang sering diamati. Pertumbuhan lag terjadi karena adanya sel non viable dan spora dalam inokulum. Pertumbuhan lag terjadi karena adanya masa adaptasi fisiologis akibat perubahan kondisi nutrisi untuk alga. Fase lag tida terjadi dalam kultivasi jika inokulum yang digunakan sudah berada pada fase eksponensial.
Dalam fase ini tidak terjadi pertambahan jumlah sel. Fase ini adalah fase penyesuaian yaitu suatu masa ketika sel-sel kekurangan metabolit dan enzim akibat dari keadaan tidak menguntungkan dalam pembiakan terdahulu, menyesuaikan diri dengan lingkungan yang baru. Enzim-enzim dan zat antara terbentuk dan terkumpul sampai konsentrasi yang cukup untuk kelanjutan pertumbuhan.
2.3.2. Fase Eksponensial (Log Phase)
Pada fase ini, sel-sel membelah dengan cepat dan terjadi pertambahan dalam jumlah sel. Selam fase ini, sel-sel berada dalam keadaan yang stabil. Bahan
L o g J u m la h Sel Fas e L ag Fas e L o g Fas e P en u ru n a n L aj u P er tu m b u h an Fas e Sta sio n er Fas e Ke m atia n Waktu
11
Universitas Indonesia sel baru terbentuk dengan konstan dan massa bertambah secara eksponensial. Hal ini bergantung dari satu atau dua hal yang terjadi, yaitu apabila zat makanan dalam pembenihan habis maka hasil metabolisme yang beracun akan tertimbun dan menghambat pertumbuhan. Kultur dalam fase pertumbuhan eksponensial tidak hanya berada dalam keseimbangan pertumbuhan tetapi jumlah dari sel-sel dalam kultur ini bertambah dengan kecepatan yang relatif konstan.
2.3.3. Fase Penurunan Laju Pertumbuhan
Pada fase ini, tetap terjadi pertambahan sel namun laju pertumbuhannya menurun. Hal ini dikarenakan terjadinya kompetisi yang sangat tinggi di dalam media hidup karena zat makanan yang tersedia tidak sebanding dengan jumlah populasi akibat dari pertambahan yang sangat cepat pada fase eksponensial sehingga hanya sebagian dari populasi yang mendapatkan makanan yang cukup dan dapat tumbuh serta membelah.
2.3.4. Fase Stasioner
Fase stasioner adalah fase pemberhentian pertumbuhan. Pada fase ini, jumlah sel kurang lebih tetap. Hal ini disebabkan oleh habisnya nutrisi dalam medium atau karena menumpuknya hasil metabolisme yang beracun sehingga mengakibatkan pertumbuhan berhenti. Dalam kebanyakan kasus, pergantian sel terjadi dalam fase stasioner, dimana adanya kehilangan sel yang lambat karena kematian yang diimbangi dengan pembentukan sel-sel yang baru melalui pembelahan. Bila hal ini terjadi, maka jumlah sel akan bertambah secara lambat, meskipun jumlah sel hidup tetap.
2.3.5. Fase Kematian (Death Phase)
Dalam fase ini, jumlah populasi ini menurun. Selama fase ini, jumlah sel yang mati per satuan waktu secara perlahan-lahan bertambah dan akhirnya kecepatan sel-sel yang mati menjadi konstan.
2.4.Faktor-faktor yang Mempengaruhi Pertumbuhan Nannochloropsis sp. 2.4.1. Jenis Medium/Nutrisi
Seperti halnya makanan pada manusia, medium perkembangbiakkan pada alga merupakan tempat diserapnya nutrisi bagi pertumbuhan alga yang nantinya akan mempengaruhi metabolisme pada alga. Agar Nannochloropsis sp. dapat hidup, maka medium pembiakannya harus memiliki berbagai nutrisi yang diperlukan untuk pertumbuhan dan perkembangannya. Terdapat berbagai jenis medium yang dapat digunakan sebagai media hidup mikroalga hijau
Nannochloropsis sp., seperti Walne, Guillard f/2, dan lain sebagainya. Semua jenis medium tersebut memiliki kandungan unsur hara yang dibutuhkan untuk pertumbuhan mikroalga hijau Nannochloropsis sp., seperti N, P, K, S, Ca dan mineral lainnya. Kebutuhan unsur hara bagi kehidupan alga secara garis besar terbagi dua, yaitu unsur hara makro dan unsur hara mikro. Unsur hara makro terdiri dari N, P, K, S, Na, Si, dan Ca, sedangkan unsur hara mikro terdiri dari Fe, Zn, Mn, Cu, Mg, Mo, Co, dan B. Unsur N, P, dan Fe dapat meningkatkan kenaikan jumlah sel. Sulfur dapat membantu akselerasi pembelahan sel, sedangkan Mg dan Fe membantu meningkatkan klorofil. Menurut Richmond, A. E. (1990), kekurangan unsur P dapat menurunkan kadar protein dan klorofil a, akan tetapi dapat meningkatkan karbohidrat.
2.4.2. Pencahayaan
Cahaya merupakan faktor utama yang mempunyai peranan penting untuk pertumbuhan mikroalga sebagai sumber energi untuk pertumbuhan mikroalga dan fotosintesis. Intensitas yang baik bagi mikroalga untuk melakukan fotosintesis berkisar antara 2000 - 3000 lux. Cahaya matahari yang diperlukan oleh mikroalga dapat diganti oleh lampu TL. Penggunaan cahaya yang berasal dari lampu TL karena didasari oleh kebutuhan intensitas cahaya pada penelitian ini dimana jika cahaya pada lampu TL dapat diatur sesuai dengan intensitas yang dibutuhkan. Selain itu lampu TL mempunyai kestabilan intensitas cahaya jika dibandingkan dengan cahaya yang bersumber dari cahaya matahari. Faktor pencahayaan terbagi menjadi tiga bagian, yaitu pencahayaan kontinu, pencahayaan alterasi dan pencahayaan gelap-terang (fotoperiodesitas). Sebenarnya faktor pencahayaan ini
13
Universitas Indonesia juga dapat dibagi lagi menjadi pencahayaan dengan panjang gelombang tertentu dan pencahayaan dengan intensitas tertentu. Namun, kali ini hanya akan dibahas mengenai pencahayaan dengan intensitas tertentu.
1. Pencahayaan Kontinu
Istilah pencahayaan kontinyu adalah Nannochloropsis sp. yang diiluminasi dengan cahaya tampak secara terus-menerus hingga mencapai fase stationernya. Menurut penelitian yang telah dilakukan, perlakuan ini memberikan hasil laju pertumbuhan yang lebih tinggi jika dibandingkan dengan pencahayaan gelap-terang (fotoperiodesitas).
2. Pencahayaan Terang-Gelap
Istilah pencahayaan terang-gelap adalah Nannochloropsis sp. yang diiluminasi dengan cahaya tampak (370-900 nm) dengan mengatur kondisi terang selama 8 jam dan kondisi gelap selama 16 jam, seperti kondisi alami (periode cahaya matahari). Dari penelitian yang telah dilakukan, perlakuan ini memberikan efisiensi cahaya yang paling besar dibandingkan dengan pencahayaan kontinu, namum laju pertumbuhannya masih sedikit di bawah pencahayaan kontinu.
3. Pencahayaan Alterasi
Alterasi adalah perubahan perlakuan cahaya kontinu dengan memberikan intensitas cahaya yang semakin tinggi seiring dengan pertambahan jumlah sel dari dalam penelitian ini. Perlakuan pencahayaan alterasi didasarkan pada semakin banyaknya jumlah sel biomassa dari Nannochloropsis sp. maka kultur akan semakin pekat, sehingga cahaya yang diberikan tidak lagi diterima secara merata oleh semua sel (terbatas pada sel yang ada di depan sumber cahaya). Usaha ini telah dibuktikan dapat meningkatkan laju pertumbuhan optimal dan menghasilkan biomassa dengan jumlah yang lebih tinggi dibandingkan dengan pencahayaan kontinu tanpa alterasi pada cyanobacterium A. Cylindrica (Wijanarko, 2003).
2.4.3. Kondisi Operasi
1. Karbondioksida (CO2) dan Oksigen (O2)
Karbondioksida diperlukan oleh fitoplankton untuk memenbantu proses fotosintesis. Karbondioksida dengan kadar 1-2 % biasanya sudah cukup digunakan dalam kultur fitoplankton dengan intensitas cahaya yang rendah. Kadar
karbondioksida yang berlebih dapat menyebabkan pH kurang dari batas optimum sehingga akan berpengaruh terhadap pertumbuhan fitoplankton (Taw, 1990). Selain karbon dioksida, oksigen juga diperlukan untuk proses respirasi pada mikroorganisme tidak dapat berfotosintesis jika tidak terdapat cahaya sebagai sumber energi hingga diperlukan juga udara dari luar sebagai sumber oksigen dalam proses respirasi.
2. pH
Derajat keasaman atau pH digambarkan sebagai keberadaan ion hidrogen. Variasi pH dapat mempengaruhi metabiolisme dan pertumbuhan kultur mikroalga antara lain mengubah keseimbangan karbon anorganik, mengubah ketersediaan nutrien dan mempengaruhi fisiologi sel. Kisaran pH untuk kultur alga biasanya antara 7-9, kisaran optimum untuk alga laut berkisar antara 7,8-8,5. Secara umum kisaran pH yang optimum pada kultur Nannochloropsis sp. antara 7-9. Untuk mencegah perubahan pH media dalam kultur alga, perlu ditambahkan EDTA (Ethyl Diamine Tetra Acetat) ke dalam media, hal ini disebabkan karena EDTA dapat berfungsi sebagai buffer sehingga pH menjadi stabil.
3. Temperatur
Suhu merupakan salah satu faktor penting yang mempengaruhi pertumbuhan fitoplankton. Perubahan suhu berpengaruh terhadap proses kimia, biologi dan fisika, peningkatan suhu dapat menurunkan suatu kelarutan bahan dan dapat menyebabkan peningkatan kecepatan metabolisme dan respirasi fitoplankton diperairan. Secara umum suhu optimal dalam kultur fitoplankton berkisar antara 20-24oC. Suhu dalam kultur diatur sedemikian rupa bergantung pada medium yang digunakan. Suhu di bawah 16oC dapat menyebabkan kecepatan pertumbuhan turun, sedangkan suhu diatas 36oC dapat menyebabkan kematian. Beberapa fitoplankton tidak tahan terhadap suhu yang tinggi. Pengaturan suhu dalam kultur fitoplankton dapat dilakukan dengan mengalirkan air dingin ke botol kultur atau dengan menggunakan alat pengatur suhu udara (Taw, 1990). Temperatur optimum bagi perkembangan Nannochloropsis sp. adalah 23-36oC.
15
Universitas Indonesia
4. Salinitas
Kisaran salinitas yang berubah-ubah dapat mempengaruhi dan menghambat pertumbuhan dari mikroalga. Beberapa mikroalga dapat tumbuh dalam kisaran salinitas yang tinggi tetapi ada juga mikroalga yang dapat tumbuh dalam kisaran salinitas yang rendah. Pengaturan salinitas pada medium yang diperkaya dapat dilakukan dengan pengenceran dengan menggunakan air tawar. Kisaran salinitas yang dimiliki oleh Nannochloropsis sp. antara 32-36 ppt, tetapi salinitas paling optimum untuk pertumbuhan Nannochloropsis sp. adalah 33-35 ppt.
2.5.Fotosintesis Pada Mikroalga 2.5.1. Definisi Fotosintesis
Fotosintesis adalah suatu proses biokimia yang dilakukan tumbuhan, alga, dan beberapa jenis bakteri untuk menghasilkan makanan dengan memanfaatkan energi cahaya. Hampir semua makhluk hidup bergantung dari energi yang dihasilkan dalam fotosintesis. Akibatnya fotosintesis menjadi sangat penting bagi kehidupan dibumi. Fotosintesis juga berjasa menghasilkan sebagian besar oksigen yang terdapat di atmosfer bumi. Organisme yang menghasilkan energi melalui fotosintesis disebut sebagai fototrof.
2.5.2. Proses Fotosintesis
Fotosintesis merupakan proses menggabungkan CO2, H2O menjadi
gula dengan menggunakan energi cahaya dengan menggunakan organel yang disebut kloroplas (Gambar 2.4.). Proses fotosintesis dibagi menjadi dua reaksi yaitu :
Gambar 2.4. Proses Umum Fotosintesis: Kerjasama Reaksi Terang Dan Gelap (Sumber: Campbell et al. 1999)
Reaksi Terang
Reaksi terang berlangsung pada sistem membran kompleks/grana yang tersusun dari protein kompleks, elektron carrier dan molekul lemak. Reaksi terang mengkonversi energi menjadi berbagai produk. Pada langkah pertama adalah konversi foton menjadi bentuk elektron tereksitasi pada molekul antenna pigmen yang terdapat pada sistem antenna. Baik molekul donor maupun molekul akseptor akan melekat pada protein kompleks pusat reaksi.
Gambar 2.5. Proses Reaksi Terang (Sumber: Campbell et al. 1999)
17
Universitas Indonesia Secara umum, terdapat tiga reaksi utama yang terjadi pada reaksi terang yaitu : 1. Oksidasi H2O, menurut persamaan :
(2.1)
2. Reduksi NADP+, menurut persamaan :
(2.2)
3. Sintesis ATP, menurut persamaan :
(2.3)
Jika tiga persamaan diatas digabungkan maka akan didapat persamaan untuk reaksi terang :
(2.4) Pada keadaan terang, fotosistem II mengumpan elektron ke fotosistem I. Elektron ini akan ditransfer dari fotosistem II ke fotosistem I oleh intermediate carrier. Reaksi tersebut adalah transfer elektron dari molekul air ke NADP+, menghasilkan bentuk yang tereduksi yaitu NADPH.
Efek dari reaksi terang adalah konversi energi radian menjadi energi bebas redoks dalam bentuk NADPH dan transfer energi grup fosfat dalam bentuk ATP. Pada reaksi terang, transfer elektron tunggal dari air menjadi NADP+ melibatkan sekitar 30 ion logam dan 7 grup aromatik. Ion logam termasuk 20 ion Fe, 5 ion Mg, 4 ion Mn dan 1 ion Cu. Aromatik termasuk quinine, pheophytin, NADPH, tyrosine dan flavoprotein.
NADPH dan ATP yang terbentuk pada reaksi terang menyediakan energi untuk reaksi gelap fotosintesis, yang dikenal sebagai siklus Calvin atau siklus fotosintetik reduksi karbon.
Reaksi Gelap
Siklus Calvin merupakan suatu siklus dalam proses fotosintesis yang termasuk dalam reaksi gelap. Mikroalga mengambil CO2 dari lingkungan dan
mereduksinya menjadi karbohidrat melalui siklus Calvin. Proses ini merupakan serangkaian reaksi biokimia yang mereduksi karbon dan menyusun ulang ikatan menghasilkan karbohidrat dari molekul CO2. Untuk fiksasi karbon (fiksasi gas
CO2 yang bebas berdifusi menjadi bentuk yang non-volatil berupa reduced sugar)
dibutuhkan ATP (energi) dan NADPH (reducing power). ATP dan NADPH yang
dihasilkan dalam proses fotosintesis memicu berbagai proses biokimia. Pada tumbuhan proses biokimia yang terpicu adalah siklus calvin yang mengikat karbon dioksida untuk membentuk ribulosa (dan kemudian menjadi gula seperti glukosa). Reaksi ini disebut reaksi gelap karena tidak bergantung pada ada tidaknya cahaya sehingga dapat terjadi meskipun dalam keadaan ada cahaya. Berikut adalah skema yang menunjukan siklus Calvin.
Gambar 2.6. Siklus calvin (Sumber: Campbell et al. 1999)
2.6.Teknik Filtrasi
Filtrasi merupakan suatu metode pemanenan, dimana medium dan mikroalga dialirkan melalui filter yang kemudian mikroalga akan tersaring/terfilter, sedangkan medium akan tetap mengalir melewati filter. Alga yang tersaring dalam filter akan menghasilkan pasta alga (Danquah, 2009). Filter yang telah terisi mikroalga inilah yang kemudian dipisahkan untuk diambil biomassanya. Filter dapat dibuat dari bahan sponge, kanvas, nilon, dakron, logam atau
19
Universitas Indonesia Ada dua bentuk dasar filtrasi yang digunakan, yaitu filtrasi permukaan dan filtrasi kedalaman. Filtrasi permukaan (surface filtration) menghasilkan cake pada permukaan media filter, sedangkan pada filtrasi kedalaman (deep bed filtration) mikroalga yang tersaring berada di dalam media filter. Berdasarkan alirannya, filtrasi dapat dibagi menjadi dua macam, yaitu filtrasi kontinyu dan filtrasi semi-kontinyu. Filtrasi kontinyu berlangsung secara terus menerus dimana filter digunakan terus menerus, dan ketika telah penuh oleh padatan filter diambil dan langsung diganti dengan filter yang berbeda, sedangkan filtrasi semi-kontinyu berlangsung dalam beberapa saat. Berdasarkan jenisnya, filtrasi dapat dibedakan menjadi beberapa macam, yaitu dead end filtration, mikrofiltrasi, ultrafiltrasi, filtrasi bertekanan, filtrasi vakum, and tangential flow filtration (TFF) (Harun, 2009). Filtrasi konvensional hanya mampu menangkap mikroalga dengan ukuran >70 μm (Brennan, 2009), sedangkan untuk mikroalga yang berukuran <30 μm harus digunakan filtrasi membran atau ultrafiltrasi (Petrusevski, 1995).
Teknik filtrasi ini juga dapat dikembangkan dengan sistem filtrasi untuk meningkatkan produksi biomassa Nannochloropsis sp. dengan pengaturan laju hisap filter. Pada pengaturan ini, filter yang digunakan dapat menggunakan filter busa atau mikrofilter untuk selanjutnya akan dilakukan proses kultivasi
Nannochloropsis sp. pada nilai densitas sel tertentu untuk berbagai laju hisap filter. Pengaturan ini diharapkan dapat mengendalikan densitas sel dalam kultur sehingga penerimaan cahaya oleh sel dapat secara merata diterima.
Penelitian sebelumnya, produksi biomassa Chlorella vulgaris mampu ditingkatkan sebesar 1,25 kali dengan perlakuan filtrasi kontinyu pada kultivasi. Sedangkan dengan menggunakan pengaturan laju hisap filter pada teknik filtrasi kontinyu, produksi biomassa dapat ditingkatkan menjadi 1,43 kali lebih besar dari perlakuan tanpa filtrasi (Dianursanti, 2012). Hal ini terbukti bahwa perlakuan filtrasi dengan mengatur laju hisap filter pada kultivasi berhasil mengatur densitas sel sedemikian rupa sehingga intensitas cahaya yang diberikan dapat tetap mencukupi kebutuhan sel selama proses kultivasi. Dalam hal ini, dapat pula dikatakan bahwa perlakuan filtrasi ini terbukti dapat meminimalkan efek self-shading.
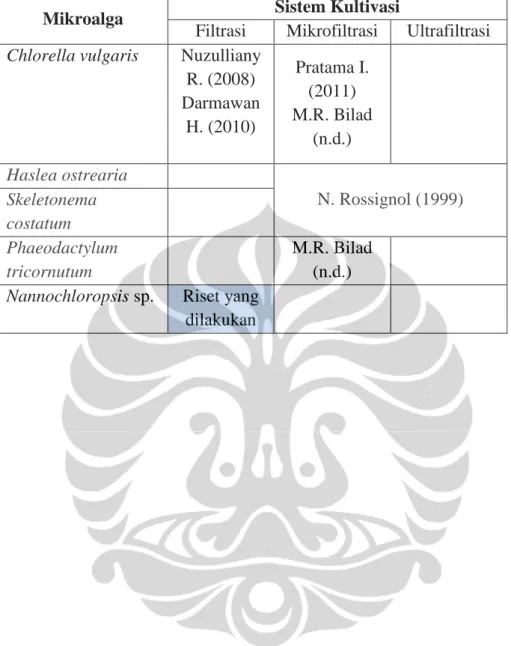
Tabel 2.2. Jejak Rekam Penelitian Budidaya Alga dalam Sistem Filtrasi
Mikroalga Sistem Kultivasi
Filtrasi Mikrofiltrasi Ultrafiltrasi
Chlorella vulgaris Nuzulliany R. (2008) Darmawan H. (2010) Pratama I. (2011) M.R. Bilad (n.d.) Haslea ostrearia N. Rossignol (1999) Skeletonema costatum Phaeodactylum tricornutum M.R. Bilad (n.d.)
Nannochloropsis sp. Riset yang dilakukan
21
Universitas Indonesia BAB 3
METODE PENELITIAN
3.1.Diagram Alir Penelitian
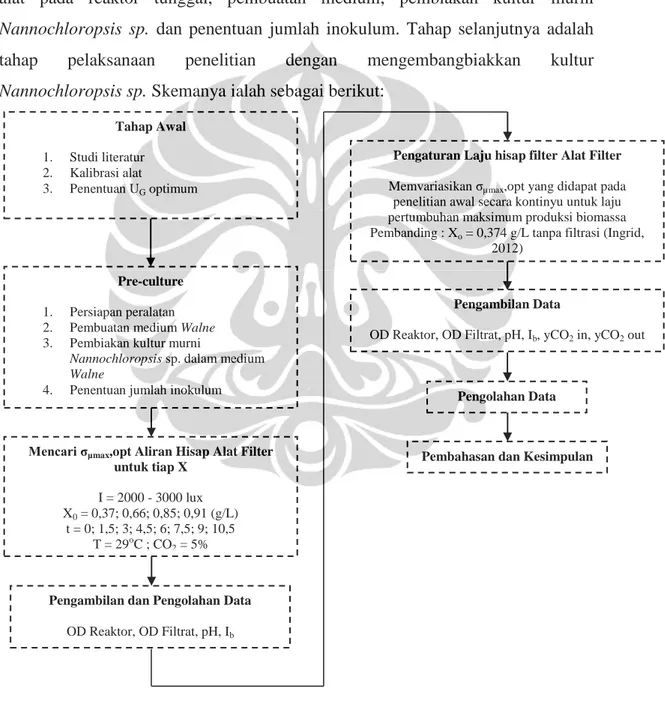
Penelitian ini diawali dengan tahap persiapan yang terdiri dari perangkaian alat pada reaktor tunggal, pembuatan medium, pembiakan kultur murni
Nannochloropsis sp. dan penentuan jumlah inokulum. Tahap selanjutnya adalah tahap pelaksanaan penelitian dengan mengembangbiakkan kultur
Nannochloropsis sp. Skemanya ialah sebagai berikut:
Gambar 3.1. Diagram Alir Penelitian Mencari σµmax,opt Aliran Hisap Alat Filter
untuk tiap X I = 2000 - 3000 lux X0 = 0,37; 0,66; 0,85; 0,91 (g/L) t = 0; 1,5; 3; 4,5; 6; 7,5; 9; 10,5 T = 29oC ; CO 2 = 5% Tahap Awal 1. Studi literatur 2. Kalibrasi alat 3. Penentuan UG optimum Pre-culture 1. Persiapan peralatan 2. Pembuatan medium Walne
3. Pembiakan kultur murni
Nannochloropsis sp. dalam medium
Walne
4. Penentuan jumlah inokulum
Pengambilan dan Pengolahan Data OD Reaktor, OD Filtrat, pH, Ib
Pengambilan Data
OD Reaktor, OD Filtrat, pH, Ib, yCO2 in, yCO2 out
Pengolahan Data
Pembahasan dan Kesimpulan Pengaturan Laju hisap filter Alat Filter Memvariasikan σµmax,opt yang didapat pada
penelitian awal secara kontinyu untuk laju pertumbuhan maksimum produksi biomassa Pembanding : Xo = 0,374 g/L tanpa filtrasi (Ingrid,
2012)
3.2.Alat dan Bahan Penelitian
Peralatan-peralatan yang akan digunakan pada penelitian ini, antara lain: 1. Fotobioreaktor flat transparan berbentuk akuarium dengan volume total 18 L
yang dilengkapi dengan aliran input dan output gas CO2 dan udara.
2. Air Flow dengan kapasitas 140 L/m merek Resun LP-100. 3. Tabung gas CO2 yang dilengkapi dengan regulator.
4. Flowmeter udara dan flowmeter CO2.
5. Sponge berfungsi sebagai filter.
6. Breeding Sponge Filter sebagai tempat memasangkan sponge/filter.
7. Lampu Philips hallogen 20W/12V/50Hz dan transformator 220V primer/12V sekunder dengan intensitas maksimum sebagai sumber iluminasi.
8. T-Septum yang terbuat dari bahan gelas sebagai titik indikator konsentrasi CO2 yang masuk ke dalam fotobioreaktor.
9. Peralatan glassware yang terdiri darierlenmeyer 100 cm3 sebagai discharge
gas CO2 dan udara output fotobioreaktor, pipet ukur 5 cm3, pipet pasteur,
gelas ukur 10 cm3, 100 cm3 botol sampel sel, dan beaker glass 20 cm3 dan 100 cm3.
10. Selang silikon dan selang plastik sebagai rangkaian peralatan dan konektor rangkaian.
11. Syringe 1001 RT Hamilton 1 cm3 (inlet-outlet) untuk mengambil sampel
input dan output CO2.
12. pH meter HANNA Model HI 8014 dengan larutan buffer 4 dan 7. 13. Set Lightmeter Lxtron LX-103 sebagai penghitung kekuatan intensitas
cahaya, dengan satuan Lux.
14. Spectro UV-VIS RS Spectrometer, LaboMed. Inc untuk menghitung OD/absorbansi.
15. Unit Gas Chromatography TCD Shimadzu GC-8A untuk mengukur konsnetrasi gas CO2input dan output fotobioreaktor, Recorder C-R6A
Chromatograph untuk mendapatkan printout dari hasil GC, serta tabung gas (carrier gas) Argon.
23
Universitas Indonesia 1. Starter mikroalga hijau Nannochloropsis sp.
2. Bahan-bahan untuk jenis-jenis medium tertera pada Tabel 3.1. 3. Gas CO2 sebagai bahan untuk fotosintesis mikroalga
4. Air laut (seawater) untuk membuat medium Walne
5. Alkohol 70% untuk sterilisasi peralatan
3.3.Variabel dalam Penelitian
Variabel-variabel yang digunakan dalam penelitian ini adalah:
3.3.1. Variabel Bebas
Variabel ini merupakan variabel yang diset pada harga tertentu. Variabel bebas yang ditentukan dalam penelitian ini adalah waktu pengambilan data (t), berat kering sel awal (Xo) dan variasi kecepatan hisapnya. Selain itu, terdapat pula
variabel semi bebas yaitu variabel yang besarnya kita tentukan sendiri namun pada penentuannya tergantung pada besar variabel lainnya. Variabel semi bebas pada penelitian ini adalah intensitas cahaya (I) yang diberikan pada
Nannochloropsis sp. Intensitas yang digunakan adalah intensitas optimum yang diperoleh dari penelitian Ingrid C. E. Inthe (2012).
3.3.2. Variabel Terikat
Variabel ini merupakan variabel yang diukur nilainya setelah diberikan harga tertentu pada variabel bebas. Variabel terikat pada penelitian ini adalah kerapatan biomassa Nannochloropsis sp., jumlah kerapatan sel (OD) reaktor dan filtrat, Ib, konsentrasi CO2 (in, out), dan pH.
3.3.3. Variabel Tetap
Variabel tetap dalam penelitian ini adalah kecepatan superfisial CO2, dan
intensitas cahaya yang digunakan.
3.4.Prosedur Penelitian 3.4.1. Skema Peralatan
Fotobioreaktor yang digunakan pada penelitian adalah fotobioreaktor dengan volume 18 L. Sistem reaktor yang digunakan adalah sistem batch, dimana
pada waktu tertentu, sebagian sel Nannochloropsis sp. yang terserap dalam filter diambil setiap 12 jam sekali dan dengan begitu volume dalam fotobioreaktor akan semakin berkurang. Gambar di bawah ini adalah sketsa fotobioreaktor yang akan digunakan.
Gambar 3.2. Skema peralatan
3.4.2. Sterilisasi Peralatan
Sterilisasi bertujuan untuk menghilangkan kontaminan yang berada di peralatan yang akan digunakan, sehingga pertumbuhan Nannochloropsis sp. tidak terhambat. Adapun langkah-langkah untuk sterilisasi alat adalah sebagai berikut:
1. Pencucian peralatan
CO
2Y
Keterangan:
1. Fotobioreaktor (PBR) 2. Breeding Sponge Filter
(a/b)
3. Pompa Udara
4. Flowmeter Udara (a/b) 5. Flowmeter CO2
6. Tabung Gas CO2
7. Sparger Biasa 8. Cabang
9. Sponge/Busa (Filter)
1 8 4a 3 4b 5 6 2a 7 2b 9
25
Universitas Indonesia Peralatan yang akan digunakan dicuci terlebih dahulu dengan air sabun kemudian dibilas dengan air sampai tidak terdapat sabun yang menempel. 2. Pengeringan
Setelah peralatan dicuci dan dibilas sampai bersih, kemudian dikeringkan dengan menggunakan tisu atau kompressor udara. Selanjutnya peralatan yang sudah kering tersebut ditutup dengan alumunium foil, untuk mencegah masuknya kontaminan.
3. Sterilisasi
Peralatan dari kaca disterilisasi dalam oven dengan suhu 100oC selama 1 jam. 4. Penyimpanan
Peralatan kaca/logam dan plastik yang telah disterilisasi disimpan dalam lemari penyimpanan kedap udara yang dilengkapi dengan lampu UV.
3.4.3. Pembuatan Medium Walne
Dalam penelitian ini medium yang digunakan sebagai kultur media pertumbuhan Nannochloropsis sp. adalah medium Walne. Medium ini dipilih karena cukup baik untuk media hidup Nannochloropsis sp. Untuk keperluan pembuatan medium sintetik yang dalam penelitian ini menggunakan Walne, maka diperlukan senyawa-senyawa kimia yang merupakan komposisi medium. Komposisi tersebut dapat dilihat pada tabel berikut ini:
Tabel 3.1. Komposisi Walne
(Sumber: Culture Collection of Algae and Protozoa)
3.4.4. Pembiakan Kultur Murni
Kultur murni yang didapat dibiakkan lagi sebelum dapat digunakan dalam penelitian, selain untuk memperbanyak persediaan Nannochloropsis sp., juga diharapkan Nannochloropsis sp. beradaptasi dalam medium baru sebelum digunakan. Cara pembiakan mikroalga Nannochloropsis sp.:
1. Persiapan medium dan peralatan pembiakan (wadah, selang udara, tutup wadah) dan disterilkan terlebih dahulu.
2. Stock murni Nannochloropsis sp. kemudian dimasukkan ke dalam wadah steril dan dicampur dengan medium Walne yang sudah steril.
3. Kultur tersebut kemudian di-bubbling dengan menggunakan kompresor udara dan CO2. Pada tahap ini juga harus diberikan cahaya, namun intensitas cahaya
diatur cukup kecil kurang lebih 1000 satu kali.
4. Pembiakan dapat dilakukan selama satu minggu atau lebih bila bertujuan untuk memperbanyak persediaan yang ada, tetapi untuk mencapai lag time
hanya diperlukan 2-3 hari.
Stok Senyawa Larutan Stok
(1) Trace metal solution (TMS) – per 100 ml ZnCl2 2,1 g
CoCl2.6H2O 2,0 g
(NH4)6Mo7O24.4H2O 0,9 g
CuSO4.5H2O 2,0 g
(2) Vitamin solution per 100 ml Cyanocobalamin 10,0 mg
Thiamine 10,0 mg
Biotin 200,0 µg
(3) Nutrient solution per litre FeCl3.6H2O 1,3 g
MnCl2.4H2O 0,36 g
H3BO3 33,6 g
EDTA (disodium salt) 45,0 g NaH2PO4.2H2O 20,0 g
NaNO3 100,0 g
TMS Stock (1) 1,0 ml
Medium per litre
Vitamin solution (2) 0,1 ml Nutrient solution (3) 1,0 ml Sterilised seawater 1,0 L
27
Universitas Indonesia 3.4.5. Penentuan Jumlah Inokulum Nannochloropsis sp.
Penentuan jumlah inokulum penting dalam penelitian ini, karena berkaitan langsung dengan jumlah sel Nannochloropsis sp. yang terdapat dalam kultur. Jumlah inokulum perlu diketahui agar dapat dilihat perubahan jumlahnya dan hal ini berkaitan dengan besar intensitas cahaya yang dibutuhkan. Langkah-langkah perhitungan :
1. Kultur yang akan dihitung jumlah inokulumnya, diaduk sampai semua endapan Nannochloropsis sp. merata dalam medium.
2. Sampel inokulum diambil secukupnya jika menggunakan mikroskop atau diambil sebanyak 5 mL jika menggunakan spektrofotometer.
3. Perhitungan sel dapat dilakukan dengan menggunakan mikroskop maupun spektrofotometer, dengan catatan untuk perhitungan menggunakan spektrofotometer telah dibuat kurva kalibrasi OD vs Nsel
a) Menggunakan Mikroskop
Sampel diteteskan pada Neubauer Improved secukupnya (±2 tetes pada ruang atas/bawah). Sampel ini kemudian ditutup dengan kaca preparat.
Sampel dihitung dengan menggunakan mikroskop (perbesaran 100x, diusahakan seluruh bagian bilik hitung terlihat dengan jelas). Alat pencacah yang digunakan untuk perhitungan adalah counter manual. Jumlah inokulum untuk setiap bilik dan ruangan dihitung rata-ratanya,
kemudian dihitung dengan rumus
...(3.1)
Bila menggunakan pengenceran maka nilai N dikali faktor pengenceran, misal penegenceran 4x, maka
...(3.2) b) Menggunakan Spektrofotometer
Spektrofotometer diatur pada panjang gelombang 540 nm. Untuk melihat nilai OD pada penelitian ini digunakan spectrofotometer single beam, dan cahaya tampak (VIS) sebagai sumber cahaya yang akan diabsorbsi oleh Nannochloropsis sp.
sel/ml
jumlah selrata-rata10.000N
sel/ml
jumlah selrata-rata10.0004N
Spektrofotometer dikalibrasi dengan kuvet berisi medium pada panjang gelombang yang sama, kemudian diatur agar absorbansinya menunjukkan angka 0,000 (nol).
Sampel dimasukan ke dalam kuvet, kemudian diuji dalam spektrofotometer. Data yang diambil adalah nilai absorbansi pada rentang 0 – 0,2, jika melebihi dari rentang tersebut maka sampel harus diencerkan sampai nilai absorbansinya mencapai rentang tersebut. Nilai OD 0 - 0,2 berada pada nilai T (Transmission) 15 - 65. Kemudian jumlah selnya dapat diketahui dari kurva kalibrasi OD vs Xsel. Jika dilakukan pengenceran maka jumlah selnya dikalikan jumlah
pengenceran yang dilakukan.
3.4.6. Pembuatan Kurva Kalibrasi
Pembuatan kurva kalibrasi ini bertujuan untuk memudahkan perhitungan sampel yang memiliki jumlah sel yang banyak dengan hanya mengatur absorbansinya (OD) menggunakan spektrofotometer cahaya tampak.
Kurva kalibrasi yang dibuat adalah kurva OD vs Xsel. Pembuatan kurva
diawali dengan membuat beberapa sampel dengan nilai OD yang berbeda-beda. Satu nilai OD dibuat secara triplo sehingga pengukuran menjadi lebih akurat. Sampel yang telah disiapkan kemudian di hitung berat kering sel Nannochloropsis
sp. menggunakan mikroskop. Setiap sampel dihitung tiga kali sehingga diperoleh hasil yang lebih akurat.
Setelah diperoleh berat kering sel dari masing-masing sampel kemudian di buat kurva antara OD vs Xsel yang selanjutnya digunakan sebagai dasar dalam
perhitungan nilai berat kering sel (Xsel) dari hasil kultivasi. Kurva OD vs Xsel yang
diperoleh dapat dilihat pada gambar berikut.
3.4.7. Pelaksanaan Penelitian
Kondisi operasi pada penelitian ini yaitu: udara yang mengandung 5 % CO2 dan dengan suhu ruang 29 oC. Selain itu, kecepatan superfisial gas UG yang
disesuaikan berdasarkan hasil uji hidrodinamik, penyesuaian intensitas cahaya yang digunakan untuk kultivasi Nannochloropsis sp. dan diperoleh dari
29
Universitas Indonesia eksperimen Ingrid C. E. Inthe (2012), serta variasi laju hisap filter system. Pada eksperimen dengan perlakuan filtrasi aliran sirkulasi kultur media yang ditujukan untuk mengurangi self-shading dengan memerangkap sebagian sel dalam filter, perlu dilakukan observasi pengaruh daripada laju hisap filter terhadap peningkatan produk biomassa dan laju pertumbuhannya dengan mencari laju hisap filter optimum pada tiap jumlah X0 dari 0,37 – 0,91 g/L.
Pertama-tama selalu dilakukan tindakan aseptic dengan menggunakan alkohol 70 % untuk menghindari adanya kontaminan yang dapat berpengaruh pada pertumbuhan mikroalga. Penelitian utama yang dilakukan adalah pemberian perlakuan pengaturan laju hisap filter dengan berbagai variasi kecepatan untuk X0
= 0,37; 0,66; 0,85 dan 0,91 (g/L) dalam fotobioreaktor kolom gelembung berukuran 18 L untuk mencari kecapatn hisap paling maksimum dari tiap jumlah inokulum. Kemudian dilakukan pengaturan laju hisap pada kecepatan hisap optimum dengan X0 = 0,37 g/L dan menggunakan pencahayaan kontinyu
kemudian sebagai pembanding dilakukan sistem reaktor tanpa filtrasi dengan kerapatan dan pencahayaan yang sama untuk melihat pengaruh dari pengaturan laju hisap filter alat filter (Heru D, 2010).
Parameter penentuan laju hisap paling optimum dari suatu X ini adalah pertumbuhan maksimum sel. Untuk menentukan laju pertumbuhan maksimum dilakukan running dalam rentang 10,5 jam. Dengan pertimbangan bahwa pada rentang waktu tersebut sudah dapat menggambarkan profil laju pertumbuhan
Nannochloropsis sp.
3.4.8. Pengambilan Data
Data yang diambil adalah OD reaktor dan filter, pH, Ib, yCO2in, dan yCO2out.
Proses pengambilan data yang dilakukan adalah sebagai berikut.
1. Sampel diambil dari kultur media sekitar 5 – 10 ml pada 3 botol yang berbeda dari reaktor untuk diukur absorbansinya bersamaan dengan mengambil nilai pH-nya. Kemudian dirata-ratakan nilainya. Dari nilai rata-rata absorbansi yang didapat tersebut dapat dilihat nilai Xsel nya pada kurva kalibrasi OD vs
Xsel. Data nilai pH dilakukan untuk melihat aktivitas sel mikroalga dari
konsentrasi [HCO3-].
2. Pengambilan data Ib dilakukan dengan menggunakan luxmeter yang
diletakkan di belakang fotobioreaktor.
3. Bersamaan dengan perlakuan di atas, biomassa yang terperangkap dalam filter juga di ambil dengan cara memindahkannya dari media kultur ke dalam wadah berisi medium Walne melalui proses pemerasan sebelum diukur OD dalam kultur media tersebut.
4. Langkah-langkah pengambilan data diulangi setiap interval waktu yang telah ditetapkan (untuk sampel dari media kultur selama 1,5 jam sekali dan filtrat selama 1,5 jam sekali).
5. Pengambilan data lipid dilakukan dengan metode Soxhlet dengan prosedur berikut:
Sampel yang sudah dihaluskan, ditimbang 5-10 gram dan kemudian dibungkus atau ditempatkan dalam “Thimble” (selongsong tempat sampel), di atas sample ditutup dengan kapas.
Pelarut yang digunakan adalah n-heksana dengan titik didih 69°C. Selanjutnya labu kosong diisi butir batu didih. Fungsi batu didih ialah untuk meratakan panas.
Setelah dikeringkan dan didinginkan, labu diisi dengan n-heksana sebanyak 175 ml. Pelarut yang baik dalam ektraksi soxhlet adalah pelarut yang mempunyai titik didih rendah seperti n-heksana yang mempunyai titik didih 69oC agar cepat menguap sehingga tidak menyebabkan kerusakan pada alat dan juga tidak membutuhkan watu yang lama untuk melakukan satu sirkulasi ektraksi.
Soxhlet disambungkan dengan labu dan ditempatkan pada alat pemanas listrik serta kondensor . Alat pendingin disambungkan dengan soxhlet. Air untuk pendingin dijalankan dan alat ekstraksi lemak mulai dipanaskan . Ketika pelarut dididihkan, uapnya naik melewati soxhlet menuju ke pipa
pendingin. Air dingin yang dialirkan melewati bagian luar kondensor mengembunkan uap pelarut sehingga kembali ke fase cair, kemudian menetes ke thimble. Pelarut melarutkan lemak dalam thimble, larutan sari ini terkumpul dalam thimble dan bila volumenya telah mencukupi, sari akan dialirkan lewat sifon menuju labu. Proses dari pengembunan hingga
31
Universitas Indonesia pengaliran disebut sebagai refluks. Proses ekstraksi lemak kasar dilakukan selama 6 jam.
Setelah proses ekstraksi selesai, pelarut dan lemak dipisahkan melalui proses penyulingan dan dikeringkan.
6. Pengambilan data klorofil dan beta karoten
Sampel dicampurkan aseton dengan perbandingan 1:1 dalam tabung 10 ml.
Kemudian ditambahkan glass bead.
Sonikasi dalam sonikator selama ± 45 menit. Di-sentrifuge ± 30 menit
Untuk klorofil, ukur absorbansi sampel pada panjang gelombang 645 nm & 663 nm (dengan larutan standarnya adalah aseton).
Untuk beta karoten, absorbansi yang digunakan adalah pada panjang gelombang 450 nm.
7. Pengambilan data protein menggunakan prosedur Lowry (1951) sebagai berikut.
Larutan protein standar (BSA 200 μg/mL) dan dH2O dicampurkan dalam
jumlah tertentu (Tabel 3.2) dalam tabung reaksi sehingga diperoleh berbagai konsentrasi antara 20-200 mg dalam larutan standar 1 mL. Pada tabung lain dicampurkan juga sampel protein dan dH2O sehingga
volume total larutan sampel 2,0 mL.
Kemudian larutan Biuret 5 mL ditambahkan ke dalam masing-masing tabung yang berisi larutan protein (standar dan sampel) dan segera divortex. Campuran reaksi diinkubasi pada suhu kamar tepat 10 menit. Untuk menghitung waktu reaksi digunakan stopwatch, dan waktu dihitung saat menambahkan larutan Biuret. Agar waktu reaksinya seragam untuk tiap sampel, ketika menambahkan larutan Biuret pada tabung berikutnya diberikan selang waktu tertentu.
Kemudian pada menit ke-10 sebanyak 0,5 mL reagen Folin ditambahkan ke dalam campuran reaksi dan segera dikocok menggunakan vortex. Larutan diinkubasi pada suhu kamar selama 30 menit setelah penambahan reagen Folin.
Serapan masing-masing larutan diukur tepat pada menit ke-30 yang ditetapkan pada panjang gelombang 750 nm.
Tabel 3.2. Penentuan kadar protein dengan metode Lowry
Blanko Larutan standar Sampel protein
No. Tabung 1 2 3 4 5 6 7 8 Standar BSA (mL) - 0,8 1,2 1,5 1,8 - - - Sampel protein (μL) - - - 5 50 200 Aquades (mL) 2 1,2 0,8 0,5 0,2 1,995 1,95 1,8 Larutan Biuret (mL) 5 Reagen Folin (mL) 0,5 3.5.Pengolahan Data
Data X (Berat Kering Sel) yang diperoleh dari pengukuran nilai absorbansi digunakan untuk melihat tingkat pertumbuhan Nannochloropsis sp. selama pembiakan. Persamaan yang digunakan untuk menghitung laju pertumbuhan spesifik adalah Persamaan Monod sebagai berikut
dt dX X 1 ...(3.3)
μ = laju pertumbuhan spesifik (jam-1) X = berat kering sel (g/L)
t = waktu (jam)
Data pH yang diambil digunakan untuk mengetahui tingkat metabolisme
Nannochloropsis sp. yang ditunjukkan dengan meningkatnya produksi [HCO3-]
dalam fotobioreaktor. Produksi [HCO3-] diiringi pelepasan [H+], sehingga
persamaan yang digunakan adalah persamaan Handerson-Haselbach, yaitu
2
3 2 CO H HCO KCO ...(3.4)
1 2 3 2 H CO K HCO CO ...(3.5)
pH CO CO K HCO3 210 2 ...(3.6)Untuk menentukan nilai Ka dan konsentrasi CO2 digunakan pendekatan Hukum
Henry,
T CO CO CO P y CO H P 2 2 2 2 ...(3.7)33 Universitas Indonesia 1 ln 1 ln 2 2 2 , T To C T To B T To A H H H H H O CO CO ...(3.8) 1 ln 1 ln 2 2 2 , T To C T To B T To A H H K K K O CO CO ...(3.9)
Selanjutnya, konsentrasi HCO3- dapat ditentukan dengan menggunakan
persamaan:
1 ln 1 exp 1 ln 1 exp 10 2 2 2 3 T To C T To B T To A T To C T To B T To A P y H K HCO H H H K K K pH T CO CO CO ...(3.10) Keterangan:PT = Tekanan Operasi (atm)
yCO2 = fraksi gas CO2
KCO2 = 4,38 x 10-7 HCO2 = 2900 KPa/mol T = Temperatur operasi T0 = Temperatur standar Ak = 40.557 Bk = -36.782 Ck = 0 Ah = 22.771 Bh = -11.452 Ch = - 3.117
Data persentase CO2 yang diambil, akan diolah untuk mengetahui jumlah gas
CO2 yang dipindahkan ke dalam satuan volume medium yang dibutuhkan untuk
metabolisme sel dalam satuan waktu, atau disebut CTR (Carbon Transfer Rate). Persamaan untuk perhitungannya adalah sebagai berikut
2 2 CO CO y CTR ...(3.11) dimana T R V P M A U medium CO G CO 2 2 ...(3.12) Dengan
UG = kecepatan superfisial gas yang diumpankan (L/jam)
A = luas permukaan reaktor yang menghadap ke sumber cahaya (m2)
MCO2 = massa molekul relatif CO2 (g/mol)
P = tekanan operasi (atm) Vmedium = volume medium (L)
R = konstanta Rydberg (0,08205 L.atm/mol.K) T = suhu operasi (K)
Selain itu, data persentase CO2 juga digunakan untuk menghitung laju gas
CO2 yang dipindahkan karena adanya aktivitas kehidupan biologi dalam satu
satuan waktu (qCO2). Persamaan yang digunakan adalah
X y X CTR q CO CO CO 2 2 2 ...(3.13) Dimana
X = berat kering sel per satuan volume (g/L)
∆yCO2 = selisih konsentrasi CO2 masuk dan keluar reaktor
CTR = (g/L.jam)
Data kandungan-kandungan yang diperoleh akan diolah sebagai berikut: 1. Lipid % 100 % sampel berat kosong botol berat akhir botol berat lipid ...(3.14) 2. Klorofil
mg/L
12,25 A663 2,55 A645 a klorofil ...(3.15)
mg/L
22,9 A645 4,64 A663 b klorofil ...(3.16)
mg/L
7,34 A663 17,76 A645 b a klorofil ...(3.17) 3. Beta karoten
1000 3,27 104
/227 / 450 klorofila klorofilb A L mg karoten beta ...(3.18) 4. ProteinKurva kalibrasi dibuat untuk menghitung kadar protein yang terdapat pada sampel. Kurva yang dibuat berdasarkan data berat sampel BSA terhadap