I. PENDAHULUAN
1.1. Latar Belakang
Ikan nila (Oreochromis niloticus) merupakan salah satu spesies ikan yang mempunyai nilai ekonomis tinggi sehingga banyak dibudidayakan. Konsumsi ikan nila ini mengalami peningkatan yang signifikan dari tahun ke tahun. Data FAO (2009) melaporkan bahwa produksi ikan nila dunia terus mengalami peningkatan, Tahun 2007 sekitar 769.936 ton dan pada tahun 2008 meningkat menjadi 2,3 juta ton, Selanjutnya pada tahun 2010 diperkirakan mencapai 2,5 juta ton (FAO, 2010). Potensi yang besar dan prospek pengembangan yang begitu terbuka, bukan jaminan bahwa budi daya ikan akan berjalan mulus, tanpa permasalahan. Banyak masalah yang dihadapi dalam sektor budi daya ikan tanpa terkecuali dengan budidaya ikan nila (Kordi dan Ghufran, 2004).
Salah satu kendala yang dihadapi dalam budidaya intensif adalah serangan penyakit ikan. Penyakit merupakan salah satu kendala dalam budi daya ikan yang dapat menyebabkan penurunan tingkat produksi ikan. Perkembangan suatu penyakit dalam akuakultur meliputi suatu interaksi yang kompleks antara tingkat virulensi patogen, derajat imunitas inang, kondisi fisiologis dan genetik hewan, stress dan padat tebaran (Irianto, 2004). Gangguan penyakit pada budi daya ikan merupakan risiko biologis yang harus selalu diantisipasi. Hal ini mendorong adanya aplikasi pengelolaan kesehatan yang terintegrasi dan berkesinambungan pada budi daya ikan (Purwaningsih dan Taukhid, 2010).
Serangan penyakit pada ikan dapat timbul sewaktu-waktu, bersifat eksplosif (meluas), penyebarannya cepat dan seringkali menimbulkan kematian
yang cepat pula. Penyakit ikan yang disebabkan oleh parasit, bakteri, jamur, virus, faktor lingkungan dan nutrisi atau makanan (Cahyono, 2000).
Beberapa jenis bakteri yang terdapat di Indonesia namun belum tersebar luas, yaitu Aeromonas salmonicida dan Edwardsiella tarda di Jawa, Mycobacterium sp. di Jawa dan Sumatera serta Streptococcus sp di Sulawesi (Irianto, 2004). Wabah A. salmonicida pernah terjadi pada bulan Oktober 1980, terutama di daerah Jawa Barat. Kerugian yang ditimbulkannya kira-kira mencapai 4 milyar rupiah (Departemen Kelautan dan Perikanan, 2007). Serangan bakteri ini baru terlihat apabila ketahanan tubuh ikan menurun akibat stres yang disebabkan oleh penurunan kualitas air, kekurangan pakan atau penanganan yang kurang tepat. Aeromonas salmonicida dapat dijumpai di lingkungan air tawar maupun air laut. Penularan bakteri Aeromonas dapat berlangsung melalui air, kontak badan, kontak dengan peralatan yang telah tercemar atau karena pemindahan ikan yang terserang Aeromonas dari satu tempat ke tempat lain (Afrianto dan Liviawaty, 1992).
Infeksi bakteri Streptococcus sp. banyak ditemukan pada ikan nila dan menyebabkan penyakit yang disebut Streptococcosis (Chang dan Plumb 1996). Streptococcosis akibat infeksi Streptococcus agalactiae merupakan penyakit pada ikan nila yang biasa dihadapi oleh pembudidaya dan dapat menyebabkan kematian yang tinggi (Baya et al. 1990). Menurut Yuasa et al. (2008) serangan bakteri S. agalactiae ini telah menyebabkan kematian hingga 60% pada budi daya ikan nila di Sumatera Selatan. Penyakit Streptococcosis ini timbul akibat rendahnya ketahanan tubuh ikan dalam menghadapi serangan penyakit bakterial, lingkungan pemeliharaan yang buruk dan manajemen pemberian pakan yang kurang baik sehingga terjadi ketidakseimbangan.
Nilai kerugian ekonomis akibat kasus penyakit yang telah dilaporkan terjadi di Kalimantan Tengah antara lain kejadian serangan penyakit pada pertengahan Februari 2005 di Kabupaten Kasongan yang menimbulkan kerugian ± 15 ton ikan nila yang berukuran rata-rata 0,5 – 1 kg per ekor (DKP Kabupaten Kasongan Kalimantan Tengah, 2005). Pada Maret 2007 pada karamba petani ikan di Kelurahan Pahandut Seberang Kota Palangka Raya terjadi kasus kematian ikan sebesar 50 ekor/hari di Kelurahan Pahandut Seberang. Menurut hasil penelitian wabah penyakit tersebut disebabkan oleh adanya bakteri yang menyerang tubuh ikan yang disebut Aeromonas sp (DKP Kabupaten Kasongan Kalimantan Tengah, 2007).
Menurut Hamza (2010), bakteri terdapat disekitar sistem perairan. Apabila ikan mengalami stress maka bakteri yang terdapat pada perairan tersebut dapat menimbulkan penyakit. Pada umumnya sumber dan cara penularan penyakit akibat serangan bakteri-bakteri antara lain melalui ikan yang sakit, ikan karir, air yang terkontaminasi, makanan yang terkontaminasi, telur yang terkontaminasi, alat atau pakaian yang terkontaminasi atau melalui bulu burung air.
1.2. Perumusan Masalah
Kegiatan budi daya ikan selama ini masih menghadapi masalah-masalah seperti rendahnya produksi akibat penyakit bakteri serta faktor penyebab perbedaan gejala klinis yang muncul dan perjalanan bakteri hingga menyebabkan kematian perlu diamati agar dapat dijadikan acuan dalam upaya pengendalian penyakit bakteri yang belum teridentifikasi. Sehingga identifikasi bakteri pada ikan nila (Oreochromis niloticus), perlu dilakukan dan diharapkan bermanfaat
untuk meningkatkan kesehatan ikan sehingga hasil dalam produksi budi daya meningkat.
1.3. Tujuan dan Manfaat
Penelitian ini bertujuan untuk mengetahui jenis bakteri patogen yang biasa menyerang ikan nila. Manfaat penelitian ini adalah mendapatkan informasi tentang jenis bakteri pada ikan nila, sehingga dapat dilakukan usaha pencegahan ataupun pengobatan terhadap penyakit tersebut.
1.4. Hipotesis
Hipotesis yang diajukan adalah adanya jenis bakteri patogen yang menyerang ikan nila.
II. TINJAUAN PUSTAKA
2. 1. Biologi dan Ekologi Ikan Nila (Oreochromis niloticus)
Ikan nila (Oreochromis niloticus) merupakan ikan air tawar yang termasuk ke dalam famili Cichlidae dan merupakan ikan asal Afrika (Boyd, 2004). Ikan ini merupakan jenis ikan yang diintroduksi dari luar negeri, ikan tersebut berasal dari
Afrika bagian Timur di Sungai Nil, Danau Tangayika, Chad, Nigeria dan Kenya lalu dibawa ke Eropa, Amerika, negara-negara Timur Tengah dan Asia. Di Indonesia benih ikan nila secara resmi pertama kali didatangkan dari Taiwan oleh Balai Penelitian Perikanan Air Tawar tahun 1969. Fillum : chordata, Sub Fillum : vertebrata, Kelas : detoichtyas, Sub Kelas : achanthoptarigi, Ordo : parcomorphi, Sub Ordo: parchokka, Family : cichlidan, Genus : oreochromis Spesies : Oroechromis niloticus, (Ditetapkan Dirjen Perikanan 1972).
Menurut Pratama (2009), ikan nila mempunyai nilai bentuk tubuh yang pipih kearah vertical (kompres) dengan profil empat persegi panjang kearah posterior, posisi mulut terletak di ujung/termal. Pada rahang terdapat bercak kehitaman. Sisik ikan nila adalah tipe scenoid. Ikan nila juga ditandai dengan jari-jari dorsal yang keras, begitupun bagian awalnya. Dengan posisi siap awal dibagian belakang sirip dada (abdormal). Pada sirip ekor tampak jelas garis-garis yang vertical dan pada sirip punggungnya garis terlihat condong lekuknya. Ciri ikan nil6a adalah garis-garis vertikal berwarna hitam pada sirip, ekor, punggung dan dubur. Pada bagian sirip caudal/ ekor yang berbentuk membulat warna merah dan biasa digunakan sebagai indikasi kematangan gonad.
Ikan ini merupakan spesies ikan yang berukuran besar antara 200-400 gram, memiliki sifat omnivora sehingga bisa mengkonsumsi makanan berupa hewan dan tumbuhan (Khairuman dan Amri, 2003), Nila dapat tumbuh dan berkembang dengan baik pada lingkungan perairan dengan kadar Dissolved Oxygen (DO) antara 2,0-2,5 mg/L. Secara umum nilai pH air pada budidaya ikan nila antara 5 sampai 10 tetapi nilai pH optimum adalah berkisar 6-9. Ikan nila umumnya hidup di perairan tawar, seperti sungai, danau, waduk, rawa, sawah dan
saluran irigasi, memiliki toleransi yang luas terhadap salinitas sehingga ikan nila dapat hidup dan berkembang biak pada perairan payau dengan salinitas antara 0-25 permil. (Setyo, 2006). Suhu optimal bagi pertumbuhan ikan nila berkisar antara 22-29 °C (Mjoun et al, 2010).
2.2 Bakteri Patogen Penyebab Penyakit
Bakteri adalah mikroorganisme dengan struktur intraseluler yang sederhana. Sel bakteri terdiri dari dinding sel yang dikelilingi oleh membran sitoplasma yang berisi sitoplasma inti. Patogen adalah mikoba yang menyebabkan penyakit yang dibuktikan dengan Postulat Koch. Organisme yang berperan sebagai patogen dalam timbulnya penyakit adalah bakteri.
Bakteri Aeromonas sp yang dapat menyebabkan penyakit pada ikan nila yaitu Aeromonas salmonicida dan Aeromonas hydrophila. A. Salmonicida merupakan bakteri patogen yang dapat menyebabkan penyakit peradangan pada bagian kulit yang terinfeksi secara akut maupun kronis yang biasa disebut dengan furunculosis (Rantam, 2003).
Salah satu jenis penyakit ikan yang sering dijumpai adalah penyakit bakterial yang disebabkan oleh bakteri Aeromonas hydrophilla, merupakan bakteri patogen penyebab penyakit “Motil Aeromonas Septicemia” (MAS), terutama untuk spesies ikan air tawar di perairan tropis. Bakteri ini termasuk patogen oportunistik yang hampir selalu ada di air dan siap menimbulkan penyakit apabila ikan dalam kondisi kurang baik. Penyakit yang disebabkan Aeromonas hydrophilla berakibat bercak merah pada ikan dan menimbulkan kerusakan pada kulit, insang dan organ dalam. Penyebaran penyakit bakterial pada
ikan umumnya sangat cepat serta dapat menimbulkan kematian yang sangat tinggi pada ikan-ikan yang diserangnya.
Aeromonas hydrophila merupakan bakteri yang bersifat Gram-negatif, mempunyai morfologi batang pendek dengan ukuran bervariasi antara lebar 0,8 sampai 1,0 mikron dengan panjang 1,0sampai 3,5 mikron, tidak memiliki spora, bakteri bersifat motil karena mempunyai flagelamonotrichous. Morfologi koloni permukaannya agak menonjol, berbentuk bulat, mengkilat, krimdengan tepi koloni entire, diameter 2-3 mm (Austin dan Austin, 1987).
Menurut Afrianti (1992) menyatakan bahwa klasifikasi Aeromonas hydrophila sebagai berikut : Filum Protophyta, Kelas Schizomycetes, Ordo Pseudanonadeles, Family vibrionaceae, Genus Aeromonas, Spesies Aeromonas hydrophila.
Penyakit yang mewabah pada budidaya ikan nila di Jawa Barat dan beberapa pulau di Indonesia pada tahun-tahun belakangan ini adalah penyakit Streptococcosis (Taukhid, 2009). Penyakit tersebut disebabkan oleh bakteri Streptococcus agalactiae, yang menyerang otak, mata, dan ginjal ikan. Infeksi S. Agalactiae menyebabkan meningitis neonatal pada manusia dan mastitis pada sapi (Elliott et al., 1990). Bakteri tersebut juga ditemukan pada hewan mamalia laut dan bersifat patogen bagi hewan mamalia teresterial dan ikan. Bakteri S. agalactiae yang berasal dari lumba-lumba (Tursiops truncatus) diinjeksikan ke ikan nila (Oreochromis niloticus) dapat menyebabkan 90% ikan mati. Wabah S. agalactiae bersifat akut, menyebabkan ikan budidaya mati 100% pada 14 hari pascainfeksi. (Evans et al., 2006)
Streptococcus agalactiae termasuk dalam genus Streptococcus golongan B. Bakteri ini merupakan bakteri Gram positif. Streptococcus agalactiae merupakan sebagian dari flora normal pada vagina dan mulut wanita pada 5-25 %. Bakteri ini secara khas merupakan hemolitik dan membentuk daerah hemolisis yang hanya sedikit lebih besar dari koloni (bergaris tengah 1-2 mm). Streptococcus golongan B menghidrolisis natrium hipurat dan memberi respons positif pada tes CAMP (Christie, Atkins, Munch-Peterson). Menurut Lehmann and Neumann (1896) klasifikasi Streptococcus agalactiae Kingdom Bacteria, Phylum Firmicutes, Class Bacilli, Ordo Lactobacillales, Family Streptococcaceae, Genus Streptococcus, Spesies S. Agalactiae.
2.3 Interaksi Antara Imunitas Inang, Jasad Patogen dan Lingkungan
Di lingkungan alam, ikan dapat diserang berbagai macam penyakit. Demikian juga dalam pembudidayaannya, bahkan penyakit tersebut dapat menyerang ikan dalam jumlah besar dan dapat menyebabkan kematian ikan, sehingga kerugian yang ditimbulkan sangat besar (Kordi dan Ghufran, 2004). Perkembangan suatu penyakit dalam akuakultur meliputi suatu interaksi yang kompleks antara tingkat virulensi patogen, derajat imunitas inang, kondisi fisiologis dan genetik hewan, stres dan padat tebaran (Irianto, 2004). Secara umum faktor-faktor yang terkait dengan timbulnya penyakit merupakan interaksi dari tiga faktor yaitu inang, patogen dan lingkungan atau stressor eksternal yaitu perubahan di lingkungan yang tidak menguntungkan, tingkat higienik yang buruk dan stress (Austin dan Austin, 2007).
Di lingkungan alam, ikan dapat diserang berbagai macam penyakit. Demikian juga dalam pembudidayaannya, bahkan penyakit tersebut dapat
menyerang ikan dalam jumlah besar dan dapat menyebabkan kematian ikan, sehingga kerugian yang ditimbulkan sangat besar (Kordi dan Ghufran, 2004). Perkembangan suatu penyakit dalam akuakultur meliputi suatu interaksi yang kompleks antara tingkat virulensi patogen, derajat imunitas inang, kondisi fisiologis dan genetik hewan, stress dan padat tebaran (Irianto, 2004).
Secara umum faktor-faktor yang terkait dengan timbulnya penyakit merupakan interaksi dari tiga faktor yaitu inang, patogen dan lingkungan atau stressor eksternal yaitu perubahan di lingkungan yang tidak menguntungkan, tingkat higienik yang buruk dan stress (Austin dan Austin, 2007).
Sumber penyakit yang dapat menyebabkan infeksi pada ikan adalah jasad patogen yang dapat dikelompokkan menjadi dua golongan yaitu patogen asli (true pathogen) dan patogen potensial (opportunistic pathogen) (Kordi dan Ghufran, 2004). Patogen asli adalah organisme patogen yang selalu menimbulkan penyakit khas apabila ada kontak dengan ikan sedangkan patogen potensial adalah organisme patogen yang dalam keadaan normal hidup damai dengan ikan, akan tetapi jika kondisi lingkungan menunjang akan menjadi patogen pada ikan (Bennett, 2009). Pada ikan sistem pertahanan itu berupa lendir, sisik, dan kulit (Bruno dan Wood, 1999). Menurut Irianto (2004) sistem imun bawaan antara lain terdiri dari penghalang fisik terhadap infeksi, pertahanan humoral dan sel-sel fagositik. Teleostei memiliki sejumlah penghalang fisik terhadap infeksi antara lain kulit dan mukus.
Salah satu kendala dalam budi daya ikan adalah terserang oleh bakteri Steptococcus sp, ikan yang terserang Steptococcosis menunjukkan gejala sisiknya hilang, gerakan renang tidak menentu ( Clark et.al 2000). Pigmen kulit gelap, bola
mata menonjol, perut kembung, ada pendarahan, dan pada infeksi akut terjadi kerusakan pada hati sehingga hati menjadi pucat, limpa membesar/bengkak, dan terjadi kerusakan pada otak (Plumb,1975). Timbulnya penyakit pada budi daya karena kondisi yang kurang baik, seperti padat tebar yang tinggi, kualitas air menurun, dan pakan yang tidak baik.
III. METODE PENELITIAN
Penelitian ini akan dilaksanakan selama 45 hari yaitu dari bulan Oktober sampai dengan bulan Desember 2013 di Laboratorium Parasit dan Penyakit Ikan, Fakultas Perikanan dan Ilmu Kelautan Universitas Riau.
3.2. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini alah inkubator, autoklaf, lampu bunsen, jarum ose, timbangan analitik, hot plat, cawan peri, gelas ukur, tabung reaksi, dan erlemayerl, untuk pengamatan bakteri digunakan mikroskop, objek glass dan cover glass
Alat yang digunakan untuk identifikasi pada ikan nila dapat dilihat pada Tabel 1.
Tabel 1. Alat yang Digunakan dalam Identifikasi Bakteri Ikan Nila
Alat Kegunaan Alat Bedah Jarum Ose Cawan Petri Tabung Reaksi Autoclave Incubator Freezer Mikroskop Camera Thermometer DO Meter Hot plat Colony counter Gelas Ukur Mikropipet Lampu bunsen Membedah ikan
Mengambil koloni bakteri Tempat biak bakteri
Tempat untuk mereaksikan zat kimia Strelisasi alat
Alat untuk menginkubasi Pendingin media Mengamati preparat Dokumentasi Pengukur suhu Pengukur DO Menghomogenkan larutan
Alat Penghitung koloni yang tumbuh Untuk mengukur volume suatu cairan Untuk memindahkan cairan
Untuk sterilisasi jarum ose
Sedangkan Bahan yang akan digunakan untuk identifikasi bakteri pada ikan nila adalah Ikan nila sebagai sampel penelitian yang berasal dari tiga stasiun berbeda, dari masing masing stasiun diambil lima ekor sampai sepuluh ekor
dengan ukuran berkisar 5 cm sampai 12 cm. Kemudian sampel di bawa ke laboratorium untuk di isolasi bakteri. Media untuk menumbuhkan bakteri adalah TSA (Tryptic Soya Agar). Untuk pengecatan Gram digunakan kristal violet, larutan iodin, alkohol 95%, safranin 1 %, akuades dan minyak emersi untuk memperjelas pengamatan di bawah mikroskop. Bahan yang digunakan untuk pengujian biokimia adalah H2O2 (Hidrogen Peroksida), kertas saring, kapas, aluminium foil, tissue, alkohol 75%, aquades, medium O/F (Oksidasi Fermentatif), dan SIM (Simon Indol Motility).
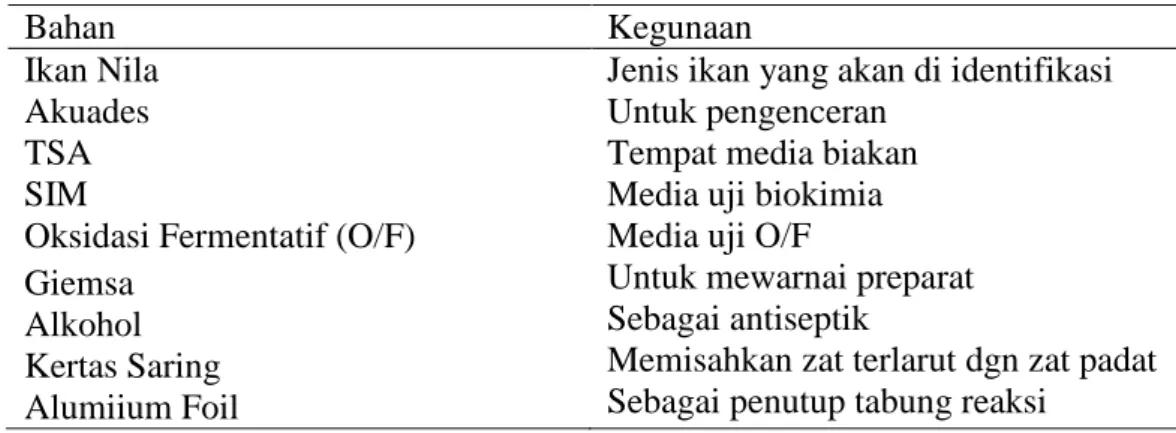
Tabel 2. Bahan yang Digunakan dalam Identifikasi Bakteri Ikan Nila
Bahan Kegunaan
Ikan Nila Jenis ikan yang akan di identifikasi
Akuades Untuk pengenceran
TSA Tempat media biakan
SIM
Oksidasi Fermentatif (O/F) Giemsa
Alkohol Kertas Saring Alumiium Foil
Media uji biokimia Media uji O/F
Untuk mewarnai preparat Sebagai antiseptik
Memisahkan zat terlarut dgn zat padat Sebagai penutup tabung reaksi
3.3. Metode Penelitian
Metode yang digunakan dalam penelitian ini adalah metode survei dengan megnambil sampel di lapangan dan dianalisa di laboratorium.
Menurut (Effendie 1979) Peubah atau parameter yang diukur untuk mewakili respon terhadap keberhasilan identifikasi bakteri adalah Kualitas Air (Fisika dan Kimia). Parameter yang paling utama diukur adalah Amonia, nitrit (NO2-) dan nitrat (NO3-). Selanjutnya diukur: pH (Power Hidrogen) Air, Oksigen Terlarut (DO). Suhu Air.
Untuk kualitas air yang diukur antara lain adalah pH, suhu, oksigen terlarut (DO). Untuk pengukuran suhu dilakukan dengan menggunakan thermometer yaitu dengan mencelupkan bagian ujung thermometer kedalam perairan. Thermometer diikat pada bagian pangkal (bukan ujung air raksa) kemudian thermometer digantung pada permukaan air beberapa menit dan suhu dibaca saat thermometer pada permukaan air dan menunjukkan angka konstan (Adriman et al, 2006).
Pengukuran pH dilakukan dengan menggunakan kertas pH universal indicator yang dicelupkan kedalam air kemudian dilihat perubahan warna yang terjadi dan dicocokkan dengan warna papan standarnya untuk mendapatkan nilai pH air tersebut.
DO atau oksigen terlarut diukur dengan menggunakan alat pengukur DO yaitu DO meter. Cara penggunaannya yaitu dengan memasukkan elektroda ke dalam wadah pemeliharaan (perairan) lebih kurang sedalam 4 cm di bawah permukaan air hingga sensor suhu juga terendam, gerakkan elektroda di dalam media ke bawah dan ke atas atau aduk dengan pengaduk magnetis kemudian bacalah hasil pengamatan sebagai mg/l atau % kejenuhan (Adriman et al, 2006).
3.4.1. Pembuatan Media Trypticase Soy Agar (TSA)
Untuk membuat media TSA diperlukan 40 gram media agar yang dilarutkan dengan 1000 ml akuades dalam tabung erlemeyar, lalu dihomogenkan dengan magnetik stirer, sambil dipanaskan di atas hot plate sampai mendidih. Selanjutnya ehlemeyer ditutup dengan kapas dan aluminium foil untuk disterilisasi dengan autoclave dengan tekanan 1 Atm pada suhu 121° C selama 15 menit. Kemudian di dinginkan hingga suhu 6° C , lalu dituangkan secara aseptik kedalam cawan petri steril dan di tutup rapat, setelah media membeku, cawan
dibungkus dengan kertas padi dengan posisi terbalik. Apabila tidak langsung digunakan media dapat disimpan dalam refrigator.
3.4.2. Pembuatan Media O/F
Untuk membuat media O/F diperlukan 11 gram media agar yang dilarutkan dengan 1000 ml akuades dalam tabung elemeyar, lalu dihomogenkan dengan magnetik stirer, sambil dipanaskan di dalam hot plate sampai mendidih. Selanjutnya erlemeyer ditutup dengan kapas dan aluminium foil untuk disterilisasi dengan autoclave dengan tekanan 1 Atm pada suhu 121° C selama 15 menit. Apabila tidak langsung digunakan media dapat disimpan dalam refrigator.
3.4.3. Pembuatan Media Motility
Untuk membuat media motility diperlukan 30 gram media SIM yang dilarutkan dengan 1000 ml akuades dalam tabung elemeyar, lalu dihomogenkan dengan magnetik stirer, sambil dipanaskan di dalam hot plate sampai mendidih. Selanjutnya erlemeyer ditutup dengan kapas dan aluminium foil untuk disterilisasidengan autoclave dengan tekanan 1 Atm pada suhu 121° C selama 15 menit. Apabila tidak langsung digunakan media dapat disimpan dalam refrigator.
3.4.4 Pengambilan Sampel
Ikan Nila yang akan di indentifikasi berukuran ± 10-15 cm. Pengambilan sampel dilakukan dengan pengamatan secara visual yaitu pengamatan langsung terhadap keadaan ikan, ikan yang diambil 10 ekor dari masing-masing stasiun. Setelah itu lalu ikan di bawa ke Laboratorium untuk dilakukan identifikasi.
3.4.5 Isolasi Bakteri
Ikan nila yang diambil sebagai sampel diletakkan diatas nampan. Permukaan tubuh ikan dibersihkan dengan kapas yang telah diberi alkohol untuk kemudian dibedah. Isolasi bakteri diambil dari borok, hati, limpa dan ginjal. Isolasi bakteri dilakukan dengan menempelkan jarum ose yang steril ke dalam organ (Ginjal, Hati, Limpa) atau borok selanjutnya jarum ose yang tadi digoreskan ke media TSA (media isolasi yang kaya dan subur dan banyak digunakan untuk menumbuhkan bakteri dari ikan dan udang). Media TSA yang telah diberi bakteri tadi kemudian dibungkus dengan menggunakan kertas padi dengan posisi terbalik untuk kemudian diinkubasi didalam inkubator selama 24-48 jam. Setelah diinkubasi selama 24 jam didapat koloni-koloni bakteri yang tumbuh di media agar, selanjutnya dilakukan identifikasi bakteri.
3.5 Analisis Data
Data yang diperoleh dimasukkan kedalam tabel selanjutnya dilakukan uji homogenitas. Apabila data homogen maka selanjutnya dianalisis dengan menggunakan uji keragaman (ANAVA). Apabila uji statistik menunjukkan perbedaan nyata dimana F hitung > F tabel maka dilanjutkan dengan uji Neuman-keuls untuk menentukan perlakuan mana yang lebih baik (Sudjana, 1991).