YANG TERIDENTIFIKASI PADA UDANG GALAH SEGAR
Oleh:
Vika Indriyasari Kurnianingrum
C34104080
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2008
Lain yang Teridentifikasi pada Udang Galah Segar. Dibimbing oleh PIPIH
SUPTIJAH dan KOMARIAH TAMPUBOLON.
Potensi perikanan Indonesia cukuplah besar dimana udang merupakan salah satu sektor andalan bagi ekspor pemerintah. Namun terjadi penurunan ekspor udang Indonesia pada tahun 2007 dikarenakan penolakan beberapa negara tujuan ekspor yang saat ini telah menerapkan zero tolerance terhadap bahan-bahan kimia seperti klorin dan kloramfenikol pada produk udang impor. Berdasarkan permasalahan tersebut maka diperlukan sebuah alternatif desinfektan lain untuk mengganti klorin yang selama ini banyak digunakan dimana salah satunya adalah chitosan yang memiliki sifat aktif karakteristik desinfektan.
Tujuan penelitian ini adalah mengidentifikasi jenis bakteri yang ditemukan pada air tambak dan udang galah segar dengan media chromocult, mengamati pengaruh konsentrasi chitosan dan waktu perendaman yang terbaik yang dapat diterapkan pada air pencuci udang dengan cara mengevaluasi keberadaan Escherichia coli dan bakteri lain yang terdapat pada udang dengan menggunakan media chromocult.
Metodologi penelitian terdiri atas penelitian pendahuluan yang meliputi tahap identifikasi genus bakteri yang terdapat pada air tambak yang merupakan habitat hidup udang galah dan pada udang galah segar dengan metode biokimia.Penelitian utama terdiri atas beberapa tahap diantaranya adalah inokulasi E. coli pada udang dengan tujuan menseragamkan jumlah bakteri E. coli awal pada udang, perlakuan desinfektasi dengan menggunakan chitosan konsentrasi 50 ppm, 100 ppm, 150 ppm, dan 200 ppm, dengan waktu perendaman selama 3 menit dan 6 menit dan penggunaan kontrol asam 1%. Serta pengujian organoleptik terhadap tekstur, bau, dan penampakan udang.
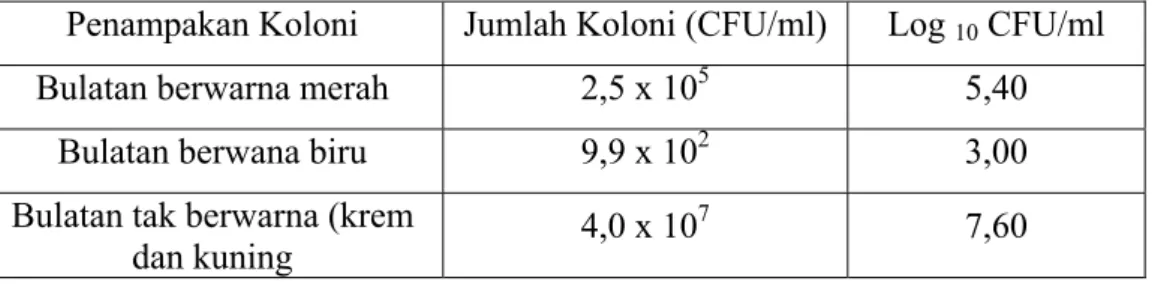
Bakteri yang teridentifikasi pada sampel air adalah Citrobacter, Enterobacter, Corynebacterium, dan Escherichia coli. Sedangkan bakteri yang teridentifikasi pada udang galah segar adalah Escherichia coli, Enterobacter, dan Pseudomonas. Proses desinfektasi udang galah segar dengan asam selama 3 menit mampu menurunkan jumlah Escherichia coli sebesar 1,36 Log10 CFU/gram, dan
perendaman selama 6 menit mengurangi E.coli sebesar 1,47 Log10 CFU/gram.
Perendaman dengan chitosan selama 3 menit dengan konsentrasi sebesar 50 ppm, 100 ppm, 150 ppm, dan 200 ppm mereduksi E. coli berturut-turut adalah 3,29 Log10 CFU/gram; 3,49 Log10 CFU/gram; dan 3,92 Log10 CFU/gram.
Perendaman selama 6 menit mereduksi sebesar 2,75 Log10 CFU/gram,
3,06 Log10 CFU/gram, dan 4,28 Log10 CFU/gram. Chitosan juga dapat mereduksi
bakteri lain yang teridentifikasi dalam media chromocult.
Hasil pengujian organoleptik terhadap udang galah segar menunjukkan hasil pada parameter penampakan perlakuan perendaman udang dengan chitosan 150 ppm selama 3 menit menghasilkan udang yang lebih disukai panelis dengan nilai 7,28. Parameter bau, perlakuan dengan chitosan 100 ppm dan 150 ppm selama 3 menit memiliki nilai yang sama yaitu 7,43, sedangkan parameter tekstur menunjukkan bahwa perlakuan yang lebih disukai panelis adalah perlakuan dengan menggunakan chitosan 150 ppm selama 3 menit dengan nilai 7,77.
YANG TERIDENTIFIKASI PADA UDANG GALAH SEGAR
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
Vika Indriyasari Kurnianingrum C34104080
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2008
Nama mahasiswa : Vika Indriyasari Kurnianingrum Nomor Pokok : C34104080
Program Studi : Teknologi Hasil Perikanan
Menyetujui,
Pembimbing I Pembimbing II
Dra.Pipih Suptijah, MBA Ir. Komariah Tampubolon, MS.
NIP. 131 476 638 NIP. 130 355 555
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
pada tanggal 7 Juli 1985 sebagai anak pertama dari tiga bersaudara, putri dari pasangan Bapak Suharto dan Ibu Tutik Wuryaningsih.
Penulis mengawali pendidikan di SDN Jampiroso I Temanggung dan menyelesaikan pendidikannya pada tahun 1997. Pada tahun 1997 penulis diterima di SLTPN 2 Temanggung dan menyelesaikan pendidikan pada tahun 2000 kemudian melanjutkan pendidikan di SMU Terpadu Krida Nusantara Bandung dan menyelesaikan pendidikan pada tahun 2003. Penulis diterima menjadi mahasiswa Institut Pertanian Bogor melalui Seleksi Penerimaan Mahasiswa Baru (SPMB) di Fakultas Perikanan dan Ilmu Kelautan, Program Studi Teknologi Hasil Perikanan pada tahun 2004.
Selama masa perkuliahan penulis aktif menjadi asisten pada mata kuliah Teknologi Pengolahan Chitin dan Chitosan (2007-2008), serta menjadi asisten dosen pada mata kuliah Teknologi Pengolahan Hasil Perikanan (2007-2008). Penulis juga aktif dalam berbagai bidang penulisan ilmiah diantaranya adalah Finalis LKTM IPA tingkat IPB, Finalis LKTM Lingkungan Hidup Tingkat Nasional, Program Recognize and Mentoring Program “The Lamelson Fondation” dan menjadi delegasi IPB dalam Intensive Student Technopreneur Program, Penyaji Tingkat Nasional dalam PKM bidang penelitian pada Pekan Ilmiah Mahasiswa (PIMNAS) XXI di UNISULA Semarang 2008 dan mendapatkan medali setara perak.
Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, penulis melakukan penelitian dengan judul “Efektifitas Desinfektan alami dari Chitosan sebagai Pereduksi Bakteri Escherichia coli dan Beberapa Bakteri Lain yang Teridentifikasi pada Udang
Galah Segar” dibawah bimbingan Dra. Pipih Suptijah, MBA dan Ir. Komariah
dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian berjudul “Efektifitas Desinfektan Alami dari Chitosan sebagai Pereduksi beberapa Bakteri yang Teridentifikasi Pada Udang Galah Segar”. Shalawat serta salam penulis haturkan kepada Rasulullah Muhammad SAW yang telah mengantar umat manusia ke era penuh kemajuan dan ilmu pengetahuan.
Dengan skripsi yang sederhana ini semoga menambah khazanah ilmu pengetahuan. Penulis menyadari masih banyak kekurangan dalam skripsi ini, sehingga masukan dan perbaikan terus menerus dari pembaca sangatlah penulis harapkan.
Penulis mengucapkan terima kasih kepada pihak-pihak yang telah membantu dan memberi dukungan selama penelitian ini, diantaranya :
1. Ibu Dra. Pipih Suptijah, MBA dan Ibu Ir. Komariah Tampubolon, MS. Selaku dosen pembimbing yang telah memberikan bimbingan dan arahan kepada penulis dengan penuh kesabaran serta telah mencurahkan perhatiannya secara penuh sehingga terselesaikan skripsi ini.
2. Ibu Ir. Iriani Setyaningsih, MS dan Ibu Dra. Ella Salamah, M.Si sebagai dosen penguji yang telah memberikan banyak masukan berharga kepada penulis. 3. Bapak, Ibu, Papah, dan Umi tercinta yang telah memberikan kasih sayang,
dukungan, motivasi, dan doa yang tak terbatas.
4. Suamiku “Arief Setiawan” tercinta dan putriku “Rasya Ar Adzra Zahra” tersayang atas, pengertian, kesabaran, kasih sayang, dukungan, dan segala hal yang tidak mungkin penulis sebutkan, terimakasih atas kepercayaan yang telah diberikan kepada penulis.
5. Keluarga besar tercinta Dika, Genta, Mbak Dini, Mas Firman, Lutfan dan Ilmi atas dukungan, pengertian dan doanya.
6. Bapak Bambang Riyanto, Spi, M.Si atas bimbingan, pembelajaran, motivasi, dan masukan berharga terhadap penulis.
7. Ibu Dr. Yanyanti, dan Ibu Rohmatussolihat serta seluruh Tim Bioteknologi-LIPI yang telah banyak membantu penulis menyelesaikan penelitiannya.
9. Sahabatku Indri, Ami, Dian, Aini, Riska, Bogel, dan Megia atas waktu yang telah diluangkan untuk mendengar keluh kesahku.
10. Teman-teman THP 41 yang senantiasa memberikan doa dan dukungan, serta bantuannya selama ini Laler, Windika, Ari, Eka, Glory, Dila, Nuzul, Anang, Nia, Ika, Sereli, Racun, Dery, Dani, Andika, Vera, Rijal, Gilang, Yudha, Bojong, Sait, Fahmi, Dede, Rijan, Alim, Syeni, Agnes, Barlian, Yogi dan semuanya yang tidak mungkin disebutkan satu persatu.
11. Teman-teman THP 39 (terutama Mas Dzakir), 40 (terutama Richi, Liani, Angling, Lisda, dan Vije), 42, dan 43 (terutama Supri dan Reza) atas kebersamaan dan semangatnya.
12. Semua pihak yang telah membaca dan menggunakan karya ilmiah ini sebagai bahan acuan ataupun untuk kegunaan lainnya.
Bogor, Juli 2008
DAFTAR TABEL ... viii DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x 1. PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Tujuan Penelitian ... 3 2. TINJAUAN PUSTAKA ... 4 2.1. Udang Galah ... 4 2.3.1. Mikroorganisme udang ... 6
2.2. Proses Pengolahan Udang ... 8
2.3. Chitosan ... 9
2.3.1. Pengertian chitosan ... 9
2.3.2. Sumber chitosan ... 9
2.3.3. Proses pembuatan ... 10
2.3.4. Aplikasi chitosan ... 13
2.3.5. Sifat fisika dan kimia chitosan ... 14
2.3.6. Karakteristik chitosan sebagai desinfektan alami ... 16
2.4. Bakteri ... 17
2.4.1. Identifikasi bakteri ... 18
2.4.2. Escherichia coli ... 21
2.5. Chromocult ... 23
3. METODOLOGI ... 25
3.1. Waktu dan Tempat ... 25
3.2. Bahan dan Alat ... 25
3.3. Metode Penelitian ... 26
3.3.1. Penelitian pendahuluan ... 26
3.3.1.1. Identifikasi bakteri dalam air tambak ... 26
3.3.1.2. Identifikasi bakteri dalam udang galah segar ... 27
3.3.1.3. Identifikasi genus bakteri dengan uji biokimia ... 27
a. Uji aktivitas enzim ekstraseluler ... 28
b. Fermentasi karbohidrat... 28
c. Uji triple sugar-iron (TSI) agar ... 29
d. Uji IMViC ... 29
3.3.2.1. Konfirmasi biakan Escherichia coli NBRC 14237 . 31 3.3.2.2. Persiapan inokulasi bakteri Escherichia coli pada
udang ... 32
3.3.2.3. Evaluasi efektifitas chitosan ... 33
3.4. Analisis organoleptik (SNI 01-2346-2006) ... 33
3.5. Rancangan Percobaan ... 34
3.5.1. Perlakuan ... 34
3.5.2. Rancangan ... 35
3.5.3. Hipotesis ... 36
4. HASIL DAN PEMBAHASAN ... 37
4.1. Penelitian Pendahuluan ... 37
4.1.1. Identifikasi bakteri dalam air tambak ... 37
4.1.2. Identifikasi bakteri dalam udang galah segar ... 46
4.2. Penelitian Utama ... 54
4.2.1. Konfirmasi biakan Escherichia coli NBRC 14237 ... 54
4.2.2. Persiapan inokulasi bakteri Escherichia coli pada udang ... 55
4.2.3. Evaluasi efektifitas chitosan dalam mereduksi Escherichia coli ... 56
4.2.4. Evaluasi efektifitas chitosan dalam mereduksi bakteri yang teridentifikasi pada media chromocult ... 58
4.3. Uji Organoleptik ... 60
4.3.1. Penampakan ... 61
4.3.2. Bau ... 62
4.3.3. Tekstur ... 63
4. KESIMPULAN DAN SARAN ... 66
4.1. Kesimpulan ... 66
4.2. Saran ... 66
1. Produksi udang Indonesia (2003-2007) ... 1
2. Komposisi kimia rata-rata daging udang ... 6
3. Persyaratan mutu mikrobiologi produk udang mentah beku ... 6
4. Syarat-syarat chitosan komersial ... 15
5. Jumlah mikroorganisme pada sampel air tambak dalam media chromocult ... 37
6. Penampakan koloni bakteri air tambak, reaksi Gram, katalase, dan oksidase dari koloni representatif ... 38
7. Identifikasi genus dengan uji biokimia terhadap koloni representatif pada air tambak ... 40
8. Jumlah koloni mikroorganisme pada sampel udang dengan media chromocult ... 47
9. Penampakan koloni bakteri udang galah segar, reaksi Gram, katalase dan oksidase dari koloni representatif ... 48
10. Identifikasi genus dengan uji biokimia terhadap koloni representatif pada udang galah segar ... 51
1. Morfologi udang galah ... 4
2. Struktur kimia chitin dan chitosan ... 10
3. Diagram cara pembuatan chitin dan chitosan, serta beberapa pemanfaatan dan penggunan chitin dan chitosan ... 12
4. Diagram beberapa segi pemanfaatan dari chitin dan chitosan yang potensial ... 13
5. Bakteri yang teridentifikasi pada media chromocult ... 24
6. Amatan mikroskop pada bakteri air tambak yang dimurnikan ... 38
7. Uji biokimia terhadap koloni representatif pada air tambak ... 39
8. Amatan mikroskop pada bakteri udang galah segar yang dimurnikan ... 48
9. Uji biokimia terhadap koloni representatif pada udang galah segar ... 50
10. Jumlah reduksi bakteri Escherichia coli setelah perlakuan dengan desinfektan ... 56
11. Kurva reduksi jumlah bakteri Enterobacter dengan perlakuan desinfektan ... 59
12. Kurva reduksi jumlah bakteri Pseudomonas dengan perlakuan desinfektan ... 59
13. Diagram batang rata-rata penilaian panelis terhadap penampakan udang galah segar dengan berbagai perlakuan pencucian dengan konsentrasi chitosan yang berbeda... 61
14. Diagram batang rata-rata penilaian panelis terhadap bau udang galah segar dengan berbagai perlakuan pencucian dengan konsentrasi chitosan yang berbeda ... 63
15. Diagram batang rata-rata penilaian panelis terhadap tekstur udang galah segar dengan berbagai perlakuan pencucian dengan konsentrasi chitosan yang berbeda ... 64
1. Spesifikasi Chitosan yang Digunakan ... 72
2. Contoh perhitungan pembuatan larutan chitosan ... 73
3. Score sheet penilaian organoleptik terhadap udang galah ... 74
4. Data mentah jumlah pertumbuhan bakteri pada sampel air tambak dengan media chromocult ... 75
5. Jumlah mikroorganisme pada sampel udang galah segar dalam media chromocult ... 76
6. Data mentah jumlah pertumbuhan bakteri Escherichia coli yang telah mendapatkan perlakuan desinfektan ... 77
7. Data mentah jumlah pertumbuhan bakteri Enterobacter yang telah mendapatkan perlakuan desinfektan ... 79
8. Data mentah jumlah pertumbuhan bakteri Pseudomonas yang telah mendapatkan perlakuan desinfektan ... 81
9. Contoh perhitungan jumlah koloni per forming unit (CFU) ... 83
10. Contoh perhitungan nilai reduksi bakteri ... 84
11. Rekapitulasi data organoleptik penampakan udang galah segar ... 85
12. Rekapitulasi data organoleptik bau udang galah segar ... 86
13. Rekapitulasi data organoleptik tekstur udang galah segar ... 87
14. Uji statistik untuk penampakan ... 88
15. Uji statistik untuk bau ... 89
16. Uji statistik untuk tekstur ... 90
17. Daftar bahan-bahan yang digunakan (Cappucino dan Sherman 1983) 91 18. Sistem penarikan taksonomi berdasarkan Bergeys Manual (1974) ... 92
19. Gambar bahan-bahan yang digunakan ... 102
1. PENDAHULUAN 1.1. Latar Belakang
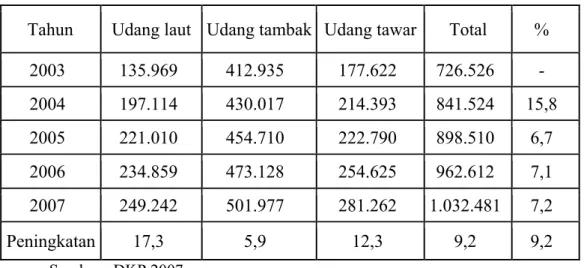
Potensi perikanan Indonesia secara keseluruhan mencapai 65 juta ton yang terdiri dari 7,3 juta ton pada sektor perikanan tangkap dan 57,7 juta ton pada sektor perikanan budidaya (Dahuri 2004). Diantara potensi tersebut, udang merupakan sektor andalan bagi ekspor pemerintah. Produksi udang Indonesia terus meningkat dari tahun ke tahun seperti yang terlihat pada Tabel 1 berikut ini.
Tabel 1. Produksi udang Indonesia tahun 2003-2007
Sumber : DKP 2007
Hingga pertengahan tahun 2007 total ekspor udang sebanyak 92.647 ton atau senilai dengan US$ 920,5 juta atau Rp 8,3 triliun. Jumlah ini cenderung menurun jika dibandingkan dengan jumlah ekspor tahun 2006 dimana total ekspor udang sebesar 169.329 ton atau senilai dengan US$ 980,2 juta atau Rp 8,8 triliun (DKP 2007). Penurunan jumlah nilai ekspor tersebut diatas terkait dengan penolakan udang yang berasal dari Indonesia pada sejumlah negara seperti Jepang, Amerika Serikat, dan Uni Eropa sebagai tujuan ekspor udang Indonesia yang utama. Penolakan sejumlah udang yang berasal dari Indonesia ini terkait dengan kebijakan yang dikeluarkan oleh NFI (National Fisheries Institute) serta Uni Eropa yang sangat memperhatikan mutu produk udang yang mereka impor.
Desinfektan biasa digunakan untuk mereduksi mikroorganisme penyebab foodborne disease. Jenis desinfektan yang banyak digunakan adalah klorin, karena beberapa kelebihan yang dimilikinya dimana diantaranya adalah harga yang murah, dan keefektifan dalam menginaktifkan bakteri hanya dengan waktu kontak
Tahun Udang laut Udang tambak Udang tawar Total %
2003 135.969 412.935 177.622 726.526 - 2004 197.114 430.017 214.393 841.524 15,8 2005 221.010 454.710 222.790 898.510 6,7 2006 234.859 473.128 254.625 962.612 7,1 2007 249.242 501.977 281.262 1.032.481 7,2 Peningkatan 17,3 5,9 12,3 9,2 9,2
yang pendek (Kim et al. 2000). Namun penelitian terkini membuktikan bahwa klorin memiliki efek karsinogenik (Bets 2005), di lain pihak Henneberger et al. (2005) menyatakan bahwa klorin memiliki efek iritasi pada hidung, tenggorokan, dan saluran respirasi bagian atas. Klorin dengan konsentrasi 125 ppm berpotensi menyebabkan kerusakan saluran pernapasan yang fatal termasuk bronkitis dan pulmonary edema. Henneberger et al. (2005) di dalam kajiannya juga mengungkapkan bahwa orang yang berinteraksi dengan klorin dalam jangka waktu 24 bulan secara berturut-turut dapat menyebabkan penurunan fungsi kerja paru-paru secara permanen. Permasalahan tersebut juga ikut meningkatkan penolakan udang yang berasal dari Indonesia oleh pasar Uni Eropa dimana mereka telah menetapkan zero tolerance terhadap beberapa senyawa kimia seperti klorin dan kloramfenikol terhadap produk seafood impor (DKP 2007).
Fenomena ini telah mendorong pada penelitian dan kebutuhan tentang suatu bentuk lain dari desinfektan yang dapat mengeliminasi bakteri serta menurunkan jumlah penyakit yang disebabkan oleh makanan, serta terbuat dari bahan yang lebih aman dan ramah lingkungan. Salah satu terobosan baru yang memungkinkan adalah penggunaan chitosan sebagai desinfektan alami yang diaplikasikan pada air pencuci udang. Hal ini cukup menarik mengingat chitosan berbahan dasar alami dan tidak meninggalkan residu yang berbahaya di dalam tubuh manusia, dimana saat ini sangat menarik bagi kalangan pelaku industri makanan di Jepang dan Amerika.
Chitosan merupakan komponen glukosamin dan juga turunan chitin melalui proses deasetilasi dan banyak terkandung pada lapisan cangkang kepiting, crustacea dan juga terdapat pada serangga, alga, diatom, dan kapang (Rinaudo 2006). Chitosan banyak digunakan pada berbagai bidang diantaranya adalah pada pengolahan air limbah, sebagai agen anti tumor (Chaiyakosha et al. 2007), menurunkan kolestrol pada tubuh manusia pada konsentrasi 50 ppm (Kanauchi et al. 1995), selain itu chitosan juga dapat berfungsi sebagai agen anti mikroba (Sudarshan et al. 1992). Beberapa kajian yang pernah dilakukan terhadap chitosan didapatkan hasil yang menarik, dimana chitosan memiliki efekifitas yang cukup baik jika digunakan pada industri makanan sebagai pengawet makanan dan desinfektan alami karena chitosan dapat berfungsi dalam menghambat bakteri,
jamur, kapang dan khamir (No et al. 2002). Tsai et al. (2002) melakukan kajian tentang efek bakterisidal pada chitosan dimana chitosan mampu mereduksi bakteri foodborne gram positif dan gram negatif pada fillet ikan segar dan oyster, seperti Staphylococcus aureus, Escherichia coli, Yersinia enterocolitica, Lysteria monocytogenes, Salmonella typhimurium, dan Vibrio cholerae.
Adanya chitosan yang digunakan sebagai desinfektan alami yang diterapkan pada air pencuci udang dan dapat berfungsi sebagai pengganti klorin diharapkan dapat memperbaiki aplikasi baru bagi industri udang sehingga dapat memperbaiki mutu sesuai dengan permintaan pasar serta meningkatkan kembali tingkat ekspor udang Indonesia ke luar negeri.
1.2. Tujuan Penelitian
Tujuan khusus dilakukannya penelitian mengenai pemanfaatan chitosan sebagai desinfektan alami dalam mereduksi beberapa bakteri yang teridentifikasi pada udang segar dengan menggunakan media chromocult yaitu:
(1) Mengidentifikasi jenis bakteri yang ditemukan pada air tambak dan udang galah segar dengan media chromocult
(2) Mengamati pengaruh konsentrasi chitosan, serta waktu perendaman yang terbaik yang dapat diterapkan pada air pencuci udang dengan mengevaluasi keberadaan Escherichia coli pada udang setelah proses pencucian
(3) Mengetahui efektifitas chitosan dalam mereduksi bakteri lain yang teridentifikasi pada udang galah segar dengan menggunakan media chromocult.
2. TINJAUAN PUSTAKA 2.1. Udang Galah
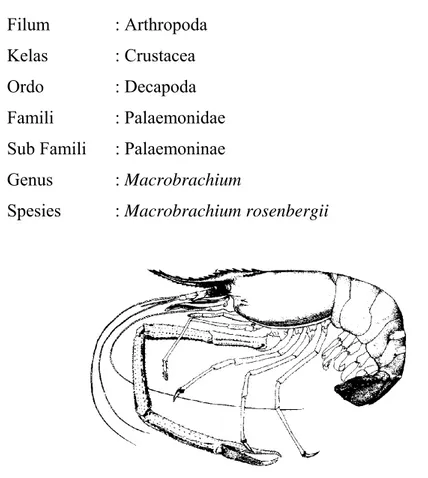
Udang galah (Macrobrachium rosenbergii) merupakan jenis udang air tawar paling besar ukurannya di Indonesia (LIPI 1977). Panjang tubuhnya dapat mencapai 15-25 cm dengan berat 100-300 gram (BPPT 2005). Udang jenis ini memiliki potensi yang besar untuk semakin dikembangkan dalam sistem budidaya air tawar, karena merupakan komoditas unggulan untuk diekspor (Daulay dan Djajadireja 1979). Houlthuis (1950) menyatakan bahwa di Indonesia udang galah banyak ditemukan di Sumatra, Kalimantan, Jawa, dan Sulawesi. Berikut merupakan klasifikasi dari udang galah menurut Houlthis (1950).
Filum : Arthropoda
Kelas : Crustacea
Ordo : Decapoda
Famili : Palaemonidae Sub Famili : Palaemoninae
Genus : Macrobrachium
Spesies : Macrobrachium rosenbergii
Gambar 1. Morfologi udang galah (Sumber : FAO 2002)
Jayachandran (2001) menyatakan bahwa udang galah mempunyai ciri khusus dibanding dengan jenis udang lainnya, yaitu kedua kakinya tumbuh dominan. Ciri khas lain yang dapat dikenali dengan mudah adalah kepala berbentuk kerucut, rostrum melebar pada bagian ujung dengan bentuk yang memanjang dan melengkung ke atas. Bagian atas terdapat gigi seperti gergaji
berjumlah 12 buah dan bagian bawah 11 buah. Sepasang mata bertangkai, terletak pada pangkal rostrum dengan jenis matanya termasuk mata majemuk atau mata faset (Murtidjo 1992), dan jika masih segar berwarna biru tua keunguan (LIPI 1977).
Dalam siklus hidupnya udang galah menempati dua habitat (Murtidjo 1992). Pada saat dewasa dan matang gonad hingga telur menetas menjadi plankton atau larva stadium 11, udang galah biasa hidup di air payau, tetapi setelah menjadi juvenil sampai usia dewasa udang galah lebih senang hidup di air tawar (New 2002).
Pada dasar badan udang dibagi menjadi 2 bagian, yaitu bagian chepalothorax dan bagian abdomen. Chepalothorax merupakan gabungan dari kepala dan dada, sedangkan bagian abdomen merupakan bagian terbesar dari udang, yang ada di dalamnya dan terkandung sebagian besar daging yang dapat dimakan dan bagian ekor (telson). Bagian kepala merupakan 34-44 % dari seluruh berat badan, daging keseluruhan 24-41%, dan persentase kulit dan ekornya berkisar antara 17-23% (Chaiyakosha et al. 2007).
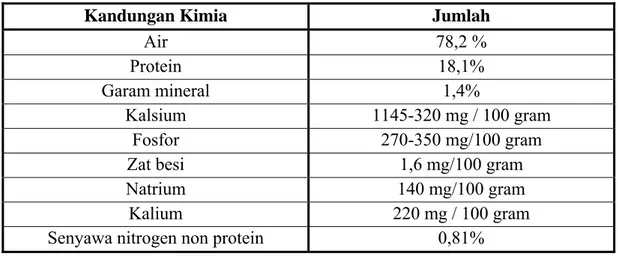
Udang adalah salah satu produk perikanan dengan rasa yang khas dan kandungan nilai gizi yang tinggi. Daging udang mempunyai kelebihan dalam hal kandungan asam aminonya yang lebih tinggi jika dibandingkan dengan daging hewan darat. Daging udang memiliki jumlah asam amino tirosin, triptofan, dan sistein yang lebih tinggi, namun kandungan histidin yang lebih rendah jika dibandingkan dengan daging hewan darat. Di samping itu, daging udang mempunyai rasa lebih enak jika dibandingkan dengan daging hasil perikanan lain (Chaiyakosha et al. 2007). Adapun komposisi kimia rata-rata daging udang menurut Hadiwiyoto (1993) tercantum dalam Tabel 2.
Dalam Standar Nasional Indonesia Udang Beku menurut Badan Standaridisasi Nasional (2007) tentang RSNI 01-2705-2005 dimana terdapat spesifikasi persyaratan mutu yang meliputi mutu organoleptik, fisika, dan mikrobiologi. Spesifikasi tentang persyaratan mutu mikrobiologi produk udang beku disajikan pada Tabel 3.
Tabel 2. Komposisi kimia rata-rata daging udang
Kandungan Kimia Jumlah
Air 78,2 %
Protein 18,1%
Garam mineral 1,4%
Kalsium 1145-320 mg / 100 gram
Fosfor 270-350 mg/100 gram
Zat besi 1,6 mg/100 gram
Natrium 140 mg/100 gram
Kalium 220 mg / 100 gram
Senyawa nitrogen non protein 0,81%
Sumber : Hadiwiyoto 1993
Tabel 3. Persyaratan mutu mikrobiologi produk udang mentah beku
Jenis Uji Persyaratan Mutu
Organoleptik
Nilai minimal 7
Mikrobiologi
Jumlah bakteri TPC/gram maksimal E. Coli MPN/ gram maksimal Salmonella Vibrio cholerae Vibrio parahaemolyticus (MPN) 5 x 105 Maksimal < 2 Negatif Negatif Maksimal < 3 Fisika Bobot tuntas Filth
Suhu pusat maksimum
Sesuai label Negatif -18°C Kimia Kloramfenikol (ppb) Nitrofuran (ppb) Tetrasiklin (ppb) Maksimal 0 Maksimal 0 Maksimal 100 Sumber : RSNI 01-2705-2005 2.1.1. Mikroorganisme udang
Salah satu faktor penting yang menentukan kualitas udang, atau bahan pangan pada umumnya, adalah kandungan mikroorganismenya. Bahan pangan menjadi tidak dapat diterima secara mikrobiologis apabila terdapat pertumbuhan
mikroba pembusuk maupun pathogen. Mikroba pembusuk berperan dalam menghasilkan perubahan dari kualitas sensori pangan. Sedangkan mikroba pathogen menjadikan pangan tersebut tidak aman untuk dikonsumsi (Walker dan Stringer 1990). Meskipun beberapa faktor yang berhubungan dengan sumber kontaminasi dan parameter-parameter yang mempengaruhi pertumbuhan relatif sama untuk keduanya, namun masalah keamanan pangan harus lebih diutamakan.
Beberapa saat setelah ditangkap, udang akan segera mati dan mulai mengalami pembusukan. Proses dekomposisi udang merupakan hasil dari kombinasi antara pertumbuhan mikroba dan aktifitas enzim yang secara alami ada di dalam jaringan (Finne 1982). Proses tersebut menghasilkan senyawa-senyawa yang mengakibatkan perubahan warna, off odor, dan off flavor (Fieger dan Novak 1961).
Mikroba yang terdapat pada udang mencerminkan karakteristik mikrobiologis dari air dimana udang tersebut berasal (Ayres et al. 1980). Jumlah mikroba yang terdapat pada udang utuh yang baru ditangkap berkisar antara 103 hingga 105 per gram. Umumnya bagian kepala mengandung kurang lebih tiga perempat bagian dari total mikroba yang ada (Ayres et al. 1980).
Simmonds dan Lamprecht (1985) menyatakan bahwa pengaruh penanganan selama pengolahan terhadap populasi mikroba pada produk terdiri dari 2 bentuk, yaitu terjadinya peningkatan jumlah mikroba yang dapat disebabkan oleh kontaminasi dari luar dan peningkatan flora mikroba yang telah ada pada udang akibat denaturasi protein ataupun degradasi lemak pada tubuh udang itu sendiri. Hal tersebut dapat diminimalkan dengan menjaga suhu pada setiap tahapan serendah mungkin, meningkatkan kesadaran pekerja, dan melaksanakan prosedur pembersihan dan desinfeksi secara teratur.
Usaha untuk mencegah penurunan mutu udang setidaknya meliputi dua masalah yang berbeda. Mempertahankan jumlah mikroorganisme dalam jumlah yang rendah dan mengontrol proses oksidasi senyawa phenol yang menghasilkan melanin. Reaksi ini dipicu oleh enzim phenolase yang secara alami terdapat di dalam jaringan menghasilkan penampakan bintik hitam (black spot) pada permukaan udang (Fieger dan Novak 1961).
2.2. Proses Pengolahan Udang
Tahapan awal pengolahan udang dari keseluruhan proses produksi pada beberapa perusahaan adalah sebagai berikut, tahap pertama adalah penerimaan bahan baku. Bahan baku dari tambak diangkut ke perusahaan dengan menggunakan truk atau mobil bak terbuka. Selama pengangkutan, udang diletakkan dalam bak plastik (coolbox) yang diberi es balok dan es curai untuk menjaga kesegaran udang selama perjalanan.
Klorin merupakan salah satu bahan utama yang digunakan dalam proses pencucian udang dalam skala industri. Dalam pengolahannya pencucian udang dengan menggunakan klorin dapat dilakukan hingga 4 kali dengan konsentrasi dan waktu penggunaan klorin yang berbeda-beda pada setiap perusahaan.
Setelah sampai di perusahaan, bahan baku dibongkar dan dimasukkan ke dalam keranjang plastik untuk ditimbang. Udang yang telah ditimbang dicuci dengan air yang mengandung klorin dengan konsentrasi 100-200 ppm dan bervariasi pada setiap pabrik yang bertujuan untuk menghilangkan kotoran-kotoran yang melekat pada tubuh udang dan untuk mereduksi jumlah bakteri.
Setelah pencucian tahap pertama, dilakukan pemotongan kepala dengan cara mematahkan kepala dari atas ke bawah mulai dari batas kaki jalan hingga kelopak penutup kepala dengan posisi punggung menghadap ke atas (Sulistia 2004). Udang kemudian dicuci dengan air yang mengandung klorin dengan konsentrasi 50-150 ppm dan biasanya bervariasi pada setiap pabrik.
Setelah pencucian tahap kedua, dilakukan sortasi berdasarkan mutu, ukuran dan warna udang. Udang yang telah disortir lagi (sortasi final) untuk mengecek ketepatan dari hasil sortasi ukuran, kemudian dicuci dengan air yang mengandung klorin dengan konsentrasi 10-25 ppm dan biasanya bervariasi pada tiap pabrik.
Setelah pencucian tahap ketiga, dilakukan penimbangan. Kemudian udang dicuci dengan air yang mengandung klorin 5-10 ppm dan bervariasi pada setiap pabrik. Setelah pencucian tahap keempat, udang disusun dalam inner pan yang sebelumnya telah dicuci dan dibersihkan. Untuk menjaga rantai dingin, dalam setiap tahapan proses meja selalu ditaburi dengan es keping.
Fadlihu (2003) menyatakan bahwa klorin biasa digunakan pada industri pengolahan udang. Klorin yang digunakan umumnya dalam bentuk kalsium hipoklorit (Ca(OCl)2) atau lebih dikenal dengan nama kaporit dimana konsentrasi
yang digunakan berbeda-beda pada setiap tahap proses produksi.
2.3. Chitosan
2.3.1. Pengertian chitosan
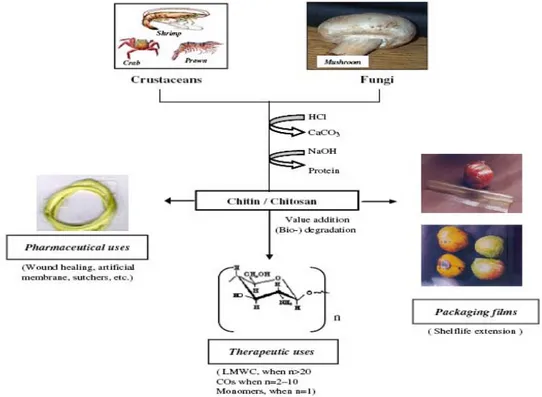
Chitosan merupakan produk dari proses deasetilasi chitin yang memiliki sifat unik sehingga dapat digunakan dalam berbagai keperluan. Hal ini menyebabkan chitosan memiliki potensi industri yang cukup besar, akan tetapi potensinya belum dimanfaatkan secara optimum di Indonesia. Chitosan juga merupakan produk alami yang tidak beracun dan polisakarida yang tidak larut air, yang diekstrak dari kulit udang. Disamping itu chitosan juga merupakan biopolimer kationik yang dapat didegradasi (Kofuji et al. 2005).
2.3.2. Sumber chitosan
Chitin sebagai sumber awal chitosan merupakan biopolimer yang cukup melimpah di alam. Sebagian besar chitin dapat diperoleh dari krustasea laut seperti kepiting, udang, oyster, dan cumi-cumi (Yi et al. 2005).
Sumber chitin dan chitosan yang cukup banyak dan terdapat dalam perairan Indonesia adalah limbah udang. Hal ini sejalan dengan munculnya udang yang telah menjadi salah satu komoditas primadona dalam industri pengolahan hasil perikanan, sejak diresmikannya program peningkatan devisa non migas terutama dari sub sektor perikanan (Suptijah et al. 1992 ).
Suptijah et al. (1992) menyatakan bahwa sumber chitin dan chitosan yang merupakan limbah udang dapat dikategorikan menjadi tiga jenis berdasarkan jenis pengolahannya yaitu kepala udang (biasanya merupakan hasil samping dari industri pembekuan udang tanpa kepala), kulit udang (biasanya merupakan hasil samping dari industri pembekuan udang atau industri pengalengan udang), dan campuran keduanya (biasanya berasal dari industri pengalengan udang).
2.3.3. Proses pembuatan
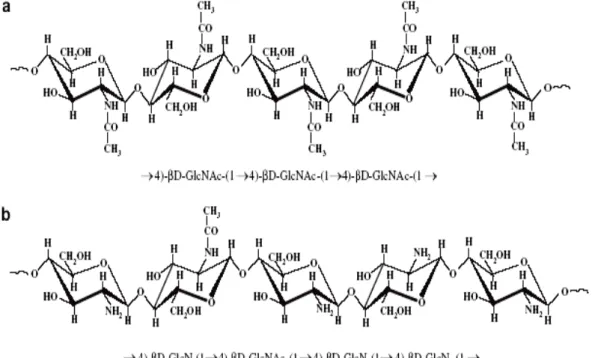
Chitosan merupakan polimer linier yang tersusun oleh 2000-3000 monomer N-asetil D-glukosamin dalam ikatan β (1-4), tidak toksik
dengan LD50 setara dengan 16 g/kg BB dan mempunyai berat molekul 800 Kda.
Berat molekul ini tergantung dari derajat deasetilasi yang dihasilkan pada saat ekstraksi. Semakin banyak gugus asetil yang hilang dari polimer chitosan, maka semakin kuat interaksi antar ion dan ikatan hidrogen dari chitosan (Tang et al. 2007). Adapun struktur chitosan dapat dilihat pada Gambar 2.
Gambar 2. Struktur kimia (a) chitin dan (b) chitosan (Prashanth dan Tharanathan 2007).
Kulit udang memiliki senyawa kimia yang disebut chitin, dengan rumus molekul (C8H13NO5)n. Chitosan didapatkan dari chitin melalui proses yang
disebut dengan deasetilasi. Adapun chitin diperoleh dengan proses deproteinasi dan demineralisasi. Yang disebut dengan proses demineralisasi merupakan proses penghilangan mineral yang dikandung kulit udang. Pada tahap ini dilakukan dengan menambahkan larutan HCl 1,5 N dengan perbandingan 1 : 7 yaitu 1 kg kulit udang dan 7 liter larutan HCl 1,5 N, kemudian dipanaskan pada suhu 90ºC. Mineral utama kulit udang adalah CaCO3 dan sedikit Ca3(PO4)2. Saat
kalsium klorida, asam karbonat dan asam fosfat yang larut air. Supaya proses demineralisasi dapat berlangsung sempurna, diusahakan agar konsentrasi asam yang digunakan serendah mungkin dan disertai pengadukan yang konstan. Pengadukan yang konstan menyebabkan asam konsentrasi rendah dapat bereaksi sempurna dengan bahan baku yang digunakan. Pada saat pencampuran dengan larutan HCl akan timbul buih yang menunjukkan adanya reaksi antara garam mineral dengan HCl menghasilkan garam-garam klorida (CaCl2) dan gas CO2
dimana garam mineral akan larut dalam HCl sehingga terpisahkan dari limbah udang.
Setelah melalui proses demineralisasi dilanjutkan dengan tahap deproteinasi yaitu proses penghilangan protein dengan menggunakan larutan NaOH 3,5 N dengan perbandingan 1 : 10 pada suhu 90ºC selama satu jam. Protein yang terdapat dalam kulit udang terekstrak dalam bentuk Na-proteinat. Ion Na+ akan mengikat ujung rantai protein yang bermuatan (-) dan melarut dalam larutan pengekstrak. Pada tahap ini terbentuk chitin.
Tahap terakhir adalah proses deasetilasi yaitu penghilangan gugus asetil dari chitin dengan menggunakan larutan NaOH 50% dengan perbandingan 1 : 10 pada suhu 140º C selama 1 jam. Proses ini bertujuan untuk menghilangkan gugus asetil (COCH3) dari chitin. Penggunaan suhu tinggi dengan konsentrasi NaOH
tinggi (50%) ini, berkaitan dengan ikatan kuat antara atom nitrogen pada gugus amin dengan gugus asetil, selain itu chitin termasuk salah satu polisakarida yang sangat sulit dihidrolisis dalam suasana asam atau basa. Setiap tahap selalu diikuti dengan proses pencucian dengan meggunakan aquades atau air bersih sampai netral (Suptijah et al. 1992).
Chitosan berbentuk spesifik dan mengandung gugus amino dalam rantai karbonnya. Hal ini menyebabkan chitosan bermuatan positif yang
berlawanan dengan polisakarida lainnya (Rinaudo 2006). Chitosan merupakan polielektrolit netral pada pH asam. Bahan-bahan seperti protein, anion polisakarida, dan asam nukleat yang bermuatan negatif akan berinteraksi kuat dengan chitosan membentuk ion netral.
Chitosan merupakan polisakarida yang masuk ke dalam kelas makromolekul, memiliki kecenderungan bioaktif dan umumnya dibuat dari
bahan-bahan alam dari hasil pertanian maupun berasal dari limbah udang, kerang-kerangan maupun kepiting (Prashanth dan Tharanathan 2007). Selulosa,
pektin merupakan biopolimer turunan dari yang terdahulu, sedangkan chitin dan chitosan merupakan turunan akhir. Prashanth dan Tharanathan (2007) mengemukakan bahwa chitin juga dapat dibuat dari penggunaan jamur dan bakteria, hal ini dapat terlihat pada Gambar 3.
Gambar 3. Diagram cara pembuatan chitin dan chitosan, serta beberapa pemanfaatan dan penggunan chitin dan chitosan (Prashanth dan Tharanathan 2007)
Chitin dan chitosan merupakan senyawa kimia yang mudah menyesuaikan diri, hidrofilik, memiliki reaktivitas kimia yang tinggi yang disebabkan oleh kandungan gugus OH dan gugus NH2 yang bebas, dan ligan yang bervariasi.
Kumpulan gugus hidroksil (hidroksil pertama pada C-6 dan hidroksil yang kedua pada C-3) serta gugus amino yang sangat reaktif (C-2) atau N-asetil yang seluruhnya terdapat pada chitin (Prashanth dan Tharanathan 2007). Di samping itu, ketahanan kimia keduanya cukup baik yaitu chitosan larut dalam larutan
asam, tetapi tidak larut dalam basa dan posisi silang chitosan memiliki sifat yang sama baiknya dengan chitin, serta tidak larut dalam media campuran asam dan basa (Tang et al. 2007).
2.3.4. Aplikasi chitosan
Penentuan kualitas chitosan tergantung pada pemakaiannya,misalnya pada proses pemurnian (non makanan) biasanya tidak memperdulikan mutunya. Namun untuk aplikasi lain terutama yang berhubungan dengan kesehatan kualitas sangat dibutuhkan (Tamura et al. 2002).
Gambar 4. Diagram beberapa segi pemanfaatan dari chitin dan chitosan yang potensial (Prashanth dan Tharanathan 2007)
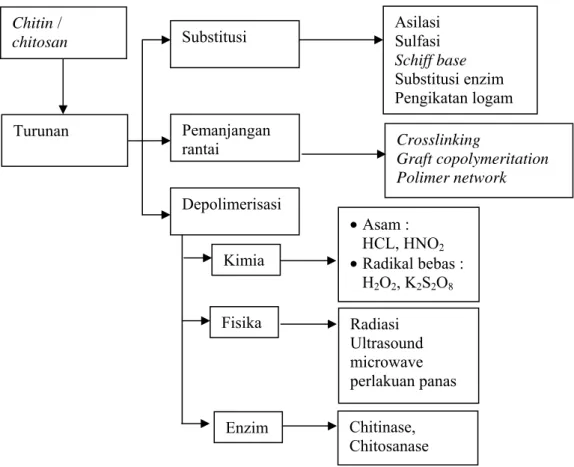
Chitin dan chitosan ini telah diaplikasikan dengan sangat luas. Proses kationisasi mengarah kepada pembentukan grup yang fungsional dan reaktif (gugus 1 amino dan 2 hydroxyl setiap residu GlcN) di dalam molekul tersebut yang membuat chitosan terlihat seperti biomolekul. Gugus amino bebas yang terdapat pada setiap monomernya yang dihasilkan dari gugus amino, berdasarkan
Crosslinking Graft copolymeritation Polimer network Chitin / chitosan Turunan Substitusi Pemanjangan rantai Depolimerisasi Kimia Fisika Asilasi Sulfasi Schiff base Substitusi enzim Pengikatan logam • Asam : HCL, HNO2 • Radikal bebas : H2O2, K2S2O8 Radiasi Ultrasound microwave perlakuan panas Chitinase, Chitosanase Enzim
pada proses protonasi, yang dilakukan pada media larutan asam. Beberapa dari turunan serta aplikasi pada dunia global seperti yang dapat dilihat pada Gambar 4.
Abdou et al (2007) menyatakan bahwa chitosan dapat dimanfaatkan pada berbagai bidang diantaranya adalah aplikasi pada bidang teknik dimana diantaranya pada industri tekstil dan kertas karena sifatnya yang biodegradable dan memiliki aktifitas antibakteri. Selain itu chitosan dapat dimanfaatkan dalam hal bioteknologi sebagai imobilisasi enzim, medium kultur tumbuhan, bidang obat-obatan dan kesehatan, bidang kecantikan, dan dalam bidang pangan.
Aplikasi chitosan dalam bidang pangan, salah satunya adalah sebagai makanan berserat sehingga dapat meningkatkan masa feses, menurunkan respon glisenik dari makanan dan menurunkan kadar kolestrol (Abdou et al. 2007).
2.3.5. Sifat fisika dan kimia chitosan
Chitosan larut dalam asam mempunyai keunikan yaitu membentuk gel yang stabil dan mempunyai dwi kutub, yaitu muatan negatif pada gugus karboksilat dan muatan positif pada gugus NH. Karakterisasi chitosan dapat ditentukan dari kelarutannya dalam asam lemah seperti asam asetat. Chitosan lebih mudah larut dalam asam asetat 1-2 % dan akan membentuk suatu garam ammonium asetat (Tang et al. 2007).
Chitosan berbentuk spesifik dan mengandung gugus amino dalam rantai karbonnya. Hal ini menyebabkan chitosan bermuatan positif yang berlawanan dengan polisakarida yang lainnya (Whang et al. 2005). Chitosan merupakan polielektrolit netral pada pH asam. Bahan-bahan seperti protein, anion polisakarida, dan asam nukleat yang bermuatan negatif akan berinteraksi kuat dengan chitosan membentuk ion netral (Qin et al. 2005).
Chitosan mengandung cukup banyak gugus polisakarida setelah selulosa. Berat molekul chitosan 1,036 x 105 dalton. Berat molekul ini tergantung dari derajat deasetilasi yang dihasilkan pada saat ekstraksi. Semakin banyak gugus asetil yang hilang dari polimer chitin, maka semakin kuat interaksi interaksi antar ion dan ikatan hidrogen dan peroksida dari chitosan (Tamura et al. 2002). Chitin dan chitosan merupakan senyawa kimia yang mudah menyesuaikan diri, hidrofilik, memiliki reaktifitas kimia yang tinggi (karena mengandung gugus OH dan gugus NH2) untuk ligan yang bervariasi (sebagai bahan pewarna dan penukar
ion). Disamping itu ketahanan kimia keduanya cukup baik, yaitu chitosan larut dalam larutan asam tetapi tidak dalam larutan basa dan posisi silang chitosan memiliki sifat yang sama baiknya dengan chitin, serta tidak larut dalam media campuran asam dan basa (Prashanth dan Tharanathan 2007).
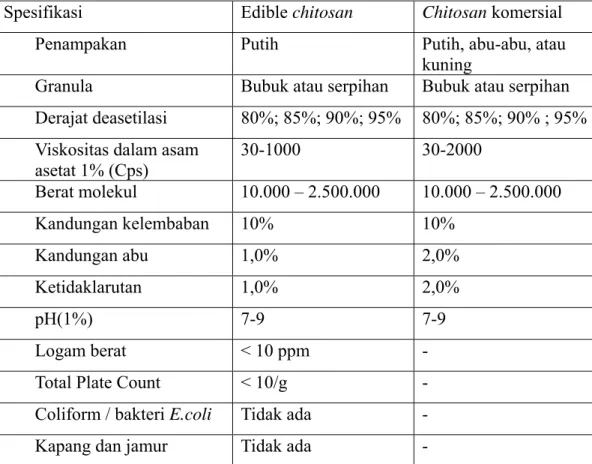
Pada umumnya, mutu chitosan ditentukan oleh beberapa parameter yaitu bobot molekul, kadar air, kadar abu, kelarutan, warna dan derajat deasetilasi. Standar mutu yang didasarkan pada spesifikasi dari PT. Vitalhouse, salah satu distributor chitin dan chitosan terbesar di Indonesia, untuk beberapa penerapan dan aplikasi disajikan pada Tabel 4.
Tabel 4. Syarat-syarat chitosan komersial
Spesifikasi Edible chitosan Chitosan komersial
Penampakan Putih Putih, abu-abu, atau
kuning
Granula Bubuk atau serpihan Bubuk atau serpihan
Derajat deasetilasi 80%; 85%; 90%; 95% 80%; 85%; 90% ; 95% Viskositas dalam asam
asetat 1% (Cps) 30-1000 30-2000 Berat molekul 10.000 – 2.500.000 10.000 – 2.500.000 Kandungan kelembaban 10% 10% Kandungan abu 1,0% 2,0% Ketidaklarutan 1,0% 2,0% pH(1%) 7-9 7-9 Logam berat < 10 ppm -
Total Plate Count < 10/g -
Coliform / bakteri E.coli Tidak ada -
Kapang dan jamur Tidak ada -
Sumber : Fu Zhou Corona Science & Technology Development Co., Ltd., 2007
Chitosan yang memiliki sifat reaktivitas kimia yang tinggi menyebabkan chitosan mampu mengikat air dan minyak. Hal ini didukung oleh adanya gugus polar dan non polar yang dikandungnya. Karena kemampuan tersebut, chitosan dapat digunakan sebagai bahan pengental atau pembentuk gel yang sangat baik, sebagai pengikat, penstabil, dan pembentuk tekstur. Chitosan memiliki
kemampuan yang sama dengan bahan pembentuk tekstur lain seperti CMC (Karboksi Metil Selulosa) dan MC (Metil Selulosa) yang dapat memperbaiki penampakan dan tekstur suatu produk karena memiliki daya pengikat air dan minyak yang kuat dan tahan panas (Tang et al. 2007).
2.3.6. Karakteristik chitosan sebagai desinfektan alami
Chitosan digunakan sebagai desinfektan/antibakteri dikarenakan beberapa sifat yang dimiliki yaitu kemampuannya dalam menghambat pertumbuhan mikroorganisme perusak dan kemampuannya dalam memberikan pelapisan terhadap produk sehingga meminimalkan interaksi antara produk dan lingkungannya. Berbagai hipotesa yang sampai saat ini masih berkembang mengenai mekanisme kerja chitosan sebagai pengawet adalah afinitas yang dimiliki oleh chitosan yang sangat kuat dengan DNA mikroba sehingga dapat berikatan dengan DNA yang kemudian mengganggu mRNA dan sintesa protein (Hadwiger dan Loschke 1978 diacu dalam Hardjito 2006).
Sifat aktifitas antimikroba dari chitosan dalam melawan bakteri tergantung dari berat molekul dan derajat deasetilasi. Berat molekul dan derajat deasetilasi yang lebih besar menunjukkan aktifitas antimikroba yang lebih besar (No et al. 2002). Chitosan sebagai polikationik amin akan berinteraksi dengan kutub negatif dari lapisan sel bakteri (Young dan Kauss 1983 diacu Chaiyakosha et al. 2007). Helander et al (2001) diacu Chaiyakosha et al.(2007) menyatakan bahwa reduksi sejumlah sel bakteri disebabkan oleh perubahan permukaan sel dan kehilangan fungsi pelindung dalam sel bakteri tersebut. Bakteri Gram negatif dengan lipopolisakarida dalam lapisan luarnya memiliki kutub negatif yang sangat sensitif terhadap chitosan. Dalam penelitiannya Tsai et al. (2002) menemukan bahwa chitosan dapat menghambat pertumbuhan Escherichia coli, adanya penghambatan ini disebabkan oleh adanya keelektronegatifan permukaan sel E. coli. Perubahan dalam potensial permukaan E.coli selama pertumbuhan, yaitu terjadinya peningkatan keelektronegatifan seiring dengan peningkatan umur sel, yaitu sampai pertumbuhan lambat, namun keelektronegatifan akan menurun setelah bakteri mencapai fase stasioner.
Di lain pihak, Simpson (1997) diacu Suptijah (2006) menyatakan bahwa chitosan dapat digunakan sebagai antibakteri dengan mekanisme sebagai berikut:
chitosan dapat berikatan dengan membran sel, diantaranya dengan glutamat yang merupakan komponen membran sel. Selain berikatan dengan protein membran, terutama fosfatidil kolin (PC) sehingga menyebabkan permeabilitas inner membran (IM) jadi meningkat dan dengan meningkatnya permeabilitas IM memberi jalan yang mudah untuk keluarnya cairan sel. Khususnya pada E. coli setelah 60 menit komponen enzim β-galaktosidase dapat terlepas, berarti dapat keluar dengan sitoplasma bahkan sambil membawa komponen metabolit yang lain, yang berarti terjadi lisis. Sehubungan dengan meningkatnya lisis maka tidak akan terjadi pembelahan sel (regenerasi), bahkan dapat sampai mati.
Wang (1992) menemukan bahwa aktifitas bakterisidal dari chitosan telah diobservasi dapat melawan beberapa bakteri gram negatif diantaranya adalah Escherichia coli. Dalam penelitiannya Chaiyakosha et al. (2007) menemukan bahwa chitosan dengan konsentrasi 150 ppm dan lama perendaman selama 5 menit mampu mengurangi bakteri Vibrio parahaemolyticus sebesar 90%.
2.4. Bakteri
Bakteri berasal dari kata latin bacterium yang berarti termasuk dalam kelompok besar dari organisme hidup. Bakteri berukuran sangatlah kecil (mikroskopik) dan kebanyakan bersifat uniselular (bersel tunggal), dengan struktur sel yang relatif sederhana tanpa nukleus/inti sel, cytoskeleton, dan organel lain seperti mitokondria dan kloroplas. Bakteri termasuk ke dalam jenis prokariota. Pada umumnya bakteri memiliki ukuran dengan diameter antara 0,5 – 1 µm (Kim et al. 2000).
Berdasarkan komposisi dan dinding sel, bakteri dibedakan menjadi bakteri gram negatif dan bakteri gram positif. Bakteri gram positif memiliki struktur dinding sel yang tebal (15-20µm) dan berlapis tunggal, dengan komposisi dinding sel terdiri atas lipid, peptidoglikan, dan asam tekoat. Kandungan lipid bakteri gram positif lebih rendah (1-4%). Peptidoglikan sebagai lapisan tunggal memiliki jumlah yang lebih dari 50% berat kering sel bakteri. Bakteri gram positif rentan terhadap penisilin, namun lebih resisten terhadap gangguan fisik. Persyaratan nutriennya relatif lebih rumit pada banyak spesies (Venkitanarayanan et al. 1999)
Pada bakteri gram negatif, struktur dinding sel berlapis tiga dengan ketebalan yang tipis (10-15nm). Komposisi dinding sel terdiri atas lipid dan
peptidoglikan dengan jumlah sekitar 10% dari berat kering. Kandungan lipid pada bakteri gram negatif cukup tinggi, yaitu 11-22%. Bakteri gram negatif umumnya kurang rentan terhadap penisilin dan kurang resisten terhadap gangguan fisik. Persyaratan nutriennya relatif sederhana dibandingkan dengan bakteri gram positif.
2.4.1. Identifikasi bakteri
Bakteri dapat diidentifikasi dengan berbagai metode, diantaranya adalah dengan menggunakan metode pengujian biokimia pada aktifitas mikroorganisme. Identifikasi dan pemisahan mikroorganisme dilakukan dengan berbagai alasan diantaranya adalah pengujian bakteri pathogen yang memungkinkan sebagai penyebab penyakit infeksi, seleksi dan isolasi dari strains mikroorganisme yang penting untuk beberapa industri, dan membandingkan aktifitas biokimia untuk tujuan mendapatkan taksonomi ( Cappuccino dan Sherman 2001).
Karakterisasi merupakan tahap pendahuluan yang penting sebelum dilakukan identifikasi. Karakterisasi merupakan dasar dalam identifikasi mikroba secara sistematik yang terdiri dari tiga tahap penting yaitu (a) klasifikasi mengelompokkan mikroorganisme ke dalam grup; (b) nomenklatur : menetapkan
nama ilmiah internasional yang tepat terhadap mikroorganisme dan (c) identifikasi penetapan organisme ke dalam klasifikasi yang diberi nama sesuai
nomenklatur (Fardiaz 1989).
Karakterisasi dapat dilakukan berdasarkan sifat sitologi (bentuk sel, gerak, sifat Gram, dan endospora), sifat pertumbuhan (morfologi, koloni, warna, bentuk dan penyebaran), serta sifat fisiologi (Prabaningtyas 2003). Pengujian lain yang banyak digunakan untuk identifikasi bakteri adalah pewarnaan Gram. Prinsip pewarnaan Gram adalah kemampuan dinding sel mengikat zat warna dasar (kristal violet) setelah pencucian dengan alkohol 96%. Hal ini berhubungan dengan komposisi senyawa penyusun dinding sel, yaitu pada bakteri Gram positif mengandung peptidoglikan lebih banyak daripada Gram negatif. Bakteri Gram positif terlihat berwarna ungu karena asam-asam ribonukleat pada sitoplasma sel-sel positif membentuk ikatan lebih kuat dengan kristal violet. Namun, sel-sel-sel-sel bakteri Gram negatif mempunyai kandungan lipid yang lebih tinggi dan umumnya
mudah larut oleh alkohol yang memperbesar pori-pori dinding sel. Dengan demikian pemucatan pada sel-sel Gram negatif lebih cepat (Hadioetomo 1985).
Keseluruhan reaksi kimia didefinisikan sebagai metabolisme selular, dan transformasi biokimia yang dapat terjadi baik diluar maupun didalam sel, berjalan dengan adanya katalisis biologi yang disebut sebagai enzim. Eksoenzim berperan pada substrat di bagian luar sel. Biasanya substrat dengan berat molekul yang tinggi tidak dapat melewati membran sel dan harus didegradasi menjadi molekul dengan berat molekul (BM) yang kecil untuk dapat melewati sel. Oleh karena itu tes aktifitas enzim ekstraseluler menunjukkan kemampuan mikroorganisme mengekskresi enzim hidrolitik ekstraseluler yang dapat mendegradasi polisakarida pati, lemak, kasein, dan gelatin. Amilase merupakan enzim yang digunakan dalam menghidrolisis pati. Lipase digunakan oleh bakteri untuk memecah komponen lemak, dan enzim protease digunakan untuk menghidrolisis kasein, sedangkan gelatinase adalah enzim yang dapat menghidrolisis gelatin (Cappuccino dan Sherman 2001). Endoenzim memiliki fungsi bekerja di dalam sel dan bertanggung jawab dalam sintesis protoplasma yang dibutuhkan dalam memproduksi energi selular dari material yang diasimilasi. Kemampuan sel yang berperan sebagai substrat nutrisi dapat menjadikan membran sel dalam mengindikasi keberadaan endoenzim yang dapat mengubah substrat kimia spesifik menjadi material lain yang lebih penting. Sehingga berdasarkan sifat tersebut dapat diketahui jenis bakteri yang sedang diuji.
Uji karakterisasi lain yang dapat digunakan untuk identifikasi bakteri adalah uji fisiologi. Uji fisiologi yang dapat dilakukan diantaranya uji hidrolisis pati, uji hidrolisis lemak, uji hidrolisis protein, uji fermentasi karbohidrat (laktosa, dekstrosa, dan sukrosa), uji fermentasi gula dan H2S, uji indole, uji methyl red, uji
Voges-Proskauer, uji sitrat, uji urease, uji reaksi susu litmus, uji katalase, dan uji oksidase (Prabaningtyas 2003).
Bakteri yang dapat menghidrolisis pati mempunyai aktifitas amilolitik yaitu menghasilkan enzim amilase yang menghidrolisis pati menjadi molekul-molekul maltosa, glukosa, dan dekstrin (Hadioetomo 1985). Jika bakteri dapat menghidrolisis pati, maka daerah sekeliling koloni akan menjadi bening kekuning-kuningan (Hartono 1995).
Bakteri yang dapat menghidrolisis protein adalah bakteri yang memproduksi enzim proteinase ekstraseluler. Semua bakteri mempunyai enzim proteinase di dalam sel namun tidak semua mempunyai enzim proteinase ekstraseluler. Selama fermentasi protein dihidrolisis menjadi turunannya seperti protease, pepton, peptide, dan asam amino (Winarno dan Fardiaz 1980).
Bakteri yang mampu menghidrolisis lemak menjadi senyawa sederhana yaitu asam lemak dan gliserol. Keadaan ini yang akan mengakibatkan bau dan rasa yang khas (Buckle et al 1978).
Uji fermentaasi karbohidrat digunakan untuk mengetahui kemampuan mikroorganisme dalam mendegradasi dan memfermentasi karbohidrat dengan memproduksi asam atau asam dan gas. Kebanyakan mikroorganisme memperoleh energi melalui reaksi enzimatis yang memacu bioksidasi dari substrat, terutama karbohidrat (Cappuccino dan Sherman 2001).
Triple Sugar Agar (TSIA) merupakan medium yang digunakan untuk mengetahui pembentukan asam. TSIA adalah media agar yang mengandung tiga macam gula yaitu galaktosa, laktosa, sukrosa, indikator merah fenol, dan FeSO4.
Konsentrasi glukosa adalah 1/10 dari konsentrasi laktosa atau sukrosa agar fermentasi glukosa saja yang dapat terlihat (Lay 1994). Jika glukosa dapat difermentasi maka kemungkinan terdapat fermentasi glukosa lain seperti monosakarida selain glukosa, disakarida (maltosa, laktosa, atau sukrosa dan lainnya) serta polisakarida. Untuk uji H2S juga digunakan media yang
mengandung sulfur dan ion Fe2+. Pada saat bakteri ditumbuhkan dalam media yang kaya akan asam amino mengandung sulfur seperti TSIA maka terjadi desulfurase membentuk H2S.Fe2+, kemudian H2S.Fe2+ bereaksi dengan asam
sulfide menghasilkan senyawa FeS yang berwarna hitam dan tidak larut air.
Uji sitrat dapat menggunakan sitrat-Koser berupa medium cair atau medium sitrat-Simon berupa medium padat. Simon citrate Agar merupakan medium sintetik dengan Na-sitrat sebagai satu-satunya sumber karbon, NH4+ sebagai sumber N dan brom thymol blue sebagai indikator pH, sedangkan medium sitrat-Koser tidak mengandung indikator. Bila mikroorganisme mampu menggunakan sitrat, maka asam akan dihilangkan dari medium biakan, sehingga menyebabkan peningkatan pH dan mengubah warna medium dari hijau menjadi
biru. Perubahan warna dari hijau menjadi biru menunjukkan bahwa mikroorganisme mampu menggunakan sitrat sebagai satu-satunya sumber karbon (Cappucino dan Sherman 2001).
Uji methyl red bertujuan untuk mengetahui konsentrasi asam yang diproduksi oleh mikroorganisme sebagai hasil akhir pada fermentasi glukosa. Heksosa monosakarida glukosa merupakan substrat utama yang dioksidasi oleh semua organisme enteric sebagai sumber energinya. Uji urease bertujuan untuk mengetahui kemampuan mikroorganisme dalam mendegradasi urea atau menghasilkan enzim urease. Enzim urease merupakan enzim hidrolisis yang memecah ikatan nitrogen dan karbon pada komponen amida seperti urea dan membentuk amonia yang menciptakan suasana basa (Lay 1994).
2.4.2. Escherichia coli
Bakteri koliform dapat dibedakan atas dua grup, yaitu koliform fekal, misalnya Escherichia coli, dan koliform non fekal, misalnya Enterobacter aerogenes. Escherichia coli disebut sebagai koliform fekal karena hidup secara normal di dalam saluran pencernaan hewan dan manusia, sedangkan Enterobacter aerogenes biasanya pada hewan atau tanaman yang telah mati (Fardiaz 1992).
Escherichia coli dikelompokkan ke dalam famili Enterobacteriaceae. Escherichia coli adalah suatu bakteri gram negatif berbentuk batang dengan ukuran 1,1 – 1,5 µm x 2,0-6,0 µm (Suhartono et al. 1995).
Sel Escherichia coli terdapat dalam bentuk tunggal/berpasangan, bersifat motil dan flagella peritikrit atau nonmotil, tidak membentuk spora (Hariyadi 2003) dan bersifat anaerobik fakultatif (Fardiaz 1989).
Sharma dan Demirci (2003) menyatakan bahwa Aktivitas air (Aw) minimal
yang memungkinkan pertumbuhan Escherichia coli adalah 0,96, sedang pertumbuhan optimum dicapai pada Aw 0,995. Nilai pH optimum pertumbuhan
Escherichia coli adalah 6,0-8,0; dengan pH minimum 4,3-4,4 dan pH maksimum 9,0-10; sedangkan suhu optimum untuk pertumbuhan Escherichia
coli 37-41°C, dengan suhu minimum 3-10°C dan suhu maksimum 48-50°C. bakteri ini relatif sensitif terhadap panas dan dapat diinaktifkan pada suhu pasteurisasi selama pemasakan.
Escherichia coli merupakan flora normal di usus. Meskipun demikian beberapa jenis Escherichia coli dapat bersifat pathogen, yaitu serotipe-serotipe yang masuk ke dalam golongan Escherichia coli enteropatogenik, Escherichia coli enteroinvasif dan Escherichia coli enterotoksigenik menimbulkan gangguan gastrointestinal (Fardiaz 1989).
Mikroorganisme yang dapat digunakan sebagai indikator sanitasi dalam pengolahan pangan adalah mikroorganisme yang umum terdapat dalam kotoran manusia maupun hewan. Mikroorganisme yang sering digunakan sebagai indikator sanitasi dalam makanan adalah bakteri koliform, terutama koliform fekal/koliform kotoran (Escherichia coli), Streptokoki fekal dan Clostridium perfringens. Adanya mikroorganisme indikator di dalam suatu makanan menunjukkan terjadi kontaminasi kotoran dan kondisi sanitasi yang tidak baik selama persiapan maupun pengolahannya (Fardiaz 1992). Bakteri yang paling banyak digunakan sebagai indikator sanitasi adalah Escherichia coli, karena bakteri ini adalah bakteri komensal yang terdapat pada usus dan umumnya merupakan bakteri pathogen penyebab penyakit (Hariyadi 2003).
Miret et al. (2006) menyatakan bahwa adanya bakteri Escherichia coli di dalam makanan dan minuman menunjukkan kemungkinan adanya mikroorganisme yang bersifat enteropatogenik dan enterotoksigenik yang berbahaya bagi kesehatan. Menurut Hariyadi (2003) adanya Escherichia coli dalam air minum menunjukkan bahwa air minum itu pernah terkontaminasi kotoran manusia dan mungkin dapat mengandung pathogen usus. Sumber kontaminasi bakteri Escherichia coli kemungkinan besar berasal dari air yang digunakan pada proses pengolahan.
Keracunan makanan yang disebabkan oleh Escherichia coli enteropatogenik (EPEC) biasanya disebabkan oleh konsumsi air atau makanan yang terkontaminasi oleh Escherichia coli penyebab enteritis. EPEC berbeda dari Escherichia coli yang secara normal terdapat di dalam usus besar. EPEC mempunyai antigen spesifik tertentu dan menyebabkan gastroenteritis akut dan enteritis seperti disentri pada manusia. Escherichia coli yang bersifat invasifit atau disebut juga EIEC (Enteroinvasif Escherichia coli), dan Escherichia coli enterotoksigenik (ETEC) termasuk ke dalam golongan EPEC. Enterotoksin yang
diproduksi oleh ETEC dapat dibedakan atas dua macam yaitu enterotoksin yang tahan panas (disebut ST yaitu Stabile Toxin) dan enterotoksin yang tidak tahan panas (disebut LT yaitu Labile Toxin). ST masih aktif setelah pemanasan pada suhu 100°C selama 30 menit. Bakteri yang bersifat enterotoksigenik memproduksi salah satu atau kedua macam toksin tersebut (Fardiaz 1989).
2.5. Chromocult
Chromocult merupakan agar selektif untuk deteksi total koliform dan Escherichia coli dalam sampel bahan. Dalam hal ini, interaksi antara pepton selektif, pyrufat, sorbitol dan buffer fosfat mendorong pertumbuhan koloni secara cepat, meskipun dapat melukai bakteri coliform namun bakteri ini tetap dapat tumbuh. Pertumbuhan bakteri gram positif dihambat oleh kandungan tergitol sehingga tidak dapat tumbuh sebaik bakteri gram negatif. Komposisi dari chromocult adalah pepton, sodium klorida, sodium dihidrogen fosfat, di-sodium hidrogen fosfat, sodium pirufat, triptofan, agar-agar, sorbitol, tergitol, dan campuran chromogenic (Merck 2002).
Media chromocult menggunakan substrat X-glucuronida untuk identifikasi keberadaan bakteri Escherichia coli. Enzim D-galactosidase pada bakteri E. coli memiliki kemampuan dalam memotong substrat Salmon-GAL dan X-glucoronide menjadi h-glucoronidase, sehingga koloni yang positif dapat memiliki warna biru gelap hingga violet. Hal ini yang memudahkan membedakan Escherichia coli dengan bakteri koliform yang lainnya, dimana D-galactosidase pada bakteri koliform lainnya hanya memotong substrat Salmon-GAL sehingga membentuk h-galactosidase dan menyebabkan terbentuknya warna merah pada koloni koliform (Finney et al. 2003).
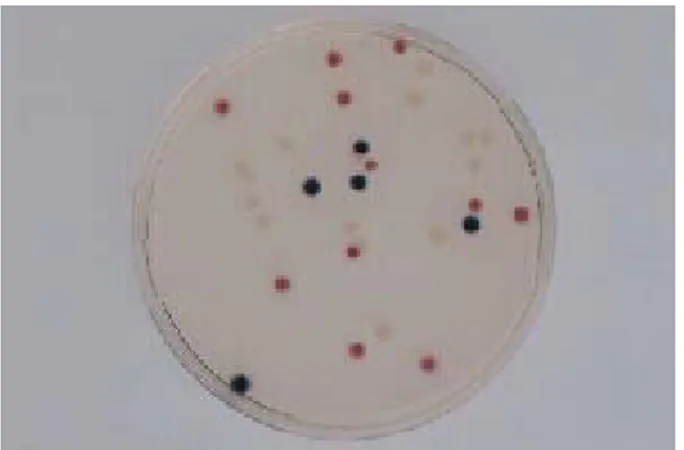
Dalam kajiannya Finey et al. (2003) menginokulasikan medium dengan menggunakan metode cawan tuang dengan menyebarkan materi sampel dalam permukaan cawan, selanjutnya diinkubasi selama 24 jam dengan suhu 35-37°C. Keberadaan Escherichia coli dapat dideteksi dengan adanya warna biru gelap hingga ungu dikarenakan adanya reaksi Salmon-GAL dan reaksi X-glucuronide. Gambar bakteri yang terdeteksi dalam media chromocult dapat dilihat pada Gambar 5.
Gambar 5. Bakteri yang teridentifikasi pada media chromocult a. merah (Citrobacter freunii)
b. biru (Escherichia coli)
3. METODOLOGI
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2008 sampai April 2008. Pelarutan chitosan dalam asam asetat, identifikasi jenis bakteri dan proses pengujian efektifitas desinfektan alami dari chitosan sebagai pereduksi bakteri Escherichia coli dan bakteri lainnya yang teridentifikasi pada media chromocult dilakukan di laboratorium Biologi Sel dan Jaringan Hewan 2, Departemen Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia, Cibinong.
3.2. Bahan dan Alat
Bahan yang digunakan adalah chitosan dengan DA (degree of acetylation) 86,64 % dan berat molekul (Mw) sebesar 161 Dalton diperoleh dari PT. Vitalhouse Indonesia, dan asam asetat 2% yang digunakan untuk melarutkan chitosan, spesifikasi chitosan secara lengkap dapat dilihat pada Lampiran 1. Bahan-bahan lain yang digunakan adalah udang galah (Macrobrachium rosenbergii) dan sampel air tambak yang merupakan habitat hidup udang galah yang diperoleh dari tambak udang galah di Ciapus, Kabupaten Bogor. Selain itu, digunakan pula biakan Escherichia coli NBRC 14237 yang diperoleh dari Japan National Biotechnology Research Centre. Media yang digunakan dalam pengujian adalah chromocult, Nutrient Agar (NA), Nutrient Broth (NB), starch agar, tributryn agar, milk agar, gelatin, phenol red lactose broth, phenole red dextrose, phenol red sucrose broth, triple sugar iron (TSI) agar, SIM agar, kovacs reagent, MR-V broth, methyl red indicator, Barritt’s reagen A dan B, Simmons citrate agar, urea broth, litmus milk broth, trypticase nitrate broth, sulfanilic acid,
alpha-napthylamine, zinc powder, H2O2, p-aminodimethylaniline oxalate
(Difco 0329-13-9), air steril, alkohol 70%, kristal violet, lugol, safranin, dan minyak emersi.
Alat-alat yang diperlukan antara lain becker plastik, aluminium foil, becker glas besar untuk merendam udang, tips steril, tabung durham, tabung gelas, pipet, jarum ose, cawan petri, disposable petri, bunsen api, vortex, shaker dengan suhu 37°C, labu erlenmeyer, buret, labu takar, gelas ukur, tabung corning, pipet
mikro, gelas pengaduk, sudip, bulb, inkubator suhu 37° C, mikroskop, serta autoklaf yang digunakan untuk mensterilkan alat-alat tersebut.
3.3. Metode Penelitian
Metode penelitian mencakup tahap penelitian pendahuluan dan tahap penelitian utama. Tahap penelitian pendahuluan meliputi tahap identifikasi bakteri pada sampel air tambak yang merupakan habitat udang galah, dan pada udang galah segar tanpa perlakuan dengan menggunakan media chromocult. Penelitian utama terdiri atas beberapa tahap diantaranya tahap pengamatan morfologi terhadap biakan Escherichia coli NBRC 14237 yang digunakan untuk mengkontaminasi udang galah segar, dilanjutkan dengan persiapan inokulasi, inokulasi E. coli pada udang yang bertujuan untuk menseragamkan jumlah bakteri E. coli awal pada udang, perlakuan desinfektasi dengan menggunakan chitosan pada berbagai konsentrasi dan lama perendaman, pengujian mikrobiologis, dan evaluasi efektifitas chitosan, serta uji organoleptik.
3.3.1. Penelitian Pendahuluan
3.3.1.1. Identifikasi bakteri dalam air tambak
Air sampel diperoleh dari tambak udang, tempat sampel udang diambil. Air diambil dan diletakkan pada tabung yang tertutup rapat. Kemudian air dalam tabung diletakkan dalam kantung plastik yang telah diisi es. Tabung dipastikan dalam kondisi terendam oleh es sehingga meminimalkan pertumbuhan bakteri yang ada di dalamnya serta mencegah terjadinya kontaminasi bakteri yang lainnya. Air tersebut selanjutnya dibawa ke laboratorium untuk mengetahui identifikasi bakteri yang terdapat didalamnya.
Metode selanjutnya mengacu pada penelitian Finney et al. (2003) dimana sampel air tambak dipipet sebanyak 1 ml dan dilarutkan ke dalam 9 ml larutan aquades steril untuk mendapatkan pengenceran 10-1 kemudian dihomogenasi dengan menggunakan vortex, selanjutnya larutan dipipet kembali sebanyak 1 ml dan dilarutkan kembali ke dalam 9 ml larutan aquades steril sehingga didapatkan pengenceran 10-2. Proses ini terus diulang hingga didapatkan pengenceran 10-6. Pada setiap pengenceran, diambil 1 ml larutan dengan menggunakan pipet steril untuk kemudian dipupukkan pada media chromocult sebanyak 20 ml pada cawan
petri dan diinkubasi pada suhu 37°C selama 24 jam. Semua proses dilakukan dalam keadaan aseptis dan steril.
Tahap selanjutnya yang merupakan tahap identifikasi bakteri mengacu pada Cappucino dan Sherman (2001) diawali dengan mengisolasi koloni bakteri dengan berbagai warna yang tumbuh pada media chromocult untuk kemudian diuji reaksi biokimianya sehingga didapatkan identifikasi bakteri hingga level genus. Uji yang dilakukan adalah uji aktifitas enzim ekstraseluler (uji amilase, lipase, dan protease), uji fermentasi karbohidrat, uji triple sugar-iron (TSI) agar, uji IMVIC (uji produksi indole, uji methyl red, uji voges-proskaeur, uji citrate utilization, uji hydrogen sulfide, uji urease, uji reduksi nitrat, uji katalase dan oksidase.
3.3.1.2. Identifikasi bakteri dalam udang galah segar (Finney et al. (2003)
Udang diambil dari tambak dengan sistem transportasi dingin untuk menjaga kesegaran udang. Udang dicuci dengan air steril dan ditimbang sebanyak 5 gram kemudian dihancurkan dengan menggunakan blender steril dengan penambahan 50 ml air steril (pengenceran desimal 10-1) dan dilakukan pengenceran desimal hingga 10-6 dengan cara pada pengenceran 10-1 dipipet sebanyak 1 ml larutan dan dimasukkan pada 9 ml larutan akuades steril. Setiap pengenceran desimal dipipet 1 ml larutan dengan menggunakan pipet steril untuk dipupukkan pada 20 ml media chromocult dalam cawan petri dan diinkubasi pada suhu 37°C selama 24 jam. Beberapa bakteri yang tumbuh pada media chromocult dihitung jumlahnya dan diidentifikasi untuk mengetahui jenis bakteri hingga level genus secara biokimia.
3.3.1.3. Identifikasi genus bakteri dengan uji biokimia (Cappucino dan Sherman 2001)
Beberapa uji yang dilakukan adalah uji aktifitas enzim ekstraseluler (uji amilase, lipase, dan protease), uji fermentasi karbohidrat, uji Triple Sugar-Iron (TSI) agar, uji IMVIC (uji produksi indole, uji Methyl Red, uji Voges-Proskaeur, uji Citrate Utilization), uji Hydrogen Sulfide, uji urease, uji reaksi Litmus Milk, uji reduksi nitrat,uji katalase dan oksidase. Setelah dilakukan karakteristik bakteri
maka didapatkan identifikasi genus bakteri yang mengacu pada sistem penarikan taksonomi menurut Bergey’s manual (1974).
a. Uji aktivitas enzim ekstraseluler
Uji aktivitas enzim ekstraseluler terdiri atas empat uji dimana diantaranya adalah uji amilase ( menghidrolisa pati), uji lipase (menghidrolisa lemak), dan uji protease (menghidrolisa protein).
Uji amilase dilakukan dengan cara menumbuhkan mikroorganisme yang akan diuji pada medium cair trypticase soy selama 24-48 jam. Kemudian sebanyak 1 ose mikroorganisme tes digoreskan pada medium starch agar, dan diinkubasi dengan posisi terbalik selama 24-48 jam pada 37°C. Setelah itu larutan iodine dituangkan pada petri dan dibiarkan selama 30 detik dan sisa larutan yang masih ada dibuang. Jika hasil akhir menunjukkan pembentukan zona bening didekat daerah pertumbuhan bakteri maka bakteri tersebut positif memiliki enzim amilase.
Pengujian ada tidaknya enzim lipase yang digunakan oleh bakteri dalam menghidrolisa lemak dilakukan dengan cara 1 ose mikroorganisme yang telah ditumbuhkan dalam medium cair trypticase soy selama 24-48 jam digoreskan pada medium tributyrin agar, dan diinkubasi dengan posisi terbalik selama 24-48 jam pada 37oC. Zona yang terbentuk diamati apakah terbentuk zona terang atau zona dari lipolisis di sekitar pertumbuhan mikroorganisme.
Pengujian selanjutnya pada keberadaan enzim ekstraseluler ini adalah uji keberadaan enzim protease yang digunakan oleh bakteri dalam menghidrolisis protein. Pengujian ini dilakukan dengan cara 1 ose mikroorganisme yang telah ditumbuhkan dalam medium cair trypticase soy selama 24-48 jam digoreskan pada medium milk agar dan diinkubasi pada posisi terbalik selama 24-48 jam dengan suhu 37°C. Selanjutnya diamati adanya zona terang atau zona dari proteolisis sekitar pertumbuhan mikroorganisme yang menunjukkan bahwa bakteri tersebut positif memiliki enzim protease.
b. Fermentasi karbohidrat
Uji fermentasi karbohidrat ini dilakukan dengan cara 1 ose mikroorganisme yang telah ditumbuhkan dalam medium cair trypticase soy
selama 24-48 jam diinokulasikan pada masing-masing medium cair yang diletakkan dalam tabung durham yaitu phenol red lactose broth, phenol red dextrose atau glucose broth,dan phenol red sucrose broth dan diinkubasi selama 24 jam pada suhu 37°C, kemudian diamati perubahan warna dan ada tidaknya gas. c. Uji triple sugar-iron (TSI) agar
Pengujian ini dilakukan dengan cara 1 ose mikroorganisme yang telah ditumbuhkan dalam medium cair trypticase soy selama 24-48 jam diinokulasikan pada medium TSI agar miring dengan cara slab dan digores. Tabung kemudian ditutup setengah rapat dan diinkubasi selama 19-24 jam pada 37°C.
Selanjutnya diamati perubahan warna pada permukaan dan dalam medium. Kemudian dideterminasi tipe reaksi apakah asam, basa, atau tidak bereaksi serta jenis karbohidrat yang difermentasikan (dekstrosa, laktosa, sukrosa). Selain itu diamati pula adanya endapan hitam yang merupakan akumulasi H2S pada
medium. d. Uji IMViC
Pengujian ini terdiri atas uji indole production test, methyl red test, Voges-Proskaeuer test, dan citrate utilization test. Indole production test dilakukan dengan cara 1 ose mikroorganisme yang telah ditumbuhkan dalam medium cair trypticase soy selama 24-48 jam diinokulasikan pada SIM agar deep tube, dan diinkubasikan selama 24-48 jam pada suhu 37°C. Kemudian hasil yang didapatkan ditambahkan dengan 10 tetes Kovac’s reagen ke dalam tabung kultur dan dikocok secara perlahan dan diamati perubahan warna reagen dan dianalisa apakah mikroorganisme tes berkemampuan menghidrolisa tryptofan.
Methyl red test dilakukan dengan cara 1 ose mikroorganisme yang telah ditumbuhkan dalam medium cair trypticase soy selama 24-48 jam diinokulasikan pada MR-V broth dan diinkubasi selama 24-48 jam pada 37°C. Selanjutnya sepertiga kultur dipindahkan ke tabung baru untuk pengujian Voges-Proskaeur test dan sisa kultur ditambahkan dengan 5 tetes indikator methyl red.
Sepertiga kultur pada methyl red test yang digunakan untuk Voges-Proskaeur test kemudian ditambahkan 1 tetes Barritt’s reagent A dan dicampur, selanjutnya ditambahkan kembali dengan 10 tetes Barritt’s reagent B dan