TUGAS KIMIA FISIKA (ENCH600006)
Dosen: Dr. Ir. Setiadi, M.Eng Jurusan Teknologi Bioproses
KONSEP LARUTAN DAN KESETIMBANGAN FASA:
DIAGRAM FASA, STABILITAS FASA, TRANSISI FASA, TERMODINAMIKA CAMPURAN, SIFAT-SIFAT LARUTAN, DAN SISTEM DUA KOMPONEN
Oleh:
Andre Fahriz Perdana Harahap (HP. 082165028325) Teknologi Bioproses 2014 (NPM. 1406605843)
Gugum Permana (HP. 085974921191)
Teknologi Bioproses 2014 (NPM. 1406576143)
Putty Eka Dewi (HP. 081213700991)
Teknologi Bioproses 2014 (NPM. 1406533535)
Nur Annisa (HP. 081511273451)
Teknologi Bioproses 2014 (NPM. 1406605862)
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK UNIVERSITAS INDONESIA DEPOK
Puji syukur kehadirat Tuhan Yang Maha Esa karena limpahan rahmat dan karunia-Nya penulis dapat menyelesaikan makalah yang membahas tentang penyelesaian soal-soal berkaitan dengan konsep larutan dan kesetimbangan fasa ini. Penulis mengucapkan terimakasih kepada segala pihak yang telah berpartisipasi atas penyelesaian makalah ini, khususnya kepada dosen kami, Bapak Dr. Ir. Setiadi, M.Eng sebagai pembimbing utama mata kuliah Kimia Fisika, beserta asisten yang telah ikut membantu penyelesaian makalah ini.
Makalah tugas penyelesaian soal-soal ini berjudul “Konsep Larutan dan Kesetimbangan Fasa: Diagram Fasa, Stabilitas Fasa, Transisi Fasa, Termodinamika Campuran, Sifat-Sifat Larutan, dan Sistem Dua Komponen” ini dipersiapkan dalam rangka memenuhi tugas mata kuliah Kimia Fisika di Jurusan Teknologi Bioproses Universitas Indonesia tahun 2015. Makalah tugas penyelesaian soal ini berisi penyelesaian soal-soal pilihan dari buku acuan Atkins edisi VIII serta beberapa soal analisis dari dosen mata kuliah Kimia Fisika Departemen Teknik Kimia FTUI 2015.
Kami menyadari masih terdapat banyak kekurangan dalam penyusunan makalah tugas penyelesaian soal ini, oleh karena itu atas segala kekurangan kami memohon maaf yang sebesar-besarnya. Kami memohon kritik dan saran agar kiranya dapat memperbaiki penulisan kami selanjutnya. Semoga makalah tugas penyelessaian soal ini dapat bermanfaat bagi siapapun yang menggunakannya. Amin.
Depok, 1 Oktober 2015
Kelompok 4
1. Massa jenis larutan aqueous (larutan yang pelarutnya adalah air) tembaga (II) sulfat pada suhu 20˚C diukur sebagaimana tercantum dalam tabel di bawah ini. Tentukan dan plot volume molar parsial dari CuSO4 dalam rentang pengukurannya.
m(CuSO4)/g 5,000 10,000 15,000 20,000 ρ/(g cm-3) 1,051 1,107 1,167 1,230
Secara teoritis, volume molar parsial dari substansi C dalam suatu campuran adalah perubahan volume per mol C yang ditambahkan ke dalam volume suatu campuran yang besar. Volume molar parsial, Vc, dari substansi C pada beberapa komposisi umum dapat didefenisikan melalui formula:
Vc = (V/nc)p,T,n’
Karena untuk menghitung volume molar parsial tembaga (II) sulfat diperlukan data mol air yang konstan, maka terlebih dahulu dilakukan penyesuaian terhadap massa air dalam larutan. Massa air penyesuaian yang tepat digunakan harus mendekati massa larutan, oleh karena itu ditetapkan massa air sebesar 100,0 g. Untuk mw sebesar 100,0 g, maka nw sebesar (100,0 g)( 1 mol/18,01 gr) = 5,552 mol. Berat molekul CuSO4 diketahui 159,60 g/mol. Diketahui pula massa jenis pelarut air murni sebesar 0,997 g/cm3 pada 20˚C. Selanjutnya dibentuk tabel untuk mempermudah perhitungan:
mc (g) mw (g) mc’ (g) mw’ (g) nc (mol) nw (mol) Xc V (cm3) 0,000 100,000 0,000 100,000 0,00000 5,552 0,0000 100,301 5,000 95,000 5,263 100,000 0,03298 5,552 0,0059 100,155 10,000 90,000 11,111 100,000 0,06962 5,552 0,0124 100,371 15,000 85,000 17,647 100,000 0,11057 5,552 0,0195 100,811 20,000 80,000 25,000 100,000 0,15664 5,552 0,0274 101,626 dengan menggunakan aplikasi pembuatan grafik polinomial berderajat dua pada Microsoft Excel 2010, diperoleh grafik berikut:
Persamaan garis polinomial orde dua yang diperoleh adalah: v = 87,293 x2 – 4,9871 x + 100,28
dimana v = V dalam satuan cm3 dan x = nC dalam satuan mol. Karena volume molar parsial merupakan perubahan volume per mol C yang ditambahkan, maka dengan mendiferensialkan persamaan diatas, diperoleh persamaan volume molar parsial:
Vc (cm3/mol)= 174,586 x – 4,9871
Berdasarkan persamaan volume molar parsial di atas, dapat dihitung volume molar parsial CuSO4 dalam rentang pengukuran sebagai berikut:
nC (mol) Xc Vc (cm3/mol)
0,06962 0,0124 7,1676
0,11057 0,0195 14,3169
0,15664 0,0274 22,3601
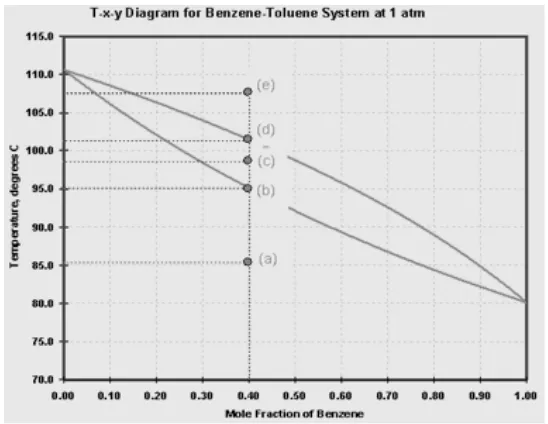
2. Dalam diagram T-xy untuk sistem benzena-toluena pada tekanan 1 atm terlihat seperti pada gambar di bawah ini.
Gambar 1. Diagram T-xy-benzene/Toluena
a) Jelaskan tiap-tiap titik pada grafik, mulai dari titik (a) hingga titik (e).
b) Perkirakan komposisi benzena dan toluena pada tiap titik dari titik (a) hingga titik (e).
Diagram fase di atas secara umum menunjukkan hubungan perubahan komposisi (fraksi mol benzena) dan temperatur selama distilasi berlangsung dari titik a hingga titik e pada tekanan konstan sebesar 1 atm. Pada diagram di atas dapat dianalisis masing-masing fraksi uap dan fraksi cair benzena pada campuran benzena-toluena dengan fraksi mol benzena sebesar 0,40 (fraksi mol toluena sebesar 0,60).
Titik (a): Pada temperatur ini (86 ˚C), larutan masih berada dalam fasa cair sehingga tidak ada fraksi uap sama sekali.
Titik (b): Pada temperatur ini (95,2 ˚C), larutan masih berada dalam fasa cair, namun mulai terbentuk gelembung (bubble) uap yang pertama. Larutan tepat mulai menguap sehingga disebut juga bubble point.
Titik (c): Pada temperatur ini (98 ˚C), larutan berada dalam fasa kesetimbangan antara uap dan cair sehingga dalam sistem akan ditemukan dua fasa ini. Penguapan akan terus berjalan selama panas ditambahkan.
Titik (d): Pada temperatur ini (101,6 ˚C), larutan sudah berada dalam fasa uap, namun masih terdapat tetesan fasa cair yang terakhir sehingga disebut juga dew point.
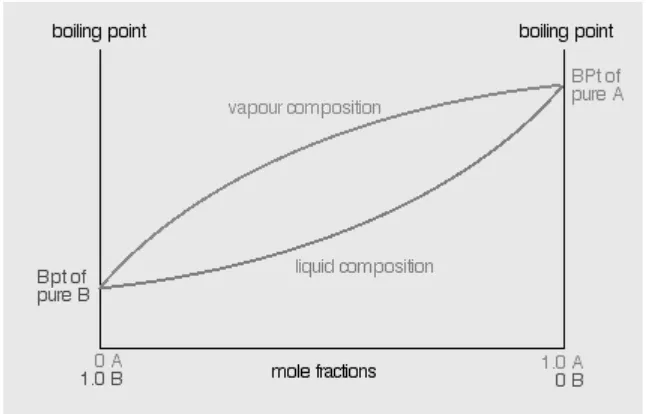
Gambar 2. Diagram komposisi uap-cair suatu campuran AB
Gambar 3. Diagram kurva komposisi uap dan cair suatu campuran AB
Diagram di atas dapat menjadi referensi untuk menentukan fraksi uap dan cair dari benzena. Pada titik (a), karena larutan berada dalam fasa cair, maka untuk benzena x=0,40 dan y=0,00. Pada titik (b), dapat dilihat pada kurva komposisi cair menunjukkan x=0,40 dan pada kurva komposisi uap menunjukkan y=0,61. Pada titik (c), dapat dilihat pada kurva komposisi cair menunjukkan x=0,31 dan pada kurva komposisi uap menunjukkan y=0,52. Pada titik (d), dapat dilihat pada kurva komposisi cair menunjukkan x=0,21 dan pada kurva komposisi uap menunjukkan y=0,40. Pada titik (e), karena larutan berada dalam fasa uap, maka untuk benzena x=0,00 dan y=0,40.
toluena adalah 0,60. Pada titik (a), karena larutan berada dalam fasa cair, maka untuk toluena x=0,60 dan y=0,00. Pada titik (b), berdasarkan hubungan dengan fraksi uap-cair benzena, diperoleh x=0,60 dan y=0,39. Pada titik (c), berdasarkan hubungan dengan fraksi uap-cair benzena, diperoleh x=0,69 dan y=0,48. Pada titik (d), berdasarkan hubungan dengan fraksi uap-cair benzena, diperoleh x=0,79 dan y=0,60. Pada titik (e), karena larutan berada dalam fasa uap, maka untuk toluena x=0,00 dan y=0,60.
3.
Berikut merupakan diagram kesetimbangan uap-cair sistem biner masing-masing untuk : etanol-metilbenzoat, etanol-2-propanol, etanol—1,2 etanadiol dan etanol-dimetil karbonat. Dari keempat diagram kesetimbangan fasa tersebut, analisalah tingkat kemudahan dan kesulitan pemisahannya? Campuran manakah yang relatif lebih mudah untuk dipisahkan dengan teknik destilasi? Jelaskan jawaban Anda.Gambar 4 : Diagram XY untuk berbagai campuran berbasis etanol
liquidnya. Hal tersebut menunjukan bahwa ikatan antar molekul Etanol- Metil Benzoat rendah sehingga ia cenderung berbentuk uap atau gas dan mudah untuk dipisahkan. Pada grafik kedua, yaitu grafik Etanol- 2-Propanol, dapat dilihat bahwa garis pada grafik cenderung lurus. Komposisi uap atau gas dan komposisi liquid atau cairan dari Etanol- 2-Propanol hampir sama. Hal tersebut menunjukan bahwa ikatan antar molekul zat ini tidak cukup lemah untuk dijadikan gas tetapi tidak cukup kuat pula untuk bertahan sebagai cairan atau liquid. Hal ini menyebabkan campuran Etanol- 2-Propanol sangat sulit untuk dipisahkan dalam kasus ini. Pada grafik ketiga, yaitu grafik Etanol- 1,2- Etanadiol, dapat dilihat bahwa kecenderungan zat tersebut untuk menjad gas lebih banyak dibandingkan menjadi liquid atau cairan. Sama seperti zat yang pertama (Etanol- Metil Benzoat), ikatan yang dimiliki antar molekulnya lemah sehingga ia cenderung menjadi gas dan mudah untuk dipisahkan. Pada grafik terakhir, yaitu grafik Etanol- Dimetil Karbonat, zat ini tidak langsung memiliki komposisi gas yang tinggi ataupun komposisi liquid yang rendah. Grafik terakhir tidak memiliki garis yang lurus sehingga tidak dapat dikatakan bahwa kemampuannya untuk berpisah atau tidak sama. Mula- mula, komposisi gas pada Etanol- Dimetil Karbonat lebih besar dari komposisi cairan atau liquidnya, tetapi pada satu titik hal tersebut berbalik dimana komposisi liquid lebih besar dari komposisi gasnya. Hal ini menunjukan bahwa Etanol- Dimetil Karbonat sulit untuk dipisahkan. Dari analisa keempat grafik, diketahui bahwa urutan kemudahan pemisahan zat- zat tersebut ialah sebagai berikut: Metil Benzoat > 1,2-Etanadiol > Dimetil Karbonat > Etanol-2-Propanol.
Distilasi atau penyulingan merupakan metode pemisahan berdasarkan perbedaan kecepatan atau kemudahan menguap. Dalam metode ini, campuran zat dididihkan sehingga menguap, dan uap ini kemudian didinginkan kembali ke dalam bentuk cairan. Zat yang mudah dipisahkan dengan metode ini ialah zat yang memiliki titik didih rendah, yaitu zat yang memiliki ikatan yang lemah antar molekulnya. Dengan begitu, zat yang paling mudah untuk dipisahkan dengan teknik atau metode distilasi dalam kasus ini adalah Etanol- Metil Benzoat, karena ia memiliki kecenderungan untuk menjadi uap yang lebih tinggi dibandingkan zat lainnya (Etanol-2-Propanol, Etanol- 1,2- Etanadiol dan Etanol- Dimetil Karbonat)
4. Tekanan uap benzena antara suhu 10˚C dan 30˚C memenuhi persamaan log(p/Torr)= 7,960 – 1780/(T/K). Hitunglah (a) entalpi penguapan dan (b) titik didih normal benzena.
Berdasarkan persamaan Clausius-Clapeyron untuk variasi tekanan uap dan temperatur, d ln p
dT = ∆vapH R T2
Dengan menyusun persamaan di atas untuk memperoleh persamaan logaritma, diperoleh,
log p = k - ∆vapH 2,303 R T
∆vapH = 2,303 x 1780K x 8,314 J/K mol = 34,080 K J/mol
Titik didih normal benzena dapat diperoleh dengan menyelesaikan persamaan p(T) untuk temperatur dimana p(T) = patmosfer dimana pada tekanan atmosfer, patmosfer = 1,00 atm = 760 torr.
log(760 torr/ torr) = 7,960 – 1780/(T/K) T ˚ = 1780
7,960− log 760=350,4 K ≈ 77,4 ˚C
Nilai berdasarkan perhitungan tersebut dapat diterima karena cukup mendekati titik didih benzena murni sebesar 80,1 ˚C.
5. Tekanan uap suatu cairan antara suhu 15˚C dan 35˚C memenuhi persamaan log(p/Torr)= 8,750 – 1625/(T/K). Hitunglah (a) entalpi penguapan dan (b) titik didih normal cairan tersebut.
Berdasarkan persamaan Clausius-Clapeyron untuk variasi tekanan uap dan temperatur, d ln p
dT = ∆vapH R T2
Dengan menyusun persamaan di atas untuk memperoleh persamaan logaritma, diperoleh,
log p = k - ∆vapH 2,303 R T
dengan k suatu konstanta. Dengan membandingkan dengan persamaan yang diberikan, log p = 8,750 – 1625 /T Sehingga dapat dihitung nilai ΔvapH sebesar
∆vapH = 2,303 x 1625K x 8,314 J/K mol = 31,114 K J/mol
Titik didih normal benzena dapat diperoleh dengan menyelesaikan persamaan p(T) untuk temperatur dimana p(T) = patmosfer dimana pada tekanan atmosfer, patmosfer = 1,00 atm = 760 torr.
log(760 torr/ torr) = 8,750 – 1625/(T/K) T ˚ = 1625
8,750− log 760=276,83 K ≈ 3,83 ˚C
6. Kelebihan energi Gibbs dari larutan metilsikloheksana (MCH) dan tetrahidrofuran (THF) pada temperatur 303.15 K ditemukan mengikuti suatu persamaan,
GE
=RTx(1−x) {0.4857−0.1077(2x−1)+0.0191(2x−1)2 }
Dimana x adalah fraksi mol dari MCH. Hitung energi Gibbs dari campuran apabila komposisi campuran adalah 1.00 mol MCH dan 3.00 mol THF.
Δmix G=4(0.082)(303.15){1
Setelah nilai-nilai disubstitusi ke dalam persamaan menjadi,
Δmix G=−55.85kJ
7. Hitung perbedaan kemiringan dari potensial kimia terhadap tekanan di masing masing sisi dari (a) titik beku normal dari air, dan (b) titik didih normal dari air. Massa jenis dari es dan air pada 0oC adalah 0,917 g/cm3 dan 1,00 g/cm3 dan, untuk air dan uap air pada 100oC adalah 0,958 g/cm3 dan 0,598 g/cm3 . berapa uap air berlebih ketika air 1,2 atm dan 100oC ?
Untuk mengerjakan soal ini, kita menggunakan persamaan transisis klasifikasi fasa dari Ehrenfest dengan perubahan fasa dari α ke β . Dengan persamaan umum :
(
∂ μβ∂ P
)
T -(
∂ μα∂ P)
T = V β , m – V α , m =∆ trs
Dari informasi yang ada, didapat :
a)
(
∂ μ(1)8. Suatu senyawa yang dikenal sebagai metan masih mendapatkan perhatian untuk diteliti karena senyawa ini merupakan komponen yang penting dari gas alam, bahan bakar fosil yang umum digunakan. Friend et al. Telah memublikasikan ulasan mengenai sifat termofisik dari metan (D.G. Friend, J.F. Ely, adan H. Ingham, J. Phys. Chem. Ref. Data 18, 583 (1989)), di mana termasuk data di bawah yang mengdeskripsikan batas fase cair-uap :
A) Buatlah grafik batas fase cair-uap! B) Estimasikan titik didih standar metana!
a) Grafik batas fase cair-uap. rangan : p/Mpa berada pada sumbu-y dan T/K pada sumbu-x. Bagian atas merupakan cairan dan bagian bawah merupakan gas.
b) Titik didih standar metana didapat saat tekanan sebesar 1 Mpa yang kira kira bernilai = 149,5 K ≈ -123,5 ˚C
c) Untuk menghitung entalpy standar penguapan dari metana dapat digunakan persamaan berikut :
∆ vapH ° = T ∆ vapV ° PT
Dari informasi yang ada, maka di dapat :
∆ vapH ° = 149,5 K x
(
Dengan berasumsi bahwa hanya ketiga molekul biner dari kedua elemen tersebut yang eksis, maka: (a) Gambar secara skematis diagram fase dari P/S. Beri label pada setiap bagian dari diagram dengan dengan zat yang ditemukan pada bagian tersebut dan berikan indikasi dari fasenya. Beri label sumbu-x sebagai xs, berikan pula nilai dari xs yang berkaitan dengan senyawa yang ada. Titik leleh dari fosfor murni adalah 44C, sedangkan untuk sulfur murni adalah 119C dan (b) Gambar secara skematis kurva pendinginan untuk campuran xs = 0.28. Asumsikan bahwa titik eutektik terjadi pada xs = 0.20 dan kelarutan antara padatan-padatan diabaikan.-Titik eutektik merupakan titik leleh terendah dari suatu komposisi. -Fraksi mol Xs dapat dihitung melalui,
3
Pada grafik di atas terdapat area-area dengan label, berikut adalah penjelasan area beserta label yang digunakan:
1. l merupakan notasi untuk Sulfur (S) dan Fosfor (P) dalam fase liquid
Alasan garis pembatas imajiner untuk setiap spesi berbeda tergantung pada nilai Xs dari masing-masing spesi. Nilai e pada grafik menggambarkan titik eutektik dari masing-masing spesi, titik eutektik sendiri adalah campuran dengan titik leleh terendah. Cairan dengan komposisi eutektik akan membeku pada satu temperatur, tanpa sebelumnya menghasilkan padatan. Apabila pada cairan sisa dari larutan memiliki komposisi yang eutektik sedangkan temperatur dijaga tetap konstan, maka hal ini disebut sebagai perhentian eutektik.