UJI FITOKIMIA DAN AKTIVITAS ANTIOKSIDAN PADA TANAMAN EX VITRO DAN IN VITRO TACCA LEONTOPETALOIDES
Andri Fadillah Martin*, Asteria Aviana, Betalini Widhi Hapsari, Deritha Elffy Rantau, dan Tri Muji Ermayanti
Pusat penelitian Bioteknologi-LIPI ABSTRACT
Tacca leontopetaloides (L.) Kuntze that belongs to family Taccaceae is one of tuberous plant useful as alternatives food. This plant contains starch (amylose and amylopectin) similar to that of potato. In addition, this plant also contains secondary metabolites potential for diarrhea, anti-dysentery, and anti-cancer. In Indonesia, this plant grows at coastal areas i.e. in Sukabumi, Yogyakarta, Garut and Karimunjawa. The purpose of this research was to carry out phytochemical analysis as well as to determine antioxidant activity on the plant grown in a greenhouse (ex vitro) dan that from plantlets resulted from tissue culture (in vitro). Phytochemical analysis was done to detect flavonoid, alkaloid, steroid, tanin dan saponin compounds, meanwhile antioxidant activity was determined by DPPH analysis. The samples used were leaf, fruit, seed, and tuber of ex vitro plants, and 3-month old of in vitro planlets. The results showed that leaf of Tacca grown ex vitro collected from Yogyakarta and Sukabumi contained steroid, tanin and saponin, its seed contained flavonoid and saponin, its fruit only contained steroid, meanwhile its tuber contained alkaloid and flavonoid. Planlets grown in vitro only contained steroid. Antioxidant activity showed that Tacca leaf collected from Yogyakarta grown in the greenhouse had the lowest IC50 i.e. 40.42 mg/l. The lowest IC50 of in vitro
plantlets was from that grown in MS medium without addition of cytokinin 1.e. 67.74 mg/l.
Keywords: Tacca leontopetaloides (L.) Kuntze, phytochemical analysis, antioxdant, ex vitro plant, in vitro plantlets
ABSTRAK
Tacca leontopetaloides (L.) Kuntze merupakan salah satu tanaman umbi-umbian dari keluarga Taccaceae yang bermanfaat sebagai makanan alternatif. Tanaman ini mengandung pati (amilosa dan amilopektin) mirip dengan kentang. Selain itu, Tacca leontopetaloides juga mengandung metabolit sekunder yang berpotensi untuk mengobati diare, disentri, dan kanker. Di Indonesia, tanaman ini tumbuh di daerah pesisir seperti Sukabumi, Yogyakarta, Garut dan Karimunjawa. Tujuan dari penelitian ini adalah untuk melakukan uji fitokimia dan aktivitas antioksidan dari tanaman yang ditumbuhkan di rumah kaca (ex vitro) dan dari planlet hasil kultur jaringan (in vitro) Tacca leontopetaloides. Uji fitokimia dilakukan untuk mendeteksi senyawa flavonoid, alkaloid, steroid, tanin dan saponin, sedangkan aktivitas antioksidan diketahui dengan uji DPPH bagian tanaman tanaman ex vitro yaitu daun, buah, biji dan umbi, serta dari seluruh bagian tanaman hasil kultur jaringan (in vitro). Hasil penelitian menunjukkan bahwa daun Tacca tumbuh di rumah kaca yang berasal dari daerah Yogyakarta maupun Sukabumi mengandung steroid, tanin dan saponin, biji mengandung flavonoid dan saponin, buah hanya mengandung steroid, sedangkan umbi mengandung alkaloid dan flavonoid. Pada planlet in vitro yang berumur 3 bulan hanya mengandung steroid. Aktivitas antioksidan menunjukkan bahwa nilai IC50 terendah diperoleh dari daun Tacca yang di tanam di
rumah kaca yang berasal dari Jogyakarta yaitu sebesar 40,42 mg/l, sedangkan pada planlet in vitro, IC50 terendah diperoleh pada planlet yang ditumbuhkan pada media MS tanpa penambahan sitokinin
yaitu 67,74 mg/l.
Kata-kata kunci: Tacca leontopetaloides (L.) Kuntze, uji fitokimia, antioksidan, tanaman, ex vitro, planlet in vitro
PENDAHULUAN
elangkaan pangan telah menjadi ancaman bagi setiap negara sejak ledakan pertumbuhan penduduk dunia. Thomas Robert Malthus tahun 1798 telah memprediksikan bahwa dunia akan menghadapi ancaman pangan karena ketidakmampuan untuk
mengimbangi pertumbuhan penduduk dengan pertumbuhan penyediaan pangan. Indonesia saat ini memiliki penduduk lebih dari 240 juta jiwa dan sebagian besar mengkonsumsi beras sebagai makanan pokok sehari-hari.
Oleh karena itu dibutuhkan upaya untuk mengurangi ketergantungan pada beras sebagai
K
komoditas pangan pokok. Salah satu alternatif yang dapat dilakukan adalah mengembangkan tanaman umbi minor yang kini mulai ditinggalkan oleh masyarakat. Meskipun Indonesia merupakan produsen terbesar ketiga umbi dunia, namun pemanfaatannya masih sangat rendah. Salah satu tanaman umbi minor yang memiliki potensi untuk dikembangkan adalah tanaman Tacca leontopetaloides.
Kecondang atau taka (Tacca
leontopetaloides (L.) Kuntze Syn T.
pinnatifida. Forst, T. involucrata Schum dan Thonn.) adalah spesies tanaman berbunga dari keluarga Taccaceae. Tacca adalah genus-satunya dalam keluarga ini yang baru saja dipisahkan dari keluarga Dioscoreaceae (R.L. Caddick et al. 2002, USDA. 2012). Secara alami taka ditemukan mulai dari Afrika Barat, Asia Tenggara, hingga Australia Utara (S.T. Ubwa et al. 2011).
Adapun deskripsi dari T. leontopetaloides ini adalah sebagai berikut : tumbuhan terna tegak, tidak berbatang, berumbi bulat gepeng - jorong melebar, berkulit tipis, halus, putih pada yang muda, dan akan berubah menjadi abu-abu tua - coklat. Daun berpelepah, hijau muda berbintik putih-hijau sampai ungu kehitaman, helaian daun membundar telur sungsang melebar, membundar telur atau melonjong-membundar telur.
Perbungaan menyerupai payung dengan 20-40 bunga, braktea lembayung atau hitam legam-coklat. Bunga menggenta, kekuningan sampai hitam-lembayung-hijau. Buah agak membulat, membulat telur sampai melonjong, warna jingga muda. Biji gepeng membundar telur-menjorong, kuning-coklat. Dua jenis yang berbeda telah dilaporkan dari Kepulauan Pasifik, yang satu menghasilkan umbi tunggal yang besar, sedangkan yang lain menghasilkan lebih banyak umbi dengan ukuran yang lebih kecil seukuran umbi kentang (Original : Root Crops, 2010).
Di masa lalu, umbi taka merupakan makanan pokok di Polinesia, dan dipergunakan sebagai sumber pati. Di Tahiti umbi taka dipergunakan untuk membuat "poi" ("poke" di Kepulauan Cook), makanan tradisional yang terdiri dari campuran buah dan pati, dibumbui dengan vanili dan lemon dan dimasak dalam oven (Original : Root Crops, 2010). Umbi mengandung 20-30% pati yang dapat dengan mudah diekstraksi dalam keadaan murni dan dipasarkan di Eropa dan digunakan di Filipina untuk pembuatan roti.
Kadar amilosa pati taka adalah sekitar 22,5%, yang berada dalam kisaran yang sama dengan kandungan amilosa kentang, singkong dan beberapa umbi lainnya. Sifat fisikokimia pati taka mirip dengan tepung kentang dan jagung (Kunle et al. 2003), bahkan lebih tahan terhadap kompresi dibandingkan dengan
tepung jagung. Dengan demikian pati taka juga dapat digunakan sebagai eksipien (bahan campuran tablet), seperti pada pati jagung yang telah lama digunakan sebagai bahan eksipien (Kunle et al. 2003).
Di Polinesia, umbi taka dapat digunakan untuk mengobati penyakit diare dan disentri (Ukpabi et al. 2009). Spesies lain dari taka yaitu T. chantrieri diketahui memiliki aktivitas sitotoksik terhadap sel leukemia manusia (Yokosuka et al. 2002) serta T. paxiana dan T. subflabellata dilaporkan memiliki aktivitas antikanker terhadap Sel HeLa (Muhlbauer et al. 2003; Risinger et al. 2010, Lei et al. 2011).
Kultur in vitro dari genus taka seperti Tacca chantrieri yang termasuk golongan tanaman hias telah dilakukan di Thailand (Charoensub et al. 2008) dan inisiasi kultur in vitro dari Tacca leontopetaloides telah dilakukan oleh Borokini (2011). Di Indonesia inisiasi kultur in vitro dari Tacca leontopetaloides telah dimulai sejak awal 2011 di Puslit Bioteknologi – LIPI.
Tanaman Tacca leontopetaloides masih menjadi tanaman liar dan kurang dimanfaatkan di Indonesia, meskipun beberapa daerah di Indonesia (Karimunjawa dan Cikelet) masih memanfaatkan tanaman ini sebagai bahan makanan darurat. Untuk mendorong penggunaan tanaman ini, penelitian bertujuan untuk mengungkapkan kegunaan tanaman taka termasuk kandungan fitokimia dan aktifitas antioksidan dari tanaman taka.
METODE PENELITIAN
Tanaman Tacca leontopetaloides yang berasal dari Yogyakarta, Sukabumi dan Karimunjawa yang ditanam di rumah kaca digunakan sebagai sumber bahan penelitian ex vitro. Kultur in vitro tanaman Tacca leontopetaloides yang digunakan adalah kultur dengan penambahan Zat Pengatur Tumbuh (ZPT) Sitokinin yaitu BAP (0,5 mg/l) dan Kinetin (0,5 mg/l) serta kultur tanpa penambahan ZPT. Semua kultur ex vitro maupun in vitro dianalisis kandungan fitokimianya meliputi golongan alkaloid, steroid/triterpenoid, flavonoid, saponin dan tannin.
Deteksi alkaloid dilakukan terhadap ekstrak sampel sebanyak 0,2 g ditambahkan 5 ml ammonia 25% lalu digerus dengan lumpang. Ditambahkan 20 ml kloroform, digerus kembali dan disaring. Filtrat dimasukkan ke dalam tabung reaksi, ditambahkan HCl 10% lalu dikocok. Larutan bagian atas (fasa kloroform) diambil, lalu dibagi dua ke dalam tabung reaksi, masing-masing ditambahkan pereaksi Dragendorff, Mayer dan Wager. Apabila terbentuk endapan merah bata dengan pereaksi Dragendorff, endapan putih dengan pereaksi Mayer dan
endapan coklat dengan pereaksi Wagner menunjukkan adanya golongan senyawa alkaloid.
Deteksi steroid dan triterpenoid dilakukan terhadap ekstrak sampel sebanyak 0,2 g dimasukkan ke dalam erlenmeyer bertutup asah, ditambahkan 20 ml dietileter, dimaserasi selama 2 jam lalu disaring. Sebanyak 5 ml filtrat diuapkan dalam cawan penguap hingga diperoleh residu, lalu ditambahkan pereaksi Liebermann-Burchard. Terbentuknya warna merah atau hijau menunjukan adanya senyawa golongan steroid atau triterpenoid.
Deteksi flavonoid dilakukan terhadap ekstrak sampel sebanyak 0,2 g ditambahkan 0,05 g serbuk magnesium (Mg) dan 0,2 ml asam alkohol (campuran HCl 37% dan etanol 96% dengan volume yang sama), kemudian ditambahkan 2 ml amil alkohol lalu dikocok dengan kuat dan dibiarkan hingga memisah. Terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol menunjukan adanya senyawa golongan flavonoid.
Deteksi saponin dilakukan terhadap ekstrak sampel sebanyak 0,2 g ditambahkan 100 ml air panas, dididihkan selama 5 menit, lalu disaring dengan kertas saring (larutan A). 10 ml larutan A dimasukkan ke dalam tabung reaksi dan dikocok dengan kuat secara vertikal selama 10 detik. Terbentuknya busa setinggi 1-10 cm yang stabil selama 1-10 menit dan tidak hilang pada penambahan setetes HCl 2 N, menunjukan adanya senyawa golongan saponin. Untuk deteksi tanin, eejumlah 50 ml larutan A dimasukkan ke dalam erlenmeyer 100 ml, lalu ditambahkan FeCl3 1%.
Terbentuknya warna biru tua atau hijau kehitaman menujukan adanya senyawa golongan tanin.
Untuk uji aktivitas antioksidan, sampel tanaman Tacca leontopetaloides (ex vitro dan in vitro) dikeringkan dalam oven sampai berat konstan, ditimbang dan diekstrak dengan metanol hingga didapatkan larutan seri konsentrasi. Setelah dilakukan ekstraksi metanol, sampel dianalisis aktivitasnya sebagai antioksidan. Uji aktivitas antioksidan dilakukan dengan menggunakan metode ”DPPH free radical scavenging effect” dimana DPPH (1,1-difenil-2-pikrilhidrazil) berfungsi sebagai radikal bebas yang direaksikan dengan ekstrak yang diduga mempunyai aktivitas sebagai antioksidan, diharapkan terjadi proses penangkapan hidrogen dari ekstrak oleh DPPH (berwarna ungu) sehingga terbentuk senyawa 1,1-difenil-2-pikrilhidrazin (berwarna kuning).
Kemudian aktivitas antioksidan diukur dengan spektrofotometer UV-Vis pada panjang gelombang 515 nm (Hu et al. 2003). Sebagai kontrol positif digunakan quersetin yang
merupakan senyawa flavonoid. Cara penghitungan inhibisi (%) adalah sebagai berikut :
% Inhibisi = Abs. Blanko – Abs. Sampel x 100% ..(1) Abs.Blanko
Abs. = absorbansi
HASIL DAN PEMBAHASAN
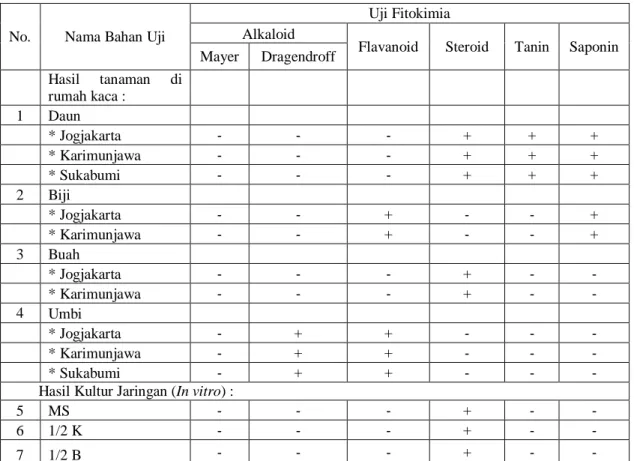
Hasil uji fitokimia sampel dapat dilihat pada Tabel 1 yang menunjukkan bahwa uji fitokimia pada sampel bagian tanaman taka yang tumbuh di rumah kaca berbeda-beda. Daun tanaman mengandung steroid, tanin dan saponin, biji mengandung flavonoid dan saponin. Sampel taka yang ditanam di rumah kaca lebih banyak mengandung metabolit sekunder dibandingkan dengan hasil kultur jaringan.
Hal ini mungkin dikarenakan beberapa faktor yang mempengaruhi produksi metabolit sekunder melalui kultur jaringan, antara lain ekspresi metabolit sekunder dipengaruhi oleh asal eksplan, komposisi media, jenis kultur dan konsentrasi zat pengatur tumbuh (Santoso & Nursandi, 1998).
Dari Tabel 1 juga terlihat bahwa tiap organ dari Tacca leontopetaloides cenderung memiliki kandungan metabolit sekunder yang berbeda pula. Pada beberapa penelitian tentang produk metabolit sekunder pada tanaman sangat terdiferensiasi pada organ khusus sehingga diperlukan kultur organ untuk memproduksi metabolit sekunder tersebut (Davioud et al. 1989).
Salah satu contoh adalah pada ginseng (Panax ginseng) dimana saponin sebagai metabolit utamanya hanya dihasilkan di akar (
Smetanska,
2008
). Pada tembakau (Nicotiana tabacum) dimana pembentukan anabasine dari lisin terjadi di akar, kemudian anabasine diubah menjadi nikotin terjadi pada organ daun. Kultur tunas dan kalus dari tembakau hanya sedikit sekali menghasilkan nikotin karena kekurangan anabasine yang merupakan metabolit terkait organ (Hussain et al. 2012).Hal lain yang menarik untuk dicermati adalah kandungan fitokimia biji dan buah. Pada biji diketahui adanya kandungan flavonoid, akan tetapi pada ekstrak buah diketahui hanya terdeteksi golongan steroid. Pada tanaman taka ex vitro, uji fitokimia dapat dilakukan pada organ-organ tertentu dari tanaman, sedangkan pada tanaman in vitro pengujian fitokimia dilakukan pada seluruh bagain tanaman karena terbatasnya sampel uji.
Tabel 1. Hasil Uji Fitokimia Umbi, Biji, Buah, Daun dan Hasil Kultur Jaringan Taka
No. Nama Bahan Uji
Uji Fitokimia Alkaloid
Flavanoid Steroid Tanin Saponin Mayer Dragendroff Hasil tanaman di rumah kaca : 1 Daun * Jogjakarta ‐ ‐ ‐ + + + * Karimunjawa ‐ ‐ ‐ + + + * Sukabumi ‐ ‐ ‐ + + + 2 Biji * Jogjakarta ‐ ‐ + ‐ ‐ + * Karimunjawa ‐ ‐ + ‐ ‐ + 3 Buah * Jogjakarta ‐ ‐ ‐ + ‐ ‐ * Karimunjawa ‐ ‐ ‐ + ‐ ‐ 4 Umbi * Jogjakarta ‐ + + ‐ ‐ ‐ * Karimunjawa ‐ + + ‐ ‐ ‐ * Sukabumi ‐ + + ‐ ‐ ‐
Hasil Kultur Jaringan (In vitro) :
5 MS ‐ ‐ ‐ + ‐ ‐
6 1/2 K ‐ ‐ ‐ + ‐ ‐
7 1/2 B ‐ ‐ ‐ + ‐ ‐
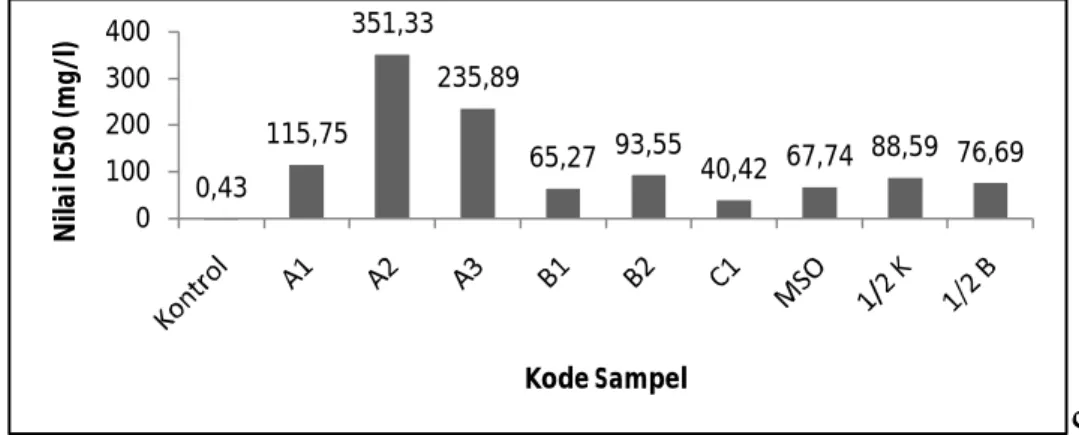
Nilai IC50 dari masing-masing ekstrak
tanaman taka hasil kultur jaringan dan berasal dari rumah kaca disajikan pada Gambar 1. Berdasarkan hasil tersebut, peredaman radikal bebas (aktivitas antioksidan) pada ekstrak tanaman taka yang berasal dari rumah kaca yang berupa umbi dan biji lebih rendah dibandingkan peredaman radikal bebas ekstrak hasil kultur jaringan taka. Sehingga semakin rendah nilai IC50 suatu sampel, maka semakin
tinggi aktivitas antioksidannya. Hal ini menunjukan bahwa ekstrak pada umbi dan biji dengan konsentrasi yang lebih rendah daripada ekstrak hasil kultur jaringan dapat memberikan efek penghambatan yang sama terhadap radikal DPPH yaitu sebesar 50%.
Pada umbi dan biji mengandung antioksidan walaupun dalam jumlah yang rendah yaitu umbi A1, A2, A3 berturut-turut sebesar 115,75; 351,33; 235,89; dan pada biji B1 sebesar 65,27 dan B2 sebesar 93,55 mg/l.
Pada daun memiliki IC50 sebesar 40,42 mg/l sedangkan hasil kultur jaringan yaitu MSO, ½ K, ½ B memiliki nilai IC50 berturut-turut sebesar 67,74; 88,59; dan 76,69 mg/l.
Hasil tersebut menunjukkan bahwa secara umum ektstrak tanaman taka hasil kultur jaringan memiliki aktivitas antioksidan yang tinggi dibandingkan dengan tanaman taka di rumah kaca.
Nilai IC50 yang tertinggi didapatkan dari daun taka di rumah kaca sebesar 40,42 mg/l dimana dari hasil uji fitokimianya pada daun taka tidak didapati adanya senyawa flavonoid (Tabel 1), sedangkan flavonoid secara umum merupakan zat antioksidan utama yang biasanya terdapat pada tanaman. Hasil yang sama juga tingginya nilai IC50 dari tanaman taka hasil kultur jaringan, dimana dari uji fitokimia tidak didapati adanya golongan flavonoid. Hal ini sejalan dengan penelitian Ratna (2008) yang melaporkan golongan steroid/triterpenoid sebagai antioksidan pada daun Pohpohan (Pilea trinevia). Kemungkinan lain adalah adanya kandungan karotenoid, dimana karotenoid bersama tokoferol merupakan senyawa non-flavonoid yang termasuk lipid-soluble antioxidant (DellaPenna et al. 2006) yang mungkin banyak terdapat pada tanaman Tacca.
Gambar 1. Nilai IC50 ekstrak etanol 96% taka yang berasal dari tanaman yang tumbuh di rumah kaca
(ex vitro) dan dari planlet hasil kultur jaringan (in vitro) Keterangan :
A1 = sampel umbi taka dari Jogjakarta C1 = sampel daun taka dari Jogjakarta A2 = sampel umbi taka dari Karimunjawa MSO = sampel dari media MSO A3 = sampel umbi taka dari Sukabumi ½ K = sampel dari media ½ Kinetin B1 = sampel biji taka dari Jogjakarta ½ B = sampel dari media ½ BAP B2 = sampel biji taka dari Karimunjawa
Kemampuan aktivitas antioksidan yang berbeda kemungkinan berhubungan dengan kadar metabolit sekunder yang berbeda. Berbagai kultur dan penambahan zat pengatur tumbuh yang berbeda pada Corydalis ambigua menghasilkan kadar alkaloid yang berbeda (Hiraoka et al. 2004). Usaha untuk meningkatkan kadar sekunder pada kultur jaringan antara lain dapat dilakukan dengan penambahan prekursor atau dengan memberikan kondisi lingkungan tertentu misalnya dengan lingkungan gelap dan terang pada Papaver rhoeas (Sarin, 2003). Prekursor juga meningkatkan produk metabolit sekunder pada kultur jaringan Hyoscyamus muticus (Ibrahim et al. 2009).
KESIMPULAN
Daun tanaman mengandung steroid, tanin dan saponin, biji mengandung flavonoid dan saponin. Sampel taka yang ditanam di rumah kaca lebih banyak mengandung metabolit sekunder dibandingkan dengan hasil kultur jaringan.
Peredaman radikal bebas (aktivitas antioksidan) pada ekstrak tanaman taka yang berasal dari rumah kaca yang berupa umbi dan biji lebih rendah dibandingkan peredaman radikal bebas ekstrak hasil kultur jaringan taka. Dari tanaman di rumah kaca, nilai IC50 tertinggi didapatkan dari daun, namun hasil uji fitokimianya pada daun taka tidak didapati adanya senyawa flavonoid. Umbi dan biji mengandung antioksidan walaupun dalam jumlah yang rendah. Planlet hasil kultur jaringan mempunyai aktivitas antioksidan yang cukup tinggi.
UCAPAN TERIMA KASIH
Ucapan terima kasih disampaikan kepada Evan Maulana, Lutvinda Ismanjani dan Rudiyanto yang telah membantu penelitian ini. Penelitian didanai oleh Program Prioritas Nasional LIPI tahun 2011 dan 2012 untuk pengembangan umbi-umbian.
DAFTAR PUSTAKA
1. Borokini TI, Lawyer EF, & Ayodele AE. 2011. In vitro Propagation of Tacca leontopetaloides (L.) Kuntze in Nigeria. Egyptian Journal of Biology. 13 : 51-56. 2. Caddick L, Wilkin RP, Rudall PJ,
Hedderson TAJ, & Chase, MW. 2002. Yams reclassified : a Recircumscription of Dioscoreaceae and Dioscoreales. Taxon. 51: 103-114.
3. Charoensub R, Thiantong D, & Phansiri S. 2008. Micropropagation of Bat Flower Plant, Tacca chantrieri Andre. Nat. Sci. 42 : 7-12. 4. Davioud E, Kan C, Hamon J, Tempe J, &
Husson HP. 1989. Production of Indole Alkaloids by in vitro
Root Cultures from
Catharanthus trichophyllus. Phytochemistry. 28 : 2675– 2680.
5. DellaPenna D, & Pogson BJ. 2006. Vitamin Synthesis in Plants: Tocopherols and Carotenoids. 0,43 115,75 351,33 235,89 65,27 93,55 40,42 67,74 88,59 76,69 0 100 200 300 400 N ila i I C 5 0 (m g/ l) Kode Sampel
Annual Review of Plant Biology. 57 : 711-738.
6. Hu C, & Kitts DD. 2003. Antioxidant, Prooxidant, and Cytotoxic Activities of Solvent-Fractionated Dandelion (Taraxacum officinale) Flower Extracts in Vitro. Journal of Agricultural and Food Chemistry. l51 : 301-310. 7. Hussain MS, Fareed S, Ansari S, Rahman
MA, Ahmad IZ, & Saeed M. 2012. Current Approaches toward Production of Secondary Plant Metabolites. J Pharm Bioallied Sci. 4 (1) : 10–20. 8. Ibrahim AI, El Kawi A, Nower M,
Ahmed, A, Amira M, & El Aal AA. 2009. Alkaloid Production and Organogenesis from Callus of Hyoscyamus muticus L. In vitro. Journal of Applied Sciences Research. 5 (1) : 82-92. 9. Kunle OO, Ibrahim YE, Emeje MO, Shaba S, & Kunle Y. 2003. Extraction, Physicochemical and Compaction Properties of Tacca Starch: A Potential Pharmaceutical Excipient. Starch/Starke. 55 : 319-325. 10. Lei I, Ni W, Li X-R, Hua Y, Fang P-L,
Kong L-M, Pan L-L, Li Y, Chen C-X, & Liu H-Y, 2011. Taccasubosides A–D, Four New Steroidal Glycosides from Tacca subflabellata. Steroids. 76 (10-11):1037–1042.
11. Muhlbauer A, & Five SS. 2003. Novel Taccalonolides from the Roots of the Vietnamese Plant Tacca paxiana. Helvetica Chimica Acta Vol 86. 2065-2072.
12. N. Hiraoka, I.D. Bhatt, Y. Sakurai, J-I. Chang, 2004. Alkaloid Production by Somatic Embryo Cultures of Corydalis ambigua. Plant Biotechnology. 21 (5) : 361–366.
13. Original : Root Crops 15. 2010. http://www.appropedia.org/Origi nal:Root_Crops_15
14. Ratna D. 2008. Identifikasi Golongan Senyawa Antioksidan pada Daun Pohpohan (Pilea trinevia) [skrpsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
15. Risinger AR, & Mooberry SL. 2010. Taccalonolides: Novel
Microtubule Stabilizers with Clinical Potential. Cancer Letter. 291 : 14-19.
16. Santoso U, & Nursandi F. 1998. Induksi Kalus & Embriosomatik Phalaenopsis amboinensis J.J. Smith dari akar dan daun melalui kultur in vitro. Tropika. 6 (2) : 142-149.
17. Sarin R. 2003. Enhancement of Opium Alkaloid Production in Callus Culture of Papaver rhoeas Linn. Indian Journal of Biotechnology. 2 : 271-272.
18. Smetanska I. 2008. Production of Secondary Metabolites using Plant Cell Cultures. Adv Biochem Eng Biotechnol. 111 : 187–228.
19. Ubwa ST, Anhwange BA, & Chia JT. 2011. Chemical Analysis of Tacca leontopetaloides Peels. American Journal of Food Technology. 6: 932-938.
20. Ukpabi UJ, Ukenye Y, Olojede AO, Ukpabi UJ, Ukenye E, & Olojede AO. 2009. Raw-Material Potentials of Nigerian Wild Polynesian Arrowroot (Tacca leontopetaloides) Tubers and Starch. Journal of Food Technology. 7 (4) : 135-138. 21. United States Department of Agriculture,
National Plant Database, 2012. http://plants.usda.gov/java/Classi ficationServlet?source=profile& symbol=TALE2&display=31. 22. Yokosuka Y, Mimaki Y, & Sashida Y.
2002. Spirostanol Saponins from the Rhizomes of Tacca chantrieri and Their Cytotoxic Activity. Phytochemistry. 61 : 73-78