FISIKA ATOM
TEORI & APLIKASINYA
Bambang Supriadi
Lailatul Nuraini
UPT PERCETAKAN & PENERBITAN
UNIVERSITAS JEMBER
FISIKA ATOM:
Teori & Aplikasinya
Penulis:
Bambang Supriadi Lailatul Nuraini
Desain Sampul dan Tata Letak
Risky Fahriza, Fatkhur Rokhim, M.Hosim
ISBN: 978-623-7226-37-6 Penerbit:
UPT Percetakan & Penerbitan Universitas Jember Redaksi: Jl. Kalimantan 37 Jember 68121 Telp. 0331-330224, Voip. 00319 e-mail: [email protected] Distributor Tunggal: UNEJ Press Jl. Kalimantan 37 Jember 68121 Telp. 0331-330224, Voip. 0319 e-mail: [email protected]
Hak Cipta dilindungi Undang-Undang. Dilarang memperbanyak tanpa ijin tertulis dari penerbit, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, photoprint, maupun microfilm.
iii
KATA PENGANTAR
Atom merupakan satuan dasar materi yang tersusun atas inti atom dan awan elektron bermuatan negatif. Inti atom terdiri dari proton bermuatan positif dan netron yang tak bermuatan. Mempelajari tentang atom sama halnya dengan mempelajari sesuatu yang abstrak karena dimensinya yang sangat kecil dan tidak dapat dilihat secara kasat mata. Hal ini menjadi salah satu penyebab kesulitan dalam memahami tentang atom. Untuk itu diperlukan sumber-sumber belajar yang menarik agar dunia atom yang abstrak dapat dengan mudah dipalajari. Buku ini dapat digunakan sebagai salah satu alternatif sumber belajar dalam mempelajari atom karena memberikan bahasan yang rinci dan mendalam serta menyediakan berbagai fitur representasi yang menarik.
Pembahasan yang rinci dan mendalam tentang fisika atom dengan menyajikan berbagai model atom merupakan salah satu keunggulan dari buku ini. Isi buku disusun secara sistematis mengikuti kronologi waktu saat konstruksi teori atom bagi setiap model atom. Selain itu juga dijelaskan tentang berbagai percobaan yang telah dilakukan oleh beberapa ahli fisika sebelum mereka mengkonstruksi teori atom. Dengan sistematika seperti ini, pembaca seolah-olah diajak mengikuti perjalanan para ahli fisika dalam mengkonstruksi teori atom yang diusulkannya.
Variasi representasi juga menjadikan salah satu fitur menarik yang ditawarkan dalam buku ini. Penjelasan tentang berbagai model atom tidak hanya diberikan melalui representasi verbal, namun juga melalui representasi matematis dan representasi gambar. Representasi matematis yang terdapat dalam buku ini diharapkan mampu menyederhanakan deskripsi verbal dari konsep fisis tentang atom. Representasi gambar yang ditawarkan dalam buku ini diharapkan mampu meminimalisir abstraksi dunia atom sehingga pembaca mampu membayangkan bagaimana kondisi fisis dalam atom. Kombinasi
iv
berbagai representasi tersebut diharapkan dapat dimanfaatkan oleh pembaca untuk mempermudah dalam memahami tentang atom.
Latihan soal merupakan salah bagian penting dalam proses memahami fisika atom. Untuk itu, pada setiap akhir bab dalam buku ajar ini disajikan latihan soal. Soal-soal yang terdapat dalam buku ini disusun secara sistematis, mulai dari permasalahan fisika atom sederhana menuju permasalahan yang komplek. Pembaca diharapkan mengerjakan soal-soal tersebut agar lebih memahami tentang fisika atom.
Akhir kata semoga buku ajar fisika atom ini dapat bermanfaat bagi pembaca. Pembaca diharapkan memiliki penguasaan yang baik terhadap topik-topik yang terdapat dalam fisika atom. Dengan penguasaan yang baik terhadap materi fisika atom diharapkan dapat melengkapi penguasaan pembaca terhadap keilmuan fisika secara menyeluruh.
Jember, Nopember 2019 Dr. Supeno, S.Pd, M.Si
v
PRAKATA
Alhamdulillahirobbil ‘alamin. Rasa syukur yang tak terhingga penulis panjatkan kepada Tuhan Yang Maha Esa karena berkat karuniaNya, buku yang berjudul “Fisika Atom Teori dan Aplikasinya” ini dapat terselesaikan dengan baik. Fisika atom merupakan salah satu materi perkuliahan di perguruan tinggi. Fisika atom ini berkaitan pula dengan beberapa mata kuliah lainnya, seperti mata kuliah fisika modern, fisika inti dan fisika kuantum.
Buku-buku yang berkaitan dengan fisika atom sudah cukup banyak di pasaran. Namun, sebagian besar buku-buku tersebut terbilang kurang lengkap. Terkadang ada beberapa sub materi yang menjadi bagian dari fisika atom namun tidak tercantum atau dibahas dalam buku-buku tersebut. Selain itu, terkait dengan rumus-rumus yang ada pada fisika atom maka seringkali buku-buku fisika atom yang ada di pasaran hanya menyajikan rumus jadinya saja dan tidak memberikan penurunan atau penyajian rumus tersebut secara lengkap. Keadaan buku-buku fisika atom yang ada di pasaran tersebut seringkali membuat mahasiswa merasa kesulitan dan kurang terbantu dalam mempelajari fisika atom hingga memunculkan pemikiran bahwa fisika atom merupakan mata kuliah yang sulit. Berdasarkan permasalahan tersebut maka disusunlah buku ajar fisika atom: teori dan aplikasinya.
Buku fisika atom ini terbilang cukup lengkap, dari segi materi maupun rumus-rumusnya. Buku ini menyajikan penurunan suatu rumus secara lengkap. Sehingga, mahasiswa atau pembaca tidak hanya mengetahui rumus jadinya saja namun juga dapat mengetahui awal mula dari rumus tersebut. Selain itu, buku fisika atom ini juga dilengkapi dengan bahan diskusi dan latihan soal untuk menguji pemahaman pembaca terkait materi yang telah disajikan. Sehingga, penulis berharap dengan adanya buku fisika atom ini para pembaca atau mahasiswa dapat terbantu dalam mempelajari materi fisika atom dan lebih mudah memahami materi fisika atom. Tak lupa penulis ucapkan terimakasih banyak kepada para pihak yang turut membantu penyusunan buku ini. Kritik dan saran yang membangun penulis harapkan demi kesempurnaan buku ini.
vi
DAFTAR ISI
KATA PENGANTAR ... iii
PRAKATA ... v
DAFTAR ISI ... v
DAFTAR GAMBAR ... ix
TINJAUAN MATA KULIAH ... xi
BAB I SPEKTRUM GAS ... 2
1.1 Pendahuluan ... 3
1.2 Orbit Elektron... 4
1.3 Spektrum Atomik ... 5
1.4 Tingkat Spektrum Dan Energi ... 6
1.5 Pergeseran Energi... 7
1.6 Spektrum Hidrogen ... 9
1.7 Spektrum Emisi Dan Absorbsi ... 13
1.8 Rangkuman ... 17
1.9 Bahan Diskusi ... 18
1.10 Daftar Pustaka ... 23
1.11 Latihan Soal ... 23
BAB II MODEL ATOM DALTON ... 26
2.1 Pendahuluan ... 26
2.2 Sejarah Atom Dalton ... 27
2.3 Kelebihan Atom Dalton ... 29
2.4 Kelemahan Atom Dalton ... 30
2.5 Rangkuman ... 31
2.6 Bahan Diskusi ... 33
2.7 Daftar Pustaka ... 38
2.8 Latihan Soal ... 39
BAB III MODEL ATOM THOMPSON ... 42
3.1 Pendahuluan ... 43
3.2 Kegagalan Model Atom Dalton ... 43
3.3 Percobaan Thompson ... 44
3.4 Kelebihan Dan Kegagalan Model Atom Thomson .... 48
vii
3.6 Bahan Diskusi ... 51
3.7 Daftar Pustaka ... 54
3.8 Latihan Soal ... 54
BAB IV HAMBURAN PARTIKEL ALPHA ... 58
4.1 Pendahuluan ... 59 4.2 Percobaan Rutherford ... 59 4.3 Rangkuman ... 75 4.4 Bahan Diskusi ... 76 4.5 Daftar Pustaka ... 79 4.6 Latihan Soal ... 80
BAB V MODEL ATOM RUTHERFORD ... 82
5.1 Pendahuluan ... 83 5.2 Atom Rutherford ... 83 5.3 Rangkuman ... 96 5.4 Bahan Diskusi ... 97 5.5 Daftar Pustaka ... 102 5.6 Latihan Soal ... 102
BAB VI TEORI ATOM BOHR ... 106
6.1 Pendahuluan ... 107
6.2 Sejarah Teori Atom Bohr ... 107
6.3 Penjelasan Teori Atom Bohr ... 108
6.4 Postulat Bohr ... 109
6.5 Model Atom Hidrogen Menurut Bohr ... 112
6.6 Kelemahan Model Atom Bohr ... 118
6.7 Rangkuman ... 119
6.8 Bahan Diskusi ... 119
6.9 Daftar Pustaka ... 125
6.10 Latihan Soal ... 125
BAB VII MODEL ATOM KUANTUM HIDROGEN ... 128
7.1 Pendahuluan ... 129
7.2 Teori Kuantum Dan Atom Hidrogen ... 129
7.3 Transformasi Koordinat Kartesius Ke Koordinat Bola... 130
7.4 Bilangan Kuantum Dan Degenerasi ... 132
viii
7.6 Fungsi Gelombang Dalam Koordinat Bola ... 135
7.7 Rangkuman ... 155
7.8 Bahan Diskusi ... 156
7.9 Daftar Pustaka ... 157
7.10 Latihan Soal ... 157
BAB VIII PEMBENTUKAN MOLEKUL ... 160
8.1 Pendahuluan ... 161
8.2 Sejarah Pembentukan Molekul ... 161
8.3 Proses Pembentukan Molekul ... 162
8.4 Contoh Pembentukan Molekul ... 162
8.5 Rangkuman ... 164
8.6 Bahan Diskusi ... 165
8.7 Daftar Pustaka ... 170
8.8 Latihan Soal ... 170
KUNCI JAWABAN LATIHAN SOAL ... 173
REFERENSI ... 219
GLOSARIUM ... 223
INDEKS ... 225
ix
DAFTAR GAMBAR
Gambar 1.1 Distribusi tingkat Energi ... 7
Gambar 1.2 Susunan Spektrometer ... 8
Gambar 1.3 Garis Kisi Utama pada Spektrum Atom Hidrogen, Atom Helium, dan Air Raksa ... 8
Gambar 1.4 Deret Balmer atom Hidrogen dengan sumbu garis Hα, Hβ, Ht, Hδ ... 10
Gambar 1.5 Deret Spektral atom Hidrogen berdasarkan tingkat energi atom ... 11
Gambar 1.6 Deret Spektral Atom Hidrogen ... 13
Gambar 1.7 Spektrum Emisi (Pancar) ... 14
Gambar 1.8 Spektrum Absorbsi (serap) ... 15
Gambar 1.9 Contoh spektrum emisi kontinu, spektrum emisi garis, dan spektrum absorbsi ... 16
Gambar 2.1 Atom Dalton ... 28
Gambar 3.1 Peralatan Thompson untuk Penelitian ... 44
Gambar 3.2 Jari-jari atom ... 45
Gambar 4.1 Percobaan Rutherford ... 60
Gambar 4.2 Model atom Thomson dan Rutherford ... 62
Gambar 4.3 Percobaan 3 ialah Rutherford menembakkan sinar alfa pada lempengan emas tipis ... 62
Gambar 4.4 Partikel Alpha Menembus Atom Thompson ... 63
Gambar 4.5 Lintasan partikel alpha untuk menembus atom thompson ... 67
Gambar 4.6 Hamburan partikel alpha ... 70
Gambar 5.1 Hamburan atom Rutherford ... 84
Gambar 5.2 Penguraian perubahan momentum ... 85
Gambar 5.3 Penguraian hamburan Rutherford ... 85
Gambar 5.4 Hamburan partikel alfa di sekitar daerah inti ... 88
Gambar 5.5 Ilustrasi probabilitas hamburan suatu partikel pada daerah sudut kecil ... 89
Gambar 5.6 Grafik Banyaknya Partikel Alpha Terhambur Terhadap Ketebalan target ... 90
x
Gambar 5.7 Grafik jumlah hamburan pada percobaan Geiger dan Marsden ... 91 Gambar 5.8 Energi kinetik relatif partikel alpha ... 92 Gambar 5.9 Grafik percobaan Geiger dan Marsden dengan sudut hambur 5° sampai 150° ... 93 Gambar 5.10 Skema interaksi partikel alpha dan inti target .... 94 Gambar 6.1 Tingkat Energi ... 115 Gambar 6.2 Transisi elektron untuk berbagai deret spektral ... 118 Gambar 7.1 Kuantisasi ruang vektor momentum ... 135 Gambar 7.2 Deret Spektrum Atom Hidrogen ... 146 Gambar 7.3 Koordinat Bola ... 147 Gambar 8.1 Proses pembentukan molekul hidrogen (a) orbital s
yang terpisah (b) orbital s yang saling overlap (c) dan (d) orbital ikatan ... 163 Gambar 8.2 Proses pembentukan molekul fluor (a) orbital p yang
terpisah (b) orbital p yang saling overlap (c) orbital ikatan ... 164
xi
DAFTAR TABEL
Tabel 7.1 Harga m dalam batasan 𝑙 ... 133 Tabel 7.2 Bentuk polinomial ... 139 Tabel 7.3 Fungsi harmonik bola ... 141
xii
TINJAUAN MATA KULIAH
Deskripsi
Buku ajar ini berisi tentang konsep fisika atom yang diperlukan bagi mahasiswa. Fisika atom merupakan mata kuliah lanjutan bagi mata kuliah wajib Fisika Inti. Fisika atom dalam perkuliahan di Program Studi Pendidikan Fisika memiliki beban Mata kuliah yaitu 2 sks. Fisika Atom dengan 2 sks berarti dalam satu semester dilaksanakan sebanyak 16 kali tatap muka.
Capaian Pembelajaran Lulusan Prodi
(CP sikap dan tata nilai) Menunjukkan sikap bertanggungjawab atas pekerjaan di bidang keahliannya secara mandiri.
(CP Keterampilan umum) Mengkaji implikasi pengembangan atau implementasi ilmu pengetahuan dan teknologi yang memperhatikan dan menerapkan nilai humaniora sesuai dengan bidang pendidikan fisika berdasarkan kaidah, tata cara, dan etika ilmiah dalam rangka menghasilkan solusi, gagasan, dan desain.
(CP ranah pengetahuan) Menguasai filosofi, pendekatan, model, metode, media, sumber-sumber belajar, dan evaluasi untuk mendukung pembelajaran fisika yang berorientasi masa depan, berbasis pada kecakapan hidup (life skill) abad ke 21 serta potensi dan kearifan lokal. (CP Keterampilan khusus) Mampu mengkreasi temuan inovatif dan kreatif untuk meningkatkan mutu pendidikan fisika masa kini dan masa depan melalui penelitian ilmiah, berbasis potensi dan kearifan lokal dengan memanfaatkan kemajuan IPTEK.
Capaian Pembelajaran Lulusan Mata Kuliah
Menguasai konsep tentang model-model atom untuk mendukung pembelajaran fisika di sekolah dan pendidikan lanjut disertai sikap kritis, kreatif, dan percaya diri.
xiii
Pedoman Penggunaan Buku
Buku ini merupakan buku wajib mata kuliah fisika atom. Pada buku ajar ini disajikan tentang uraian materi, contoh soal, rangkuman, tugas diskusi serta latihan soal.
Tugas diskusi berupa penanyangan sumber belajar dari berbagai media belajar. Sumber belajar dari internet, buku dan artikel hasil penelitian.
Latihan soal pada buku fisika atom ini dilengkapi dengan kunci jawaban sehingga memudahkan mahasiswa untuk mengcrosscheck jawaban.
Di akhir keseluruhan materi terdapat tes summatif. Tes summatif ini berfungsi untuk menguji seberapa besar pengetahuan mahasiswa menguasai materi fisika atom.
2
BAB I SPEKTRUM GAS
1) Mahasiswa mampu memahami tentang gerak elektron
2) Mahasiswa mampu menjelaskan spektrum atomik
3) Mahasiswa mampu memahami dan menggambarkan distribusi tingkat energi elektron
4) Mahasiswa mampu menganalisis terjadinya spektrum gas hidrogen
5) Mahasiswa mampu membedakan spektrum emisi dan absorbsi
3 1.1 PENDAHULUAN PETA KONSEP
SPEKTRUM
GAS
Orbit
elektron
Spektrum Atomik Tingkat Spektrum dan Energi Pergeseran Energi Spektrum Hidrogen Spektrum Emisi dan Absorbsi4
1.2 ORBIT ELEKTRON
Orbit adalah lintasan suatu benda mengelilingi pusat inti lintasan. Misal bumi mengorbit matahari, dan bulan mengorbit bumi. Elektron adalah partikel subatomik yang bermuatan negatif. Elektron tidak mengorbit pada jalur tetap, namun mengorbit pada sebuah ruang yang disebut orbital. Atom tersusun atas inti atom dan elektron. Inti atom tersusun atas proton dan neutron, sedangkan elektron merupakan partikel bermuatan negatif. Berikut adalah nilai muatan proton, neutron, dan elektron:
𝑒− = −1,6 × 10−19𝐶
𝑒+ = +1,6 × 10−19𝐶
Kemudian massa dari proton, neutron, dan elektron adalah berikut:
𝑚𝑝 = 1,673 × 10−27𝑘𝑔 = 938,27 𝑀𝑒𝑉 𝐶⁄ 2
𝑚𝑛 = 1,675 × 10−27𝑘𝑔 = 939 𝑀𝑒𝑉 𝐶⁄ 2 𝑚𝑒 = 9,1 × 10−31𝑘𝑔 = 0,511 𝑀𝑒𝑉 𝐶⁄ 2
1. Bentuk inti
Gaya Coloumb merupakan gaya yang terjadi karena adanya interaksi antara proton dan electron. Gaya sentripetal merupakan gaya yang menyeimbangkan gaya coloumb untuk mempertahankan orbit electron, sehingga nilai gaya coloumb sama dengan gaya sentripetal.
Gaya Coloumb
+
-
Gaya5 𝐹𝑐 = 1 4𝜋𝜀𝑜 𝑞𝑝𝑞𝑒 𝑟2 𝐹𝑠𝑝 = 𝑚𝑣 2 𝑟 = 𝑚𝜔 2𝑟 𝐹𝑐 = 𝐹𝑠𝑝 1 4𝜋𝜀𝑜 𝑞𝑝𝑞𝑒 𝑟2 = 𝑚 𝑣2 𝑟
Maka dapat ditentukan panjang orbit adalah sebagai berikut:
𝑟 = 1
4𝜋𝜀𝑜 𝑞2
𝑚𝑣2
Kemudian kecepatan partikel dapat ditentukan dengan persamaan berikut:
𝑣2 = 1
4𝜋𝜀𝑜 𝑞2
𝑚𝑟
2. Postulat Bohr menyatakan partikel bergerak memiliki besaran momentum pada arah translasi maupun rotasi. Pada arah translasi momentumnya adalah berikut:
𝑝 = 𝑚𝑣
Sedangkan pada arah rotasi, memiliki momentum berikut: 𝐿⃑ = 𝑚𝑣𝑟
1.3 SPEKTRUM ATOMIK
Spektrum atom adalah kumpulan semua panjang gelombang dan frekuensi yang mungkin dari radiasi elektromagnetik. Panjang gelombang tersebut diemisikan atau diserap selama transisi elektron antara tingkat energi pada suatu atom. Spektrum absorbi merupakan suatu spektrum yang dihasilkan ketika sebuah electron melompati suatu tingkatan yang lebih tinggi ketingkatan yang lebih rendah. Spektrum emisi adalah spektrum yang dihasilkan ketika suatu elektron melompati suatu tingkatan energi yang rendah ke tingkatan energi yang lebih tinggi.
6
1.4 TINGKAT SPEKTRUM DAN ENERGI
Foton dipancarkan bila elektron melompat dari suatu tingkat energi yang lebih rendah. Beberapa macam lintasan suatu orbital dapat berkaitan dengan energi elektron yang tidak mempunyai persamaan. Energi elekron 𝐸𝑛 dinyatakan dalam jari-jari orbit 𝑟𝑛 diberikan sebagai berikut:
𝐸𝑛 = 𝑒2 8𝜋𝜀0𝑟𝑛 = 𝑚𝑒2 8𝜋𝜀0➔ (Hidrogen) ∆𝐸 = ℎ𝑓 = ℎ𝑐 𝜆 = 𝐸𝐵− 𝐸𝐴➔ (Transmisi energi 𝑒 −), ℎ = 6,6 𝑥 10−34𝐽𝑠
Energi ionasi merupakan energi minimum yang dibutuhkan supaya dapat melepaskan sebuah elektron negatif (𝑒−) dari
sebuah atom. 𝐸 = 13,6 (1 𝑛2− 1 ∞) 𝑒𝑉 = 13,6 𝑛2 𝑒𝑉 Hydrogen 𝐻11 Deutrium 𝐻12 Tritium 𝐻13
Spektrum gas hidrogen menurut Bohr
1 𝜆 = 𝑅 ( 1 𝑛𝐴2 − 1 𝑛𝐵2) 𝑅 = −𝐸1 𝑐 ℎ= 1,097 𝑥 10 −7m (Tetapan Rydbeg)
Sehingga persamaan di atas dapat dinyatakan dalam beberapa tingkatan, yaitu: 1 𝜆 = 𝑅 ( 1 𝑛𝑖2− 1 𝑛𝑓2 ) 1 𝜆 = 𝑅 ( 1 12− 1 𝑛𝑓2) dengan , n = 2,3,4… Lyman 1 𝜆 = 𝑅 ( 1 22− 1 𝑛𝑓2) n = 3,4,5… Balmer 1 𝜆 = 𝑅 ( 1 32− 1 𝑛𝑓2) n = 4,5,6 … Paschen
7 1 𝜆 = 𝑅 ( 1 42− 1 𝑛𝑓2) n = 5,6,7 … Brackett 1 𝜆 = 𝑅 ( 1 12− 1 𝑛𝑓2) n = 6,7,8 … Pfund
Gambar 1.1 Distribusi tingkat Energi
1.5 Pergeseran Energi
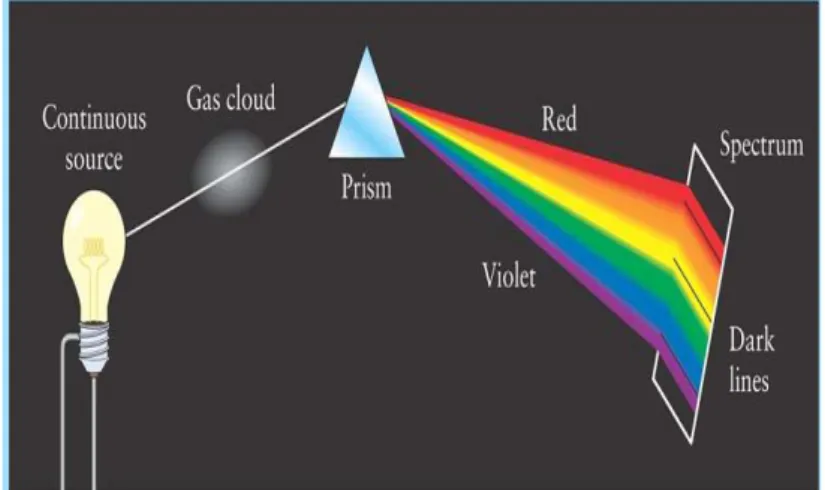
Pada suatu zat cair dan zat padat yang memilik temperatur untuk memancarkan radiasi yang dapat ditangkap dan diukur melalui panjang gelombang tertentu. Berdasarkan Pergeseran Wien, panjang gelombang yang dipancarkan berbeda-beda tergantung temperaturnya. Panjang gelombang tersebut dapat disejajarkan dengan keberadaan warna-warna pada spektrum gelombang elektromagnetik.
Spektrum atomik yang dipancarkan saat radiasi atom atau molekul gas bertekanan rendah dapat diamati menggunakan alat spektrograf dengan metode spektrografi. Metode spektografi yaitu atom atau molekul gas diberi tegangan listrik selanjutnya hasil pancaran spektrum tersebut diamati melalui spektrometer. Susunan ideal untuk mengamati spektrum atom dapat dilihat pada Gambar 1.2. Spektrometer yang sesungguhnya dapat menggunakan kisi difraksi untuk menggantikan prisma. Idealnya
8
untuk spektrum atom beberapa unsur yang dihasilkan adalah spektrum garis emisi (spektrum garis pancaran) yang terputus-putus dan hanya berupa pita-pita tersekat-sekat oleh ruang gelap berupa batang-batang warna
Gambar 1.2 Susunan Spektrometer
Gambar 1.3 Garis Kisi Utama pada Spektrum Atom Hidrogen, Atom Helium, dan Air Raksa
9
Gambar 1.3 menunjukkan spektrum atomik hidrogen, helium dan air raksa yang menunjukkan bahwa spektrum yang terbentuk berupa spektrum emisi garis. Spektrum tersebut dihasilkan ketika ketiga sampel dalam fase uap dieksitasikan kemudian diamati dengan menggunakan spektrometer. Pada Gambar 1.3 menunjukkan bahwa masing-masing unsur mempunyai spektrum garis yang unik (khas). Itulah sebabnya spektrometer dapat digunakan untuk menganalisis komposisi zat yang tidak diketahui dengan membandingkan sampel yang telah ada sebelumnya.
Pada Gambar 1.3 dapat diketahui bahwasannya pada salah satu prisma yang dipancarkan oleh seberkas cahaya. Kemudian, seberkas cahaya akan terdispersikan menjadi spektrum. Saat sumber suatu cahaya berwujud zat padat maupun zat cair yang dapat berpijar, maka akan menghasilkan spektrum yang kontinu. Namun, apabila sumber cahayanya berwujud gas berpijar maka akan menghasilkan spektrum dengan sifat dan warna berbeda, berbentuk garis kisi paralel terisolasi antara satu sama lain. Spektrum ini disebut spektrum emisi. Garis tersebut memiliki panjang gelombang yang ditentukan oleh elemen emisi cahaya. Dapat diketahui bahwa atom H memiliki sekumpulan garis tertentu saat berada di posisi yang sama, sedangkan atom He dapat menghasilkan himpunan yang lain.
1.6 Spektrum Hidrogen
Pernyataan model Thomson yang dapat dikatakan kurang tepat daripada model Rutherford dikarenakan dari hasil uji coba, atom Thomson tak dapat menggambarkan spektrum cahaya yang disinarkan dari atom hidrogen. Terdapat elektron yang tidak akan berpindah pada orbitnya, jika energi radiasi pada elektron tersebut tidak ada. Jika pada elektron terdapat energi radiasi maka elektron tersebut berpindah dari lintasan satu ke yang lainnya. Pindahnya sebuah elektron tersebut akan memberikan hasil berupa elektromagnetik dengan nilai panjang gelombang tertentu dan harganya berada pada inframerah sampai ultraviolet. Gelombang inilah nantinya akan memberikan hasil garis-garis spektrum yang terkumpul menjadi satu pada deret spektrum.
10
Awal terjadinya sangat rumit untuk menentukan rumus yang dapat menjelaskan frekuensi pada kumpulan cahaya berasal dari spektrum pada garis atom. Abad ke-19 seorang eksperimen menemukan jika panjang gelombang dapat dikhususkan dengan panjang gelombang yang dipancarkan atom Hidrogen khususnya pada rumus empiris. Penemunya adalah JJ. Balmer (1885) ketika Balmer mempelajari bagian-bagian dari cahaya tampak yang dapat dilihat dengan jelas. Penemu tersebut menemukan ternyata garisnya berubah semakin mengecil kemudian bersatu terkumpul dengan batasan deret itu sebagaimana ditunjukkan Pada Gambar 1.4 berikut.
Gambar 1.4 Deret Balmer atom Hidrogen dengan sumbu garis Hα, Hβ, Ht, Hδ.
Panjang gelombang pada deret Balmer dapat di rumuskan sebagai berikut: 1 𝜆= R( 1 22− 1 n2) pada n = 3,4,5... (6.1) Keterangan : R : Rydberg = 1,097 x 107 m-1
Garis-garis spektrum pada deret Balmer terjadi pada panjang gelombang dengan nilai terbesar mencapai 656,3 nm dikenal sebagai juga Hα yang memiliki warna merah dan panjang gelombang sebesar 486,3 nm disebut juga sebagai Hβ yang berwarna biru. Panjang gelombang sebesar 364,6 nm yang
11
disebut sebagai Hδ berwarna ultraviolet. Panjang gelombang akan semakin kecil didapatkan pada garis kemudian akan lebih lemah dan kecil. Apabila melebihi batas tersebut tidak akan ada lagi garis yang tersebar, Cuma ada spektrum kontinue dengan nilai yang sangat lemah.
Hα menghasilkan harga n : 3, Hβ menghasilkan harga n : 4, Hβ menghasilkan harga n : 5 sebagainya. Batasnya sesuai dengan n : tak hingga. Nilai panjang gelombang adalah 4/R sesuai uji coba. Pada kulit ke-2 di susunan atom tersebut. Spektrum atom hidrogen pada garis dalam daerah ultraviolet dan inframerah menghasilkan beberapa deret lain.
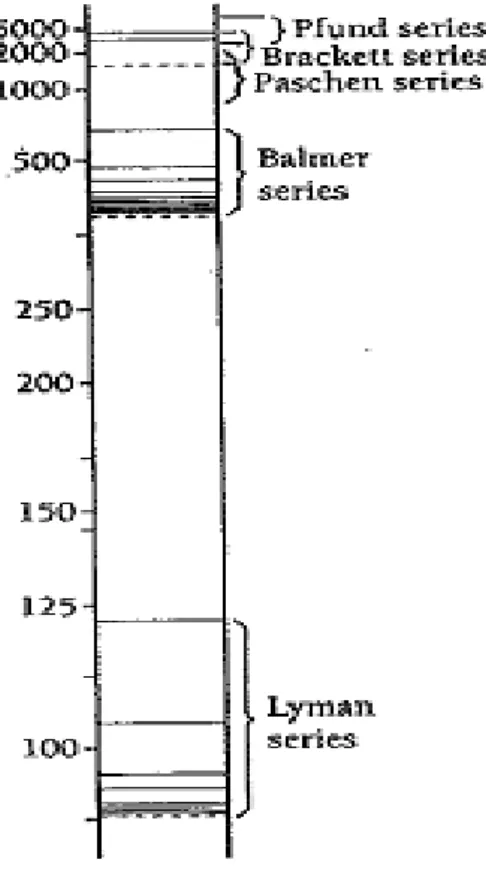
Spektrum hidrogen atomic juga bisa jatuh pada spektrum tertentu dikenal sebagai deret spektral. Pada Gambar 1.5 menunjukkan beberapa deret spektral bagi atom hidrogen selain deret Balmer.
Gambar 1.5 Deret Spektral atom Hidrogen berdasarkan tingkat energi atom.
12
Spektrum pada deret lyman yang berwarna ultraviolet mempunyai spektrum lompatan pada n lebih dari 1 sampai n sama dengan 1, dirumuskan:
1 𝜆= R( 1 12− 1 n2) pada n = 2,3,4... (6.2)
Daerah inframerah bisa didapatkan tiga deret spektrum diantaranya:
1) Deret Paschen yang merupakan inframerah 1 mendapatkan hasil lompatan dari orbit n lebih dari 3 sampai orbit n sama dengan 3, rumus sebagai berikut:
1 𝜆= R( 1 32− 1 n2) pada n = 4,5,6... (6.3)
2) Deret Brackett yang merupakan spektrum infra merah 2 menghasilkan spektrum lompatan elektron pada orbit n lebih dari 4 sampai n sama dengan 4 dengan rumus sebagai berikut: 1 𝜆= R( 1 42− 1 n2) pada n = 5,6,7... (6.4)
3) Pada deret Pfund yang merupakan inframerah 3 menghasilkan spektrum lompatan elektron pada orbit n lebihdari 5 sampai n samadengan 5, dengans rumus sebagai berikut: 1 𝜆 = R( 1 52− 1 n2) pada n : 6,7,8... (6.5)
Deret tersebut jika dikaitkan pada panjang gelombang kemudian di paparkan dalam bentuk spektrum garis atom hydrogen sebagaimana ditunjukkan pada Gambar 1.6
Deret Brackett bersatu dengan deret Paschen dan Pfund, berada di daerah inframerah. Kesesuaian pada struktur atom lainnya yang lebih rumit akan membuat kesempatan untuk eksperimen dan setelah itu dikelola dan dilanjutkan oleh penemu yang bernama Niels Bohr.
13
Gambar 1.6 Deret Spektral Atom Hidrogen.
1.7 Spektrum emisi dan absorbsi
Setiap benda mengemisikan gelombang eletromagnetik. Untuk benda padat seperti filament lampu pijar, gelombang elektromagnetik yang diemisikan memiliki jangkauan panjang gelombang yang kontinu (bersambungan) yang disebut spektrum kontinu. Beberapa diantaranya berada dalam spektrum cahaya tampak. Akan tetapi jika sumber cahaya berasal dari atom-atom gas bertekanan rendah maka spektrum yang dihasilkan bukanlah spektrum kontinu melainkan berupa beberapa garis terang warna-warni dengan latar belakang hitam. Spektrum seperti ini disebut spektrum garis.
14
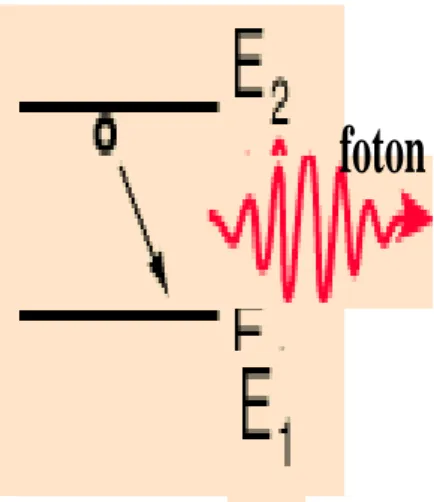
Spektum emisi dapat terjadi akibat adanya perpindahan sebuah elektron dari level energi yang besar ke level energi yang kecil. Pada peristiwa inilah elektron dapat dikatakan mampu memancarkan foton. Mekanisme terjadinya spektrum emisi dapat dilihat pada Gambar 1.7 berikut.
Gambar 1.7 Spektrum Emisi (Pancar)
Atom-atom tidak hanya mengemisikan cahaya tetapi juga menyerap cahaya. Seberkas cahaya yang terdiri dari spektrum kontinyu ketika dilewatkan tabung yang berisi atom hidrogen akan kehilangan panjang gelombang tertentu setelah melewati tabung hirogen tersebut. Hal ini ditunjukkan dengan adanya garis-garis hitam di atas garis kontinyu. Hal ini terjadi karena adanya penyerapan panjang gelombang tertentu oleh atom hidrogen. Garis-garis hitam yang diserap oleh atom hidrogen ini terjadi pada panjang gelombang yang sama seperti yang diemisikan oleh atom hidrogen. Spektrum yang terjadi disebut
spektrum absorbsi. Spektrum absorbsi terdiri dari sederetan
garis-garis hitam pada spektrum kontinyu.
Perpindahan lintasan elektron dari level energi yang besar ke level energi yang lebih besar, energi ini dinamakan spektrum absorbsi. Pada peristiwa inilah elektron mampu menyerap sebuah
Spektrum
15
foton. Mekanisme terjadinya spektrum absorbsi dilihat pada Gambar 1.8 berikut.
Gambar 1.8 Spektrum Absorbsi (serap)
Spektrum absorbsi yang terjadi pada matahari atau bintang dapat dipergunakan untuk menduga unsur apa saja yangg terkandung di matahari atau bintang. Spektrum emisi kontinyu dari radiasi yang dihasilkan oleh matahari harus melewati gas-gas yang lebih dingin pada atmosfir matahari. Setelah melewati gas-gas tersebut dan sampai ke bumi ada beberapa panjang gelombang yang hilang yang ditandai dengan adanya garis-garis hitam. Garis-garis hitam pada spektrum matahari ini dikenal dengan garis Fraunhofer. Sebagai contoh garis Fraunhofer tersebut sesuai dengan garis pada spektrum gas helium, berarti di matahari terdapat gas helium. Gambar 1.9 dapat dipergunakan untuk lebih memahami perbedaan antara spektrum emisi kontinyu, spektrum emisi garis, dan spektrum absorbsi.
Spektrum
Garis Gelap
16
Gambar 1.9 Contoh spektrum emisi kontinu, spektrum emisi garis, dan spektrum absorbsi.
Spektrum Hidrogen adalah spektrum yang susunan pancaran dari atom hidrogenya terjadi saat elektron berpindah ataupun melompat dari tingkatan yang tinggi ke tingkatan yang lebih rendah. Susunan pancaran pada rangkaian hidrogen terbagi menjadi beberpa rangkaian spektral, dengan panjang gelombang yang dihitung menggunakan sebuah formula Rydberg. Garis spektral yang teramati dapat terbentuk karena adanya elektron yang bertransisi akibat adanya dua tingkatan energi yang berbeda di dalam atomnya. Dalam formula rydberd klasifikasi sangatlah penting untuk mengembangkan mekanika kuantum. Selain dalam mekanika kuantum rangkaian spektrum juga sangat penting untuk mengembangkan ilmu astronomi guna untuk mendeteksi hidrogen serta untuk menghitung pergeseran merah.
17
1.8 RANGKUMAN
Orbit merupakan suatu lintasan yang mengelilingi inti. Atom terdiri dari macam-macam muatan baik positif maupun negatif. Muatan negatif disebut juga dengan elektron. Atom sendiri terdiri dari sebuah inti atom dan elektron, elektron elektron tersebut bergerak mengitari inti atom.
Untuk mempertahankan orbit atom maka timbul suatu gaya, gaya ini disebut gaya coloumb yang terjadi karena interaksi proton dan elektron sehingga orbit tetap stabil. Postulat Bohr menyatakan partikel bergerak memiliki besaran momentum pada arah translasi maupun rotasi.
Spektrum atom adalah kumpulan semua panjang gelombang dan frekuensi yang mungkin dari radiasi elektromagnetik. Panjang gelombang tersebut diemisikan atau diserap selama transisi elektron antara tingkat energi pada suatu atom. Sedangkan spektrum absorbi adalah spektrum yang dihasilkan saat suatu elektron melompat dari level energi yang besar ke level energi yang lebih besar dan Spektrum emisi adalah spektrum yang dihasilkan saat elektron lompat dari tingkatan energi yang kecil ke tingkat energi yang lebih besar. Tingkat energi memiliki hubungan erat dengan spektrum dimana ketika foton dipancarkan, elektron akan melompat dari suatu tingkat energi ke lebih kecil. Menurut Bohr spektrum gas dibedakan menjadi beberapa tingkatan.
Sebuah prisma yang memancarkan seberkas cahaya akan dirubah menjadi sebuah sektrum. Apabila sumber cahaya yang berbentuk zat padat ataupun dalam bentuk zat cair berpijar maka spektrum yang akan dihasilkan akan berupa kontinu. Dimana dalam hal arti kontinu itu sendiri sebuah cahaya dalam panjang gelombang akan muncul dalam bentuk spektrum. Apabila spektrum yang berpijar berupa gas maka spektrum tersebut meiliki suatu sifat yang dikatakan berbeda dan berubah menjadi lebih dari satu warna. Selain itu garis yang terbentuk juga akan terisolasi dengan yang lain. spektrum jenis inilah disebut dengan spektrum emisi. Panjang gelombang pada garis ini dapat
18
ditentukan oleh suatu panjang gelombang yang memancarkan cahaya.
Spektrum atom hidrogen mulanya tidak dapat dibahas oleh teori atom Rutherford, sehingga untuk menyempurnakan spektrum atom hidrogen tersebut pada akhir abad 19 J.J Balmer menemukan dari suatu eksperimen bahwa apabila sebuah panjang gelombang yang terjadi pada tiap deret maka akan didiskualifikasikan menggunakan sebuah rumus empiris yang sangat sederhana. Selain itu sebuah panjang gelombang tersebut juga dapat menjelaskan sebuah frekuensi gelombang yang dipancarkan oleh hidrogen. Karena keteraturan atom hidrogen sampai dengan atom yang lebih kompleks masih terjadi tumpang tindih maka Niels Bohr membuka peluang untuk uji coba struktur atom.
Proses suatu zat mengeluarkan sebuah radiasi ketika akan dipanaskan melalui pengolahan kimia disebut sebagai spektrum gas. Tingkatan emisi zatnya akan tergantung pada suatu komposisi dan spektrokopisnya. Sedangkan untuk frekuensi cahaya yang bergantung pada sebuah energi dari sebuah emisi disebut frekuensi spektrum emisi. Spektrum jenis ini terbagi menjadi spektrum garis dan spektrum kontinu. Sedangkan
spektrum absorpsi adalah proses sebuah elektron dari suatu zat
akan menyerap sebuah panjang gelombang energi. Struktur dan molekul atom dari sebuah bahan akan mengatur tingkat penyerapan, jumlah radiasi elektromagnetik, struktu kristal padat, suhu, serta interaksi antar rmolekul.
1.9 BAHAN DISKUSI
Berikut ini disajikan beberapa link video pada YouTube yang berkaitan dengan materi Spektrum Gas. Analisislah masing-masing video tersebut dan buatlah kesimpulan dari video tersebut untuk meningkatkan pemahaman Anda terkait dengan materi Spektrum Gas.
19
20
21
22
23
1.10 DAFTAR PUSTAKA
Beiser, Arthur. 1999. Konsep Fisika Modern. Jakarta : Erlangga Gribbin, John. 2003. Fisika Kuantum. Jakarta : Erlangga
https://bekbebek.wordpress.com/2015/03/08/fisika-spektrum-atom-hidrogen/ [Diakses pada 21 Oktober 2019] Krane, Kenneth. 1988. Fisika Modern. Jakarta : UI press
Mc Avoy, J.P dan Zarate Oscar. 1996. Mengenal Teori Kuantum
Untuk Pemula. Jakarta
Surya, Yohanes.2009.Fisika Modern.Tangerang: PT Kandel
1.11 LATIHAN SOAL
1. Jelaskan mengenai spektrum emisi dan spektrum absrobsi? 2. Garis-garis spektrum yang dipancarkan oleh atom hidrogen
terisolasi yang tereksitasi terjadi dalam bentuk deret. Jelaskan mengenai deret-deret tersebut!
3. Apakah yang dimaksud dengan metode spektografi yang dapat digunakan pada alat spektograf?
26
Percobaan reaksi kimia yang dilakukan John Dalton menghasilkan hal baru yang menjadi fondasi dari teori atom Dalton Salah satu kelebihan atom Dalton yaitu mampu membuktikan perbedaan suatu unsur dengan suatu senyawa. Ada pula beberapa kelebihan lainnya
Salah satu kelemahan atom Dalton yaitu tidak mampu menjelaskan sifat kelistrikan dari suatu materi. Ada pula beberapa kelemahan lainnya
BAB II
MODEL ATOM DALTON
2.1 PENDAHULUAN Model Atom Dalton Sejarah Atom Dalton Kelebihan Atom Daton Kelemahan Atom Dalton
1. Mahasiswa mampu menjelaskan teori atom menurut Dalton
2. Mahasiswa mampu menganalisis kelebihan atom Dalton
3. Mahasiswa mampu menganalisis kelemahan atom Dalton
27
2.2 SEJARAH ATOM DALTON
Pendapat Aristoteles memberi pandangan pada manusia bahwa terdapat bagian terkecil yang menyusun suatu benda. Pendapat Aristotelis dikembangkan oleh Democritus yang merupakan filosuf Yunani kuno hidup pada 46 SM–370 SM. Menurut Democritus perkembangan mengenai atom dapat diibaratkan seperti batu. Sebuah batu yang dibelah menjadi 2 dan seterusnya dibelah sampai tidak dapat dibelah lagi, maka sifat yang dimiliki batu sebelumnya akan dimiliki pula oleh belahan batu terkecil. Hal itu lah yang sebut sebagai ATOMOS (A=tidak, Thomos=Dibagi). Setiap zat tersusun dari atom yang berbeda satu sama lain. Pendapat Democritus mengenai atom merupakan hasil dari pemikiran yang tidak didasari oleh suatu percobaan.
Untuk menyokong kemajuan teori atom, John Dalton melakukan pembuktian dengan percobaan reaksi kimia antar zat. Percobaan kimia yang dilakukan John Dalton menghasilkan hal baru yang menjadi pondasi dari teori atom Dalton. Hukum ketetapan massa dan hukum kesetaraan tetap adalah pondasi dari atom Dalton. Hukum ketetapan massa (hukum Lavoisier) menyatakan suatu penjumlahan yang setara antara massa total zat hasil reaksi dengan massa total dari zat sebelum reaksi. Hukum kesetaraan tetap (hukum prouts) ini merupakan massa elemen-elemenpada suatu senyawa memiliki kesetaraan tetap. Berdasarkan landasan tersebut Dalton menyatakan bahwa:
1. Partikel yang mahakecil dari suatu zat disebut atom
2. Bentuk atom adalah bola polos yang maha kecil. Atom tidak dapat dibagi, dibuat, atau dihancurkan. Oleh sebab itu atom-atom sebelum reaksi akan muncul kembali setelah reaksi karena atom tidak dapat dihancurkan, sehingga berlaku Hukum Kekekalan Massa dari Lavoisier dimana massa seluruh reaktan harus sama dengan massa kecil reaksi. 3. Atom dari salah satu unsur tidak bisa menjadi unsur dari
atom lain.
28
4. Molekul terbuat dari 2 / lebih atom yang bermula dari beberapa unsur – unsur lain yang bersenyawa, misalnya reaksi H + 𝑂2→𝐻2𝑂. Molekul merupakan suatu zat yang terdiri atas atom-atom dengan sifat yang sama seperti zat awalnya.
5. Molekul di dalamnya terdapat atom – atom yang bersenyawa dengan kesetaraan tertentu dan total massa seluruhnya adalah tetap.
6. 2 senyawa atau lebih terbentuk dari 2 macam atom dengan kesetaraan atom-atom dalam dua senyawa adalah sederhana.
Gambar 2.1 Atom Dalton
John Dalton menyatakan bahwa 2 unsur yang berkombinasi memiliki kesetaraan 1:1, hal ini dikarenakan segala molekul berbentuk sama (senyawanya memiki susunan yang tetap dimana atom unsur-unsurnya digabung menjadi molekul). Untuk unsur atom yang berat senyawa akan mempunyai susunan konstan dengan persentase bobot besar. Dalton memiliki lambang sendiri dalam mempresentasikan unsur dan senyawa. Menurut Dalton rumus dalam tanda kurung adalah benar yaitu :
a. Oksigen O (O2)
b. Air HO (H2O)
29
Teori atom Dalton menganggap beberapa atom bisa bersalin pendamping bisa juga sejumlah molekul bisa dibagi dalam beberapa atom dalam reaksi kimia, tapi dalam pereaksi jumlah atom-atom akan setara dengan jumlah atom dalam hasil reaksi. Atom tidak dapat dihancurkan sehingga dalam reaksi kimia tidak akan ada massa yang terbentuk atau hancur.
Hukum perbandingan berganda mengatakan apabila terbentuk dua atau tiga ataupun lebih senyawa dari unsur yang mengalami reaksi, maka kesetaraan berat antara unsur pereaksidengan unsur lain dalam kedua senyawa adalah perbandingan bilangan bukan pecahan, seperti oksigen yang bereaksi dengan karbon akan mendapatkan (CO2) dan (CO)
dengan kesetaraan massa O2 adalah 2:1.
2.3 KELEBIHAN ATOM DALTON
Beberapa dari hasil kajian atom yang diperoleh dalam hal ini oleh John Dalton memiliki hal-hal positif sehingga menjadi segi kelebihan, diantaranya sebagai berikut:
1. Bahwa 2 atom maupun lebih yang berasal dari susunan unsur sejenis ataupun yang non sejenis (sama) mampu menjadi satu molekul.
Contohnya :
Beberapa unsur sama yaitu: H2, N2, O2, O3, dsb.
Untuk unsur berbeda yaitu: H2SO4, H2O, HCl, dsb.
Karbon dioksida Karbon
30
2. Mampu menjelaskan beberapa fakta eksperimen mengenai Hukum Kekekalan Massa maupun dari Hukum Kesetaraan Tetap.
3. Mampu membuktikan perbedaan suatu unsur dengan suatu senyawa
4. Mampu menjelaskan terbentuknya suatu senyawa
5. Mampu memberi motivasi pada ilmuwan lain guna mengkaji dan menginovasi untuk lebih baik lagi perihal atom, maka diharapkan dalam hal ini mulai ada teori – teori atom dengan tingkatan yang lebih baik, seperti: atom Thompson, Rutherford, maupun Niels Bohr.
2.4 KELEMAHAN ATOM DALTON
Suatu fakta - fakta eksperimen dapat dijelaskan melalui teori atom Dalton, namun dalam hal ini dari atom Dalton itu sendiri masih memiliki beberapa kelemahan dan kekurangan yang perlu adanya pengembangan. Perkembangan dan kemajuan dari IPTEK membawa perubahan akan pemahaman tentang atom tersebut. Jika ditinjau dari pandangan modern, atom sendiri terdiri dari suatu inti yang dalam hal ini bermuatan positif (+) atau dalam hal ini terdiri atas partikel neutron serta proton dan awan elekton bermuatan negatif (-) yang dalam hal ini selalu mengelilingi inti atom itu sendiri. Adapun kelemahan dan kelebihan dari teori Dalton, yaitu sebagai berikut:
1. Tidak mampu menjawab permasalahan terkait perbedaan antaratom unsur satu dengan lainnya. Karena menurut Dalton, ada kesamaan sifat antar atom dari suatu jenis unsur yang sama dan begitupula untuk atom dari suatu jenis unsur yang beda, hal ini akan memiliki sifat yang akan berbeda pula. Atau dalam hal ini didapatkan kesimpulan bahwa jenis atom-atom dari sebuah unsur golongan tertentu dengan massa yang dalam hal ini adalah sama, serta dengan satuan- satuan dari atom dalam suatu senyawa mempunyai perbandingan, maka persentase dari susunan senyawa
31
tersebut haruslah mempunyai nilai tertentu pula. Dalton dalam hal ini juga mampu membuktikan berkaitan tentang Hukum Perbandingan Tetap dari Proust.
2. Tidak mampu menjelaskan sifat kelistrikan dari suatu materi Karena dalam hal ini tidak memungkinkan suatu bola yang dalam hal ini bola yang padatmampu menghantarkan suatu arus listrik dimana electron-elektron bergerak. Maka dalam hal ini ada partikel yang lain sehingga mampu menghantarkan arus dari materi yang dalam hal ini adalah arus listrik.
3. Tidak mampu menjelaskan adanya keterkaitan antar atom yang mampu berikatan satu sama lain.
4. Adanya suatu partikel sub atomik dengan tolak ukur lebih kecil daripada atom. Karena menurut John Dalton sendiri, atom adalah bagian paling kecil dari penyusun suatu materi, sehingga dalam hal ini dibantah oleh Thompson melalui percobaannya yang pada faktanya atom mempunyai sub-sub atom yakni neutron (netral), proton (positif), dan elektron (negatif).
5. Menurut teori atom Dalton, suatu atom tidak dapat beralih menjadi atom lain karena efek dari reaksi kimia atau dalam hal ini suatu atom tidak akan berubah akibat reaksi kimia, namun reaksi nuklir dapat dimungkinkan untuk atom beralih menjadi atom lain atau dalam hal ini reaksi kimia nuklir mampu merubah suatu atom tersebut.
2.5 RANGKUMAN
Teori atom Dalton mengemukakan 2 dasar dari teori atomnya, 2 dasar hukumnya yang pertama adalah hukum ketetapan massa yang sering dikenal hukum Lavoisier dan tentang hukum kesetaraan tetap atau yang biasa dikenal hukum prouts. Lavosier menyatakan suatu penjumlahan yang setara antara massa total zat hasil reaksidengan massa total dari zat sebelum reaksi. Hukum
32
Prouts menyatakan massa elemen-elemen pada suatu senyawa memiliki kesetaraan tetap. Jadi berdasarkan apa yang tertulis dalam hukum Lavosier dan hukum Prouts tersebut Dalton menyimpulkan pendapatnya tentang atom adalah sebagai berikut:
1. Partikel yang mahakecil dari suatu zat disebut atom 2. Bentuk atom adalah bola polos yang mahakecil. Atom
tidak dapat dibagi, dibuat, atau dihancurkan.Oleh sebab itu atom-atom sebelum reaksi akan muncul kembali setelah reaksikarena atomtidak dapat dihancurkan, sehingga berlaku Hukum Kekekalan Massa dari Lavoisier dimana massa seluruh reaktan harus = massa kecil reaksi. 3. Atom dari salah satu unsur tidak bisa menjadi unsur dari
atom lain.
Misalnya: tembaga. Atom unsur tembaga semuanya sama. 4. Molekul terbuat dari 2 / lebih atom yang bermula dari beberapa unsur – unsur lain yang bersenyawa, misalnya reaksi
H + 𝑂2 𝐻2𝑂. Molekul merupakan suatu zat yang terdiri atas atom-ataomdengan sifat yang sama seperti zat awalnya.
5. Molekul di dalamnya terdapat atom – atom yang bersenyawa dengan kesetaraan tertentu dan total massa seluruhnya adalah tetap.
6. 2 senyawa atau lebih terbentuk dari 2 macam atom dengan kesetaraan atom-atom dalam dua senyawa adalah sederhana.
Teori atom Dalton mengalami kegagalan saat ditemukannya partikel-partikel yang berada didalam atom, beberapa factor diantaranya
1. Diasumsikan apabila seluruh atom dalam suatu unsur mempunyai massa dan perilaku yang sama jelas terbukti tidak benar.
2. Asumsinya atom tidak bisa dibuat dan juga dihancurkan, teori ini terbukti tidak benar. Karena sebenarnya telah
33
ditemukan sedikit perubahan energi listrik pada daerah luar atom yang membuat atom dapat memperbanyak ikatan satu antara satu dengan yang lain.
3. Teori atom yang dikemukakan Dalton tidak bisa menerangkan peristiwa tentang larutan mampu menghantarkan arus listrik.
2.6 BAHAN DISKUSI
Berikut ini disajikan beberapa link video pada YouTube yang berkaitan dengan materi Atom Dalton. Analisislah masing-masing video tersebut dan buatlah kesimpulan dari video tersebut untuk meningkatkan pemahaman terkait dengan materi Atom Dalton.
1. Teori Atom Dalton
Sumber:
34 2. Model atom Dalton
35
3. Konsep model atom Dalton yang melegenda
36 4. Dalton's Atomic Theory | #aumsum
37
5. Teori atom dalton dalton theory chemsong
38
2.7 DAFTAR PUSTAKA
Beiser Arthur. 1982. Konsep Fisika Modern. Jakarta : Erlangga. Holliday dan Resnick, Drs. Erwin Sucipto. 1984. Fisika. Jakarta :
Erlangga.
https://blog.ruangguru.com/eksplorasi-5-jenis-model-atom [Diakses pada 21 Oktober 2019]
Kertiasa, Nyoman. 1990. Fisika. Jakarta: Departemen Pendidikan dan Kebudayaan.
Wiyanto, yusman. 2010. Fisika Atom Dalam Perspektif Klasik,
Semiklasik, dan Kuantum. Yogyakarta, Pustaka Pelajar
39
2.8 LATIHAN SOAL
1. Mengapa konsep atom Dalton dikatakan lebih rinci jika dibandingkan dengan konsep atom Democritus?
2. Unsur A dan B membentuk dua senyawa. Senyawa 1 mengandung 320 gram A dan 80 gram B. Senyawa 2 mengandung 480 gram A dan 160 gram B. Berapakah perbandingan massa unsur sesuai hukum Dalton?
3. Jelaskan mengenai hipotesis Dalton yang mendukung hukum perbandingan tetap
42
BAB III
MODEL ATOM THOMPSON
1. Mahasiswa mampu memahami kegagalan pada model atom Dalton
2. Mahasiswa mampu menjelaskan percobaan Thomson
3. Mahasiswa mampu menganalisis kelebihan dan kegagalan model atom Thomson
4. Mahasiswa mampu menghaitung besarnya medan listrik yang dihasilkan atom Thomson 5. Mahasiswa mampu menghitung besarnya
frekuensi dan energi vibrasi atom menurut model atom Thomson
43
Thompson
melakukan sebuah penelitian untuk menentukan sifat-sifat katoda dengan dasar penemuan tabung katode oleh Willian Crockers
Salah satu kelebihan atom Thomson yaitu dapat menjelaskan mengenai partikel subatomik. Ada pula beberapa kelebihan yang lain
Salah satu kelemahan atom Thomson yaitu tidak bisa menjelaskan hamburan partikel bermuatan. Ada pula beberapa kelemahan yang lain
3.1 PENDAHULUAN PETA KONSEP
3.2 Kegagalan Model Atom Dalton
Model atom Thomson muncul karena adanya beberapa kegagalan pada model atom Dalton. Beberapa kegagalan pada model atom Dalton adalah sebagai berikut:
1. Teori atom Dalton tidak dapat menjelaskan gejala-gejala fisik ataupun kimiawi. Hal ini dapat diketahui dari adanya kecacatan inheren yang ada pada atom tersebut serta tidak berhasil menerangkan gejala – gejala spektra atom hidrogen yang dicetuskan oleh Balmer.
2. Adanya keterkaitan dengan paradigma mekanika klasik Newtonian dan teori gelombang elektromagnetiknya Maxwell dengan konsep dalton yang belum adanya pengakuan keberhasilan Dalton yang masih bertahan hingga akhir abad-19. Model Atom Thompson Percobaan Thompson Kelebihan Atom Thompson Kelemahan Atom Thomson
44
3.3 Percobaan Thompson
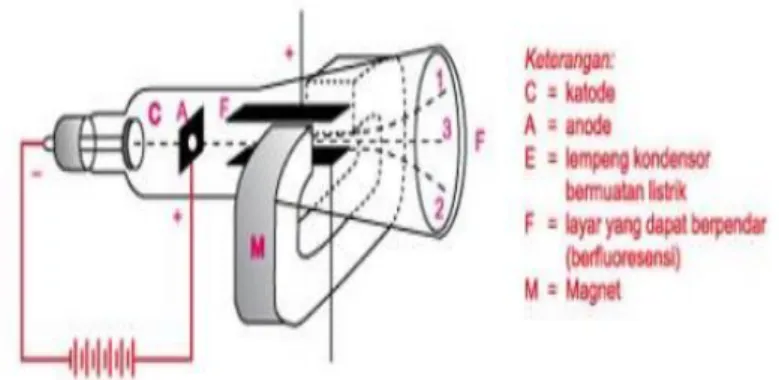
Tabung katode yang ditemukan oleh William Crockers mendasari Thompson melakukan sebuah penelitian untuk menentukan sifat-sifat katoda (1856-1940). Pada penelitian sebelumnya menyatakan bahwa kecepatan sinar katoda jauh lebih rendah daripada kecepatan cahaya. Kemudian, sinar katoda tersebut bukan merupakan radiasi elektromagnetik. Dari penelitian Thompson didapati:
1. Partikel penyusun atom adalah sinar katoda yang bermuatan negatif selanjutnya disebut dengan elektron.
2. Sifat dasar atom yang netral, sehingga harus ada yang menjadi penetral ketika ada elektron yang bermuatan negatif. Partikel penetral tersebut adalah proton yang bermuatan positif dengan jumlah yang sama dengan jumlah elektron yang ada.
Gambar 3.1 Peralatan Thompson untuk Penelitian Kesimpulan dari model atom Thompson:
▪ Atom merupakan bola pejal yang mempunyai muatan yang tersebar merata diseluruh permukaan, yaitu muatan positif dan negatif.
45
▪ Muatan atom adalah netral, karena jumlah muatan negatif (elektron) sama dengan jumlah muatan positif (proton).
Melalui model atom Thompson inilah ada beberapa sifat atom yang bisa dijelaskan, diantaranya ukuran, total elektron, massa elektron dan muatan listriknya.
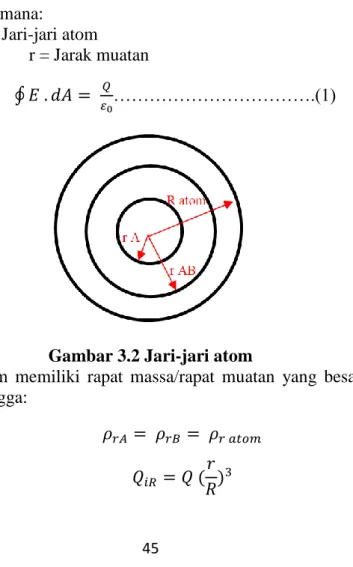
Medan Listrik yang Dihasilkan Atom Thompson a) Hukum Gauss (Distribusi Muatan)
R ≈ r Dimana: R= Jari-jari atom r = Jarak muatan ∮ 𝐸 . 𝑑𝐴 = 𝜀𝑄 0……….(1)
Gambar 3.2 Jari-jari atom
Atom memiliki rapat massa/rapat muatan yang besarnya sama, sehingga: 𝜌𝑟𝐴 = 𝜌𝑟𝐵 = 𝜌𝑟 𝑎𝑡𝑜𝑚 𝑄𝑖𝑅 = 𝑄 ( 𝑟 𝑅) 3
46
= 𝑍𝑒 (𝑟
𝑅)
3………(2)
Persamaan (2) dimasukkan pada persamaan (1) sehingga, medan listrik dapat dituliskan sebagai berikut:
𝐸(4𝜋𝑟2) = 1 𝜀0(𝑍𝑒( 𝑟 𝑅) 3 ) 𝐸 = 1 4𝜋𝜀0( 𝑍𝑒𝑟 𝑅3)
b) Hukum Coloumb (Muatan titik)
R < r Dimana:
R = Jari-jari atom r = Jarak muatan
Dengan memasukkan persamaan Hukum Coloumb, maka persamanaan Hukum Gauss dalam menemukan medan listrik menjadi sebagai berikut:
𝐸(4𝜋𝑟2) = 1 𝜀0 (𝑍𝑒( 𝑟 𝑅) 3 ) Gambar 3.3 Muatan proton dan elektron
47 𝐸 = 1 4𝜋𝜀0( 𝑍𝑒𝑟 𝑅3) 𝐸 = 1 4𝜋𝜀0( 𝑍𝑒 𝑅2) Gaya Elektrostatis
Dengan munculnya medan listrik yang diakibatkan oleh atom Thompson, maka elektron mengalami gaya elektrostatis dengan persamaan: 𝐹𝑒 = 𝑒. 𝐸 𝐹𝑒 = 𝑒. 1 4𝜋𝜀0 (𝑍𝑒𝑟 𝑅3) = 1 4𝜋𝜀0 (𝑍𝑒 2𝑟 𝑅3 )
Dengan jari-jari yang bergantung posisi elektron. Keterangan:
𝐹𝑒 : gaya elektrotatis (N)
𝐸 : medan elektromagnet (N/C) 𝑍 : nomor atom
e : muatan elektron (C)
r : jarak elektron terhadap inti (m) R : jari-jari atom (m)
𝜀0 : permitivitas ruang hampa (8,854.1012 C2/Nm2)
Gaya Pemulih dan Konstanta Pemulih
Gaya pemulih adalah gaya yang berfungsi untuk menjaga kestabilan antara elektron dan proton. Gaya pemulih yang didapatkan berdasarkan Gaya Hooke, dimana didapatkan konstanta pemulih sebagai berikut:
𝑘𝑟 = 1 4𝜋𝜀0(
𝑍𝑒2 𝑅3) 𝑟
48 𝑘 = 1 4𝜋𝜀0 (𝑍𝑒 2 𝑅3)
Setiap atom memiliki jumlah proton, elektron, dan jarak yang berbeda-beda. Sehingga nilai konstanta juga sangat beragam. Besarnya frekuensi dapat dicari melalui:
𝑘 = 𝑚𝜔2 𝑘 𝑚= (2𝜋𝑓) 2 𝑘 𝑚= (2𝜋𝑓) 2 𝑓 = 1 2𝜋 √ 𝑘 𝑚
Massa yang dimaksud adalah massa elektron, karena elektron yang mengalami gerak vibrasi (gerak harmonis). Sehingga untuk mencari Energi vibrasi suatu elektron dituliskan dalam persamaan sebagai berikut:
𝐸 = ℎ𝑐 𝜆 = ℎ𝑓 𝐸 = ℎ 2𝜋 √ 𝑘 𝑚 Keterangan:
𝜔 : kecepatan sudut (rad/s) λ : panjang gelombang (m) f : frekuensi (Hz)
E : energi (J)
m : massa elektron (9,1.10-31kg) h : konstanta Planck (6,626×10-34 J.s)
3.4 Kelebihan dan Kegagalan Model Atom Thomson
Model atom Thomson memiliki beberapa kelebihan sebagai berikut:
49
1. Model Atom Thompson dapat menjelaskan mengenai partikel subatomik. Sehingga, Thompson membuktikan adanya partikel lain yang bermuatan negatif dalam atom.
2. Adanya penguatan hasil penelitian dari Hertz dan Lenard yang menunjukkan bahwa suatu partikel dapat menembus suatu atom, jika massa partikel tersebut lebih ringan daripada elektron dari suatu atom. Hal ini dapat dibuktikan, bahwa suatu partikel alfa dapat menembus suatu lempengan yang berbahan alumunium atau emas.
Selain memiliki kelebihan, model atom Thomson juga memiliki beberapa kelemahan atau kegagalan. Beberapa kegagalan pada model atom Thomson adalah sebagai berikut: 1. Dari hasil pengamatan atau percobaan didapatkan spektrum
serap atau pancar dalam atom Hidrogen adalah 122 nm. Kadang kala, atom tidak memancarkan atau menyerap radiasi pada frekuensi yang sama.
2. Tidak bisa menjelaskan hamburan partikel bermuatan.
3.5 RANGKUMAN
• Kesimpulan model atom Thomson, antara lain:
→ Atom merupakan bola pejal yang mempunyai listrik positif yang tersebar merata di seluruh bagia atom
→ Muatan atom dinetralkan oleh elektron elektron yang tersebar di antara muatan-muatan positif • Sifat-sifat atom yang dapat dijelaskan berdasarkan model
atom Thomson, yaitu: a. Ukuran b. Total elektron c. Massa elektron d. Muatan listriknya
50
• Medan Listrik yang Dihasilkan Atom Thomson ✓ Hukum Gauss 𝐸 = 1 4𝜋𝜀0( 𝑍𝑒𝑟 𝑅3) ✓ Hukum Coloumb 𝐸 = 1 4𝜋𝜀0 (𝑍𝑒 𝑅2) • Gaya Elektrostatis 𝐹𝑒 = 𝑒. 𝐸 𝐹𝑒 = 1 4𝜋𝜀0( 𝑍𝑒2𝑟 𝑅3 )
• Gaya Pemulih dan Konstanta Pemulih
o Gaya pemulih: gaya untuk menjaga kestabilan antara elektron dan proton. Gaya pemulih yang didapatkan berdasarkan Gaya Hooke.
o Konstanta Pemulih 𝑘 = 1 4𝜋𝜀0 (𝑍𝑒 2 𝑅3) • Frekuensi 𝑓 = 1 2𝜋 √ 𝑘 𝑚 • Energi vibrasi 𝐸 = ℎ 2𝜋 √ 𝑘 𝑚
51
3.6 BAHAN DISKUSI
Berikut ini disajikan beberapa link video pada YouTube yang berkaitan dengan materi Atom Thomson. Analisislah masing-masing video tersebut dan buatlah kesimpulan dari video tersebut untuk meningkatkan pemahaman terkait dengan materi Atom Thomson.
52
53
54
3.7 DAFTAR PUSTAKA
Anonim. 2017. Bahan Ajar Kimia Dasar I-Jurusan Kimia FMIPA
UNPATTI. http://kimia.fmipa.unpatti.ac.id/wp- content/uploads/2017/11/Kimia-Dasar-I_-Perkembangn-Teori-Atom-.pdf. Diakses 12 Mei 2019 13:28.
https://www.geologinesia.com/2018/05/teori-atom-thomson.html [Diakses pada 21 Oktober 2019]
Krane, Kenneth. 1992. Fisika Modern. Jakarta: Universitas Indonesia Press.
Kuhn, Thomas.S. 1993. Peran Paradigma Dalam Revolusi Sains. Ed. Kedua. (terj. Tjun Surjaman). Bandung: PT. Remaja Rosda Karya.
Mc Avoy, J.P dan Zarate Oscar. 1996. Mengenal Teori Kuantum
Untuk Pemula. (Terj. Ahmad Baiquni). Jakarta.
Supriyadi, Bambang. 2019. Media Pembelajaran PPT: Model -
Model Atom. Jember. 3.8 LATIHAN SOAL
1. Jelaskan model atom menurut Thomson !
2. Jelaskan percobaan yang dilakukan oleh JJ. Thomson ! 3. Jelaskan kelebihan dan kelemahan dari model atom Thomson
!
4. Sebuah atom Lithium memancarkan medan listrik sebesar 0,685 𝑥 1012 N/C. Berapakah jari-jari dari atom Lithium
tersebut?
5. Diketahui 𝑁𝑎1122 memiliki jari-jari atom sebesar 0,2 Å.
55
b) Berapakah energi vibrasi yang dihasilkan?
6. Sebuah atom memiliki jari-jari atom sebesar R= 0,1nm. Jika berkas partikel alfa mempunyai energi sebesar 10 MeV (z=2) dihamburkan dari atom perak (Z=47), berapakah sudut belok rata-rata per tumbukan!
7. Suatu partikel alfa memiliki energi sebesar 7 MeV (z=2) ditembakkan pada suatu atom emas (Z=79) yang memiliki jari-jari sebesar 0,1 nm. Tentukan berapakah sudut hambur maksimum maksatom tersebut?
8. Sebuah partikel alfa menembak suatu atom magnesium
23
12Mg yang memiliki jari-jari atom sebesar 0,1 nm.
Tentukan besar medan listrik yang dihasilkan oleh atom tersebut!
9. Hitunglah frekuensi dan energi getar elektron dalam atom Hidrogen yang memiliki jari-jari atom sebesar 0,053 nm?
58
BAB IV
HAMBURAN PARTIKEL ALPHA
1. Mahasiswa mampu menjelaskan percobaan
Rutherford terkait hamburan partikel alfa
2. Mahasiswa mampu menggambarkan skema
percobaan Rutherford terkait hamburan parikel alfa
3. Mahasiswa mampu menghitung besarnya
sudut hambur partikel alfa
4. Mahasiswa mampu menghitung besarnya
parameter impak dari partikel alfa Kemampuan Akhir yang diharapkan
59
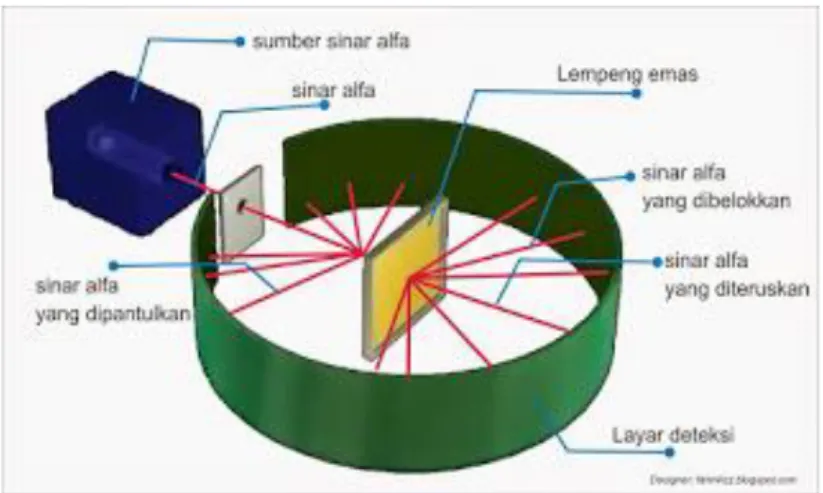
Rutherford melakukan percobaan
menggunakan kotak timbal, celah dari pelat timbal, pelat tipis dari emas, dan layar berpendar
Kesimpulan yang diperoleh Rutherford yaitu partikel alfa ada yang sebagian dibelokkan, sebagian diteruskan, dan sebagian dipantulkan
✓ Jarak antara partikel alfa dan inti ✓ Parameter impak ✓ Sudut hambur partikel alfa 4.1 PENDAHULUAN PETA KONSEP 4.2 PERCOBAAN RUTHERFORD
Pada tahun 1911, Ertnest Rutherford bersama dua orang asistennya melakukan suatu percobaan untuk menguji teori atom JJ.Thomson, yang menyatakan bahwa :
Elektron tersebar merata pada atom, seperti halnya kimsis pada roti, dan massa atom tersebar merata diseluruh isi atom.
Rutherford melakukan percobaan dengan menggunakan beberapa kompenen, seperti Gambar 4.1 berikut:
Hamburan Partikel Alfa Percobaan Rutherford Kesimpulan Percobaan Rutherford Hal terkait hamburan partikel alfa
60
Gambar 4.1 Percobaan Rutherford
1. Kotak Timbal yang didalamnya terdapat pemancar partikel alpha
2. Slit atau celah yang terbuat dari pelat timbal. 3. Pelat Tipis yang terbuat dari emas
4. Layar Berpendar berfungsi sebagai dektetor, yang dilapisi oleh zat ZnS (Seng Sulfida)
Di dalam kotak timbal, terdapat unsur radioaktif radium yang menghasilkan unsur radon dan partikel alpha. Partikel alpha digunakan karena sifatnya yang sama atau setara dengan atom He yang bermuatan (+2) dan bermassa 4 sma (2 proton dan 2 neutron). Jika partikel yang digunakan bermuatan negatif misalnya partikel beta atau elektron, maka elektron akan bergabung dengan e- lain dan diteruskan sinarnya.
Selanjutnya terdapat sebuah celah yang disebut dengan slit. Celah ini dipasang dengan tujuan untuk menyaring arah pergerakan partikel alpha, agar tetap lurus (tidak konvergen maupun tidak divergen). Celah tersebut dibuat dari bahan timbal. Bahan timbal digunakan karena partikel alpha yang daya tembusnya paling kecil, tidak bisa menembus timbal dan sifat timbal yang menahan radiasi.
61
Pelat emas digunakan karena sifatnya yang sulit teroksidasi, mudah dibentuk, dan tersusun atas kristal ccp (cubic close
packed). Jika logam yang digunakan bersifat mudah teroksidasi,
maka yang tertembak adalah oksidanya bukan atomnya. Layar atau detektor, dilapisi Zn S yang dapat digunakan menangkap radiasi dan dapat mengubah menjadi energi lain (listrik).
Partikel alpha yang dihasilkan unsur radio aktif Radium ditembakkan dengan kecepatan 2x107 m/s. Partikel alpha yang memiliki daya tembus yang paling kecil dibandingkan dengan partikel Beta dan Gamma tidak bisa menembus timbal. Karena terdapat celah, partikel alpha tetap bergerak lurus melewati celah dan menumbuk lempeng emas.
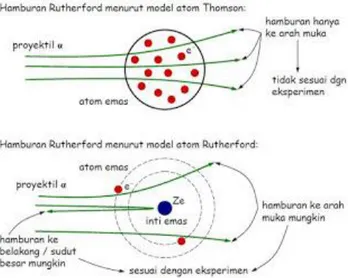
Menurut Thompson sebuah partikel menerobos dan mengalami pembelokan θ. Perhatikan partikel alpha bermuatan ze (2e) mendekati atom Thomson bermuatan ze yang menghasilkan medan listrik sesuai Gauss sebesar
E = 1
4𝜋𝜀0 𝑧𝑒 𝑅3
Maka partikel alpha mengalami gaya elektron (tolak menolak ) sebesar :
F = ze E = 1
4𝜋𝜀0 2𝑧𝑒2
62
Gambar 4.2 Model atom Thomson dan Rutherford
Jika teori atau model atom Thomson benar, maka seluruh partikel alpha akan diteruskan. Akan tetapi hasil yang muncul dari percobaan Rutherford meskipun terdapat banyak partikel yang diteruskan, ada sebagian kecil partikel dibelokkan dan dipantulkan.
Gambar 4.3 Percobaan 3 ialah Rutherford menembakkan sinar alfa pada lempengan emas tipis
Hasil ini kemudian membawa Rutherford menuju 3 kesimpulan: 1. Sebagian besar partikel alpha menembus lempeng emas tanpa
63
berasumsi bahwa jarak antara inti atom dan elektron sangatlah jauh jiak dibandingkan dengan ukuran elektron dan inti atom. 2. Sedikit sekali partikel alpha yang dipantulkan kembali. Hal
ini menunjukkan bahwa partikel alpha (+2) menumbuk inti atom yang bermuatan positif.
3. Sebagian kecil partikel alpha dibelokkan. Peristiwa ini menunjukkan bahwa muatan inti atom sejenis dengan partikel alpha (+2), ketika partikel alpha lewat didekat ini atom, partikel akan dibelokkan oleh gaya tolak-menolak muatan listrik yang sejenis.
Meskipun model Rutherford telah mampu menjelaskan struktur atom yang rumit dengan baik dan mudah dipahami serta menjelaskan bentuk lintasan elektron, akan tetapi model ini masih memiliki kekurangan:
1. Letak elektron dan cara rotasinya tidak dapat dijelaskan. 2. Spektrum garis yang terapat pada atom Hidrogen tidak dapat
dijelaskan.
3. Elektron yng tidak dapat jatuh ke inti atom tidak dapat dijelaskan.
64
Partikel alpha menembus atom Thompson dengan jarak b terhadap diameter atom Thompson . Adanya Gaya Elektrostatik (F) yang timbul akibat dari partikel alpha yang menembus atom Thompson seperti pada gambar diatas, maka akan menyebabkan lintasan partikel alpha menyimpang sebesar θ terhadap lintasan sebelumnya yang dapat dilihat pada gambar. Pada Gambar 4.4 diperoleh persamaan Gaya Elektrostatik (F) pada sumbu x dan sumbu y,yaitu :
𝐹𝑥 = 𝐹 sin ∅ dan 𝐹𝑦 = 𝐹 cos ∅ dengan
𝑆𝑖𝑛 ∅ ≅ 𝑥
𝑟 dan 𝐶𝑜𝑠 ∅ ≅ 𝑏 𝑟
Dengan menerapkan hukum kekekalan momentum yang berbunyi “Jika tidak ada gaya luar yang bekerja pada system, maka momentum total sesaat sebelum sama dengan momentum total sesudah tumbukan”. Secara matematis dapat dituliskan bahwa :
𝑃𝑎𝑤𝑎𝑙 = 𝑃𝑎𝑘ℎ𝑖𝑟
Apabila sudut simpang (θ) dari lintasan partikel alpha sangat kecil maka berlaku cos 𝜃 ≅ 1 dan sin 𝜃 ≅ tan 𝜃 dengan
𝑃𝑎𝑤𝑎𝑙 = 𝑃𝑎𝑘ℎ𝑖𝑟 𝑃0𝑥+ 𝑃0𝑦 = 𝑃𝑥+ 𝑃𝑦
Momentum Awal (𝑃𝑎𝑤𝑎𝑙 ) yang terjadi pada partikel alpha adalah
𝑃0𝑥 = 𝑚 𝑣 dan 𝑃0𝑦 = 0
Momentum Akhir (𝑃𝑎𝑘ℎ𝑖𝑟 ) yang terjadi pada partikel alpha adalah
65 𝑃𝑥 = 𝑝 cos 0 𝑃𝑥 = 𝑚 𝑣 𝑃𝑦 = 𝑝 sin 𝜃 𝑃𝑦 = 𝑝 tan 𝜃 𝑃𝑦 = 𝑝 tan 0 𝑃𝑦 = 0
Sehingga momentum awal dan momentum akhir yang terjadi pada partikel alpha adalah sama. Secara matematis dapat dituliskan seperti dibawah ini.
𝑃0𝑥+ 𝑃0𝑦 = 𝑃𝑥+ 𝑃𝑦
𝑚 𝑣 + 0 = 𝑚𝑣 + 0 𝑚 𝑣 = 𝑚 𝑣
Jadi, apabila partikel alpha menembus atom Thompson dengan sudut simpang yang kecil maka momentum awal sebelum tumbukan samadengan momentum akhir setelah tumbuhkan (𝑃𝑎𝑤𝑎𝑙 = 𝑃𝑎𝑘ℎ𝑖𝑟 )
Dari momentum awal sampai akhir terjadi perubahan momentum yang dinotasikan dengan (∆𝑃). Perubahan momentum (∆𝑃) jika dihubungkan dengan Impuls (I = ∫ 𝐹𝑑𝑡) maka
∆𝑃𝑥 = 𝑃𝑥− 𝑃0𝑥 ∆𝑃𝑥 = 0 − 0
∆𝑃𝑥 = 0
Perubahan momentum pada sumbu x adalah 0 karena besar momentum partikel alpha sebelum bertumbukan pada sumbu x
66
sama dengan besar momentum partikel alpha setelah bertumbukan pada sumbu x , sedangkan untuk perubahan momentum pada sumbu y adalah
∆𝑃𝑦 = ∫ 𝐹 𝑦𝑑𝑡
∆𝑃𝑦 = ∫ 𝐹 cos ∅ 𝑑𝑡
𝑡 0
Dengan menggunakan persamaan sebelumnya bahwa F = zkr, maka ∆𝑃𝑦 = ∫ 𝑧𝑘𝑟 cos ∅ 𝑑𝑡0𝑡 dengan 𝐶𝑜𝑠 ∅ ≅ 𝑏 𝑟 Maka, ∆𝑃𝑦 = ∫ 𝑧𝑘𝑟 𝑏 𝑟 𝑡 0 𝑑𝑡 ∆𝑃𝑦 = 𝑧𝑘𝑟 𝑏 𝑟 𝑡 ∆𝑃𝑦 = 𝑧𝑘𝑟𝑡 dengan k = 1 4𝜋𝜀0 𝑧𝑒2 𝑅3
Jadi, perubahan momentum pada sumbu y adalah zkrt dengan z yaitu nomor atom partikel alfha (2He4), k adalah konstanta, r
adalah jari-jari atom Thompson, dan t adalah fungsi waktu. Lintasan yang dilewati oleh partikel alpha untuk menembus atom Thompson adalah x2. Apabila digambarkan