10
III.
METODOLOGI PENELITIAN
A.
BAHAN DAN ALAT
1.
Bahan
Bahan baku yang digunakan dalam penelitian ini adalah ampas tahu yang didapatkan dari salah satu pabrik tahu Sumedang yang terletak di kawasan Cimanggu, Bogor. Selain itu digunakan pula tepung tapioka, laru tempe komersial, gula aren, gula kelapa, garam halus, tepung maizena dan bumbu-bumbu (pekak dan adas) yang didapatkan dari Pasar Anyar, Bogor.
Bahan kimia yang digunakan adalah HCl, H2SO4, formaldehyde, pereaksi Anthrone, NaOH, AgNO3, K2SO4, CuSO4, H3BO3, asam sitrat, Na2CO3, KI, dan alkohol 90%.
2.
Alat
Alat yang digunakan pada penelitian ini adalah toples plastik, ember plastik, kain saring, panci pengukus, tampah, kompor, pengaduk kayu, plastik penutup, plastik sampel, pendingin tegak, hot plate, pH meter, magnet stirrer, penyaring vakum, unit analisis protein, oven, tanur, neraca analitik, wadah fermentasi, alat-alat gelas untuk analisis kimia.
B.
METODE PENELITIAN
Penelitian ini dibagi menjadi empat tahap, yaitu : 1). Pembuatan kecap manis ampas tahu 2). Analisis sifat fisik, kimia dan uji organoleptik 3). Penentuan formula terpilih 4). Analisis mikrobiologi kecap manis ampas tahu formula terpilih.
1.
Pembuatan Kecap Manis Ampas Tahu
Ampas tahu yang didapat dari pabrik tahu Sumedang di daerah Cimanggu, Bogor merupakan ampas tahu yang masih basah sehingga harus dicuci agar menghasilkan ampas tahu yang bersih. Ampas tahu diberi dua perlakuan yaitu a). dipress dan dikukus selama 15 menit dan b). dipress dan dikukus selama 30 menit. Pengepressan dilakukan dengan tujuan untuk mengurangi kadar air ampas tahu yang masih tinggi dengan menggunakan kain saring. Selanjutnya, ampas tahu yang telah berkurang kadar airnya dicampurkan dengan tepung tapioka yang telah disangrai dengan jumlah penambahan tepung tapioka sebesar 5% dan 10% untuk masing-masing perlakuan pengukusan. Pemilihan rasio pencampuran tersebut diperkirakan mampu menghasilkan tekstur koji yang padat sehingga membantu proses pertumbuhan kapang. Campuran ampas tahu kukus dan tapioka kemudian ditaburi laru tempe sebanyak 5 gr untuk 1 kg campuran ampas dan tepung tapioka, lalu diaduk-aduk sampai rata. Setelah itu ampas yang telah ditaburi laru diletakkan di atas tampah setebal 2 cm yang telah dialasi daun pisang dan ditutup dengan daun pisang. Tampah diletakkan di tempat yang terhindar dari serangga dan sinar matahari langsung selama 3 hari pada suhu ruang sampai kapang cukup tebal menutupi koji. Koji yang telah jadi lalu dipotong kecil-kecil, kemudian dikeringkan dengan oven selama 4 jam pada suhu sekitar 50 – 60 oC. Koji yang telah dikeringkan dapat disebut sebagai koji kering.
Larutan garam untuk fermentasi moromi yang digunakan merupakan larutan garam dengan konsentrasi 23%. Untuk mendapatkan 1 liter larutan garam 23%, garam sebanyak 230 gram ditambahkan dengan sedikit air sedikit demi sedikit sambil diaduk hingga volumenya menjadi 1 liter. Potongan koji yang telah kering kemudian dimasukkan ke dalam larutan garam. Tiap 100 gram potongan koji kering membutuhkan sekitar 1 liter larutan garam. Proses perendaman
11 dilakukan dengan dua perlakuan, yaitu selama 1 bulan dan 2 bulan pada wadah toples plastik yang ditutupi dengan kain saring. Selama proses perendaman, apabila pada siang hari terdapat sinar matahari maka toples dijemur dalam keadaan terbuka (tidak menggunakan penutup kain saring) dan dilakukan pengadukan dua kali sehari yaitu sebelum dan sesudah penjemuran di bawah sinar matahari untuk meratakan sirkulasi udara pada toples agar tidak terjadi suasana anaerob pada moromi bagian dasar toples.
Hasil fermentasi selama 1 dan 2 bulan (moromi) selanjutnya ditambahkan air dengan perbandingan 1,5 liter untuk setiap 1 liter moromi. Setelah itu dilakukan pasteurisasi pada suhu sekitar 60-70 oC di atas kompor selama kurang lebih 15-20 menit. Setelah proses pasteurisasi selesai, cairan tersebut disaring dengan kain saring. Cairan hasil penyaringan ini disebut dengan kecap mentah. Penyiapan bumbu dilakukan dengan menyiapkan rempah-rempah yang digunakan, yaitu pekak (Illicium verum) dan adas (Foeniculum vulgare Miller). Pekak dan adas terlebih dahulu disangrai hingga berbau harum tajam lalu digiling. Sebanyak 25 g adas dan 6 g pekak yang telah halus dicampur secara merata. Sementara itu, persiapan gula dilakukan dengan menyayat gula merah kelapa dan gula aren dengan perbandingan 1 :1 lalu dicampur secara merata.
Cairan kecap mentah dipindahkan ke dalam panci, kemudian ditambahkan campuran gula merah yang sebelumnya telah dipersiapkan lalu dimasak hingga mendidih. Setiap 1 liter kecap mentah membutuhkan 1,5 kg campuran gula aren dan gula kelapa. Selama proses pemasakan, ditambahkan bumbu yang telah disiapkan dengan perbandingan bumbu dan kecap mentah sebesar 5 g campuran bumbu untuk setiap 1 liter kecap mentah. Proses pemasakan dilakukan dengan mengaduk kecap mentah tersebut hingga mendidih, setelah kecap mendidih ditambahkan 6 sendok teh larutan maizena (8 gram tepung maizena yang dilarutkan dalam 50 ml air matang) untuk setiap 1 liter kecap mentah. Proses pemasakan dilakukan sampai mengental dengan dilakukan proses pengadukan secara terus menerus untuk menghindari terjadinya kerak dan over karamelisasi pada kecap yang berada di dasar panci. Setelah proses pemasakan selama sekitar 40 menit, dilakukan penyaringan menggunakan kain saring dalam kondisi yang masih panas lalu didinginkan dan siap dibotolkan dan dianalisis lebih lanjut. Diagram alir pembuatan kecap ampas tahu dapat dilihat pada Gambar 1.
12 Gambar 1. Diagram alir tahapan penelitian
Analisis fisik Analisis
organoleptik
Analisis mikrobiologi Analisis kimia
- Uji total padatan terlarut - Uji viskositas
- Uji kadar protein - Uji kadar NaCl - Uji total gula - Uji kadar air
- Uji rating hedonik
Kecap manis ampas tahu formula terpilih
- Uji angka lempeng total - Uji MPN koliform - Uji E.coli
- Uji kapang khamir Kecap mentah
Pemasakan
Kecap ampas tahu Ampas tahu setelah dipress Tepung tapioka setelah disangrai pencampuran Fermentasi koji Fermentasi moromi koji
13
2.
Analisis Sifat Fisik, Kimia dan Uji Organoleptik.
a.
Analisis Kadar Protein Metode Kjedahl (AOAC 960.52, 1995)
Sampel sebanyak 100 mg ditimbang dan dimasukkan ke dalam labu Kjedahl lalu ditambahkan dengan 1 gr K2SO4, 40 mg HgO, 2 mL H2SO4, dan 2 butir batu didih. Kemudian, dididihkan hingga cairan menjadi jernih lalu didinginkan. Cairan yang telah dingin ditambah sejumlah kecil air destilata dan dipindahkan ke alat destilasi serta dibilas dengan 1-2 ml air destilata sebanyak 5-6 kali. Air bilasan dipindahkan ke labu destilasi lalu ditambahkan 8-10 ml larutan 60% NaOH – 5% Na2SO3.
Erlenmeyer 250 ml yang berisi larutan 5 ml H3BO3 dan 2-4 tetes indikator metilen red-metilen blue di bawah kondensor. Ujung tabung kondensor harus terendam di dalam larutan H3BO3. Selanjutnya, dilakukan destilasi sampai tertampung kira-kira 15 ml destilat dalam erlenmeyer. Hasil destilasi diencerkan hingga kira-kira 50 ml lalu dititrasi dengan HCl 0.02 N hingga terjadi perubahan warna menjadi ungu. Catat volume HCl 0.02 N yang diperlukan untuk titrasi. Hal ini dilakukan pula pada blanko. %N dan kadar protein dapat dihitung dengan menggunakan rumus :
( )
x 100%
dimana : a = jumlah (mL) larutan HCl untuk mentitrasi larutan contoh b = jumlah (mL) larutan HCl untuk mentitrasi blanko N = normalitas larutan HCl
Kadar protein (g/100g bahan basah) = %N x Faktor konversi Kadar protein (g/100g bahan kering) = kadar protein (bb) x 100 (100– kadar air (bb))
b.
Padatan Terlarut (SNI 06-6989.3-2004))
Pengukuran total padatan terlarut menggunakan alat refraktometer. Larutan yang akan diukur diteteskan pada prisma refraktometer. Nilai pada skala yang terbaca pada batas gelap dan terang menunjukkan besarnya total padatan terlarut dalam satuan derajat Brix.
c.
Kadar Air dengan Metode Oven Vakum (AOAC, 1999)
Cawan kosong dan tutupnya dikeringkan dalam oven selama 15 menit kemudian didinginkan dalam desikator. Cawan yang telah kering diambil dengan penjepit, kemudian ditimbang. Contoh ditimbang 1-2 gram pada cawan tersebut, kemudian dikeringkan pada oven vakum suhu 70°C, 25 mmHg selama 2 jam. Cawan yang telah dioven kemudian didinginkan dalam desikator, lalu ditimbang. Penimbangan diulangi hingga diperoleh bobot tetap (≤ 0,0005 gram). Kadar air dihitung menurut persamaan berikut:
Kadar air (g/100 g bahan basah) = ( ) x 100 Keterangan:
W = bobot contoh sebelum dikeringkan (gram)
W1 = bobot contoh + cawan sesudah dikeringkan (gram) W2 = bobot cawan kosong kering (gram)
d.
Kadar NaCl (AOAC 960.29, 2000)
Abu hasil pengabuan kering sampel dicuci sebanyak 3 kali ulangan dengan menggunakan 1-2 ml air destilata. Total air destilata yang digunakan adalah 10-15 ml. Larutan
14 abu dipindahkan ke dalam labu Erlenmeyer 100 ml dan ditambahkan 1 ml larutan K2CrO4 5%, kemudian dititrasi dengan larutan AgNO3 0,1 M. Titik akhir titrasi tercapai sampai terbentuk warna oranye yang pertama.
e.
Total Gula (Apriyantono et al., 1994)
1. Pembuatan Kurva Standar
Ke dalam tabung reaksi bertutup, pipet larutan glukosa standar sebanyak 0,2; 0,4; 0,6; 0,8; dan 1 ml, lalu encerkan sehingga total volume masing-masing tabung 1 ml. Buat larutan blanko yang berisi 1 ml air destilata. Ke dalam masing-masing larutan glukosa standar dan blanko tersebut, tambahkan dengan cepat 5 ml pereaksi anthrone dan ditutup. Vorteks dan kocok hingga merata. Panaskan tabung reaksidi atas penangas air 100˚C selama 12 menit. Setelah dingin pindahkan larutan ke dalam kuvet dan baca absorbansinya menggunakan spektrofotometer UV-Vis dengan panjang gelombang 630 nm. Buat plot kurva standar.
2. Analisis Contoh
Masukkan sebanyak 5 ml contoh (dari persiapan contoh) ke dalam labu takar 100 ml dan diencerkan sampai tanda tera dengan air destilata. Masukkan sebanyak 1 ml contoh tersebut ke dalam tabung reaksi bertutup dan lanjutkan dengan proses seperti pada pembuatan kurva standar.
( )
f.
Uji Viskositas menggunakan Viskometer Brookfield
1. Pengukuran sampel
Masukkan stop kontak. Tentukan nomor (jenis) spindle dan kecepatan putar. Bila pengukuran dilakukan pada fluida yang kekentalannya belum diketahui, dianjurkan untuk menggunakan spindle dari bernomor besar hingga kecil dan kecepatan putar dari kecepatan putar rendah ke kecepatan tinggi. Gunakan nomor spindle 4 dengan kecepatan putar 30 rpm untuk sampel kecap yang sangat kental, nomor spindle 3 dengan kecepatan putar 30 rpm untuk sampel kecap yang kental, dan nomor spindle 1 dengan kecepatan putar 60 rpm untuk sampel kecap yang cair.
Atur ketinggian viskometer hingga tanda garis tercelup. Tekan ke bawah. Lakukan pengukuran dengan menekan tombol ON. Lepaskan „clamp lever‟. Biarkan spindle berputar selama 20-30 detik untuk menghasilkan viskositas yang tepat. Setelah jarum stabil, tekan tuas penjepit sehingga jarum penunjuk tidak berubah posisi. Matikan motor dengan memindah tombol ke posisi OFF. Baca angka yang terlihat dan catat. Kembalikan jarum menunjuk posisi 0.
2. Perhitungan
Hitung viskositas dengan rumus berikut:
15 Tabel 5. Faktor konversi penetapan viskositas
Spindle Rpm 60 30 12 6 No. 1 1 2 5 10 No. 2 5 10 25 50 No. 3 20 40 100 200 No. 4 100 200 500 1000
g.
Uji Organoleptik (Meilgaard et al., 1999)
Uji organoleptik menggunakan metode rating hedonik yang dilakukan dengan mengurutkan tingkat penerimaan konsumen pada keseluruhan atribut (flavor) dengan kisaran nilai terendah hingga tertinggi yaitu 1(tidak suka)-5(sangat suka). Tujuh puluh orang panelis tidak terlatih mengikuti uji Rating Hedonik. Panelis tidak terlatih menerima delapan sampel yang berbeda. Setiap sampel diberi kode yang terdiri dari tiga angka. Kode diberikan secara acak. Setiap panelis tidak terlatih akan menerima kode dan urutan penyajian yang sampel yang berbeda.
Berdasarkan hasil penilaian panelis tidak terlatih yang dituliskan pada formulir isian, maka dibuat tabulasi data. Hasil penilaian ini kemudian dianalisis menggunakan ANOVA. Bila nilai F hitung > nilai F tabel, maka hasil ini menunjukkan ada perbedaan signifikan di antara beberapa contoh yang diuji. Kemudian, dilanjutkan dengan uji lanjut menggunakan uji Duncan.
3.
Uji Mikrobiologi Kecap Manis Ampas Tahu Formula Terpilih
a.
Persiapan sampelSebanyak 25 gram atau 25 ml sampel ditimbang atau dipipet ke dalam kantong stomacher steril. Setelah itu ditambahkan 225 ml pengencer buffer fosfat, dan dihomogenkan dengan stomacher selama 30 detik sehingga diperoleh suspensi dengan pengenceran 10-1. Disiapkan 5 tabung atau lebih yang masing-masing telah diisi dengan 9 ml pengencer.
b.
Uji Angka Lempeng Total (Total Plate Count)
(BPOM RI, 2006)Hasil dari homogenisasi pada penyiapan sampel yang merupakan pengenceran 10-1 dipipet sebanyak 1 ml kedalam tabung pengencer pertama, dikocok homogen hingga diperoleh pengenceran 10-2. Dibuat pengenceran selanjutnya hingga 10-4 atau sesuai dengan pengenceran yang diperlukan. Dari setiap pengenceran dipipet 1 ml kedalam cawan petri dan dibuat duplo ke dalam setiap cawan dituangkan 15-20 ml media PCA. Cawan petri segera digoyang dan diputar sedemikian rupa hingga suspense tersebar merata. Setelah media memadat, cawan diinkubasi suhu 35-37°C selama 24-46 jam dengan posisi dibalik. Setelah itu jumlah koloni yang tumbuh diamati dan dihitung. Hasil pengamatan dan perhitungan yang diperoleh dinyatakan sesuai persyaratan berikut :
1. Dipilih cawan petri dari satu pengenceran yang menunjukkan jumlah koloni antara 25-250. Jumlah koloni rata-rata dari kedua cawan dihitung lalu dikalikan dengan faktor pengencerannya.
2. Bila salah satu dari cawan petri menunjukkan jumlah koloni kurang dari 25 atau lebih dari 250, dihitung jumlah rata-rata koloni, kemudian dikalikan faktor pengencerannya
16 3. Jika terdapat cawan-cawan dari dua tingkat pengenceran yang berurutan menunjukkan jumlah
koloni antara 25-250, maka dihitung jumlah koloni dari masing-masing tingkat pengenceran, kemudian dikalikan dengan faktor pengencerannya. Apabila hasil perhitungan pada tingkat yang lebih tinggi diperoleh jumlah koloni rata lebih besar dari dua kali jumlah koloni rata-rata pengenceran dibawahnya, maka ALT dipilih dari tingkat pengenceran yang lebih rendah. Bila hasil perhitungan pada tingkat pengenceran lebih tinggi diperoleh jumlah koloni rata-rata kurang dari dua kali jumlah rata-rata pada penenceran dibawahnya maka ALT dihitung dari rata-rata jumlah koloni kedua tingkat pengenceran tersebut.
4. Bila tidak ada satupun koloni dari cawan maka ALT dinyatakan sebagai < dari 1 dikalikan faktor pengenceran terendah.
Cara perhitungan : N = Jumlah koloni pada cawan (n1+0,1 n2)x d n1= jumlah cawan pada pengenceran pertama n2= jumlah cawan pada pengenceran kedua d= pengenceran pada cawan pertama
c.
Uji MPN Koliform (BPOM RI, 2006)Prosedur pengujian MPN Coliform sesuai Metode Analisis Mikrobiologi (MA PPOM 69/MIK/06) yaitu dengan cara menyiapkan dua tabung reaksi masing-masing berisi 9 ml buffer fosfat.. Dari hasil homogenisasi pada penyiapan sampel dipipet 1 ml pengenceran 10-1 ke dalam tabung buffer fosfat pertama hingga diperoleh suspensi dengan pengenceran 10-2 lalu dikocok sampai homogen. Selanjutnya dibuat pengenceran 10-3 dan seterusnya. Ada dua tahap pengujian MPN Coliform yaitu :
1. Uji Praduga (Presumtif Test)
Untuk mendapatkan pengenceran disiapkan 3 tabung reaksi berisi 9 ml BGLBB yang dilengkapi tabung durham untuk masing-masing tingkat pengenceran. Kedalam tiap tabung dari masing-masing seri dimasukkan 1 ml suspensi pengenceran. Diinkubasi pada suhu 37° C selama 24-48 jam. Setelah 24 jam dicatat dan diamati adanya gas yang terbentuk dalam tiap tabung, kemudian inkubasi dilanjutkan hingga 48 jam dan dicatat tabung-tabung yang menunjukkan uji positif.
2. Uji Penegasan
Biakan dari tabung yang menunjukkan uji praduga positif dipindahkan 1 sengkelit ke dalam tabung reaksi berisi 10 ml BGLBB yang telah dibungkus tabung durham. Seluruh tabung diiinkubasi pada suhu 37 °C selama 24-48jam. Dilakukan pengamatan adanya pembentukkan gas. Pernyataan hasil dari uji MPN koliform ini yaitu jumlah tabung yang positif gas dicatat dan dirujuk ke tabel MPN. Angka yang diperoleh pada tabel MPN menyatakan jumlah bakteri koliform dalam tiap gram/tiap ml sampel yang diuji (BPOM RI, 2006).
d.
Uji MPN Escherichia coli (BPOM RI, 2006)17 1. Uji Pendugaan
Untuk setiap pengenceran disiapkan 3 tabung reaksi berisi 9 ml BGLBB yang dilengkapi tabung durham kedalam tiap tabung dari masing-masing seri dimasukkan 1 ml suspense pengenceran. Diinkubasi pada suhu 35-37° C selama 24-48 jam. Setelah 24 jam dicatat dan diamati perubahan warna biakan dan adanya gas yang terbentuk di dalam tiap tabung. Kemudian inkubasi dilanjutkan hingga 48 jam dan dicatat tabung-tabung yang menunjukkan gas positif.
2. Uji Konfirmasi
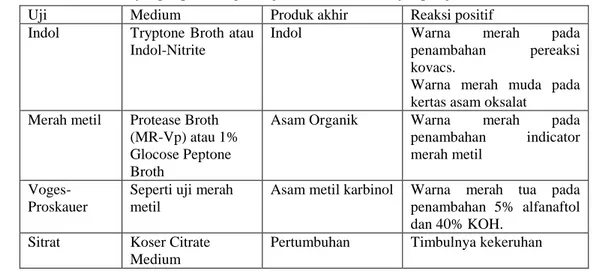
Biakan dari tabung yang merupakan uji presumptive positif dipindahkan 1 sengkelit ke dalam tabung reaksi berisi 10 ml EC Broth yang telah dilengkapi dengan tabung durham. Seluruh tabung diinkubasi pada suhu 44±0,5°C selama 24-48 jam. Dilakukan pengamatan terhadap pembentukkan gas. Dari biakan EC Broth yang positif, masing-masing diinokulasikan pada lempeng media EMB, diinkubasi pada suhu 35-37°C selama 24 jam diamati koloni spesifik yang tumbuh. Dipilih koloni spesifik yang tumbuh pada biakan EMB, diinokulasikan pada media NA miring, diinkubasikan pada suhu 35-37 °C selama 24 jam dilanjutkan uji IMViC. Reaksi-reaksi yang terjadi pada uji IMViC dapat dilihat pada tabel berikut :
Tabel 6. Medium yang digunakan pada uji IMViC dan reaksi yang terjadi
Uji Medium Produk akhir Reaksi positif
Indol Tryptone Broth atau Indol-Nitrite
Indol Warna merah pada
penambahan pereaksi kovacs.
Warna merah muda pada kertas asam oksalat
Merah metil Protease Broth (MR-Vp) atau 1% Glocose Peptone Broth
Asam Organik Warna merah pada
penambahan indicator merah metil
Voges-Proskauer
Seperti uji merah metil
Asam metil karbinol Warna merah tua pada penambahan 5% alfanaftol dan 40% KOH.
Sitrat Koser Citrate Medium
Pertumbuhan Timbulnya kekeruhan
e.
Uji Kapang/Khamir (BPOM RI, 2006)Hasil dari persiapan sampel masing-masing pengenceran dipipet 0,5 ml, dituangkan pada permukaan PDA yang sudah ditambahkan asam tartarat segera digoyang sambil diputar hingga suspense tersebar merata dan dibuat duplo. Pada satu lempeng PDA yang sudah ditambahkan asam tartarat diteteskan 0,5 ml pengencer dan disebarratakan. Seluruh cawan petri diinkubasi pada suhu 20-25° C dan diamati pada hari ketiga sampai ke lima. Jumlah koloni yang tumbuh diamati dan dihitung. Hasil pengamatan dan perhitungan yang diperoleh dinyatakan sesuai persyaratan berikut, dipilih cawan petri dari salah satu pengenceran yang menunjukkan jumlah koloni antara 15-150. Jumlah koloni dari kedua cawan dihitung lalu dikalikan dengan faktor pengencerannya. Bila pada cawan petri dari dua tingkat pengenceran yang berurutan menunjukkan jumlah antara 15-150, maka dihitung jumlah koloni dan dikalikan faktor pengencerannya, kemudian diambil rata-rata. Hasil dinyatakan sebagai angka kapang.dalam tiap gram atau tiap ml sampel.
18
C.
RANCANGAN PERCOBAAN
Faktor-faktor yang diamati adalah sebagai berikut:
Faktor pertama (A), merupakan lama pengukusan ampas tahu press : A1 : kukus 15 menit
A2 : kukus 30 menit
Faktor kedua (B), merupakan jumlah penambahan tepung tapioka : B1: 5%
B2: 10%
Faktor ketiga (C), merupakan lama fermentasi garam: C1: 1 bulan
C2: 2 bulan
Rancangan percobaan yang digunakan adalah rancangan Acak Lengkap metode Faktorial dengan tiga kali ulangan (Sudjana, 1991). Model eksperimen yang digunakan sebagai berikut : Yijk = U + Ai + Bj + Ck +ABij + ACik + BCjk +ABCijk + E(ijk)l Keterangan :
Yijk = variabel respon percobaan ke-k yang terjadi karena pengaruh bersama taraf ke-i faktor kombinasi perbedaan lama pengukusan dan taraf ke-j faktor penambahan tepung tapioka serta lama fermentasi garam
U = pengaruh rata-rata sebenarnya atau nilai tengah umum (berharga konstan) Ai = pengaruh taraf ke-i faktor lama pengukusan ampas tahu (i = 1, 2)
Bj = pengaruh taraf ke-j faktor jumlah penambahan tepung tapioka(j = 1, 2) Ck = pengaruh taraf ke-k faktor lama fermentasi garam (k = 1, 2)
ABij = pengaruh interaksi taraf ke-i faktor lama pengukusan ampas tahu (i = 1, 2) dan taraf ke-j faktor penambahan tepung tapioka (j = 1, 2)
ACik = pengaruh interaksi taraf ke-i faktor lama pengukusan ampas tahu (i = 1, 2) dan taraf ke-k faktor lama fermentasi garam (j = 1, 2)
BCjk = pengaruh interaksi taraf ke-i faktor penambahan tepung tapioka (i = 1, 2) dan taraf ke-k faktor lama fermentasi garam (j = 1, 2)
ABCijk = pengaruh interaksi taraf ke-i faktor lama pengukusan ampas tahu (i = 1, 2), faktor penambahan tepung tapioka (i = 1, 2) dan taraf ke-k faktor lama fermentasi garam (j = 1, 2) E(ijk)l = pengaruh unit percobaan pada ulangan ke-l yang diakibatkan oleh kombinasi perlakuan l = ulangan (l = 1, 2, 3)
Analisis Data
Hasil pengukuran dari kedelapan perlakuan dengan tiga kali ulangan percobaan tersebut kemudian diuji secara statistik menggunakan tabel ANOVA yang dibantu dengan media pengolahan SPSS yang kemudian dilanjutkan dengan uji lanjut Duncan untuk hasil Uji Organoleptik.