PENGARUH KADAR GARAM TERHADAP DAYA YANG DIHASILKAN PEMBANGKIT LISTRIK TENAGA AIR GARAM SEBAGAI ENERGI
ALTERNATIF TERBARUKAN
Fachrul Arizal¹, Muhammad Hasbi², Abd. Kadir³ ¹Mahasiwa Jurusan Teknik Mesin, Fakultas Teknik, Universitas Halu Oleo
³Dosen Jurusan Teknik Mesin, Fakultas Teknik, Universitas Halu Oleo Jl. H.E.A Mokodompit, Kampus Hijau Bumi Tridarma Andounohu, Kendari 93232
Abstrak
Tujuan penelitian ini yaitu untuk mengetahui pengaruh perbandingan kadar garam terhadap daya listrik yang dihasilkan pembangkit listrik air garam sebagai energi listrik alternatif terbarukan. Alat dan bahan yang digunakan pada penelitian ini yaitu AVO meter, tang, mistar, gelas ukur, neraca analitik,salt meter, garam, plat tembaga, plat aluminium, kabel dan kaca. Prosedur penelitian ini adalah mempersiapkan alat dan bahan, kemudian membuat sel elektrokimia sebanyak 2 pasang sel elektrokimia dan penampung air dan garam menggunakan kaca dengan volume air 2 liter, membuat rangkaian seri plat tembaga dan aluminium, membuat larutan air dan garam, kemudian melakukan pengujian daya listrik air garam sebagai sumber energi alternatif menggunakan AVO meter. Parameter yang diukur pada penelitian ini yaitu besar potensial listrik dan kuat arus yang mampu dihasilkan air garam dengan variasi jumlah massa garam 25 g, 50 g, 75 g,100 g, 125 g, 150 g, 175 g, 200 g, dan 225 g dilakukan untuk memberikan beda kadar garam. Setelah melakukan pengujian air garam menjadi sumber energi alternatif, daya yang besar didapatkan pada kadar garam 74 % atau dengan massa garam 175 g yang menghasilkan daya sebesar 0.058 Watt, sedangkan nilai daya terendah terdapat pada kadar garam 7 % atau dengan massa garam 25 g yang dimana hanya mampu menghasilkan daya listrik sebesar yaitu 0,011 Watt. Untuk menyalakan lampu LED 1,5 W menggunakan metode sel elektrokimia dapat dilakukan dengan membuat sel sebanyak 20 sel dengan volume air sebanyak 2000 ml dan dicampur dengan garam sebanyak 175 g garam dengan kadar garam 74 %. Menggunakan 20 pasang sel elektroda aluminium dan tembaga dimana masing-masing elektroda berukuran 3 cm x 6 cm.
Kata kunci : Air garam, sel elektrokimia, kadar garam, dan daya. Abstract
The purpose of this study is to find out of salinity towards electric power produced by salt water power plants as a renewable alternative electrical energy. Tool and materials used in this research were the AVO meter, pliers, copper plate, aluminium plate, ruler, measuring cups, balance analitik, salt meter, salt, copper plate, aluminum plate, cable and glass. The procedure of this study was preparing tools and materials, then making an electrochemical cell as much as 2 pairs of electrochemical cells and a container of water and salt using glass with 2 liter volume of water, making the series circuit copper plate and aluminum, making a solution of water and salt, then testing the power of salt water as a source alternative energy using AVO meter. The parameters measured in this study was a large electric potential and strong currents are able to produce brine with amounts of salt variety 25 g, 50 g, 75 g, 100 g, 125 g, 150 g, 175 g, 200 g and 225 g, done to provide different salinity. After testing the brine into alternative energy sources, large power obtained on the salinity 74% or with mass of salt 175 g which produce the power that is equal to 0058 watts, while the value of the lowest power contained in the salinity of 7% or the mass of salt 25 g, where only capable to produce the electric power amounting of 0,011 Watt. To turn on the LED lamp 1.5 W using electrochemical cells method can be done by making the cells as much as 20 cells with a volume of 2,000 ml of water and salt mixed with 175 g of salt with a salt content of 74%. Using 20 pairs of aluminum and copper electrode cell where each electrode measuring 3 cm x 6 cm.
Keywords: Brine, electrochemical cells, salinity and power. 1. Pendahuluan
Penelitian tentang SEACELL (Sea
Water Electro Chemical Cell) Pemanfaatan
Elektrolit Air Laut Menjadi Sumber Terbarukan Energi Listrik sebagai perubahan Generator Set untuk pencahayaan di Sampan. Desain SEACELL
dibuat dengan sistem terbuk untuk ion dari air laut terus mengalir selama operasi
SEACELL. Cara kerja SEACELL adalah
ketika air laut masuk dan mengalir ke
SEACELL, ion dari garam NaCl terkadung
dalam air laut terurai menjadi Na+ dan Cl sehingga dihasilkan anoda dan katoda reaksi. Ion negatif dari garam akan mengoksidasi Pb (timbal) elektroda, menyebabkan perbedaan potensial antara elektroda Pb dengan larutan NaCl. Hal itulah yang menyebabkan arus listrik. Tegangan yang dihasilkan dari SEACELL
secara teoritis mampu 15 volt per 1 kg air laut (Fariya,S dan Rejeki. S, 2015).
Tanda bahwa air laut mengandung arus listrik adalah adanya unsur Natrium
Chlorida (NaCl) yang tinggi dan oleh air
(H2O) diuraikan menjadi Na+ dan Cl-.,
dengan adanya partikel muatan bebas itu, maka timbul arus listrik, Timbulnya arus listrik oleh muatan tersebut dapat dipakai sebagai sumber energi listrik yang murah dan ramah lingkungan dengan menggunakan metode sel volta (Kuwahara, 2001).
Simulasi prototipe on field battery
telah dibuat melalui pemaanfaatan perbedaan salinitas dengan beberapa pasangan elektroda. Pendekatan yang digunakan untuk simulasi, yaitu sel konsentrasi elektrolit yang dipisahkan oleh jembatan garam berisi natrium klorida. Air laut dan air tawar tiruan yaitu natrium klorida dengan konsentrasi masing-masing 0,6 M dan 0,024 M. Daya yang dihasilkan, diukur dengan potensiostate DAQ melalui integal kurva I-V. Beberapa pasangan elektroda telah diuji coba untuk mengekstrak energi. Dari hasil pengujian yang dilakukan, pasangan elektroda alumunium dan tembaga menghasilkan daya yang paling tinggi yaitu 373,1314 µW/cm². (Udi, A.M dan Kurniawan, F. 2013).
2. Tinjauan Pustaka Sel Volta
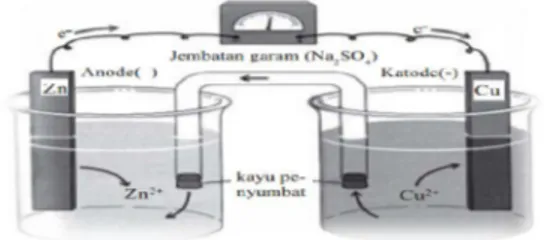
Logam tembaga dicelupkan dalam larutan CuSO4 dan logam seng dicelupkan
dalam larutan ZnSO4. Kedua larutan
dihubungkan dengan jembatan garam. Jembatan garam merupakan tabung U yang diisi agar-agar dan garam KCl. Sedangkan kedua elektroda (logam Cu dan Zn) dihubungkan dengan alat penunjuk arus yaitu voltmeter.
Gambar 1. Sel volta (Utami, dkk., 2009) Elektroda pada Sel Volta yaitu berupa katoda dan anoda. Katode adalah Elektroda di mana terjadi reaksi reduksi, berarti logam Cu dalam sel volta disebut sebagai elektroda positif. Sedangkan Anode adalah Elektroda di mana terjadi reaksi oksidasi, berarti logam Zn dalam sel volta disebut sebagai elektroda negatif.
Fungsi jembatan garam adalah menyetarakan kation dan anion dalam larutan. Adapun syarat jembatan garam yaitu bisa dilewati ion dan hanya sedikit melewatkan pelarut. Jembatan garam pada penelitian ini berupa agar yang diisi dengan 3% natrium klorida. Pemilihan natrium klorida dikarenakan kedua sisi reaktor adalah larutan natrium klorida yang berbeda konsentrasi. Perbedaan konsentrasi akan menyebabkan difusi ion secara alami dari konsentrasi tinggi menuju konsentrasi rendah. Pada natrium klorida, ion klorida memiliki mobilitas yang lebih besar dibandingkan ion natrium. Haman dkk., (1998).
Potensial Elektroda
Banyaknya arus listrik yang dihasilkan dari kedua elektroda di atas dapat ditentukan besarnya dengan menetapkan potensial elektroda dari Zn dan Cu. Hanya saja potensial elektroda suatu zat tidak mungkin berdiri sendiri, harus ada patokan yang menjadi standar. Sebagai elektroda standar digunakan elektroda hidrogen. Jadi, potensial elektroda digambarkan dengan reaksi reduksi. Tetapi jika zat ternyata lebih mudah melakukan reaksi oksidasi dibanding hidrogen, maka harga potensial elektrodanya adalah negatif. Dalam hal ini potensial oksidasinya positif, tetapi karena potensial elektroda harus ditulis reduksi berarti potensial reduksinya adalah negatif.
Daftar harga potensial elektroda untuk logam-logam yang penting sebagai berikut:
Tabel 1. Potensial elektroda (Utami, dkk., 2009)
Reaksi Reduksi E°sel Li+(aq) + e -Li(s) -3,04 Na+(aq) + e- Na(s) -2,71 Mg2+(aq) + 2e -Mg(s) -2,38 Al3+(aq) + 3e- Al(s) -1,66 2H3(aq) + 2e- H2(g) 2OH-(aq) -0,83 Zn2+(aq) + 2e -Zn(s) -0,76 Cr3+(aq) + 3e- Cr(s) -0,74 Fe2+(aq) + 2e- Fe(s) -0,41 Cd2+(aq) + 2e- Cd(s) -0,40 Ni2+(aq) + 2e- Ni(s) -0,23 Sn2+(aq) + 2e- Sn(s) -0,14 Pb2+(aq) + 2e- Pb(s) -0,13 Fe3+(aq) + 3e- Fe(s) -0,04 2H+(aq) + 2e- H2(s) 0,00 Sn4+(aq) + 2e -Sn2+(aq) 0,15 Cu2+(aq) + e -Cu+(aq) 0,16 Cu2+(aq) + 2e- Cu(s) 0,34 Cu+(aq) + e- Cu(s) 0,52 I2+(s) + 2e- 21-(aq) 0,54 Fe3+(aq) + e- Fe2+(aq) 0,77 Ag+(aq) + e- Ag(s) 0,80 Hg2+(aq) + 2e- Hg( ) 0,85 2Hg2+(aq) + 2e -Hg2(aq) 0,90 Br2( ) + 2e- 2Br-(aq) 1,07 O2(g) + 4H + (aq) + 4e -2H2O( ) 1,23 CI2(aq) + 2e- 2CI-(aq) 1,36 H2O2(aq) + 2H+(aq) + 2e -2H2O( ) 1,78 S2O2(aq)2-(aq) + 2e -2SO22-(aq) 2,01 F2(g) + 2e- 2F-(aq) 2,87 3. Metodologi Penelitian Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Maret sampai april 2017, pengujian daya listik dilakukan di Laboratorium Fakultas Teknik Universitas Halu Oleo dan pengujian kadar garam dilakukan di Laboratorium Forensik dan Mikrobiologi, FMIPA, Universitas Halu Oleo.
Alat dan bahan yang digunakan adalah multi meter, mistar, gelas ukur, salt meter, neraca analitik, dan tang.Bahan yang digunakan adalah air, garam, plat tembaga, plat aluminium, kabel dan wadah.
Prosedur Percobaan
Adapun prosedur percobaan penelitian ini yaitu menyiapkan alat dan bahan penelitian, membuat sel elektrokimia sebanyak 2 sel dengan luas penampang tembaga dan seng sebesar 30 cm2, siapkan garam dengan variasi massa 25 g, 50 g, 75 g, 100 g, 125 g, 150 g, 175 g, 200 g dan 225 g, mengukur kadar garam sebelum digunakan pada sel eletrokimia dengan volume air 2 liter, masukkan kutup positif dan negativ yang dirangkai seri kedalam larutan air dan garam kemudian ukur daya menggunakan multi meter.
Gambar 2. Sketsa alat uji 4. Hasil Penelitian dan Pembahasan
Berdasarkan hasil penelitian terhadap pengaruh kadar garam terhadap daya yang dihasilkan pembangkit listrik tenaga air garam sebagai energi alternatif terbarukan, didapatkan hasil sebagai berikut:
Tabel 2. Pengaruh kadar garam terhadap daya yang dihasilkan pembangkit listrik tenaga air garam sebagai energi alternatif terbarukan Massa garam (g) Tegangan (volt) Arus (ampere) Kadar garam (%) Daya (watt) 25 1.13 0,010 7 0,011 50 1,19 0,013 18 0,016 75 1,34 0,014 28 0,019 100 1,49 0,018 40 0,026 125 1,67 0,025 54 0,042 150 1,76 0,027 64 0,047 175 1,97 0,029 74 0,058 200 1,10 0,033 83 0,036 225 0,93 0,035 97 0,033
Daya listrik adalah jumlah energi yang diserap atau dihasilkan dalam sebuah sirkuit atau rangkaian. Rumus yang digunakan untuk menghitung daya listrik adalah: P = V. I (1) Keterangan
P = Daya (Watt) V = Potensial (Volt) I = Arus (Ampere)
Kemampan air laut membangkitkan daya listrik dapat dilihat pada tabel berikut sebagai berikut:
Tabel 3. Kemampan air laut membangkitkan daya listrik Tegangan (Volt) Arus (A) Daya (watt) Kadar Garam (%) 1.32 0.014 0.018 27
Untuk penggunaan air laut sebagai sumber energi listrik menggunakan sel elektrokimia hanya dapat menghasilkan daya sebesar 0,018 W.
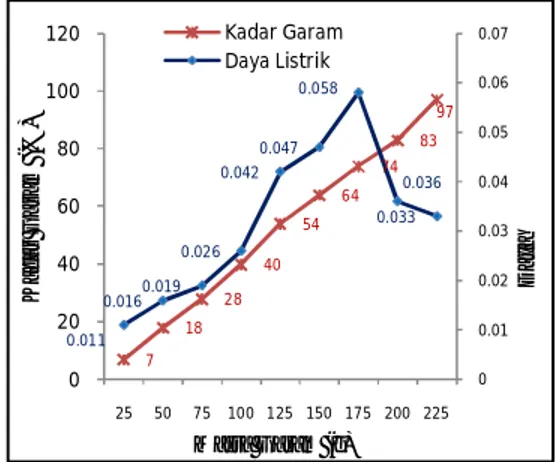
Air garam sebagai sumber energi listrik alternatif dapat dilihat pada gafik berikut:
Gambar 3. Grafik pengaruh kadar garam terhadap daya listrik
Gambar di atas merupakan gafik daya yang dihasikan air garam sebagai sumber energi. Dari gafik, nilai daya tertinggi yang mampu dihasilkan air garam sebagai sumber energi listrik yaitu terdapat pada kadar garam 74 % dapat menghasilkan daya sebesar 0.058 Watt, sedangkan nilai daya terendah terdapat pada kadar garam 7 % dimana hanya mampu menghasilkan daya listrik sebesar 0,011 Watt.
Besarnya energi yang dihasilkan oleh sel eleketrokimia tergantung dari banyaknya sel yang ada pada sel elektrokimia tersebut. Pada peneitian yang dilakukan dalam 2000 ml air yang dicampurkan dengan 175 g garam atau 74 % kadar garam, untuk ukuran tembaga
7 18 28 40 54 64 74 83 97 0.011 0.0160.019 0.026 0.042 0.047 0.058 0.036 0.033 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0 20 40 60 80 100 120 25 50 75 100 125 150 175 200 225 Kadar Garam Daya Listrik Massa Garam (g) K adar Gar am (% ) D aya
sebagai katoda yaitu 3 cm x 6 cm dan penampang aluminium sebagai anoda yaitu 3 cmx6 cm dengan menggunakan 20 pasang sel elektrokimia dapat menghidupkan 3 buah lampu LED (light emitions diode) dengan kapasitas 12 volt dengan daya 1,5 Watt.
Gambar 4. Energi kimia menjadi energi listrik
Hal tersebut dikarenakan makin banyak sel yang ada pada sel elektrokimia makin banyak pula potensial listrik dari penampang tembaga dan aluminium yang dihasilkan pada sel sehingga memperbesar daya listrik, sesuai dengan rumus dari daya listrik yaitu, daya sama dengan hasil perkalian antara potensial listrik dengan arus listrik. Maka, makin besar potensial lastriknya makin besar pula daya yang dihasilkan. Begitupun sebaliknya Antara potensial dan arus listrik sama-sama dapat memperbesar nilai daya listrik apabila nilainya besar dan besarnya nilai potensial dan arus listrik salah satunya tergantung dari besarnya nilai luas penampang katoda dan anoda pada sel elektrokimia,
Kesimpulan
Dari hasil penelitian yang dilakukan dalam wadah 2000 ml air dengan variasi garam mulai dari 25 g, 50 g, 75 g, 100 g, 125 g, 150 g,175 g, 200 g dan 225 g. Bahwa daya terendah yang dihasilkan sel elektrokimia pada massa garam 25 g atau dengan kadar garam 7%, daya yang dihasilkan adalah 0,011 Watt dan terus meningkat namun pada kadar garam 74% atau pada massa garam 175 g, daya listrik yang dihasilkan adalah 0,058 Watt dan
merupakan nilai tertinggi sebelum mengalami penurunan daya pada massa garam 200 g atau dengan kadar garam 83% dan terus mengalami penurunan seiring peningkatan jumlah kadar garam, hal ini disebabkan karena H2O tidak mampu lagi
mengurai NaCl menjadi Na+ dan Cl-.
Besar kecilnya arus listrik dan potensial listrik suatu sel elektrokimia dipengaruhi dari banyaknya jumlah sel dan luasan penampang sel elektoda, dimana potensial listrik dari sel elektrokimia dipengaruhi banyaknya jumlah sel elektrokimia serta besaran arus listrik yang dihasilkan dengan memperbesar luasan penampang elektroda.
Daftar Pustaka
Fariya, S. dan Rejeki, S. 2015. SEACELL (Sea Water Electrochemical cell) Pemanfaatan Elektrolit Air Laut Menjadi Cadangan Sumber Energi Listrik Terbarukan Sebagai
Penerangan Pada Sampan. Program
Pascasarjana, Fakultas Teknologi Kelautan ITS, Surabaya.
Hamann, C.H., Hamnett, A., Vielstich. 1998. Electrochemistry. Wiley VCH. USA.
Kuwahara. 2001. Geologi Laut. Jakarta: Erlangga.
Udi,A.M dan Kurniawan,F. 2013. Simulasi Prototipe on Field Battery Melalui Pemanfaatan Perbedaan Salinitas Dengan Beberapa Pasangan
Elektroda. FMIPA, Institut Teknologi
Sepuluh Nopember (ITS). Surabaya Utami, B., Nugroho, A.C., Mahardiani, L.,
Yamtinah, B. 2007.Kimia Untuk SMA
dan MA Kelas XII Program Ilmu Alam.
Pusat Departemen Pendidikan Nasional, Jakarta.