PADA
DARI
PASIR
46 ISSN 0216 - 3128
OPTIMASI
WAKTU
DAN
TINGKAT
OKSIDASI
PEMBUATAN
KONSENTRAT
Ce, La DAN Nd
MONASIT
MV. Purwani, dkk.
MV Purwani dan Suyanti
Pusa/ Teknologi Akselera/or dan Proses Bahan - BATAN
ABSTRAK
OPTIMASI WAKTU DAN TINGKATOKSIDASI PADA PEMBUATAN KONSENTRAT Ce, La DAN Nd DARI PASIR MONASIT Telah dilakukan oksidasi ber/ingka/ pada pembua/an konsentrat Ce, konsentrat Nd dan konsentrat La dad logam tanahjarang hidroksida ( LTJOH ) hasil olah pasir monasit. Parameter yang diteliti adalah wak/u oksidasi danjumlah tingkat oksidasi. Pada pelarutan umpan25gram LTJOH hasil olah pasir monasit dalam 80 ml HNOJyang dioksidasi dengan KBrOJ=1 gram, hasilterbaik dicapai pada wak/u oksidasi op/imasi 30 menit. Pada /ingka/ oksidasi 1pembua/an konsentrat Ce diperoleh berat konsentrat Ce = 9,7753 gram, kadar Ce = 71,07%. Efisiensi pengendapan Ce = 93,77 %. FP Ce-Th = 2,6393, FP Ce-La= GI?dan FP Ce-Nd = 77,3944. Untuk meningkatkan efisiensi pengambilan Ce supaya
diperoleh konsen/ra/ Nd dan konsentra/ La yang mengandung Ce sekecil mungkin dilakukan oksidasi ber/ingka/. Pengambilan Ce maksimum dicapai pada /ingka/ oksidasi ke 11/ Pada tingka/ oksidasi 11/
diperoleh berat konsentra/ Nd= 10,1842 gram, kadar Nd=38,92 %,efisiensi pengendapan Nd =86,78%. FP Nd-Th=8,1758, FP Nd-La= 1,5935 dan FP Nd-Ce= 15,9675. Berat konsen/rat La yang diperoleh = 1,6731 gram, kadar La = 81,45%, efisiensi pengendapan La = 80,67 %. FP La-Th = c.o, FP La-Ce =
270,9786 dan FP La-Nd=10,3254..
ABSTRACT
THE OPTIMA TION OF TIME AND DEGREE OF OXYDA TION ON MAKING OF Ce, La AND Nd CONCENTRATE FROM MONAZITE SAND. The mul/is/age oxidation at making ofCe concentrate, Nd concentrate and La concentrate from rare earth hydroxide product treatment of monazite sand have been done... The parametres observed were time and stage of oxydation. At dissolving of 25 gram rare earth hydroxide in 80 ml HNOJ and was oxydated with 1 gram of KBrOJ' the best yield on making of Ce concentrate was achieved at oxydation time was 30 minutes.. At first stage of oxydation , on making ofCe concentrate were obtained the weight ofCe concentrated.=9.7753 gram, percentage ofCe =71.07%, The efisiensi ofprecipitaton ofCe =93.77 %.SF (Separation Factor) Ce-Thc=2.6393, SF Ce-La=Gl?andSF
Ce-Nd =77.3944. For upgrade recovery efficiency ofCe, to make La and Nd concentrate which content of Ce minimum, the multistage oxydation was done. The maximum recovery of was achieved at the3rd
oxydation. At the3rdoxydation were obtained the weight of Nd concentrlate= 10,1842 gram, percelltage of Nd =38.92 %.the precipitatiun efficiency of Nd=86.78%. Sf Nd-Th=8./758, SF Nd-La= 1.5935 dan FP Nd-Ce = 15.9675, the weight of La = 1.6731 gram, , percentage of La =81.45%. The precipitation eficiency of La=80.67%. SF La-Th=c.o, SF La-Ce=270.9786 and SF La-Nd= 10.3254..
PENDAHULUAN
Scrillm
(Nd) mcmpunyai(Cc), I.antanllmnilai ckonomis(La) dan Ncodimillmyang tinggi mengingat manfaatnya dalam berbagai industri. Ketiga unsur ini merupakan unsur-unsur tanah jarang yang terdapat dalam pasir monasit. OiIndonesia Pasir Monasit merupakan hasil samping pencucian bijih timah oleh PT Tambang Timah yang terdapat di P.Bangka dan Belitung. Pasir Monasit ini hanya dibuang dilaut disekitar pulau terse but. Selain itu , pasir monas it juga terdapat di Singkep, Rirang dan Tanah Merah.
Kegunaan Ce misalnya sebagai bahan katalis pada penyulingan minyak bumi, logam
paduan yang tahan suhu tinggi dan korosi, industri kacaloptik (CRT, kamera), kapasitor, keramik bcrwarna dan cat scrra scbagai bahan pCl110lcs . tangki pcngcmas .. Kcgunaan La scbagai bahan
baku pembutan gelas optik dan filamen MBE, sedang kegunaan Nd antara lain untuk bahan pembuatan magnet dan superkonduktor.(I)
Penelitian ini bertujuan membuat konsentrat Ce hidroksida, Nd hidroksida dan La oksalat dari konsentrat logam tanah jarang (LTJ) hasil olah pasir monas it dengan cara oksidasi dan pengendapan, sebagai langkah awal untuk memperoleh bahan yang mumi.(2) Pada penelitian sebelumnya telah diperoleh konsentrat LTJ dari pasir monasit berbentuk hidroksida (LTJOH).
Prosldlng PPI • PD/PTN 2006
Pustek Akselerator dan Proses Bahan· BATAN Yogyakarta, 10 Juli 2006
MV. Purwani, dkk. ISSN 0216 - 3128
47
10 Ce
(N01)~
+
5H2Q10 Ce(N03)4
+
Kp+
Br/+
35Hp Untuk memisahkan dan membuat konsentrat Ce,konsentrat La dan konsentrat Nd dilakukan dengan beberapa tahapan proses sebagai berikut :
Pembuatan konsentrat Ce dengan oksidasi dan pengendapan fraksional.
Unsur-unsur logam tanah jarang biasanya mempunyai valensi rangkap. Sifat yang spesifik dari Ce ialah Ce mempunyai valensi rangkap III dan IV, sedang unSUf-unsur yang lainnya umumnya mempunyai valensi rangkap II dan III. Berdasarkan perbedaan ini, maka jika semua unsur
(LTJ)(OH)3 .j,
+
3HNO/L TJ)(NO\+
3HpIOCe(OH)3
+
30HN03 IOCe(N03)/ 30H 022KBr03 K20
+
Br2i
+
50" 10Ce(N0lh+
10HNO,+
5 O!! IOCe(OH)3+
40.HN03+
2KBrd 3Terjadinya reaksi dan terbentuknya hasil reaksi diperlukan waktu yang cukup agar reaksi dan hasil reaksi yang diperoleh maksimal. Reaksi oksidasi di atas merupakan reaksi heterogen searah (tidak bolak-balik) karena reaktan terdiri dari larutan dan padatan (KBr03) dan hasil reaksi selain berupa cairan juga terbentuk gas.
Kecepatan reaksi berkurangnya reaktan atau bertambahnya hasil reaksi secara matematis yang sederhana dapat dirumuskan :
A
+
B+
C~ 0+
E+
F+
G (6)r = k CAn= - d CA
I
dt (7)kCA"=
-
dCAI dt (8)dCA
I
CA"= - k dt (9)Jika diintegralkan dengan batasan
t = 0 ~ CA = CAo (10)
t=t ~ CA=CA (11)
[1/(n-I)] {[I/CA("-')] - [I/CAo(n-,)] }=kt (12) r =kecepatan reaksi mol yang terbentuk persatuan
waktu
CA = mol A sesudah bereaksi
CAo= mol A mula=mula ( sebelum bereaksi ) k = konstante kecepatan reaksi
t = waktu reaksi n = orde reaksi
J ika persamaan tersebut untuk hasil reaksi 0 maka CD = CA = CAo- A yang bereaksi
Dari persamaan terse but untuk kesempurnaan reaksi sangat dipengaruhi oleh waktu reaksi.
Ce diubah menjadi valensi IV, maka Ce dapat dipisahkan dari unsur lainnya. Bila LTJOH dioksidasi, maka unsur-unsur logam tanah jarang selain. Ce akan berubah menjadi valensi III, sedangkan Ce akan berubah menjadi valensi IV. Untuk mempermudah terjadinya oksidasi, LTJOH dilarutkan terlebih dahulu memakai HN03. Asam nitrat sangat mudah melarutkan LTJOH dan sekaligus berfungsi sebagai oksidator, sehingga oksidasi akan semakin mudah. Oksidator yang dipakai ialah KBr03 .
(I)
(2) (3)ill
(5)Oleh karena itu, pada penelitian ini diteliti waktu reaksi oksidasi.
Disamping waktu oksidasi, mengingat bahwa tidak ada reaksi yang sempurna atau konversi mencapai 100%, maka untuk meningkatkan konversi hasil dilakukan oksidasi bertingkat. Pada penelitian sebelumnya telah dilakukan variasi jumlah oksidator yang dipakai, tetapi tidak diperoleh konversi yang mendekati 100%. Kesempurnaan pengambilan atau pembuatan konsentrat Ce ini sangat penting, karena jika Ce belum terambil sempurna maka konsentrat La dan Nd yang dihasilkan masih dikotori oleh Ceo
Pemisahan Ce, La dan Nd dilakukan dengan cara pengendapan. Proses pengendapan adalah proses terjadinya padatan karena melewati besarnya harga hasil kali kelarutan (solubility product) atau solubility product constant ( Ksp) dan dalam keadaan jenuh. Berdasarkan perbedaan Ksp masing-masing unsur dalam bentuk senyawanya, maka unsur-unsur dapat dipisahkan satu dengan lainnya. Untuk memisahkan Ce dari larutan nitrat dilakukan pengendapan dengan NH40H. Serium (IV) dalam bentuk hidroksida mempunyai harga Ksp kecil, sehingga akan mudah mengendap pada pH rendah. Sedang un sur yang lain mengendap pada pH tinggi karena mempunyai Ksp yang besar. Pada valensi IV, sifat kebasaan Ce akan mirip dengan Th, kedua unsur ini akan mengendap bersama-sama. Reaksi yang terjadi sebagai berikut :
Ce(N03)4 +4NH40H -+Ce(OH)4 J,+4NH4N03 (13)
Prosiding PPI • PDIPTN 2006
48 ISSN 0216-3128 MV. Purwani, dkk.
Pembuatan konsentrat Nd dengan cara pengendapan memakai NH40H
Pada pH rendah La, Nd dan unsur-unsur lainnya sukar mengendap atau dengan kata lain masih berbentuk larutan. Larutan sisa setelah pengambilan Ce berwarna agak merah jambu yang menunjukkan warna Nd. Untuk memisahkan Nd, larutan diendapkan dengan ammonia pada pH 8. Untuk mengetahui keberhasilan proses, selain berat dan kadar unsur yang diperoleh juga dihitung
Pembuatan konsentrat La dengan pengendapan memakai asam oksalat.
Setelah Nd dipisahkan, ke dalam larutan dimasukkan asam oksalat sampai tidak terbentuk endapan lagi. Endapan putih yang terbentuk adalah konsentrat La oksalat.
La(N03»+3H2C204 ~ La2(C204hj.+ 3HN03 (15) efisiensi pengendapan dan faktor pisah un sur satu dengan lainnya.
Efi"ISlensl pengen dapan unsur
=
kadar unsur dalam konsentrat x berat konsentrat x1000/,0
(16)kadar unsur dalam LTJOH x 25
Faktor Pisah A _B = efisiensi pengendapan unsur A
efisiensi pengendapan unsur B
(17)
BAHAN DAN TAT A KERJA
Bahan
LTJOH.: Th = 5,84%, La = 12,58%, Ce = 29,64%, Nd
=
12,82%., HN03 teknis , NaOH teknis, KBr03 dari Merck, air suling. NH40H teknis, unsur LTJ untuk standar analisis.Alat
Pembuatan konsentrat La
Filtrat sesudah pemisahan Nd ditambah asam oksalat sampai tidak terbentuk endapan lagi. Endapan disaring, dikeringkan, ditimbang dan dianalisis.
Variasi tingkat oksidasi
Oksidasi
I
Pembuatan konsentrat Ceo
LTJ OH sebanyak 25 gram dilarutkan dalam 80 ml HN03 teknis ditambah 1 gram KBr03' Sambil diaduk dan dipanaskan dengan waktu divariasi selama waktu optimum yang diperoleh pada variasi waktu. Sesudah dingin ditambah NH40H teknis sampai pH 1. Endapan yang diperoleh disaring, dikeringkan, ditimbang dan dianalisis.
Pengaduk pemanas, pH meter, ayakan, penggerus, alat gelas, spektrometer pendar sinar X
Tata Kerja
Variasi waktu oksidasi
Pembuatan konsentrat Ce
LTJ OH sebanyak 25 gram dilarutkan dalam 80 ml HN03 teknis ditambah 1 gram KBr03 sambil diaduk dan dipanaskan dengan waktu divariasi selama 15, 20, 25, 30 dan 35 men it. Sesudah dingin ditambah NH40H teknis sampai pH 1. endapan yang terbentuk disaring, dikeringkan, ditinbang dan dianalisis.
Pembuatan konsentrat La + Nd Larutan sisa pemisahan NH40H teknis sampai pH 10, terbentuk disaring, dikeringkan, dianalisis.
Oksidasi
II
dan seterusnyaCe ditambah endapan yang ditimbang dan
Pembuatan konsentrat Nd
Larutan sisa pemisahan Ce ditambah NH40H teknis sampai pH 8, endapan yang terbentuk disaring, dikeringkan dan dianalisis.
Endapan pH 10 dilarutkan lagi dalam 80 ml HN03 teknis ditambah 1 gram KBrOJ
Sambil diaduk dan dipanaskan selama waktu optimum yang diperoleh pada variasi waktu.
Prosldlng PPI • PDlPTN 2006
Pustek. Akselerator dan Proses Bahan· BATAN Yogyakarta, 10 Jull 2006
MV. Purwalli, dkk. ISSN 0216 - 3128 49 Pada saat pelaksanaan penelitian, karena pemanasan sampai mendidih dan terbentuk gas, maka setelah pemanasan 35 menit larutan sangat kental dan tidak bisa diaduk sehingga pemanasan dihentikan.
Pada Gambar 2 dapat dilihat hubungan antara waktu oksidasi dengan kadar un sur. Dalam konsentrat Ce, kadar Ce pada waktu oksidasi 15 men it sebesar 46%, kadar Th 3,07%, kadar Nd 0,8% dan La tidak terdeteksi. Waktu oksidasi 15 menit ini, selain belum terjadi oksidasi yang sempuma juga belum terjadi pelarutan hidroksida yang sempuma. Padatan yang tidak larut mengandung unsur lain selain Ce, Th, La dan Nd. Pada waktu oksidasi berlangsung 20 - 25 men it, kadar Ce sebesar 65 - 68% dan mencapai puncaknya pada waktu oksidasi 30 men it sebesar 71,07%. Hal ini menunjukkan bahwa reaksi semakin sempuma. Th (OH)4 mempunyai sifat kebasaan yang sangat kuat dan sangat mudah mengendap. Meskipun kadar Th dalam umpan kecil, tetapi dalam endapan konsentrat Ce kadarnya relatif besar, yaitu berkisar antara 3,07 - 6,7%. Harga pKsp Th (OH)4 = 44,6 dan pKsp Ce(OH)4 = 50,4, sehingga kedua unsur ini sangat mudah mengendap. Hidroksida Ce(I1J) atau Ce(OH)3 mempunyai harga pKsp
=
19,82, sangat jauh bcrbeda dcngan pKsp CC(OH)4'Jika oksidasi Ce(I1I) menjadi Ce(IV) tidak berlangsung dengan baik, maka tidak akan terjadi pengendapan yang cepat pada pH rendah. Dengan melihat kadar Ce yang tinggi dalam endapan, menunjukkan bahwa oksidasi terjadi dengan sangat baik. Harga pKsp La (OH»)
=
22,3 dan pKsp Nd(OH»)=
23,3, oleh karena itu La(OH») . dan Nd(OH») tidak mudah mengendap. Dengan demikian kadar La dan Nd sangat kecil dalam konsentrat CeoSesudah dingin ditambah NH40H teknis sampai pH J. Endapan yang diperoleh disaring,
dikeringkan, ditimbang dan dianalisis.
Larutan sisa pemisahan Ce ditambah NH40H teknis sampai pH 10, endapan yang terbentuk disaring, dikeringkan dan dianalisis. Pekerjaan diulangi sampai Ce tidak terbentuk dalam endapan pH I membuktikan oksidasi sudah sempuma.
HASIL DAN PEMBAHASAN
Pengaruh
waktu oksidasi
Pada waktu oksidasi berlangsung selama 15 men it, endapan konsentrat Ce yang diperoleh sebanyak 8,7 gram. Semakin lama waktu oksidasi 20 dan 25 men it, endapan yang terbentuk semakin banyak. Tetapi setelah waktu oksidasi 30 dan 35 menit endapan yang terbentuk relatif sarna sebesar kira-kira 10 gram. Seperti dijelaskan pad a persal11aan 6 sal11paipersal11aan 12 hubungan antara konsentrasi atau mol yang bereaksi maupun yang terbentuk dipengaruhi oleh waktu reaksi atau oksidasi. Pada Gambar I dapat dilihat grafik hubungan antara waktu oksidasi dcngan bcrat konsentrat Ce yang terbentuk membentuk kecenderungan garis yang asimtotis naik ke atas. Waktu oksidasi 30 menit merupakan waktu yang optimum, karena pada waktu ini sudah tidak ada kenaikan hasil reaksi. Seandainya reaksi yang berlangsung orde satu maka dengan pengintegrasian persamaan 12 akan diperoleh persamaan CA
=
CAO'e -kt untuk reaktan. Jika digambarkan hubungan antara waktu dan mol yang tersisa akan membentuk garis asimtotis kebawah. Dengan demikian untuk produk akan diperoleh hubungan yang membenuk garis asimtotis ke atas .
1 1
10
9
8
.§ ~~
80 ~Q)I
)(~~
i!
40 /Cc
::s Q) •••• tI?~ C
0
'C=
~ oX15 20 25 30 35
Waktu oksidasi, menit
-+-
Th ___ La ~Ce--- Nd
Waktu oksidasi, menit
15
20
25
30
35
Gambar
2.Hubungan
waktu
oksidasi dengan
kadar unsur dalam konsentrat Ce
Gambar
1.Hubungan waktu oksidasi
dengan
berat konsentrat Ce
Gambar 3 menunjukkan bahwa efisiensi pengendapan Ce sangat besar dibanding lainnya. Semakin besar waktu oksidasi, reaksi pelarutan dan
Prosiding PPI • PDlPTN 2006
50
-
ISSN 0216 - 3128 MJ-: Purwani, dkk.oksidasi yang terjadi semakin sempurna, Ce(IV) yang terbentuk semakin banyak, sehingga efisiensinya semakin besar.
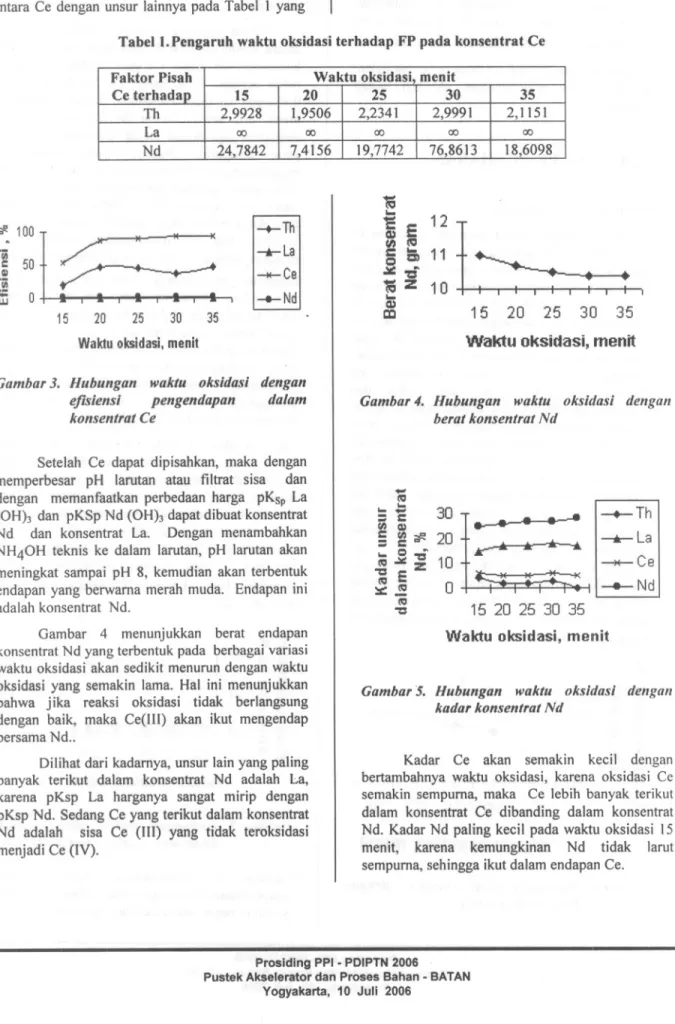
Dengan melihat besarnya faktor pisah ( FP ) antara Ce dengan unsur lainnya pada Tabel 1 yang
sangat besar, lebih memantapkan bahwa Ce mudah dipisahkan dari unsur lainnya, kecuali dengan Th.
Waktu oksidasi optimum dipilih 30 men it, dengan FP Ce- Th, FP Ce-La dan FP Ce-Nd paling besar.
Tabel1. Pengaruh waktu oksidasi terhadap FP pada konsentrat Ce
Faktor Pisah Waktu oksidasi, menit
Ce terhadap 15 20253035 Th 2,9928 1,9506 2,23412,99912,1151 La 00 00 000000 Nd 24,7842 7,4156 19,774276,861318,6098 /: )( Hie
~
1.1,1,111
15 20 25 30 35-+-
Th-+-
La --- Ce-e-
Nd 15~ e
12
I
f;! ~5
5
11
+---....
.:.: -=
~
~ z
10
~,~,:
~
15
20
25
30
35
Walctu oksidasi, menit
Waktu oksidasi, menit
Gambar
3.Hubungan
waktu oksidasi dengan
eflSiensi
pengendapan
dalam
konsentrat Ce
Gambar
4.
Hubungan
waktu
oksidasi dellgall
beratkollselltratIVd
Waktu oksidasi,
menit
Gambar
5.Hubungan
waktu
oksidasi dellgall
kadar konsentrat IVd
Kadar Ce akan semakin kecil dengan bertambahnya waktu oksidasi, karena oksidasi Ce semakin sempurna, maka Ce lebih banyak terikut dalam konsentrat Ce dibanding dalam konsentrat Nd. Kadar Nd paling kecil pada waktu oksidasi 15 menit, karena kemungkinan Nd tidak lamt sempurna, sehingga ikut dalam endapan Ceo
15 20 25 30 35
--+-
Th --.- La _____ Ce
-..- N d----•
----Setelah Ce dapat dipisahkan, maka dengan memperbesar pH larutan atau filtrat sisa dan dengan memanfaatkan perbedaan harga pKsp La (OH)3 dan pKSp Nd (OH)3 dapat dibuat konsentrat Nd dan konsentrat La. Dengan menambahkan NH40H teknis ke dalam larutan, pH larutan akan meningkat sampai pH 8, kemudian akan terbentuk endapan yang berwarna merah muda. Endapan ini adalah konsentrat Nd.
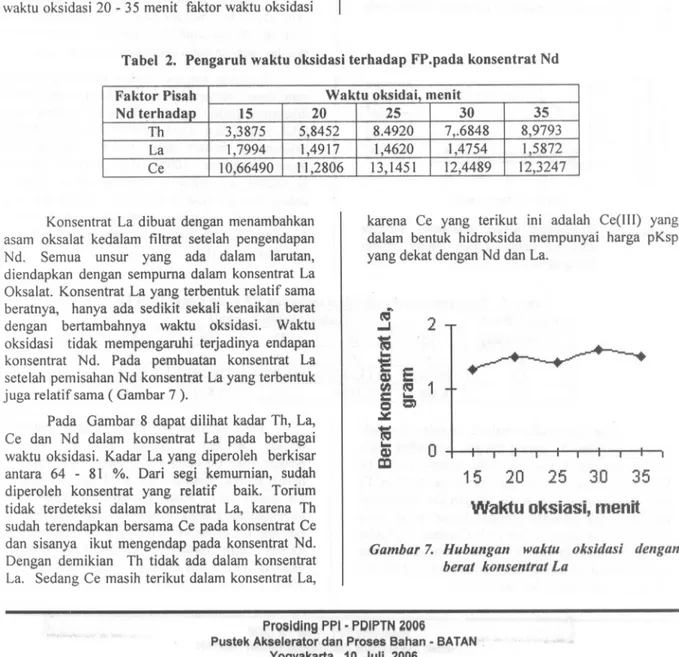
Gambar 4 menunjukkan berat endapan konsentrat Nd yang terbentuk pad a berbagai variasi waktu oksidasi akan sedikit menurun dengan waktu oksidasi yang semakin lama. Hal ini menunjukkan bahwa jika reaksi oksidasi tidak berlangsung dengan baik, maka Ce(III) akan ikut mengendap bersama Nd ..
Dilihat dari kadarnya, unsur lain yang paling banyak terikut dalam konsentrat Nd adalah La, karena pKsp La harganya sangat mirip dengan pKsp Nd. Sedang Ce yang terikut dalam konsentrat Nd adalah sisa Ce (111) yang tidak teroksidasi menjadi Ce (IV).
Prosldlng PPI • PDIPTN 2006
Pustek Akselerator dan Proses Bahan· BATAN Yogyakarta, 10 Juli 2006
M V. Purwani, dkk. ISSN 0216 - 3128
51
Gambar
6.Hubungall
waktu oksidasi dengan
efisiellsi
pengendapan
dalam
konsentrat Nd
Dilihat dari harga efisiensi pengendapannya, pad a waktu oksidasi 15 men it, efisiensi pcngendapan agak keci I karena kadar dan berat endapan konsentrat Nd yang terbentuk juga agak keci!. Sedang pada berbagai variasi waktu oksidasi setelah 15 men it efisiensinya hampir sama. Besarnya efisiensi pengendapan Nd berkisar an tara 94 - 98 %. Demikian juga dengan La, pada waktu oksidasi 15 men it kadar La kecil, maka efisiensinya juga kecil sekitar 45%. Tetapi setelah waktu oksidasi 20 - 35 menit faktor waktu oksidasi
Waklu oksidasi, men~ 15 20 25 30 35
__ Th ___ La __ Ce
--Nd
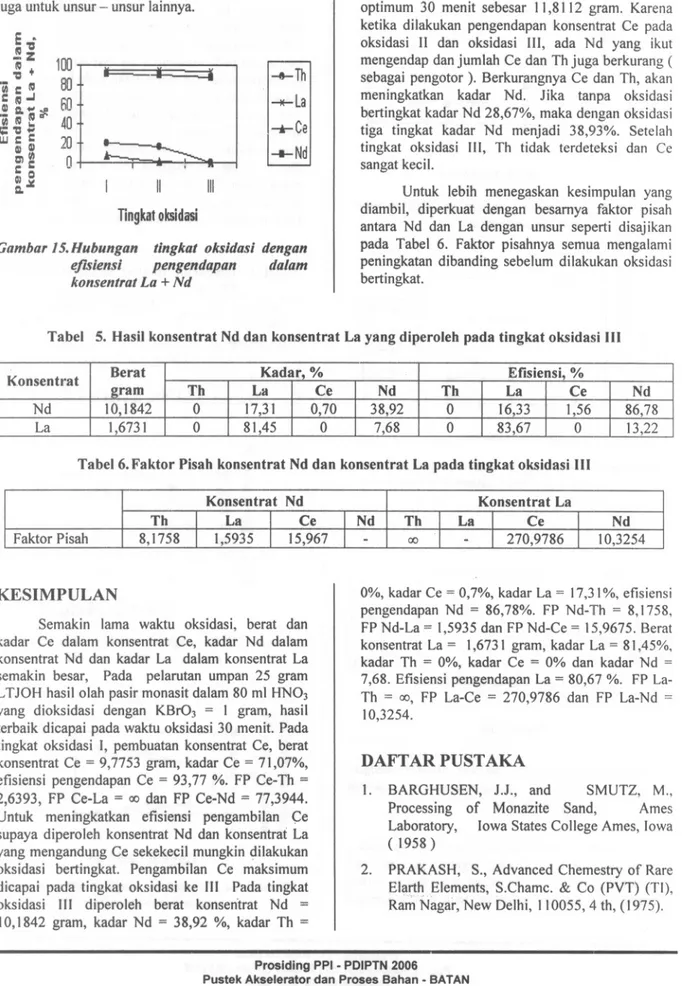
tidak begitu berpengaruh, maka efisiensi pengendapan La dalam konsentrat Nd hampir sama sekitar 60%. Pengendapan Ce sangat dipengaruhi oleh waktu oksidasi, maka dengan meningkatnya waktu oksidasi, efisiensi pengendapan Ce dalam konsentrat Nd semakin keeil. Konsentrasi Ce dalam konsentrat Nd tinggal 6 - 10%.
Dari Tabel 2 dapat dilihat bahwa harga FP yang paling besar adalah harga FP Nd-Ce. Hal ini menunjukkan bahwa Nd dan Ce mudah dipisahkan dengan metoda ini. Semakin besar waktu oksidasi harga FP Nd-Ce semakin besar. Hal ini menunjukkan bahwa Ce sudah semakin sempurna menjadi Ce(IV), sehingga sisanya dalam konsentrat Nd semakin sedikit. Harga FP Nd-Th semakin besar dengan bertambahnya waktu oksidasi, meskipun pengaruhnya tidak begitu kuat. Harga FP Nd-La paling keeil dan harganya relatif sarna, menunjukkan La dan Nd sangat sulit dipisahkan dengan metoda ini. Sehingga perlu dicoba dengan metoda yang lain.
Tabel 2. Pengaruh waktu oksidasi terhadap FP.pada konsentrat Nd
Faktor Pisah Waktu oksidai, menit
Nd terhadap 15 20302535 Th 3,3875 5,8452 8.4920 7,.68488,9793 La 1,7994 1,4917 1,4620 1,4754 1,5872 Ce 10,6649013,145112,448912,324711,2806
Konsentrat La dibuat dengan menambahkan asam oksalat kedalam filtrat setelah pengendapan Nd. Semua unsur yang ada dalam larutan, diendapkan dengan sempurna dalam konsentrat La Oksalat. Konsentrat La yang terbentuk relatif sama beratnya, hanya ada sedikit sekali kenaikan berat dengan bertambahnya waktu oksidasi. Waktu oksidasi tidak mempengaruhi terjadinya endapan konsentrat Nd. Pada pembuatan konsentrat La setelah pemisahan Nd konsentrat La yang terbentuk juga relatifsama (Gambar 7).
Pada Gambar 8 dapat dilihat kadar Th, La, Ce dan Nd dalam konsentrat La pada berbagai waktu oksidasi. Kadar La yang diperoleh berkisar antara 64 - 81 %. Dari segi kemurnian, sudah diperoleh konsentrat yang relatif baik. Torium tidak terdeteksi dalam konsentrat La, karena Th sudah terendapkan bersama Ce pad a konsentrat Ce dan sisanya ikut mengendap pada konsentrat Nd. Dengan demikian Th tidak ada dalam konsentrat La. Sedang Ce masih terikut dalam konsentrat La,
karena Ce yang terikut ini adalah Ce(lII) yang dalam bentuk hidroksida mempunyai harga pKsp yang dekat dengan Nd dan La.
15
20
25
30
35
Waktu oksiasi, menit
Gambar
7.Hubungan
waktu oksidasi dengan
berat konsentrat La
Pro$lding PPI • PDIPTN Z006
52 ISSN 0216 - 3128 MV. Purwan;, dkk. --.- 11'1 ...- La
~_ce
i--t-+-; I •
Ndl15
2J
2)
3)
35
Waktu oksidasi, menit
Gambar
8.Hubungan
waktu ok.'i;das; dengan
kadar konsentrat La
Dalam filtrat setelah pengambilan Nd, unsur La adalah yang paling dominan. Oleh karena itu efisiensi pengendapan La juga paling besar dibanding unsur yang lain. Meskipun demikian efisiensinya tetap relatif kecil yaitu berkisar antara 30 - 40%, tetapi kadar La yang diperoleh relatif besar, hanya konsentrat La yang diperoleh sedikit beratnya sekitar 2 gram. Besamya efisiensi pengendapan pada konsentrat La dapat dilihat pada Gambar 9.
~:!
40~~ __ Th c'tij--La
.- = ... 30 '" c=
.~ ~ ~ ~ 20 -f<-Ce ~ ~ c--Nd
w ~ ~ 10 ______ --+- -..e -41 ~~ 0! ~
15 20 25 30 35Waktu okidasi, menit
Gambar
9.Hubungan
waktu oksidasi
dengan
eftsiensi pengendapan unsur da/am
konsentrat La
Dilihat FP La terhadap unsur lain pada Tabel
J,
FP La -Th tak terhingga, menunjukkan La sangat mudah dipisahkan dari Th. Demikian juga FP La-Ce sangat besar, hal ini juga menunjukkan bahwa La dapat dipisahkan dari CeoSedang FP La-Nd relatif paling kecil, menunjukkan bahwa La dan Nd lebih suli! dipisahkan dengan metoda ini dibandingkan pemisahan dari Th dan Ceo Dengan waktu oksidasi 30 men it, dapat diperoleh FP La-Th tak terhingga, FP La-Ce = 259,3997 dan FP La-Nd = 9,6723 Pengaruh tingkat oksidasi.
Pada pengaruh tingkat oksidasi dipakai umpan 25 gram LTJOH yang dilarutkan dalam 80 ml HN03 pekat teknis dioksidasi dengan I gram KBr03 selama waktu optimum 30 menit. Untuk pemisahan Ce, hasil oksidasi diendapkan pada pH I memakai amonia.
Oksidasi bertingkat bertujuan untuk menyempumakan pengambilan Ce dari konsentrat LTJOH supaya konsentrat Nd dan konsentrat La yang diperoleh mengandung Ce sekecil-kecilnya. Gambar ] 0 mellunjukkan hubungan antara tingkat oksidasi dengan berat endapan konsentrat Ceo
Semakin banyak tingkat oksidasi, endapan yang diperoleh semakin sedikit dan proses oksidasi dihentikan pada tingkat oksidasi III, karena sudah tidak efektif lagi. Dari Gambar 10 dapat diambil kesimpulan, bahwa suatu reaksi memang tidak dapat sempuma 100% dan dengan oksidasi bertingkat ini untuk menyempumakan reaksi , dalam hal ini reaksi oksidasi. Kadar Ce pada konsentrat Ce yang diperoleh pada tingkat oksidasi ] sebesar 7] ,07%, kemudian menurun pada tingkat oksidasi II dan III.
. ren
garu ---~-
--
--Faktor Pisah Waktu oksidasi. menit
Nd terhadap 15 2025 3035 Th 00 00 00 00 00 Ce 75,9422 ] 13,]532]41,954] 259,3887245,79]4 Nd 4,4003 7, ] 085 7,0722 9,8723. 7,7936
3
h waktu oksidasi terhadaD FP Dada kL
Dapat disimpulkan bahwa oksidasi Ce pad a tingkat oksidasi I paling banyak dibanding pada tingkat oksidasi II dan III. Pada oksidasi II dan III kemungkinan ada unsur lain selain La, Nd dan Th yang mempunyai sifat mirip dengan Ceo Hubungan antara tingkat oksidasi dengan kadar unsur pada konsentrat Ce dapat dilihat pada Gambar ] ]. Kadar Th juga menurun dari 6 - 2% merupakan unsur yang terbesar terikut dalam konsentrat Ce, La tidak terdeteksi dan kadar Nd naik ] - 5%.
Pada Gambar 12 dapat dilihat hubungan tingkat oksidasi dengan efisiensi. Efisiensi pengambilan Ce tentu saja paling besar dibanding unsur lainnya. Meskipun kadar Th dalam konsentrat Ce relatif kecil, tetapi efisiensinya relatif besar, membuktikan bahwa sebagian Th sudah mengendap bersama Ce dalam konsentrat Ceo Sedang untuk La, karena tidak terdeteksi dalam konsentrat Ce, efisiensinya 0% dan efisiensi Nd berkisar antara I
-]0%.
Prosiding PPI - PDIPTN 2006
Pustek Akselerator dan Proses Bahan - BATAN Yogyakarta, 10 Juli 2006
MV, Purwani, dkk. ISSN 0216 - 3128 53
Tingka1 oksidasi
Gambar JO.Hubungan
tingkat IJksidasi dengan
berat konsentrat Ce
11
0) Q)0
-
•...ro-
Q)c:6
If} ~c:0
ro•... Q) CD 70 ~ ~ 60 0; oi 50 "EO ~ "§ 40 c::-::~ 30 ~ ~ 20'" 0
::.::-'" 10 o IIIII
__ Th--La
-.- Ce __ Ndjumlah oksidator yang tetap, sedang jumlah yang dioksidasi menurun reaksinya akan semakin baik.
Gambar 13 dan Gambar 14 menunjukkan kondisi konsentrat La + Nd yang diperoleh. Berat konsentrat Nd + La sedikit menurun dengan bertambahnya tingkat oksidasi, karena Ce dan Th sudah terendapan pada konsentrat Ce, sehingga jumlahnya pada konsentrat La+Nd semakin sedikit. Nd sedikit akan ikut mengendap pada konsentrat Ce pada tingkat oksidasi II dan tingkat oksidasi III. Sedang La hampir tidak ikut terendapkan dalam konsentrat Ce pada oksidasi II dan III.. Meskipun berat konsentrat La + Nd menurun, tetapi jumlah La dan Nd yang terendapkan relatif tetap jumlahnya, maka kadar La dan Nd semakin meningkat pada tingkat oksidasi II dan III. Kadar Ce dan Th hampir tidak terdeteksi dalam konsentrat La + Nd.
Tabel 4. Pengaruh tingkat oksidasi terhadap FPCe
Faktor Tinl!kat oksidasi Pisah Ce
I
II
III
terhadao Th 1,63852,63817,7570 La 00 00 00 Nd 27,174476,861375,7714II
III
Tingkat oksidasiGambar 14.Hubungan
tingkat oksidasi dengan
kadar konsentrat La
+
Nd
II
III
Tingkat oksidasi
Gambar 13.Hubungan
tingkat oksidasi dengan
berat konsentrat La
+
Nd
II
III
Tingkat oksidasi
Gambar
II.
Hubungan tingkat oksidasi dengan
kadar unsur da/am konsentrat Ce
:;11 ~ ~ 100 t':IU
'.
1
~ .-.-Th : t':I Q) •• --La tn" ~ ~ 50 ...-Ce Co: ._ 0\I:Jl .-.-Nd ~ E ~ t':I 0 1;:- w t':I I IIIII 'tI Tingkat oksidasiGambar 11.Hubungan
tingkat oksidasi dengan
eflSiensi
pengendapan
da/am
konsentrat Ce
Pada Tabel 4 dapat dilihat bahwa pada , diperoleh FP Ce terhadap unsur lain rata-rata semakin besar. Hal ini dapat dimengerti karena reaksi oksidasinya semakin bain baikl Dengan
-
~ I..'E
~ ~
0
Q.) C)~10
14
+6
.::.:: -~~...I
2
Q.) COe~
!:!
=: 40~~
30+
~
I~i
cl'!20-
...: c
10
('05:0 "CIc
('0 Q ~.:.: ....• --- Th_La
--...- Ce --- NdProsicling PPI - PDIPTN 2006
54 ISSN 0216-3128 MV. Purwani, dkk.
Pad a Gambar 15 dapat dilihat bahwa efisiensi Nd relatif konstant pad a berbagai variasi waktu oksidasi, membuktikan jumlah Nd yang diendapkan dalam konsentrat Nd tetap. Demikian juga untuk unsur - unsur lainnya.
E .
~~
-z
100 ~ +1--,
1;c ~
80~
--8-
Th C~..1 (I)c.•.•~
60--La
•• (Q ~ ~ ;; 40-+-
Ce w~~ 20~
1---
Nd Cj(/) nc c
-OJ 0c.~
IIIII I Tingkat oksidasiGambar 15.Hubungan
tingkat oksidasi dengan
eftsiensi
pengendapan
da/am
konsentrat La
+
Nd
Pada Tabel 5 berat konsentrat Nd setelah oksidasi III sebesar 10,1842 gram, sedang pada pengaruh waktu oksidasi tanpa oksidasi beretingkat berat konsentrat Nd yang diperoleh pad a waktu optimum 30 menit sebesar 11,8112 gram. Karena ketika dilakukan pengendapan konsentrat Ce pada oksidasi II dan oksidasi III, ada Nd yang ikut mengendap dan jumlah Ce dan Th juga berkurang ( sebagai pengotor ). Berkurangnya Ce dan Th, akan meningkatkan kadar Nd. Jika tanpa oksidasi bertingkat kadar Nd 28,67%, maka dengan oksidasi tiga tingkat kadar Nd menjadi 38,93%. Setelah tingkat oksidasi III, Th tidak terdeteksi dan Ce sangat keci!.
Untuk lebih menegaskan kesimpulan yang diambil, diperkuat dengan besamya faktor pisah antara Nd dan La dengan unsur seperti disajikan pad a Tabel 6. Faktor pisahnya semua mengalami peningkatan dibanding sebelum dilakukan oksidasi bertingkat.
Tabel 5. HasH konsentrat Nd dan konsentrat La yang diperoleh pad a tingkat oksidasi III
Konsentrat Herat Kadar,
%
Efisiensi,%
gram Th La Ce Nd ThLa Ce Nd Nd 10,18420 17,3138,920,700 16,3386,781,56 La 1,67310 81,4507,680 83,67013,22Tabel 6. Faktor Pisah konsentrat Nd dan konsentrat La pada tingkat oksidasi III
Faktor Pisah Th 8,1758 Nd Th 00 Konsentrat La La I Ce 270,9786 Nd 10,3254
KESIMPULAN
Semakin lama waktu oksidasi, berat dan kadar Ce dalam konsentrat Ce, kadar Nd dalam konsentrat Nd dan kadar La dalam konsentrat La semakin besar, Pada pelarutan umpan 25 gram LTJOH hasil olah pasir monasit dalam 80 ml HN03
yang dioksidasi dengan KBr03 = I gram, hasil terbaik dicapai pada waktu oksidasi 30 menit. Pada tingkat oksidasi I, pembuatan konsentrat Ce, berat konsentrat Ce = 9,7753 gram, kadar Ce = 71,07%, efisiensi pengendapan Ce
=
93,77 %. FP Ce- Th=
2,6393, FP Ce-La
=
00 dan FP Ce-Nd=
77,3944.Untuk meningkatkan efisiensi pengambilan (:e supaya diperoleh konsentrat Nd dan konsentrat La yang mengandung Ce sekekecil mungkin dilakukan oksidasi bertingkat. Pengambilan Ce maksimum dicapai pada tingkat oksidasi ke III Pada tingkat oksidasi III diperoleh berat konsentrat Nd
=
10,1842 gram, kadar Nd
=
38,92 %, kadar Th=
0%, kadar Ce = 0,7%, kadar La = 17,3 1%, efisiensi pengendapan Nd = 86,78%. FP Nd-Th = 8,1758, FP Nd-La = 1,5935 dan FP Nd-Ce = 15,9675. Berat konsentrat La = 1,673 I gram, kadar La = 81,45%, kadar Th = 0%, kadar Ce = 0% dan kadar Nd = 7,68. Efisiensi pengendapan La = 80,67 %. FP La-Th = 00, FP La-Ce = 270,9786 dan FP La-Nd =
10,3254.
DAFT AR PUST AKA
I. BARGHUSEN, J.J., and SMUTZ, M., Processing of Monazite Sand, Ames Laboratory, Iowa States College Ames, Iowa ( 1958 )
2. PRAKASH, S., Advanced Chemestry of Rare E1arth Elements, S.Chamc. & Co (PVT) (TI), Ram Nagar, New Delhi, 110055,4 th, (1975).
Prosiding PPI - PDIPTN 2006
Pustek Akselerator dan Proses Bahan - BATAN Yogyakarta, 10 Juii 2006
MV. Purwani, dkk. ISSN 0216 - 3128
55
3. LOURIE, Y., Aide Memorie de ChemicAnalyiqui, edition MIR , Moscow, (1975). 4. VOGEL, Textbook Of Quantitative Inorganic
Analysis, Longman Group UK Limited, London, (1978)
5. SMITH, J.M., Chemical Engineering Kinetics, Mc Graw Hill Book Company, New York (1980) .
6. TIPTON, CR., Reactor Hand Book, voLI, 2 nd, Betelle Memorial Institute, (1967
Prosiding PPI • PDIPTN 2006 Pustek Akselerator dan Proses Bahan - BATAN