PROSIDING SEMINAR NASIONAL
BIOTEKNOLOGI
2020
Penyelenggara:
Pusat Penelitian Bioteknologi dan Bioindustri Indonesia – PT Riset Perkebunan Nusantara
Jalan Taman Kencana No.1 Bogor 16128
Integrasi Bioteknologi Pertanian dan Perkebunan di
Era Revolusi Industri 4.0
Bogor, 15 – 16 Oktober 2020
Seminar Nasional Bioteknologi | 2020
2
KATA PENGANTAR
uji syukur kepada Tuhan Yang Maha Pengasih Lagi Maha Penyayang, atas rahmat dan karunia-Nya sehingga Prosiding Seminar Nasional Bioteknologi 2020 ini dapat diterbitkan. Prosiding ini merupakan kumpulan makalah yang disajikan dalam rangkaian acara Seminar yang mengambil tema: Integrasi Bioteknologi Pertanian dan Perkebunan di Era Revolusi Industri 4.0. Seminar telah dilaksanakan pada tanggal 15 – 16 Oktober 2020 secara
live
daring padaplatform Zoom
yang juga disiarkan padaLive Youtube Channel
Pusat Penelitian Bioteknologi dan Bioindustri Indonesia.Tujuan dari penyelenggaraan Seminar ini adalah untuk tetap membangun semangat produktivitas riset dan pengembangan para peneliti Indonesia di masa pandemi Covid-19. Terlebih di era revolusi industri 4.0 yang menuntut penguasaan terhadap sains dan teknologi untuk terus ditingkatkan agar tidak tertinggal dengan kemajuan teknologi itu sendiri. Melalui Seminar ini, diharapkan dapat mendatangkan inovasi – inovasi baru bioteknologi untuk mendukung pemecahan masalah perkebunan dan pertanian di era revolusi industri 4.0. Sub-tema yang diusung pada makalah – makalah yang telah disampaikan antara lain Agronomi dan
Precision Farming
, Bioteknologi Tanaman, Bioindustri, Bioteknologi Mikroba dan Kesehatan, serta Biomolekuler dan Bioinformatika.Terimakasih kami ucapkan kepada seluruh penulis yang telah menyumbangkan karyanya, juga jajaran manajemen Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, serta seluruh panitia Seminar Nasional Bioteknologi 2020 yang telah bekerja keras merencanakan, mempersiapkan, dan melaksanakan Seminar dengan sebaik – baiknya. Kemudian terimakasih kepada Tim Redaksional Prosiding yang telah berupaya agar naskah yang diterbitkan memenuhi kaidah penulisan ilmiah dan ejaan Bahasa Indonesia yang disempurnakan dan dari segi tampilan yang disajikan secara menarik.
Kami mohon maaf jika dalam penerbitan Prosiding ini masih terdapat kekurangan dan kekeliruan. Semoga Prosiding ini dapat memberikan banyak manfaat untuk masyarakat. Semangat berkarya dan maju terus riset dan pengembangan bioteknologi di Indonesia.
Bogor, 30 November, 2020 Ketua Pelaksana,
Irma Kresnawaty, M.Si
Seminar Nasional Bioteknologi | 2020
3
SUSUNAN REDAKSI
Daftar Isi
01. Re-isolasi mikroba fungsional dari pupuk hayati Promi dan uji antagonismenya terhadap Ganoderma boninense sebagai kontrol kualitas
[Haryo Tejo Prakoso & Ema Imtihana Rosyida] 5-10
02. Profil pertumbuhan tanaman kelapa sawit transgenik P5CS setelah aklimatisasi
[Turhadi, Imron Riyadi, Hayati Minarsih, Priyono, Asmini Budiani] 11-20
Editor Kepala : Irma Kresnawaty, M.Si
Editor Pelaksana :
Rizka Tamania Saptari, M.Si Fauziatul Fitriyah, M.Agr.Sc
Asisten Editor :
Syifa Fauziah Nurmila, S.E
Layout & Desain : Cory Diana Lestari, S.Kom Eka Kristka Versia Viyan Nugroho, A.Md
03. Optimasi Teknik pemanenan mikroalga Nannochloropsis oceanica secara flokulasi menggunakan FeCl3 skala laboratorium
[Yora Faramitha, Irma Kresnawaty, Fauziatul Fitriyah, Dini Astika Sari] 21-26 04. Teknologi biokilang biomassa lignoselulosa untuk mendukung pengembangan
ekonomi sirkular: Perke bangan global dan tantangan implementasi di Indonesia [Bambang Prasetya, Yopi, Euis Hermiawati, Nanik Rahmani, Ahmad Thontowi, Ario
Betha Juanssilfero, Hans Wijaya] 27-48 05. Keragaman tanaman sirih (Piper sp.) berdasarkan penanda morfologi dan molekuler
[Nur Laela Wahyuni Meilawati, Tias Arlianti] 49-56
06. Intrograsi gen toleran Aluminium MaMt2 dari galur kedelai transgenik ke dalam varietas unggul kedelai Biosoy
[Saptowo Jumali Pardal, Riza Baihaki, Imdadul Aziz, Suharsono, Ratna Utari, Riri
Sundasari] 57-63
07. Analisis filogenetik bakteri Serratia sp. dan Kurthia sp. pada pindang tongkol (Euthynnus affinis)
[Purwaningtyas Kusumaningsih, Gede Mustika] 64-69
08. Analisis dinamika struktur mutan glukosa oksidase IPBCC dalam pengikatan substrat secara in silico
[Asrul Fanani, Laksmi Ambarsari, Popi Asri Kurniatin, Setyanto Tri Wahyudi] 70-77
09. Isolation and characterization of Rhizobium bacterian from various roots nodules legumes crops
[Eka Lupitasarim Riki Ruhimat, Sarah Sakinah Umadi, Laudy Arrisa Arumsari Sahana] 78-84
10. Pertumbuhan fitoplankton Chaetoseros calsitrans dengan perlakuan jenis medium starter pada skala laboratorium
[Noor Eka Febryana, Jumrodah] 85-92
11. Karakterisasi morfologi cendawan penyebab antraknosa pada tanaman bawang merah (Allium ascolonicum L.) di kabupaten Enrekang
[Hikmahwati, Muhammad Rifqy Aulia, Fitrianti, Harli A Karim, Nur Ilmi] 93-98 PROSIDING SEMINAR NASIONAL BIOTEKNOLOGI
TAHUN 2020 ISSN. 2774-1931
Seminar Nasional Bioteknologi | 2020
4
12. Theurapeutic potential and safety assessment of fecal microbiota transplantation (FMT): a review
[Qori Emilia, Ryan Haryo Setyawan] 99-107
13. Studi in silico gen – gen dalam metabolisme gibberellin pada tanaman Stevia rebaudiana Bert. melalui pendekatan komparasi genomik
[Rizka Tamania Saptari, Riza Arief Putranto, Rizkita Rachmi Esyanti] 108-119
14. Morphological and histological analysis of somatic embryo development of cocoa (Theobroma cacao L.)
[Sulistyani Pancaningtyas, Teguh Imam Santoso] 120-131
15. Analisis ekonomi penggunaan bibit kelapa sawit kultur jaringan
[Valentina Sokoastri] 132-138
16. Potensi dan keunggulan kultur jaringan kelapa kopyor
[Valentina Sokoastri, Doni Setiadi, Imron Riyadi] 139-142
17. Metode pemetaan udara area kebun terjangkau dengan drone komersial dan perangkat lunak open-source
[Arif Rakhman Hakim, Andre Dani Mawardhi] 143-151
18. Pendekatan penentuan harga teknologi berdasarkan nilai inovasi bioteknologi
[Arif Rakhman Hakim] 152-157
19. Respons pertumbuhan tanaman tebu (Saccharum officinarum L.) terhadap jenis pupuk dan biostimulan
[Poppy Arisandy, Galuh Wening Permatasari, Happy Widiastuti] 158-165
20. Viabilitas benih kopi (Coffea sp.) terhadap konsentrasi hormone gibberellin (GA3) dan perendaman suhu air yang berbeda
[Dede Suhendra, Siska Efendi, Aswaldi Anwar] 166-171
21. Protein hydrolysates rejuvenated old callus and improved shoot regeneration in sugarcane tissue culture
[Fauziatul Fitriyah, Irma Kresnawaty, Hayati Minarsih, Djoko Santoso] 172-179
22. Desain konsep pemetaan partisipatif untuk lahan kelapa sawit petani untuk mendukung pertanian presisi di provinsi Jambi
[Bobin Sebayang, Mohamad Solahudin, Bambang Pramudya, Supriyanto]
Susunan Acara Seminar Nasional Bioteknologi 2020 Jadwal Sesi Paralel Makalah Peserta Room A Jadwal Sesi Paralel Makalah Peserta Room B Jadwal Sesi Paralel Makalah Peserta Room C
180-185 186 187 188 189
Seminar Nasional Bioteknologi | 2020
5
Re-isolasi mikroba fungsional dari pupuk hayati Promi dan uji antagonismenya terhadap
Ganoderma boninense sebagai kontrol kualitas
Functional microbe re-isolation from Promi biofertilizer and its antagonistic test towards Ganoderma boninense
as quality control
Haryo Tejo Prakoso1* & Ema Imtihana Rosyida2
1) Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Jl. Taman Kencana No. 1, Bogor, 16128 2) Jurusan Pendidikan Biologi, FMIPA, Universitas Negeri Yogyakarta, Jl. Colombo Yogyakarta No. 1, Yogyakarta, 55281
*)Korespondensi penulis: haryotejoprakoso@gmail.com
Abstrak
Saat PBB mencanangkan Sustainable Development Goals pada tahun 2016, kegiatan pertanian berkelanjutan di Indonesia semakin marak belakangan ini. Salah satu komponen dalam pertanian berkelanjutan adalah penggunaan pupuk hayati. PPBBI telah mengembangkan formula pupuk hayati sekaligus biofungisida berbasis konsorsium mikroba fungsional yang dikenal dengan nama Promi. Salah satu kekurangan pupuk hayati dibandingkan dengan pupuk kimia adalah daya simpannya yang tidak bisa selama pupuk kimia dan kurang praktisnya cara aplikasi. Studi ini bertujuan untuk mengetahui viabilitas populasi mikroba dalam Promi yang sudah tersimpan selama 20 bulan, baik yang langsung diencerkan maupun yang direndam dahulu dalam air selama seminggu, dan menguji efektivitasnya pada Ganoderma penyebab penyakit busuk pangkal batang di kelapa sawit. Sampel diambil dan dilakukan pengenceran serial sampai 10-6 dengan dua jenis larutan pengencer (air dan garam
fisiologis) kemudian dicawankan dengan metode cawan tuang untuk dilakukan penghitungan cawan total. Pencawanan diulang sebanyak dua kali. Uji antagonisme terhadap Ganoderma dilakukan menggunakan
Trichoderma hasil re-isolasi pada media PDA yang dilanjutkan dengan inokulasi Ganoderma ke media alkali lignin. Hanya dua dari tiga jenis konsorsium mikroba, yaitu Aspergillus dan Trichoderma spp, yang dapat bertahan selama 20 bulan. Populasi Aspergillus setelah diencerkan dengan air dan larutan garam fisiologis dan pada sampel yang direndam air selama seminggu adalah 3.05 x 104, 2.15 x 104, 6.5 x 104 sedangkan populasi Trichoderma adalah 9 x 104, 7.95 x 104, and 3.3 x 104, secara berurutan. Tidak tumbuhnya Ganoderma pada
media alkali lignin setelah sebelumnya diantagoniskan dengan Trichoderma hasil re-isolasi mengkonfirmasi keefektifan Promi sebagai agen biofungisida.
[Kata kunci: daya simpan,Ganoderma, pertanian berkelanjutan, uji viabilitas]
Pendahuluan
Peralihan fokus global dari Millenium Development Goals menjadi Sustainable Development Goals (SDG) memberikan perubahan cara pandang dalam hampir setiap lini, tidak terkecuali pertanian di Indonesia. Dahulu, fokus utama pertanian di Indonesia adalah bagaimana memproduksi bahan pangan sebanyak-banyaknya untuk minimal dapat memenuhi kebutuhan dalam negeri, yang dikenal dengan Revolusi Hijau
(Thorburn, 2015). Akan tetapi, program Revolusi Hijau mengakibatkan kerusakan lingkungan karena penggunaan pupuk dan pestisida secara berlebihan (Farawita, 2018). Trend yang sama juga teramati di beberapa negara Asia Tenggara lainnya (Thorburn, 2015) dan juga dunia (Pingali, 2012). Oleh karena itu, program SDG menitikberatkan terhadap apa yang disebut sebagai triple bottom line: pembangunan ekonomi, kelestarian lingkungan, dan inklusi sosial (Sachs, 2012).
Seminar Nasional Bioteknologi | 2020
6
Pertanian berkelanjutan (sustainable agriculture) juga dibangun di atas ketiga pondasi
triple bottom line tersebut. Untuk menjaga kelestarian lingkungan, fungsi pupuk anorganik berangsur-angsur digantikan oleh pupuk hayati, walaupun tidak dapat menggantikan 100% karena pupuk anorganik tetap dibutuhkan tetapi dosisnya dikurangi. Menurut definisi Permentan No. 70/SR.140/10/2011, pupuk hayati adalah produk biologi aktif yang terdiri atas mikroba yang dapat meningkatkan efisiensi pemupukan, kesuburan, dan kesehatan tanah. Pusat Penelitian Bioteknologi dan Bioindustri Indonesia telah mengembangkan formula pupuk hayati sekaligus biofungisida berbasis konsorsium mikroba fungsional yang dikenal dengan nama Promi. Mikroba fungsional yang terkandung di dalam Promi adalah Aspergillus spp, Trichoderma harzianum DT38, Trichoderma pseudokoningii DT39, dan Polyota spp. Ketiga jenis mikroba tersebut mempunyai fungsi yang berbeda-berbeda. Aspergillusspp. berfungsi sebagai pelarut fosfat, Trichoderma spp berfungsi sebagai penghasil IAA sekaligus sebagai jamur antagonis, dan Polyota spp berfungsi sebagai jamur pelapuk atau dekomposer.
Promi sebagai pupuk hayati dapat digunakan pada tanaman hortikultura maupun pada tanaman perkebunan. Akan tetapi, kekurangan dari pupuk hayati adalah daya simpannya yang relatif pendek dan aplikasinya yang kurang praktis karena setelah Promi dilarutkan oleh air, larutan tersebut harus segera diaplikasikan sedangkan petani terkadang malas untuk menakar dosis sesuai kebutuhan. Oleh karena itu, studi kali ini bertujuan ingin mengetahui viabilitas mikroba yang ada dalam Promi yang sudah disimpan selama 20 bulan dan mengetahui efek perendaman dengan air selama seminggu terhadap viabilitas mikroba yang terkandung dalam Promi yang berusia 20 bulan tersebut sebagai simulasi larutan stok yang dibuat petani.
Bahan dan Metode Uji viabilitas mikroba
Dalam percobaan ini, digunakan dua jenis larutan pengencer, yaitu garam fisiologis (garfis) NaCl 0.85% dan air yang sebelumnya telah disterilkan dengan menggunakan autoklaf pada suhu 121° C selama 15 menit. Sebanyak 10 gram sampel pupuk hayati Promi yang sudah berumur 20
bulan sejak diproduksi diencerkan serial sampai 106.
Pengenceran 103 sampai 106 kemudian dicawankan
dengan menggunakan metode cawan tuang ke dalam media Potato Dextrose Agar (PDA) yang sebelumnya telah disterilisasi. Pencawanan diulang sebanyak dua kali. Inkubasi dilakukan pada suhu ruang dan pengamatan dilakukan sampai hari ke 5. Jumlah koloni yang muncul kemudian dihitung untuk mendapatkan data penghitungan total koloni. Untuk memenuhi prosedur statistik, jumlah koloni dalam satu cawan hanya dapat dihitung apabila berada pada rentang 25-250 koloni.
Pada uji viabilitas dari efek larutan stok, sebanyak 10 gram Promi direndam dalam 90 ml air steril selama seminggu. Setalah seminggu, dilakukan penghitungan total koloni menggunakan metode yang sama dengan yang sudah dijelaskan sebelumnya. Hanya saja, kali ini larutan pengencer yang digunakan adalah air ledeng yang sudah disteril.
Uji efektivitas biofungisida
Trichoderma spp hasil re-isolasi kemudian diuji tantang dengan Ganoderma boninese
penyebab busuk pangkal batang pada kelapa sawit. Kedua isolat tersebut diremajakan terlebih dahulu pada media PDA. Inokulum Trichoderma spp
kemudian diambil pada bagian hifa yang sedang aktif tumbuh pada inkubasi hari ke tiga sedangkan inokulum Ganoderma diambil pada hari ke tujuh. Kedua inokulum tersebut kemudian diinokulasikan pada satu cawan yang sama berisi media PDA dengan diberi jarak antara satu dengan yang lain kurang lebih 2 cm. Cawan yang berisi kedua inokulum tersebut kemudian diinkubasi selama 1 minggu pada suhu ruang.
Ganoderma boninense hasil uji tantang dengan Trichoderma spp hasil re-isolasi kemudian diinokulasikan ke media alkali lignin (dalam 1 liter aquades: K2HPO4 1 g, MgSO4.7H2O 0.2 g, KCl 0.2 g,
NaNO3 2 g, ekstrak ragi 0.2 g, ekstrak malt 1 g, agar
18 g, KOH 2 butir, guaiacol 0.4 ml, alkali lignin 1 g, chloramphenicol 0.5 g, dan benomyl 4 mg). Sampel dicuplik kecil dengan menggunakan scapel steril di area pertemuan antara Tricoderma sp. dengan
Ganoderma sp. dan diletakkan di media alkali lignin dengan posisi jamur menghadap ke bawah. Hasil isolasi kemudian diinkubasi pada suhu ruang dan dan diamati setiap hari selama 3 hari.
Seminar Nasional Bioteknologi | 2020
7
Hasil dan Pembahasan Uji viabilitas mikroba
Dari ketiga jenis mikroba yang terkandung di dalam pupuk hayati Promi, hanya dua jenis mikroba saja yang dapat bertahan setelah 20 bulan disimpan, yaitu Aspergillus spp. dan Trichoderma
spp. Kedua jamur tersebut dapat tumbuh dengan baik walaupun diencerkan dengan menggunakan dua larutan pengencer yang berbeda (air dan garfis). Populasi Aspergillus spp. yang diencerkan dengan air dan garfis masing-masing adalah 3.05 x 104 dan 2.15 x 104, secara berurutan, sedangkan
populasi Trichoderma spp. yang diencerkan dengan air dan garfis masing-masing adalah 9 x 104 dan
7.95 x 104, secara berurutan (Tabel 1). Kedua
jamur tersebut pun dapat tumbuh dengan baik setelah direndam dengan air selama seminggu dengan populasi Aspergillus spp. dan Trichoderma spp. masing-masing secara berurutan adalah 6.5 x 104 dan 3.3 x 105 (Tabel 2).
Polyota merupakan jamur yang masuk ke dalam golongan Jamur Pelapuk Putih (JPP). Menurut Baldrian (2008), JPP tidak bisa bertahan lama di tanah karena ia membutuhkan substrat yang sesuai untuk bertahan hidup sehingga daya tahan hidupnya
di tanah tanpa substrat yang sesuai relatif rendah. Bahan pembawa pada pupuk hayati Promi merupakan padatan yang menyerupai tanah sehingga kemungkinan Polyota spp. tidak dapat bertahan lama pada bahan pembawa disebabkan oleh sifat hidup JPP yang tidak dapat bertahan lama di tanah tanpa substrat eksternal yang sesuai.
Lain halnya dengan Aspergillus spp. dan
Trichoderma spp., mereka dapat bertahan hidup lama di tanah. Aspergillus dikenal dapat bertahan hidup pada hampir semua jenis substrat, baik tanah, vegetasi yang membusuk, udara bahkan air (Nolard
et al., 1988). Trichoderma termasuk organisme yang hidup di dalam tanah dan hampir dapat ditemukan pada semua jenis tanah yang ada di dunia (Samuels, 2006). Oleh karena bahan pembawa dalam pupuk hayati Promi menyerupai tanah, maka Aspergillus spp. dan Trichoderma spp.
dapat bertahan lama pada bahan pembawa tersebut, meskipun sudah disimpan selama 20 bulan. Perbandingan jumlah total penghitungan koloni pada sampel pupuk hayati Promi yang berumur 20 bulan yang diencerkan dengan dua jenis larutan pengencer yang berbeda serta direndam air selama seminggu kemudian diencerkan dengan air dapat dilihat pada Gambar 1.
Tabel 1. Jumlah koloni yang teramati dari pupuk hayati Promi yang sudah disimpan selama 20 bulan pada dua perlakuan larutan pengencer
Table 1. The number of colonies observed from Promi biofertilizer that had been stored for 20 months in two diluent solution treatments
Sampel Sample
Larutan pengencer Diluent solution
Pangkat pengenceran yang dicawankan Dilution power that were plated
10-3 10-4 10-5 10-6 Aspergillus spp. Air Water Garam Fisiologis Physiological saline 30.5 21.5 TSUD* TSUD TSUD TSUD 0 0 Trichoderma spp. Air Water Garam Fisiologis Physiological saline 90 79.5 TSUD TSUD TSUD TSUD 0 0 Polyota spp. Air Water Garam Fisiologis Physiological saline 0 0 0 0 0 0 0 0 *) TSUD = Terlalu sedikit untuk dihitung /Too few to count
Seminar Nasional Bioteknologi | 2020
8
Tabel 2. Jumlah koloni yang teramati dari pupuk hayati Promi yang sudah disimpan selama 20 bulan dan direndam air selama seminggu
Table 2. The number of colonies observed from Promi biofertilizer that had been stored for 20 months and soaked in water for a week
Sampel Sample
Larutan pengencer Diluent solution
Pangkat pengenceran yang dicawankan Dilution power that were plated
10-3 10-4 10-5 10-6
Aspergillus spp. Air Water 65 TSUD* TSUD 0
Trichoderma spp. Air Water 226 43.5 TSUD 0
Polyota spp. Air Water 0 0 0 0
*) TSUD = Terlalu sedikit untuk dihitung /Too few to count
Gambar 1. Perbedaan populasi mikroba fungsional yang diencerkan menggunakan dua jenis larutan pengencer dan perendaman di air selama seminggu
Figure 1. Functional microbe population difference diluted using two types of diluent solution and soaked in water for a week Gambar 1 menunjukkan bahwa jumlah
populasi mikroba fungsional pada pengenceran pupuk hayati Promi menggunakan air sedikit lebih tinggi jika dibandingkan dengen pengenceran menggunakan garam fisiologis, walaupun perbedaannya tidak terlalu signifikan. Perbedaan yang signifikan terlihat pada Aspergillus spp. dan
Trichoderma spp. dari pupuk hayati Promi berumur 20 bulan yang direndam air selama seminggu. Terlihat kenaikan populasi yang cukup drastis pada
Trichoderma spp yang mencapai hampir 10 kali lipat jika dibandingkan dengan sampel yang langsung diencerkan menggunakan air. Fungi dikenal dapat tumbuh asalkan permukaan di mana mereka berkembang biak memiliki kadar air yang cukup, apalagi jika tersedia air dalam jumlah yang banyak dan mereka dapat memanfaatkan sumber nutrisi yang berasal hanya dari debu dan kotoran saja (Pasanen et al., 2000). Oleh karena itu, pembuatan larutan Promi di tingkat petani dapat memanfaatkan air saja. Dari hasil percobaan ini, terlihat bahwa
pupuk hayati Promi yang dilarutkan dalam air selama seminggu dapat menaikkan populasi mikroba fungsional. Akan tetapi, perlu diperhatikan bahwa air yang digunakan pada percobaan kali ini adalah air yang steril. Pada praktiknya di lapangan, jarang tersedia air yang steril sehingga hasil yang diharapkan bisa jadi bervariasi. Untuk mendapatkan hasil yang kurang lebih sama dengan studi ini, petani bisa merebus air yang akan digunakan untuk melarutkan pupuk hayati Promi kemudian mendinginkannya sebelum dilakukan pencampuran supaya larutan tersebut dapat disimpan.
Uji efektivitas biofungisida
Trichoderma spp. hasil re-isolasi mendominasi cawan petri dan tidak memberikan kesempatan bagi Ganoderma boninense untuk bertumbuh (Gambar 2). Trichoderma diketahui memiliki kecepatan pertumbuhan yang pesat dan memiliki kemampuan mikoparasitisme, yaitu kemampuan untuk mengenali dan membunuh jamur
0,00E+00 1,00E+05 2,00E+05 3,00E+05 4,00E+05 5,00E+05 Aspergillus Trichoderma Tot al Pl at e C ount ( cf u/ m l)
Seminar Nasional Bioteknologi | 2020
9
antagonis dengan cara melilitkan hifanya pada hifa jamur antagonis kemudian ia akan mensekresikan enzim hidrolitik pendegradasi dinding sel (Naher et al., 2014). Untuk mengetahui apakah Ganoderma boninense yang diuji tantang dengan Trichoderma
masih hidup atau tidak, sebagian hifa Ganoderma
yang berbatasan dengan hifa Trichoderma
kemudian dipotong dan diinokulasi ke media alkali lignin.
Ganoderma boninense hasil uji tantang tidak mengubah warna media alkali lignin (Gambar 3a).
Ganoderma boninense merupakan jamur yang dapat mendegradasi lignin karena ia memiliki sistem enzim
ligninolitik (Surendran et al., 2017). Jika Ganoderma
yang diuji masih hidup, maka system enzim ligninolitik akan bereaksi dengan guaiacol yang terkandung pada media alkali lignin dan akan memberikan warna kecoklatan pada sekitar media (Xu et al., 2015), seperti yang terlihat pada Gambar 3b. Oleh karena itu, jika Ganoderma hasil uji tantang tidak memberikan perubahan warna pada media alkali lignin, maka dapat dipastikan bahwa
Ganoderma hasil uji tantang tersebut sudah mati. Dengan demikian, Trichoderma spp. hasil re-isolasi dari pupuk hayati Promi masih dapat menjalankan fungsinya sebagai agen biofungisida
Gambar 2. Uji tantang antara Ganoderma boninense dengan Trichoderma spp. hasil re-isolasi dari pupuk hayati Promi berumur 20 bulan
Figure 2. Antagonism test between Ganoderma boninense and Trichoderma spp. re-isolated from Promi biofertilizer that had been kept for 20
months
Gambar 3. Ganoderma boninense hasil uji tantang yang ditumbuhkan pada media alkali lignin (a). Dapat dilihat bahwa tidak terjadi perubahan warna pada media yang menunjukkan Ganoderma tersebut sudah tidak aktif/mati. Jika masih hidup, Ganoderma pada media alkali lignin akan mengubah warna media menjadi merah kecoklatan (b)
Figure 3. Ganoderma boninense resulted from antagonism test grown on alkali lignin medium (a). It can be seen that no colour change was observed
on the medium indicating that Ganoderma was inactive or dead. If it still active, Ganoderma would change the color of alkali lignin medium
Seminar Nasional Bioteknologi | 2020
10
Kesimpulan
Mikroba fungsional yang dapat bertahan dalam pupuk hayati Promi yang disimpan selama 20 bulan hanya Aspergillus spp. dan Trichoderma spp.
sedangkan Polyota spp. tidak teramati. Larutan pengencer untuk melarutkan pupuk hayati Promi dapat menggunakan air karena jumlah populasi mikroba fungsional antara dilarutkan dengan menggunakan air dan garfis tidak terlalu jauh berbeda. Berdasarkan hasil studi ini, larutan stok pupuk hayati Promi dapat dibuat dan disimpan selama seminggu. Akan tetapi, perlu diperhatikan bahwa air yang digunakan pada studi ini adalah air yang sudah steril sehingga interpretasi hasil studi di lapangan diharapkan lebih berhati-hati karena hasilnya bisa bervariasi. Hasil uji antagonis
Trichoderma spp. hasil isolasi mampu membunuh
Ganoderma boninense penyebab busuk pangkal batang pada tanaman kelapa sawit. Hal ini membuktikan bahwa Trichoderma spp. dari pupuk hayati Promi masih dapat menjalankan fungsinya walaupun setelah disimpan selama 20 bulan.
Daftar Pustaka
Baldrian P (2008). Wood-inhabiting ligninolytic basidiomycetes in soils: Ecology and constraints for applicability in bioremediation. Fungal Ecology, 1(1), 4-12.
Farawita F (2018). Degradasi Ekologi dan Kapitalisme Revolusi Hijau (Analisis Wacana Kritis pada Buku Teks Sejarah Sekolah). Jurnal Pendidik dan Peneliti Sejarah, 1(2), 77-83.
Naher L, UK Yusuf, SG Tan, S Siddiquee & MR Islam (2014). In vitro and in vivo biocontrol performance of Trichoderma harzianum rifai on Ganoderma boninense Pat. related to
pathogenicity on Oil palm (Elaeis guineensis Jacq.). J. Pure Appl. Pure Microbiol, 8(973-978. Nolard N, M Detandt & H Beguin (1988). Ecology of
Aspergillus Species in the Human Environment. In
eds. H. V. Bossche, D. W. R. Mackenzie & G. Cauwenbergh, Aspergillus and Aspergillosis. Boston: Springer.
Pasanen A-L, J-P Kasanen, S Rautiala, M Ikäheimo, J Rantamäki, H Kääriäinen & P Kalliokoski (2000). Fungal growth and survival in building materials under fluctuating moisture and temperature conditions. Journal International Biodeterioration & Biodegradation, 46(2), 117-127.
Pingali P (2012). Green revolution: impacts, limits, and the path ahead. Proceedings of the National Academy of Sciences, 109(31), 12302-12308. Sachs JD (2012). From millennium development goals to
sustainable development goals. The Lancet,
379(9832), 2206-2211.
Samuels GJ (2006). Trichoderma: Systematics, the Sexual State, and Ecology. Phytopathology, 96(2), 195-206.
Surendran A, Y Siddiqui, HM Saud & NSAaS Manickam (2017). The Antagonistic Effect of Phenolic Compounds on Ligninolytic and Cellulolytic Enzymes of Ganoderma Boninense, Causing Basal Stem Rot in Oil Palm. INTERNATIONAL JOURNAL OF AGRICULTURE AND BIOLOGY, 19(6), 1437-1446.
Thorburn C (2015). The Rise and Demise of Integrated Pest Management in Rice in Indonesia. Insects,
6(2), 381-408.
Xu C, D Singh, KM Dorgan, X Zhang & S Chen (2015). Screening of ligninolytic fungi for biological pretreatment of lignocellulosic biomass. Canadian Journal of Microbiology, 61(10), 745-752.
Seminar Nasional Bioteknologi | 2020
11
Profil pertumbuhan tanaman kelapa sawit transgenik P5CS setelah aklimatisasi
Growth profile of P5CS transgenic oil palm after acclimatization
Turhadi*, Imron Riyadi, Hayati Minarsih, Priyono & Asmini Budiani
Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Jl. Taman Kencana No.1, Bogor 16128, Indonesia
*)Korespondensi penulis: turhadibiologi@gmail.com
Abstrak
Transformasi genetik untuk merakit tanaman yang toleran kekeringan telah dilakukan dengan mengintroduksikan gen P5CS ke dalam kalus kelapa sawit. Planlet transgenik telah dihasilkan dan telah melalui uji cekaman kekeringan in-vitro. Salah satu tahapan krusial dalam rekayasa genetik adalah aklimatisasi tanaman sebelum ditanam di lapang. Penelitian ini bertujuan mengevaluasi tingkat keberhasilkan aklimatisasi dan mengkarakterisasi pertumbuhan planlet kelapa sawit transgenik P5CS setelah aklimatisasi. Sebanyak 17 planlet non-transgenik dan 26 planlet transgenik P5CS diaklimatisasi pada media tanam dengan komposisi top soil : kompos (1:3; v:v) selama 4 minggu. Tinggi tanaman, kecepatan penambahan tinggi, jumlah daun, panjang, lebar, serta rasio panjang:lebar daun diamati dalam penelitian ini hingga minggu ke-6 setelah aklimatisasi. Hasil penelitian menunjukkan bahwa daya hidup planlet non-transgenik dan transgenik P5CS masing-masing 76,5% dan 76,9% dengan karakter pertumbuhan yang bervariasi antar klon tanaman. Tinggi tanaman transgenik P5CS
hasil aklimatisasi pada minggu ke-6 yaitu 8,5-25,4 cm dengan kecepatan penambahan tinggi 0,100-0,267 cm/minggu dan jumlah daun 1-3 helai. Panjang, lebar, serta rasio panjang:lebar daun tanaman transgenik P5CS
hasil aklimatisasi yaitu 7,0-17,0 cm, 1,0-3,0 cm, dan 4,4-9,8. Terdapat 4 kelompok tanaman kelapa sawit transgenik P5CS hasil aklimatisasi berdasarkan karakter pertumbuhannya menggunakan teknik Unweighted Pair Group Method with Arithmetic Mean (UPGMA). Kelompok 1 terdiri dari tanaman T-30(1). Kelompok 2 terdiri dari tanaman 12(3), 12(4), dan 12(5). Kelompok 3 terdiri dari tanaman 13, 14(2), 22, 23, 24, 25(1), 25(2), dan 26. Kelompok 4 terdiri dari tanaman 1, 3(1), 3(2), 5, 6, 10, 11, dan T-12(2).
[Kata kunci: planlet, rasio panjang:lebar daun, tinggi tanaman, UPGMA]
Pendahuluan
Kebutuhan minyak nabati yang semakin meningkat dari tahun ke tahun dan tantangan terhadap perubahan iklim global berdampak terhadap perkebunan serta penyediaan bahan tanam kelapa sawit. Salah satu strategi yang dapat dilakukan untuk mengatasi permasalahan tersebut yaitu melalui pemanfaatan teknologi rekayasa genetika guna menghasilkan bibit kelapa sawit dengan sifat yang diinginkan secara lebih cepat dibandingkan cara konvensional (Masli et al., 2008), salah satunya sifat toleran terhadap cekaman kekeringan.
Toleransi terhadap cekaman kekeringan merupakan sifat yang bersifat poligenik pada tanaman. Banyak gen yang telah dilaporkan bertanggung jawab dalam menentukan sifat toleran terhadap cekaman kekeringan, salah satunya gen
P5CS yang bertanggung jawab dalam biosintesis prolin (Riduan et al., 2010; Zarei et al., 2012; Iskandar et al., 2014; Pavei et al., 2016). Pada tahun 2019, gen P5CS yang berperan dalam menyandikan enzim Δ1-pyrroline-5-carboxylate
synthetase tersebut juga telah berhasil diintroduksikan ke dalam kalus kelapa sawit (Budiani
Seminar Nasional Bioteknologi | 2020
12
diperoleh telah menunjukkan respon toleran terhadap cekaman kekeringan secara in-vitro
(Turhadi et al., 2020). Namun, hingga sejauh ini planlet-planlet transgenik P5CS tersebut belum dilakukan aklimatisasi.
Proses aklimatisasi adalah salah tahapan penting dalam rangkaian perakitan bahan tanam melalui kultur jaringan dan transformasi genetik (Ehirim et al., 2014). Keberhasilan aklimatisasi kelapa sawit hasil kultur jaringan juga telah dilaporkan sebelumnya (Gomes et al. 2015; Yunita 2016; Corrêa et al., 2016; Ernayunita et al., 2019). Untuk mengetahui tingkat keberhasilan selama dan/atau setelah proses aklimatisasi, maka tahap evaluasi bahan tanam sangat diperlukan. Menurut Gomes et al. (2015), keberhasilan tanaman yang diaklimatisasi salah satunya dipengaruhi oleh profil pertumbuhan bagian aerial tanaman. Sehingga, pada penelitian ini evaluasi dilakukan dengan mengamati bagian aerial tanaman.
Strategi evaluasi awal yang mudah dilakukan pada tanaman hasil transformasi genetik yaitu berupa pengamatan profil pertumbuhannya. Pengamatan terhadap profil pertumbuhan tanaman hasil kultur jaringan yang diaklimatisasi telah dilaporkan, misalnya kelapa sawit (Sumaryono & Riyadi 2011), tebu (Dibax et al., 2011), dan kurma (Aslam et al., 2015). Meskipun demikian, klon-klon kelapa sawit transgenik P5CS yang telah diperoleh belum dilakukan evaluasi profil pertumbuhannya selama kondisi aklimatisasi. Sehingga, penelitian ini bertujuan mengevaluasi tingkat keberhasilkan aklimatisasi dan mengkarakterisasi pertumbuhan planlet kelapa sawit transgenik P5CS ketika dilakukan aklimatisasi.
Bahan dan Metode Bahan tanaman
Klon-klon tanaman kelapa sawit yang berasal dari planlet umur 2 tahun hasil kultur in-vitro yang terdiri dari 17 tanaman non-transgenik dan 26
tanaman transgenik P5CS digunakan dalam penelitian ini.
Kondisi aklimatisasi
Proses aklimatisasi dilakukan di dalam fasilitas Rumah Kaca Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Bogor. Akar planlet tanaman kelapa sawit dicuci dengan air mengalir. Akar selanjutnya dikeringkan menggunakan kertas tisu dan kemudian direndam dalam larutan 2 mM 1-Naphthaleneacetic acid (NAA) selama 10 menit (Sumaryono & Riyadi 2011). Planlet ditanam pada media tanam berupa top soil : kompos dengan perbandingan 1 : 3 (v:v) di dalam pot plastik transparan ukuran 300 mL. Permukaan media tanam yang telah ditanami planlet disemprot dengan larutan fungisida Dithane M-45 dengan konsentrasi 2 g/L pada minggu ke-0 dan minggu ke-2 setelah tanam. Selama proses aklimatisasi yang dilakukan selama 4 minggu, pada masing-masing tanaman dilakukan penyungkupan dengan menggunakan pot plastik transparan ukuran 300 mL. Perawatan berupa penyiraman dilakukan setiap 2 hari sekali.
Konfirmasi keberadaan transgen P5CS dengan teknik PCR
Konfirmasi keberadaan transgen P5CS
dilakukan melalui PCR dengan menggunakan DNA sebagai template yang diisolasi dari daun tanaman kelapa sawit mengikuti prosedur dari Orozco-Castillo et al. (1994). Primer Actin dan NPTII digunakan untuk konfirmasi keberadaan transgen P5CS pada tanaman kelapa sawit (Tabel 1). Proses amplifikasi daerah target dilakukan dengan 35 siklus dengan kondisi PCR sebagai berikut: pre-denaturasi (95 °C; 1 menit), denaturasi (95 °C; 15 detik), annealing (55 °C; 15 detik), ekstensi (72 °C; 10 detik), dan post-ekstensi (72 °C; 10 menit). Produk PCR selanjutnya divisualisasikan pada 1% gel agarose melalui elektroforesis 80 Volt selama 35 menit. Dokumentasi hasil elektroforesis dilakukan dengan menggunakan UV-Gel Doc.
Tabel 1. Primer yang digunakan untuk konfirmasi keberadaan transgen P5CS
Table 1. Primer used for P5CS transgen confirmation
Nama primer Primer name Sekuen Sequnce Panjang amplikon (pb) Amplicon length (bp) Actin-F CCCACCTGAACGGAAATACA 400 Actin-R CGGATGGCACCTCAGTCTTA NPTII-F GAGGCTATTCGGCTATGACT 700 NPTII-R ATCGGCAGCGGCGATACCGT
Seminar Nasional Bioteknologi | 2020
13
Pengamatan pertumbuhan
Evaluasi pertumbuhan klon-klon tanaman kelapa sawit dilakukan dengan mengamati tinggi tanaman, jumlah, panjang serta lebar daun. Tinggi tanaman dan jumlah daun diamati pada minggu ke-0, 2, 4, dan 6 setelah tanam. Panjang dan lebar daun diamati pada minggu ke-6 setelah tanam.
Analisis data
Data yang diperoleh dianalisis secara statistik deskriptif, analisis korelasi, dan analisis klaster. Analisis korelasi dilakukan menggunakan paket Corrplot pada perangkat lunak R-Studio. Analisis klaster berupa Unweighted Pair Group Method with Arithmetic Mean (UPGMA) digunakan pada penelitian ini untuk mengelompokkan klon-klon kelapa sawit berdasarkan tingkat kemiripan karakter-karakter pertumbuhannya. Sebelum dianalisis menggunakan teknik UPGMA pada setiap data distandarisasi untuk mengurangi efek bias satuan dari setiap karakter mengikuti prosedur Jolliffe & Cadima (2016). Analisis klaster dilakukan menggunakan program PAST 3.06 (Hammer et al., 2001).
Hasil dan Pembahasan Persentase keberhasilan aklimatisasi
Sebanyak 43 klon tanaman kelapa sawit yang terdiri dari 17 klon non-transgenik dan 26 klon transgenik P5CS digunakan dalam tahapan aklimatisasi. Empat minggu setelah tanaman kelapa sawit ditanam pada media aklimatisasi, sebanyak 76,5% tanaman non-transgenik dan 76,9% tanaman transgenik P5CS menunjukkan keberhasilan (Tabel 2). Tingginya persentase baik
tanaman transgenik dan non-transgenik tersebut mengindikasikan bahwa tahap aklimatisasi berhasil dilakukan dengan baik. Aklimatisasi tanaman lainnya hasil kultur jaringan juga menunjukkan tingkat keberhasilan yang tinggi, misalnya tebu dan stevia. Perbanyakan tebu varietas RB931003 dan RB98710 melalui kultur jaringan berhasil diaklimatisasi masing-masing mencapai 85% dan 100% (Dibax et al., 2011). Aklimatisasi tanaman stevia yang berasal dari umur eksplan 0, 1, 2, dan 3 minggu masing-masing sebesar 6,7%, 83,3%, 13,3%, dan 0% (Sinta & Amanah 2019).
Konfirmasi keberadaan transgen P5CS
Konfirmasi keberadaan transgen P5CS
dilakukan pada tanaman kelapa sawit non-transgenik dan non-transgenik. Kualitas DNA baik klon non-transgenik maupun transgenik P5CS menunjukkan kualitas yang baik yang diindikasikan dengan teramplifikasinya pita Actin berukuran 400 pb. Hasil konfirmasi yang dilakukan menunjukkan bahwa 20 nomor klon kelapa sawit telah membawa sisipan gen P5CS yang diindikasikan dengan adanya pita NPTII berukuran 700 pb, sedangkan tanaman non-transgenik tidak menunjukkan adanya pita tersebut (Gambar 1). Semua nomor klon transgenik yang diaklimatisasi menunjukkan keberhasilan adanya sisipan gen P5CS dikarenakan sebelum aklimatisasi telah dilakukan konfirmasi keberadaan transgen sebagai salah satu tahapan dalam penelitian uji in-vitro cekaman kekeringan (Turhadi
et al. 2020). Sehingga, tanaman yang diaklimatisasi adalah tanaman yang positif membawa transgen
P5CS.
Tabel 2. Persentase daya hidup tanaman kelapa sawit non-transgenik dan transgenik P5CS Table 2. Percentage of survival rate of non-transgenic and P5CS transgenic oil palm
Jumlah tanaman
Plant number Daya hidup (%)
survival rate (%) Hidup Life Mati Dead Non-transgenik / Non-transgenic 13 4 76,5 Transgenik P5CS / P5CS transgenic 20 6 76,9
Seminar Nasional Bioteknologi | 2020
14
Gambar 1. Hasil PCR menggunakan primer Actin dan NPTII pada tanaman kelapa sawit non-transgenik dan transgenik P5CS. M = Penanda DNA 100 pb; K- = kontrol negatif (H2O); NT = tanaman kelapa sawit non-transgenik; T = tanaman kelapa sawit transgenik P5CS.
Figure 1. PCR result based on Actin and NPTII primers in non-transgenic and P5CS transgenic oil palm. M = DNA marker 100 bp; K- = negative control
(H2O); NT = non-transgenic oil palm; T = P5CS transgenic oil palm.
Pertumbuhan tanaman
Proses aklimatisasi baik klon non-transgenik maupun transgenik P5CS diawali dengan merendam akar setiap individu tanaman di dalam larutan hormon NAA (Gambar 2A). Langkah ini bertujuan untuk membantu menginduksi akar-akar baru dari setiap individu dikarenakan tidak semua tanaman yang diaklimatisasi mempunyai akar yang baik. Salah satu tahapan dalam proses aklimatisasi tanaman hasil kultur jaringan yaitu penyungkupan. Proses penyungkupan pada penelitian ini dilakukan selama 4 minggu dengan menggunakan pot plastik transparan (Gambar 2B). Penyungkupan ini dilakukan untuk menjaga tingkat kelembaban di sekitar lingkungan tumbuh tanaman yang sedang diaklimatisasi (Sumaryono et al., 2012; Ehirim et al., 2014). Hingga minggu ke-6 pertumbuhan baik tanaman non-transgenik (Gambar 2C) maupun transgenik P5CS (Gambar 2D) menunjukkan pertumbuhan yang baik. Selain itu, pertumbuhan tanaman ini dinilai baik karena juga diindikasikan dengan munculnya akar-akar baru yang terlihat (Gambar 2E-F). Hasil penelitian ini sejalan dengan penelitian sebelumnya oleh Sumaryono & Riyadi (2011) yang menunjukkan adanya akar-akar baru pada tanaman kelapa sawit yang berhasil diaklimatisasi. Namun, beberapa tanaman
transgenik P5CS tidak berhasil diaklimatisasi yang ditunjukkan dengan mengeringnya daun dan kemudian mati (Gambar 2G). Banyak hal yang memengaruhi tingkat keberhasilan tanaman hasil kultur jaringan ketika diaklimatisasi. Menurut Gomes
et al. (2015) faktor yang berkaitan dengan fase pengakaran, misalnya keberadaan akar, jumlah akar, panjang akar utama, dan tinggi tajuk dari planlet sangat berkaitan dengan daya hidup selama proses aklimatisasi.
Evaluasi terhadap pertumbuhan klon-klon transgenik P5CS yang diaklimatisasi telah dilakukan. Hasil pengamatan menunjukkan bahwa terdapat variasi tinggi tanaman transgenik yaitu 8,5-25,4 cm pada 6 minggu setelah tanam (Tabel 3). Tanaman paling tinggi yaitu klon T-10, sedangkan tanaman paling pendek yaitu T-12(5). Selain tinggi tanaman, variasi pertumbuhan tanaman transgenik P5CS juga ditunjukkan oleh kecepatan penambahan tinggi. Klon T-3(1) memperlihatkan kecepatan penambahan tinggi terbesar (0,267 cm/minggu) dibandingkan klon-klon transgenik P5CS lainnya dan non-transgenik (Gambar 3). Berdasarkan hasil penelitian ini juga diketahui bahwa sebagian besar klon transgenik P5CS mempunyai kecepatan penambahan tinggi yang lebih kecil dibandingkan tanaman non transgenik (Gambar 3).
Seminar Nasional Bioteknologi | 2020
15
Gambar 2. Profil planlet tanaman kelapa sawit saat direndam di dalam larutan 2 mM NAA (A), selama aklimatisasi di dalam sungkup plastik minggu ke-4 (B), setelah sungkup plastik dibuka pada minggu ke-6 pada tanaman non-transgenik (C) dan transgenik P5CS (D), profil pertumbuhan akar tanaman non-transgenik (E) dan transgenik P5CS (F), dan tanaman yang tidak berhasil hidup saat aklimatisasi (G). Tanda panah warna merah menunjukkan akar tanaman kelapa sawit.
Figure 2. Oil palm plantlet profile when soaked on 2 mM NAA solution (A), during acclimatization on plastic cover at 4th week (B), after opened plastic
cover at 6th week on non-transgenic (C) and P5CS trangenic, growth profile of non-transgenic (E) and P5CS transgenic root (F), and died
Seminar Nasional Bioteknologi | 2020
16
Tabel 3. Tinggi tanaman kelapa sawit non-transgenik dan transgenik P5CS
Table 3. Plant height of non-transgenic and P5CS transgenic oil palm
Klon Tinggi tanaman minggu ke- (cm)
0 2 4 6 Non-transgenik (n=13) 18,8 19,2 19,7 20,1 T-1 18,7 19,0 19,3 19,4 T-3(1) 18,8 19,2 19,4 20,4 T-3(2) 20,3 20,5 21,0 21,2 T-5 16,4 16,8 17,2 17,2 T-6 18,6 18,9 19,4 19,6 T-10 24,7 25,0 25,4 25,4 T-11 17,0 17,4 18,2 18,2 T-12(2) 18,6 19,0 19,2 19,2 T-12(3) 15,1 15,6 16,2 16,5 T-12(4) 15,6 15,7 16,2 17,1 T-12(5) 7,6 8,0 8,5 8,5 T-13 17,5 17,8 18,0 18,3 T-14(2) 17,6 17,9 18,2 18,5 T-22 13,1 13,6 14,0 14,2 T-23 20,8 21,0 21,4 22,1 T-24 16,5 16,9 17,2 18,0 T-25(1) 16,8 17,1 17,6 17,6 T-25(2) 16,9 17,1 17,5 18,3 T-26 17,6 18,0 18,4 18,4 T-30(1) 20,7 20,9 21,4 22,0
Gambar 3. Kecepatan penambahan tinggi tanaman kelapa sawit non-transgenik dan transgenik P5CS
Figure 3. Shoot elongation rate of non-transgenic and P5CS transgenic oil palm
0,267 0,250 0,250 0,233 0,233 0,217 0,217 0,192 0,200 0,183 0,167 0,150 0,150 0,150 0,133 0,133 0,133 0,133 0,117 0,117 0,100 0,000 0,050 0,100 0,150 0,200 0,250 0,300 T-3(1) T-12(4) T-24 T-25(2) T-12(3) T-23 T-30(1) NT (n=13) T-11 T-22 T-6 T-12(5) T-3(2) T-14(2) T-5 T-13 T-25(1) T-26 T-1 T-10 T-12(2)
Kecepatan penambahan tinggi (cm/minggu) /
shoot elongation rate (cm/week)
Kl o n / cl o n e
Seminar Nasional Bioteknologi | 2020
17
Salah satu bentuk evaluasi pertumbuhan tanaman transgenik P5CS juga dilakukan pada ukuran daun. Hingga minggu ke-6, jumlah daun baru yang sudah berkembang penuh dari tanaman transgenik P5CS yaitu 1-3 helai, sedangkan tanaman non-transgenik rata-rata jumlah daun yaitu 1 helai (Tabel 4). Varisasi fenotipe daun baru yang terbentuk setelah pengkondisian secara ex-vitro
bergantung pada beberapa hal, meliputi spesies tanaman, lingkungan kultur serta aklimatisasi, dan umur planlet (Kumar & Rao 2012).
Baik panjang, lebar, dan rasio panjang:lebar daun tanaman transgenik P5CS memperlihatkan adanya variasi dibandingkan tanaman non-transgenik. Mayoritas tanaman transgenik P5CS
mempunyai daun yang lebih pendek dibandingkan tanaman non-transgenik. Terdapat tiga klon transgenik P5CS yang mempunyai daun yang lebih panjang dibandingkan tanaman non-transgenik yaitu T-23, T-26, dan T-30(1), masing-masing 16,2, 17,0, dan 16,0 cm (Gambar 4a). Selain itu, berdasarkan pengamatan yang dilakukan juga diketahui bahwa mayoritas tanaman transgenik
P5CS mempunyai daun yang sempit dibandingkan tanaman non-transgenik. Lebar daun tanaman transgenik P5CS yaitu 1,0-3,0 cm (Gambar 4b). Sama halnya dengan panjang dan lebar daun, rasio
panjang:lebar daun tanaman transgenik P5CS lebih kecil dibandingkan tanaman non-transgenik yaitu berkisar 4,4-9,8 (Gambar 4c). Variasi profil pertumbuhan ini merupakan hal yang umum terjadi pada tanaman-tanaman hasil kultur jaringan saat dilakukan aklimatisasi. Menurut Pospíšilová et al. (1999) menyebutkan bahwa abnormalitas pada karakter morfologi, anatomi, dan fisiologi planlet hasil perbanyakan secara in vitro dapat diatasi setelah dikondisikan pada lingkungan ex vitro
melalui aklimatisasi.
Analisis korelasi menunjukkan bahwa terdapat hubungan positif secara signifikan (p<0.05) antara kecepatan penambahan tinggi, panjang daun, lebar daun, dan rasio panjang:lebar daun (Gambar 5). Koefisien korelasi (r) antar karakter-karakter pertumbuhan tersebut berkisar antara 0,84-0,96. Hal tersebut mengindikasikan bahwa hubungan yang sangat kuat antar keempat karakter tersebut. Berdasarkan hasil penelitian ini juga diketahui bahwa tidak adanya korelasi tinggi tanaman dan jumlah daun terhadap keempat karakter lainnya lainnya. Berdasarkan profil pertumbuhannya diketahui mengindikasikan bahwa baik klon kelapa sawit non transgenik maupun transgenik P5CS telah berhasil diaklimatisasi pada lingkungan ex vitro.
Tabel 4. Jumlah daun tanaman kelapa sawit non-transgenik dan transgenik P5CS
Table 4. Leaves number of non-transgenic and P5CS transgenic oil palm
Nomor tanaman Jumlah daun minggu ke-
0 2 4 6 Non-transgenik (n=13) 1 1 1 1 T-1 1 2 2 2 T-3(1) 1 2 2 2 T-3(2) 1 1 1 1 T-5 1 2 2 2 T-6 1 1 1 1 T-10 2 3 3 3 T-11 1 1 1 1 T-12(2) 1 1 1 1 T-12(3) 2 3 3 3 T-12(4) 1 2 2 2 T-12(5) 1 1 1 2 T-13 1 1 1 1 T-14(2) 1 1 1 1 T-22 1 1 1 1 T-23 1 1 1 1 T-24 1 1 1 1 T-25(1) 1 1 1 1 T-25(2) 1 1 1 1 T-26 1 1 1 1
Seminar Nasional Bioteknologi | 2020
18
T-30(1) 1 1 1 1
Gambar 4. Panjang, lebar, dan rasio panjang:lebar (p:l) daun tanaman kelapa sawit non-transgenik dan transgenik P5CS
Figure 4. Length, width, and length:width (l:w) ratio of leaves of non-transgenic and P5CS transgenic oil palm
Gambar 5. Koefisien korelasi Pearson antar peubah pertumbuhan tanaman kelapa sawit transgenik P5CS hasil aklimatisasi. KPT: Kecepatan penambahan tinggi, JD6: jumlah daun minggu ke-6 minggu setelah tanam (MST), PD= panjang daun, LD: lebar daun, dan RPLD: rasio panjang: lebar daun. Analisis korelasi dilakukan dengan taraf signifikansi (α) = 5%. Warna biru mengindikasikan adanya korelasi yang negatif secara signifikan; warna kuning mengindikasikan adanya korelasi yang positif secara signifikan; warna putih mengindikasikan tidak adanya korelasi yang signifikan.
Figure 5. Pearson correlation coefficient between growth characters of acclimatized P5CS transgenic oil palm. KPT: Shoot elongation rate, JD6: leaves
number at 6th week after planting (WAP), PD: leaf length, LD: leaf width, and RPLD: length:width (l:w) ratio of leaf. Correlation analysis was
done with significance level (α) = 5%. Blue color indicated significantly negative correlation; Yellow color indicated significantly positive
correlation; White color indicated non-significantly correlation. 17,0 16,2 16,0 15,7 15,5 15,3 14,7 14,6 14,3 14,1 14,0 14,0 13,7 13,6 13,5 13,4 13,2 12,4 12,2 12,0 7,0 0 10 20 T-26 T-23 T-30(1) NT (n=13) T-3(1) T-10 T-24 T-1 T-3(2) T-14(2) T-6 T-11 T-12(2) T-5 T-25(2) T-12(4) T-12(3) T-25(1) T-22 T-13 T-12(5) Panjang daun (cm) Kl o n 3,0 2,9 2,9 2,8 2,7 2,6 2,5 2,5 2,4 2,3 2,3 2,3 2,2 2,0 1,8 1,8 1,6 1,6 1,5 1,4 1,0 0 2 4 T-10 T-3(1) T-23 T-6 T-13 T-25(2) T-12(4) T-30(1) NT (n=13) T-1 T-3(2) T-26 T-22 T-11 T-12(3) T-25(1) T-14(2) T-24 T-5 T-12(2) T-12(5) Lebar daun (cm) Kl o n 9,8 9,2 9,1 8,8 7,4 7,3 7,0 7,0 6,9 6,7 6,4 6,3 6,2 5,6 5,5 5,4 5,3 5,2 5,1 5,0 4,4 0 5 10 15 T-12(2) T-24 T-5 T-14(2) T-26 T-12(3) T-11 T-12(5) T-25(1) NT (n=13) T-30(1) T-1 T-3(2) T-23 T-22 T-12(4) T-3(1) T-25(2) T-10 T-6 T-13 Rasio p:l daun Kl o n
Seminar Nasional Bioteknologi | 2020
19
Adanya variasi profil pertumbuhan 20 klon tanaman transgenik P5CS dalam penelitian ini diperlihatkan oleh hasil pengelompokkan yang menghasilkan 4 kelompok (Gambar 6). Kelompok 1 terdiri dari tanaman T-30(1). Kelompok 2 terdiri dari tanaman T-12(3), T-12(4), dan T-12(5). Kelompok 3 terdiri dari tanaman 13, 14(2), 22, 23, T-24, T-25(1), T-25(2), dan T-26. Kelompok 4 terdiri dari tanaman 1, 3(1), 3(2), 5, 6, 10, T-11, dan T-12(2). Kelompok 1 merupakan klon dengan yang mempunyai kecepatan penambahan
tinggi yang cepat serta ukuran daun yang panjang dan lebar. Kelompok 2 merupakan klon-klon dengan penambahan tinggi dengan kecepatan sedang serta ukuran daun yang panjang tetapi tidak terlalu lebar. Kelompok 3 merupakan klon-klon dengan penambahan tinggi dengan kecepatan sedang serta ukuran daun yang panjang dan sempit. Kelompok 4 merupakan klon-klon dengan kecepatan penambahan tinggi yang lambat serta ukuran daun yang pendek dan sempit.
Gambar 6. Pengelompokkan klon-klon kelapa sawit transgenik P5CS berdasarkan tingkat kemiripan karakter pertumbuhan menggunakan teknik UPGMA
clustering
Figure 6. Grouping of P5CS transgenic oil palm clones based on the similarity level of growth characters using UPGMA clustering technique.
Kesimpulan
Aklimatisasi telah berhasil dilakukan dengan tingkat keberhasilan pada klon non-transgenik dan transgenik P5CS masing-masing 76,5% dan 76,9% dengan karakter pertumbuhan yang bervariasi antar klon tanaman. Hasil analisis klaster berdasarkan kemiripan karakter pertumbuhan yang terdiri dari tinggi tanaman, kecepatan penambahan tinggi, jumlah daun, panjang, lebar, serta rasio panjang:lebar daun mengelompokkan 20 klon tanaman kelapa sawit transgenik P5CS menjadi 4 kelompok. Kelompok 1 terdiri dari tanaman T-30(1). Kelompok 2 terdiri dari tanaman T-12(3), T-12(4), dan T-12(5). Kelompok 3 terdiri dari tanaman T-13, T-14(2), T-22, T-23, T-24, T-25(1), T-25(2), dan T-26. Kelompok 4 terdiri dari tanaman T-1, T-3(1), T-3(2), T-5, T-6, T-10, T-11, dan T-12(2).
Ucapan Terima Kasih
Terima kasih kepada Badan Pengelola Dana Penelitian Kelapa Sawit (BPDPKS) atas pembiayaan secara parsial untuk penelitian ini.
Daftar Pustaka
Aslam J, SA Khan & MAK Azad (2015).
Agrobacterium-mediated genetic transformation of date palm (Phoenix dactylifera L.) cultivar “Khalasah” via somatic embryogenesis. Plant Sci Today 2(3), 93-101.
Budiani A, IB Nugroho, H Minarsih & I Riyadi (2019). Regeneration of P5CS-transformed oil palm plantlets mediated by Agrobacterium tumefaciens. Menara Perkebunan 87(2), 123-130.
Corrêa TR, SY Motoike, APdS Andrade, SM Coser, V Queiroz, MMC Granja, DDN Caetano, CNMendoza Peña & EAdT Picoli (2016). Accelerated in vitro propagation of elite oil
Seminar Nasional Bioteknologi | 2020
20
palm genotypes (Elaeis guineensis Jacq.) by substituting cytokinin with putrescine. African J Biotechnol 15(50), 2767-2775.
Dibax R, GB de Alcântara, JCB Filho, MP Machado, Y de Oliveira & ALL da Silva (2011). Plant regeneration of sugarcane cv. RB931003 and RB98710 from somatic embryos and acclimatization. J Biotechnol Biodivers 2(3), 32-37.
Ehirim BO, MN Ishaq, S Agboire, C Solomon, AN Ejizu & A Diarra (2014). Acclimatization: an important stage in tissue culture. Asian American Plant Sci Res J 1(1), 1-7.
Ernayunita, H Rahmadi, Y Yenni, RD Setiowati, & IY Harahap (2019). Vegetative characterization to identify oil palm (Elaeis guineensis Jacq.) plantlet abnormalities. AIP Conference Proceedings 2099, 020004.
Gomes HT, PMC Bartos & JE Scherwinski-Pereira (2015). Optimizing rooting and survival of oil palm (Elaeis guineensis) plantlets derived from somatic embryos.In Vitro Cell Dev Biol Plant 51, 111-117.
Hammer O, DAT Harper, & PD Ryan (2001). PAST: palaentological statictics software package for education and data analysis.
Palaentologia Electronica 4(1).
Iskandar HM, D Widyaningrum & S Suhandono (2014). Cloning and characterization of
P5CS1 and P5CS2 genes from Saccharum officinarum L under drought stress. J Tropical Crop Sci 1(1), 23-30.
Jolliffe IT, J Cadima (2016). Principal component analysis: a review and recent developments.
Philos Trans A Math Phys Eng Sci, 20150202.
Kumar K, Rao IU (2012) Morphophysiological problems in acclimatization of micropropagated plants in-ex vitro
conditions-a review. J Ornament Hortic Plants
2, 271-283.
Masli DIA, A Parveez, G Kadir, & AMM Yunus (2008). Transgenic oil palm mediated by
Agrobacterium tumefaciens. MPOB Information Series, PI 20071240 (Patent). Orozco-Castillo C, KJ Chalmers, R Waugh & W Powell
(1994). Detection of genetic diversity and selective gene introgression in coffee using
RAPD markers. Theor Appl Genet 87: 934-940.
Pavei D, MC Gonçalves-Vidigal, AR Schuelter, I Schuster, ESN Vieira, ECG Vendruscolo & JP Poletine (2016). Response to water stress in transgenic (p5cs gene) wheat plants (Triticum aestivum L.). Australian J Crop Sci
10(6), 776-783.
Pospóšilová J, I Tichá, P Kadleček, D Haisel & Š
Plzáková (1999). Acclimatization of micropropagated plants to ex vitro conditions. Biol Plant 42, 481-497. Riduan A, H Aswidinnoor, Sudarsono, D Santoso &
Endrizal (2010). Toleransi tembakau transgenik yang mengekspresikan gen P5CS
terhadap stres kekeringan. J Pengkajian dan Pengembangan Teknologi Pertanian 13(2), 107-118.
Sinta MM, DM Amanah (2019). Acclimatization and early growth of tissue culture-derived Stevia rebaudiana at low altitude area in Bogor, Indonesia. Menara Perkebunan 87(1), 68-76.
Sumaryono, I Riyadi (2011). Ex vitro rooting of oil palm (Elaeis guineensis Jacq.) plantlets derived from tissue culture. Indonesian J Agric Sci 12(2): 57-62.
Sumaryono, MM Sinta & Nurhaimi-Haris (2012). Daya hidup planlet karet asal in vitro microcutting pada berbagai periode penutupan sungkup plastik dan komposisi media tumbuh. Menara Perkebunan 80(1), 25-31.
Turhadi, Minarsih H, Riyadi I, Priyono & Budiani A (2020). Physiological responses and P5CS
gene expression of transgenic oil palm plantlet induced by drought stress. Menara Perkebunan 88(2), 69-78.
Yunita R, I Mariska, R Purnamaningsih, EG Lestari, S Utami (2016). Induksi akar tunas kelapa sawit (Elaeis guineensis Jacq.) secara in vitro
dan ex vitro. J Littri 22(1), 37-42.
Zarei S, AA Ehsanpour & J Abbaspour (2012). The role of over expression of P5CS gene on proline, catalase, ascorbate peroxidase activity and lipid peroxidation of transgenic tobacco (Nicotiana tabacum L.) plant under in vitro drought stress. J Cell Molecular Res
Seminar Nasional Bioteknologi | 2020
21
Optimasi teknik pemanenan mikroalga Nannochloropsis oceanica secara flokulasi menggunakan
FeCl3 skala laboratorium
Optimization of microalgae harvesting technique of Nannochloropsis oceanica by flocculation using FeCl3 in
laboratorium scale
Yora Faramitha*, Irma Kresnawaty, Fauziatul Fitriyah & Dini Astika Sari
Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Jl. Taman Kencana No. 1 Bogor, Indonesia 16128
*)Korespondensi penulis: yora.faramitha@gmail.com
Abstrak
Nannochloropsis oceanica merupakan mikroalga laut bersel tunggal yang mengandung protein dan lemak yang tinggi. Nannochloropsis telah banyak digunakan sebagai pellet dalam budidaya ikan dan berpotensi besar dimanfaatkan sebagai sumber nutrien omega 3 dan bahan bakar nabati yang menjanjikan. Akan tetapi, pemanfaaatan mikroalga secara umum mempunyai kendala dalam teknik pemanenan. Nannochloropsis oceanica
mempunyai ukuran yang lebih kecil dibanding Chlorella sp sehingga lebih sulit untuk dipanen. Sentrifugasi merupakan teknik yang paling efektif tetapi mahal sedangkan sedimentasi dinilai aman dan hemat biaya tetapi membutuhkan waktu. Flokulasi menggunakan bahan kimia lebih disukai karena efektif dan cepat, walaupun kemungkinan merusak produk akhir. Penelitian ini bertujuan untuk mempelajari pengaruh kecepatan dan waktu pengadukan terhadap efektifitas pemanenan N. oceanica menggunakan FeCl3 dan menentukan dosis minimum
FeCl3 yang dibutuhkan untuk secara efektif mengendapkan N. oceanica. Efisiensi flokulasi (EF) dari tiap perlakuan
ditentukan berdasarkan kerapatan optis (OD pada 440 nm) dan kerapatan sel (CD) pada medium kultur sebelum dan sesudah perlakuan flokulasi. Sebagai hasil, diperoleh Teknik pemanenan N. oceanica yang optimum pada kecepatan pengadukan sebesar 100 rpm selama 15 menit dengan konsentrasi FeCl3 sebesar 80 ppm. Pada
kondisi tersebut, nilai EF_OD dan EF_CD yang diperoleh masing-masing sebesar 92,26±1,95% dan 95,81±2,17%.
[Kata kunci: Efisiensi flokulasi, kerapatan optis, kerapatan sel]
Pendahuluan
Nannochloropsis oceanica merupakan jenis mikroalga laut sel tunggal yang mempunyai daya tarik tinggi karena mengandung protein dan lemak yang tinggi (Suda & Miyashita, 2019).
Nannochlorpsis umumnya mempunyai kandungan protein kasar sekitar 50% dari berat keringnya (Hulatt et al., 2017; Skrede et al., 2011) dan kandungan lemak berkisar antara 37-60% dari berat keringnya (Ma et al., 2014). Tidak hanya itu,
Nannochloropsis juga mengandung asam lemak omega-3 tidak jenuh, khususnya Eicosa Pentaenoic Acid (EPA) dalam jumlah yang sangat tinggi (Ma et
al., 2016). Senyawa ini umum dikenal sebagai minyak ikan dan mempunyai manfaat kesehatan yang besar khususnya dalam mencegah penyakit kardiovaskular dan inflamasi dan sumber makanan yang baik untuk perkembangan otak janin dalam kandungan (Molino et al., 2019).
Kandungan protein dan lemak yang tinggi pada Nannochloropsis membuat mikroalga ini mempunyai pemanfaatan yang luas. Nannochloropsis banyak digunakan sebagai sumber makanan (aquafeed) dalam budidaya ikan laut, udang, dan zooplankton, baik dalam bentuk kultur alga maupun konsentrat (Al-Hoqani, et al., 2017).
Seminar Nasional Bioteknologi | 2020
22
Nannochloropsis juga diyakini berpotensi sebagai sumber bahan bakar nabati generasi ketiga yang menjanjikan (Maity et al., 2014). Sorigue et al.
(2016) menemukan beberapa senyawa hidrokarbon alkana dan alkena, seperti heptadekana, pentadekana, dan heptadekena pada beberapa spesies Nannochloropsis. Hasil riset tersebut menunjukkan bahwa Nannochloropsis mampu mengubah asam lemak bebas menjadi hidrokarbon melalui pencahayaan.
Potensi pemanfaatan Nannochloropsis yang cukup besar ini perlu diselaraskan dengan sistem produksi yang efektif dan hemat biaya. Hingga saat ini, proses pemanenan mikroalga masih menjadi salah satu kendala utama karena tingginya biaya pemamenan, yaitu 20-30% dari total biaya produksi (Christenson & Sims, 2011). Ukuran mikroalga yang sangat kecil (2-20 µm), konsentrasi biomassa yang cukup sedikit (0,5-5 g/L), dan sifatnya yang stabil dalam air membuat proses pemisahan mikroalga dari medium air menjadi sangat sulit (Vandamme et al. 2013).
Secara umum, terdapat empat teknik pemanenan biomassa mikroalga diantaranya sentrifugasi, filtrasi, sedimentasi dan flokulasi. Sentrifugasi sangat cocok digunakan untuk aplikasi produk makanan dan farmasetikal. Pemanenan menggunakan sentrifugasi mempunyai tingkat perolehan biomassa tertinggi (>90%) namun memerlukan biaya modal dan operasional yang sangat besar dan boros energi. Pemanenan menggunakan filtrasi lebih cocok untuk mikroalga bersel besar dengan tingkat perolehan biomassa 70-90% namun biaya yang diperlukan juga cukup tinggi dan rentan terhadap permasalahan membran tersumbat atau rusak. Sebaliknya, pemanenan secara sedimentasi sangat hemat biaya dan aman, akan tetapi memerlukan waktu yang sangat lama. Dibanding teknik-teknik lainnya, flokulasi banyak digunakan karena dinilai efektif dengan tingkat perolehan biomassa diatas 90% dan hemat biaya baik modal maupun operasional. Akan tetapi pemanenan menggunakan flokulan kimia dikhawatirkan dapat merusak atau mengkontaminasi produk akhir (Christenson & Sims, 2011; Milledge & Heaven, 2013).
Flokulasi terjadi saat adanya penambahan flokulan (bahan kimia, biopolimer, atau mikroorganisme) ke dalam kultur mikroalga
sehingga sel-sel mikroalga membentuk flok atau agregat dan dapat dipisahkan dari media secara mudah dengan sedimentasi (Vandamme et al., 2013). Alumunium sulfat (Al2(SO4)3), ferri klorida
(FeCl3) dan NaOH adalah flokulan kimia yang umum
digunakan dan sudah diuji efektivitasnya dalam pemanenan berbagai jenis mikroalga, seperti:
Nannochloropsis oculata, Nannochloropsis sp.,
Thalassiosira weissflogii, Acutodesmus obliquus, dan Scenedesmus sp (Borges et al., 2016; Chua et al., 2018; Lemos et al., 2016; Shen et al., 2013; Wu
et al. 2015). Sepengetahuan kami, riset terkait optimasi pemanenan N. oceanica menggunakan flokulan FeCl3 belum banyak dilakukan. Oleh karena
itu, penelitian ini bertujuan untuk mempelajari pengaruh kecepatan dan waktu pengadukan terhadap efektifitas pemanenan Nannochloropsis oceanica menggunakan FeCl3 dan menentukan dosis
minimum FeCl3 yang dibutuhkan untuk secara efektif
mengendapkan N. oceanica.
Bahan dan Metode Mikroalga dan kondisi kultivasi
Mikroalga Nannochloropsis oceanica (NIES-2145) diperoleh dari NIES Microbial Culture Collection, Jepang. Perawatan dan perbesaran kultur isolat ini dilakukan di Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Bogor. Isolat N. oceanica dikulturkan menggunakan air laut sintetis (Monsterlaut ASW Salt Mix +) yang diperkaya dengan media F/2 dengan tingkat salinitas 20 ppt, pH 8.5, dan pencahayaan rutin meggunakan lampu LED 16 watt. Kultur dipanen pada fase eksponensial, yaitu pada nilai kerapatan optis (optical density / OD) sekitar 0,6 yang diukur pada panjang gelombang 440 nm.
Eksperimen flokulasi menggunakan FeCl3
Feri klorida (FeCl3) diperoleh dari Sigma dan
digunakan sebagai agen flokulan. Larutan stok FeCl3
dengan konsentrasi 10.000 ppm disiapkan dengan melarutkan 0,6 g garam FeCl3 dalam 60 mL air
akuades. Sebanyak 100 mL kultur N. oceanica
dalam wadah erlenmeyer 100 mL digunakan sebagai sampel. Desain penelitian ini menggunakan Rancangan Acak Kelompok (RAK) dengan tiga ulangan. Eksperimen flokulasi yang dilakukan mengacu metode Chua et al. (2019) dengan sedikit modifikasi. Sejumlah FeCl3 ditambahkan secara
Seminar Nasional Bioteknologi | 2020
23
meggunakan magnetic stirrer pada kecepatan dan waktu pengadukan sesuai perlakuan yang diuji. Sampel kemudian didiamkan selama 30 menit untuk proses sedimentasi.
Dalam penelitian ini terdapat dua tahapan eksperimen. Pertama, perlakuan yang diuji adalah variasi kecepatan dan waktu pengadukan yang terdiri dari perlakuan A yaitu pengadukan dengan kecepatan 100 rpm selama 15 menit dan perlakuan B yaitu pengadukan dengan kecepatan 300 rpm selama 5 menit. Dosis yang diberikan untuk perlakuan A dan B adalah 100 ppm. Eksperimen kedua adalah variasi dosis FeCl3 untuk perlakuan A
dan B. Untuk perlakuan A, variasi konsentrasi FeCl3
yang diuji adalah 20,40, 60, 80, dan 100 ppm sedangkan untuk perlakuan B terdiri dari 100, 200, 300, 400, dan 500 ppm.
Efisiensi flokulasi
Sampel yang sudah didiamkan selama 30 menit diukur nilai kerapatan optis (optical density/ OD) dan kerapatan selnya (cell density/CD) untuk menentukan nilai efisiensi flokulasi (EF). Sebanyak 350 µm supernatan diambil dari setengah ketinggian larutan sampel dan diukur nilai kerapatan optisnya (optical density / OD) pada panjang gelombang 440 nm. Sebagai kontrol, diukur nilai OD
sampel kultur N. oceanica sebelum ditambahkan FeCl3. Rumus efisiensi flokulasi berdasarkan nilai OD
(EF_OD) ditunjukkan pada persamaan 1. Selain itu, sebanyak 100 µm supernatan sebelum dan sesudah ditambahkan FeCl3 juga diambil untuk dihitung
jumlah selnya menggunakan hemacytometer. Efisiensi flokulasi (EF) dari hasil kerapatan sel (EF_CD) dihitung menggunakan persamaan 2.
Analisis statistik
Pengaruh perbedaan perlakuan waktu dan kecepatan pengadukan terhadap efisiensi flokulasi biomassa N. Oceanica dianalisis dengan Uji T sedangkan pengaruh konsentrasi FeCl3 dianalisis
dengan One-way annova menggunakan aplikasi statistik IBM SPSS 16.0. Perbedaan signifikansi tiap perlakuan ditentukan dengan menggunakan uji Tukey HSD pada P <0,05.
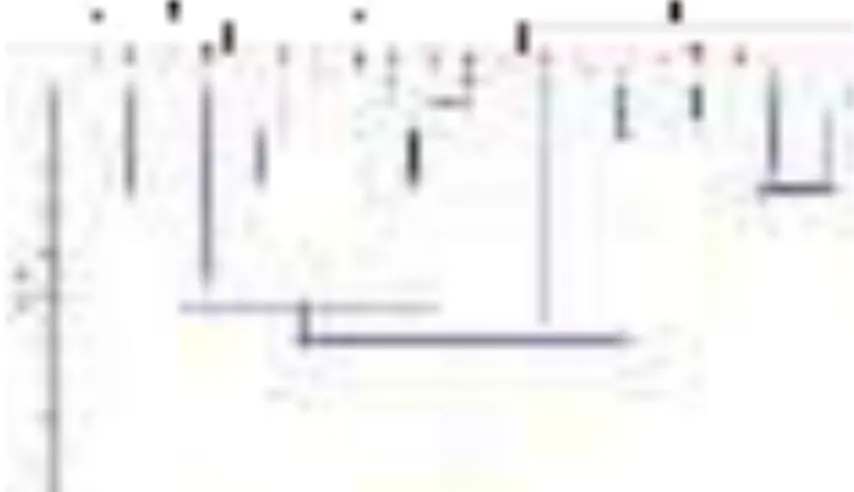
Hasil dan Pembahasan
Pada penambahan flokulan FeCl3 100 ppm,
eksperimen dengan pengadukan pada kecepatan 100 rpm selama 15 menit (Perlakuan A) mempunyai performa efisiensi flokulasi yang jauh lebih baik dibanding pengadukan dengan kecepatan 300 rpm selama 5 menit (Perlakuan B) (Gambar 2). Nilai EF_OD dan EF_CD dari perlakuan A masing-masing sebesar (96,29±0,83 % dan 98,60±0,34 %). Akan tetapi, nilai EF_OD dan EF_CD dari perlakuan B hanya setengah dari nilai EF perlakuan A. Hal ini menunjukkan terdapat pengaruh dari kecepatan dan lama waktu pengadukan terhadap nilai efisiensi flokulasi.
Kemampuan FeCl3 dalam mengendapkan
biomassa N. oceanica meningkat seiring pertambahan konsentrasi yang ditunjukkan dengan peningkatan persentase EF (Gambar 2 & Gambar 3). Pada perlakuan A, nilai EF_OD dan EF_CD tertinggi diperoleh dari perlakuan FeCl3 100 ppm
(96,29±0,83 % dan 98,60±0,34 %). Akan tetapi, nilai tersebut tidak berbeda signifikan dengan nilai EF dari perlakuan FeCl3 80 ppm (92,26±1,95 %
dan 95,81±2,17%). Oleh sebab itu, konsentrasi FeCl3 optimum untuk perlakuan A adalah 80 ppm.
Pada perlakuan B, konsentrasi FeCl3 optimum
berdasarkan nilai EF_OD adalah pada konsentrasi 300 ppm dengan nilai EF_OD sebesar 91,83 ± 0,13.Adapun berdasarkan nilai EF_CD, konsentrasi FeCl3 optimum adalah 400 ppm dengan nilai EF_CD
sebesar 97,79 ± 0,40. Konsentrasi optimum yang diperoleh dari perlakuan B sangat tinggi, yaitu sekitar 4-5 kali dari konsentrasi optimum FeCl3 dari
perlakuan A. Hal ini semakin memperkuat bahwa teknik pengadukan yang tidak tepat, khususnya ditinjau dari kecepatan dan lama pengadukan, dapat berdampak pada pemborosan dosis FeCl3 yang
diperlukan.
Sebagai flokulan, FeCl3 menginduksi
terjadinya flokulasi sel-sel N. oceanica melalui mekanisme netralisasi muatan (Vandamme et al., 2013). Mikroalga sel pada umumnya, termasuk N. oceanica, membawa muatan negatif yang mencegah terjadinya agregasi antar sel di dalam media kultur (Shen et al., 2013). Penambahan flokulan berupa multivalen kation (seperti Al2(SO4)3 dan FeCl3) ke
dalam kultur membuat muatan pada permukaan sel mikroalga menjadi netral yang mengakibatkan
Seminar Nasional Bioteknologi | 2020
24
hilangnya tolakan elektrostatis antar sel. Sel kemudian dapat saling berdekatan membentuk
flok-flok melalui interaksi Van der Waals (Muyleart et al., 2015).
Gambar 1. Perbandingan efisiensi flokulasi N. oceanica menggunakan perlakuan A dan B pada konsentrasi FeCl3 100 ppm
Figure 1. Comparison of efficiency flocculation of N. oceanica using treatment A and B at FeCl3 concentration of 100 ppm
Gambar 2. Efisiensi flokulasi N. oceanica dari berbagai konsentrasi FeCl3 pada kecepatan pengadukan 100 rpm selama 15 menit (Perlakuan A)
Table 2. Flocculation efficiency of N. oceanica from various concentration of FeCl3 at stirring speed of 100 rpm for 15 minutes (Treatment A)
Gambar 3. Efisiensi flokulasi N. oceanica dari berbagai konsentrasi FeCl3 pada kecepatan pengadukan 300 rpm selama 5 menit (Perlakuan B)
Table 2. Flocculation efficiency of N. oceanica from various concentration of FeCl3 at stirring speed of 300 rpm for 5 minutes (Treatment B)
96,29 98,60 42,57 48,14 0 20 40 60 80 100 FE (OD) FE (CD) Ef is ie n si f lo k u la si ( % ) Fl o cc u la ti o n e ff ic ie n cy ( % ) A B 0 10 20 30 40 50 60 70 80 90 100 0 20 40 60 80 100 Ef is ie n si f lo k u la n si ( % ) Fl o cc u la ti o n e ff ic ie n cy ( % ) Dosis (ppm) Dosage (ppm) EF_OD EF_CD 0 10 20 30 40 50 60 70 80 90 100 0 100 200 300 400 500 Ef is ie n si f lo k u la si ( % ) Fl o cc u la ti o n e ff ic ie n cy ( % ) Dosis FeCl3(ppm) Dosage of FeCl3 (ppm) EF_OD EF_CD a a b b b a a a a c d c b b a