BAB 2
TINJAUAN PUSTAKA
2.1. Embriologi Telinga Dalam
Telinga pada manusia terdiri atas tiga daerah yaitu telinga luar, telinga tengah dan telinga dalam. Telinga luar pada dasarnya merupakan corong pengumpul suara yang terdiri atas pinna dan saluran pendengaran luar. Telinga tengah adalah bagian yang menyalurkan suara dari telinga luar ke telinga dalam dan telinga dalam yang mengubah suara menjadi rangsangan saraf. (Drake et all, 2004)
Telinga dalam adalah organ pertama dari tubuh yang dalam perkembangannya telah terbentuk secara sempurna baik dalam ukuran maupun konfigurasinya yaitu pada kehamilan trimester kedua. Perkembangan telinga dalam dimulai pada awal minggu ketiga yaitu perkembangan intrauterin yang ditandai dengan tampaknya plakode ektoderm pada setingkat miensefalon. Plakode auditori berinvaginasi membentuk lubang (pit) auditori sepanjang minggu ke-4 yang kemudian menjadi vesikula auditori.
Pada tahap perkembangan selanjutnya vesikula otik (vesikula auditori) bagian ventral membentuk sakulus dan koklearis sedangkan bagian dorsal membentuk utrikulus, kanalis semisirkularis dan duktus endolimfatikus. Pembentukan saluran-saluran tersebut disebabkan adanya bagian-bagian tertentu dari daerah tersebut yang berdegenerasi. Duktus koklearis yang sedang tumbuh menembus mesenkim di sekitarnya dan berpilin seperti membentuk spiral. Selanjutnya duktus koklearis tetap berhubungan dengan sakulus melalui duktus reunien.
Duktus semisirkularis, duktus utrikulus, duktus sakulus dan duktus koklearis kemudian diisi dengan cairan endolimfe sehingga semua struktur membran dari saluran tersebut dinamakan membran labirin. Dinding sel membran labirin sangat tipis dan terdiri atas sel-sel epitel tunggal yang ditutupi oleh lapisan serabut jaringan ikat yang dibentuk dari mesenkim di sekitarnya. Beberapa dari sel epitel tersebut dimodifikasi menjadi sel-sel rambut (sel neuroepitel dan beberapa sel pendukung).
Dasar dari sel-sel neuroepitel dikelilingi oleh ujung serabut saraf yang datang dari ganglion spinal dan ganglion vestibular. Ganglion-ganglion tersebut berhubungan dengan otak melalui serabut saraf yang dibentuk oleh tulang yang disebut tulang labirin. Ruang
diantara membran labirin dan tulang labirin tersebut berisi cairan perilimfe.(Drake et all, 2004)
2.2. Anatomi Telinga Dalam
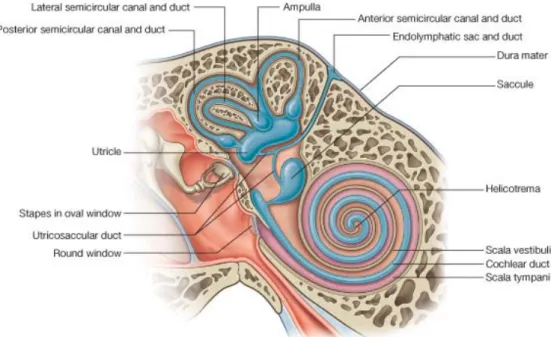
Telinga dalam terdiri dari serangkaian rongga tulang yang disebut labirin tulang serta duktus dan sakulus membran yang disebut labirin membran (Drake R. L., Vogl W. and Mitchell A. W. M., 2004).
Labirin tulang terdiri dari vestibulum, kanalis semisirkularis dan koklea. Rongga tulang ini dibatasi dengan peritoneum dan mengandung cairan jernih disebut cairan perilimfe. Berbatasan dengan perilimfe tetapi tidak mengisi seluruh ruangan labirin tulang terdapat labirin membranosa yang terdiri dari duktus semisirkularis, duktus koklearis, utrikulus dan sakulus. Ruang labirin membranosa ini diisi dengan cairan endolimfe.
Struktur dari telinga dalam membantu penyampaian informasi ke otak tentang keseimbangan dan pendengaran yaitu :
a. duktus koklear sebagai organ pendengaran.
b. duktus semisirkularis, utrikulus dan sakulus sebagai organ keseimbangan.
Gambar 2.2. Membran Labirin
2.2.1. Vestibulum
Vestibulum yang mengandung jendela oval pada dinding lateralnya adalah bagian pusat dari labirin tulang. Vestibulum berhubungan dengan koklea di bagian anterior dan dengan kanalis semisirkularis di bagian posterosuperior.
Pada dinding lateral vestibulum terdapat foramen oval yang ditutupi foot plate stapes beserta ligamentum anulare. Dinding medial vestibulum menghadap ke meatus akustikus internus dan ditembus oleh saraf. Pada dinding medial ini terdapat dua cekungan yaitu cekungan sferis untuk sakulus dan cekungan elips untuk utrikulus.
Pada dinding posterior vestibulum terdapat lima lubang kanalis semisirkularis dan di dinding anterior vestibulum terdapat dua lubang yang berbentuk elips ke skala vestibularis koklea (Drake 2004).
2.2.2. Kanalis Semisikularis
Terdapat tiga buah kanalis yaitu kanalis semisirkularis superior, posterior dan lateral yang terletak di atas dan belakang vestibulum. Ketiga kanalis semisirkularis bermuara pada utrikulus. Bentuk kanalis seperti 2/3 lingkaran dengan panjangnya hampir sama yaitu ± 0,8 mm.
Pada salah satu ujung masing-masing kanalis ini melebar disebut ampula dan mengandung sel-sel rambut krista yang berisi epitel sensori vestibular dan terbuka ke vestibulum. Struktur reseptor ini disebut krista ampularis terletak memanjang di ujung ampula pada tiap kanal membranosa. Setiap krista terdiri dari sel rambut dan sel pendukung (sustenakular) yang dikelilingi oleh bagian gelatinosa (kupula) yang menutupi ampula. Prosesus dari sel rambut melekat pada kupula dan basis sel rambut berhubungan dekat dengan serabut aferen dari bagian vestibular dari kranial ke nervus VII. (Barrett K. E. et al, 2010 ).
2.2.3. Koklea
Koklea terletak di depan vestibulum dan berbentuk seperti rumah siput yang mengarah ke dasar dari kanalis auditorius interna dan sumbunya yang panjang mengarah keluar dengan membentuk sudut 300
Di dasar koklea, skala vestibuli berakhir pada jendela oval yang ditutupi oleh kaki tulang pendengaran (stapes). Skala timpani berakhir pada jendela oval, sebuah foramen di dinding medial dari telinga dalam yang ditutupi oleh membran timpani yang fleksibel. Skala media, ruang tengah koklea, berlanjut ke labirin membraniosa dan tidak berhubungan dengan kedua skala lainnya (Barret.K.C et all, 2010).
dengan bidang horizontal. Di sepanjang koklea, membran basilar dan membran Reissner membagi koklea menjadi tiga ruang atau skala. Di atas terdapat skala vestibuli dan di bawah skala vestibuli dan di bawah terdapat skala timpani yang mengandung cairan perilimfe dan berhubungan satu sama lain di puncak koklea melalui sebuah lubang terbuka yang disebut helikotrema.
Gambar 2.3. Potongan Melintang Koklea
2.2.4. Sakulus dan Utrikulus
Utrikulus terletak di bagian belakang lekukan dinding atas vestibulum, sakulus bentuknya jauh lebih kecil tetapi strukturnya sama dan terletak di dalam lekukan bagian bawah dan di depan utrikulus. Sakulus menyokong suatu struktur makula pada dinding medialnya dalam suatu bidang vertikal yang meluas ke dinding anterior. Sakulus berhubungan dengan utrikulus melalui suatu duktus yang sempit yang juga merupakan saluran menuju sakus endolimfatikus. Makula utrikulus terletak pada bidang tegak lurus terhadap macula sakulus, utrikulus dan sakulus seluruhnya dikelilingi oleh perilimfe kecuali pada tempat masuknya saraf di daerah makula (Drake R.L. et all, 2004).
Di dalam setiap labirin membranosa, di lantai utrikulus terdapat organ otolit (makula). Makula yang lain terletak pada dinding sakulus di posisi semivertikal. Makula mengandung sel pendukung dan sel rambut dikelilingi oleh sebuah membran otolit dimana melekat pada kristal kalsium karbonat yang disebut otolit. Otolit yang disebut juga otokonia atau debu telinga berukuran 3-19 µm pada manusia dan lebih padat dari cairan endolimfe. Prosesus dari sel rambut melekat pada membran. Serabut saraf dari sel rambut bergabung dengan krista dari bagian vestibular saraf kranial ke VII.
2.2.5. Duktus Semisirkularis
Bagian ini terbuka ke bagian posterior dari utrikulus melalui lima lubang yang terpisah dan letaknya tegak, ini merupakan tiga daratan pada ruang telinga dalam. Masing-masing duktus pada semisirkularis melebar pada salah satu ujungnya yang membentuk ampula dan terletak pada saluran tulang yang melebar. Panjang sumbu dari masing-masing ampula kira-kira 2 mm.
2.2.6. Duktus Koklearis
Duktus koklearis disebut juga skala media dan merupakan bagian labirin membran koklea sedangkan bagian labirin tulang koklea disebut skala vestibuli dan skala timpani. Bentuk duktus koklearis ini mengikuti bentuk labirin tulang koklea berupa dua setengah sampai dua tiga perempat putaran spiral. Duktus koklearis meluas mulai dari basis koklea sampai ke apek koklea kemudian akan berakhir sebagai saluran buntu pada apeks yang disebut caecum cupulare. Skala vestibuli dan skala timpani pada apeks koklea berhubungan satu sama lain terdapat helikotrema (Barret K.C et all, 2010).
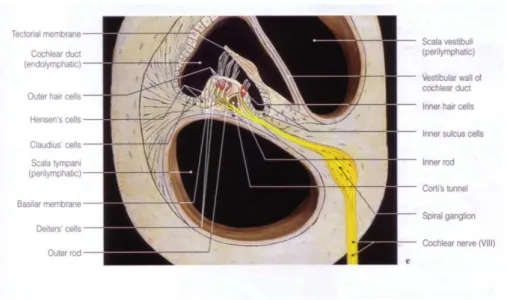
2.2.7. Organ Corti
Pada membran basilaris terdapat organ corti dimana struktur tersebut mengandung sel rambut yang merupakan reseptor pendengaran. Organ ini memanjang dari apeks ke dasar koklea dan mempunyai bentuk spiral. Prosesus sel rambut melubangi lamina retikular, membran yang disokong oleh sel pilar atau rods of corti. Sel rambut disusun menjadi empat baris, tiga baris dari sel rambut luar lateral terhadap terowongan dibentuk oleh rods of corti dan satu baris dari sel rambut medial ke terowongan.
Menutupi barisan sel rambut adalah membran tektorial yang tipis, kental, dan elastik dimana sel rambut luar melekat. Badan sel neuron sensoris yang terdapat di sekeliling dari dasar sel rambut terletak di ganglion spiral di dalam modiolus yang merupakan inti tulang dimana koklea terdapat.
2.3. Vaskularisasi Telinga Dalam
Telinga dalam mendapat vaskularisasi dari arteri labirin cabang dari arteri serebralis anterior-inferior tetapi dapat juga sebagai cabang langsung dari arteri basilaris. Arteri ini masuk ke meatus akustikus internus dan terpisah menjadi arteri vestibularis anterior dan arteri koklearis komunis yang bercabang pula menjadi arteri koklearis dan arteri vestibulokoklearis. Arteri vestibularis anterior memperdarahi vestibularis anterior memperdarahi vestibularis, utrikulus dan sebagian duktus semisirkularis.
Arteri vestibulokoklearis sampai di modiolus di daerah putaran basal koklea terpisah menjadi cabang terminal vestibular dan cabang koklear. Cabang vestibular memperdarahi sakulus, sebagian besar kanalis semisirkularis dan ujung basal koklea. Cabang koklear memperdarahi ganglion spiralis, lamina spiralis ossea, limbus dan ligamen spiralis. Arteri koklearis berjalan mengitari nervus akustikus di kanalis akustikus di kanalis akustikus internus dan di dalam koklea mengitari modiolus.
Vena dialirkan ke vena labirintin yang diteruskan ke sinus petrosus inferior atau sinus sigmoideus. Vena-vena kecil melewati akuaduktus vestibularis dan koklearis ke sinus petrosus superior dan inferior (Wright, 1997).
2.4. Persarafan Telinga Dalam
Nervus vestibulokoklearis (nervus akustikus) yang dibentuk oleh bagian koklear dan vestibular di dalam meatus akustikus internus bersatu pada sisi lateral akar nervus fasialis dan masuk ke batang otak antara pons dan medulla oblongata. Sel sel sensoris vestibularis dipersarafi nervus koklearis dengan ganglion vestibularis (Scarpa) terletak di dasar meatus akustikus internus. Sel-sel sensoris pendengaran dipersarafi nervus koklearis dengan ganglion spiralis Corti terletak di modiolus, pada dasar meatus akustikus internus terletak ganglion vestibulare (Donaldson, 1991).
2.5. Fisiologi Pendengaran
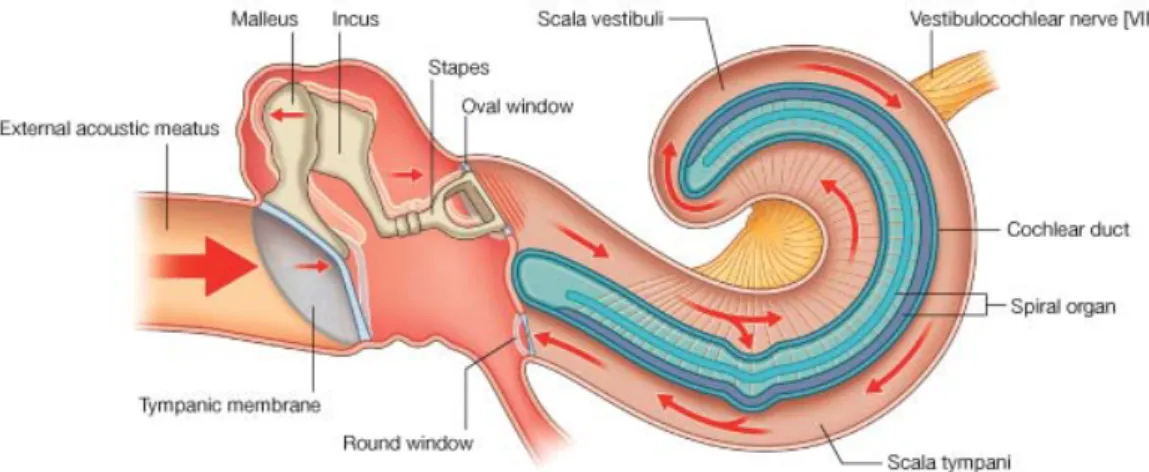
Proses mendengar diawali dengan dengan ditangkapnya energi bunyi oleh daun telinga dalam bentuk gelombang yang dialirkan melalui udara atau tulang koklea. Getaran tersebut menggetarkan membran timpani diteruskan ke telinga tengah melalui rangkaian tulang pendengaran yang akan mengamplifikasi getaran melalui daya ungkit tulang pendengaran dan perkalian perbandingan luas membran timpani dan tingkap lonjong.
Energi getar yang telah diamplifikasi ini akan diteruskan ke stapes yang menggerakkan tingkap lonjong sehingga cairan perilimfe pada skala vestibuli bergerak. Getaran diteruskan melalui membrana Reissner yang mendorong cairan endolimfe sehingga akan menimbulkan gerak relatif antara membran basilaris dan membran tektoria. Proses ini merupakan rangsangan mekanik yang menyebabkan terjadinya defleksi stereosilia sel-sel rambut, sehingga kanal ion terbuka dan terjadi pelepasan ion bermuatan listrik dari badan sel. Keadaan ini menimbulkan proses depolarisasi sel rambut, sehingga melepaskan neurotransmiter ke dalam sinapsis yang akan menimbulkan potensial aksi pada saraf auditorius lalu dilanjutkan ke nukleus auditorius lalu dilanjutkan ke nukleus auditorius sampai ke korteks pendengaran (area 39-40) di lobus temporalis (Brake, K.C et all, 2004).
Gambar 2.3. Transmisi Suara
Dikutip dari Buku Gray’s Anatomy
2.6. Perkembangan Merespon Suara 2.6.1. Respon pada Bayi di bawah 4 bulan
Pada masa ini bayi mulai menunjukkan perhatian lebih pada suara ibu daripada suara orang lain. Bayi akan terkejut jika ada bunyi keras dan mulai menyadari suara yang lembut. Bayi mulai bermain dengan mainan yang mengeluarkan bunyi dan berhenti menangis untuk mendengar suara. Bayi juga terbangun ketika ada suara keras dan mengedipkan atau melebarkan matanya sebagai reflex terhadap suara (Northen J. dan Downs H., 1991).
2.6.2. Respon pada Bayi Usia 5-7 bulan
Bayi mulai mencari sumber bunyi dan dapat menggeser kepalanya ke arah lateral ketika mendengar bunyi. Bayi memberikan tanggapan yang berbeda terhadap bunyi yang berbeda dan menangis jika mendengar suara yang tidak diinginkannya. Bayi mulai menyukai nyanyian dan siulan serta suara dari alat musik (Northen J. dan Downs H., 1991).
2.6.3. Respon pada Bayi Usia 6-10 bulan
Pada masa ini respon bayi tehadap suara meningkat dengan kepala berputar cepat. Bayi mulai dapat memberikan respon terhadap namanya, suara telepon dan suara lainnya.
Bayi juga sudah dapat mengeluarkan suara dengan nada tinggi dan rendah (Northen J. dan Downs H., 1991).
2.6.4. Respon pada Bayi Usia 9-13 bulan
Perkembangan bayi mulai meningkat ditandai dengan bayi sudah dapat mengeluarkan beberapa suku kata seperti “ma-ma”. Bayi dapat mengeluarkan nada-nada nyanyian dan mengingat apa yang didengarnya. Bayi juga dapat menghubungkan bunyi tertentu dengan kejadian tertentu (Northen J. dan Downs H., 1991).
2.6.5. Respon pada Bayi Usia 13-15 bulan
Pada masa ini bayi sudah dapat mengikuti perintah sederhana dan dapat mengeluarkan 3-5 kata serta dapat menirukan bunyi-bunyi tertentu (Northen J. and Downs H., 1991).
2.6.6. Respon pada Bayi Usia 18-24 bulan
Bayi dapat mengenal bagian dari tubuh dan dapat mengeluarkan 20-50 kata. Bayi juga dapat mendengar namanya dipanggil dari ruangan lain (Northen J. dan Downs H., 1991).
2.6.7. Respon pada Bayi Usia di atas 24 bulan
Pada tahap ini bayi sudah dapat mengatakan 4-5 kalimat dan dapat dimengerti oleh orang yang mendengarkannya (Northen J. dan Downs H., 1991)..
Faktor risiko terjadinya gangguan pendengaran pada neonatus
1. Riwayat keluarga ditemukan ketulian
2. Infeksi intrauterin
3. Abnormalitas pada kraniofasial
4. Hiperbilirubinemia yang memerlukan tranfusi tukar
5. Penggunaan obat ototoksik aminoglikosida lebih dari 5 hari atau
penggunaan
antibiotik tersebut dengan obat golongan loop diuretic
6. Meningitis bakteri
7. Apgar skor < 4 pada saat menit pertama setelah dilahirkan, atau
apgar skor < 6 pada menit kelima.
8. Memerlukan penggunaan ventilasi mekanik lebih dari 5 hari.
9. Berat lahir < 1500 gram
10. Manifestasi dari suatu sindroma yang melibatkan ketulian.
Meskipun faktor risiko yang telah disebutkan merupakan suatu indikasi
untuk dilakukan pemeriksaan untuk menentukan adanya suatu gangguan
pendengaran, akan tetapi dilapangan ditemukan bahwa 50% neonatus dengan
gangguan pendengaran tidak mempunyai faktor risiko. Oleh karena itu
direkomendasikan suatu pemeriksaan gangguan pendengaran pada seluruh
neonatus setelah lahir atau setidaknya usia tiga bulan.
2.7. Faktor penyebab ketulian pada neonatus
Secara garis besar faktor penyebab terjadinya gangguan pendengaran dapat berasal dari genetik maupun didapat:
2.7.1 Faktor genetik
Gangguan pendengaran karena faktor genetik pada umumnya berupa gangguan pendengaran bilateral tetapi dapat pula asimetrik dan mungin bersifat statis maupun progresif. Kelainan dapat bersifat dominan, resesif, berhubungan dengan kromosom X (contoh: Hunter’s syndrome, Alport syndrome, Norrie’s disease) kelainan mitokondria (contoh: Kearns-Sayre syndrome), atau merupakan suatu malformasi pada satu atau beberapa organ telinga (contoh: stenosis atau atresia kanal telinga eksternal serind dihubungkan dengan malformasi pinna dan rantai osikuler yang menimbulkan tuli konduktif). 2.7.2 Faktor didapat (aquired)
Dapat disebabkan oleh : 1. Infeksi
Rubela kongenital, Cytomegalovirus, Toksoplasmosis, virus herpes simpleks (tabel 1), meningitis bakteri, otitis media kronik purulenta, mastoiditis, endolabirintitis, kongenital sifilis. Toksoplasma, Rubela, Cytomgalovirus, menyebabkan gangguan pendengaran pada 18% dari seluruh kasus gangguan pendengaran dimana gangguan pendengaran sejak lahir
akibat infeksi Cytomegalovirus sebesar 50%, infeksi Rubela kongenital 50%, dan Toksoplasma kongenital 10%-15%, sedangkan untuk infeksi herpes simpleks sebesar 10%. Gangguan pendengaran yang terjadi bersifat tuli sensorineural. Penelitian oleh Rivera menunjukan bahwa 70% anak yang mengalami infeksi sitomegalovirus konegenital mengalami gangguan pendengaran sejak lahir atau selama masa neonatus. Pada meningitis bakteri melalui laporan post-mortem dan beberapa studi klinis menunjukan adanya kerusakan di koklea atau saraf pendengaran, sayangnya proses patologis yang terjadi sehingga menyebabkan gangguan pendengaran masih belum dapat dipastikan.
2. Obat ototoksik
Obat-obatan yang dapat menyebabkan gangguan pendengaran adalah: Golongan antibiotika: Erythromycin, Gentamicin, Streptomycin, Netilmicin, Amikacin, Neomycin (pada pemakaian tetes telinga), Kanamycin, Etiomycin, Vancomycin, golongan diuretika: furosemide.
Kadar bilirubin indirek ditentukan juga oleh beberapa faktor seperti: kecepatan produksi bilirubin, kadar albumin, dan obat-obatan (sulfonamid, diuretikum, salisilat). (Huang et all, 2004)
3. Trauma
Fraktur tulang temporal, pendarahan pada telinga tengah atau koklea, dislokasi osikular, trauma suara.
4. Neoplasma
Tumor yang sering terjadi seperti
1. Bilateral acoustic neurinoma (neurofibromato),
2. Cerebellopontine tumor, tumor pada telinga tengah (contoh:
rhabdomyosarcoma, glomus tumor. (Mishra MJ et all 2009)
5. Hiperbilirubinemia
Definisi :
Neonatal hiperbilirubinemia adalah keadaan dimana kadar bilirubin total > 5mg/dl
(86µmol/L). Hiperbilirubinemia tampak secara klinis sebagai ikterus. Ikterus
neonatorum adalah keadaan klinis ada bayi yang ditandai oleh pewarnaan ikterus
pada kulit dan sklera akibat akumulasi bilirubin tak terkonjugasi yang berlebih.
Secara klinis ikterus mulai tampak pada bayi baru lahir bila kadar bilirubin darah 5-7
mg/dl, bila kurang dari itu maka tidak akan tampak secara klinis. Neonatus aterm
rata-rata memiliki konsentrasi bilirubin serum puncak 5-6 mg/dl (86-103 µmol/L)
pada hari ketiga dan keempat. Ikterus fisiologis yang memberat terjadi pada kadar
bilirubin diatas ambang ini (7-17 mg/dl).
Konsentrasi bilirubin serum
≥17 mg/dl pada bayi aterm tidak lagi dianggap fisiologis
dan biasanya dapat kita temukan penyebab ikterus patologis pada bayi-bayi ini.
Penyebab terbanyak ikterus neonatorum adalah peningkatan kadar bilirubin indirek.
Bilirubin indirek inilah yang bersifat neurotoksik bagi bayi.(Marthin CR,Cloherty J,P,
2004)
Etiologi
Hiperbilirubinemia (indirek) dapat disebabkan oleh bermacam-macam keadaan.
Etiologi terjadinya hiperbilirubinemia:
1. Etiologi yang sering:
a. Hiperbilirubinemia fisiologis
b. Inkompatibilitas galongan darah ABO dan Rhesus
c. Breast milk jaundice
d. Infeksi
e. Hematom subdural/sefalhematoma, ekimosis,hemangioma
f. Bayi dari ibu diabetes mellitus
g. Polisitemia/hiperviskositas
2. Etiologi yang lebih jarang:
a. Defisiensi G6PD
b. Defisiensi piruvat kinase
c. Sferositosis kongenital
d. Lucey-Driscoll syndrome
e. Crigler-Najjar disease
f. Hipotiroidisme
g. Hemoglobinopati
Pengaruh hiperbilirubinemia terhadap gangguan pendengaran
Kekhawatiran utama akibat hiperbilirubinemia yang berlebihan adalah potensi efek neurotoksiknya, walaupun dapat juga terjadi jejas pada sel-sel lainnya. Hal ini masih merupakan masalah yang signifikan meskipun telah ada kemajuan-kemajuan dalam perawatan neonatus ikterik (hiperbilirubinemia).
Kepustakaan lain menjelaskan bahwa hiperbilirubinemia berat dan tidak ditangani pada masa neonatal akan menyebabkan kadar bilirubin yang tinggi dan bersifat toksik pada perkembangan bayi. Pada bayi aterm, gejala hiperbilirubinemia adalah anak lemah dan malas minum yang akan berlanjut menjadi choreoathetoid cerebral palsy, retardasi mental, tuli sensorineural dan gaze paresis.
Terdapat bukti-bukti bahwa peningkatan kadar bilirubin yang moderat sekalipun tetap akan membuat bayi lebih memiliki risiko memiliki kelainan-kelainan kognitif, persepsi, motorik dan auditorik. Penelitian-penelitian prospektif terkontrol telah mengungkapkan adanya gangguan neurologis dan kognitif pada anak-anak yang mengalami peningkatan kadar bilirubin indirek pada masa bayinya. Penelitian-penelitian statistik yang luas pada bayi-bayi aterm sehat, seperti yang dilaporkan the National Collaborative Perinatal Project, telah mendeteksi adanya hubungan antara hiperbilirubinemia dalam kadar ‘rendah’ yang biasanya tidak diterapi dengan sequele neurologis dan motorik ringan. Penelitan-penelitian klinis dan patologis yang lebih baru lagi telah membuktikan bahwa kadar biliribun yang dahulu dianggap aman ternyata membahayakan. Hiperbilirubinema derajat sedang pada neonatus aterm yang sehat mungkin tidak aman untuk otaknya.
Bilirubin masuk ke otak bila ia tidak terikat dengan albumin atau tidak terkonjugasi atau ‘bebas’ (Bf) atau bila ada kerusakan pada sawar darah otak. Bilirubin dibentuk dari hemoglobin (gambar 2), sekitar 75%-nya dari hemolisis dan 25% dari eritropoiesis yag tidak efektif. Hemoglobin pertama-tama diubah menjadi biliverdin melalui sebuah reaksi yang tergantung pada adenosin trifosfatase yang dikatalisis oleh heme oksigenase, menghasilkan sebuah molekul karbon dioksida untuk setiap molekul biliverdin dan pada akhirnya akan terbentuk bilirubin.
Bilirubin non-toksik dikatalisis oleh biliverdin reduktase menjadi bilirubin tidak terkonjugasi, sebuah antioksidan alami pada kadar rendah, namun menjadi neurotoksik pada kadar tinggi. Bilirubin tidak terkonjugasi bersifat nonpolar, tidak larut dalam air dan terikat pada albumin serum, maka hanya ada sedikit bilirubin tidak terkonjugasi dalam bentuk tidak terikat atau bilirubin tidak terkonjugasi ‘bebas’ (Bf), namun justru Bf inilah yang bebas masuk dalam otak, cairan serebrospinal,dan bertanggungjawab pada neurotoksisitasnya. Bf mudah melewati sawar darah otak, namun bilirubin yang terikat pada albumin tidak dapat memasuki otak kecuali bila ada gangguan sawar darah otak, kemudian akan dihasilkan pewarnaan kuning yang luas. Pada kondisi toksik, bilirubin tidak terkonjugasi yang tidak terikat atau Bƒ-lah (bilirubin indirek) yang ada dalam otak, bukan bilirubin yang terikat pada albumin.
Bilirubin tak terkonjugasi diambil oleh sel-sel hepar, dikonjugasi dengan glukoronida oleh UDPGT (UDP-glucoronosyltransferase) menjadi bilirubin terkonjugasi yang nontoksik, larut dalam air dan diekskresikan dalam empedu. Meskipun bilirubin terkonjugasi tidak neurotoksik, tetapi terikat pada albumin dan berkompetisi dengan bilirubin tak terkonjugasi untuk lokasi ikatan dengan albumin. Bilirubin terkonjugasi dieliminasi dalam feses namun juga dipecah dalam usus oleh bakteri menjadi bilirubin tak terkonjugasi, yang kemudian diserap kembali dalam aliran darah, inilah yang kita sebut sebagai sirkulasi enterohepatik. Bilirubin mempengaruhi fungsi mitokondria dengan menghambat kerja enzim-enzim mitokondrial, menggangu sintesis DNA, menginduksi pemecahan DNA, menghambat sintesi protein, memecah fosforilasi oksidatif dan menghambat uptake tyrosine (suatu ‘marker’ untuk transmisi sinaptik). Bilirubin memiliki afinitas terhadap fosfolipid membentuk presipitat yang melekat pada membran sel otak. Mekanisme toksisitas bilirubin telah disimpulkan dari penelitian-penelitian dengan menggunakan konsentrasi bilirubin yang relevan secara patofisiologis, yaitu kadar bilirubin tidak terkonjugasi yang diperkirakan akan dijumpai pada sistem saraf pusat bayi-bayi dengan hiperbilirubinemia.
Beberapa penilitian yang telah dilaporkan membuktikan bahwa model toksisitas neuronal selektif terjadi menyerupai kejadian iskemia otak. Homeostasis ion calsium (Ca+) adalah mekanisme dasar utama yang menyebabkan kematian sel neuron dan peningkatan eksitabilitas neuron. Banyak neuron menggunakan protein-protein sebagai buffer ion kalsium untuk mempertahankan kadar kalsium intrasel yang rendah. Percobaan-percobaan terhadap tikus-tikus Gunn ikterik, menunjukkan keterlambatan aktivitas ion kalsum dan ‘Calmodulin dependent protein kinase II’ (CaM kinase II), suatu bahan yang dibutuhkan oleh protein kinase sel dalam proses fosforilasi. Secara invitro didapatkan bahwa bilirubin menghambat aktivitas CaM kinase II, yang dianggap berhubungan dengan berbagai fungsi
neuron penting, seperti: pelepasan neurotransmitter, perubahan konduktansi ion yang diatur oleh kalsium serta dinamika neuroskeletal.
Dalam otak kerentanan terhadap efek neurotoksik bilirubin bervariasi menurut tipe sel, kematangan otak dan metabolisme otak. Kondisi-kondisi yang mempengaruhi sawar darah otak seperti: infeksi/sepsis, asidosis, hipoksia, hipoglikemia, trauma kepala dan prematuritas dapat mempengaruhi masuknya bilirubin kedalam otak.
Bilirubin tak terkonjugasi yang masuk dalam otak terutama dalam bentuk bebas atau bilirubin anion, berikatan dengan fosfolipid dan gangliosida pada permukaan membran plasma neuron. Ikatan antara bilirubin anion-fosfolipid kompleks merupakan ikatan yang tidak stabil. Bilirubin anion mengambil ion hidrogen dan membentuk asam bilirubin yang menempel kuat pada membran. Asam bilirubin tersebut akan menyebabkan kerusakan pada membran plasma sehingga dapat menyebabkan bilirubin anion masuk kedalam sel neuron. Bilirubin anion yang masuk kedalam sel akan berikatan dengan fosfolipid pada membran organel subseluler seperti mitokondria, retikulum endoplasma dan nukleus. Ikatan ini akan menyebabkan terbentuknya asam bilirubin dan kerusakan membran tingkat subseluler. Kerusakan tersebut memberikan dampak terhadap multisistem enzim dan menyebabkan kerusakan sel neuron di seluruh tubuh (Saricci,SU,Serdar MA,Korkmar et all, 2004)
Hiperbilirubinemia dalam darah
Bilirubin ekstraseluler
Ikatan antara bilirubin anion dengan fosolipid (dan gangliosida) pada
membran plasma neuron
Bilirubin anion masuk kedalam sel
ikatan antara bilirubin anion
Pembentukan asam bilirubin
Agregasi dan presipitasi
dengan fosfolipid pada membran asam bilirubin mitokondria, reticulum endoplasma
dan nukleus
Kerusakan membran plasma
Pembentukan asam bilirubin
Kematian sel neuron
Gambar 2.4 Jalur bilirubin dalam darah
(Santoso 2010)
Patofisiologi
Produksi bilirubin yang meningkat : peningkatan jumlah sel darah merah, penurunan umur sel darah merah, peningkatan pemecahan sel darah merah (Inkompatibilitas golongan darah dan Rh, defek sel darah merah pada defisiensi G6PD atau sferositosis, polisitemia, sekuester darah, infeksi).
Penurunan konjugasi Bilirubin: prematuritas, ASI , defek kongenital yang jarang. Peningkatan Reabsorpsi Bilirubin dalam saluran cerna : ASI, asfiksia, pemberian ASI yang terlambat, obstruksi saluran cerna.
Kegagalan ekskresi cairan empedu : infeksi intrauterin, sepsis, hepatitis, sindrom kolestatik, atresia biliaris, fibrosis kistik.
Neonatal jaundice fisiologis dapat terjadi dari hasil simultan dari 2 fenomena berikut:
1. Bilirubin produksi meningkat karena kerusakan peningkatan eritrosit janin. Ini adalah hasil dari jangka hidup singkat dari eritrosit janin dan massa eritrosit lebih tinggi pada neonatus.
2. Hati kapasitas ekskretoris rendah baik karena konsentrasi rendah dari ligandin protein mengikat dalam hepatosit dan karena rendahnya aktivitas transferase glucuronyl, enzim bertanggung jawab untuk bilirubin mengikat asam glukuronat, sehingga membuat air bilirubin larut (konjugasi).
Bilirubin diproduksi di sistem retikuloendotelial sebagai produk akhir katabolisme hem dan terbentuk melalui reaksi oksidasi-reduksi. Sekitar 75% bilirubin berasal dari hemoglobin, tapi degradasi mioglobin, sitokrom, katalase dan juga berkontribusi. Pada langkah oksidasi pertama, biliverdin terbentuk dari heme melalui aksi heme oxygenase, tingkat membatasi langkah dalam proses, melepaskan besi dan karbon monoksida. Sedangkan karbon monoksida diekskresikan melalui paru-paru dan dapat diukur dalam napas pasien untuk mengukur produksi bilirubin.
Selanjutnya, larut dalam air biliverdin direduksi menjadi bilirubin, yang, karena ikatan hidrogen intramolekul, hampir tidak larut dalam air dalam bentuk isomer yang paling umum nya (bilirubin IXα Z, Z). Karena sifat hidrofobik nya, bilirubin tak terkonjugasi diangkut dalam plasma terikat erat pada albumin. Mengikat protein lain dan eritrosit juga terjadi, tetapi peran fisiologis mungkin terbatas. Mengikat bilirubin peningkatan albumin postnatal dengan usia dan berkurang pada bayi yang sakit.
Kehadiran pesaing mengikat endogen dan eksogen, seperti obat-obatan tertentu, juga mengurangi afinitas pengikatan albumin untuk bilirubin. Sebuah fraksi bilirubin tak terkonjugasi menit dalam serum tidak terikat pada albumin. Bilirubin bebas mampu melintasi lipid yang mengandung membran, termasuk penghalang darah-otak, yang menyebabkan neurotoksisitas. Dalam kehidupan janin, bilirubin bebas dapat melewati plasenta, tampaknya dengan difusi pasif, dan ekskresi bilirubin dari janin terjadi terutama melalui organisme ibu.
Saat mencapai hati, bilirubin diangkut ke dalam sel hati, di mana bisa mengikat ligandin. Serapan bilirubin ke dalam hepatosit meningkat dengan konsentrasi ligandin meningkat. Konsentrasi Ligandin rendah saat lahir tetapi meningkat pesat selama beberapa minggu pertama kehidupan. Konsentrasi Ligandin dapat ditingkatkan dengan pemberian agen farmakologis seperti fenobarbital.
Bilirubin terikat dengan asam glukuronat (terkonjugasi) dalam retikulum endoplasma hepatosit dalam reaksi dikatalisis oleh uridin diphosphoglucuronyltransferase (UDPGT). Monoconjugates terbentuk pertama dan mendominasi pada bayi baru lahir. Diconjugates tampaknya terbentuk pada membran sel dan mungkin memerlukan kehadiran tetramer UDPGT.
Konjugasi bilirubin secara biologis penting karena mengubah molekul air yang tidak larut bilirubin menjadi molekul yang larut dalam air. Air kelarutan bilirubin terkonjugasi memungkinkan untuk dibuang ke dalam empedu. Aktivitas UDPGT rendah saat lahir tetapi meningkat dengan nilai-nilai orang dewasa dengan usia 4-8 minggu. Selain itu, obat-obatan tertentu (fenobarbital, deksametason, clofibrate) dapat diberikan untuk meningkatkan aktivitas UDPGT.
Bayi yang memiliki sindrom Gilbert atau senyawa yang heterozigot untuk promotor Gilbert dan mutasi struktural daerah pengkode UDPGT1A1 berada pada peningkatan risiko hiperbilirubinemia signifikan. Interaksi antara genotipe Gilbert dan anemia hemolitik seperti glukosa-6-fosfatase dehidrogenase (G-6-PD) kekurangan, sferositosis herediter, atau penyakit hemolitik ABO juga tampaknya meningkatkan risiko penyakit kuning neonatal parah.(Hansen TW,Nietsch L,Norman E et all 2009)
Selanjutnya, pengamatan penyakit kuning pada beberapa bayi dengan stenosis pilorus hipertropi juga mungkin terkait dengan varian Gilbert-jenis. Genetik polimorfisme untuk protein transporter anion organik OATP-2 berkorelasi dengan risiko 3 kali lipat untuk mengembangkan ikterus neonatal ditandai. Kombinasi polimorfisme OATP-2 gen dengan gen UDPGT1A1 varian selanjutnya akan meningkatkan risiko ini menjadi 22 kali lipat. Studi juga menunjukkan bahwa polimorfisme pada gen untuk glutathione-S-transferase (ligandin) dapat menyebabkan tingkat yang lebih tinggi dari bilirubin total serum.
Genetik. faktor genetik yang terlibat dalam patogenesis hiperbilirubinemia neonatal. Dalam
studi kasus kontrol nested, kami menentukan 1) frekuensi timin-adenin (TA) n polimorfisme promotor dan mutasi Gly71Arg di uridin diphosphoglucuronate-glucuronosyltransferase 1A1 (UGT1A1) gen pada neonatus> atau = 35-minggu usia kehamilan yang mengalami tingkat bilirubin> 18 mg / dL dan kontrol, 2) interaksi antara (TA) n polimorfisme promotor,
glukosa-6-fosfat dehidrogenase (G6PD) mutasi gen, dan puncak bilirubin. Terdapat kaitan genetis antara difosfat uridin-glucuronosyltransferase1A1 (UGT1A1) Gly71Arg, UGT1A1 promotor TATA-box dan mutasi gen glukosa-6-fosfat dehidrogenase (G6PD) dalam pengembangan hiperbilirubinemia tak terkonjugasi neonatal.
Dengan demikian, beberapa variasi antarindividu dalam kegiatan dan tingkat keparahan penyakit kuning neonatal dapat dijelaskan secara genetik. Sebagai dampak dari varian genetik lebih sepenuhnya dipahami, pengembangan panel tes genetik untuk risiko penyakit kuning neonatal berat atau berkepanjangan dapat menjadi wajar.
Setelah diekskresikan ke dalam empedu dan ditransfer ke usus, bilirubin ini akhirnya dikurangi menjadi tidak berwarna tetrapyrroles oleh mikroba dalam usus besar. Namun, beberapa deconjugation terjadi di usus kecil proksimal melalui aksi B-glucuronidases terletak di perbatasan kuas. Ini bilirubin tak terkonjugasi dapat diserap kembali ke dalam sirkulasi, meningkatkan kolam plasma bilirubin total. Siklus penyerapan, konjugasi, ekskresi, deconjugation, dan reabsorpsi disebut ‘enterohepatik sirkulasi. Proses ini mungkin meluas pada masa neonatus, sebagian karena asupan gizi terbatas pada hari-hari pertama kehidupan, memperpanjang waktu transit di usus.(Keren R,et all,. A 2009)
Pada ibu yang sedang mengalami kesulitan dengan pembentukan ASI, cairan dan asupan gizi yang tidak memadai sering menyebabkan penurunan berat badan yang signifikan setelah melahirkan pada bayi. Bayi tersebut memiliki peningkatan risiko penyakit kuning berkembang melalui sirkulasi enterohepatik meningkat, seperti dijelaskan di atas. Fenomena ini sering disebut sebagai penyakit kuning dan menyusui ini berbeda dengan penyakit kuning ASI dijelaskan di bawah.
Faktor-faktor tertentu hadir dalam ASI dari beberapa ibu juga dapat menyebabkan sirkulasi enterohepatik bilirubin meningkat (ASI jaundice). β-glukuronidase mungkin memainkan peran dengan uncoupling bilirubin dari ikatannya dengan asam glukuronat, sehingga membuatnya tersedia untuk reabsorpsi. Data menunjukkan bahwa risiko penyakit kuning ASI secara signifikan meningkat pada bayi yang memiliki polimorfisme genetik pada urutan coding dari UDPGT1A1 atau OATP2 gen. Meskipun mekanisme yang menyebabkan fenomena ini belum disepakati, bukti menunjukkan bahwa suplementasi dengan pengganti ASI tertentu dapat mengurangi tingkat penyakit kuning ASI (Maisels M.J et all 2009).
Ikterus neonatal, meskipun fenomena transisi normal di sebagian besar bayi, kadang-kadang dapat menjadi lebih jelas. Golongan darah yang tidak kompatibel (misalnya, Rh, ABO) dapat meningkatkan produksi bilirubin melalui hemolisis meningkat. Secara historis, isoimunisasi Rh adalah penyebab penting penyakit kuning yang parah, sering
mengakibatkan perkembangan kernikterus. Meskipun kondisi ini telah menjadi relatif jarang terjadi di negara-negara industri setelah penggunaan profilaksis Rh di Rh-negatif, isoimunisasi Rh tetap umum di negara berkembang.
Gangguan hemolitik nonimmune (sferositosis, G-6-PD kekurangan) juga dapat menyebabkan penyakit kuning meningkat, dan peningkatan hemolisis tampaknya telah hadir di beberapa bayi dilaporkan telah dikembangkan kernikterus di Jepang pada 10-15 tahun terakhir. Interaksi yang mungkin antara kondisi tersebut dan varian genetik dari Gilbert dan UDPGT1A1 gen, serta varian genetik dari beberapa protein lain dan enzim yang terlibat dalam metabolisme bilirubin, penemuan ini juga menyoroti tantangan yang terlibat dalam penggunaan umum dari penyakit kuning segi fisiologis dan ikterus patologis. Meskipun penyakit kuning fisiologis merupakan konsep membantu dari perspektif didaktis, menerapkannya pada sebuah neonatus dengan penyakit kuning yang sebenarnya lebih sulit.( Yamamoto A 2009)
Perhatikan metafora berikut: Pikirkan bilirubin serum total ikterus neonatal sebagai gunung tertutup oleh gletser. Jika pengukuran ketinggian gunung tersebut diambil ketika berdiri di puncak, jumlah batu dan jumlah es yang terdiri dari pengukuran ini tidak jelas. Hal yang sama berlaku bagi banyak bilirubin total nilai serum yang diperoleh dalam ikterus neonatal. Sebuah fondasi proses fisiologis dan proses patologis (misalnya, ketidakcocokan rhesus) dengan jelas dapat berkontribusi untuk pengukuran. Namun, berapa banyak dari total nilai terukur berasal dari masing-masing komponen tidak jelas. Juga, karena varian genetik dalam metabolisme bilirubin hanya sangat dikejar dalam diagnostik kerja-up bayi dengan penyakit kuning, mungkin kontribusi mereka terhadap bilirubin serum total yang diukur biasanya tidak diketahui.
Beberapa penelitian terkini menunjukkan bahwa infeksi saluran kencing (ISK) ditemukan pada 7,5% asimtomatik, afebris, pada bayi kuning usia kurang 8 minggu. Selain itu, bayi dengan timbulnya ikterus setelah 8 hari usia atau pasien dengan fraksi bilirubin terkonjugasi tinggi lebih mungkin untuk memiliki sebuah ISK. Oleh karena itu, disarankan pengujian untuk ISK dimasukkan sebagai bagian dari evaluasi dalam asimtomatik, bayi kuning yang datang ke gawat darurat.(Omar C,Hamza s bassem AM, Mariam R 2011)
c. Epidemiologi
Hiperbilirubinemia neonatal sangat umum karena hampir setiap bayi baru lahir mengalami tingkat serum bilirubin tak terkonjugasi lebih dari 30 umol / L (1,8 mg / dL) selama minggu pertama kehidupan. Angka kejadian sulit untuk membandingkan karena banyak peneliti berbeda yang tidak menggunakan definisi yang sama untuk
hiperbilirubinemia neonatal signifikan atau penyakit kuning. Selain itu, identifikasi bayi yang akan diuji tergantung pada pengakuan visual dari penyakit kuning oleh penyedia layanan kesehatan, yang sangat bervariasi dan tergantung baik pada perhatian pengamat dan pada karakteristik bayi seperti ras dan usia kehamilan. Penelitian epidemiologi memberikan suatu kerangka acuan untuk kejadian diperkirakan. Pada tahun 1986, Maisels dan Gifford dilaporkan 6,1% bayi dengan kadar bilirubin serum lebih dari 220 umol / L (12,9 mg / dL). Dalam sebuah studi tahun 2003 di Amerika Serikat, 4,3% dari 47.801 bayi memiliki total serum bilirubin. dalam rentang di mana fototerapi direkomendasikan oleh tahun 1994 American Academy of Pediatrics (AAP) pedoman, dan 2,9% memiliki nilai dalam rentang di mana tahun 1994 AAP pedoman menyarankan fototerapi mempertimbangkan.
Sebuah studi dari Turki melaporkan penyakit kuning yang signifikan dalam 10,5% bayi yang panjang dan dalam 25,3% dari jangka dekat bayi. Penyakit kuning yang signifikan didefinisikan menurut umur kehamilan dan pasca kelahiran dan mendatar pada 14 mg / dL (240 umol / L) pada 4 hari pada bayi prematur dan 17 mg / dL (290 umol / L) pada bayi panjang.
Studi ini tampaknya menunjukkan bahwa beberapa variabilitas etnis dalam kejadian dan tingkat keparahan penyakit kuning neonatal mungkin berhubungan dengan perbedaan dalam distribusi varian genetik dalam metabolisme bilirubin. (Riskin A, Tamir A,kuglelman A , 2009)
.
Kernikterus terjadi pada 1,5 dari 100.000 kelahiran di Amerika Serikat. Kematian dari neonatal jaundice fisiologis sebenarnya tidak harus terjadi. Kematian dari kernikterus dapat terjadi, terutama di negara-negara kurang berkembang sistem perawatan medis. Dalam sebuah penelitian kecil dari pedesaan Nigeria, 31% bayi dengan ikterus klinis diuji memiliki G-6-PD kekurangan, dan 36% bayi dengan G-6-PD kekurangan meninggal dengan kernikterus diduga dibandingkan dengan hanya 3% dari bayi dengan G-6-PD yang normal skrining hasil tes.
Kemungkinan dampak polimorfisme genetik pada variasi etnis dalam insiden dan keparahan harus diakui. Dengan demikian, dalam studi bayi Taiwan, Huang dkk melaporkan bahwa neonatus yang membawa 211 dan 388 varian dalam UGT1A1 dan OATP2 gen dan yang disusui beresiko sangat tinggi untuk hiperbilirubinemia parah. (Sun LL et all 2012)
Risiko pengembangan penyakit kuning neonatal signifikan lebih tinggi pada bayi laki-laki. Ini tidak muncul terkait dengan tingkat produksi bilirubin, yang mirip dengan yang ada di
bayi perempuan. Risiko penyakit kuning neonatal signifikan berbanding terbalik dengan usia kehamilan. (Sun G ,wu M, cao J,Du L, 2007)
d. Penyebab
Ikterus fisiologis disebabkan oleh kombinasi produksi bilirubin meningkat sekunder terhadap kerusakan percepatan eritrosit, penurunan kapasitas ekskretoris sekunder rendahnya tingkat ligandin dalam hepatosit, dan aktivitas rendah dari uridin enzim bilirubin konjugasi diphosphoglucuronyltransferase (UDPGT).
Ikterus neonatus patologis terjadi bila faktor tambahan menemani mekanisme dasar yang dijelaskan di atas. Contohnya termasuk anemia hemolitik imun atau nonimmune, polisitemia, dan adanya ekstravasasi memar atau darah.
Penurunan bilirubin mungkin memainkan peran dalam penyakit kuning menyusui, penyakit kuning ASI, dan dalam beberapa metabolik dan gangguan endokrin.
e. Faktor risiko meliputi:
1. Ras: Insiden lebih tinggi di Asia Timur dan Indian Amerika dan lebih rendah di Afrika Amerika.
2. Geografi: Insiden lebih tinggi pada penduduk yang tinggal di ketinggian. Yunani yang hidup di Yunani memiliki insiden yang lebih tinggi daripada mereka yang tinggal di luar Yunani.
3. Genetika dan keluarga: Insiden lebih tinggi pada bayi dengan saudara kandung yang menderita sakit kuning neonatal signifikan dan terutama pada bayi yang lebih tua saudara dirawat karena penyakit kuning neonatal. Insiden juga lebih tinggi pada bayi dengan mutasi / polimorfisme pada gen yang kode untuk enzim dan protein yang terlibat dalam metabolisme bilirubin, dan pada bayi dengan homozigot atau heterozigot glukosa-6-fosfatase dehidrogenase (G-6-PD) kekurangan dan anemia hemolitik herediter . Kombinasi varian genetik seperti tampaknya memperburuk penyakit kuning neonatal 4. Gizi: Insiden lebih tinggi pada bayi yang mendapat ASI atau yang menerima nutrisi yang
tidak memadai. Mekanisme untuk fenomena ini mungkin tidak sepenuhnya dipahami. Namun, ketika volume makan yang tidak memadai yang terlibat, peningkatan sirkulasi enterohepatik bilirubin mungkin memberikan kontribusi untuk penyakit kuning yang berkepanjangan. Data terbaru menunjukkan bahwa payudara sakit kuning susu berkorelasi dengan kadar faktor pertumbuhan epidermal, baik dalam ASI dan dalam serum bayi. Menunjukkan bahwa perbedaan antara ASI dan susu formula bayi mungkin kurang jelas dengan beberapa rumus yang modern . Namun, formula yang mengandung hidrolisat protein telah terbukti meningkatkan ekskresi bilirubin.
5. Faktor ibu: Bayi dari ibu dengan diabetes memiliki insiden yang lebih tinggi. Penggunaan beberapa obat dapat meningkatkan kejadian, sedangkan yang lain menurunkan kejadian.
6. Usia kehamilan dan berat lahir: Insiden lebih tinggi pada bayi prematur dan pada bayi dengan berat lahir rendah.(Maisels et al,2009)
i . Manifestasi Klinis
Kulit, mukosa dan konjungtiva kuning.
Biasanya, presentasi adalah pada hari kedua atau ketiga kehidupan.
Penyakit kuning yang terlihat selama 24 jam pertama kehidupan mungkin akan nonphysiologic; evaluasi lebih lanjut disarankan.
Bayi dengan penyakit kuning setelah 3-4 hari hidup juga mungkin memerlukan
pengawasan yang lebih ketat dan pemantauan.
Pada bayi dengan penyakit kuning yang parah atau penyakit kuning yang terus di luar 1-2 minggu pertama kehidupan, hasil dari layar metabolik baru lahir harus diperiksa untuk hipotiroidisme galaktosemia dan kongenital, riwayat keluarga harus dieksplorasi lebih lanjut, sejalan dengan berat badan bayi yang dievaluasi, tayangan ibu sejauh kecukupan ASI harus diperoleh, dan warna tinja harus dinilai.
Riwayat keluarga
Sebelumnya saudara kandung dengan penyakit kuning pada periode neonatal,
pengobatan terutama jika penyakit kuning diperlukan
Anggota keluarga dengan penyakit kuning atau sejarah keluarga yang dikenal sindrom Gilbert
Anemia, splenektomi, atau batu empedu pada anggota keluarga atau faktor keturunan dikenal untuk gangguan hemolitik
Penyakit hati
Riwayat kehamilan dan persalinan:
penyakit sugestif dari infeksi virus atau lainnya
asupan obat ibu
tertundanya pengikatan plasenta
Riwayat Postnatal
Kehilangan warna tinja
Gangguan imaturitas saluran cerna
Menyusui
Penurunan berat badan kurang rata-rata
Gejala atau tanda-tanda hipotiroidisme
Gejala atau tanda-tanda penyakit metabolik (misalnya, galaktosemia)
Paparan gizi orangtua (HutahaenB, 2007)
Pemeriksaan Fisik
Ikterus neonatal pertama akan terlihat dalam wajah dan dahi. Identifikasi dibantu oleh tekanan pada kulit, karena blansing mengungkapkan warna yang mendasarinya.
Penyakit kuning kemudian secara bertahap menjadi terlihat pada badan dan ekstremitas. Perkembangan kuning secara cephalocaudal harus dengan baik dijelaskan. Penyakit kuning menghilang ke arah yang berlawanan. Penjelasan untuk fenomena ini tidak dipahami dengan baik, namun kedua perubahan bilirubin-albumin mengikat berkaitan dengan pH dan perbedaan suhu kulit dan aliran darah telah diusulkan.
Fenomena ini secara klinis berguna karena, independen dari faktor lainnya, penyakit kuning terlihat di ekstremitas bawah sangat menunjukkan kebutuhan untuk memeriksa tingkat bilirubin, baik dalam serum atau noninvasively melalui bilirubinometry transkutan. Pada sebagian besar bayi, warna kuning ditemukan hanya pada pemeriksaan fisik. Penyakit kuning lebih intens mungkin berhubungan dengan kantuk. Batang otak pendengaran ang membangkitkan potensi dilakukan saat ini dapat mengungkapkan perpanjangan latency, penurunan amplitudo, atau keduanya.(Stevenson DK, Wong RJ,Vreman HJ, et all, 2004)
Temuan neurologis, seperti perubahan dalam otot, kejang, atau menangis karakteristik berubah, pada bayi secara signifikan kuning adalah tanda-tanda bahaya dan membutuhkan perhatian segera untuk mencegah kernikterus. Dengan adanya gejala atau tanda-tanda, fototerapi yang efektif harus dimulai segera tanpa menunggu hasil uji laboratorium (Hutahaen B 2007).
Kebutuhan potensial untuk transfusi tukar tidak harus menghalangi inisiasi langsung dari fototerapi.
Hepatosplenomegali, petechiae, mikrosefali mungkin berhubungan dengan anemia hemolitik, sepsis, dan infeksi bawaan dan harus memicu evaluasi diagnostik diarahkan diagnosa ini. Ikterus neonatal dapat diperburuk dalam situasi ini.
Diagnosis
Anamnesis : riwayat ikterus pada anak sebelumnya, riwayat keluarga anemi dan pembesaran hati dan limpa, riwayat penggunaan obat selama ibu hamil, riwayat infeksi maternal, riwayat trauma persalinan, asfiksia.
Pemeriksaan fisik :
1. Umum : keadaan umum (gangguan nafas, apnea, instabilitas suhu, dll)
2. Khusus : Dengan cara menekan kulit ringan dengan memakai jari tangan dan dilakukan pada pencahayaan yang memadai.
Berdasarkan Kramer dibagi :
Derajat ikterus Daerah ikterus
Perkiraan kadar bilirubin
I Kepala dan leher 5,0 mg%
II
Sampai badan atas (di atas
umbilikus) 9,0 mg%
III
Sampai badan bawah (di bawah umbilikus) hingga
tungkai atas (di atas lutut) 11,4 mg/dl
IV
Sampai lengan, tungkai
bawah lutut 12,4 mg/dl
V
Sampai telapak tangan dan
kaki 16,0 mg/dl
Pemeriksaan laboratorium
Pemeriksaan laboratorium: kadar bilirubin, golongan darah (ABO dan Rhesus) ibu dan anak, darah rutin, hapusan darah, Coomb tes, kadar enzim G6PD (pada riwayat keluarga dengan defisiensi enzim G6
Pengukuran Bilirubin termasuk yang berikut:
PD).
1. Bilirubinometry transkutan dapat dilakukan dengan menggunakan perangkat genggam yang menggabungkan algoritma optik canggih. Penggunaan perangkat tersebut telah terbukti mengurangi kebutuhan untuk pengambilan sampel darah pada bayi dengan ikterus. Namun, tidak dapat digunakan untuk memantau kemajuan fototerapi.
2. Bilirubinometry transkutan lebih baik dari penilaian visual. Yang terakhir ini bukanlah teknik yang dapat diandalkan untuk memperkirakan tingkat bilirubin, tetapi tidak adanya penyakit kuning sebagaimana dinilai oleh mata dalam kondisi pencahayaan yang baik memiliki keakuratan yang cukup tinggi sejauh yang memprediksi bayi mana yang berkembang menjadi nilai kadar serum bilirubin yang tinggi
3. Pada bayi dengan ikterus ringan, bilirubinometri transkutan mungkin diperlukan untuk memastikan bahwa tingkat bilirubin total dengan aman di bawah yang membutuhkan intervensi.
4. Pada bayi dengan ikterus moderat, bilirubinometry transkutan mungkin berguna dalam memilih pasien yang memerlukan proses mengeluarkan darah atau pengambilan sampel darah kapiler untuk pengukuran bilirubin serum.
5. Pada bayi dengan penyakit kuning yang ekstrim, bilirubinometry transkutan dapat menjadi alat yang berguna untuk jalur cepat seperti bayi terhadap terapi yang cepat dan agresif.
6. Biasanya, tes serum total kadar bilirubin adalah satu-satunya diperlukan pada bayi dengan penyakit kuning moderat yang menyajikan pada hari kedua atau ketiga khas hidup tanpa sejarah dan temuan fisik sugestif dari proses patologis. Pengukuran fraksi bilirubin (terkonjugasi vs tak terkonjugasi) dalam serum biasanya tidak diperlukan pada bayi yang hadir seperti dijelaskan di atas. Namun, pada bayi yang memiliki hepatosplenomegali, petekia, trombositopenia, atau temuan lainnya sugestif penyakit hepatobiliari, gangguan metabolisme, atau infeksi bawaan, pengukuran awal fraksi bilirubin disarankan. Hal yang sama berlaku untuk bayi yang tetap kuning di luar 7-10 hari pertama kehidupan, dan untuk bayi dengan total bilirubin serum pengobatan.(Slusher TM et all, 2009)
Pemeriksaan tambahan dapat diindikasikan dalam situasi berikut:
Bayi dengan penyakit kuning pada hari pertama atau setelah hari ketiga kehidupan
Bayi yang mengalami anemia saat kelahiran
Bayi sakit
Tingkat bilirubin serum yang meningkat cukup untuk memicu pengobatan
Kuning yang signifikan tetap ada setelah 2 minggu pertama kehidupan
Riwayat keluarga, ibu, kehamilan, menunjukkan kemungkinan proses patologis
Pemeriksaan fisik mengungkapkan temuan bukan faktor hiperbilirubinemia fisiologis sederhana
q . Selain jumlah kadar bilirubin serum, pemeriksaan lain yang dianjurkan bila curiga kuning non patologis:
Direct antiglobulin test (DAT) pada bayi (Coombs test)
Hemoglobin dan hematokrit
Tingkat albumin serum: menjadi tambahan yang berguna dalam mengevaluasi risiko tingkat toksisitas karena albumin mengikat bilirubin dalam perbandingan 1:1 di lokasi tinggi afinitas utama mengikat.
Nomogram for hour-specific bilirubin values: alat yang berguna untuk memprediksi, baik sebelum atau saat keluar rumah sakit, bayi yang berpotensi nilai bilirubin tinggi. Bayi diidentifikasi dengan cara ini memerlukan pemantauan ketat tindak lanjut dan diulang bilirubin pengukuran. Kemampuan prediksi telah terbukti baik untuk nilai bilirubin diukur dalam serum dan untuk nilai-nilai diukur transcutaneously. Nomogram ini juga telah terbukti bekerja dengan baik untuk DAT-positif bayi dengan ketidakcocokan AB0. Hasil DAT tes positif tidak menambahkan nilai apapun kepada manajemen klinis bayi ini di luar yang sudah diperoleh nilai bilirubin jam khusus diplot ke nomogram.
Pengukuran end-tidal carbon monoxide dalam napas: End-tidal carbon monoxide in breath (ETCO) dapat digunakan sebagai indeks produksi bilirubin. Pengukuran ETCO dapat membantu dalam mengidentifikasi individu dengan produksi bilirubin meningkat dan dengan demikian, pada peningkatan risiko mengembangkan tingkat tinggi bilirubin. Aparat telah dikembangkan untuk mengukur ETCO simple (CO-Stat End Tidal Breath Analyzer; Natus Medical Inc).
Darah tepi untuk morfologi eritrosit
Jumlah Retikulosit
Nilai Konjugasi bilirubin : Mengukur fraksi bilirubin dapat diindikasikan dalam keadaan dijelaskan di atas. Perhatikan bahwa pengukuran bilirubin langsung sering tidak akurat, tunduk pada variasi antar laboratorium dan intralaboratory signifikan, dan umumnya bukan alat sensitif untuk mendiagnosis kolestasis kecuali pengukuran ulang mengkonfirmasi adanya bilirubin terkonjugasi tinggi.
Tes fungsi hati: Aspartate aminotransferase (ASAT atau SGOT) dan alanin
aminotransferase (ALAT atau SGPT) tingkat yang meningkat pada penyakit hepatoselular. Fosfatase alkalin dan γ-glutamyltransferase (GGT) tingkat sering meningkat pada penyakit kolestasis. Sebuah rasio γ-GT/ALAT lebih dari 1 adalah sangat sugestif dari obstruksi bilier. Namun, tidak membedakan antara kolestasis intrahepatik dan ekstrahepatik.
Tes untuk mencari infeksi virus atau parasit: diindikasikan pada bayi dengan
hepatosplenomegali, petechiae, trombositopenia, atau bukti lain dari penyakit hepatoseluler.
Reducing substance urin: tes skrining yang berguna untuk galaktosemia, asalkan bayi
Pengukuran gas darah: Risiko toksisitas SSP bilirubin meningkat pada asidosis, asidosis terutama pernapasan.
Bilirubin-binding test: Meski merupakan alat penelitian yang menarik, tetapi tes ini belum digunakan secara luas dalam praktek klinis. Meskipun peningkatan kadar terikat (“gratis”) bilirubin berhubungan dengan peningkatan risiko ensefalopati bilirubin, bilirubin terikat hanyalah salah satu dari beberapa faktor yang menengahi / memodulasi toksisitas bilirubin.(Fransisco J, Gracia,Alan L nager, 2008)
Fungsi tiroid (T3, danT4, f T3 dan f T4)
r. Pemeriksaan Klinis :
Radiologis : foto polos abdomen
Ultrasonografi : Ultrasonografi dari saluran-saluran hati dan empedu diperlukan pada
bayi dengan laboratorium atau tanda-tanda klinis penyakit kolestasis.
Radionuklida scanning : Scan hati radionuklida untuk penyerapan asam
hepatoiminodiacetic (HIDA) diindikasikan jika atresia bilier ekstrahepatik diduga. Di institusi penulis, pasien pra-perawatan dengan fenobarbital 5 d mg / kg / hari selama 3-4 hari sebelum melakukan scan.
Tes histologis
Organ tubuh, termasuk otak, berwarna kuning dengan penyakit kuning yang signifikan, namun, warna kuning tidak selalu menunjukkan toksisitas SSP. Perbedaan ini tidak selalu dipahami dengan jelas dalam deskripsi “low-bilirubin kernicterus.”Saat ini, telah membuat kebingungan dan ketidakpastian mengenai pedoman terapi dan tingkat intervensi.
s. Diagnosis Banding
Biliary Atresia Breast Milk Jaundice
Cholestasis
Cytomegalovirus Infection
Dubin-Johnson Syndrome
Duodenal Atresia
Galactose-1-Phosphate Uridyltransferase Deficiency (Galactosemia)
Hemolytic Disease of Newborn
Hepatitis B
t. Komplikasi
Ensefalopati hiperbilirubinemia (bisa terjadi kejang, malas minum, letargi dan dapat berakibat pada gangguan pendengaran, palsi serebralis) karena adanya peningkatan kadar bilirubin indirek serum (BIS). Secara umum seorang bayi dianggap ’bermasalah’ bila kadar BIS ≥10 mg/dL, umumnya dapat ditemukan penyebab ikterus patologis pada bayi baru lahir. Bilirubin merupakan masalah pada bayi karena bersifat neurotoksik (toksisitas bilirubin), selanjutnya dapat berkembang menjadi ensefalopati bilirubin(Alfhors.CE, Parker AE 2008)
Kernicterus
Sebuah penelitian terhadap kasus-kasus kern-icterus klasik di Amerika Serikat dan beberapa negara lainnya, serta laporan-laporan terbaru tentang neuropati auditorik akibat hiperbilirubinemia tanpa tanda-tanda kern-icterus klasik yang lain, menggaris bawahi perlunya ‘model-model’ untuk memberikan pemahaman yang lebih baik tentang bagaimana ikterus terjadi pada 60% bayi baru lahir dan menyebabkan kerusakan otak permanen. Hal ini penting karena dengan pemahaman yang lebih baik kita akan dapat mencegah kerusakan tersebut.
Pada dasarnya ensefalopati bilirubin merupakan suatu diagnosis secara patologi anatomi, dimana ditemukan pengendapan bilirubin pada otak dan sering berakibat kerusakan neuron yang permanen. Bayi dengan keadaan ini mempunyai risiko mengalami kematian, atau jika dapat bertahan hidup akan mengalami GPN dikemudian hari BIS telah dibuktikan secara invitro dan invivo dalam konsentrasi yang tinggi secara difusi dapat melewati sawar darah otak (SDO 6,9,12 Vohr dalam penelitiannya mendapatkan bahwa bayi dengan kadar BTS puncak rata-
rata 14,3±2,8 mg/dL mempunyai hubungan yang signifikan dengan skor BNBAS (Brazelton Neonatal Behavioral Assesment Scale) yang rendah. Semakin tinggi kadar BTS, semakin rendah skor BNBAS.14 Wolf dalam penelitiannya melaporkan pada pemeriksaan Infant Motor Screening (IMS) bayi berusia 4 bulan dengan riwayat hiperbilirubinemia neonatal aterm, didapatkan hasil normal pada kadar BTS rata-rata 27,3±5,3 mg/dL, suspek pada kadar BTS rata-rata 28±4 mg/dL, dan abnormal pada kadar BTS rata-rata 33,7±10,3 mg/dL. Sedangkan pada penelitian berikutnya didapatkan 23% anak usia 1 tahun dengan riwayat hiperbilirubinemia neonatal, dengan kadar BTS rata-rata 33,4 mg/dL didapatkan skor BSID (Bayley’s Scales of Infant Development) abnormal. Sedangkan dengan kadar BTS rata-rata 26,5 mg/dL didapatkan skor BSID masih dalam batas normal. (Susanto 2008) dari 23 bayi
menyimpulkan mengalami yang hiperbilirubinemia neonatal mempunyai risiko mengalami gangguan perkembangan neurologis.
Kehilangan pendengaran bawaan menunjukkan bahwa gangguan pendengaran hadir saat lahir. Gangguan pendengaran dapat berupa disebabkan oleh faktor genetik dan mungkin turun-temurun dialam (baik sindromik atau nonsyndromic) atau karena faktor lain hadir baik dalam masa kehamilan atau pada saat kelahiran. Diperkirakan bahwa 80-90% anak dengan gangguan pendengaran permanen signifikan telah memiliki kerusakan sejak periode neonatal.
2.8. Penilaian dengan Emisi Otoakustik (OAE)
Dikenal 2 jenis pemeriksaan OAE, yaitu spontaneus dan evoked OAE. Spontaneus OAE dapat timbul tanpa adanya stimulus bunyi, namum tidak semua manusia memiliki spontaneus OAE sehingga manfaat klinisnya tidak diketahui. Evoked OAE adalah OAE yang terjadi paska pemberian stimulus, dibedakan menjadi ;
(1)
Transient Evoked OAE (TEOAE)
(2)
Distortion Product OAE (DPOAE).
Uji emisi otoacoustik mengukur integritas telinga bagian dalam. Probe ringan dimasukkan ke dalam saluran telinga dan menghasilkan pita lebar "klik". Energi akustik yang dihasilkan oleh getaran sel-sel rambut luar koklea di dalam menanggapi klik tersebut, terdeteksi oleh mikrofon kecil di dalam probe. Hasil yang ditampilkan hasil Pass atau Refer. Dalam beberapa kasus dapat memberikan persentase numerik, dalam praktekya, total waktu rata-rata untuk pengujian. (Suwento 2008). Pada waktu melakukan pengujian dan merekam hasil, mungkin memakan waktu antara 1-20 menit.
Pemeriksaan emisi otoakustik dilakukan dengan cara memasukkan sumbat telinga (probe) ke dalam liang telinga luar. Dalam probe tersebut terdapat mikrofon dan pengeras suara. Mikrofon berfungsi menangkap suara yang dihasilkan koklea setelah pemberian stimulus. Sumbat telinga dihubungkan dengan komputer untuk mencatat respon yang timbul dari koklea. Pemeriksaan sebaiknya dilakukan di ruangan yang sunyi atau kedap suara, untuk mengurangi bising lingkungan (Suwentoet all, 2007).
Pemeriksaan emisi otoakustik merupakan respon koklea yang dihasilkan oleh sel-sel rambut luar yang dipancarkan dalam bentuk energi akustik (Suwento,et all 2007).
2.8.1.Transient Evoked Otoacoustic Emissions
Transient Evoked Otoacoustic Emissions merupakan emisi suara yang dihasilkan oleh rangsangan bunyi dengan menggunakan durasi yang sangat pendek, biasanya bunyi click, tetapi dapat juga tone burst. Transient Evoked Otoacoustic Emissions merupakan emisi otoakustik yang pertama kali digunakan dalam klinik. Stimulus yang diberikan sekitar 60-80 dB SPL. Transient Evoked Otoacoustic Emissions menunjukkan kondisi beberapa bagian koklea dan sekaligus menilai status fungsi koklea pada tingkatan mendekati ambang stimulus.
2.8.2. Distortion Product Otoacoustic Emissions
Distortion Product Otoacoustic Emissions merupakan emisi sebagian respon dari dua rangsangan yang berbeda frekuensi. Stimulus terdiri dari dua bunyi murni pada dua frekuensi (f1, f2; f2>f1) dan dua level intensitas (L1, L2). Suatu rasio f1/f2 menghasilkan Distortion Product Otoacoustic Emissions terbesar pada 1,2 untuk frekuensi tinggi dan rendah pada 1,3 untuk frekuensi sedang. Untuk menghasilkan respon optimal, atur intensitasnya sehingga L1 menyamai atau melebihi L2. Penyesuaian 65/66 dB SPL L1-L2 adalah yang sering digunakan. Distortion Product Otoacoustic Emissions dapat memperoleh frekuensi yang spesifik dan dapat digunakan untuk merekam frekuensi yang lebih tinggi dari Transient Evoked Otoacoustic Emissions. Distortion Product Otoacoustic Emissions dapat digunakan untuk mendeteksi kerusakan koklea akibat obat-obat ototoksik dan akibat pajanan suara bising.
2.8.3. Anatomi dan Fisiologi Dasar Emisi Otoakustik
Ketika bunyi dihasilkan sebagai suatu emisi, bunyi tersebut ditransmisikan melalui telinga luar dimana rangsangan suara diubah dari suatu sinyal akustik menjadi sinyal mekanis pada membran timpani dan ditransmisikan melalui tulang pendengaran telinga tengah, kemudian kaki tulang stapes bergerak pada jendela oval menyebabkan gelombang bergerak di dalam koklea berisi cairan. Gelombang yang bergerak di koklea menggerakkan membran basilar, setiap bagian membran basilar sensitif hanya pada jangkauan tertentu saja.
Penyusunan ini berdasarkan gradien tonotopik, bagian yang terdekat ke jendela oval lebih sensitif terhadap stimulus frekuensi tinggi. Bagian yang lebih jauh lebih sensitif
terhadap stimulus frekuensi rendah. Oleh karena itu, respon pertama yang dikembalikan dan direkam oleh mikrofon adalah bagian koklea frekuensi tertinggi karena jarak tempuhnya lebih pendek. Respon dari bagian frekuensi lebih rendah yang dekat apeks koklea sampai setelahnya.
Ketika membran basilar bergerak, sel-sel rambut ikut bergerak dan sebuah respon elektromekanik dihasilkan ketika sebuah sinyal aferen ditransmisikan dan sebuah sinyal eferen dikeluarkan. Sinyal eferen ditransmisikan kembali melalui jalur pendengaran dan sinyal tersebut diukur di kanal telinga luar (Campbell K. C. M., 2010).
Transient Evoked Otoacoustic Emission (TEOAE)
Dikutip dari Buku Ajar THT-KL UI 2.8.4 Tujuan Pemeriksaan Emisi Otoakustik
Tujuan utama pemeriksaan emisi otoakustik adalah untuk menilai keadaan koklea terutama sel rambut. Hasil pemeriksaan dapat berguna untuk antara lain:
a. Skrining pendengaran awal khususnya pada neonatus infan atau individu dengan gangguan perkembangan
b. Memperkirakan sensitivitas pendengaran dalam rentang tertentu
c. Membedakan gangguan sensori dan neural; pada gangguan pendengaran sensorineural
d. Dapat memeriksa gangguan pendengaran fungsional (berpura-pura) dan juga dapat dilakukan pada pasien yang sedang tidur bahkan pada keadaan koma.
Beberapa syarat yang diperlukan untuk mendapatkan hasil emisi
otoakustik yang tepat adalah sebagai berikut :
a. Liang telinga luar tidak obstruksi
b. Menutup rapat-rapat liang telinga dengan probe c. Posisi yang optimal dari probe
d. Tidak ada penyakit telinga tengah e. Sel rambut luar masih berfungsi f. Pasien kooperatif
g. Lingkungan sekitar tenang
Emisi otoakustik pada bayi baru lahir
Dikutip dari The Hearing Solution Goup 2.8.6. Faktor-faktor yang mempengaruhi kerja OAE
2.8.6.1. Nonpatologi
a. Kesalahan dalam memasang probe
b. Serumen yang menghalangi probe
c. Debris atau benda asing dalam telinga
d. Vernix caseosa pada neonatus
2.8.6.2. Patologi
a. Telinga luar seperti:
- stenosis
- otitis eksterna
- kista
b. Membran timpani seperti : adanya perforasi
c. Telinga tengah seperti :
- Tekanan telinga tengah yang abnormal
- Otosklerosis
- Disartikulasi telinga tengah
- Kista
- Otitis media
d. Koklea
- Pemaparan obat-obat ototoksik atau pemaparan suara bising.
2.8.6.7. Hasil OAE
Hasil pemeriksaan dalam bentuk tabel yang diinterpresentasikan oleh beberapa frekuensi yang ditampilkan dalam hasil pass atau refer ( lihat tabel)
.
Dikutip dari Suwento 2007 UI
2.9. Penilaian BERA terhadap gangguan pendengaran
Bayi terlalu kecil bukan sebagai halangan untuk melakukan penilaian definitif gangguan pendengaran pada anak terhadap status fungsi telinga tengah dan sensitifitas koklea serta jalur suara. Kecurigaan terhadap adanya gangguan pendengaran pada anak harus dilakukan secara tepat. Jenis-jenis pemeriksaan pendengaran yang direkomendasikan oleh American of Pediatrics (AAP) adalah pemeriksaan yang disesuaikan dengan umur bayi, dan harus merasa nyaman terhadap situasi pemeriksaan, pemeriksaan harus dilakukan pada tempat yang cukup sunyi dengan gangguan visual dan audio yang minimal.
Pada pemeriksaan dengan BERA, secara fisiologik mekanisme jalur auditorius mulai dari saraf auditorius saai ke korteks auditorius sangat kompleks. Terdapat lima gelombang yang mencerminkan daerah yang diperiksa, antara lain:
1. Gelombang I timbul dari bagian distal nervus VIII.
2. Gelombang II dari bagian proksimal nervus VIII dengan kemungkinan
bagian distal nervus VIII masih ikut berperan.
3. Gelombang III dari kompleks olivari superior.
4. Gelombang IV berasal dari neuron ketiga di nukleus olivarius superior
kompleks, nukleus koklearis dan lemniskus lateralis.
Brainstem auditory-evoked potentials harus dilakukan evaluasi setelah terjadi
ikterus neonatus berat untuk menyingkirkan gangguan pendengaran sensorineural.
Pada ikterus fisiologis, Potensial pada BERA normal dengan resolusi
hiperbilirubinemia. Namun, pada pasien dengan ikterus neonatal yang signifikan
atau kernikterus, the auditory-evoked potential dan fungsi pendengaran mungkin
abnormal.
Salah satu bentuk neurotoksisitas bilirubin adalah abnormalitas sistem auditori pada hiperbilirubinemia. Berdasarkan bukti tes audiometrik didapatkan gangguan pendengaran dominan bilateral pada frekwensi tinggi dan simetris dengan fungsi perkembangan suara yang abnormal. Hal tersebut berhubungan dengan lesi patologis pada nukleus koklear. Bilirubin yang terdapat pada otak dapat merusak nuclei audiotori sentral dan jalur vestibular, nuclei serebellar dan ganglia basalis yang dihubungkan dengan hipereaktivitas vestibuler. Menurut Shapiro (2001), terdapat manifestasi auditori sentral yang patologis, melibatkan struktur auditori batang otak termasuk nuclei lemniskus lateralis, kolikuli inferior tanpa keterlibatan thalamus maupun cortical auditory pathways.
Bila ditemukan keadaan tuli konduktif, kurva serial latensi / intensitas
mempunyai kemiringan yang sama seperti orang normal tetapi mengalami
pergeseran keintensitas pendengaran yang lebih tinggi, maka akan ditemukan
semua gelombang (I-V) akan bergeser kekanan (memanjang), sedangkan interwave
latency interval (IWI) dalam batas normal. Lesi tipe sensorineural mempunyai latensi
puncak yang sebanding dengan orang normal pada intensitas stimulasi tinggi, tetapi
pada intensitas yang lebih rendah, latensi tersebut memanjang secara signifikan.
Untuk membentuk interpretasi BERA dalam membedakan gangguan konduktif dan
lesi retokoklear diperlukan tes audiometrik khusus yang cermat dan teliti seperti OAE
dan timpanometri. Saraf a
uditori dan visually evoked potentials yang terpengaruh
selama penyakit kuning yang sedang berlangsung, namun ada kriteria telah
ditetapkan yang memungkinkan ekstrapolasi dari temuan potensial ditimbulkan dari
resiko kernikterus. Data menunjukkan bahwa kemungkinan mengenai respon batang
otak pendengaran otomatis (AABR) dengan konsentrasi bilirubin terikat. Karena
terikat bilirubin konsentrasi dapat lebih erat berkorelasi dengan bilirubin
neurotoksisitas, mungkin menunjukkan peningkatan risiko neurotoksisitas bilirubin.
Hasil AABR yang diperoleh tak lama setelah bayi didiagnosis kuning untuk
perawatan segera dan agresif. (Harvey Coates, Kim Gifkins ,2004)
KERANGKA TEORI & KERANGKA KONSEP 2.10. Kerangka Teori
Masalah
Perinatal
Hiperbilirubinemia Hipoksia (tekanan parsial oksigen) Prematuritas Penimbunan bilirubin pada jaringan otakKERUSAKAN SEL NEURON
(J l h l k) Pola kerusakan: - Nukleus koklear - Olivari superior - Lemniskus lateralis - Kolikuli inferior Status infeksi: - Cytomegalovirus - Rubela - Toksoplasma - Herpes simpleks
Obat ototoksik (dosis dan lama pemberian) - Gentamisin - Furosemid Trauma (d j t Faktor genetik - Abnormalitas kromoson X - Abnormalitas mitokondrial Malformasi t li Infeksi telinga luar dan tengah TULI
KONDUKTIF TULI SENSORINEURAL GANGGUAN
2.11. Kerangka Kerja HIPERBILIRUBINEMIA GANGGUAN PENDENGARAN Umur Jenis Kelamin Berat badan lahir Kadar biliribin direk dan total
selama perawatan