Regenerasi Beberapa Kultivar Kentang dan Transformasi
Kentang dengan Gen RB melalui
Agrobacterium tumefaciens
Listanto, E.1, G. A. Wattimena2, N. M. Armini2, M. S. Sinaga3, E. Sofiari4, dan M. Herman1 1 Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian,
Jl. Tentara Pelajar 3A, Bogor 16111
2 Departemen Agronomi dan Hortikultura, Fakultas Pertanian Institut Pertanian Bogor, Kampus Darmaga, Bogor
3 Departemen Proteksi Tanaman, Fakultas Pertanian Institut Pertanian Bogor, Kampus Darmaga, Bogor 4 Balai Penelitian Tanaman Sayuran Jl. Tangkuban Parahu 517, Lembang, Bandung 40391 Naskah diterima tanggal 25 Juli 2008 dan disetujui untuk diterbitkan tanggal 23 Februari 2009 ABSTRAK. Penyakit hawar daun yang disebabkan oleh cendawan Phytophthora infestans (Mont.) de Bary merupakan salah satu penyakit yang merusak tanaman dan memengaruhi hasil umbi kentang. Salah satu usaha untuk mengendalikan penyakit ini, yaitu dengan menggunakan kultivar tahan yang dapat dirakit melalui rekayasa genetik. Penelitian ini terdiri atas 3 kegiatan, yaitu studi regenerasi, transformasi gen RB ke dalam Agrobacterium
tumefaciens, dan transformasi kentang dengan gen RB. Penelitian dilakukan untuk mengetahui regenerasi beberapa
kultivar kentang, keberhasilan transfer gen RB ke dalam A. tumefaciens, dan melakukan transformasi kentang dengan gen RB melalui A. tumefaciens. Hasil penelitian menunjukkan bahwa kultivar Merbabu dan Atlantik memiliki kemampuan regenerasi yang tinggi dan menghasilkan tunas sebanyak 30,6 dan 22,8. Dari semua kultivar yang diuji, Granola paling sensitif terhadap kanamisin pada konsentrasi 50 mg/l dan dipilih sebagai bahan transformasi. Plasmid pCLD04541 berhasil ditransfer ke dalam A. tumefaciens. Koloni A. tumefaciens yang tumbuh pada media LB yang diberi antibiotik tetrasiklin dan rifampisin menunjukkan keberadaan plasmid pCLD04541 yang mengandung gen
RB. Hasil transformasi terhadap 5.347 eksplan ruas batang Granola diperoleh 50 transforman yang positif terdeteksi
oleh polymerase chain reaction (PCR) mengandung gen RB. Keberadaan gen RB ditunjukkan dari hasil amplifikasi ujung-N dengan ukuran fragmen sebesar 619 bp dan ujung-C dengan ukuran fragmen sebesar 840 bp.
Katakunci: Solanum tuberosum; Kultivar; Sistem regenerasi; Transformasi; A. tumefaciens.
ABSTRACT. Listanto, E., G. A. Wattimena, N. M. Armini, M. S. Sinaga, E. Sofiari, and M. Herman. 2009. Regeneration on Some Potato Cultivars and Potato Transformation with RB Gene Through Agrobacterium tumefaciens. Late Blight on Potato, Incited by Phytophthora infestans (Mont.) de Bary is a devastating disease affecting tuber yield. One of the efforts to control this disease is by using resistance cultivar that can be bred through genetic engineering. This experiment consisted of 3 activities those were to study the regeneration of several potato cultivars and to transform RB gene into A. tumefaciens and to do Agrobacterium-mediated transformation on potato using RB gene. The results showed that Merbabu and Atlantic cultivars had the highest regeneration capacity which produced 30.6 and 22.8 shoots. Granola has the most sensitive variety to kanamycine on 50 mg/l concentration, therefore this cultivar had been chosen for transformation material. Colonies of A. tumefaciens that grew on LB media containing tetracycline and rifampicine antibiotics indicated bearing pCLD04541 plasmid carrying RB gene. The results of transformation on 5,347 internode explants of Granola produced 50 transformants that were positively detected by PCR for RB gene. Polymerase chain reaction product of RB gene were detected by the occurrence of 2 amplification products, 619 bp for N-term and 840 bp for C-term.
Keywords: Solanum tuberosum; Cultivar; Regeneration system; Transformation; A. tumefaciens.
Kentang (Solanum tuberosum L.) merupakan salah satu jenis tanaman hortikultura yang termasuk sayuran umbi utama di Indonesia. Selain sebagai bahan pangan yang mengandung nutrisi tinggi dengan beberapa vitamin penting, mineral dan asam amino, kentang juga memiliki kontribusi penting sebagai sumber karbohidrat. Berdasarkan kandungan nutrisi yang tinggi dan kemudahan diproduksi, kentang dapat
dikembangkan menjadi tanaman pangan penting melalui pemuliaan konvensional maupun bioteknologi. Elizabeth et al. (2008) telah berhasil memperbaiki kandungan nutrisi umbi kentang terutama vitamin E yang berfungsi bagi kesehatan manusia melalui bioteknologi.
Produksi kentang di Indonesia berfluktuasi dari waktu ke waktu. Departemen Pertanian (2007) melaporkan bahwa pada tahun 2006
beberapa sentra produksi kentang menunjukkan perubahan luas panen dibandingkan tahun-tahun sebelumnya. Secara nasional, luas panen mengalami penurunan sekitar 2,94%. Kendala lain yang dapat menyebabkan terjadinya fluktuasi produksi, antara lain tidak tersedianya bibit varietas unggul, mutu bibit yang rendah, serangan hama dan penyakit, serta teknik budidaya maupun penanganan pascapanen yang kurang tepat.
Salah satu penyakit yang dapat menyebabkan penurunan produksi adalah penyakit hawar daun yang disebabkan oleh Phytophthora infestans (Mont.) de Bary. Di Indonesia, penyakit ini termasuk penyakit penting pada kentang dengan kerugian di lapangan yang ditimbulkan berkisar antara 10-100% bergantung pada tingkat infestasi, musim, ketinggian, dan varietas kentang bahkan pernah menyebabkan kehilangan hasil sampai 100% (Sinaga et al. 1997, Purwanti 2002).
Beberapa usaha pengendalian P. infestans telah dilakukan, di antaranya melalui aplikasi fungisida dan menggunakan tanaman tahan. Penerapan fungisida untuk mengatasi penyakit hawar daun merupakan salah satu cara pengendalian yang efektif, tetapi tidak dapat bertahan lama karena ras
P. infestans mudah berubah menjadi ras lain yang
tahan terhadap aplikasi fungisida yang sama. Di samping itu, fungisida merupakan agen pencemar lingkungan yang berpengaruh buruk terhadap kesehatan manusia dan ternak. Salah satu cara untuk mengurangi pengaruh negatif penggunaan fungisida yaitu dengan menanam kultivar yang tahan terhadap hawar daun.
Penggunaan kultivar tahan telah banyak diusahakan oleh pemulia kentang dengan melakukan introgresi gen resistensi ( R ) dominan dari spesies liar. Solanum bulbocastanum merupakan spesies liar diploid (2n=2x=24) yang menunjukkan ketahanan yang tinggi terhadap semua ras P. infestans (Helgeson et
al. 1998). Ketahanan tersebut tetap tinggi
meskipun ada tekanan penyakit secara intensif tetapi tanpa fungisida, sehingga ketahanannya dikategorikan sebagai ketahanan tidak spesifik ras atau ketahanan horisontal. Ketahanan yang memiliki spektrum luas terhadap ras P. infestans tersebut dikendalikan oleh gen mayor yaitu gen
RB. Song et al. (2003), telah berhasil mengklon
gen RB ke dalam suatu plasmid biner pCLD04541 dan mengintroduksikan ke dalam genom kultivar Katahdin yang terbukti tahan terhadap semua ras P. infestans yang ada di Amerika Serikat. Ketahanan terhadap penyakit ini juga telah dilakukan oleh beberapa ahli lain menggunakan gen Rpi-blb1 pada kromosom 8 dan Rpi-blb2 pada kromosom 6 (van der Vossen et al. 2003), serta
Rpi-blb3 pada kromosom 4 (Park et al. 2005).
Keberhasilan ini mendorong untuk memanfaatkan gen RB guna merakit kultivar yang banyak ditanam di Indonesia yang memiliki ketahanan cukup luas terhadap berbagai isolat P. infestans. Penyisipan gen RB ke dalam genom tanaman kentang dapat dilakukan melalui teknik transformasi. Hutchinson et al. (2000) mengemukakan ada tahapan penting dalam transformasi yaitu (1) sistem regenerasi yang sesuai untuk transformasi, (2) sistem transfer DNA asing yang sesuai, (3) gen yang diinginkan telah dikarakterisasi dan merupakan pengendali suatu sifat penting, dan (4) metode pengujian tanaman transgenik di laboratorium, rumah kaca, atau lapangan. Transformasi melalui bantuan A.
tumefaciens merupakan salah satu teknik yang
banyak dilakukan pada tanaman. Agrobacterium
tumefaciens sering memiliki plasmid biner yang
dilengkapi dengan DNA transfer (T-DNA). Bila suatu fragmen DNA (gen tertentu) disisipkan ke dalam T-DNA akan dapat ditransfer ke dalam genom tanaman secara efisien dan akan dipertahankan kestabilannya (Gelvin 2003). Kelebihan lain penggunaan teknik ini ialah akan menghasilkan 1 atau beberapa kopi dari gen yang ditransfer, sedikit terjadi kerusakan gen yang tertransfer selama integrasi pada genom, serta tanaman transgenik yang dihasilkan akan memiliki sifat agronomi normal dan fertil (Koroch et al. 2002, Gelvin 2003).
Tujuan penelitian adalah untuk mempelajari daya regenerasi beberapa kultivar kentang dan mendapatkan tanaman kentang yang mengandung gen RB untuk ketahanan terhadap P. infestans. Tanaman kentang yang dihasilkan nantinya dapat digunakan untuk pengendalian serangan
P. infestans dan dapat mengurangi penggunaan
BAHAN DAN METODE
Penelitian dilakukan di Laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik (BB-Biogen) Pertanian, Bogor pada bulan Juni sampai dengan Desember 2006. Regenerasi Tanaman Kentang
Percobaan regenerasi menggunakan prosedur yang diadopsi dari University of Wisconsin, Madison, USA. Metode regenerasi meliputi tahap perbanyakan, regenerasi, dan respons tanaman terhadap antibiotik. Percobaan ini tidak menggunakan rancangan percobaan dan parameter yang diamati dengan menghitung nilai rerata jumlah tunas yang terbentuk. Materi tanaman yang digunakan adalah eksplan ruas batang yang berasal dari tanaman kentang kultivar Granola, Atlantik, Amudra, Merbabu, dan Manohara dalam kultur in vitro. Setiap cawan petri ditanami dengan 10 potong eksplan ruas batang (panjang 0,5 cm), masing-masing kultivar dengan 5 ulangan. Eksplan ruas batang ditanam pada media ZIG (MS basal salts + sukrosa 20 g/l + vitamin N&N + zeatin-ribosid + IAA + GA3 + phitagel, pH 5,7), vitamin N&N tersusun dari biotin, folic acid, mio-inositol, glisin, nicotinic
acid, piridoksin HCl, dan tiamin HCl. Kultur ruas
batang diinkubasi media ZIG selama 2 minggu dan diganti pada media yang baru setiap 2 minggu sekali. Pengamatan dilakukan terhadap rerata jumlah tunas yang terbentuk.
Percobaan respons tanaman terhadap antibiotik dilakukan berdasarkan metode tersebut melalui penambahan antibiotik kanamisin pada konsentrasi 0, 25, 50, 75, 100, dan 125 mg/l. Eksplan yang dievaluasi adalah eksplan dari kultivar Katahdin, Atlantik, Granola, dan Merbabu. Pengamatan dilakukan terhadap jumlah eksplan yang tetap tumbuh pada media dengan konsentrasi kanamisin yang semakin meningkat.
Transformasi Gen RB ke dalam
A. tumefaciens
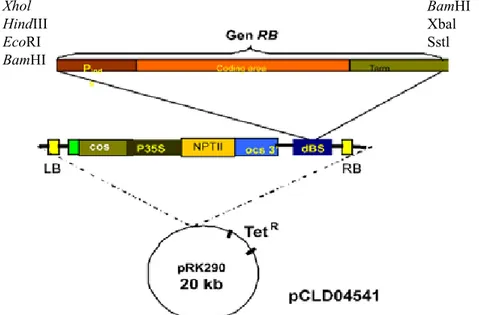
DNA plasmid pCLD04541 yang telah disisipi gen RB diperoleh dari Universitas Wisconsin, Amerika Serikat (Gambar 1). Transformasi
A. tumefaciens dengan plasmid pCLD04541
dilakukan dengan metode triparental mating. Tahapan triparental mating adalah sebagai berikut: bakteri E. coli yang membawa plasmid pCLD04541 ditumbuhkan pada media LB yang mengandung tetrasiklin 50 mg/l, sedangkan E.
coli yang membawa plasmid pRK2013 (berasal
Gambar 1. Peta modifikasi plasmid biner pCLD04541 (Modified map of pCLD04541 binary
plasmid). Gen RB (8,6 kb) disisipkan pada sisi BamHI {RB gene (8.6 kb) inserted into BamHI site}. Sumber: Anonimous (2006)
Xhol HindIII EcoRI BamHI BamHI Xbal Sstl
dari Dr. Dwi Setyo Utomo, Universitas Lampung) ditumbuhkan pada media LB yang mengandung kanamisin 50 mg/l. Kedua biakan diinkubasi pada suhu 37oC selama 1 malam. Bakteri A.
tumefaciens strain LBA4404 ditumbuhkan pada
media LB dengan suhu 28o C selama 2 hari. Koloni yang terbentuk dari setiap sel tunggal diambil dan dicampur, kemudian ditumbuhkan pada media YEP tanpa antibiotik dengan membentuk lingkaran 1 cm serta diinkubasikan pada suhu 28o C selama 24-48 jam. Campuran ketiga bakteri ditumbuhkan lagi pada media YEP yang mengandung tetrasiklin 50 mg/l dan rifampisin 10 mg/l. Koloni yang diharapkan tumbuh adalah koloni A. tumefaciens strain LBA4404 yang membawa pCLD04541. Koloni tunggal A. tumefaciens yang tumbuh tersebut diulang lagi pada media yang sama dan pada kondisi yang sama. Untuk konfirmasi bahwa gen
RB telah masuk di dalam A. tumefaciens, DNA
dari plasmid pCLD04541 diisolasi dan dipotong dengan enzim restriksi BamHI serta dilakukan analisis PCR untuk ujung N dan ujung C dari gen RB.
Transformasi Kentang dengan Gen RB Persiapan eksplan. Eksplan ruas batang dipotong dengan panjang sekitar 0,5 cm dari tanaman kentang in vitro yang ditumbuhkan pada media PROP (MS basal salts + sukrosa + mio-inositol + vitamin PROP dengan pH 5,8. Vitamin PROP tersusun dari glisin, nicotinic acid, piridoksin HCl, dan tiamin HCl). Eksplan diusahakan bebas dari daerah buku. Jumlah eksplan ruas batang yang digunakan pada percobaan sebanyak 5.347 eksplan untuk transformasi dan 102 eksplan untuk kontrol negatif.
Kultur A. tumefaciens. Metode transformasi diadopsi dari University of Wisconsin, Madison, USA. Satu koloni tunggal dari A. tumefaciens yang mengandung plasmid pCLD04541 digoreskan pada media YEP agar (Bacto peptone 10 g/l,
yeast extract 10 g/l, dan NaCl 5 g/l, pH 7,0) yang
mengandung tetrasiklin dengan konsentrasi 50 mg/l dan rifampisin 10 mg/l, lalu diinkubasi pada suhu 28oC selama 48 jam. Satu koloni tunggal digunakan untuk inokulasi pada 50 ml YEP cair yang mengandung tetrasiklin 50 mg/l dan asetosiringon 200 mM lalu digoyang pada suhu 28oC sampai diperoleh OD antara 0,6 dan 0,8.
Transformasi. Sebelum transformasi, eksplan ditempatkan pada kertas saring steril yang dibasahi dengan media MS0 cair (MS basal
salts + sukrosa + vitamin MS dengan pH 5,7,
vitamin MS tersusun dari glisin, mio-inositol,
nicotinic acid, piridoksin HCl, dan tiamin HCl)
dan dibiarkan pada suhu 24oC selama 72 jam. Tahap inokulasi, 300 eksplan direndam pada suspensi Agrobacterium selama 30 menit. Eksplan kemudian dipindah dan ditempatkan di antara kertas saring untuk mengurangi kelebihan bakteri. Eksplan kemudian ditanam pada media ko-kultivasi (media ZIG + asetosiringon 200 mM, pH 5,7) dan setiap cawan petri ditempatkan 20 eksplan. Jumlah cawan yang digunakan sebanyak 26.735 buah. Tahap ko-kultivasi, cawan berisi eksplan ditempatkan di ruang gelap dengan suhu 18-20oC selama 3 hari. Sebagai kontrol digunakan eksplan sama yang tidak diinokulasi dengan
Agrobacterium.
Seleksi dan regenerasi planlet. Setelah 3 hari eksplan dipindahkan pada media seleksi (media ZIG yang mengandung kanamisin 50 mg/l dan karbenisilin 100 mg/l) dan diinkubasi pada suhu 20-22o C dengan fotoperiode selama 16/8 jam. Kanamisin digunakan untuk menekan pertumbuhan sel atau jaringan tanaman yang tidak tertransformasi, sedangkan karbenisilin digunakan untuk membunuh Agrobacterium. Setelah 2 minggu, eksplan dipindahkan pada media seleksi baru. Pemindahan eksplan hanya dilakukan terhadap eksplan yang tumbuh pada media seleksi. Tahap ini diulang setiap 2 minggu dengan media seleksi baru sampai terbentuk tunas. Eksplan yang tumbuh pada media seleksi tersebut dianggap sebagai transforman. Tunas yang terbentuk dipindah ke media perakaran, yaitu media MS0 (tanpa zat pengatur tumbuh) yang mengandung kanamisin 50 mg/l dan karbenisilin 100 mg/l. Planlet yang terbentuk dibiarkan tumbuh dan sebagian daunnya digunakan untuk analisis molekuler dengan teknik PCR. Parameter yang diamati adalah jumlah tunas yang muncul dan tahan pada media seleksi.
Isolasi DNA dan analisis PCR. DNA genom transforman diisolasi berdasarkan metode Fulton et al. (1995). Analisis PCR digunakan untuk mendeteksi keberadaan gen RB secara awal menggunakan primer spesifik ujung-N dan ujung-C. Primer yang digunakan untuk ujung-N
adalah P1(1-5) 5’CTCATTTTACCCCTACAA3’ dan P2(3-5) 5’GCGTTTTGGACCCTTTTA3’ dengan menghasilkan fragmen DNA sebesar 619 bp, sedangkan primer untuk ujung-C adalah cr1 5’GCCAGTCTTCTCCTATTC3’ dan cf1 5’TAAGCATGAGTTGGAATA3’ dengan menghasilkan fragmen DNA sebesar 840 bp. Reaksi PCR dilakukan dengan total volume reaksi 25 μl yang terdiri 1x buffer PCR, 1,5 mM MgCl2, dNTPs (masing-masing dNTP 0,2 mM), primer 1 dan 2 masing-masing 2 pmol, Taq DNA polimerase (invitrogen) 0,8 unit dengan DNA sebanyak 50 ng. Reaksi amplifikasi dilakukan pada mesin PCR MJ research PCT-100. Kondisi amplifikasi diawali dengan denaturasi pada suhu 94o C selama 5 menit dilanjutkan dengan 30 siklus yang terdiri atas tahap denaturasi pada suhu 94oC selama 1 menit, tahap annealing pada suhu 53oC selama 1 menit, dan tahap perpanjangan pada suhu 72oC selama 1 menit, serta diakhiri dengan 1 tahap perpanjangan pada suhu 72oC selama 5 menit. Sebanyak 15 μl dari hasil amplifikasi digunakan untuk elektroforesis pada gel agarose dengan konsentrasi 1,2%. Hasil elektroforesis diamati dan diambil gambarnya dengan chemidoc.
HASIL DAN PEMBAHASAN Regenerasi Tanaman Kentang
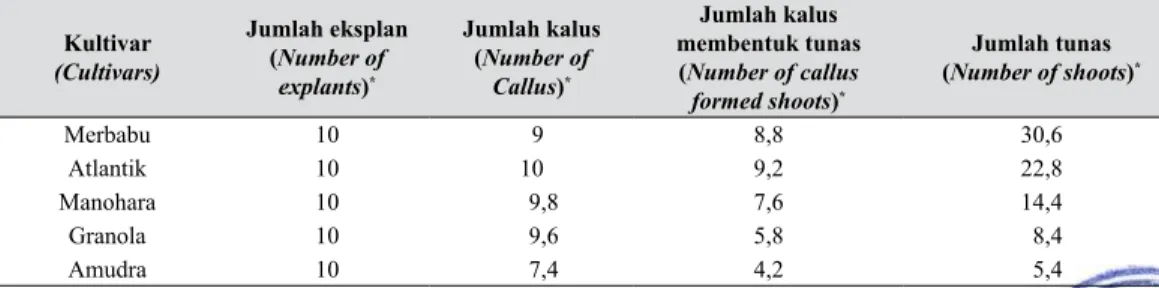
Hasil studi regenerasi menunjukkan bahwa kultivar Merbabu dan Atlantik memiliki kemampuan beregenerasi cukup tinggi dibandingkan dengan kultivar lain (Tabel 1), sedangkan kultivar Manohara menduduki urutan ketiga disusul oleh Granola dan Amudra.
Keberhasilan regenerasi tanaman tidak lepas dari peran beberapa faktor yang terlibat di dalamnya. Yasmin et al. (2003) melaporkan bahwa penggunaan auksin dan sitokinin pada kentang melalui induksi kalus yang berasal dari eksplan daun dan ruas batang mampu menghasilkan tunas. Beaujean et al. (1998) melaporkan bahwa penggunaan ruas batang lebih mempercepat pembentukan tunas dan hal ini dipengaruhi oleh penambahan zeatin-ribosid pada media regenerasi. Penggunaan eksplan ruas batang juga berhasil digunakan untuk membentuk tanaman kentang transgenik tahan penyakit hawar daun pada kultivar Katahdin menggunakan zat pengatur tumbuh zeatin-ribosid (Song et al. 2003), sedangkan peneliti lain melaporkan bahwa penggunaan BAP (Benzen amino purin) cukup efektif dalam membentuk tunas, tetapi berbeda untuk setiap kultivar yang digunakan (Anjum dan Ali 2004, Kuhl et al. 2007).
Pengamatan inisiasi tunas dilakukan setelah 1 minggu pada media regenerasi. Hasil pengamatan menunjukkan bahwa rerata tunas muncul setelah umur 2 minggu pada media regenerasi. Pada kultivar Amudra tidak semua eksplan yang ditanam menghasilkan tunas, tetapi eksplan berkembang menjadi kalus. Bakal tunas pada kultivar Merbabu dan Atlantik mulai tampak sebelum berumur 2 minggu. Kultivar Granola memiliki daya regenerasi lebih rendah dibandingkan dengan Manohara, tetapi jauh berbeda dibandingkan dengan daya regenerasi kultivar Merbabu dan Atlantik. Hasil pengamatan menunjukkan bahwa pada media yang sama perkembangan tunas yang terbentuk berbeda-beda bergantung pada kultivar yang digunakan. Tabel 1. Hasil studi regenerasi kentang pada beberapa kultivar kentang (The results of
re-generation study on several potato cultivars)
Kultivar (Cultivars) Jumlah eksplan (Number of explants)* Jumlah kalus (Number of Callus)* Jumlah kalus membentuk tunas (Number of callus formed shoots)* Jumlah tunas (Number of shoots)* Merbabu 10 9 8,8 30,6 Atlantik 10 10 9,2 22,8 Manohara 10 9,8 7,6 14,4 Granola 10 9,6 5,8 8,4 Amudra 10 7,4 4,2 5,4
* Rerata dari 5 ulangan (Average of 5 replication)
Media regenerasi (regeneration media): MS Basal Salt (4,33 g); sukrose (30 g); N & N vitamin (1 ml); Zeatin-riboside (4,78 mg); GA3 (0,2 mg); IAA (0,01 mg); phitagel (3 g)
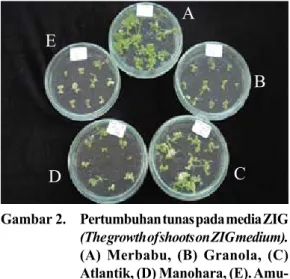
Hal ini sangat dipengaruhi oleh perbedaan genotip kentang dan respons genotip terhadap media yang digunakan (Gambar 2). Dugaan ini didukung oleh kesimpulan dari Missiou et al. (2004) bahwa penggunaan kombinasi zat pengatur tumbuh yang berbeda berkaitan secara signifikan dengan genotip dan media yang digunakan.
Kemampuan regenerasi suatu kultivar dalam proses transformasi sangat menentukan keberhasilan dalam mendapatkan transforman. Berdasarkan hasil tersebut diketahui bahwa hampir semua kultivar dapat digunakan untuk transformasi genetik pada tanaman kentang. Namun demikian, berdasarkan pertimbangan bahwa kultivar Granola sangat disukai oleh petani
dan pasar, maka kultivar tersebut dipilih untuk digunakan dalam penelitian untuk penelitian transformasi.
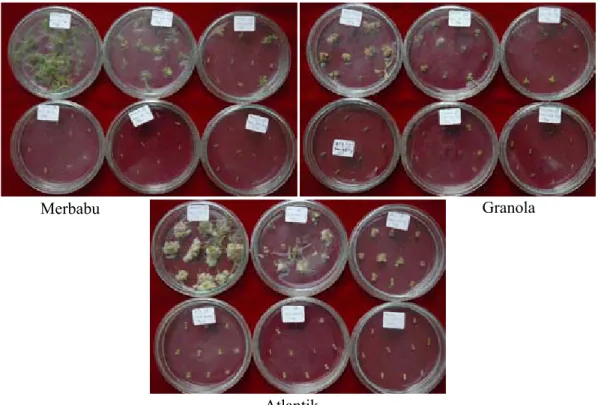
Penelitian respons tanaman terhadap antibiotik dilakukan menggunakan agen seleksi kanamisin pada berbagai tingkat konsentrasi, yaitu 0, 25, 50, 75, 100, dan 125 mg/l. Penggunaan kanamisin didasarkan atas pertimbangan bahwa penelitian transformasi kentang menggunakan plasmid biner pCLD04541 yang di dalam T-DNAnya terdapat gen seleksi nptII, yaitu gen untuk ketahanan terhadap kanamisin. Hasil pengamatan pada 4 kultivar yang digunakan menunjukkan bahwa rerata semua kultivar mati pada konsentrasi kanamisin 75 mg/l, sedangkan Granola pada media yang mengandung kanamisin 50 mg/l sudah mengalami kematian (Tabel 2). Sebagian eksplan kultivar Atlantik dan Granola membentuk tunas pada konsentrasi kanamisin di bawah 75 mg/l (Gambar 3).
Berdasarkan hasil studi respons tanaman terhadap kanamisin, maka pada penelitian selanjutnya digunakan kanamisin dengan konsentrasi 50 mg/l.
Transfer Gen RB ke dalam A. tumefaciens Transformasi plasmid pCLD04541 ke dalam
A. tumefaciens strain LBA4404 dilakukan melalui
metode triparental mating. Penggunaan metode ini dipilih karena metode lainnya, yaitu metode elektroforasi dan freeze-thaw tidak berhasil. Hal ini diduga karena ukuran plasmid yang digunakan (pCLD04541) terlalu besar, yaitu sekitar Gambar 2. Pertumbuhan tunas pada media ZIG
(The growth of shoots on ZIG medium).
(A) Merbabu, (B) Granola, (C) Atlantik, (D) Manohara, (E). Amu-dra
A
B
C
D
E
Tabel 2. Hasil studi respons tanaman terhadap kanamisin pada berbagai konsentrasi (The
results of plant response to kanamycin in different concentration)
Kultivar (Cultivar)
Ulangan
(Replica-tion)
Jumlah eksplan tumbuh pada media mengandung kanamisin pada konsentrasi (mg/l)
(Sum of explant growth on media containing kanamycin in concentration of)
0 25 50 75 100 125 Katahdin 1 10 5 7 0 2 3 2 10 7 7 2 2 1 Atlantik 1 10** 10** 7 0 1 0 2 10** 10** 8 6 0 0 Granola 1 8** 8** 4 3 0 2 2 7** 9** 2 8 4 3 Merbabu 1 10v 10v 10v* 3 0 0 2 10v 10v 10v** 2 0 0
** eksplan membentuk kalus (explant formed callus); v eksplan tumbuh bagus (explant grew well);
v* eksplan tumbuh bagus 50% (explant grew well about 50%); dan v** eksplan tumbuh bagus 40% (explant grew well about
37,7 kb, sedangkan, penggunaan triparental mating memudahkan pemindahan plasmid pCLD04541 dari E. coli ke dalam A. tumefaciens dengan bantuan plasmid helper pRK2013. Penggunaan plasmid helper pRK2013 disebabkan karena adanya fungsi mob (mobilizing) di dalam E. coli HB101 yang memiliki inang luas (DeArce 2006). Selama proses triparental mating, pRK2013 memobilisasi sendiri ke dalam A. tumefaciens LBA4404 dan E. coli DH5α. Kemudian pRK2013 akan memobilisasi plasmid pCLD04541 dan pRK2013 kembali ke dalam E. coli HB101 dan
A. tumefaciens LBA4404. Dengan penggunaan
seleksi antibiotik, maka A. tumefaciens LBA4404 yang mengandung pCLD04541 dapat dipisahkan dari kedua strain E. coli.
Gambar 4 menunjukkan koloni A. tumefaciens yang mengandung plasmid pCLD04541 mampu tumbuh pada media LB yang mengandung tetrasiklin 50 mg/l dan rifampisin 10 mg/l. Penggunaan tetrasiklin karena plasmid pCLD04541 mengandung gen ketahanan terhadap tetrasiklin, sedangkan penggunaan rifampisin
Gambar 3. Respons kultivar kentang (Merbabu, Granola, dan Atlantik) terhadap kanamisin (Response of potato cultivars (Merbabu, Granola, and Atlantic) to kanamycin)
Merbabu Granola
Atlantik
Gambar 4. Koloni A. tumefaciens strain LBA4404 mengandung plasmid pCLD04541 yang membawa gen
RB pada media LB mengandung
tetrasiklin 50 mg/l dan rifampisin 10 mg/l (Colonies of A.tumefaciens
strain LBA4404 containing pCLD04541 carries RB gene on LB medium contain 50 mg/l tetracycline and 10 mg/l rifampicin)
untuk menunjukan bahwa koloni yang tumbuh adalah A. tumefaciens.
Keberadaan plasmid pCLD04541 di dalam
A. tumefaciens tidak cukup dideteksi melalui
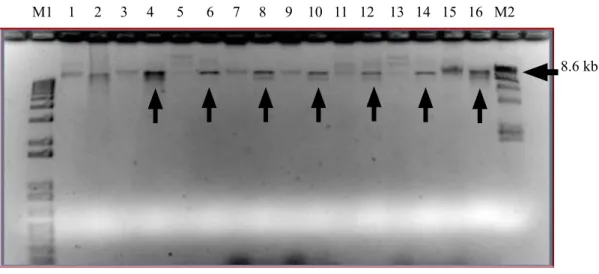
seleksi antibiotik, tetapi memerlukan konfirmasi menggunakan uji restriksi, yaitu dengan enzim restriksi BamHI. Penggunaan enzim ini dikarenakan gen RB menyisip T-DNA plasmid pCLD04541 pada sisi BamHI, sehingga plasmid tersebut bila dipotong akan menghasilkan 2 fragmen yang berukuran 29,1 kb dan 8,6 kb (fragmen gen RB). Tujuh koloni A. tumefaciens yang tumbuh pada media LB mengandung tetrasiklin dan rifampisin. Setelah diisolasi DNA plasmidnya dan dipotong dengan enzim BamHI menunjukkan adanya 2 pita DNA yang berukuran 29,1 kb dan 8,6 kb (Gambar 5).
Sebagai konfirmasi ulang bahwa DNA plasmid hasil isolasi dari A. tumefaciens adalah plasmid pCLD04541 yang mengandung gen RB, maka dilakukan analisis PCR terhadap ujung N dan ujung C dari gen tersebut menggunakan primer spesifik. Hasil amplifikasi ujung N gen
RB menghasilkan fragmen DNA berukuran
619 bp dan ujung C menghasilkan fragmen DNA berukuran 840 bp (Gambar 6). Sebagai pembanding digunakan kontrol DNA tanaman
Gambar 5. Konfirmasi keberadaan gen RB di A. tumefaciens (Confirmation of RB gene in A. tumefaciens). 1. DNA Agrobacterium non-transforman, 2. DNA Agrobacterium non-transforman + BamHI, 3, 5, 7, 9, 11, 13, 15 = DNA utuh Agrobacterium transforman, 4, 6, 8, 10, 12, 14, 16 = DNA Agrobacterium transforman + BamHI, M1: marker (1 kb ladder), M2: marker λ/HindIII. Panah tegak (Vertical arrow): fragmen gen RB 8,6 kb. Panah horizontal (Horizontal arrow): 8.6 kb
M1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 M2
8.6 kb
transgenik yang mengandung gen RB, yaitu tanaman transgenik Katahdin SP904 dan SP951. Kedua kontrol juga menunjukkan adanya fragmen DNA hasil amplifikasi berukuran 619 bp sebagai ujung N dan 840 bp sebagai ujung C (Gambar 6).
Gambar 6. Hasil analisis PCR gen RB pada plasmid pCLD04541 dalam A.
tumefaciens (The results of PCR analysis of RB gene in pCLD04541 plasmid on A. tumefaciens) . M: Marker (1 kb Ladder), (1) SP951, (2) SP904, dan (3) pCLD04541 M 1 2 3 619 bp (ujung N) 840 bp (ujung C)
Gambar 7. Kondisi seleksi eksplan Granola pada media seleksi (Selection
con-dition of Granola explant on selec-tion media)
Tabel 3. Jumlah planlet terbentuk pada transformasi kentang kultivar Granola dengan bantuan Agrobacterium (Number of plantlet formation of Agrobacterium-mediated
transformation of potato on Granola cultivar)
Kultivar (Cultivars)
Jumlah eksplan (Number of
explant)
Jumlah eksplan tahan antibiotik
(Number of explant resistance to antibiotic) Jumlah eksplan bertunas (Number of explant shooted) Jumlah planlet (Number of plantlet) Granola 5.347 106 95 94 Kontrol 102 - - 22
Gambar 8. Transforman Granola pada media perakaran (Granola transformant
on rooting media)
Transformasi Kentang dengan Gen RB Transformasi Granola dengan gen RB dilakukan terhadap 5.347 eksplan ruas batang. Tabel 3 menunjukkan bahwa dari 5.347 eksplan ruas batang yang diinokulasi dengan A. tumefaciens terseleksi 106 eksplan yang tahan hidup pada media seleksi (Gambar 7). Dari 106 eksplan yang tumbuh pada media seleksi hanya 95 eksplan mampu membentuk tunas. Dari 95 eksplan bertunas tersebut dihasilkan 94 planlet yang tumbuh pada media perakaran (Gambar 8).
Di antara 94 planlet transforman yang terbentuk, 77 sampel DNA telah diisolasi dan dianalisis PCR untuk keberadaan ujung N dan ujung C dari gen RB. Hasil analisis PCR dari 77 sampel DNA menunjukkan ada 50 sampel yang menghasilkan fragmen DNA baik untuk ujung N sebesar 619 bp ataupun ujung C sebesar
840 bp dari gen tersebut. Sebagai pembanding digunakan sampel DNA gen RB dari plasmid pCLD04541, Katahdin SP904, dan SP951, sedangkan hasil PCR Granola non-transforman hanya menunjukkan fragmen DNA untuk ujung C sebesar 840 bp. Hasil ini didukung oleh hasil analisis PCR yang dilakukan oleh John A. Raash (Staf Peneliti Universitas Wisconsin, Amerika Serikat, komunikasi pribadi 2006) bahwa tanaman kentang nontransgenik menunjukkan positif PCR untuk ujung C. Gambar 9 menunjukkan sebagian hasil PCR dari 77 sampel DNA yang menunjukkan fragmen DNA ujung N dan ujung C. Hasil transformasi kentang Granola yang telah mengandung gen RB diharapkan akan memiliki ketahanan terhadap P. infestans untuk semua ras yang ada di Indonesia. Pengujian lebih lanjut untuk mengetahui efektivitas gen RB terhadap P.
KESIMPULAN
1. Hasil regenerasi beberapa kultivar kentang menunjukkan bahwa kultivar Merbabu dan Atlantik memiliki daya regenerasi tertinggi dengan jumlah tunas terbentuk 30,6 dan 22,8. 2. Kultivar Granola merupakan kultivar paling sensitif terhadap agen seleksi kanamisin dan dipilih sebagai bahan transformasi dengan gen RB.
3. Plasmid pCLD04541 yang di dalamnya tersisipi gen RB berhasil ditransformasi ke dalam A. tumefaciens.
4. Diperoleh 50 tanaman Granola transforman positif mengandung gen RB untuk ketahanan terhadap P. infestans.
SARAN
Hasil transformasi kentang Granola yang telah mengandung gen RB perlu dilakukan kajian lebih lanjut seperti teknik southern blot guna membuktikan integrasi gen tersebut pada genom kentang serta uji efektivitas gen RB beberapa ras
P. infestans yang ada di Indonesia.
UCAPAN TERIMA KASIH
Ucapan terima kasih disampaikan kepada USAID-Agricultural Biotechnology Support Project II (USAID-ABSP II) berjudul ”The Development of Transgenic Late Blight-Resistant (LBR) Potato” dan Badan Penelitian dan Gambar 9. Hasil analisis PCR ujung N (A) dan ujung C (B) gen RB pada transforman Granola (Results of PCR analysis N-term end (A) and C-term end (B) of RB gene on
trans-formant Granola). (1) 1.1.1 (+): putative transgenic Granola, (2) 1.2.1 (+): putative transgenic Granola, (3) 1.4.2 (+): putative transgenic Granola, (4) 1.5.1 (+): putative transgenic Granola, (5) 1.5.2 (+): putative transgenic Granola, (6) 4.20.1 (+): puta-tive transgenic Granola, (7) 21.13.1 (+): putaputa-tive transgenic Granola, (8) 14.9.1 (+): putative transgenic Granola, (9) Katahdin SP904 (+), (10) Katahdin SP951 (+), (11)
RB (plasmid) (+), (12) Granola (-) on N-term end (+) on C-term, (13) H20 (-), M: 1 Kb DNA Ladder
1 2 3 4 5 6 7 8 M 9 10 11 12 13
M 1 2 3 4 5 6 7 8 9 10 11 12 13
619 bp
Pengembangan Pertanian yang telah memberikan sebagian biaya penelitian dan beasiswa program doktor di Program Studi Agronomi, Sekolah Pascasarjana, Institut Pertanian Bogor.
PUSTAKA
1. Anjum, M.A., and H. Ali. 2004. Effect of Culture Medium on Direct Organogenesis from Different Explants of Various Potato Genotypes. Biotechnol. 3(2):187-193. 2. Anonymous. 2006. Binary Vector pCLD04541. www.
jiclabgenome.co.uk. [30 Juni 2006].
3. Beaujean, A., R.S. Sangwan, A. Lecardonnel, and B.S. Sangwan-Norreel. 1998. Agrobacterium-mediated Transformation of Three Economically Important Potato Cultivars using Sliced Internodal Explants: An Efficient Protocol of Transformation. J. Experimental Botany. 49(326):1589-1595.
4. DeAcre, M. 2006. Experiment 1. Production of Transgenic Plants. www.tcd.ie/Genetics/staff/Miguel_ DeArce_GE3020/. [25 Mei 2006].
5. Depertemen Pertanian. 2007. Data Statistik Pertanian. Penerbit. Departemen Pertanian. 280 Hlm.
6. Elizabeth, F., J. Crowell, M. McGrath and D.S. Douches. 2008. Accumulation of Vitamin E in Potato (Solanum
tuberosum) Tubers. Transgenic Res 17:205–217.
7. Fulton, T.M., J. Chunzoongse and S.D.Tanksley. 1995. Microprep Protocol for Extraction of DNA from Tomato and other Herbaceous Plants. Plant Mol. Biol. Rep. 13(3): 207-209.
8. Gelvin, S. B. 2003. Agrobacterium-Mediated Plant Transformation: the Biology behind the Gene-Jockeying Tool. Microbiol. and Molecular Biol. Reviews. 67:16– 37.
9. Helgeson, J.P., J.D. Pohlman, S. Austin, G.T. Haberlach, S.M. Wielgus, D. Ronis, L. Zambolim, P. Tooley, J.M. McGrath, R.V. James, and W.R. Stevenson. 1998. Somatic Hybrids between Solanum bulbocastanum and Potato: A New Source of Resistance to Hawar Daun. Theor. Appl.
Genet. 96:738-742.
10. Hutchinson, J.F., D. Isenegger, S. Nadesan, N. Smith, and P. Waterhouse. 2000. Potato Biotechnology-achievements and Opportunities. In C. M. Williams and L. J. Walters (Eds). IHD at Potatoes 2000 Linking Research to Practice
Conference Proceedings. 3 pp. [23 Januari 2007].
11. Kuhl J.C., K. Zarka, J. Coombs, W.W. Kirk, and D.S. Douches. 2007. Late Blight Resistance of RB Transgenic Potato Lines. J. Amer. Soc. Hort. Sci. 132(6):783–789. 12. Koroch, A., J. Kapteyn, H.R. Juliani, and J.E. Simon.
2002. In Vitro Regeneration and Agrobacterium Transformation of Echinacea purpurea Leaf Explants.
Trends in New Crops and New Uses: 522-526.
13. Missiou, A., K. Kalantidis, A. Boutla, S. Tzortzakaki, M. Tabler and M. Tsagris. 2004. Generation of Transgenic Potato Plants Highly Resistant to Potato Virus Y (PVY) through RNA Silencing. Molecular Breeding 14:185-197.
14. Park, T.H., J. Gros, A. Sikkema, V.G.A.A. Vleeshouwers, M. Muskens, S. Allefs, E. Jacobsen, R.G.F. Visser, and E.A.G. van der Vossen. 2005. The Late Blight Resistance Locus Rpi-blb3 from Solanum bulbocastanum belongs to a Major Late Blight R Gene Cluster on Chromosome 4 of Potato. MPMI 18(7):722-729.
15. Purwanti, H. 2002. Penyakit Hawar Daun [Phytophthora
infestans (Mont.) de Bary] pada Kentang dan Tomat:
Identifikasi Permasalahan di Indonesia. Buletin AgroBio 5(2):67-72.
16. Sinaga, A., Budiman, Susi M., Sukmaya, Djoko S., Mei R.D., Sudjoko S., and Ahmad D. 1997. Potato Cultivation
in Indonesia. Assessment Institute for Agriculture
Technology. 57p.
17. Song, J., J.M. Bradeen, S.K. Naess, J.A. Raasch, S.M. Wielgus, G.T. Haberlach, J. Liu, H. Kuang, S. Austin-Phillips, C.R. Buell, J.P. Helgeson, and J. Jiang. 2003. Gene RB Cloned from Solanum bulbocastanum Confers Broad Spectrum Resistance to Potato Hawar Daun. PNAS 100:9128-9133.
18. Van der Vossen, E., A. Sikkema, B.L. Hekkert, J. Gros, P. Stevens, M. Muskens, D. Wouters, A. Pereira, W. Stiekema, and S. Allefs. 2003. An Ancient R Gene from the Wild Potato Species Solanum bulbocastanum Confers Broad-spectrum Resistance to Phytophthora infestans in Cultivated Potato and Tomato. The Plant J. 36:867-882.
19. Yasmin, S., K.M. Nasiruddin, R. Begum and S.K. Talukder. 2003. Regeneration and Establishment of Potato Plantlets through Callus Formation with BAP and NAA.