REGENERASI DAN TRANSFORMASI TEBU
(
Saccharum officinarum
L.) KULTIVAR PA 183 DAN CB 6979
DENGAN GEN FITASE
MELALUI
Agrobacterium tumefaciens
GV2260
RENY HAYATY ZUL
A351030191
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Master Sains pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
REGENERASI DAN TRANSFORMASI TEBU
(
Saccharum officinarum
L.) KULTIVAR PA 183 DAN CB 6979
DENGAN GEN FITASE
MELALUI
Agrobacterium tumefaciens
GV2260
RENY HAYATY ZUL
A351030191
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Regenerasi dan Transformasi Tebu (Saccharum officinarum L.) Kultivar PA 183 dan CB 6979 dengan Gen Fitase Melalui
Agrobacterium tumefaciens GV2260
ABSTRAK
RENY HAYATY ZUL. Regenerasi dan Transformasi Tebu (Saccharum officinarum L.) Kultivar PA 183 dan CB 6979 dengan Gen Fitase Melalui
Agrobacterium tumefaciens GV2260. Dibimbing oleh Dr. Ir. AGUS PURWITO, MSc dan Dr. Ir. DWI ANDREAS SANTOSA, MSc.
Tujuan dari penelitian ini adalah untuk mendapatkan komposisi media regenerasi yang paling baik untuk regenerasi kalus tebu nontransforman dan transforman. Tujuan yang lain adalah mengintroduksi gen fitase ke dalam genom tanaman tebu melalui Agrobacterium tumefaciens GV2260. Hasil yang diperoleh dari penelitian ini adalah komposisi media regenerasi yang terbaik untuk menginduksi tunas pada kultivar PA 183 adalah media MS yang ditambah dengan BAP 0.75 mg/L dan kinetin 0.20 mg/L. Media untuk induksi perakaran pada kultivar PA 183 diperoleh pada media MS yang ditambah IBA 0.50 mg/L dan IAA 0.50 mg/L. Komposisi media terbaik untuk menginduksi tunas pada kultivar CB 6979 adalah media MS ditambah dengan BAP 0.50 mg/L dan kinetin 0.40 mg/L. Formasi tunas pada kultivar CB 6979 diinduksi oleh media MS yang ditambah dengan IBA 0.25 mg/L dan IAA 0.50 mg/L. Kalus transforman kultivar PA 183 sebanyak dan 135 kalus transforman kultivar CB 6979 dapat tumbuh pada media seleksi kanamisin. Planlet transforman kultivar PA 183 yang bisa tumbuh pada media regenerasi berjumlah 90 dan kultivar CB 6979 berjumlah 129 sedangkan yang dapat tumbuh setelah diaklimatisasi berjumlah 20 planlet kultivar PA 183 dan 25 planlet kultivar CB 6979. PCR yang dilakukan pada planlet tebu transforman menunjukkan bahwa gen fitase berhasil ditransformasi dan hasil uji aktivitas enzim fitase pada planlet transforman, kultivar PA 183 adalah 0.116 U/ml dan CB 6979 0.123 U/ml.
RIWAYAT HIDUP
Penulis dilahirkan di Padang pada tanggal 8 Agustus 1974 dari ayah Zulkarnaini Chatib (Alm) dan ibu Yustina, SH (Alm). Penulis merupakan putri kedua dari dua bersaudara.
Penulis menyelesaikan SMA pada SMA Negeri 1 Solok, pada tahun 1992. Tahun 1992 penulis melanjutkan pendidikan sarjana yang ditempuh di Program Studi Teknologi Benih, Fakultas Pertanian Universitas Andalas, lulus pada tahun 1997. Pada tahun 2003, penulis diterima di Program Studi Agronomi Sekolah Pascasarjana IPB. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan Nasional.
Judul Tesis : Regenerasi dan Transformasi Tebu (Saccharum officinarum L.) Kultivar PA 183 dan CB 6979 dengan Gen Fitase Melalui
Agrobacterium tumefaciens GV2260 Nama : Reny Hayaty Zul
NRP : A351030191
Disetujui
Komisi Pembimbing
Dr. Ir. Agus Purwito, Msc Dr. Ir. Dwi Andreas Santosa, MSc
Ketua Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, MSc Dr. Ir. Khairil Anwar Notodiptro, MS
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya penulis dapat menyusun dan menyelesaikan tesis ini.
Pada kesempatan ini pula penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Dr. Ir Agus Purwito, MSc dan Dr. Ir. Dwi Andreas Santosa, Msc selaku pembimbing yang telah memberikan waktunya untuk membimbing serta mengarahkan penulis selama penelitian berlangsung hingga tesis ini dapat selesai.
2. Prof. Dr. Ir. G.A. Wattimena, MSc sebagai penguji tamu yang banyak membantu dalam menyelesaikan penyempurnaan tesis ini. 3. Papa (Alm), Mama (Alm) yang memberi inspirasi dan dorongan
kepada penulis selama menempuh studi dan menyelesaikan tesis. 4. Papi, Mami, Nenek, Paman-paman, Tante-tante, Ni Aten dan Mas
Wawan, Abang Hendri dan Adikkku Dian, dan ponakanku Rara tercinta yang tiada hentinya memberikan dukungan moral dan material selama penulis menempuh studi dan menyelesaikan tesis. 5. Ni Susi, Ade Nena, Uli, dan teman-teman Program Studi Agronomi
yang telah membantu dan memberi dukungan selama penulis menempuh studi dan menyelesaikan tesis.
6. Seluruh staf laboratorium Bioteknologi Tanaman, Departemen Budidaya Pertanian, Fakultas Pertanian IPB, Indonesian Cetre for Biodiversity and Biotechnology (ICBB) dan PT. Saraswanti Indo Genetech (SIG), yang telah memberi fasilitas dan bantuan.
7. Civitas akademi Fakultas Pertanian Universitas Mahaputra M. Yamin, yang telah memberikan dukungan moral selama penulis menempuh studi dan menyelesaikan tesis.
Pada akhirnya penulis berharap bahwa tulisan ini dapat bermanfaat bagi pihak-pihak yang memerlukan.
Bogor, 24 Mei 2007
DAFTAR ISI
Halaman
DAFTAR ISI... i
DAFTAR TABEL... ii
DAFTAR GAMBAR... iii
DAFTAR LAMPIRAN... iv
I. PENDAHULUAN 1.1. Latar Belakang... 1
1.2. Tujuan Penelitian... 3
II. TINJAUAN PUSTAKA 2.1 Tebu (Saccharum officinarum L.)... 4
2.2. Agrobacterium tumefaciens... 5
2.3. Konstruksi Kaset Gen pBIN1-ECS... 7
2.4. Fitat dan Fitase... 8
2.5. Kultur Jaringan Tanaman Tebu... 10
2.6. Analisis Tanaman Transgenik... 14
III. BAHAN DAN METODE 3.1. Tempat dan Waktu... 16
3.2. Bahan dan Alat... 16
3.3. Metode Penelitian... 16
3.3.1. Kultur Jaringan Tanaman Tebu... 16
3.3.1.1. Sterilisasi dan Penanaman Eksplan... 16
3.3.1.2. Regenerasi Tanaman Tebu... 17
3.3.2. Transformasi Kalus Tebu dengan Gen Fitase (Santosa et al., (2004) yang dimodifikasi)... 19
3.3.2.1. Penyiapan Kalus untuk Transformasi... 19
3.3.2.2. Penyiapan A.tumefaciens GV 2260 pBIN1-ECS untuk Transformasi……….... 19
3.3.3.1. Ekstraksi DNA... 20
3.3.3.2. Amplifikasi DNA... 21
3.3.4. Uji Aktivitas Enzim Fitase pada Tebu Transforman dan Non Transforman (Greiner, 2005)... 21
IV. HASIL DAN PEMBAHASAN 4.1. Kultur Jaringan Tanaman Tebu... 23
4.1.1. Sterilisasi Eksplan... 23
4.1.2. Regenerasi Tanaman Tebu... 23
4.1.2.1. Regenerasi pada Kultivar PA 183... 23
4.1.2.2. Regenerasi pada Kultivar CB 6979... 25
4.1.2.3. Induksi Perakaran... 27
4.2. Transformasi Kalus Tebu Var CB 6979 dan PA 183 dengan Gen Fitase... 31
4.3. Pengujian Molekuler... 33
4.3.1. Amplifikasi DNA... 33
4.3.2. Uji Aktifitas Enzim Fitase Pada Planlet Tebu Transforman dan Non Transforman... 34
4.4. Pembahasan Umum... 35
V. SIMPULAN DAN SARAN 5.1. Simpulan... 37
5.2. Saran... 37
Daftar Pustaka... 38
DAFTAR TABEL
Halaman
1. Rata-rata jumlah tunas kalus tebu kultivar PA 183 pada
minggu ke-3 sampai minggu ke-5... 24 2. Rata-rata jumlah daun kalus tebu kultivar PA 183 pada
minggu ke-3 sampai minggu ke-5... 24 3. Rata-rata jumlah tunas kalus tebu kultivar CB 6979 pada
minggu ke-3 sampai minggu ke-5... 26 4. Rata-rata jumlah daun kalus tebu kultivar CB 6979 pada
minggu ke-3 sampai minggu ke-5... 26 5. Rata-rata jumlah akar planlet tebu kultivar CB 6979 dan PA 183
pada media perakaran pada minggu ke-4 sampai minggu ke-6... 28 6. Rata-rata jumlah tunas planlet tebu kultivar CB 6979 dan PA 183
pada media perakaran pada minggu ke-4 sampai minggu ke-6... 29 7. Rata-rata jumlah daun planlet tebu kultivar CB 6979 dan PA 183
pada media perakaran pada minggu ke-6... 30 8. Rata-rata panjang akar planlet tebu kultivar CB 6979 dan PA 183
pada media perakaran pada minggu ke-6... 30 9. Jumlah kalus tebu kultivar PA 183 dan CB 6979 hasil transformasi... 31 10. Nilai uji aktivitas fitase dan hasil PCR pada tebu kultivar PA 183
DAFTAR GAMBAR
Halaman 1. Konstruksi kaset gen pBIN1-ECS... 7 2. A) kalus PA 183 berumur 1 bulan pada media MS I; B) Kalus
CB 6979 berumur 1 bulan pada media MS I... 23 3. Planlet tebu pada media perakaran; A) planlet tebu kultivar CB 6979
pada media perakaran dengan penambahan 0.25 mg/L IBA dan 0.50 mg/L IAA; B) planlet tebu kultivar PA 183 pada media
perakaran dengan penambahan 0.50 mg/L IBA dan 0.50 mg/L IAA; C) planlet tebu kultivar PA 183 pada media perakaran dengan
penambahan 0.25 mg/L IBA dan 0.20 mg/L IAA... 31 4. A) kalus PA 183 transgenik pada media seleksi; B) kalus CB 6979
transgenik pada media seleksi; C) kalus PA 183 transgenik pada
media seleksi... 33 5. Planlet tebu transforman kultivar PA 183; A) planlet yang berwarna
hijau muda; B) planlet yang berwarna hijau; C) planlet yang berwana
albino dan hijau muda; D) planlet yang berwarna belang hijau dan albino... 33 6. Planlet tebu transforman kultivar CB 6979; A) planlet yang berwarna
hijau dan hijau muda; B) planlet yang berwarna hijau kekuningan; C) planlet yang berwarna albino; D) planlet yang berwarna hijau
dan albino... 33 7. Elektroforesis hasil PCR planlet beberapa kultivar tebu.
(1) PA 175; (2) CB 6979; (3) (K+) kontrol positif ; (4) PSJT 9441; (5) PS 851 pBIN1PI-IIEC; (6) marker 1 Kb Plus DNA Ladder (Invitrogen); (7) kalus CB 6979 pBIN1-ECS; (8) CB 6879
DAFTAR LAMPIRAN
Halaman
1. Komposisi media MS untuk induksi kalus dan regenerasi
I. PENDAHULUAN
1.1. Latar Belakang
Tebu (Saccharum officinarum L.) merupakan salah satu tanaman perkebunan yang paling tua dikenal oleh manusia dan memiliki peranan penting, dimana 65% produksi gula dunia berasal dari tebu. Beberapa komponen alami pada industri farmasi berasal dari tebu. Di bidang pertanian dan industri, produk dari industri gula digunakan untuk pakan ternak, pabrik kertas dan sebagai sumber bahan bakar.
Kebutuhan gula di Indonesia tahun 1998 sebesar 13.4 kg per kapita per tahun, sehingga jumlah konsumsi gula sebesar 2.7 juta ton. Tahun 2002 seiring dengan peningkatan jumlah penduduk terjadi peningkatan kebutuhan gula yaitu 14.57 kg per kapita per tahun, sehingga jumlah konsumsinya pun meningkat sebesar 3.2 juta ton. Produksi gula di dalam negeri tahun 1998 adalah 1.5 juta ton, dan pada tahun 2002 sebesar 1.8 juta ton (Dewan Gula Nasional, 2003). Produksi gula sebesar ini belum bisa mencukupi konsumsi masyarakat Indonesia karena konsumsi gula lebih tinggi dibanding dengan produksi, sehingga untuk mencukupi kebutuhan dalam negeri pemerintah mengimpor 1.49 juta ton setiap tahun. Pada tahun 2005 Indonesia mengimpor gula sebesar 1,6 juta ton dan menduduki peringkat kedua sebagai negara pengimpor gula sesudah Rusia (Khudori, 2005). Hal ini memperlihatkan bahwa terdapat peluang untuk pengembangan tanaman tebu guna memenuhi kebutuhan.
Produksi tebu di Indonesia yang rendah disebabkan karena rendahnya pasokan tebu dari petani, peralihan penanaman tebu dari lahan basah ke lahan kering, mutu bibit yang buruk, dan petani tidak mampu mengganti bibitnya dengan varietas yang lebih baik. Selain itu, sistem keprasan yang saat ini diterapkan beresiko besar terhadap penyakit yang dapat menurunkan produksi hingga 30%. Produktivitas lahan pada lahan kering yang lebih banyak membutuhkan pupuk P juga berkurang akibat tidak efisiensinya pemupukan pupuk fosfat.
cara konvensional dengan penyilangan menghadapi dua kendala utama : pertama terbatasnya sumber daya genetik yang secara seksual kompatibel dengan tanaman tebu induknya, kedua, siklus pemuliaan dengan metode ini dianggap terlalu lama (Minarsih, 2003; Singh, et al., 2005).
Usaha untuk mendapatkan varietas tebu yang unggul terutama ditujukan untuk perbaikan kuantitas (bobot tebu per hektar) dan kualitas (rendemen gula) dapat dilakukan dengan perbaikan genetik tanaman melalui teknik rekayasa. Transfer gen dapat dilakukan secara langsung dan tidak langsung. Transfer gen secara langsung melalui elektroporasi dan particle bombartment, mempunyai kemampuan bereproduksi dan jumlah salinan gen rendah serta keberadaan gen target tidak stabil. Transfer gen secara tidak langsung melalui vektor
Agrobacterium tumefaciens. Transformasi menggunakan Agrobacterium memiliki banyak keuntungan yaitu jumlah kopi gen lebih kecil, ekspresi gen lebih tinggi dan lebih mudah untuk dimanipulasi secara in vitro (Cheng et al; 1997).
Peningkatan produksi gula dengan varitas tebu yang unggul terutama ditujukan untuk meningkatkan rendemen gula dapat dilakukan dengan transformasi gen fitase dari bakteri tanah yang dapat menghasilkan tebu berproduksi tinggi, efisien dalam pemakaian pupuk P dan daunnya dapat dijadikan pakan ternak. Gen fitase dipilih untuk disisipkan ke dalam tanaman tebu karena gen ini menghasilkan enzim yang dapat mengubah senyawa fitat yaitu senyawa organik yang mengikat unsur fosfat di dalam sel tanaman. Jika senyawa fitat di hidrolisis akan menghasilkan ester yang berfosfat rendah dan melepaskan unsur fosfat inorganik.
Fosfat inorganik yang tersedia di dalam sel tanaman memberikan pengaruh positif pada proses pembentukan klorofil, meningkatkan fotosintesis dan metabolisme tanaman tebu sehingga rendemen tebu meningkat. Fitase juga meningkatkan ketersediaan mineral-mineral lainnya, seperti kalsium, magnesium, dan kalium di dalam jaringan tanaman sehingga tanaman dapat mengurangi kebutuhan pupuk.
lengkap dan kompetensi untuk ditransformasi merupakan dua kunci penting untuk menentukan keberhasilan program transformasi genetik. Perubahan-perubahan yang terjadi pada eksplan menuju pembentukan tumbuhan baru (planlet), sangat tergantung pada medium tempat tumbuhnya, bahan eksplan, penggunaan zat pengatur tumbuh yang seimbang dan kondisi lingkungan kultur. Menurut Sastrowijono (1991), zat pengatur tumbuh yang dibutuhkan dalam jumlah sangat sedikit memegang peranan dalam pembelahan dan pertumbuhan sel. Zat pengatur tumbuh atau regulator diperlukan untuk differensiasi kalus menjadi tunas, akar atau regenerasi bagian tumbuhan terutama dari eksplan yang tumbuh menjadi kalus dan berdiferensiasi menjadi bertunas dan berakar.
1.2. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mendapatkan media yang sesuai untuk regenerasi tanaman tebu PA 183 dan CB 6979.
2. Mengintroduksi gen fitase ke dalam genom tanaman tebu melalui
II. TINJAUAN PUSTAKA
2.1. Tebu (Saccharum officinarum L.)
Tanaman tebu (Saccharum officinarum L.) merupakan tanaman perkebunan bernilai ekonomi tinggi di daerah tropik dan subtropik. Pertama kali diketahui berasal dari daratan Indo-Gangetic, India. Tebu merupakan tanaman rerumputan (Graminae) yang termasuk dalam genus Saccharum dari salah satu anggota kelompok Andropogonae. Dalam genus Saccharum ada tiga spesies yang dibudidayakan saat ini merupakan hibrid kompleks yang tersusun atas S. officinarum L, S. barberi jesw dan, S. sinense (roxb.) Jesw, dan dua spesies liar S. spontaneum L. dan S. robustum Brand dan Jesw (Naik, 2001).
Spesies tebu dalam genus Saccharum merupakan tanaman poliploid yang kompleks dengan jumlah kromosom yang besar, S. officinarum L (2n = 80 euploid); S. robustum Brand & Jesw. ex Grassl (2n = 60 dan 80, euploid dan 2n = 63 – 200, aneuploid); S. sinense Roxb (2n = 111 – 120, aneuploid); S. barberi
Jesw (2n = 81 – 124, aneuploid); S. Spontaneum L. (2n = 40 – 128, euploid dan aneuploid); dan S. edule Hassk. (2n = 60, 70 dan 80, aneuploid) (Roach dan Daniel, 1987 dalam Hartatik, 2005). Jumlah kromosom dasar pada genus
Saccharum bervariasi di antara spesies tanaman yaitu 5, 6, 8, 10 dan 12. Kemungkinan jumlah kromosom dasar pada tanaman tebu budidaya adalah x = 10, karena jumlah kromosom dasar tersebut paling dominan pada Andropogoneae
(Sreenivasan, et al., 1987).
Secara ekonomi tebu merupakan tanaman yang penting, karena merupakan bahan baku utama pembuatan gula pasir. Selain itu industri furfural, dextran, dan alkohol juga sangat tergantung pada tanaman ini. Produk samping industri gula dapat dikembangkan menjadi bahan nutrisi pakan ternak, prosesing bahan makanan, pembuatan kertas dan sebagai sumber energi bahan bakar.
sehingga perbaikan tanaman tebu tidak dapat dilakukan melalui pemuliaan tanaman konvensional (Santosa et al ., 2004).
Transfer gen pada tanaman akan menghasilkan tanaman transgenik. Istilah transgenik dalam pengertian luas dipakai untuk tanaman yang memiliki gen asing yang berfungsi dan terintegrasi ke dalam genom tanaman tersebut (Uchimiya et al., 1989). Penggunaan metode transformasi tanaman untuk memasukkan gen asing ke genom tanaman mempunyai dampak yang penting terhadap hasil tebu (Gustavo et al., 1998).
Kultur jaringan tebu, biologi molekuler tanaman tebu, dan introduksi gen tanaman tebu telah banyak dikembangkan (Martin, 1982). Bower dan Birch pada tahun 1992 sukses mendapatkan tebu transgenik dari suspensi sel dan kalus embriogenik yang ditransformasi melalui particle bombartment. Penggunaan metode transformasi tanaman untuk memasukkan gen resisten ke genom tanaman mempunyai arti yang penting terhadap hasil tebu, dimana didapatkan generasi galur tebu transgenik pertama yang resisten serangan stem-borer (Gustavo et al.,
1998).
Transformasi gen secara in vitro akan berhasil dan bermanfaat apabila sudah diperoleh protokol regenerasi tanaman yang efisien dan stabil. Kompetensi untuk beregenerasi yaitu kemampuan membentuk tanaman lengkap dan kompetensi untuk ditransformasi merupakan dua kunci penting untuk menentukan keberhasilan program transformasi genetik.
2.2. Agrobacterium tumefaciens
Agrobacterium tumefaciens merupakan bakteri patogen tanah, yang kebanyakan digunakan untuk introduksi gen asing ke dalam sel tanaman dan regenerasi berikutnya pada tanaman transgenik (Gustavo et al., 1998; Li dan Gray, 2005). Transformasi ini menyebabkan tumor crown gall (bisul mahkota), yang secara agronomi merupakan penyakit penting yang berpengaruh pada kebanyakan tanaman dikotiledon (Sheng dan Citovsky, 1996).
diapit oleh sekuen berulang DNA (25 bp) sebagai batas T-DNA (Sheng dan Citovsky, 1996).
Komponen kedua adalah daerah virulen (vir) berukuran 35 kb, yang juga berlokasi pada Ti plasmid, yang terdiri dari tujuh lokus utama (virA, virB, virC, virD, virE, virG dan virH) (Gustavo et al., 1998). Protein produk dari gen ini, disebut protein virulen (Vir), yang respon terhadap senyawa fenolik yang dikeluarkan oleh tanaman berkayu untuk menghasilkan copy T-DNA dan sebagai mediasi T-DNA ke dalam sel inang (Sheng dan Citovsky, 1996).
Komponen ketiga adalah chromosomal virulence (chv) genes, yang terdiri dari chvA, chvB, pscA (atau exoC) dan att, yang berlokasi di kromosom
Agrobacterium. Gen chv terlibat dalam khemotaksis bakteri dan pelekatan ke dalam sel tanaman dengan membentuk senyawa protein β-1,2-glucan (Nester et al., 1996).
Proses transfer gen dari Agrobacterium tumefaciens ke sel tanaman memiliki lima langkah penting yang secara tidak langsung mempengaruhi, yaitu 1) koloni bakteri, 2) induksi sistem virulen bakteri, 3) pembentukan komplek transfer T-DNA, 4) transfer T-DNA, dan 5) integrasi T-DNA ke dalam genom tanaman. Koloni bakteri sangat penting dan merupakan langkah awal dalam induksi tumor dan proses itu berlangsung ketika Agrobacterium tumefaciens
menyerang permukaan sel tanaman (Gustavo et al, 1998). Pelukaan menyebabkan sel tanaman menjadi rentan terhadap Agrobacterium tumefaciens.
Sel-sel tersebut memproduksi banyak sekali senyawa fenolik seperti asetosyringon yang berfungsi sebagai pemicu ekspresi gen vir (Nester et al.,
1996). Pada Agrobacterium protein VirA dan VirG merupakan komponen sensor sinyal sistem regulator genetik transduksi. (Gelvin, 2003). Sementara itu sel tanaman juga mensistesis beberapa tipe molekul sinyal yang mengaktifkan satu seri gen vir pada plasmid Ti. Gen vir tersebut menyandikan enzim-enzim yang penting untuk memproses, mentransfer dan melekatkan T-DNA pada inti sel tanaman (Nester et al., 1996).
mengendalikan virulensi pada derah vir pada Ti-plasmid (Nester et al, 1996). Fenolik yang timbul akibat pelukaan, akan menginduksi virA untuk memproduksi protein VirA yang memiliki topologi transmembran. Protein VirA mengalami autofosforilasi yang selanjutnya akan memfosforilasi virG. Phospho virG akan mengaktifkan transkripsi gen-gen vir yang lain. Proses pengaktifan ini mengawali produksi protein VirB, VirC, VirD, VirE dan VirF. Protein VirD1 menyandi situs spesifik endonuklease yang bertanggung jawab memotong border T-DNA dan mengaktifkan sistesis T-DNA yang telah putus. Pada pemotongan ini VirD2 tetap terikat secara kovalen pada ekor 5’ dari DNA yang terlepas. Molekul ini kemudian dikirim ke sel tanaman melalui saluran yang kemungkinan terbentuk dari protein VirB yang terdiri dari 11 protein VirB oleh operon VirB. Saluran ini juga digunakan untuk mengirim protein VirE2. Di dalam sel tanaman VirE bergabung dengan utasan tunggal T-DNA yang diawali dengan molekul VirD2 pada struktur komplek T. Protein VirD2 dan VirE2 mengantarkan T-DNA masuk ke inti melalui bentuk komplek saluran inti (NPC ; Nuclear-pore complexes). Di dalam inti T-DNA akan terintegrasi ke genom tanaman (Sheng dan Citovsky, 1996).
2.3. Konstruksi Kaset Gen pBIN1-ECS
Konstruksi kaset gen pBIN1-ECS (Gambar 1) merupakan hasil konstruksi dan modifikasi. Konstruksi kaset gen ini di dapat melalui kerjasama antara
Federal Research Centre For Nutrition, Centre for Molecular Biology German dan Fakultas Pertanian IPB.
EcoRI BamHI/BglII SalI HindIII
Gambar 1. Konstruksi kaset gen pBIN1-ECS (Santosa et.al.,2007, in press) 1045 bp phy
ECL03375 OSC
Konstruksi kaset gen pBIN1-ECS membawa gen struktural fitase berukuran 1045 bp yang dikendalikan oleh promoter kimera CaMV35S dan OSC enhancer untuk ekspresi di tanaman. Gen nptII yang membawa sifat resistensi terhadap antibiotik kanamisin juga disisipkan ke dalam vektor yang digunakan sebagai marker seleksi. Gen nptII berlokasi arah hulu gen struktural fitase. 2.4. Fitat dan Fitase
Asam fitat atau mio-inositol 1,2,3,4,5,6-heksakis (dihidrogen phosphate) adalah zat anti gizi, karena kemampuannya mengikatnya kation-kation multivalen seperti kalsium, besi, seng dan sebagainya dalam suatu kompleks yang tidak larut, dan membentuk garam-garam fitat berupa Na2Mg5-fitat, K2Mg5-fitat atau CaMg5-fitat (fitin). Myo-inositol hexaphosphate (CaMg5-fitat) sangat berperan dalam penurunan jumlah kation multivalen seperti Ca2+, Mg2+, Zn2-, Fe2-, dan Fe3-. Asam fitat juga terikat dengan beberapa mineral dan protein sehingga membentuk kompleks fitat-protein-mineral yang sukar larut, yang menyebabkan asam fitat tidak mempunyai nilai guna yang optimal (Indarwati, 2000).
Posfor disimpan dalam benih atau biji tanaman dalam bentuk asam fitat (mio-inositol heksakisfosfat) (Hegeman dan Grabau, 2001). Dalam biji-bijian umumnya asam fitat berada di sel-sel kotiledon. Shieh dan Ware (1980) menyatakan bahwa beberapa jenis tanaman mengandung asam fitat, namun kandungan fosfornya sedikit sekali yang dapat dimanfaatkan pada proses pencernaan hewan seperti hewan non ruminant, sebab sistem pencernaannya tidak mampu menghidrolisis fitat. Hegeman dan Grabau (2001) juga menyatakan bahwa kotoran hewan yang tidak bisa memanfaatkan fitat dalam sistem pencernaannya akan menyebabkan level fosfor yang tinggi dalam tanah dan air sehingga menyebabkan terjadinya pencemaran lingkungan. Hidrolisis secara enzimatik terhadap asam fitat mampu melepaskan fosfor dari ikatannya sehingga dapat dimanfaatkan oleh hewan tersebut dan mengurangi pengaruh negatif terhadap lingkungan.
tertentu bahkan menjadi fosfat dan mio-inositol bebas. Menurut IUPAC-IUB, ada dua jenis enzim fitase, yaitu :
a. 3-fitase (EC 3.1.3.8) yang mengkatalisis reaksi : mio-inositol heksakisfosfat + H2O mio-inositol-1,2,4,5,6-pentakisfosfat + Pi
b. 6-fitase (EC 3.1.3.26) yang mengkatalisis reaksi : mio-inositol heksakisfosfat + H2O mio-inositol-1,2,3,4,5-pentakisfosfat + Pi
Jenis 3-fitase umumnya terdapat pada mikrob, sedangkan 6-fitase umumnya terdapat pada biji-bijian. Sumber fitase bervariasi mulai dari berbagai jenis mikrob (jamur dan bakteri), tanaman hingga jaringan hewan mammalian atau usus halus (Cosgrove, 1980). E.coli dilaporkan dapat memproduksi gen fitase (Greiner et al, 1993).
Apabila fitase bertemu dengan fitat maka fitase akan segera menyerang fitat dan aktivitas fitase akan meningkat tajam sejalan dengan peningkatan suhu dan udara. Setelah itu grup ester fosfat pada fitat terhidrolisis. Hal tersebut menyebabkan ester fosfat yang lemah pada mioinositol tidak cukup kuat untuk mengkelat kation, sehingga kation tersebut terdifusi keluar (Kilmer et al, 1994).
2.5. Kultur Jaringan Tanaman Tebu
Kultur jaringan tanaman didasarkan pada pendapat bahwa tanaman dapat diisolasi bagian tanaman seperti organ, jaringan atau sel, yang mana dapat dimanipulasi secara in vitro dan kemudian ditumbuhkan kembali menjadi tanaman yang utuh (Caponetti et al., 2005). Teknik in vitro untuk pengadaan bahan tanaman perkebunan mempunyai beberapa keunggulan yaitu adanya perbaikan mutu genetis, fisiologis, dan kemurnian yang cukup tinggi. Hal ini disebabkan eksplan sebagai sumber bahan tanaman diperbanyak dari tanaman induk yang unggul. Keuntungan lain menggunakan teknik kultur jaringan yaitu dapat dilakukan seleksi terhadap sifat-sifat tanaman yang dikehendaki secara dini. Selain itu, kondisi lingkungan tempat tumbuh individu mini tersebut dapat dikontrol sesuai dengan keperluan (Haris & Mathius 1995). Teknik kultur jaringan pada tanaman tebu awalnya digunakan untuk peningkatan produktivitas. Pada saat ini teknik kultur jaringan berkembang sebagai sarana pendukung program pemuliaan tanaman, misalnya mendapatkan sifat ketahanan suatu penyakit, stress lingkungan atau sifat perbaikan genetik lainnya.
Penelitian kultur jaringan tanaman tebu dilakukan pertama kali di Hawaii tahun 1961 oleh Nickell, kemudian dilanjutkan oleh Heinz dan Mee (1969) dan Barba dan Nickell (1969) yang menjadi perintis teknik kultur jaringan tebu pertama di dunia. Mereka berhasil mendapatkan planlet yang utuh yang berkembang dari kultur kalus. Kalus dapat diinisiasi dari hampir semua jaringan seperti meristem apikal tunas dan akar serta daun muda. Planlet yang diregenerasikan dari kalus menunjukkan variasi yang luas dalam jumlah kromosom beberapa karakter penting dari tanaman tebu. Sejak saat itu teknik kultur jaringan tebu berkembang di beberapa negara di dunia (Naik, 2001).
seperti Knudson C (1946), Murashige dan Skoog (1962), White (1963), Nitsch dan Nitsch (1969), Schenk dan Hildebrant (1972), dan Gamborg’s B-5 (1976).
Media tumbuh tanaman terdiri dari 95% air, nutrisi makro dan nutrisi mikro, vitamin serta gula. Nutrisi makro biasanya dibutuhkan dalam jumlah yang banyak dalam satuan milimolar (mM) sedangkan nutrisi mikro dalam jumlah yang sedikit dalam satuan mikromolar (µM). Vitamin termasuk bahan organik bagian dari enzim atau kofaktor yang esensial untuk fungsi metabolik, yang dibutuhkan dalam jumlah yang sangat sedikit dan berperan penting dalam pertumbuhan tanaman. Gula juga merupakan bagian penting dari nutrisi media yang esensial untuk pertumbuhan dan perkembangan kultur (Trigiano et al, 2000).
Tipe media kultur jaringan yang dipilih tergantung kepada spesies yang akan dikulturkan. Media Murashige dan Skoog (MS) lebih cocok dan kebanyakan digunakan media dasar kultur jaringan untuk regenerasi tanaman dari jaringan dan kalus. Media Gamborg’s B-5 digunakan untuk kultur kalus kedelai dan kultur suspensi. Media tersebut memiliki jumlah nitrat dan garam amonium yang lebih rendah dibandingkan dengan media MS. Media Schenk dan Hildebrant dikembangkan untuk kultur kalus monokotil dan dikotil. Media White digunakan untuk kultur jaringan akar tomat. Konsentrasi garam-garam mineralnya lebih rendah dibandingkan dengan media MS. Media Nitsch’s dikembangkan untuk kultur anther dengan konsentrasi garam-garam mineral lebih sedikit dari media MS tetapi lebih banyak dibandingkan dengan media White (Beyl, 2005).
hilderbrandt (SH) untuk differensiasi akar. Differensiasi akar diinduksi pada kertas saring dalam medium cair (Naik, 2001)
Pusat Penelitian Perkebunan Gula Indonesia (P3GI) telah berhasil mengembangkan media MS yang dimodifikasi untuk perbanyakan secara cepat tanaman tebu melalui teknik kultur jaringan. Induksi kalus tanaman tebu menggunakan media MS-I yaitu media dasar yang dimodifikasi dengan vitamin dan ditambah 3 mg/L 2,4-D.
Untuk mempercepat penampilan sifat totipotensi sangat dianjurkan menggunakan eksplan, organ atau jaringan muda yang masih dalam keadaan meristematis sebagai bahan tanam. Menurut Gunawan (1992), eksplan sebaiknya diambil dari bagian-bagian tanaman yang belum banyak mengalami perubahan bentuk dan kekhususan fungsi seperti meristem batang dan akar, meristem kambium, meristem interkaler, meristem daun dan felogen. Hal-hal penting yang harus diperhatikan dalam pemilihan eksplan yaitu sumber eksplan, ukuran dan umur fisiologi. Hoy et al., (2003) menyatakan bahwa tanaman tebu yang dihasilkan dari kultur jaringan yang eksplannya berasal dari meristem apikal tidak berubah dalam hal pertumbuhan dan karakteristik hasil dan juga didapatkan bibit yang bebas dari penyakit sistemik. Bahan eksplan dari varietas tebu yang berumur 3-4 bulan dan bebas penyakit sering dipakai dalam penelitian kultur jaringan tebu. Perlu diperhatikan cara sterilisasinya karena permukaan bagian eksplan umumnya mengandung sejumlah mikroba kontaminan sehingga sterilisasi permukaan perlu dilakukan sebelum ditanam pada media (Naik, 2001).
Penambahan auksin, sitokinin eksogen mengubah level ZPT endogen sel (Gunawan, 1992).
Auksin berperan dalam beberapa proses perkembangan, termasuk pemanjangan sel dan pembesaran jaringan, dominan apikal, formasi akar adventif, dan embriogenesis somatik. Secara umum, ketika konsentrasi auksin rendah, insisiasi akar terjadi dan ketika konsentrasi tinggi, formasi kalus terjadi. Senyawa sintetik auksin yang paling sering digunakan adalah 1-naftalen asetik acid (NAA), 2,4-diklorofenoksiasetik acid (2,4-D), dan 4-amino-3,5,6-trikloro-2-piridinkarbosilik acid (picloram) (Beyl, 2005). Pembentukan kalus embriogenik dan embriogenesis somatik pada tanaman tebu juga dilakukan oleh Blanco et al., (1997) dengan media dasar MS yang ditambah dengan picloram 8.2 µM, dicamba 22.6 µM dan 2,4-D 4.5 µM. Blanco et al., (1999) menginisiasi kalus embriogenik dengan menggunakan media MS yang ditambah dengan 2,4-diklorofenoksiasetik acid (2,4-D) sebanyak 13.5 µM.
Sitokinin meningkatkan pembelahan sel dan menstimulasi inisiasi dan pertumbuhan tunas in vitro. Sitokinin yang paling banyak digunakan adalah zeatin, dihidrozeatin, kinetin, benziladenine (BA), thidiazuron dan 2-isopentenil adenine (2-iP). Pada konsentrasi tinggi (1-10 mg/L) sitokinin menginduksi formasi tunas adventif, tetapi menghambat formasi akar. Sitokinin meningkatkan formasi tunas aksilar sebaliknya dominan apikal diregulasi oleh auksin (Beyl, 2005). Penambahan 6-benzil amino purin (BAP) pada media MS sangat bagus untuk insiasi tunas. Pemakaian 0.2 mg/L benzil amino purin (BAP) dan 0.2 mg/L kinetin dengan menggunakan media dasar MS dilakukan oleh Hendre et al.,
(1983) untuk multiplikasi tunas pada tanaman tebu (Naik, 2001). Pada umumnya di dalam suatu percobaan kultur jaringan dipergunakan terlebih dahulu BAP dan kinetin yang lebih tahan terhadap degradasi (Wattimena et al., 1992).
tanaman secara in vitro yang optimal seringkali memerlukan adanya cahaya, namun tidak demikian dengan proses pembelahan sel. Pada awal pembelahan sel dari eksplan yang dikulturkan dan pertumbuhan kalus kadang-kadang dihambat oleh adanya cahaya (Wattimena et al, 1992).
Kondisi lingkungan kultur yang ideal pada suhu 25±20C dilengkapi dengan cahaya lampu fluorescens 5000-10000 lux. Kelembaban relatif ruang inkubasi diatur sekitar 70-80%, bila kurang dari 50% maka media yang disimpan akan cepat mengering sedangkan kelembaban yang terlalu tinggi meningkatkan kontaminan seperti jamur dan bakteri (Sugiyarta, 1991). Menurut Naik, (2001), regenerasi tanaman tebu dari kultur meristem apikal dapat dilakukan pada suhu 20-260C dengan waktu cahaya 16 jam 5000-8000 lux.
2.6. Analisis Tanaman Transgenik
Analisis tanaman transgenik dapat dilakukan dengan beberapa cara antara lain, visual, histokimia dan molekular. Pengamatan secara visual antara lain dilakukan jika T-DNA yang terintegrasi memiliki gen pelapor seperti gfp. Pengamatan dapat dilakukan mulai fase kalus hingga tanaman dewasa, dengan tidak merusak jaringan atau sel.
Integrasi gen sisipan pada tanaman hasil transformasi dapat dianalisis secara molekular menggunakan teknik PCR. PCR merupakan singkatan dari
dari 30-mer sangat jarang digunakan. DNA target yang diamplifikasi hendaknya tidak lebih dari 3 kb karena ukuran ideal untuk PCR adalah bila DNA yang akan diamplifikasi kurang dari 1 kb (Brown, 1996).
Selama amplifikasi, dalam setiap siklus terjadi 3 tahap perubahan suhu. Tahap pertama DNA adalah denaturasi yang umumnya dilakukan pada suhu 94°C. Saat denaturasi, DNA yang semula utas ganda terurai menjadi utas tunggal karena ikatan hidrogennya lepas. Tahap kedua suhu diturunkan sehingga memungkinkan primer menempel (annealing) pada DNA cetakan (target). Tahap ketiga terjadi pemanjangan DNA (sintesis), biasanya pada suhu 74°C sehingga memungkinkan enzim DNA polimerase bekerja.
III. BAHAN DAN METODE
3.1. Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Bioteknologi Tanaman, Departemen Budidaya Pertanian, Fakultas Pertanian IPB, Indonesian Centre for Biodiversity and Biotechnology (ICBB), Bogor dan PT. Saraswanti Indo Genetech (SIG), Bogor. Penelitian dimulai dari bulan Februari 2005 sampai Desember 2006.
3.2. Bahan dan Alat
Bahan tanaman yang digunakan untuk transformasi dan regenerasi adalah kalus tebu kultivar CB 6979, dan PA 183 yang berasal dari eksplan bagian daun muda yang masih menggulung dari pucuk tebu berumur 4 sampai 6 bulan. Plasmid rekombinan yang digunakan adalah pBIN1-ECS yang membawa gen fitase dan marka seleksi kanamisin melalui Agrobacterium tumefaciens GV 2260. Media untuk pertumbuhan kultur A. tumefaciens adalah media LB (komposisi media disajikan pada lampiran 1). Bahan untuk media tanam antara lain media induksi kalus dan media regenerasi (komposisi media disajikan pada lampiran 2). Bahan untuk isolasi DNA tanaman antara lain 250 mM NaOH, 250 mM HCl, dan buffer sample (500 mM Tris-HCl, 0.25 % (v/v) Triton X-100.
Alat yang digunakan dalam penelitian ini antara lain pinset, lampu spritus, pisau, alat-alat gelas, laminar air flow cabinet, otoklaf, botol media, rak kultur, lemari es, kertas aluminium, inkubator, spektrofotometer, sentrifus, tabung eppendorf, mikro filter, pipet mikro dan tip, mortal dan penumbuk, water bath,
perangkat elektroforesis, sarung tangan dan alat PCR.
3.3. Metode Penelitian
Penelitian ini terdiri dari dua bagian yaitu : 1) optimasi media regenerasi tanaman tebu, dan 2) transformasi tanaman tebu dengan gen fitase.
3.3.1. Kultur jaringan tanaman tebu 3.3.1.1. Sterilisasi dan Penanaman Eksplan
jaringan yang sehat. Pucuk tebu tersebut dipotong sepanjang 20 cm tepat di atas meristem. Sterilisasi dengan cara pencelupan ke dalam alkohol 70% dan dibakar di atas nyala api spiritus. Sterilisasi diulang sampai 3 kali sambil membuka dan membuang lapisan daun pucuk hingga diperoleh daun muda yang masing menggulung dan dipotong berukuran 2 – 3 mm sebanyak 10 potong.
Penanaman eksplan dilakukan dengan menggunakan pinset pada media MS-I (Lampiran 2) dalam kondisi gelap, masing-masing botol kultur diisi 5 potong eksplan, kemudian ditutup dengan kertas aluminium. Semua pekerjaan sterilisasi dan penanaman eksplan dilakukan dalam kabinet air flow. Botol-botol kultur yang telah ditanami eksplan selanjutnya disimpan dalam ruang inkubasi selama 1 bulan sampai diperoleh kalus yang mempunyai struktur kompak dan mampu berproliferasi. Setelah satu bulan kalus disubkultur pada media MS-I. 3.3.1.2. Regenerasi Tanaman Tebu
Pada tahap regenerasi kalus menjadi planlet disusun dengan menggunakan Rancangan Acak Lengkap. Penelitian ini dibagi menjadi dua tahap yaitu tahap : 1) regenerasi kalus pada media optimasi regenerasi; 2) regenerasi kalus transforman pada media optimasi regenerasi.
Tahap regenerasi kalus pada media optimasi regenerasi dilakukan menggunakan Rancangan Acak Lengkap Faktorial 3 x 3 dengan 5 ulangan. Yang terdiri dari faktor A adalah konsentrasi BAP yang terdiri dari 3 taraf, yaitu :
A1. 0.50 mg/L A2. 0.75 mg/L A3. 1.00 mg/L
Faktor B adalah konsentrasi kinetin yang terdiri dari 3 taraf, yaitu : B1. 0.0 mg/L
B2. 0.2 mg/L B3. 0.4 mg/L
Model rancangannya adalah : Yijk = µ + αi + βj + (αβ)ij + εijk µ : Nilai rataan umum
αi : Pengaruh kosentrasi BAP pada media optimasi regenerasi ke-i (i = 0.50 ; 0.75 ; 1.00)
βj : Pengaruh konsentrasi kinetin pada media optimasi regenerasi ke-j (j = 0 ; 0.2 ; 0.4)
(αβ)ij : Pengaruh interaksi antara konsentrasi BAP pada media optimasi regenerasi ke-i dan konsentrasi kinetin pada media optimasi regenerasi ke-j
εijk : Pengaruh galat percobaan konsentrasi BAP pada media optimasi regenerasi ke-i dan konsentrasi kinetin pada media regenerasi ke-j dan ulangan ke-k
Yijkl : Nilai pengamatan
Setelah tunas tumbuh dipindahkan ke media cair dan bagian basalnya dipotong untuk induksi akar. Tahap induksi perakaran dilakukan menggunakan Rancangan Acak Lengkap Faktorial 2 x 4 dengan 5 ulangan, yang terdiri dari faktor A adalah kultivar tebu yaitu :
A1. CB 6879 A2. PA 183
Faktor B media perakaran yang terdiri dari 4 taraf, yaitu : B1. 0.25 mg/L IBA dan 0.20 mg/L IAA
B2. 0.25 mg/L IBA dan 0.50 mg/L IAA B3. 0.50 mg/L IBA dan 0.20 mg/L IAA B4. 0.50 mg/L IBA dan 0.50 mg/L IAA
Model rancangannya adalah : Yijk = µ + αi + βj + (αβ)ij + εijk µ : Nilai rataan umum
αi : Pengaruh kultivar tebu ke-i (i = 1, 2)
βj : Pengaruh IBA dan IAA pada media induksi perakaran ke-j (j = 0.25:0.20 ; 0.25:0.50 ; 0.50:0.20 ; 0.50:0.50)
(αβ)ij : Pengaruh interaksi antara kultivar tebu ke-i dengan IBA dan IAA pada media induksi perakaran ke-j
εijk : Pengaruh galat percobaan kultivar tebu ke-i dan IBA dan IAA pada media induksi perakaran ke-j, ulangan ke-k
Yij : Nilai pengamatan
Media optimasi regenerasi yang diperoleh dari regenerasi kalus ini dipakai pada tahap regenerasi kalus transforman.
3.3.2. Transformasi Kalus Tebu dengan Gen Fitase (Santosa et al, 2004 yang dimodifikasi)
3.3.2.1. Penyiapan Kalus untuk Transformasi
Kalus yang embriogenik dipotong dengan ukuran 2-3 mm. Sekitar 20 kalus direndam dalam 15 mL media MScd dan diinkubasi dalam kondisi gelap 28°C sambil digoyang selama satu minggu pada 60 rpm. Tujuh jam sebelum ko-kultivasi dengan Agrobacterium, kalus ditambahkan dengan 75µL antioksidan. 3.3.2.2. Penyiapan A.tumefaciens GV2260 pBIN1-ECS untuk Transformasi
Satu koloni Agrobacterium dari media padat ditumbuhkan pada 5 mL media LB yang mengandung kanamisin 50 mg/L dan rifampisin 50 mg/L, pada suhu 28°C dan digoyang pada 150 rpm, selanjutnya diukur OD578 = 0.5 lalu dibagi ke dalam 2 mL eppendorf dan disentrifus 2000 x g selama 10 menit. Pelet dicuci dengan media cair MScd lalu disentrifus lagi dan ditambahkan MScdao kemudian diukur lagi nilai OD578 = 0.2. Suspensi bakteri siap digunakan untuk transformasi. 3.3.2.3. Transformasi Kalus Tebu dengan Gen Fitase
mengurangi cairan suspensi bakteri. Kalus yang telah dikeringkan tadi dimasukkan ke dalam 30 mL MS yang mengandung 0.5 g/L kasein hidrolisat, 100 mg/L asetosiringon dan 50 mg/L kanamisin, diinkubasi pada kondisi gelap suhu 28°C dan digoyang 60 rpm selama 2 hari. Bila ditemukan pertumbuhan
Agrobacterium pada media maka media diganti dengan media baru. Setelah ko-kultivasi kalus dicuci dengan air steril sebanyak 2 kali, keringkan pada kertas saring steril, kemudian transfer pada 25 ml MS yang mengandung 0.5 g/L kasein hidrolisat, cefotaksim 1000 mg/L, inkubasi pada kondisi gelap 28oC dan digoyang pada 60 rpm selama 2 jam. Selanjutnya kalus ditransfer ke dalam 30 mL media MS padat yang mengandung 0.5 mg/L kasein hidrolisat, 500 mg/L cefotaksim lalu diinkubasi dengan kondisi gelap pada 28oC selama 1 minggu, selanjutnya ganti media dengan media MS yang mengandung 0.5 mg/L kasein hidrolisat, 500 mg/L cefotaksim, 100 mg/L kanamisin dan kultur selama 2 minggu atau lebih untuk memastikan tidak ada pertumbuhan bakteri (Ananda, 2004). Selanjutnya kalus ditanam pada media MS I dengan kanamisin 150 mg/L untuk mendapatkan struktur yang kompak dan mampu berproliferasi, setelah sebulan kalus disubkultur dan selanjutnya dapat diregenerasikan pada media dasar MS dengan zat pengatur tumbuh BAP, Kinetin, IBA dan IAA.
3.3.3. Pengujian Molekuler 3.3.3.1. Ekstraksi DNA
3.3.3.2. Amplifikasi DNA
Hasil ekstraksi DNA tanaman tebu digunakan untuk amplifikasi DNA dengan teknik PCR. Primer yang digunakan adalah primer spesifik untuk gen fitase. Primer gen fitase yang digunakan adalah 5’ – CA GGC TCT ATC CGC TAA TCG – 3’ dan 5’ – GG CGC GGT GGG GCA ATA ATC – 3’. Reaksi diatur sebagai berikut; denaturasi pada 940C selama 30 detik, annealing pada 580C selama 30 detik dan ekstension pada 720C selama 45 detik. Jumlah setiap campuran reaksi sebanyak 25 µL yang terdiri dari 12.5 µL Master Mix; 1.25 µL masing-masing primer spesifik untuk gen fitase; 1.5 µL DNA tanaman transgenik putatif atau kontrol serta 8.5 µL ddH2O. Reaksi dijalankan sebanyak 30 siklus. Selanjutnya DNA hasil amplifikasi dimasukkan dalam sumur gel agarose 2%. Elektroforesis dijalankan selama 45 menit pada 115V dalam buffer 0.5 TAE, kemudian direndam dalam ethidium bromide 10µg/mL lalu dilihat pada UV transsiluminator.
3.3.4. Uji Aktifitas Enzim Fitase Pada Tebu Transforman dan Non Transforman (Greiner, 2005)
Sebanyak 0.1 g daun tebu transforman dihaluskan menggunakan mortar dan kemudian ditambah 350 μl natrium asetat 0.1 M pH 5.0. Larutan kemudian diinkubasi selama 3 jam pada suhu 4°C sambil distirer atau dishaker. Setelah itu disentrifugasi pada 1200g selama 15 menit dan didapatkan supernatant sebagai sumber enzim fitase sebanyak 50 μl. Sumber enzim fitase sebanyak 50 μl ditambah dengan 350 μl natrium asetat 0.1 M pH 4.5 yang mengandung 1.5 mM fitat, diinkubasi selama 30 menit pada suhu 37°C. Kemudian untuk menghentikan reaksi enzim fitase ditambahkan 1500 µl larutan AAM (aseton : 5N sulfuric acid : 10 µM ammonium molybdate dengan perbandingan 1 : 1 : 2) pada larutan hasil inkubasi. Setelah itu 100 µl 1 M asam sitrat ditambahkan sebagai larutan penstabil reaksi enzim fitase tersebut dan ukur OD pada 355 nm.
mengetahui besarnya aktivitas enzim fitase maka setelah diukur kepekatan warna kuningnya (OD) menggunakan spektrofotometer pada panjang gelombang 35 nm selanjutnya dihitung menggunakan rumus sebagai berikut :
U = ΔE . Volume total ml Σ.t Volume enzim
ΔE = Esampel - Eblanko
Σ = 8.7 cm2 µmol-1
T = 30 menit ; Volume total = 2000 µl ; Volume enzim = 50 µl
IV. HASIL DAN PEMBAHASAN
4. 1. Kultur Jaringan Tanaman Tebu
4.1.1. Sterilisasi dan Penanaman Eksplan
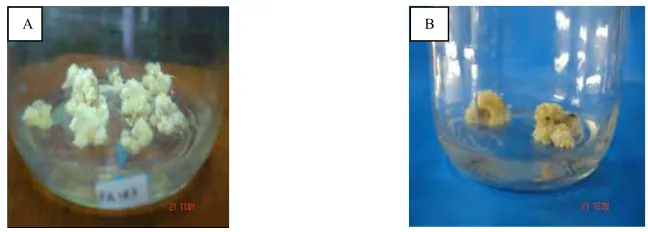
Eksplan yang ditanam pada media MS yang ditambah 3 mg/L 2,4-D dalam kondisi gelap menghasilkan kalus yang kompak, embriogenik, berwarna putih dan kuning (Gambar 2). 2,4-D yang ditambahkan pada media mampu untuk menginduksi kalus pada eksplan tebu dan menghasilkan kalus yang berwarna putih (Chengalrayan dan Meagher, 2001;Mamun et al, 2004).
Gambar 2. A) Kalus PA 183 berumur 1 bulan pada media MS I; B) Kalus CB 6979 berumur 1 bulan pada media MS I
4.1.2. Regenerasi Tanaman Tebu
4.1.2.1. Regenerasi pada kultivar PA 183
Dari Tabel 1 dapat dilihat bahwa pada pengamatan minggu ke-3 sampai dengan minggu ke-5 penambahan BAP, kinetin dan interaksi antara BAP dan kinetin berpengaruh nyata terhadap jumlah tunas kalus tebu kultivar PA 183. Media dengan penambahan BAP 0.75 mg/L dan kinetin 0.2 mg/L merupakan komposisi media yang menghasilkan jumlah tunas terbanyak.
Tabel 1. Rata-rata jumlah tunas kalus tebu kultivar PA 183 pada minggu ke-3
1.00 8.65c 7.65c 9.55c 8.61B Rata-rata 9.68CD 10.68C 8.36D
Minggu ke-4
0.50 9.10cd 11.65bc 8.90d 9.88B
0.75 13.10b 16.00a 9.70cd 12.93A
1.00 9.70cd 9.30cd 10.90bcd 9.96B
Rata-rata 10.63D 12.31C 9.83D Minggu ke-5
0.50 10.95c 13.40b 10.40c 11.58B
0.75 15.95a 17.85a 10.30c 14.70A
1.00 10.00c 9.70c 11.00c 10.23C
Rata-rata 12.30E 13.65D 10.56F Ket : nilai-nilai yang diikuti oleh huruf sama tidak berbeda nyata pada taraf 0.05 uji Duncan nilai-nilai yang diikuti oleh huruf kapital sama tidak berbeda nyata pada taraf 0.05 uji
Duncan
Tabel 2. Rata-rata jumlah daun kultur in vitro tebu kultivar PA 183 pada minggu ke-3 sampai minggu ke-5
Kinetin (mg/L) BAP (mg/L)
0.0 0.2 0.4 Rata-rata
Minggu ke-3
0.50 4.05bc 4.00bc 2.30c 3.45C
0.75 4.80abc 5.45ab 5.75ab 5.33B
1.00 7.55a 6.35ab 7.05a 6.98A
Rata-rata 5.47D 5.27D 5.03D Minggu ke-4
0.50 5.20bc 5.85bc 4.05c 5.03B
0.75 7.60abc 9.65a 6.90abc 8.05A
1.00 8.85ab 7.35abc 8.55ab 8.25A
Rata-rata 7.22C 7.62C 6.50C
Minggu ke-5
0.50 6.55c 7.80bc 6.15c 6.83B
0.75 10.85ab 13.25a 7.75bc 10.62A
1.00 9.75abc 8.00bc 9.35abc 9.83A
Rata-rata 9.05C 9.68C 7.75C
Ket : nilai-nilai yang diikuti oleh huruf sama tidak berbeda nyata pada taraf 0.05 uji Duncan nilai-nilai yang diikuti oleh huruf kapital sama tidak berbeda nyata pada taraf 0.05 uji
Pada Tabel 2 dapat dilihat bahwa penambahan BAP, kinetin dan interaksi antara BAP dan kinetin berpengaruh nyata terhadap jumlah daun kultur in vitro
tebu kultivar PA 183. Rata-rata jumlah daun terbanyak pada minggu ke-3 dihasilkan pada media dengan penambahan BAP 1.0 mg/L dan kinetin 0.0 mg/L. Sedangkan pada minggu ke-4 dan minggu ke-5 rata-rata jumlah daun terbanyak dihasilkan pada media dengan penambahan BAP 0.75 mg/L dan kinetin 0.2 mg/L. BAP dan kinetin merupakan zat pengatur tumbuh sitokinin. Sitokinin adalah kelompok senyawa organik yang menyebabkan pembelahan sel. Pembelahan sel dapat meningkatkan regenerasi tunas secara in vitro, yang menstimulasi formasi meristem tunas apikal dan tunas pucuk. Sitokinin dapat menyebabkan keluarnya dominan tunas apikal, yang dengan demikian menstimulasi pertumbuhan tunas lateral dan menghasilkan multiplikasi formasi tunas (Gaba, 2005).
4.1.2.2. Regenerasi pada kultivar CB 6979
Tabel 3. Rata-rata jumlah tunas kultur in vitro tebu kultivar CB 6979 pada minggu ke-3 sampai minggu ke-5
Kinetin (mg/L)
Rata-rata 7.93D 8.26D 12.66C Minggu ke-4
0.50 5.60c 6.35c 16.00a 9.31B
0.75 14.45ab 14.35ab 15.45a 14.75A
1.00 12.30b 11.95b 16.90a 13.71A
Rata-rata 10.78D 10.88D 16.11C Minggu ke-5
0.50 6.20d 6.55d 19.70a 10.81C
0.75 17.85a 17.50ab 18.30a 17.88A
1.00 15.30bc 13.25c 18.95a 15.81B
Rata-rata 13.11E 12.43E 18.98D Ket : nilai-nilai yang diikuti oleh huruf sama tidak berbeda nyata pada taraf 0.05 uji Duncan nilai-nilai yang diikuti oleh huruf kapital sama tidak berbeda nyata pada taraf 0.05 uji
Duncan
Tabel 4. Rata-rata jumlah daun kultur in vitro tebu kultivar CB 6979 pada minggu ke-3 sampai minggu ke-5
Kinetin (mg/L)
Rata-rata 7.75D 7.17D 12.30C Minggu ke-5
0.50 7.00c 5.55c 17.90a 10.15B
0.75 15.70ab 13.00b 15.10ab 14.60A
1.00 12.00b 12.80b 18.30a 14.37A
Rata-rata 11.57D 10.45D 17.10C Ket : nilai-nilai yang diikuti oleh huruf sama tidak berbeda nyata pada taraf 0.05 uji Duncan nilai-nilai yang diikuti oleh huruf kapital sama tidak berbeda nyata pada taraf 0.05 uji
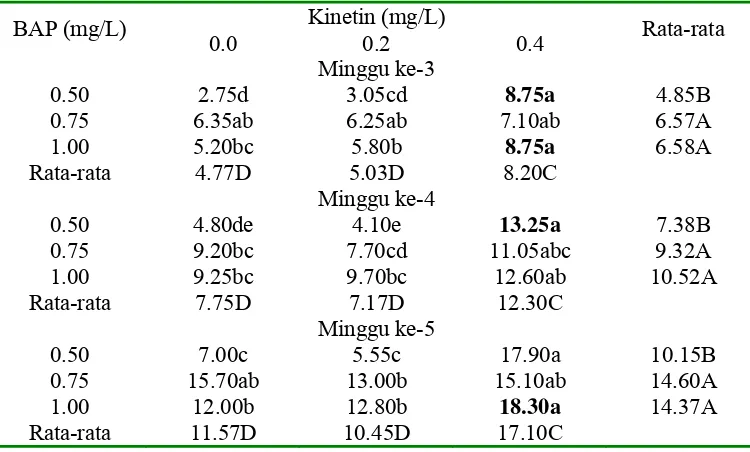
Pada Tabel 4, penambahan BAP, kinetin dan interaksi antara BAP dan kinetin berpengaruh nyata terhadap jumlah daun kultur in vitro tebu kultivar CB 6979. Rata-rata jumlah daun terbanyak pada minggu ke-3 sampai minggu ke-4 dihasilkan pada media dengan penambahan BAP 0.5 mg/L dan kinetin 0.4 mg/L. Sedangkan pada minggu ke-5 rata-rata jumlah daun terbanyak dihasilkan pada media dengan penambahan BAP 1.0 mg/L dan kinetin 0.4 mg/L.
Penambahan BAP 0.5 mg/L sudah mampu untuk menginduksi tunas kalus dan jumlah daun kultur in vitro tebu kultivar CB 6979 begitu juga dengan penambahan kinetin 0.4 mg/L mampu untuk menginduksi tunas kalus dan jumlah daun kultur in vitro tebu kultivar CB 6979. Sejalan dengan penelitian Haenz dan Mae (tahun 1969 dalam Naik, 2001) menyatakan bahwa untuk inisiasi tunas eksplan tebu pada media MS ditambahkan air kelapa dan BAP 0,5 mg/l. Kane, (2005) menyatakan bahwa konsentrasi dan tipe sitokinin menjadikan dasar kecepatan multiplikasi tunas, dan panjang tunas. Tergantung pada spesies, ada atau tidak ada auksin eksogen, sitokinin meningkatkan induksi proliferasi tunas aksilar.
4.1.2.3. Induksi perakaran
Tabel 5. Rata-rata jumlah akar planlet tebu kultivar CB 6979 & PA 183 pada media perakaran pada minggu ke-4 sampai minggu ke-6
Media Akar
Rata-rata 3.30D 5.55C 5.25C 4.95C
Minggu ke-5
Ket : nilai-nilai yang diikuti oleh huruf sama tidak berbeda nyata pada taraf 0.05 uji Duncan nilai-nilai yang diikuti oleh huruf kapital sama tidak berbeda nyata pada taraf 0.05 uji
Duncan
Tabel 6. Rata-rata jumlah tunas planlet tebu kultivar PA 183 & CB 6979 pada media perakaran pada minggu ke-4 sampai minggu ke-6
Media Akar
Ket : nilai-nilai yang diikuti oleh huruf sama tidak berbeda nyata pada taraf 0.05 uji Duncan nilai-nilai yang diikuti oleh huruf kapital sama tidak berbeda nyata pada taraf 0.05 uji
Duncan
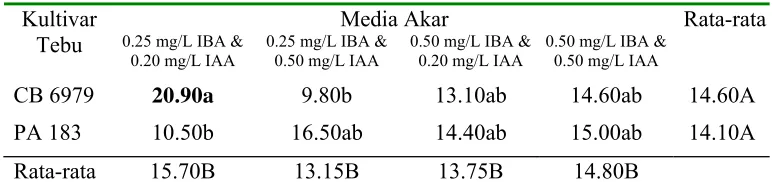
Rata-rata jumlah daun pada media perakaran planlet tebu kulivar PA 183 dan CB 6979 yang diamati pada minggu ke-6 dapat dilihat pada tabel 7. Kultivar tebu dan media akar tidak memberikan pengaruh yang nyata pada rata-rata jumlah daun planlet tebu sedangkan interaksi antara kultivar tebu dengan media akar berpengaruh nyata terhadap rata-rata jumlah daun. Media perakaran dengan penambahan 0.25 mg/L IBA dan 0.20 mg/L IAA memberikan hasil rata-rata jumlah daun terbanyak pada tebu kultivar CB 6979. Jumlah daun terbanyak pada tebu kultivar PA 183 dihasilkan pada media perakaran dengan penambahan 0.25 mg/L IBA dan 0.50 mg/L IAA
Tabel 7. Rata-rata jumlah daun pada media perakaran planlet tebu kultivar PA 183 & CB 6979 pada minggu ke-6
Media Akar
Rata-rata 15.70B 13.15B 13.75B 14.80B
Ket : nilai-nilai yang diikuti oleh huruf sama tidak berbeda nyata pada taraf 0.05 uji Duncan nilai-nilai yang diikuti oleh huruf kapital sama tidak berbeda nyata pada taraf 0.05 uji
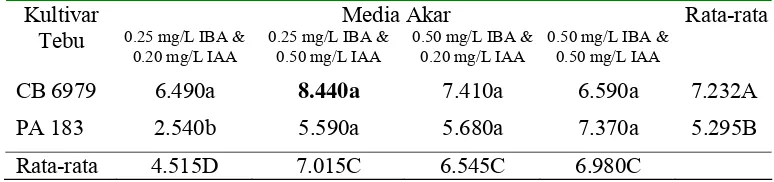
Panjang akar planlet tebu kultivar CB 6979 dan PA 183 pada media perakaran yang diamati pada minggu ke-6 dapat dilihat pada tabel 8. Planlet tebu kultivar CB 6979 memberikan hasil panjang akar yang lebih panjang dari planlet tebu kultivar PA 183. Media perakaran dengan penambahan 0.25 mg/L IBA dan 0.50 mg/L IAA memberikan hasil panjang akar terpanjang pada planlet tebu kultivar CB 6979 dan media perakaran dengan penambahan 0.50 mg/L IBA dan 0.50 mg/L IAA memberikan hasil panjang akar terpanjang pada planlet tebu kultivar PA 183.
Tabel 8. Rata-rata panjang akar (cm) planlet tebu kultivar CB 6979 dan PA 183 pada minggu ke-6
Rata-rata 4.515D 7.015C 6.545C 6.980C
Ket : nilai-nilai yang diikuti oleh huruf sama tidak berbeda nyata pada taraf 0.05 uji Duncan nilai-nilai yang diikuti oleh huruf kapital sama tidak berbeda nyata pada taraf 0.05 uji
Duncan
Gambar 3. Planlet tebu pada media perakaran; A) planlet tebu kultivar CB 6979 pada media perakaran dengan penambahan 0.25 mg/L IBA dan 0.50 mg/L IAA; B) planlet tebu kultivar PA 183 pada media perakaran dengan penambahan 0.50 mg/L IBA dan 0.50 mg/L IAA; C) planlet tebu kultivar PA 183 pada media perakaran dengan penambahan 0.25 mg/L IBA dan 0.20 mg/L IAA.
4.2. Transformasi Kalus Tebu Kultivar CB 6979 dan PA 183 dengan Gen Fitase
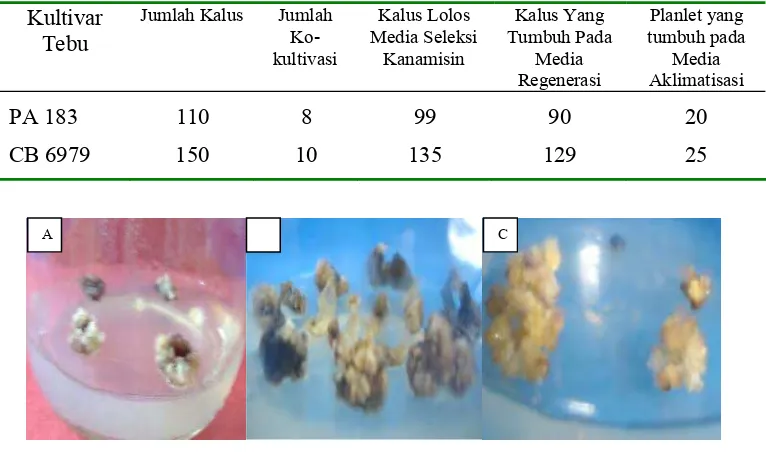
Kalus yang tumbuh dan bersih dari kontaminasi menggunakan metode ini mencapai 90%. Kalus PA 183 dan CB 6979 yang tumbuh pada media seleksi kanamisin berjumlah 99 kalus untuk kultivar PA 183 dan 135 kalus kultivar CB 6979. Hasil kalus yang dapat tumbuh pada media seleksi dapat dilihat pada gambar 4. Kalus PA 183 dan CB 6979 yang tumbuh pada media seleksi kanamisin, selanjutnya ditanam pada media regenerasi tunas dan perakaran.
Pada tabel 9 menunjukkan bahwa kalus kultivar tebu PA 183 transforman dan kalus kultivar CB 6979 transforman yang ditanam pada media regenerasi mampu tumbuh menjadi planlet transforman. Pada kultivar PA 183 kalus yang mampu tumbuh menjadi planlet sebanyak 90 sedangkan pada kultivar CB 6979 sebanyak 129 planlet. Warna daun yang terjadi pada planlet transforman bervariasi, yaitu albino (20%), hijau kekuningan (10%), belang hijau albino (10%) dan hijau (60%) (Gambar 5 dan 6). Selanjutnya planlet transforman tebu kultivar PA 183 dan CB 6879 diaklimatisasi. Tidak semua planlet transforman tebu kultivar PA 183 dan CB 6979 mampu tumbuh pada media aklimatisasi, hal ini disebabkan oleh warna daun yang bervariasi pada masing-masing planlet, planlet dengan warna daun hijau yang mampu tumbuh. Selanjutnya planlet inilah yang digunakan untuk analisis molekuler gen fitase dengan PCR dan uji nilai aktivitas fitase.
Tabel 9. Jumlah kalus tebu kultivar PA 183 dan CB 6979 hasil transformasi Kultivar
Tebu
Jumlah Kalus Jumlah Ko-kultivasi
Kalus Lolos Media Seleksi
Kanamisin
Kalus Yang Tumbuh Pada
Media Regenerasi
Planlet yang tumbuh pada
Media Aklimatisasi
PA 183 110 8 99 90 20
CB 6979 150 10 135 129 25
Gambar 4. A) Kalus PA 183 transgenik pada media seleksi; B) kalus CB 6979 transgenik pada media seleksi; C) kalus PA 183 transgenik pada media seleksi.
Gambar 5. Planlet tebu transforman kultivar PA 183; A) planlet yang berwarna hijau muda; B) planlet yang berwarna hijau; C) planlet yang berwana albino dan hijau muda; D) planlet yang berwarna belang hijau dan albino.
A B C D
Gambar 6 Planlet tebu transforman kultivar CB 6979; A) planlet yang berwarna hijau dan hijau muda; B) planlet yang berwarna hijau kekuningan; C) planlet yang berwarna albino; D) planlet yang berwarna hijau dan albino.
4.3 Pengujian Molekuler 4.3.1. Amplifikasi DNA
Analisis molekuler dilakukan untuk melihat integrasi gen didalam genom tanaman. Isolasi DNA dilakukan pada planlet tebu transforman yang sudah diaklimatisasi selama 2 bulan. DNA genom total planlet tebu transforman dan non transforman kultivar PA 183 dan CB 6979 yang berhasil diisolasi kemudian diamplifikasi menggunakan primer spesifik gen fitase. Dari Gambar 7 tampak pita yang muncul berukuran 900 bp menunjukkan bahwa gen fitase yang diintroduksi berhasil masuk kedalam genom tanaman tebu.
Gambar 7. Elektroforesis hasil PCR planlet beberapa kultivar tebu. (1) PA 175; (2) CB 6979; (3) (K+) kontrol positif ; (4) PSJT 9441; (5) PS 851 pBIN1PI-IIEC; (6) Marker 1 Kb Plus DNA Ladder (Invitrogen); (7) kalus CB 6979 pBIN1-ECS; (8) CB 6879 pBIN1-ECS.
4.3.2 Uji Aktifitas Enzim Fitase Pada Planlet Tebu Transforman dan Non Transforman
Tabel 10 menunjukkan bahwa nilai uji aktivitas fitase pada tebu transforman lebih tinggi dibandingkan dengan tebu non transforman. Nilai uji aktivitas fitase pada kultivar tebu CB 6979 transforman tertinggi sebesar 0.123 U/ml dan pada kultivar PA 183 transforman nilai uji aktivitas fitase tertinggi sebesar 0.116 U/ml. Uji aktivitas fitase yang dilakukan Wulandari (2005) pada kalus transforman kultivar PA 183 sebesar 0.02850 U/ml, adanya peningkatan aktivitas fitase pada planlet tebu transforman ini diduga disebabkan karena planlet telah ditanam di lapang sehingga enzim fitase lebih aktif menghidrolisis fitat yang ada di daerah perakaran. Bila konsentrasi substrat meningkat aktivitas katalitik konsentrasi enzim tertentu akan meningkat mengikuti pola hiperbolik mendekati kecepatan maksimalnya yang khas (Lenhninger, 1990).
1000 bp
900 bp
Tabel 10. Nilai uji aktivitas fitase dan hasil PCR pada tebu kultivar PA 183 dan CB 6979
Kultivar Tebu Nilai Uji Aktivitas Fitase (U/ml) Hasil PCR
PA 183 non transforman 0.056 -
CB 6979 non transforman 0.089 -
CB 6979 transforman 1 0.093 +
Kalus tebu kultivar PA 183 dan CB 6979 yang dikultur pada media regenerasi dan induksi perakaran memberikan respon yang berbeda terhadap penambahan sitokinin dan auksin. Kalus hampir selalu dapat dihasilkan dari satu jenis eksplan pada beberapa varietas yang dikulturkan pada medium yang sama, namun kalus yang dihasilkan dari masing-masing varietas mungkin saja memiliki daya organogenetik yang berbeda antara satu dengan lainnya, walaupun diberi perlakuan yang sama. Pertumbuhan dan perkembangan kultur secara in vitro
diperlukan komposisi dan atau konsentrasi zat pengatur tumbuh yang berbeda untuk satu varietas dengan varietas lain dari suatu jenis tanaman (Wattimena, et al., 1992).
V. SIMPULAN DAN SARAN
5.1. SIMPULAN
1. Media optimum regenerasi kalus tebu kultivar PA 183 yang didapat adalah media MS dengan penambahan BAP 0.75 mg/L dan kinetin 0.2 mg/L. 2. Media optimum regenerasi kalus tebu kultivar CB 6979 yang didapat
adalah media MS dengan penambahan BAP 0.50 mg/L dan kinetin 0.4 mg/L.
3. Media optimum perakaran planlet tebu kultivar CB 6979 yang didapat adalah media MS dengan penambahan IBA 0.25 mg/L dan IAA 0.50 mg/L untuk jumlah akar dan panjang akar, dan media MS dengan penambahan IBA 0.25 mg/L dan IAA 0.20 mg/L untuk jumlah tunas dan jumlah daun. 4. Media optimum perakaran planlet tebu kultivar PA 183 yang didapat
adalah media MS dengan penambahan IBA 0.50 mg/L dan IAA 0.50 mg/L untuk jumlah akar dan panjang akar, dan media MS dengan penambahan IBA 0.25 mg/L dan IAA 0.20 mg/L untuk jumlah tunas dan jumlah daun. 5. Kalus tebu PA 183 dan CB 6979 yang diintroduksi menggunakan gen
fitase dengan perantara A. tumefaciens GV 2260 (pBIN1-ECS) berhasil ditumbuhkan pada media seleksi transforman.
6. Planlet tebu transgenik PA 183 dan CB 6979 setelah dilakukan PCR ternyata secara visualisasi menunjukkan adanya pita hasil amplifikasi berukuran 900 bp.
7. Hasil uji aktivitas fitase pada planlet tebu transforman dan non transforman menunjukkan adanya akivitas fitase yang lebih tinggi pada planlet tebu transforman yaitu pada planlet tebu CB 6979 pBIN1-ECS sebesar 0.123 U/ml dan PA 183 pBIN1-ECS sebesar 0.116 U/ml.
5.2. SARAN
Daftar Pustaka
Ananda, RR Woro Umayi. 2004. Studi transformasi pada tebu dengan perantara
Agrobacterium tumafaciens GV 2260 (pMA) serta regenerasi kalus transgenik. Tesis. Sekolah Pascasarjana. IPB. 63 hlm.
Beyl AC. 2005. Getting started with tissue culture, media preparation, sterile technique, and laboratory equipment. Di dalam Trigiano, N.Robert and Gray, J. Dennis (ed). Plant Development and Biotechnology. CRC Press. P : 19 – 38.
Blanco AM, Nieves N, Sanchez M, Borroto GC, Castillo R, Gonzalez LJ, Escalona M, Baez E dan Hernandez Z. 1997. Protein changes associated with plant regeration in embryogenic calli of sugarcane (Saccharum sp). Plant Cell, Tissue and Organ Culture 51. P : 153 – 158.
Brown TA. 1996. Gene cloning an introduction. Champan & Hall.
Caponetti DJ, Gray JD and Trigiano NR. 2005. History of plant tissue and cell culture. Di dalam Trigiano, NR dan Gray JD (ed) Plant Development and Biotechnology. CRC Press. P : 9 – 15.
Cheng M, Fry JE, Peng S, Zou H, Hironaka R, Duncan DR, Connor TW dan Wan Y. 1997. Genetic transformation of wheat mediated by Agrobacterium tumefaciens. Plant Physiol 115. P : 971 – 980.
Chengalrayan K dan Gallo-Meagher M. 2001. Effect of various growth regulators on shoot regeneration of sugarcane. In Vitro Cell. Dev. Biol. Plant 37. P : 434 – 439.
Cosgrove DJ. 1980. Inositol phosphates, their chemistry, biochemistry and physiology. New York, Elsevier Scientific Publishing Company.
Davies JP. 1995. The plant hormones : their nature, occurrence, and functions. Di dalam Davies JP (ed). Plant hormones : physiology, biochemistry and molecular biology. Kluwer Academic Publishers. p. 1 – 12.
Dewan Gula Nasional. 2003. Statistik perkembangan gula Indonesia 2002-2003. Direktorat Jenderal Bina Produksi Perkebunan. Deptan. Jakarta.
Gaba PV. 2005. Plant growth regulators in plant tissue culture and development. Di dalam Trigiano, NR dan Gray JD (ed). Plant development and biotechnology. CRC Press. P : 241 – 250.
Gelvin BS. 2003. Agrobacterium-mediated plant transformation : the Biology behind the “Gene-Jockeying” tool. Microbiology and Molecular Biology Reviews. Vol. 67. No. 1. p. 16-37.
Gustavo AR, Gonzales-Cabrera J, Vazquez-Padron R dan Ayra-Pardo C. 1998.
Agrobacterium tumefaciens : A natural tool for plant transformation. molecular biology and genetic. Plant Biotechnology Electric Jurnal Biotechnology. Vol. 1. No. 3.
Greiner R. 2005. Procedure phytase activity from callus. [Tidak dipublikasikan]. Greiner R, Konietzny U, Jany KD. 1993. Purification and characterization of two
phytases from Escherichia coli. Arch Biochem Biophys 303. P : 107 – 113.
Haris N dan. Mathius NT. 1995. Teknologi in vitro untuk pengadaan bibit tanaman perkebunan. Warta Pusat Penelitian Bioteknologi Perkebunan. 1(1):hal 2-9.
Hartatik S. 2000. Studi genetik plasma nutfah tebu (Saccharum spp) berdasarkan penanda morfologi, agronomi dan isozim. Disertasi. Program Pascasarjana IPB. Bogor.
Hegeman EC and Elizabeth AG. 2001. A novel phytase with sequence similarity to purple acid phosphatases is expressed in cotyledons of germinating soybean seedlings. Plant Physiology 126. P : 1598 – 1608.
Hoy WJ, Bischoff PK, Miligan BS dan Gravois AK. 2003. Effect of tissue culture explant source on sugarcane yield components. Euphytica 129. P : 237 – 240.
Indarwati S. 2000. Isolasi dan modifikasi media produksi bakteri penghasil fitase. Tesis. Program Pascasarjana IPB. 56 hlm.
Kane EM. 2005. Shoot culture procedures. Di dalam Trigiano, NR dan Gray JD (ed). Plant development and biotechnology. CRC Press. P : 241 – 250. Khudori. 2005. Posisi Indonesia di pertemuan WTO. Koran Tempo. 13
Desember 2005.
Kilmer OL,. Serb PA dan. Hoseney RC. 1994. Effects of mineral and apparent phytase activity in the development of hard to cook state of beans. Cereal Chem 71 (5). P : 476 – 482.
Lenhninger AL. 1990. Dasar-dasar mikrobiologi. Rajawali Press. Jakarta. Li TZ dan Gray JD. 2005. Genetic engineering technologies. Di dalam Trigiano,
NR dan Gray JD (ed). Plant development and biotechnology. CRC Press. P : 241 – 250.
Mamun MA, Sikdar MBH, Paul DK, Rahman MM, dan Islam MR. 2004. In vitro micropropagation of some important sugarcane varieties of Bangladesh. Asian Journal of Plant Sciences 3 (6): 666-669.
Martin JR, Golves G, de Armas R, Espinosa R, Vigoa R, Leon A. 1982. La Cana de Azucar en Cuba. Di dalam Enriquez-Obregon GA, Vazquez-Padron RI, Prieto-Samsonov DL (ed). Genetic transformation of sugarcane by
Agrobacterium tumefaciens using antioxidant compound. Biotechnologia Aplicada. 14. P : 169 – 174.
Minarsih H. 2003. Rekayasa genetik tebu (Saccharum officinarum L.) untuk toleransi kekeringan. Laporan Riset. Riset Unggulan Terpadu VIII Bidang Bioteknologi. Kementerian Riset dan Teknologi RI Lembaga Ilmu Pengetahuan Indonesia.
Naik GR. 2001. Sugarcane biotechnology. Science Publisher, Inc. Enfield (NH), USA.
Nester WE, Kemner J, Deng W, Lee YW, Fullner K, Liang X, Pan S dan Heath DJ. 1996. Agrobacterium : A natural genetic engineer exploited for plant biotechnology. Di dalam Stacey G, Mullin B dan Gresshoff MP (ed). Bioloy of plant-microbe interactions. International Society for Molecular Plant-Microbe Interaction. St. Paul, Minnesota, USA.
Santosa DA. 2002. IPB memiliki tebu transgenik. Kompas 11 (Kolom 1 – 5). 24 September 2002.
Santosa DA, Hendroko R, Farouk A dan Greiner R. 2004. A rapid and higly efficient method for transformation of sugarcane callus. Molecular Biotechnology. Vol.24. P. 113 – 119.
Sastrowijono S. 1991. Aspek fisiologis dalam mikropropagasi tebu. Di dalam : Diktat Pelatihan Penangan Mikropropagasi Tanaman Tebu. Pasuruan 4 – 9 Februari 1991. Pusat Penelitian Perkebunan Gula Indonesia. Pasuruan. Shieh TR, dan Ware JH. 1968. Survey of microorganism for the production of
extracelluler phytase. Appl. Microbiol 16 P : 1348 – 1351.
Sheng J dan Citovsky V. 1996. Agrobacterium – Plant cell DNA transport : Have virulence proteins will travel. The Plant Cell 8. P : 1699 – 1740.
Singh N, Somai BM dan Pillay D. 2005. In vitro screening of sugarcane to evaluate smut susceptibility. Plant Cell, Tissue and Organ Culture 80. P : 259-266.
Sugiyarta E. 1991. Persyaratan laboratorium dan penetapan media pada teknik kultur jaringan tebu. Di Dalam : Diktat Pelatihan Penangan Mikropropagasi Tanaman Tebu. Pasuruan 4 – 9 Februari 1991. Pusat Penelitian Perkebunan Gula Indonesia. Pasuruan.
Trigiano RN dan Gray JD. 2000. Plant tissue culture concepts and laboratory exercise. 2nd edition. CRC Press. New York.
Uchimiya H, Handa T dan Brar DS. 1989. Transgenic plant. biotech 12. P : 1 – 20.
Wattimena GA. 1988. Zat pengatur tumbuh tanaman. Pusat Antar Universitas Institut Pertanian Bogor Bekerjasama Dengan Lembaga Sumberdaya Informasi – IPB. Bogor.
Wattimena GA, Gunawan LW, Mattjik AN, Syamsudin E, Wiendi AMN dan Ernawati A. 1992. Bioteknologi tanaman. Depertemen Pendidikan Dan Kebudayaan Direktorat Jenderal Pendidikan Tinggi. Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor. Bogor.
Wulandari I. 2005. Studi beberapa metode transformasi genetik tanaman tebu (Saccharum offinarum L.) dengan gen fitase melalui perantara
Lampiran 1. Komposisi media MS untuk induksi kalus dan regenerasi planlet yang telah dimodifikasi
Induksi Kalus Regenerasi Tunas Induksi Akar Persenyawaan
Sukrosa 30000 30000 30000
Gelrite 2500 2500 -
2,4-D 3.0 - -
Kinetin 0.1 Sesuai dgn perlakuan -
BAP - Sesuai dgn perlakuan -
IBA - - Sesuai dgn perlakuan
Lampiran 2. Komposisi media LB
Tripton 10 g/L
Ekstrak Yeast 5 g/L
NaCl 5 g/L
Sukrosa 5 g/L
MgSO4.7H2O 20 g/L
MgCl2.6H2O 10 g/L
Lampiran 3. Komposisi media transformasi Metode Santosa, et al., (2004)
Media Komposisi MS MS salts; 1 mg/l asam nicotinat; 0.8
mg/l vitamin B1; 0.5 mg/l vitamin B6; 100 mg/l myo-inositol dan 20 g/l sukrosa
MS cd MS salts; 1 mg/l asam nicotinat; 0.8 mg/l vitamin B1; 0.5 mg/l vitamin B6; 100 mg/l myo-inositol dan 20 g/l sukrosa, 500 mg/l casein hidrolisat; 5 mg/l 2,4 D
MS cd-AO MS Induksi kalus ditambah dengan 15 mg/l asam askorbat; 40 mg/l sistein; 2 mg/l silver nitrat