TRANSFORMASI GENETIK KENTANG (
Solanum tuberosum L.)KULTIVAR NOOKSACK DENGAN GEN
FBPase/ClRan1
MELALUI PERANTARA
Agrobacterium tumefaciens
FATAHILLAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Transformasi genetik
kentang (Solanum tuberosum L.) Kultivar nooksack dengan gen FBPase/ClRan1 melalui perantara Agrobacterium tumefaciens” adalah benar karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2016
RINGKASAN
FATAHILLAH. Transformasi Genetik Kentang (Solanum tuberosum L.) Kultivar Nooksack dengan Gen FBPase/ClRan1 Melalui Perantara Agrobacterium tumefaciens. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI.
Nooksack merupakan salah satu kultivar kentang yang baik untuk diolah menjadi french fries. Kentang kultivar Nooksack berasal dari hasil persilangan konvensional antara kentang kultivar Kennebec dan kentang kultivar A501-13. Keunggulan Nooksack adalah memiliki kualitas umbi yang baik, daging umbi berwarna putih, kandungan pati tinggi, dan memiliki kandungan gula rendah. Hanya saja kentang kultivar Nooksack juga memiliki kekurangan yaitu hasil umbi yang rendah. Oleh sebab itu, produksi tanaman kentang kultivar Nooksack harus ditingkatkan.
Fruktosa bisfosfatase terlibat dalam fotosintesis. Pembungkaman ekspresi FBPase menyebabkan penurunan laju fotosintesis dan peningkatan ekspresi FBPase meningkatkan laju fotosintesis. Ekspresi ClRan1 berlebihan pada Arabidopsis dapat meningkatkan pemanjangan akar. Peningkatan ekspresi FBPase yang dikombinasikan dengan peningkatan ekspresi ClRan1 diharapkan dapat meningkatkan produksi umbi kentang. Oleh sebab itu, penelitian ini bertujuan untuk melakukan transformasi genetik tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan gen FBPase/ClRan1 melalui perantara A. tumefaciens.
Transformasi genetik dilakukan menggunakan ruas (internode) dan eksplan daun. Jumlah internode dan daun yang digunakan dalam transformasi masing-masing 60 eksplan. Transformasi dilakukan dengan menggunakan A. tumefaciens melalui metode ko-kultivasi. Efisiensi transformasi tanaman kentang dengan menggunakan ruas adalah sebesar 50% sedangkan dengan eksplan daun adalah sebesar 83.33%. Efisiensi regenerasi dari kalus transgenik putatif adalah 6.66% dari kalus yang berasal dari ruas dan 16% dari kalus yang berasal dari daun. Walaupun beberapa tunas diregenerasikan di beberapa kalus, tetapi hanya tiga tunas transgenik putatif yang dapat tumbuh. Analisis PCR membuktikan bahwa dua dari tiga tunas tersebut adalah tunas transgenik yang mengandung gen FBPase/ClRan1. Kedua tanaman transgenik yang mengandung gen FBPase mempunyai laju fotosintesis yang lebih tinggi daripada tanaman non-transgenik. Hal ini mengindikasikan bahwa ekspresi berlebih gen FBPase dapat meningkatkan laju fotosintesis. Tanaman transgenik juga mempunyai akar yang lebih banyak dan lebih panjang daripada tanaman non-transgenik. Hal ini mengindikasikan bahwa ekspresi berlebih gen ClRan1 dapat meningkatkan pertumbuhan akar. Tanaman transgenik yang mengandung gen FBPase/ClRan1 mempunyai produksi umbi yang lebih tinggi daripada tanaman non-transgenik. Hal ini terjadi kemungkinan karena hasil fotosintesis yang tinggi disalurkan ke stolon, sehingga umbinya menjadi banyak dan besar.
SUMMARY
FATAHILLAH. Genetic Transformation of Potato (Solanum tuberosum L.) Cultivar Nooksack with FBPase/ClRan1 Genes Mediated by Agrobacterium tumefaciens. Supervised by SUHARSONO and UTUT WIDYASTUTI.
Nooksack is one of a good potato cultivar for french fries. Nooksack potato cultivar is derived from a conventional cross between Kennebec potato cultivar and A501-13 potato cultivar. Advantage of Nooksack is having a good quality of tuber, white color of tuber fresh, high starch tuber content, and low sugar content. However, Nooksack cultivars produced low tuber yield and long dormancy period. Therefore, the productivity of Nooksack cultivar should be improved.
Fructose bisphosphatase involves in photosynthesis. Silencing of the expression of FBPase caused a decrease in the rate of photosynthesis and increasing expression of FBPase increased the rate of photosynthesis. Increasing the expression of ClRan1 in Arabidopsis enhanced the elongation of roots. Increasing the expression of FBPase combined with increasing the expression of ClRan1 are expected increasing the productivity of potato tuber. Therefore, this study aimed to conduct genetic transformation of potato (S. tuberosum L.) cv. Nooksack with FBPase/ClRan1 genes mediated by A. tumefaciens.
Genetic transformation was conducted by using internodes and leaf as explants. The number of internodes and leaf explants were 60 explants each. Genetic transformation was carried out by co-cultivation method by using A. tumefaciens. The efficiency of transformation using internode explant was 50% and 83.33% by using leaf explants. The efficiency of regeneration of putative transgenic calli derived from internodes and from leaf discs were 6.66% and 16% respectively. Eventhough some shoots were regenerated from some calli, but only three putative transgenic shoots could be developped into putative transgenic plants. Analysis of PCR proved that two of three shoots were transgenic containing FBPase/ClRan1 genes. The two transgenic potato containing FBPase genes have a photosynthesis rate higher than non-transgenic plants. This result indicates that over-expression of FBPase genes can increase the photosynthesis rate. Transgenic plants also have more developped and longer roots than non-transgenic plants. This result indicates that over-expression of ClRan1 genes can increase the development of roots. Transgenic plants containing FBPase/ClRan1 genes have higher tuber productivity than non-transgenic plants. This result may be due to a high photosynthesis product channeled to stolon to become numerous and big tubers.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
TRANSFORMASI GENETIK KENTANG (
Solanum tuberosum L.)KULTIVAR NOOKSACK DENGAN GEN
FBPase/ClRan1
MELALUI PERANTARA
Agrobacterium tumefaciens
FATAHILLAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis kirimkan kehadirat Allah SWT Yang Maha Bijaksana karena atas limpahan karuania-Nya sehingga tesis yang berjudul “Transformasi Genetik Kentang (Solanum tuberosum L.) Kultivar Nooksack Dengan Gen FBPase/ClRan1 Melalui Perantara Agrobacterium tumefaciens” ini berhasil diselesaikan dengan baik. Penelitian ini didanai oleh (1) Riset andalan perguruan tinggi dan industri (RAPID) dengan nomer kontrak 079/SP2/LT/DRPM/II/2016 atas nama Prof Dr Suharsono, DEA dan (2) Lembaga Pengelola Dana Pendidikan (LPDP).
Penulis mengucapkan terima kasih kepada para pembimbing, yaitu Bapak Prof Dr Ir Suharsono, DEA, dan Ibu Dr Ir Utut Widyastuti, MSi yang telah meluangkan waktu dan kesempatannya untuk memberikan bimbingan dan saran selama penelitian dan penulisan tesis ini. Penulis juga mengucapkan terima kasih kepada Bapak Diky Indrawibawa, SP dan Bapak H Hasan dari CV BA Farm Bandung atas bantuannya dalam aklimatisasi tanaman kentang transgenik.
Terima kasih penulis sampaikan kepada Bapak Dr Ir Aris Tjahjoleksono, DEA sebagai penguji luar komisi pada ujian tesis dan Bapak Dr Ir Miftahudin, MSi sebagai ketua Program Studi Biologi Tumbuhan (BOT) yang telah memberikan masukan. Penulis juga mengucapkan terima kasih kepada Prof Akiho Yokota dari NAIST JAPAN yang telah memberikan A. tumefacies yang mengandung plasmid pBI121 yang membawa gen FBPase/ClRan1. Ungkapan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Program Studi Biologi Tumbuhan yang telah memberikan bekal ilmu dan bantuan sehingga penulis dapat menyelesaikan studi dengan baik. Tidak lupa ucapan terima kasih ditunjukkan kepada rekan-rekan mahasiswa S2 BOT angkatan 2014 yang telah banyak memberikan pengalaman dan kenangan selama ini, serta rekan kerja Laboratorium BIORIN (Biotechnology Research Indonesia-the Netherland) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) yaitu Pak Mulya, Mba Pepi, Seni, Kak Yusdar, Kak Nurul, Pak Asri, Pak Elyas, Ibu Ifa, Mba Fajri, Mba Ida, Kak Nuril, Kak Lutfi, Mas Nono, Farhana, Mbak Fajri, Mas Ari, Mbak Destik, Mba Nadeak, Mba Tiwi, Ibu Ida, dan Kak Baso, dan rekan kerja di Laboratorium Kultur Jaringan, PPSHB IPB yaitu Mba Nia, Pak Asep, Mba Sarah, Pak Sutiono, dan Pak Iri. Ungkapan terima kasih juga penulis ucapkan kepada Istri yaitu Sajriawati, SPi, MSi dan anak yaitu Abu Ubay Fatahillah Wahid atas kesetiaan dan kesabarannya menemani saya selama penelitian. Ungkapan terima kasih juga penulis sampaikan kepada kakek yaitu H Abu Bakar Dg. Tiro, orang tua yaitu Drs Abd Wahid, SSos dan Hj St Faridah, SST, mertua yaitu Siti Ara dan Basri, adik-adik yaitu Ahmad Hidayat, Muh Farid Nur Wahid, Rahmat Basri serta seluruh keluarga atas segala doa dan dukungan selama penulis menjalani program Magister IPB.
Akhir kata, semoga tesis ini bermanfaat.
Bogor, November 2016
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
1 PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA
Kentang Kultivar Nooksack 2
Gen ClRan1 3
Gen fruktosa 1,6-bisfosfatase (FBPase) 4
3 METODE PENELITIAN
Waktu dan Tempat Penelitian 7
Bahan dan Metode 7
Perbanyakan Tanaman In Vitro 7
Perbanyakan Agrobacterium tumefaciens 7
Introduksi Gen FBPase/ClRan1 pada Tanaman Kentang 8 Isolasi DNA dan Analisis Integrasi Gen FBPase/ClRan1 8
Aklimatisasi 9
Pengamatan Morfologi 9
Analisis Fisiologi 9
Analisis Data 9
4 HASIL DAN PEMBAHASAN
Introduksi Gen FBPase/ClRan1 pada Tanaman Kentang 10
Identifikasi Tanaman Transgenik 12
Analisis Morfologi dan Analisis Fotosintesis 13
5 SIMPULAN DAN SARAN
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 21
DAFTAR TABEL
1 Efisiensi transformasi dan regenerasi tanaman kentang transgenik
yang mengandung gen FBPase/ClRan1 11 2 Pengaruh gen FBPase/ClRan1 terhadap jumlah daun, diameter
batang dan tinggi tanaman kentang (S. tuberosum L.) kultivar
Nooksack umur 4 MST 13
3 Laju fotosintesis, konduktansi stomata dan konsentrasi CO2
interseluler tanaman kentang (S. tuberosum L.) kultivar
Nooksack umur 4 MST 14
4 Berat basah tajuk dan berat kering tajuk tanaman kentang
(S. tuberosum L.) kultivar Nooksack umur 11 MST 14 5 Pengaruh gen FBPase/ClRan1 terhadap produksi umbi tanaman
DAFTAR GAMBAR
1 Morfologi akar tanaman Arabidopsis transgenik yang mengandung gen ClRan1 (RAN1-2, RAN1-3, RAN1-4, RAN1-6, RAN1-7, dan
RAN1-9) dan non-transgenik sebagai kontrol (Akashi et al. 2016) 4 2 Morfologi tanaman kentang transgenik yang ekspresi gen
FBPase nya telah dibungkam (FBP12, FBP14, dan FBP36) dan
tanaman non-transgenik (Koβmann et al. 1994) 5
3 Jalur metabolisme gula yang melibatkan enzim FBPase pada
fotosintesis tanaman (Buchanan et al. 2001) 6
4 Daerah T-DNA dari plasmid pBI121-FBPase/ClRan1 7 5 Tahapan perakitan tanaman kentang transgenik yang mengandung
gen FBPase/ClRan1 12
6 Hasil amplifikasi DNA menggunakan PCR dengan 2 set primer 12 7 Perbandingan jumlah dan ukuran umbi G0 tanaman kentang umur
DAFTAR LAMPIRAN
1 Komposisi media MS (Murashige & Skoog 1962) 22
2 Komposisi media Luria Bertani dalam 100 ml 23
3 Rumus perhitungan efisiensi transformasi dan regenerasi 24
4 Komposisi larutan TAE dalam 1 liter 25
5 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap jumlah daun tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan
software SPSS 16 26
6 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap diameter batang tanaman kentang (S. tuberosum L.) kultivar Nooksack
dengan software SPSS 16 27
7 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap tinggi tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software
SPSS 16 28
8 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap laju fotosintesis tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan
software SPSS 16 29
9 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap konduktansi stomata tanaman kentang (S. tuberosum L.) kultivar Nooksack
dengan software SPSS 16 30
10 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap konsentrasi CO2
interseluler tanaman kentang (S. tuberosum L.) kultivar Nooksack
dengan software SPSS 16 31
11 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap berat basah tajuk tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan
software SPSS 16 32
12 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap berat kering tajuk tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan
software SPSS 16 33
13 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap jumlah umbi tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan
software SPSS 16 34
14 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap berat umbi tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan
1 PENDAHULUAN
Latar Belakang
Nooksack merupakan salah satu kultivar kentang yang baik untuk diolah menjadi french fries. Kentang french fries mempunyai peranan yang sangat penting dalam diversifikasi pangan. Kentang kultivar Nooksack berasal dari hasil persilangan konvensional antara kentang kultivar Kennebec dan kentang kultivar A501-13. Keunggulan kentang kultivar Nooksack adalah memiliki kualitas umbi yang baik, daging umbi berwarna putih, kandungan pati tinggi, memiliki kandungan gula rendah, dan tahan terhadap penyakit layu bakteri (Hoyman dan Holland 1974). Lauer (1986) melaporkan bahwa kentang kultivar Nooksack juga memiliki kekurangan seperti hasil umbi yang rendah dan masa dormansinya panjang. Oleh sebab itu, peningkatan produksi tanaman kentang kultivar Nooksack harus dilakukan sehingga menjadi kultivar yang unggul dan memiliki produktivitas yang tinggi. Jika produksi kentang french fries tidak dimulai di Indonesia, maka Indonesia akan mengimpor kentang ini terus-menerus. Oleh karena itu, peningkatan produksi kentang ini harus dikembangkan di Indonesia. Peningkatan kualitas dan kuantitas suatu kultivar dapat diperoleh dengan melakukan persilangan konvensional dan teknologi rekayasa genetika.
Karakter unggul suatu tanaman dapat ditingkatkan melalui teknologi rekayasa genetik. Salah satu upaya yang dapat dilakukan untuk meningkatkan produksi tanaman kentang dalam waktu yang lebih singkat adalah melalui transformasi genetik. Transformasi genetik merupakan proses introduksi gen dari satu organisme ke organisme yang lain dengan menggunakan teknik rekayasa genetika. Proses transformasi genetik dapat dilakukan secara langsung seperti particle bombardment (Travella et al. 2005) dan secara tidak langsung misalnya melalui perantara Agrobacterium tumefaciens (Zupan et al. 1996). Setiap teknik transformasi memiliki kekurangan dan keunggulan masing-masing. Pada penelitian ini, transformasi genetik yang digunakan adalah menggunakan perantara bakteri A. tumefaciens. Keunggulan dan alasan penggunaan teknik tersebut adalah dapat dilakukan dengan peralatan laboratorium yang sederhana dan peluang untuk mendapatkan sisipan gen tunggal lebih tinggi dibanding dengan teknik transformasi secara langsung (Gelvin 2003). Transformasi genetik kentang dengan perantara A. tumefaciens telah banyak dilakukan, di antaranya dilakukan oleh Banerjee et al. (2006) pada kultivar Andigena, Badr et al. (2008) pada kultivar Spunta, Nicola, Hermes, dan Lady Rosetta, Khatun et al. (2012) pada kentang kultivar Cardinal dan Heera, Veale et al. (2012) pada kultivar Mnandi, Manguntungi (2014) pada kentang kultivar Atlantik, Bustomi (2014) pada kultivar Baraka, Mardiyyah (2015) pada kultivar Diamant, dan Salsabila (2015) pada kultivar Agria.
Fruktosa-2
1,6-bisfosfatase yang disandi oleh gen FBPase terlibat dalam proses fotosintesis (Choi et al. 2001). Gen FBPase telah berhasil diisolasi oleh Tamoi et al. (2005). Ekspresi berlebih gen FBPase mampu meningkatkan aktivitas fotosintesis sehingga menyebabkan peningkatan produksi biomassa dan akumulasi paramilon pada Euglena gracilis transgenik dibandingkan dengan tipe liarnya (Ogawa et al. 2015a). Pembungkaman ekspresi gen FBPase dengan RNA interference (RNAi) menyebabkan penurunan aktivitas fotosintesis dan pertumbuhan sel terhambat (Ogawa et al. 2015b). Lee et al. (2008) juga melaporkan bahwa hilangnya aktivitas enzim fruktosa-1,6-bisfosfatase menyebabkan berkurangnya kandungan sukrosa dan menghambat laju pertumbuhan tanaman Oryza sativa. Gen FBPase juga dilaporkan telah berhasil diintroduksikan ke dalam tanaman Arabidopsis (Strand et al. 2000) dan tembakau (Miyagawa et al. 2001). Peningkatan ekspresi gen FBPase mampu meningkatkan pertumbuhan dan laju fotosintesis tanaman tembakau (Miyagawa et al. 2001). Ekspresi secara berlebih kedua gen tersebut diharapkan mampu meningkatkan produksi umbi tanaman kentang. Oleh karena itu, pada penelitian ini, FBPase/ClRan1 diintroduksikan ke dalam tanaman kentang. Gen FBPase/ClRan1 telah dikonstruksi secara tandem dan masing-masing dikendalikan oleh promoter rbsS3C (ribulose bisphosphate carboxylase small subunit) untuk gen FBPase dan promoter 35S CaMV untuk gen ClRan1. Kedua promoter ini diharapkan mampu meningkatkan ekspresi gen FBPase/ClRan1 pada tanaman kentang sehingga kedua gen ini dapat bekerja sama dalam meningkatkan laju fotosintesis dan produksi umbi tanaman kentang kultivar Nooksack.
Tujuan Penelitian
Penelitian ini bertujuan untuk melakukan transformasi genetik tanaman kentang (Solanum tuberosum L.) kultivar Nooksack dengan gen FBPase/ClRan1 melalui perantara A. tumefaciens untuk mendapatkan tanaman transgenik dan melakukan analisis laju fotosintesis dan produksi umbi.
Manfaat Penelitian
Kentang kultivar Nooksack transgenik yang berproduksi tinggi dan umbi yang berukuran besar sangat bermanfaat untuk bahan baku kentang french fries. Selain itu gen FBPase/ClRan1 dapat digunakan untuk meningkatkan produksi tanaman lainnya.
2 TINJAUAN PUSTAKA
Kentang Kultivar Nooksack
negara-3
negara Eropa dan negara di Amerika Utara sedangkan produksi kentang terbesar di Asia dihasilkan oleh Cina dan India (Bradshaw and Mackay 1994). Di Indonesia, kentang ditanam di dataran tinggi Sumatra Utara, Sumatra Barat, Jawa Barat, Jawa Tengah, Jawa Timur dan Sulawesi Selatan.
Penelitian tentang kentang kultivar Nooksack dimulai pada tahun 1964 sampai 1972 di Washington bagian utara dan timur, sehingga pada tahun 1973 kentang kultivar Nooksack dirilis di Washington. Nooksack memiliki bentuk batang yang besar, tegak, dan berwarna hijau. Nooksack juga memiliki bentuk daun yang besar dan berwarna hijau. Umbi Nooksack beragam, baik bentuk, ukuran, warna kulit, warna daging umbi maupun komposisi pati dan gulanya. Pemanfaatan kentang sangat bergantung dari bentuk umbi dan komposisi pati dan gula yang terdapat di dalam umbi. Nooksack mempunyai kandungan pati yang tinggi dan kandungan gula yang rendah sehingga ketika digoreng kentang ini tidak berwarna kecokelatan. Umbi kentang kultivar Nooksack sangat baik untuk diolah dalam bentuk beku yaitu french fries. Selain sebagai french fries, Nooksack dapat juga diolah menjadi keripik atau chips (Hoyman dan Holland 1974).
Kentang kultivar Nooksack tahan terhadap beberapa patogen penyebab penyakit yaitu Phytophthora infestans, Streptomyces scabies, dan Spoudylocladium atrovirens. Ketahanan terhadap fungi Phytophthora infestans merupakan sifat yang diturunkan oleh kentang kultivar Kennebec sebagai tetua betinanya. Sedangkan sifat-sifat lain dari Nooksack seperti bentuk umbi yang lonjong, warna kulit umbi yang cokelat muda, dan tahan terhadap Streptomyces scabies merupakan sifat tanaman yang diturunkan oleh kentang kultivar A501-13 sebagai tetua jantannya (Hoyman dan Holland 1974). Kentang kultivar Nooksack juga memiliki kekurangan. Menurut Lauer (1986) kekurangannya adalah memiliki masa dormansi yang panjang dan hasil umbinya yang rendah.
Gen ClRan1
4
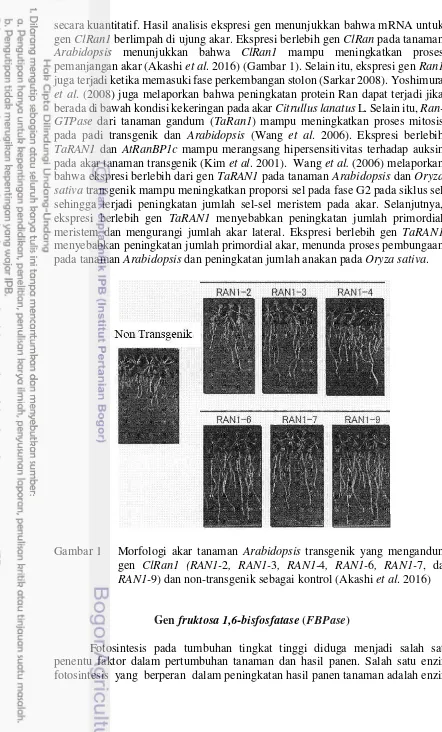
secara kuantitatif. Hasil analisis ekspresi gen menunjukkan bahwa mRNA untuk gen ClRan1 berlimpah di ujung akar. Ekspresi berlebih gen ClRan pada tanaman Arabidopsis menunjukkan bahwa ClRan1 mampu meningkatkan proses pemanjangan akar (Akashi et al. 2016) (Gambar 1). Selain itu, ekspresi gen Ran1 juga terjadi ketika memasuki fase perkembangan stolon (Sarkar 2008). Yoshimura et al. (2008) juga melaporkan bahwa peningkatan protein Ran dapat terjadi jika berada di bawah kondisi kekeringan pada akar Citrullus lanatus L. Selain itu, Ran- GTPase dari tanaman gandum (TaRan1) mampu meningkatkan proses mitosis pada padi transgenik dan Arabidopsis (Wang et al. 2006). Ekspresi berlebih TaRAN1 dan AtRanBP1c mampu merangsang hipersensitivitas terhadap auksin pada akar tanaman transgenik (Kim et al. 2001). Wang et al. (2006) melaporkan bahwa ekspresi berlebih dari gen TaRAN1 pada tanaman Arabidopsis dan Oryza sativa transgenik mampu meningkatkan proporsi sel pada fase G2 pada siklus sel sehingga terjadi peningkatan jumlah sel-sel meristem pada akar. Selanjutnya, ekspresi berlebih gen TaRAN1 menyebabkan peningkatan jumlah primordial meristem dan mengurangi jumlah akar lateral. Ekspresi berlebih gen TaRAN1 menyebabkan peningkatan jumlah primordial akar, menunda proses pembungaan pada tanaman Arabidopsis dan peningkatan jumlah anakan pada Oryza sativa.
Gambar 1 Morfologi akar tanaman Arabidopsis transgenik yang mengandung gen ClRan1 (RAN1-2, RAN1-3, RAN1-4, RAN1-6, RAN1-7, dan RAN1-9) dan non-transgenik sebagai kontrol (Akashi et al. 2016)
Gen fruktosa 1,6-bisfosfatase (FBPase)
5
fruktosa 1,6-bisfosfatase (FBPase). Enzim ini berperan dalam biosintesis sukrosa
yang secara khusus dapat meningkatkan hasil panen (Zrenner 1996). Tanaman
transgenik yang memiliki penurunan aktivitas enzim FBPase memperlihatkan penurunan laju fotosintesis. Produk yang dikatalisis oleh enzim FBPase yaitu fruktosa 6-fosfat yang merupakan metabolit pada siklus Calvin. Intermediet hasil fosforilasi diβnversi menjadi sukrosa dan diekspor dari daun dan disimpan dalam bentuk pati dan selanjutnya digunakan untuk pertumbuhan tanaman (Koßmann et al. 1994). Miyagawa et al. (2001) melaporkan bahwa introduksi gen FBPase dalam kloroplas tanaman tembakau menyebabkan peningkatan ekspresi gen FBPase sehingga menyebabkan peningkatan laju fotosintesis di daun, akumulasi karbohidrat, dan peningkatan pertumbuhan. Selain itu, ekspresi berlebih gen FBPase yang terjadi pada kloroplas tanaman tembakau mampu meningkatkan konsentrasi RuBP. Peningkatan konsentrasi RuBP mencapai 30-50% dibanding dengan tanaman kontrol (Miyagawa et al. 2001). Sebaliknya, tanaman kentang transgenik dengan gen FBPase antisens memperlihatkan pertumbuhan tanaman yang lambat (Koßmann et al. 1994) (Gambar 2). Tamoi et al. (1996) telah melaporkan bahwa sel sianobakterium (Synechococcus PCC7942) memiliki dua isozim yaitu FBPase-I dan FBPase-II. Urutan asam amino dari FBPase-II lebih mirip dengan FBPase kloroplas dibanding dengan FBPase sitosol pada tumbuhan tingkat tinggi.
Gambar 2 Morfologi tanaman kentang transgenik yang ekspresi gen FBPase nya telah dibungkam (FBP12, FBP14, dan FBP36) dan tanaman non- transgenik (Koßmann et al. 1994)
FBPase kloroplas (cp-FBPase) terdapat dalam organisme fotosintetik dan berperan dalam mengasimilasi CO2, sedangkan FBPase sitosol (cFBPase) terlibat
6
dianalisis dengan mengamati laju fotosintesis dan laju pertumbuhan tanaman. Koβmann et al. (1994) melaporkan bahwa aktivitas enzim FBPase pada tanaman kentang yang kurang dari 15% mengakibatkan pertumbuhan tanaman berkurang karena aktivitas fotosintesis berkurang, sehingga terjadi penurunan produktivitas umbi. Selain itu, enzim FBPase mengontrol regenerasi RuBP pada siklus Calvin dan sintesis amilum (Tamoi et al. 2005) dan aktivitasnya diregulasi oleh cahaya (Lee 2003).
Sukrosa dan pati adalah produk akhir yang utama pada tanaman tingkat tinggi dan berfungsi untuk perkembangan tanaman (Geigenberger 2011). Dalam siklus Calvin CO2 difiksasi dari atmosfer dengan tujuan untuk membentuk
karbohidrat dan triosa-fosfat (TPS) sebagai senyawa perantara dalam pembentukan karbohidrat (Gambar 3). Laju fiksasi CO2 menentukan laju pembentukan pati dan
sukrosa. Melalui proses kondensasi, TPS membentuk fruktosa-1,6-bisfosfat (F1,6BP) yang digunakan untuk membentuk pati di kloroplas dan sukrosa di sitosol. Fruktosa-1,6-bisfosfatase (FBPase) mengkatalisis pemecahan F1,6BP menjadi fruktosa-6-fosfat (F6P) dan Pi. Sejauh ini, ada tiga FBPase yang berada di dalam sel tanaman yaitu: enzim sitosolik (CyFBPase) yang terlibat dalam sintesis sukrosa dan glukoneogenesis dan dua lainnya adalah enzim yang isoform yaitu cFBP1 dan cFBP2 (Cséke dan Buchanan 1986). Kloroplastik FBPase (cFBP1) merupakan enzim kunci pada siklus Calvin dan berperan dalam regenerasi ribulosa 1,5-bifosfat (RuBP) dan pembentukan pati di kloroplas.
7
3 METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan dari bulan Agustus 2015 hingga Juli 2016 bertempat di Laboratorium Kultur Jaringan dan Laboratorium BIORIN (Biotecnology Research Indonesia - the Netherland) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Institut Pertanian Bogor. Aklimatisasi dan analisis fotosintesis dilakukan di CV BA Farm, Desa Kertawangi, Kecamatan Cisarua, Kabupaten Bandung Barat.
Bahan dan Metode
Bahan yang digunakan adalah kentang kultivar Nooksack yang diperoleh dari Pusat Penelitian Sumberdaya Genetik dan Bioteknologi (PPSHB) IPB. Bakteri yang digunakan untuk transformasi adalah Agrobacterium tumefaciens strain EHA105 yang membawa plasmid pBI121-FBPase/ClRan1 pemberian Prof. Akiho Yokota (Nara Institute of Science & Technology, Jepang). Peta fisik daerah T-DNA dari plasmid pBI121- FBPase/ClRan1 disajikan pada Gambar 4. Primer FBPase forward (CAAATGGCGGCCGGAGCGGTAG) dan primer ClRan1 reverse (CAGTCTTCTGGTCCGGCAAAGCC) digunakan untuk mengidentifikasi tanaman transgenik.
Gambar 4 Daerah T-DNA dari plasmid pBI121-FBPase/ClRan1. LB: left border, RB: right border, SP: Signal Peptide, FBPase: Fructose-1,6- bisphosphatase, rbcS3C-P: ribulose bisphosphate carboxylase small subunit gene promoter, Nos-T: nopaline synthase terminator, Nos-P: nopaline synthase promoter, ClRan1: Citrullus lanatus Root Activating Number, 35S-P: 35S CaMV promoter, NptII: gen neomycin phosphotransferase
Perbanyakan Tanaman In Vitro
8
Perbanyakan Agrobacterium tumefaciens
Agrobacterium tumefaciens dikulturkan selama 36 jam pada 10 ml media Luria Bertani (LB) cair (Lampiran 2) yang ditambah dengan antibiotik kanamisin 100 mg/l dan rifamisin 50 mg/l, dengan penggoyangan pada kecepatan 150 rpm. Bakteri dikultur pada suhu ruang dalam kondisi gelap. Sebanyak 20 µ l dari biakan tersebut diambil kembali dan dibiakkan kembali di dalam 10 ml media LB cair dengan kondisi yang sama dengan sebelumnya hingga mencapai nilai OD600 sebesar 0.1-0.2.
Introduksi Gen FBPase/ClRan1 pada Tanaman Kentang
9
Isolasi DNA dan Analisis Integrasi Gen FBPase/ClRan1
DNA kentang diisolasi dengan mengikuti metode Suharsono (2002) yang dimodifikasi menggunakan buffer CTAB 2X (2% CTAB, 0.1 M Tris-HCl, 20 mM EDTA, 1.4 M NaCl, 1% polyvinil pirolidine, pH 8). Analisis integrasi gen di dalam tanaman transgenik untuk identifikasi tanaman transgenik dilakukan dengan Polymerase Chain Reaction (PCR). Komposisi yang digunakan dalam reaksi PCR terdiri dari 500 ng DNA genom, 0.25 mM primer FBPase forward dan 0.25 mM primer ClRan1 reverse, 5 µl Dream TaqTM Green PCR Master Mix, ditambah dengan ddH2O hingga volume 10 µl. Kondisi PCR adalah pra PCR dengan suhu
94oC selama 2 menit; masing-masing 35 siklus untuk denaturasi 95oC selama 10
detik, annealing 64oC selama 30 detik, ekstensi 72oC selama 45 detik; dan satu siklus untuk pasca PCR 25oC. Hasil PCR kemudian dielektroforesis pada gel agarose 1% (b/v) dengan voltase sebesar 100 volt selama 30 menit di dalam larutan penyangga TAE (Lampiran 4), kemudian gel direndam di dalam ethidium bromida (0,5 µg/mL) selama 10 menit, selanjutnya direndam di dalam akuades selama 10 menit. Visualisasi dilakukan pada UV transilluminator dan didokumentasikan dengan gel doc.
Aklimatisasi
Tanaman kentang in vitro (plantlet) yang mempunyai batang lebih dari 5 cm dibiarkan di rumah kaca selama 1 minggu. Plantlet dibersihkan dari semua agar dan akarnya dipotong, kemudian direndam di air yang mengandung hormon pembentukan akar dan dipindahkan ke dalam tray yang berukuran 3 cm x 3 cm x 5 cm yang berisi coco-peat yang dicampur dengan pupuk kandang. Setelah tanaman berumur 3 minggu, tanaman dipindahkan ke dalam polybag yang mengandung media yang sama dengan sebelumnya.
Pengamatan Morfologi
Pengamatan morfologi tanaman dilakukan dengan mengukur dan mengamati beberapa sifat-sifat tanaman. Sifat-sifat tanaman yang diamati adalah diameter batang, tinggi tanaman, dan jumlah daun. Pengamatan ini dilakukan secara acak terhadap 3 tanaman di 3 polybag yang berbeda untuk masing masing galur pada umur 4 minggu setelah tanam (MST). Panen dilakukan pada umur 11 MST. Pengamatan tanaman pada saat panen adalah berat basah tajuk dan berat kering tajuk, jumlah umbi, dan berat umbi per-tanaman.
Analisis Fisiologi
10
fotosintesis, konduktansi stomata, dan konsentrasi CO2 interseluler. Analisis ini
dilakukan secara acak dengan masing-masing 3 kali ulangan. Pengamatan ini dilakukan terhadap 3 tanaman di 3 polybag yang berbeda untuk masing-masing galur pada umur 4 MST.
Analisis Data
Data yang diperoleh, selanjutnya dianalisis menggunakan SPSS 16 melalui uji sidik ragam (ANOVA) untuk mengetahui perbedaan antara tanaman transgenik dan non-transgenik. Jika hasil uji ANOVA memberikan perbedaan yang nyata, maka dilakukan uji lanjut Beda Nyata Terkecil (BNT) pada taraf kepercayaan 95%.
4 HASIL DAN PEMBAHASAN
Introduksi Gen FBPase/ClRan1 pada Tanaman Kentang
Transformasi kentang meliputi beberapa tahap, yaitu persiapan eksplan, infeksi Agrobacterium ke tanaman, ko-kultivasi, induksi kalus, induksi tunas, pemanjangan tunas, dan pengakaran tunas, dan aklimatisasi (Gambar 5). Transformasi genetik dilakukan dengan menggunakan bagian ruas tanpa mata tunas yang berukuran 0.5 cm dan potongan daun yang berukuran 1 cm. Jumlah ruas dan eksplan daun yang digunakan dalam transformasi masing-masing mencapai 60 eksplan. Keberhasilan proses transformasi gen ke tanaman ini sangat dipengaruhi dengan penambahan asetosiringon (Chen et al. 2014). Penambahan asetosiringon mampu menginduksi gen vir dan meningkatkan efektivitas infeksi A. tumefaciens (Rashid et al. 2010). Selain asetosiringon, senyawa lain seperti monosakarida mampu berperan sebagai koi-nduser dari senyawa fenolik (Peng et al. 1998). Keberhasilan transformasi tanaman sangat dipengaruhi oleh proses ko-kultivasi di ruang gelap (Wanichananan et al. 2010). Penggunaan ruas batang tanpa mata tunas sebagai eksplan dimaksudkan untuk menghindarkan terbentuknya tunas dari mata tunas. Tunas yang terbentuk dari mata tunas biasanya tidak terpapar secara langsung dengan agen seleksi sehingga dapat menghasilkan tunas transgenik yang palsu.
11
A.tumefaciens yang berlebihan pada eksplan. A. tumefaciens yang tumbuh berlebihan dapat menyelimuti eksplan hingga eksplan mengalami kematian dan tidak membentuk kalus. Oleh sebab itu, cefotaxime ditambahkan ke media yang bertujuan untuk menghambat pertumbuhan dan mematikan bakteri A. tumefaciens. Jika pemberian cefotaxime berlebih, maka dapat menghambat pertumbuhan kalus transgenik putatif dan menurunkan persentase efisiensi regenerasi (Kazemi et al. 2014). Pada penelitian ini, kalus non-transgenik tidak diperlakukan dengan cefotaxime dan tidak diinfeksikan dengan A. tumefaciens. Kanamisin juga menghambat pertumbuhan tanaman walaupun tanaman tersebut mengandung gen resisten terhadap kanamisin.
Transformasi genetik kentang menggunakan A. tumefaciens telah berhasil dilakukan dengan menggunakan potongan daun dan ruas sebagai eksplan. Jumlah kalus yang tahan kanamisin 100 mg/l sebanyak 30 untuk ruas dan 50 untuk eksplan daun. Efisiensi transformasi tanaman kentang dengan menggunakan ruas sebesar 50% sedangkan eksplan daun sebesar 83.33% dengan rata-rata 66.66% (Tabel 1). Penelitian sebelumnya menunjukkan bahwa efisiensi transformasi adalah sebesar: 22.53% (Mardiyyah 2015), 5.01% (Salsabila 2015), 16.36% (Bustomi 2014) dan 25.21 (Nadeak 2016). Tingginya nilai efisiensi transformasi pada penelitian ini dapat disebabkan karena beberapa hal, antara lain pencucian eksplan yang cukup bersih, kurangnya kontaminasi oleh bakteri A. tumefaciens, kurangnya jaringan eksplan yang mengalami kerusakan selama proses pencucian dan penggunaan alat tanam yang tidak panas ketika proses subkultur. Rajamuddin (2016) melaporkan bahwa salah satu penyebab tingginya efisiensi transformasi adalah tidak dilakukan skrining antibiotik setelah dikokultivasi, dan seleksi dilakukan setelah terbentuk kalus.
Tabel 1 Efisiensi transformasi dan regenerasi tanaman kentang transgenik yang mengandung gen FBPase/ClRan1
Pengamatan Eksplan
Ruas Daun
Jumlah eksplan 60 60
Jumlah kalus tahan kanamisin 30 50
Efisiensi transformasi (%) 50.00 83.33
Jumlah Kalus Beregenerasi 2 8
Efisiensi Regenerasi (%) 6.66 16.00
12
untuk mencegah pencokelatan pada eksplan adalah dengan melakukan subculture setiap seminggu sekali.
Efisiensi regenerasi yang dihasilkan dari penelitian ini adalah 16.00% untuk eksplan daun dan 6.66% untuk eksplan ruas. Efisiensi regenerasi eksplan daun lebih tinggi daripada efisiensi regenerasi eksplan ruas. Hal ini disebabkan karena eksplan ruas mengalami browning lebih banyak dibanding dengan eksplan daun. Pada penelitian ini, eksplan daun memiliki kemampuan beregenerasi lebih cepat dibanding eksplan ruas. Jumlah kalus yang berhasil beregenerasi adalah 8 kalus dari eksplan daun dan 2 kalus dari eksplan ruas, tetapi hanya 3 tunas transgenik putatif yang berhasil ditumbuhkan menjadi besar, yaitu 1 tunas dari eksplan ruas dan 2 tunas dari eksplan daun. Tunas yang mampu tumbuh di media selektif, selanjutnya dipindahkan ke media ½ MS yang mengandung antibiotik kanamisin 100 mg/l yang selanjutnya dinamakan NKT (Gambar 5E). Tunas ini selanjutnya diperbanyak di media yang sama.
Gambar 5 Tahapan perakitan tanaman kentang transgenik yang mengandung gen FBPase/ClRan1. A: Kokultivasi, B: Pengkalusan, C: Regenerasi tunas di media seleksi kanamisin 100 mg/L, D: Pemanjangan tunas, E: Plantlet kentang di media pengakaran, F: Aklimatisasi
Identifikasi Tanaman Transgenik
13
transgenik putatif dan kontrol positif yaitu plasmid yang mengandung gen FBPase/ClRan1. Hasil PCR ini mengindikasikan bahwa gen FBPase/ClRan1 telah berhasil terintegrasi ke dalam genom tanaman kentang.
Gambar 6 Hasil amplifikasi DNA menggunakan PCR dengan 2 set primer. A: primer FBPase’F-ClRan1’R, B: primer Act’F-Act’R, M = Marker 1 kb DNA; P adalah kontrol positif (plasmid); NKT1 dan NKT2 adalah tanaman transgenik; NKT3: non- transgenik; NT adalah kontrol negatif (wild type)
PCR terhadap tanaman non-transgenik dengan primer FBPase/ClRan1 tidak menghasilkan fragmen DNA yang berukuran 1047 pb. Untuk membuktikan bahwa DNA yang digunakan untuk analisis PCR adalah dalam keadaan yang bagus, PCR dilakukan untuk mengamplifikasi gen aktin. PCR dengan menggunakan cetakan DNA pada tanaman transgenik dan non-transgenik semuanya menghasilkan fragmen DNA dengan ukuran 600 pb (Gambar 6B). Hasil ini menunjukkan bahwa DNA di semua tanaman yang dianalisis adalah dalam keadaan bagus
Analisis Morfologi dan Analisis Fotosintesis
Tanaman kentang transgenik segera diaklimatisasi (Gambar 5F). Proses ini membantu plantlet untuk beradaptasi dengan perubahan lingkungan dan untuk mengetahui fungsi gen pada tanaman kentang. Setelah aklimatisasi selanjutnya tanaman dipindahkan ke polybag. Tanaman kentang kultivar Nooksack yang mengandung gen FBPase/ClRan1 memiliki jumlah daun, diamater batang dan tinggi tanaman yang lebih tinggi dibanding tanaman kentang non-transgenik (Tabel 2). Analisis ANOVA pengaruh FBPase/ClRan1 terhadap jumlah daun, diameter batang dan tinggi tanaman di lampirkan pada lampiran 5, 6 dan 7.
Tabel 2 Pengaruh gen FBPase/ClRan1 terhadap jumlah daun, diameter batang dan tinggi tanaman kentang (S. tuberosum L.) kultivar Nooksack umur 4 MST
14
Peningkatan jumlah daun, diameter batang dan tinggi tanaman memiliki korelasi positif dengan peningkatan laju fotosintesis pada tanaman kentang transgenik (Tabel 3). Peningkatan laju fotosintesis memiliki pengaruh terhadap perkembangan dan pertumbuhan tanaman. Mungara et al. (2013) melaporkan bahwa semakin banyak jumlah daun, maka akan semakin banyak cahaya yang diserap untuk proses fotosintesis. Fotosintat yang dihasilkan digunakan untuk pertumbuhan dan perkembangan tanaman. Miyagawa et al. (2001) melaporkan bahwa peningkatan pertumbuhan tanaman tembakau transgenik disebabkan oleh ekspresi gen FBPase yang berlebihan
Tabel 3 Laju fotosintesis, konduktansi stomata dan konsentrasi CO2 interseluler
tanaman kentang (S. tuberosum L.) kultivar Nooksack umur 4 MST
No. Galur Laju Fotosintesis
Ket: Angka yang diikuti oleh huruf yang sama dan pada kolom yang sama adalah tidak berbeda nyata pada α = 0.05; NKT: tanaman transgenik, NT: tanaman non-transgenik.
Pada umur 4 MST tanaman transgenik yang mengandung gen FBPase/CLRan1 mempunyai laju fotosintesis dan konsentrasi CO2 interseluler
yang lebih tinggi daripada tanaman non-transgenik (Tabel 3). Peningkatan laju fotosintesis dan konsentrasi CO2 interseluler di dalam tanaman kentang transgenik
kemungkinan besar disebabkan karena ekspresi berlebih dari gen FBPase/ClRan1. Ekspresi berlebih dari gen FBPase mampu meningkatkan konsentrasi RuBP di dalam kloroplas tanaman. Peningkatan konsentrasi RuBP di dalam kloroplas bisa mencapai 30-50% (Miyagawa et al. 2001). Konduktansi stomata pada tanaman kentang transgenik sama dengan tanaman kentang non-transgenik. Hasil ini menunjukkan bahwa kemungkinan gen FBPase/ClRan1 tidak mempengaruhi konduktasi stomata pada tanaman kentang transgenik (Tabel 3). Analisis ANOVA pengaruh gen FBPase/ClRan1 terhadap laju fotosintesis, konduktansi stomata dan konsentrasi CO2 interseluler disajikan pada lampiran 8, 9 dan 10.
15
Tabel 4 Berat basah tajuk dan berat kering tajuk tanaman kentang (S. tuberosum L.) kultivar Nooksack umur 11 MST
No. Galur Berat Basah
Ket: Angka yang diikuti oleh huruf yang sama dan pada kolom yang sama adalah tidak berbeda nyata pada α = 0.05; NKT: tanaman transgenik, NT: tanaman non-transgenik.
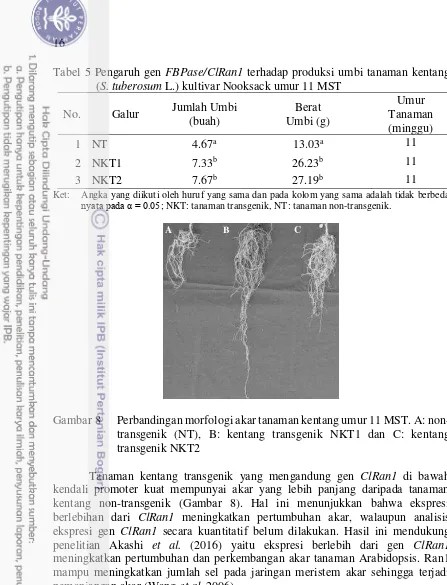
Tanaman kentang transgenik yang mengandung gen FBPase/ClRan1 di bawah kendali promoter kuat mempunyai produksi umbi baik berat maupun jumlah umbi lebih tinggi daripada tanaman kentang non-transgenik (Tabel 5; Gambar 7). Hal ini menunjukkan bahwa ekspresi berlebih FBPase/ClRan1 meningkatkan produksi umbi. Analisis ANOVA pengaruh gen FBPase/ClRan1 terhadap jumlah umbi dan berat umbi disajikan pada lampiran 13 dan 14. Peningkatan produksi umbi kemungkinan disebabkan oleh meningkatnya laju fotosintesis pada tanaman transgenik (Tabel 3). Ekspresi berlebihan dari gen FBPase meningkatkan laju pertukaran karbon pada siklus Calvin sehingga dapat digunakan untuk regenerasi RuBP dan sintesis amilum. Tanaman kentang cv. Desiree transgenik (Koβmann et al. 1994) dan Oryza sativa (Lee 2008) yang kehilangan aktivitas FBPase memiliki laju fotosintesis yang rendah sehingga mengakibatkan sintesis sukrosa dan pertumbuhan tanaman menjadi terhambat. Peningkatan jumlah umbi mengindikasikan bahwa ClRan1 berperan dalam meningkatkan pembelahan sel yang lebih aktif sehingga tanaman transgenik menghasilkan jumlah stolon yang lebih banyak daripada tanaman non-transgenik. Peningkatan jumlah stolon pada tanaman kentang memiliki pengaruh terhadap peningkatan jumlah umbi. Pertumbuhan dan perkembangan tanaman yang lebih cepat mampu memacu peningkatan hasil panen. Hasil panen yang tinggi pada tanaman kentang transgenik mengindikasikan bahwa tanaman kentang tersebut memiliki laju fotosintesis yang tinggi.
Gambar 7 Perbandingan jumlah dan ukuran umbi G0 tanaman kentang umur 11
MST. A: non-transgenik (NT), B: kentang transgenik NKT1 dan C: kentang transgenik NKT2
16
Tabel 5 Pengaruh gen FBPase/ClRan1 terhadap produksi umbi tanaman kentang (S. tuberosum L.) kultivar Nooksack umur 11 MST
No. Galur Jumlah Umbi (buah)
Berat Umbi (g)
Umur Tanaman (minggu)
1 NT 4.67a 13.03a 11
2 NKT1 7.33b 26.23b 11
3 NKT2 7.67b 27.19b 11
Ket: Angka yang diikuti oleh huruf yang sama dan pada kolom yang sama adalah tidak berbeda nyata pada α = 0.05; NKT: tanaman transgenik, NT: tanaman non-transgenik.
Gambar 8 Perbandingan morfologi akar tanaman kentang umur 11 MST. A: non-transgenik (NT), B: kentang non-transgenik NKT1 dan C: kentang transgenik NKT2
Tanaman kentang transgenik yang mengandung gen ClRan1 di bawah kendali promoter kuat mempunyai akar yang lebih panjang daripada tanaman kentang non-transgenik (Gambar 8). Hal ini menunjukkan bahwa ekspresi berlebihan dari ClRan1 meningkatkan pertumbuhan akar, walaupun analisis ekspresi gen ClRan1 secara kuantitatif belum dilakukan. Hasil ini mendukung penelitian Akashi et al. (2016) yaitu ekspresi berlebih dari gen ClRan1 meningkatkan pertumbuhan dan perkembangan akar tanaman Arabidopsis. Ran1 mampu meningkatkan jumlah sel pada jaringan meristem akar sehingga terjadi pemanjangan akar (Wang et al. 2006).
5 SIMPULAN DAN SARAN
Simpulan
Transformasi genetik kentang kultivar Nooksack dengan menggunakan gen FBPase yang dikendalikan oleh promoter rbsS3C dan gen ClRan1 yang
17
dikendalikan oleh promoter 35S CaMV telah menghasilkan tanaman kentang transgenik. Tanaman kentang transgenik yang mengandung gen FBPase/ClRan1 di bawah kendali promoter kuat mempunyai laju fotosintesis dan produksi umbi yang lebih tinggi daripada tanaman kentang non-transgenik.
Saran
Analisis ekspresi gen secara kuantitatif perlu dilakukan untuk mengetahui pengaruh gen FBPase/ClRan1 terhadap laju fotosintesis, dan produksi umbi kentang.
DAFTAR PUSTAKA
Akashi K, Yoshimura K, Nanasato Y, Takahara K, Munekage Y, Yokota A. 2008. Wild plant resources for studying molecular mechanisms of drought/strong light stress tolerance. Plant Biotechnol. 25:257–263.
Akashi K, Yoshimura K, Kajikawa M, Hanada K, Kosaka R, Kato A, Katoh A, Nanasato Y, Tsujimoto H, Yokota A. 2016. Potential involvement of drought-induced RanGTPase ClRAN1 in root growth enhancement in a xerophyte wild watermelon. Biosci Biotechnol Biochem. 11(6):1-11.
Azghandi AV, Viliers TA. Ghorbani, Tajabadi A. 2002. The Microscopy of tissue decoloration and browning problem in pistashio callus cultures. Acta Hort. 591(1):124-146.
Badr E, Mabrouk Y, Rakha F, Ghazy AH. 2008. Agrobacterium tumefaciens-mediated transformation of potato and analysis of genomic instability by RAPD. Res J Agric Biol Sci. 4(1):16-25.
Banerjee AK, Prat S, Hannapel DJ. 2006. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Sci. 170:732–738.
Bradshaw JE, Mackay GR. 1994. Breeding Strategies for Clonally Propagated Potatoes. In JE Bradshaw. GR Mackay. Eds Potato Genetics. Wallingford (GB): CABI. p 467–497.
Buchanan B, Gruissem W, Jones RL. 2001. Biochemistry and Molecular Biology of Plants. Lincoln (GB): Wiley.
Bustomi. 2014. Transformasi genetik kentang (Solanum tuberosum L.) kultivar Baraka dengan gen pembungaan Hd3a [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Chen SC, Liu HW, Lee K, Yamakawa T. 2014. High-efficiency Agrobacterium rhizogenes-mediated transformation of heat inducible sHSP 18.2-GUS in Nicotiana tabacum. Plant Cell Rep. 26:26-37.
Choi KH, Shi J, Hopkins CE, Tolan DR., Allen KN. 2001. Snapshots of catalysis: The structure of fructose-1,6-(bis)phosphate aldolase covalently bound to the substrate dihydroxyacetone phosphate. Biochem. 40:13868-13875.
18
Cséke C, Buchanan B. 1986. Regulation of the formation and utilization of photosynthate in leaves. Biochimic et Biophysic Acta. 853:43–63.
Evans JR, Santiago LS. 2014. PromethusWiki gold leaf protocol: gas exchange using LI-COR 6400. Funct Plant Biol. 4(1):223-226.
Geigenberger P. 2011. Regulation of starch biosynthesis in response to a fluctuating environment. Plant Physiol. 155:1566–1577.
Gelvin SB. 2003. Agrobacterium-mediated plant transformation: the biology behind the Gene-Jockeying tool. Microbiol Mol Biol Rev. 67:16-37.
Gustafson V, Mallubhotla S, MacDonnell J, Sanyal-Bagchi M, Chakravarty B, Wang-Pruski G, Rothwell C, Audy P, DeKoeyer D, Siahbazi M, Flinn B, Regan S. 2006. Transformation and plant regeneration from leaf explants of Solanum tuberosum L. cv. ‘Shepody. PCTOC. 85:361–366.
Hoyman WG, Hollan RC. 1974. Nooksack: a russet potato adapted to northwestern Washington. Am Potato J. 51:99-102.
Kazemi EM, Jonoubi P, Majd A, Pazhouhandeh M. 2014. Restriction of negative effects of cefotaxime in tomato transformation by using FeEDDHA. Inti J Farm Alli Sci. 3(5):538-542.
Khatun A, Hasan MM, Bachchu AA, Moniruzzaman M, Nasiruddin. 2012. Agrobacterium-mediated genetic transformation of potato (Solanum tuberosum L.) var. Cardinal dan Heera. The Agriculturists. 10(1):81-86. Kim SH, Arnold D, Lloyd A, Roux SJ. 2001. Antisense expression of an
Arabidopsis Ran binding protein renders transgenic roots hypersensitive to auxin and alters auxin-induced root growth and development by arresting mitotic progress. Plant Cell 13:2619–2630.
Koβmann J, Sonnewald U, Willmitzer L. 1994. Reduction of the chloroplastic fructose-l,6- bisphosphatase in transgenic potato plants impairs photosynthesis and plant growth. Plant J. 6(5):637-650.
Lauer DA. 1986. Response of Nooksack potatoes to nitrogen. Am Potato J. 63(5):251-262.
Lee SW, Hahn TR. 2003. Light-regulated differential expression of pea choloroplast and cytosolic fructose-1,6-bisphosphatases. Plant Cell Rep. 21:611-8.
Lee SK, Jeon JS, Bornke F, Voll L, Cho JI, Goh CH, Jeong SW, Park JI, Kim SJ, Choi SB et al. 2008. Loss of cytosolic fructose-1,6-bisphosphatase limits photosynthetic sucrose synthesis and causes severe growth retardation in rice (Oryza sativa). Plant Cell Environ. 31:1851-1863.
Manguntungi AB. 2014. Transformasi genetik kentang Atlantik dengan gen penyandi lisozim melalui perantara Agrobacterium tumefaciens [tesis]. Bogor (ID): Institut Pertanian Bogor.
19
Mungara E, Indradewa D, Rogomulyo R. 2013. Analisis pertumbuhan dan hasil padi sawah (Oryza sativa L.) pada sistem pertanian konvensional, transisi organik dan organik. Vegetalika. 2(3):1-12.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiol Plant. 15:473-497.
Nadeak H. 2016. Perakitan kentang (Solanum tuberosum L.) kultivar Nooksack transgenik yang mengandung gen Hd3a [tesis]. Bogor (ID). Institut Pertanian Bogor.
Ogawa T, Tamoi M, Kimura A, Mine A, Sakuyama H, Yoshida E, Maruta T, Suzuki K, Ishikawa T, Shigeoka S. 2015a. Enhancement of photosynthetic capacity in Euglena gracilis by expression of cyanobacterial fructose-1,6-/sedoheptulose-1,7-bisphosphatase leads to increases in biomass and wax ester production. Biotechnol for Biofuels. 8:80.
Ogawa T, Kimura A, Sakuyama H, Tamoi M, Ishikawa T, Shigeoka S. 2015b. Characterization and physiological role of two types of chloroplastic fructose-1,6- bisphosphatases in Euglena gracilis. Arch Biochem Biophys. 575:61–68. Paserang AP, Tjahjoleksono A, Widyastuti U, Suharsono. 2015. Transformation of
inhibitor of meristem activity (IMA) gene into Jatropha curcas L. Makara J Sci. 19(3):117-122.
Peng WT, Lee YW, Nester EW. 1998. The penolic recognition profiles of the Agrobacterium tumefaciens VirA protein broadened by a high level of the sugar binding protein ChvE. J Bacteriol. 180:5632-5638.
Rajamuddin MAL. 2016. Transformasi gen KAPPA (k)-Carragenase pada rumput laut Kappaphycus alvarezii [disertasi]. Bogor (ID). Institut Pertanian Bogor. Rashid H, Afzal A, Khan MH, Chaudhry Z, Malik SA. 2010. Effect of bacterial
culture density and acetosyringone concentration on Agrobacterium mediated transformation in wheat. Pak J Bot. 42(6):4183-4189.
Riley PA. 2000. Tyrosinase kinetics: a semi-quantitative model of the mechanism of oxidation of monohydric and dihydric phenolic substrates. J Theor Biol. 203(1):1-12.
Salsabila L. 2015. Transformasi genetik kentang (Solanum tuberosum l.) kultivar Agria dengan gen pembungaan Hd3a [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Sarkar D. 2008. The signal transduction pathways controlling in planta tuberization in potato: an emerging synthesis. Plant Cell Rep. 27:1-8. Setiawan, Tohari, Shiddieq D. 2012. Pengaruh cekaman kekeringan terhadap
akumulasi prolin tanaman Nilam Pogostemon cablin Benth. JIP. 15(2):85-99.
Strand A, Zrenner R, Trevanion S, Stitt M, Gustafsson P, Gardeström P. 2000. Decreased expression of two key enzymes in the sucrose biosynthesis pathway, cytosolic fructose-1,6 bisphosphatase and sucrose phosphate synthase, has remarkably different consequences for photosynthetic carbon metabolism intransgenic Arabidopsis thalina. J Plant. 23:759–770.
Suharsono. 2002. Konstruksi pustaka genom kedelai kultivar Slamet. Hayati. 9:67-70.
20
Tamoi M., Ishikawa T, Takeda T, Shigeoka S. 1996. Molecular characterization and resistance to hydrogen peroxide of two fructose-1,6-bisphosphatses from Synechococcus PCC 7942. Arch Biochem Biophys. 334:27–36.
Tamoi M, Nagaoka M, Yabuta Y, Shigeoka S. 2005. Carbon metabolism in the calvin cycle. Plant Biotechnol. 22:355-360.
Travella S, Ross SM, Harden J, Everett C, Snape JW, Harwood WA. 2005. A comparison of transgenic barley lines produced by particle bombardment and Agrobacterium-mediated techniques. Plant Physiol Biochem. 45:822-833.
Veale MA, Slabbert MM, Emmenes LV. 2012. Agrobacterium-mediated
transformation of potato cv. Mnandi for resistance to the potato tuber moth
(Phthorimaea operculella). SAJB. 80:67-74.
Wang X, Xu Y, Han Y, Bao S, Du J, Yuan M, Xu Z, Chong K. 2006. Overexpression of RAN1 in rice and arabidospsis alters primordial meristem, mitotic progress, and sensitivity to auxin. Plant Physiol. 140:91-101.
Wanichananan P, Teerakathiti T, Roytrakul S, Kirdmanee C, Peyachoknagul S. 2010. A highly efficient method for Agrobacterium mediated transformation in elite rice varieties (Oryza sativa L. spp. Indica). Afr J Biotechnol. 9(34):5488-5495.
Yoshimura K, Masuda A, Kuwano M, Yokota A, Akashi K. 2008. Programmed proteome response for drought avoidance/tolerance in the root of a C3 xerophyte (wild watermelon) under water deficits. Plant Cell Physiol. 49:226–241.
Zrenner R, Krause KP, Apel P, Sonnewald U. 1996. Reduction of the cytosolic fructose-l,6-bisphosphatase in transgenic potato plants limits photosynthetic sucrose biosynthesis with no impact on plant growth and tuber yield. Plant J. 9(5):671-681.
21
22
Lampiran 1 Komposisi media MS (Murashige & Skoog 1962)
23
Lampiran 2 Komposisi media Luria Bertani dalam 100 ml
NaCl 1 g
24
Lampiran 3 Rumus perhitungan efisiensi transformasi dan regenerasi
% Efisiensi Transformasi =Jumlah eksplan berkalus resisten kanamisinJumlah eksplan total yang ditransformasi x 100
25
Lampiran 4 Komposisi larutan TAE dalam 1 liter
Tris base 4.84 g
26
Lampiran 5 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap jumlah daun tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Jumlah Daun
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan 1.368 2 .684 9.436 .014
Galat .435 6 .072
Total 1.802 8
Nilai probabilitas signifikansi 0.014 < 0.05 sehingga terdapat perbedaan yang signifikan pada jumlah daun yang dilakukan dengan menggunakan tiga galur tanaman.
Uji Lanjut BNT/LSD yaitu Beda Nilai Terkecil untuk mengetahui perlakuan mana yang berpengaruh nyata. Perbandingan Berganda
Peubah: Jumlah Daun
(I) Galur (J) Galur Perbedaan Nilai Tengah (I-J) Galat Baku α 95% Selang Kepercayaan Batas Bawah Batas Atas
BNT 1 2 -.95333* .21980 .005 -1.4912 -.4155
3 -.52333 .21980 .055 -1.0612 .0145
2 1 .95333* .21980 .005 .4155 1.4912
3 .43000 .21980 .098 -.1078 .9678
3 1 .52333 .21980 .055 -.0145 1.0612
2 -.43000 .21980 .098 -.9678 .1078
27
Lampiran 6 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap diameter batang tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Diameter Batang
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan .132 2 .066 148.225 .000
Galat .003 6 .000
Total .134 8
Nilai probabilitas signifikansi 0.000 < 0.05 sehingga terdapat perbedaan yang signifikan pada diameter batang yang dilakukan dengan menggunakan tiga galur tanaman.
Uji Lanjut BNT/LSD yaitu Beda Nilai Terkecil untuk mengetahui perlakuan mana yang berpengaruh nyata. Perbandingan Berganda
Peubah: Diameter Batang
(I) Galur (J) Galur Perbedaan Nilai Tengah (I-J) Galat Baku α 95% Selang Kepercayaan Batas Bawah Batas Atas
BNT 1 2 -.25667* .01721 .000 -.2988 -.2145
3 -.25667* .01721 .000 -.2988 -.2145
2 1 .25667* .01721 .000 .2145 .2988
3 .00000 .01721 1.000 -.0421 .0421
3 1 .25667* .01721 .000 .2145 .2988
2 .00000 .01721 1.000 -.0421 .0421
28
Lampiran 7 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap tinggi tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Tinggi Tanaman
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan 34.829 2 17.414 16.412 .004
Galat 6.367 6 1.061
Total 41.196 8
Nilai probabilitas signifikansi 0.004 < 0.05 sehingga terdapat perbedaan yang signifikan pada tinggi tanaman yang dilakukan dengan menggunakan tiga galur tanaman.
Uji Lanjut BNT/LSD yaitu Beda Nilai Terkecil untuk mengetahui perlakuan mana yang berpengaruh nyata. Perbandingan Berganda
Peubah: Tinggi Tanaman
(I) Galur (J) Galur Perbedaan Nilai Tengah (I-J) Galat Baku α 95% Selang Kepercayaan Batas Bawah Batas Atas
BNT 1 2 -4.80000* .84108 .001 -6.8580 -2.7420
3 -2.76667* .84108 .017 -4.8247 -.7086
2 1 4.80000* .84108 .001 2.7420 6.8580
3 2.03333 .84108 .052 -.0247 4.0914
3 1 2.76667* .84108 .017 .7086 4.8247
2 -2.03333 .84108 .052 -4.0914 .0247
29
Lampiran 8 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap laju fotosintesis tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Laju Fotosintesis
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan 219.351 2 109.675 7.480 .023
Galat 87.974 6 14.662
Total 307.325 8
Nilai probabilitas signifikansi 0.023 < 0.05 sehingga terdapat perbedaan yang signifikan pada laju fotosintesis yang dilakukan dengan menggunakan tiga galur tanaman.
Uji Lanjut BNT/LSD yaitu Beda Nilai Terkecil untuk mengetahui perlakuan mana yang berpengaruh nyata. Perbandingan Berganda
Peubah: Laju Fotosintesis
(I) Galur (J) Galur Perbedaan Nilai Tengah (I-J) Galat Baku α 95% Selang Kepercayaan Batas Bawah Batas Atas
BNT 1 2 -9.27000* 3.12649 .025 -16.9202 -1.6198
3 -11.36000* 3.12649 .011 -19.0102 -3.7098
2 1 9.27000* 3.12649 .025 1.6198 16.9202
3 -2.09000 3.12649 .529 -9.7402 5.5602
3 1 11.36000* 3.12649 .011 3.7098 19.0102
2 2.09000 3.12649 .529 -5.5602 9.7402
30
Lampiran 9 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap konduktansi stomata tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Konduktansi Stomata
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan .000 2 .000 .489 .636
Galat .001 6 .000
Total .001 8
31
Lampiran 10 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap konsentrasi CO2 interseluler tanaman kentang (S. tuberosum L.) kultivar
Nooksack dengan software SPSS 16
Sidik Ragam Konsentrasi CO2 interseluler
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan 1076.187 2 538.094 5.792 .040
Galat 557.375 6 92.896
Total 1633.562 8
Nilai probabilitas signifikansi 0.040 < 0.05 sehingga terdapat perbedaan yang signifikan pada jumlah umbi tanaman yang dilakukan dengan menggunakan tiga galur tanaman.
Uji Lanjut BNT/LSD yaitu Beda Nilai Terkecil untuk mengetahui perlakuan mana yang berpengaruh nyata. Perbandingan Berganda
Peubah: Konsentrasi CO2 interseluler
(I) Galur (J) Galur Perbedaan Nilai Tengah (I-J) Galat Baku α 95% Selang Kepercayaan Batas Bawah Batas Atas
BNT 1 2 -12.44000 7.86960 .165 -31.6962 6.8162
3 -26.76333* 7.86960 .014 -46.0195 -7.5071
2 1 12.44000 7.86960 .165 -6.8162 31.6962
3 -14.32333 7.86960 .119 -33.5795 4.9329
3 1 26.76333* 7.86960 .014 7.5071 46.0195
2 14.32333 7.86960 .119 -4.9329 33.5795
32
Lampiran 11 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap berat basah tajuk tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Berat Basah Tajuk
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan 11.401 2 5.700 .355 .715
Galat 96.334 6 16.056
Total 107.735 8
33
Lampiran 12 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap berat kering tajuk tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Berat Kering Tajuk
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan .553 2 .276 1.586 .280
Galat 1.045 6 .174
Total 1.598 8
34
Lampiran 13 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap jumlah umbi tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Jumlah Umbi
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan .622 2 .311 12.598 .007
Galat .148 6 .025
Total .770 8
Nilai probabilitas signifikansi 0.007 < 0.05 sehingga terdapat perbedaan yang signifikan pada jumlah umbi tanaman yang dilakukan dengan menggunakan tiga galur tanaman.
Uji Lanjut BNT/LSD yaitu Beda Nilai Terkecil untuk mengetahui perlakuan mana yang berpengaruh nyata. Perbandingan Berganda
Peubah: Jumlah Umbi
(I) Galur (J) Galur Perbedaan Nilai Tengah (I-J) Galat Baku α 95% Selang Kepercayaan Batas Bawah Batas Atas
BNT 1 2 -.52333* .12829 .007 -.8373 -.2094
3 -.58667* .12829 .004 -.9006 -.2727
2 1 .52333* .12829 .007 .2094 .8373
3 -.06333 .12829 .639 -.3773 .2506
3 1 .58667* .12829 .004 .2727 .9006
2 .06333 .12829 .639 -.2506 .3773
35
Lampiran 14 Sidik ragam pengaruh gen FBPase/ClRan1 terhadap berat umbi tanaman kentang (S. tuberosum L.) kultivar Nooksack dengan software SPSS 16
Sidik Ragam Berat Umbi
Jumlah Kuadrat (JK) Derajat Bebas (Db) Kuadrat Tengah (KT) Fhitung α
Antar perlakuan 375.384 2 187.692 50.328 .000
Galat 22.376 6 3.729
Total 397.760 8
Nilai probabilitas signifikansi 0.000 < 0.05 sehingga terdapat perbedaan yang signifikan pada berat umbi tanaman yang dilakukan dengan menggunakan tiga galur tanaman.
Uji Lanjut BNT/LSD yaitu Beda Nilai Terkecil untuk mengetahui perlakuan mana yang berpengaruh nyata. Perbandingan Berganda
Peubah: Berat Umbi
(I) Galur (J) Galur Perbedaan Nilai Tengah (I-J) Galat Baku α 95% Selang Kepercayaan Batas Bawah Batas Atas
BNT 1 2 -13.19667* 1.57678 .000 -17.0549 -9.3384
3 -14.15333* 1.57678 .000 -18.0116 -10.2951
2 1 13.19667* 1.57678 .000 9.3384 17.0549
3 -.95667 1.57678 .566 -4.8149 2.9016
3 1 14.15333* 1.57678 .000 10.2951 18.0116
2 .95667 1.57678 .566 -2.9016 4.8149
36