POTENSI PENGGUNAAN KETAMIN SEBAGAI
ALTERNATIF ANASTETIKUM PADA TRANSPORTASI
IKAN PATIN
RIZKI HIDAYAT
DEPARTEMEN ANATOMI, FISIOLOGI DAN FARMAKOLOGI FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Potensi Penggunaan Ketamin sebagai Alternatif Anastetikum pada Transportasi Ikan Patin” adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber dan informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2010
Rizki Hidayat B04061046
RINGKASAN
RIZKI HIDAYAT. Potensi Penggunaan Ketamin sebagai Alternatif Anastetikum pada Transportasi Ikan Patin. Dibimbing oleh ABADI SUTISNA dan ANDRIYANTO.
Tujuan penelitian ini adalah mengetahui potensi penggunaan ketamin sebagai alternatif anastetikum pada transportasi ikan patin. Anastesi ikan patin menggunakan ketamin dalam penelitian ini dilakukan dengan cara perendaman (dipping). Penelitian ini menggunakan rancangan acak lengkap yang terdiri atas 6 kelompok perlakuan yaitu P0 sebagai kontrol negatif merupakan kelompok ikan yang tidak direndam ketamin, sedangkan P1, P2, P3, P4, dan P5 merupakan kelompok ikan yang direndam ketamin dengan dosis masing-masing 10 ppm, 20 ppm, 30 ppm, 40 ppm, dan 50 ppm. Masing-masing perlakuan diulang sebanyak 5 kali. Hasil penelitian menunjukkan bahwa onset paling cepat dimiliki oleh kelompok P4 yaitu 26 menit dan durasi paling lama ditunjukkan oleh kelompok P2 139,12 menit, sedangkan tingkat kematian terendah yang disebabkan oleh ketamin terlihat pada kelompok P2 sebanyak 0%. Namun onset dari kelima perlakuan tidak berbeda nyata sehingga perbedaan dosis tidak terlalu mempengaruhi kecepatan onset. Dengan demikian dapat disimpulkan bahwa dosis yang efektif untuk tujuan transportasi adalah 20 ppm.
ABSTRACT
RIZKI HIDAYAT.
K
etamine Potent Use as Alternative Anaestheticum on Transportation of Catfish. Under direction of ABADI SUTISNA and ANDRIYANTO.The main objective of this study is determining the ketamine potent use as alternative anaestheticum on transportation of catfish. Catfishes were anaesthetized in this study was done by dipping. This study used design randomized complete consist of 6 groups treatment such as P0 negative control without dipping, while P1, P2, P3, P4, and P5 were dipped groups with a dose of ketamine respectively 10 ppm, 20 ppm, 30 ppm, 40 ppm, and 50 ppm. Every treatment was repeated 5 times. The result of this study showed that the fastest onset was P4 group, 26 minutes and the longest duration was P2, 139.12 minutes. The lowest level death was caused ketamine namely P2 groups, 0%. But, the onset of 5 groups treatment wasn’t real diffrence, so could be cloncluded that dose didn’t too influence onset and effective dose for transportation was 20 ppm
©Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
POTENSI PENGGUNAAN KETAMIN SEBAGAI
ALTERNATIF ANASTETIKUM PADA TRANSPORTASI
IKAN PATIN
RIZKI HDAYAT
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
DEPARTEMEN ANATOMI, FISIOLOGI DAN FARMAKOLOGI FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul : Potensi Penggunaan Ketamin sebagai Alternatif Anastetikum pada Transportasi Ikan Patin
Nama Mahasiswa : Rizki Hidayat
NIM : B04061046
Disetujui oleh,
Drh.Abadi Sutisna, M.Si Drh. Andriyanto, M.Si
Pembimbing I Pembimbing II
Diketahui,
Wakil Dekan Fakultas Kedokteran Hewan
Dr. Nastiti Kusumorini NIP. 19621205 198703 2 001
PRAKATA
Puji syukur penulis sampaikan kehadirat Allah SWT yang selalu memberikan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Potensi Penggunaan Ketamin sebagai Alternatif Anastetikum pada Transportasi Ikan Patin”. Skripsi ini disusun untuk meraih gelar sarjana Kedokteran Hewan pada Fkultas Kedokteran Hewan, Institut Pertanian Bogor.
Dengan segala keikhlasan hati, penulis mengucapkan terima kasih kepada: 1. drh. Abadi Sutisna, M.Si dan drh. Andriyanto, M.Si selaku dosen pembimbing yang telah memberikan bimbingan, arahan, dan masukan kepada penulis dengan penuh kesabaran selama pelaksaan penelitian dan penyusunan skripsi.
2. Prof. Dr. drh. Fachriyan H Pasaribu dan Dr. drh. Eva Harlina, M.Si AP.Vet selaku dosen penguji yang telah memberikan bimbingan, arahan, dan masukan dalam menyelesaikan skripsi ini.
3. Keluarga tercinta, Ayahanda Safridal, Ibunda Martina Rahayu, Adik-adikku Johansyah Rasyid dan Mutia Khairunnisa yang telah memberikan segala do’a, dukungan, semangat dan kasih sayang yang tiada henti.
4. Kakek H. Drs. Djasaruddin (alm), nenek Hj. Yulimar DS, dan seluruh keluarga besar Djasaruddin yang telah memberikan segala do’a, dukungan, semangat dan kasih sayang yang tiada henti.
5. Kakek Dalimun (alm), nenek Sapiah (alm), dan seluruh keluarga besar Dalimun yang telah memberikan segala do’a, dukungan, semangat dan kasih sayang yang tiada henti.
6. Seluruh staf departemen Anatomi Fisiologi dan Farmakologi (AFF), pakde Sri dan mas Paimin yang telah membantu dalam pelaksanaan penelitian. 7. Teman-teman sepenelitianku, Kurnia, Laras, Siska, dan Rina yang telah
berjuang bersama-sama dalam menyelesaikan skripsi ini, semoga persahatan kita tak lekang oleh waktu.
8. Keluarga besar IKMP Bogor, keluarga besar IPMM, rekan-rekan kostan Gravehouse, rekan-rekan kostan Wisma Riski, rekan-rekan TPB A20 dan rekan-rekan seperjuangan Aesculapius 43 yang telah menemani selama studi
di Fakultas Kedokteran Hewan (FKH) IPB serta memberikan semangat untuk tetap menyelesaikan studi di FKH IPB.
9. Sahabat karibku, Haris, Yuga, Rian, dan Ega yang telah menemani bercanda gurau selama studi di Fakultas Kedokteran Hewan (FKH) IPB serta memberikan semangat dan motivasi untuk menyelesaikan studi di FKH IPB. 10. Haris Prayitno yang telah banyak menyumbangkan tenaga dan pikirannya
dalam menyelesaikan skripsi ini.
11. Semua pihak yang turut membantu dan memberi dukungan yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, akan tetapi penulis berharap skripsi ini dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Agustus 2010
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 27 Desember 1987 di Pekanbaru, merupakan anak pertama dari tiga orang bersaudara dari pasangan Bapak Safridal dan Ibu Martina Rahayu. Pendidikan formal penulis dimulai di TK Cerdas Koto Kociak (1992-1994) dan dilanjutkan di SDN 19 Koto Kociak (1994-2000). Setelah menyelesaikan pendidikan dasar penulis melanjutkan pendidikan di Madrasah Tsanawiyah Negri (MTsN) Padang Japang (2000-2003), dan menempuh pendidikan menengah atas di SMU N 1 Guguak, Kabupaten Limapuluh Kota, Sumatera Barat (2003-2006). Pada tahun 2006 penulis berkesempatan melanjutkan pendidikan tinggi di Institut Pertanian Bogor melalui jalur USMI. Selanjutnya, pada tahun 2007 penulis diterima sebagai mahasiswa Fakultas Kedokteran Hewan IPB.
Selama menempuh pendidikan tinggi di IPB penulis aktif di beberapa kegiatan baik intra maupun ekstra kampus. Penulis diberi kesempatan dan kepercayan sebagai designer Vetzone periode 2007-2009, ketua Divisi Informasi Komunikasi dan Usaha Himpro HKSA periode 2008-2009, dan ketua Ikatan Kekeluargaan Mahasiswa Payakumbuh (IKMP) Bogor pada periode 2009-2010. Sebagai salah satu syarat untuk memperoleh gelar sarjana, penulis menyusun skripsi dengan judul “Potensi Penggunaan Ketamin sebagai Alternatif Anastetikum pada Transportasi Ikan Patin”.
DAFTAR ISI
Halaman
DAFTAR ISI ...x
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
I.PENDAHULUAN ...1
1.1. Latar belakang ... 1
1.2. Tujuan ... 3
1.3. Manfaat ... 3
1.4. Hipotesis penelitian ... 3
II.TINJAUAN PUSTAKA ...4
2.1. Ikan patin ... 4
2.2. Budidaya patin ... 6
2.3. Pengangkutan ikan ... 7
2.4. Kualitas ikan ... 11
2.5. Stres pada ikan ... 12
2.6. Anastesi ikan ... 13
2.7. Ketamin ... 16
III.METODOLOGI ...18
3.1. Waktu dan tempat ... 18
3.2. Alat dan bahan ... 18
3.3. Tahap persiapan ... 18
3.4. Rancangan percobaan ... 18
3.5. Tahap Perlakuan ... 19
3.6. Parameter yang diamati ... 19
3.7. Analisis data ... 19
IV.HASIL DAN PEMBAHASAN ...20
4.1. Onset ketamin ... 20
4.2. Durasi ketamin ... 22
xi
4.4. Pembahasan umum ... 25
V.SIMPULAN DAN SARAN ...27
5.1. Simpulan ... 27
5.2 Saran ... 27
xii DAFTAR TABEL
Halaman 1. Standar kepadatan ikan dengan menggunakan kantung plastik
(sistem tertutup) ... 9
2. Standar kepadatan ikan dengan sistem transportasi terbuka... 9
3. Tahap anastesi dan recovery ... 15
4. Hasil rataan onset ketamin ... 20
5. Hasil rataan durasi ketamin ... 22
xiii DAFTAR GAMBAR
Halaman
1. Morfologi ikan patin ... 4
2. Skema pola produksi budidaya patin ... 6
3. Sistem transportasi tertutup ... 10
4. Sistem transportasi terbuka ... 10
5. Lokasi organ-organ endokrin yang terlibat dalam respons stres pada ikan ... 12
xiv DAFTAR LAMPIRAN
Halaman 1. Data lengkap monitoring tahapan anastesi pada ikan patin dengan
ketamin dan persentase kematian akibat anastesi ketamin ... 30 2. Hasil rataan onset, durasi, dan persentase kematian anastesi ketamin ... 47 3. Hasil olahan data dengan Analysis of Varian (ANOVA) dan uji duncan
I. PENDAHULUAN
1.1. Latar Belakang
Ikan patin merupakan salah satu jenis ikan konsumsi yang sangat digemari oleh masyarakat Indonesia. Ikan patin memiliki nilai ekonomis yang tinggi karena harga jualnya yang sangat menjanjikan dan melampaui harga jual rata-rata ikan konsumsi jenis lainnya sehingga dikenal sebagai komoditi berprospek cerah. Rasa daging yang enak, lezat, dan gurih membuat masyarakat Indonesia sangat menggemari ikan ini (Sunarma 2007).
Ikan patin memiliki kandungan protein yang tinggi. Meningkatnya kebutuhan konsumen akan makanan sumber protein asal ikan, menuntut mutu ikan yang berkualitas. Mutu makanan asal ikan dipengaruhi oleh banyak faktor antara lain nutrisi, lingkungan, kualitas air, dan penanganan terhadap ikan itu sendiri. Penanganan ikan dapat berupa teknik pemeliharaan, pemanenan, transportasi, dan pengolahan ikan sebelum dikonsumsi. Penanganan transportasi yang tidak baik akan menimbulkan tingkat stres yang tinggi pada ikan sehingga berakhir dengan kematian.
Secara umum ada beberapa subsistem kegiatan budidaya dalam bidang perikanan, meliputi kegiatan pembenihan, pendederan, dan pembesaran. Semua subsistem tersebut saling berhubungan. Kegiatan pembenihan merupakan kunci dari keberhasilan kegiatan lainnya. Tanpa kegiatan pembenihan, kegiatan lainnya tidak akan dapat berjalan. Kegiatan pendederan dan pembesaran pastinya akan memerlukan benih yang berasal dari kegiatan pembenihan (Khairuman dan Sudenda 2009).
Pemindahan benih dari tempat pembenihan ke tempat pembesaran memerlukan penanganan khusus agar benih tetap hidup. Oleh karena itu, perlu diusahakan suatu manajemen transportasi ikan untuk menjaga agar benih ikan tetap dalam keadaan hidup. Transportasi merupakan faktor terbesar yang mempengaruhi kelangsungan hidup ikan, terutama benih ikan. Goncangan selama pengangkutan menyebabkan ikan mengalami stres. Dalam keadaan stres, ikan akan berusaha menyesuaikan diri dengan gangguan yang ada dengan cara menggunakan seluruh energi cadangan yang dimiliki. Apabila gangguan
2 berlangsung terus menerus, ikan akan kehabisan energi dan menjadi lemah (Irianto 2005).
Kondisi ini akan semakin diperparah apabila tidak tersedia kadar oksigen yang cukup dan suhu yang optimal (28-30oC). Suhu yang tinggi menyebabkan metabolisme ikan menjadi tinggi sehingga ikan akan menghasilkan feses yang banyak. Feses yang banyak dalam air membuat kadar amoniak dalam air akan semakin tinggi. Menurut Khairuman dan Sudenda (2009), amoniak merupakan zat beracun yang berbahaya bagi kehidupan ikan patin, sehingga dapat menyebabkan kematian ikan patin. Hingga saat ini transportasi ikan yang ideal masih menjadi masalah, sehingga perlu dilakukan upaya-upaya untuk menghambat laju metabolisme dengan menjaga agar suhu selama pengangkutan tetap rendah (Utomo 2003).
Tingginya tingkat kematian pada saat transportasi benih menyebabkan kurangnya pasokan benih ikan yang dapat dibesarkan. Dengan demikian tentunya akan berimbas terhadap jumlah ikan yang dapat dipasarkan. Oleh karena itu, perlu dilakukan penelitian untuk mencari solusi dalam mengurangi tingkat kematian benih ikan yang mengalami pengangkutan jarak jauh. Salah satu solusi untuk mengurangi stres dan tingkat kematian akibat transportasi adalah dengan membuat benih ikan tertidur dengan menggunakan anastetikum. Anastetikum yang umum digunakan dalam praktek anastesi adalah ketamin.
Ketamin merupakan derivat phencyclidine yang menyebabkan dissociative anastesi, yaitu menunjukkan suatu keadaan kataleptik, mata tetap terbuka dengan adanya nistagmus lambat, tidak komunikatif walaupun tampak sadar. Penggunaan ketamin dalam anastesi sangat bervariasi. Ketamin dapat digunakan sebagai premidikasi, sedasi, induksi, dan anastesi umum. Ketamin cepat dimetabolisme, onset cepat dan kelarutan dalam lemak yang tinggi sehingga menyebabkan tingginya volume distribusi. Pengaruh ketamin terhadap sistem respirasi pada umumnya menguntungkan. Depresi respirasi minimal dan refleks-refleks jalan nafas tetap utuh. Dengan demikian risiko kematian akibat gangguan pernapasan sangat kecil (Winarto 2009 dan Surjandhari 2005). Sifat-sifat menguntungkan yang dimiliki ketamin tersebut diharapkan mampu mengurangi tingkat stres pada
3 ikan yang mengalami transportasi sehingga tingkat kematian akibat transportasi dapat ditekan.
1.2. Tujuan
Penelitian ini bertujuan mengetahui dosis efektif ketamin untuk transportasi ikan patin. Selain itu juga untuk memperoleh anastetikum yang aman dan relatif murah sebagai alternatif anastetikum pada transportasi ikan patin.
1.3. Manfaat
Hasil dari penelitian ini diharapkan dapat digunakan oleh distributor ikan yang memerlukan alternatif anastetikum yang aman dan murah untuk mengurangi tingkat stres serta kematian dalam transportasi ikan. Selain itu, hasil penelitian ini juga dapat digunakan oleh peneliti dan praktisi dalam melakukan pengambilan sampel.
1.4. Hipotesis Penelitian
Perendaman (dipping) ikan ke dalam ketamin sebagai anastetikum sebelum pengangkutan akan mengurangi tingkat stres pada ikan. Semakin rendah tingkat stres pada saat transportasi akan meningkatkan kelangsungan hidup ikan yang mengalami pengangkutan.
II. TINJAUAN PUSTAKA
Secara fisik ikan terdiri atas kepala 21%, tulang 14%, sisik dan sirip 13%, isi perut 16%, dan bagian otot (daging) 36%. Proporsi ini sangat bervariasi menurut ukuran dan bentuk dari setiap spesies, namun pada umumnya bagian daging mencapai 30-40%. Ikan mengandung protein 16-21%, lemak 0,2-2,5%, abu 1,2-1,5%, dan air sekitar 66-81%. Komposisi kimia ini bervariasi antar spesies bahkan antar individu tergantung umur, jenis kelamin, lingkungan, dan musim. Komposisi kimia ikan ini juga berkaitan dengan pakan yang dikonsumsinya. Lemak adalah komponen yang paling tinggi variasinya dalam satu spesies yang pada umumnya dipengaruhi musim atau tingkat reproduksi ikan tersebut. Ikan juga mengandung mineral seperti kalsium, fosfor, magnesium, dan tembaga, terutama pada bagian kepala, tulang, dan kulit, sedangkan hati ikan banyak mengandung zat besi (Anonim 2009).
2.1. Ikan patin
Ikan patin merupakan jenis ikan air tawar yang termasuk kedalam ordo Ostariophysi, subordo Siluroidea, famili Pangasidae, dan genus Pangasius. Dalam bahasa inggris ikan patin dikenal sebagai Catfish (Khairuman 2007). Morfologi ikan patin disajikan pada Gambar 1.
Gambar 1 Morfologi ikan patin
(budidayapatin.files.wordpress.com).
Berdasarkan Gambar 1 terlihat ikan patin memiliki bentuk tubuh memanjang berwarna putih seperti perak dengan punggung berwarna kebiru-biruan. Panjang tubuh ikan patin dapat mencapai 120 cm. Ciri khas ikan patin adalah memiliki kepala yang relatif kecil dan mulut yang terletak di ujung kepala
5 agak di bawah. Pada sudut mulutnya terdapat dua pasang kumis pendek yang berfungsi sebagai alat peraba saat berenang ataupun mencari makan. Ikan patin tidak memiliki sisik seperti ikan-ikan pada umumnya sehingga tubuhnya licin (Susanto 1998). Warna tubuh patin didominasi oleh warna putih berkilauan seperti perak dan punggung berwarna kebiru-biruan. Bagian punggung Ikan patin terdapat sirip yang dilengkapi dengan 7-8 buah jari-jari, dimana salah satu jari bersifat keras dan 6-7 lainnya bersifat lunak. Sebuah jari yang keras ini dapat berubah fungsi menjadi patil. Sirip ekor simetris membentuk cagak. Sirip dada memiliki 12-13 jari-jari lunak dan sebuah jari keras yang juga dapat berfungsi sebagai patil. Sirip dubur panjang dengan 30-33 jari-jari lunak dan sirip perutnya hanya memiliki 6 jari-jari lunak (Khairuman dan Sudenda 2009).
Ikan patin bersifat nokturnal yaitu melakukan aktivitas dimalam hari. Di samping itu, ikan patin juga suka bersembunyi di dalam liang-liang yang dibentuk pada dinding kolam. Ikan patin bersifat omnivora, hal inilah yang membedakannya dengan ikan-ikan catfish lainnya. Di alam, makanan ikan ini antara lain ikan-ikan kecil, cacing, serangga, biji-bijian, udang-udang kecil dan moluska (Susanto 1998). Ikan patin memiliki toleransi yang sangat tinggi terhadap derajat keasaman (pH) air. Dengan demikian ikan ini dapat bertahan hidup dikisaran pH air yang lebar, dari perairan yang agak asam (pH rendah) sampai dengan perairan yang basa (pH tinggi). Kebutuhan oksigen (O2) terlarut untuk kehidupan patin berkisar antara 3-6 ppm, sedangkan karbondioksida (CO2) yang bisa ditoleransi berkisar antara 9-20 ppm. Suhu air sebagai media pemeliharaan yang optimum dalam budidaya patin yaitu 28-30oC.
Ikan patin terdiri atas berbagai jenis. Di Indonesia setidaknya terdapat dua jenis patin yang populer yang telah banyak dibudidayakan oleh masyarakat Indonesia, yaitu patin lokal yang dikenal dengan nama ilmiah Pangasius pangasius dan Patin Siam. Patin lokal juga terdiri dari beberapa jenis, salah satunya patin jambal yang merupakan jenis populer yang berpeluang menjadi komoditas ekspor.
6 2.2. Budidaya Patin
Secara alami ikan patin banyak ditemukan di sungai-sungai besar di Sumatra (Way Rarem, Musi, Indragiri, Batanghari), Jawa ( Brantas, Bengawan Solo), dan Kalimantan. Beberapa tahun terakhir, populasi ikan patin di alam semakin sedikit, hal ini diindikasikan dengan menurunnya hasil produksi tangkapan dari alam. Untuk mengatasi permasalahan tersebut dilakukan pembudidayaan ikan patin (Khairuman 2007).
Secara umum ada beberapa subsistem kegiatan budidaya dalam bidang perikanan, meliputi kegiatan pembenihan, pendederan, dan pembesaran. Semua subsistem tersebut saling berhubungan. Kegiatan pembenihan merupakan kunci dari keberhasilan kegiatan lainnya. Kegiatan pendederan dan pembesaran pastinya akan memerlukan benih yang berasal dari kegiatan pembenihan (Khairuman dan Sudenda 2009). Pola produksi dalam budidaya patin disajikan pada Gambar 2.
Gambar 2 Skema pola produksi budidaya patin.
Selanjutnya Sunarma (2007) menambahkan, dalam melakukan budidaya patin ada beberapa persyaratan yang harus dipenuhi seperti sumber air, kualitas dan kuantitas air. Air merupakan faktor mutlak dalam kegiatan budidaya ikan karena merupakan media hidup ikan yang paling utama. Sumber air dalam kegiatan budidaya dapat berasal dari saluran irigasi, sungai, ataupun sumber air lainnya. Keberhasilan budidaya sangat dipengaruhi oleh kualitas air. Air yang kurang baik dapat menyebabkan ikan mudah terserang penyakit. Terdapat beberapa aspek yang perlu diperhatikan dalam menentukan kualitas air, yaitu:
Sifat kimia air. Air mengandung O2 dan CO2 yang sifatnya saling bertentangan. Oksigen yang terlarut dalam air dapat berasal dari hasil fotosintesis
Pembenihan Pendederan Pembesaran
- Hatcery - Skala Rumah Tangga - Kolam - Jaring - Kolam - Jaring - Keramba
7 dengan bantuan sinar matahari atau berasal dari udara luar melalui proses difusi permukaan air. Ikan patin merupakan jenis ikan yang tahan terhadap kekurangan oksigen di dalam air. Hal ini disebabkan ikan patin dapat mengambil oksigen langsung dari udara bebas sehingga dapat bertahan selama beberapa menit di darat. Kadar oksigen minimum yang baik adalah 4 mg/L air.
Selain O2 dan CO2, air juga memiliki derajat keasaman (pH). Derajat keasaman (pH) merupakan ukuran konsentrasi ion hidrogen yang terlarut sehingga menunjukkan suasana asam atau basa suatu perairan. Derajat keasaman (pH) dipengaruhi oleh konsentrasi CO2 dan senyawa yang bersifat asam. Pada umumnya pH perairan akan meningkat pada siang hari disebabkan oleh proses fotosintesis tanaman air atau fitoplankton yang mengkonsumsi CO2. Pada malam hari terjadi penurunan pH karena tanaman air dan fitoplankton mengkonsumsi O2 dan menghasilkan CO2. Derajat keasaman (pH) yang baik untuk budidaya ikan patin adalah berkisar antara 5-9.
Zat beracun. Zat beracun dalam air yang berbahaya bagi kehidupan ikan patin adalah amoniak. Amoniak dapat berasal dari proses metabolisme ikan atau dari proses pembusukan bahan organik oleh bakteri. Batas konsentrasi kandungan amoniak yang dapat mematikan kehidupan ikan patin berkisar antara 0,1-0,3 mg/L air.
2.3. Pengangkutan Ikan
Pengangkutan ikan adalah memindahkan ikan dari satu tempat ke tempat lain. Pengangkutan ikan bertujuan untuk mengangkut ikan sebanyak mungkin dengan tingkat kematian dan kerugian sekecil mungkin. Pemindahan benih dari tempat pembenihan ke tempat pembesaran memerlukan penanganan khusus agar benih tetap hidup. Secara garis besar pengangkutan ikan hidup dilakukan dengan dua cara yaitu sistem kering dan sistem basah. Pengangkutan sistem kering biasanya dilakukan pada jenis ikan yang dapat tetap hidup walaupun berada di luar air, asalkan tetap dingin dan basah. Sistem ini biasanya diawali dengan menidurkan (immobilized) ikan dengan kejutan dingin, bahan kimia seperti uretan, atau dengan bahan tanaman seperti biji karet, singkong, ekstrak cengkeh, dan lainnya. Ikan kemudian dikemas dengan media lumut, rumput laut, serutan kayu,
8 serbuk gergaji, hancuran es, dan lainnya, selanjutnya diangkut dalam kondisi suhu sejuk. Pengangkutan sistem basah biasanya dilakukan dengan menggunakan wadah, tanki, atau kantong. Untuk pengangkutan dengan tanki perlu diperhatikan kadar oksigen terlarut, CO2, Amoniak (NH3), suhu, keseimbangan osmotik, dan kepadatan ikan. Pengangkutan yang terlalu padat akan mempercepat penurunan oksigen terlarut, meningkatkan suhu, CO2, dan amoniak. Selain itu juga dapat memungkinkan terjadinya penularan parasit dari satu ikan ke ikan lainnya (Anonim 2009).
Pengangkutan ikan dengan sistem basah terdiri dari dua sistem yaitu pengangkutan sistem terbuka dan sistem tertutup. Pada pengangkutan sistem terbuka media air berkontak langsung dengan udara luar, sedangkan pada sistem tertutup tidak terjadi kontak dengan udara luar karena media terdapat dalam wadah yang tertutup rapat. Kebutuhan oksigen pada pengangkutan sistem tertutup dipenuhi dengan memasukkan gas oksigen murni ke dalam wadah tersebut (Utomo 2003).
Ditambahkan lagi oleh Utomo (2003), pengangkutan sistem terbuka biasanya digunakan untuk jalur darat dan jarak tempuh yang relatif dekat. Pada sistem ini sumber oksigen sebagian besar dari oksigen yang terlarut dalam air, yang lainnya hasil difusi udara pada tekanan udara normal. Perbandingan volume air dengan berat ikan relatif besar pada sistem ini dibandingkan pada sistem tertutup. Semakin lama waktu pengangkutan maka semakin tinggi perbandingan volume air dengan berat ikan. Pada sistem tertutup dapat disiasati dengan melakukan upaya-upaya menghambat laju metabolisme dan mencukupi oksigen selama pengangkutan, sehingga volume air dapat dikurangi dan waktu pengangkutan dapat diperpanjang. Berbeda dengan pengangkutan sistem terbuka, pada sistem tertutup oksigen berasal dari oksigen murni yang dimasukkan ke dalam wadah dan tekanan udara di dalam wadah dibuat menjadi lebih tinggi dibanding di luar. Dengan demikian menyebabkan konsentrasi dan kelarutan oksigen dalam media air cukup tinggi.
Sistem transportasi tertutup umumnya dilakukan untuk fase telur, larva, benih, konsumsi, dan induk, sedangkan untuk ukuran induk dan konsumsi dapat juga dilakukan dengan transportasi sistem terbuka. Perbandingan kandungan
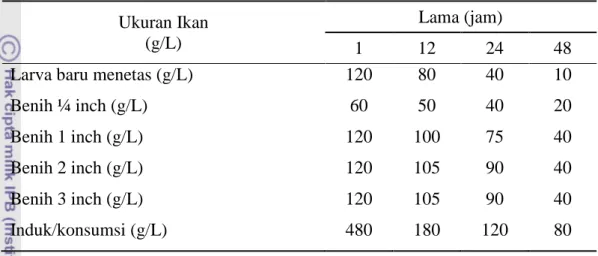
9 oksigen yang digunakan dalam sistem tertutup dengan air yaitu 70:30 (Sucipto 2009). Standar kepadatan ikan pada sistem tertutup yang menggunakan kantong plastik ditampilkan pada Tabel 1.
Tabel 1 Standar kepadatan ikan (gr/L) dengan menggunakan kantong plastik (sistem tertutup)
Ukuran Ikan (g/L)
Lama (jam)
1 12 24 48
Larva baru menetas (g/L) Benih ¼ inch (g/L) Benih 1 inch (g/L) Benih 2 inch (g/L) Benih 3 inch (g/L) Induk/konsumsi (g/L) 120 60 120 120 120 480 80 50 100 105 105 180 40 40 75 90 90 120 10 20 40 40 40 80
Sistem transportasi ikan terbuka memiliki standar kepadatan yang berbeda dengan sistem transportasi tertutup. Standar kepadatan ikan pada sistem transportasi terbuka ditampilkan pada Tabel 2.
Tabel 2 Standar kepadatan ikan (g/L) dengan sistem transportasi terbuka Ukuran Ikan (g/L) Lama (jam) 1 6 12 24 Benih ¼ inch (g/L) Benih 1 inch (g/L) Benih 2 inch (g/L) Benih 3 inch (g/L) Induk/konsumsi (g/L) 120 240 360 360 480 60 180 240 360 180 30 120 120 240 360 30 120 120 180 240 Keberhasilan transportasi benih ikan dipengaruhi oleh beberapa faktor antara lain kondisi fisik maupun kimia air (O2 terlarut, NH3, CO2, pH) dan suhu air. Kepadatan juga sangat mempengaruhi kelangsungan hidup ikan selama pengangkutan, karena semakin padat ikan maka akan semakin tinggi persaingan dalam penggunaan ruang dan oksigen terlarut. Untuk menjaga ikan agar tetap hidup, sehat dan segar sampai ke tangan konsumen sebaiknya menggunakan suhu
10 rendah sekitar 20oC dan hendaknya pengangkutan dilakukan pada pagi atau sore hari (Prihatman 2000).
Menurut Susanto (1998), ada beberapa langkah yang harus dipenuhi untuk mencapai keberhasilan dalam pengakutan benih yaitu: pemberokan atau dipuasakan, air, wadah, dan oksigen. Sebelum pengangkutan ikan dipuasakan selama 18 jam. Hal ini bertujuan untuk mengurangi kotoran yang dikeluarkan selama perjalanan. Karena kotoran ikan akan menyebabkan menurunnya kualitas air. Air yang digunakan adalah air yang sudah diaerasi selama 24 jam. Aerasi bertujuan untuk membuang gas-gas berbahaya di dalam air seperti CO2, dan menambah kandungan O2. Wadah yang biasa digunakan dalam pengangkutan benih ikan patin adalah kantong plastik kecil berkapasitas 5 L. Kantong plastik dibuat rangkap untuk menghindari kebocoran. Perbandingan oksigen yang diperlukan selama transportasi dengan air adalah 2:1. Sebaiknya dalam satu kantong plastik diisi 1 L air sumur yang sudah di aerasi selama 24 jam dan 2 L oksigen dengan tekanan 100 kg/cm2. Selain itu juga harus diperhatikan benih, pengemasan, dan lama pengangkutan. Teknik pengemasan ditampilkan pada Gambar 3 dan Gambar 4.
Gambar 3 Sistem transportasi tertutup.
11 Amonia merupakan produk akhir utama katabolisme protein yang disekresikan keluar tubuh ikan melalui insang dan kulit. Dalam air, amonia ada dalam 2 bentuk yaitu ion-ion amonium (terionisasi, NH4+) dan dalam bentuk amonium bebas (tidak terionisasi, NH3). NH3 bersifat sangat toksik bagi ikan (Irianto 2005).
2.4. Kualitas Ikan
Kualitas ikan diartikan sebagai segala sesuatu yang secara sadar atau tidak merupakan bahan pertimbangan bagi orang yang mengkonsumsi atau membeli ikan. Dengan demikian kualitas ikan dapat ditinjau dari nilai gizi atau nutrisi, tingkat kesegaran, kerusakan yang terjadi selama transportasi, penanganan, pengolahan, penyimpanan, distribusi dan pemasaran, bahaya terhadap kesehatan, dan kepuasan membeli atau mengkonsumsi. Ikan merupakan produk pangan yang sangat mudah rusak. Kerusakan ikan diawali dengan terjadinya autolisis yang disebabkan oleh enzim yang berasal dari ikan itu sendiri, dan kemudian diikuti oleh kerusakan secara mikrobiologis, fisik, atau kimia.
Autolisis terjadi segera setelah ikan mati. Otot ikan akan menjadi kaku karena perubahan senyawa nekliotida akibat terhentinya pasokan oksigen dan energi setelah ikan mati, keadaan ini disebut rigor mortis. Setelah rigor mortis selesai otot ikan akan kembali lemas dan elastis. Rigor mortis berlangsung selama beberapa jam atau hari, tergantung spesies, ukuran ikan, cara penangkapan dan cara penanganan, suhu, serta kondisi fisik ikan. Setelah autolisis selanjutnya adalah pemecahan senyawa-senyawa penyusun ikan menjadi senyawa lain dengan berat molekul yang lebih kecil. Pemecahan penyusun jaringan ikan tersebut berakibat pada penurunan sifat organoleptik seperti bau, rasa, tekstur, dan terkadang warna.
Kerusakan akibat mikrobiologis akan memecah senyawa-senyawa protein, lemak dan karbohidrat menjadi senyawa pembusuk seperti indol, skatol, merkaptan, amonia, asam sulfida, dan lainnya. Kerusakan mikrobiologis inilah yang berperan penting dalam menimbulkan penyakit pada konsumen. Kerusakan kimia seringkali berupa proses oksidasi lemak yang menyebabkan rasa ikan menjadi pahit dan bau yang tengik serta terjadinya perubahan warna daging.
12 Mempertahankan kualitas ikan harus dimulai sejak panen hingga sampai ke konsumen.
2.5. Stres pada ikan
Stres pada ikan didefinisikan sebagai reaksi fisiologis yang terjadi saat ikan mecoba untuk menjaga keseimbangan homeostasisnya (Janouskova et al. 1999). Stres memicu terjadinya perubahan biokimiawi, fisiologis, dan morfologis pada ikan sebagai alarm reaction yang selanjutnya akan memicu rangkaian perubahan hormonal. Dalam keadaan stres ikan akan berusaha menyesuaikan diri dengan gangguan yang ada dengan cara menggunakan seluruh energi cadangan. Apabila gangguan tetap terus berlangsung, ikan akan menjadi lemah akibat kehabisan energi. Akibatnya ikan tidak mampu menghadapi agen patogenik yang secara berkelanjutan kontak dengan ikan, sehingga ikan akan sakit dan mati (Irianto 2005).
Respons hewan secara abnormal akibat perubahan lingkungan (stressor) dimediasi oleh aksi dari syaraf motorik dan pelepasan satu atau lebih hormon ke dalam aliran darah sehingga dapat menstimulasi organ endokrin. Respons hormonal akibat stres pada invertebrata belum begitu dimengerti dengan baik, tetapi pada ikan dan vertebrata lainnya aksi hormonal ini diatur oleh sisem andrenergik dan Hypothalamic Pituitary Inter-renal axis (HPI). Lokasi organ-organ endokrin yang terlibat dalam respons stres pada ikan ditunjukkan pada Gambar 5.
13 Gambar 5 Lokasi organ-organ endokrin yang terlibat dalam respons stres pada
ikan (Ross dan Ross 2008).
Ada tiga tahapan respons ikan terhadap stres yaitu respons primer berupa nervous (gelisah) dan perubahan hormonal berupa peningkatan kortikosteroid dan kathekolamin serta perubaan aktivitas neurotransmitter. Respons sekunder berupa perubahan metabolik, seluler, gangguan osmoregulasi, perubahan gambaran darah, dan fungsi imun. Respons tersier berlangsung pada individu dan populasi. Pada tahap ini terjadi peningkatan metabolisme, penurunan resistensi terhadap penyakit, penurunan tingkat kesuburan, penurunan daya tetas telur, dan perubahan tingkah laku.
Ikan yang stres memiliki respons antibodi dan respons seluler (phagocytic) relatif rendah, sehingga tidak mempunyai ketahanan yang memadai terhadap serangan penyakit. Stres pada ikan dapat disebabkan oleh berbagai faktor dan dapat dikelompokkan menjadi stres kimia, lingkungan, dan biologis. Penyebab-penyebab stres ini dapat langsung mempengaruhi ikan atau secara tidak langsung mempengaruhi kondisi lingkungan ikan. Stres kimia dapat dikarenakan terjadinya penurunan konsentrasi CO2, ammonia maupun nitrit (Afrianto dan Evi 1992).
Beberapa parameter yang dapat menyebabkan terjadinya stres lingkungan antara lain adalah suhu yang ekstrim, air yang terlalu jenuh dengan gas, atau intensitas cahaya yang berlebihan (Afrianto dan Evi 1992). Stres akibat suhu (terutama suhu rendah) dapat secara total menghambat aktivitas killer cells sistem imun, sehingga akan mengeliminasi sistem pertahanan awal yang utama dalam menghambat patogen atau parasit. Suhu yang terlalu tinggi juga bersifat sangat merusak. Peningkatan suhu terlalu tajam, sangat mengganggu kemampuan ikan dalam membebaskan antibodi terhadap patogen secara cepat. Perlu waktu panjang untuk memproduksi antibodi dalam merespons patogen yang menginvasi tubuh sehingga memungkinkan patogen berkembangbiak dan dengan mudah menyebabkan ikan menjadi sakit (Irianto 2005).
2.6. Anastesi Ikan
Anastesi adalah bahan kimia atau agen fisik yang menyebabkan hilangnya mobilitas, keseimbangan, kesadaran, sensasi dan hilangnya kemampuan untuk
14 merasakan sakit melalui depresi sistem saraf pusat dan saraf perifer. Kemampuan ikan merasakan sakit sampai saat ini masih menjadi kontroversi, namun banyak bukti menunjukkan bahwa penggunaan obat bius meningkatkan kesejahteraan ikan (Summerfelt dan Smith 1990).
Penggunaan anastesi mempermudah kerja pada saat penelitian dan studi invasif seperti pembedahan untuk penyidikan fisiologis dimana diperlukan keadaan ikan yang tidak bergerak dalam waktu yang cukup lama. Sedasi dengan anastesi juga digunakan untuk transportasi, grading atau vaksinasi. Meskipun secara umum penggunaan anastesi adalah untuk membuat ikan tidak bergerak, anastesi juga digunakan untuk menurunkan tingkat stres ikan. Hal ini dipertegas lagi oleh Eppard et al. (2003), bahwa penggunaan agen anastesi telah terbukti mengurangi stres fisiologis dalam tindakan pengambilan sampel darah dan mengurangi angka kematian ketika dihadapkan pada tekanan yang berat dan berulang. Ross dan Ross (2008) juga menyebutkan bahwa penggunaan anastesi dapat menekan respons normal kortisol yang merupakan indikator terjadinya stres. Saat ini diketahui banyak digunakan etomidate yang diketahui dapat menghambat sistesa kortisol.
Saat ini hanya Tricaine Methane Sulphonate (TMS) dan metomidate yang terdaftar sebagai anastesi untuk ikan di Kanada. Anastesi yang dipilih tidak boleh memiliki efek samping terhadap ikan maupun pengelolanya. Harus bersifat biodegradable dan mudah dibersihkan setelah tubuh terpapar bahan anastesi (Iwama et al. 2010). Kemudian ditambahkan lagi oleh Tidwell et al. (2004), anastesi yang ideal adalah anastesi yang menimbulkan anastesi dengan cepat dengan tingkat stres minimum dan administrasinya mudah. Recovery harus cepat dan efektif pada dosis rendah serta memiliki margin of safety yang luas.
Anastesi pada ikan biasanya diberikan melalui air, oleh karena itu pada dasarnya merupakan anastesi inhalasi yang akan diserap oleh insang. Pemberian anastesi secara injeksi kurang efektif pada sebagian besar ikan namun efektif pada mamalia (Harms 2009). Efisensi suatu anastesi pada ikan ditentukan oleh spesies, ukuran, kepadatan ikan, serta kualitas air (misalnya suhu dan salinitas). Oleh karena itu perlu dilakukan tes pendahuluan dengan jumlah ikan yang sedikit untuk menentukan dosis optimal dan waktu pemaparan. Perlakuan sebelum ikan
15 dianastesi adalah dengan tidak memberi makan ikan selama 18 jam. Ikan dengan kondisi perut penuh dapat memuntahkan makanannya ketika dianastesi dan akan menyumbat insang serta mengotori air. Kemudian dalam penanganannya juga harus dilakukan dengan hati-hati untuk menghindari lecet dan hilangnya pelindung lendir. Menurut Iwama et al. (1989), terdapat beberapa tahapan anastesi dan recovery pada ikan yang dipaparkan pada Tabel 3.
Tabel 3 Tahapan anastesi dan recovery Tahapan Anastesi Deskripsi I II III Kehilangan keseimbangan
Kehilangan gerakan tubuh tetapi gerakan opercular masih ada Kehilangan gerakan tubuh dan opercular secara total
Tahapan
Recovery
I II III
Tubuh mulai bergerak tapi opercular baru mulai Gerakan tubuh dan opercular mulai aktif
Keseimbangan mulai kembali dan penampilan seperti preanastesi
Sumber : Iwama et al. 1989
Pencapaian tahapan anastesi dipengaruhi dosis dan lamanya paparan. Pada awal induksi biasanya ikan menjadi hiperaktif (Tidwell et al. 2004). Banyak deskripsi tentang tahapan-tahapan anastesi pada ikan. Tahapan-tahapan anastesi yang ditampilkan pada Tabel 1 setidaknya sudah dapat menggambarkan tingkat anastesi yang dialami oleh ikan bagi para peneliti. Kebanyakan anastesi yang digunakan pada ikan sama seperti anastesi yang digunakan pada mamalia bahkan manusia.
Pada sebagian besar anastesi, immobilitas ikan dicapai pada tahap III, namun beberapa anastesi (metomidate, quinaldine sulfat) mungkin tidak sepenuhnya memblok gerakan otot tak sadar sehingga kedutan otot masih akan terjadi. Tahap III anastesi umumnya melibatkan penghentian pernapasan, mengurangi gas transfer yang menyebabkan hipoksia dan asidosis pernapasan akibat pengurangan kadar oksigen darah dan kenaikan serentak CO2 darah. Sebagai akibat dari kurangnya respirasi akan menyebabkan meningkatnya
16 konsentrasi adrenalin dan kortisol dalam darah. Kebanyakan kasus yang terjadi, pepanjangan anastesi tahap III tanpa irigasi insang akan menyebabkan kematian (Iwama et al. 2010).
2.7. Ketamin
Menurut Plumb (2005) Ketamin merupakan anastesi general yang bersifat dissosiative, artinya pasien terlepas dari lingkungan mereka. Ketamin adalah derivat dari phencyclidine yang bekerja menghambat reseptor N-metil-D-aspartat (NMDA). Ketamin menekan thalamoneocortical yang terlibat dalam persepsi nyeri, sehingga ketamin dianjurkan untuk mengontrol rasa sakit. Anastesi ketamin bersifat rapid acting (reaksi cepat) dan juga mempunyai aktivitas analgesik yang signifikan serta efek mendepres cardiopulmonar yang cukup. Ketamin menginduksi terjadinya amnesia dengan mengganggu fungsi sistem syaraf pusat (SSP) melalui over stimulasi SSP. Ketamin menghambat GABA dan juga memblok serotonin, norepinefrin, serta dopamin di SSP. Sistem thalamoneocortical juga akan didepres dan secara bersamaan sistem limbik di aktivasi. Pada kucing ketamin menyebabkan penurunan suhu tubuh rata-rata 1,6oC untuk setiap dosis terapeutik.
Efek analgesia yang sangat kuat dari ketamin menyebabkan penderita masih akan merasakan efek analgesiknya ketika sudah sadar. Rasa nyeri yang dihambat terutama adalah nyeri somatik, sedangkan nyeri viseral hampir tidak dihambat sehingga kurang efektif untuk operasi organ-organ viseral. Secara umum ketamin tidak menimbulkan perubahan tonus otot dan tidak juga menghilangkan refleks pedal dan refleks pinnal. Efek ketamin juga terjadi pada sistem kardiovaskular dengan meningkatkan cardiac output, denyut jantung, tekanan aorta, tekanan arteri pulmonari dan tekanan vena sentral. Efek kardiovaskular ini merupakan efek sekunder untuk meningkatkan tonus simpatis. Ketamin memiliki efek inotropic negatif jika sistem simpatik diblokir. Ketamin tidak mendepres pernapasan secara signifikan pada dosis biasa, tetapi pada dosis yang lebih tinggi dapat menyebabkan frekuensi pernapasan menurun. Pada manusia yang mengidap penyakit asma, ketamin menyebabkan penurunan resistensi saluran udara (Plumb 2005).
17 Ketamin didistribusikan ke seluruh jaringan tubuh secara cepat dengan konsentrasi yang tinggi ditemukan di otak, hati, paru-paru, dan lemak. Ikatan dengan protein plasma sekitar 50% pada kuda, 53% pada anjing dan 37% sampai dengan 53% pada kucing (Plumb 2005). Ketamin dimetabolisme di hati dengan cara demethylasi dan hidroksilasi. Selanjutnya metabolit ketamin diekskresikan melalui renal (90%), feses (5%), dan 4% dalam bentuk yang tidak dirubah diekresikan via urin (Anonim 2001). Metabolitnya memiliki daya kerja analgetis yang berlangsung lama dari pada efek hipnotisnya. Ketamin memiliki efek samping hipertensi, kejang-kejang, sekresi ludah yang kuat dan peningkatan tekanan intrakranial dan intraokuler, juga mengurangi prestasi kegiatan jantung dan paru-paru (Tjay dan Raharja 2007). Ditambahkan lagi oleh Plumb (2005), ketamin dapat menginduksi enzim mikrosomal hepatik, namun yang muncul hanya sedikit. Redistribusi ketamin keluar dari SSP lebih dipengaruhi oleh durasi faktor anastesi daripada eliminasi waktu paruh, sama halnya dengan thiobarbiturat lainnya. Peningkatan pemberian dosis ketamin hanya akan meningkatkan durasi anastesi, sehingga ketamin dikatakan memiliki margin of safety yang luas. Ketamin memiliki indeks terapeutik yang sangat luas, sekitar lima kali lebih besar dari penthobarbital. Ketamin memiliki kelarutan air 200 g/L pada 20oC. Ketamin bersifat aman terhadap pengelola (Merck and Company 1989).
III. METODOLOGI
3.1. Waktu dan tempat
Penelitian ini dilaksanakan pada bulan Agustus sampai dengan September 2009. Penelitian dilakukan di Rumah Ikan Patin Dramaga Pratama, Ciampea, Bogor.
3.2. Alat dan Bahan
Penelitian ini menggunakan ikan patin dengan jumlah 600 ekor yang memiliki panjang sekitar 5 cm, bobot sekitar 6 gram, dan umur sekitar 1 bulan. Ikan yang digunakan berasal dari Rumah Ikan Patin Dramaga Pratama, Bogor. Senyawa yang digunakan dalam perlakuan adalah ketamin. Adapun peralatan yang digunakan yaitu wadah plastik, sendok plastik, baskom, stopwatch dan syringe.
3.3. Tahap Persiapan
Tahap persiapan dilakukan dengan mengaklimatisasi ikan patin percobaan. Aklimatisasi dilakukan selama 1 bulan dengan menempatkan ikan-ikan tersebut pada akuarium yang bersuhu 26oC sampai dengan 28oC. Aklimatisasi dilakukan agar ikan patin percobaan dapat menyesuaikan diri dengan lingkungan penelitian dan meminimalisir kesalahan yang disebabkan oleh faktor lingkungan.
3.4. Rancangan Percobaan
Metode yang digunakan dalam penelitian ini adalah metode rancangan acak lengkap yang terdiri atas 6 perlakuan. Selanjutnya setiap perlakuan tersebut diulang sebanyak 5 ulangan, masing-masing ulangan terdiri atas 5 ekor ikan. Selain itu, untuk meminimalisir galat dilakukan replikasi sebanyak 4 kali pada waktu yang berbeda. Pemberian ketamin dilakukan dengan perendaman (dipping). Rancangan percobaan dapat diuraikan sebagai berikut:
Kontrol (P0) : kelompok ikan patin yang tidak direndam ketamin (kontrol negatif)
Perlakuan 1 (P1) : kelompok ikan patin yang direndam ketamin dengan dosis 10 ppm
19 Perlakuan 2 (P2) : kelompok ikan patin yang direndam ketamin dengan dosis
20 ppm
Perlakuan 3 (P3) : kelompok ikan patin yang direndam ketamin dengan dosis 30 ppm
Perlakuan 4 (P4) : kelompok ikan patin yang direndam ketamin dengan dosis 40 ppm
Perlakuan 5 (P5) : kelompok ikan patin yang direndam ketamin dengan dosis 50 ppm
3.5. Tahap Perlakuan
Tahap perlakuan diawali dengan mengambil ikan dari akuarium dengan menggunakan alat khusus. Setelah itu, ikan percobaan ditempatkan pada wadah plastik yang berisi air sebangak 100 ml, kemudian air diberi ketamin sesuai perlakuan. Selanjutnya, ikan-ikan percobaan ini diamati gejala anastesi yang timbul untuk menentukan onset ketamin. Selain itu, juga diamati kematian ikan untuk mengetahui gambaran keamanan penggunaan ketamin. Sesaat setelah ikan teranastesi, sesegera mungkin ikan tersebut dipindahkan ke dalam gelas plastik yang berisi air tanpa ketamin. Selanjutnya, diamati kondisi ikan sampai pulih kembali, hal ini dilakukan untuk menghitung durasi ketamin.
3.6. Parameter yang diamati
Parameter yang diamati dalam penelitian ini adalah onset dan durasi anastesi pada ikan patin dengan metode dipping. Selain itu juga diamati tingkat kematin akibat anastesi ketamin. Parameter yang diamati untuk mengetahui tahapan anastesi adalah tonus otot, keseimbangan, rasa nyeri, refleks dan kesadaran.
3.7. Analisis data
Data yang diperoleh dianalisis dengan Analysis of Varian (ANOVA). Selanjutnya dilakukan uji Duncan untuk melihat perbedaan pada masing-masing perlakuan.
IV. HASIL DAN PEMBAHASAN
Penelitian ini dilakukan dengan metode dipping ke dalam larutan ketamin terhadap benih ikan patin dengan tujuan untuk mengetahui onset, durasi, dan kematian anastesi ketamin. Ikan yang sudah teranastesi dipindahkan ke dalam wadah berisi air bersih untuk proses pulih sadar (recovery). Berdasakan hasil analisis statistik dari seluruh parameter yang diamati, didapatkan hasil signifikansi >0,05 yang menandakan hipotesa diterima. Hasil penelitian yang diperoleh disajikan sebagai berikut.
4.1. Onset Ketamin
Onset suatu anastetikum merupakan waktu dari mulai hewan diinduksi dengan anastetikum sampai dengan keadaan dimana hewan yang dianastesi mulai berkurang kesadarannya atau bahkan hilang. Onset suatu anastetikum dapat diketahui dengan memperhatikan tahap-tahap anastesi yang ditapilkan pada ikan. Parameter utama untuk mengetahui onset suatu sediaan anastetikum adalah hilangnya beberapa refleks. Hasil rataan onset ketamin disajikan pada Tabel 4. Tabel 4 Hasil rataan onset ketamin
Perlakuan R1 R2 R3 R4 Rataan ± SD P0 0 0 0 0 0 P1 31,01 79,22 22,09 85,72 54,51 ± 32,60a P2 36,97 71,78 21,09 53,95 45,95 ± 21,83 a P3 31,47 49,85 13,79 28,32 30,86 ± 14,82 a P4 32,10 37,92 13,42 20,57 26 ± 11,06 a P5 22,79 56,06 10,02 21,20 27,52 ± 19,86 a
Keterangan: huruf superskrip yang berbeda pada kolom yang sama menyatakan perbedaan yang nyata (p<0,05)
Berdasarkan Tabel 4 dapat dilihat secara berurutan rata-rata onset tercepat adalah P4 (26 menit), P5 (27,52 menit), P3 (30,86 menit), P2 (45,95 menit), P1 (54,51 menit) dan P0 merupakan kontrol negatif yang tidak direndam ketamin sehingga memiliki onset 0. Terlihat dari data yang sudah dipaparkan bahwa semakin besar dosis yang diberikan maka onsetnya juga akan semakin cepat. Secara umum, anastetikum yang ideal adalah anastetikum yang memiliki onset
21 yang cepat, sehingga dari data tersebut dapat disimpulkan bahwa dosis 40 ppm pada P4 merupakan dosis paling baik. Hal ini didukung oleh Tidwell et al. (2004), yang menyatakan bahwa anastesi ideal adalah yang menimbulkan anastesi dengan cepat dengan tingkat stres minimum. Selanjutnya, berdasarkan hasil perhitungan dengan ANOVA didapatkan hasil signifikansi >0,05 yang menandakan hipotesa diterima. Kemudian pada uji lanjut dengan uji Duncan dapat dilihat bahwa tidak terdapat perbedaan yang nyata terhadap penurunan onset pada kelima perlakuan. Hal ini mengindikasikan perbedaan dosis tidak mempengaruhi onset anastesi.
Pada prinsipnya anastesi ikan dengan cara perendaman (dipping) sama halnya dengan anastesi secara inhalasi pada mamalia. Pada pemberian anastesi dengan cara perendaman (dipping) ini, anastetikum akan masuk melalui insang dan didistribusikan ke seluruh jaringan tubuh. Disamping itu, anestestikum juga dapat diabsorbsi oleh permukaan tubuh ikan. Onset anastetikum tercapai ketika ikan mulai kehilangan refleks dan keseimbangannya (Browser 2001). Ikan yang dianastesi akan mulai menunjukkan gejala awal berupa hilangnya keseimbangan, sehingga ikan akan terlihat berenang dengan posisi yang tidak seimbang bahkan terbalik. Selanjutnya, perlahan-lahan ikan akan kehilangan tonus otot yang ditandai dengan kondisi ikan yang terlihat lemah dan tidak mampu berenang, namun respons nyeri masih ada setelah dirangsang. Pada saat ikan kehilangan respons nyeri, inilah saat dimana onset anastesi tercapai. Biasanya ikan yang teranastesi akan diam di dasar wadah tanpa gerakan. Pada Tabel Lampiran 1 disajikan gejala-gejala yang timbul dari mulai ikan diinduksi dengan anastetikum sampai dengan tercapainya onset anastesi. Ikan patin yang mulai teranastesi ditampilkan pada Gambar 6.
22 Sifat suatu anastetikum bergantung pada kelarutannya dalam lemak, ikatan dengan protein, pKa, diffusi pada jaringan, dan efek vasodilatasi. Ketamin didistribusikan dengan cepat ke seluruh jaringan tubuh dan konsentrasi yang tinggi ditemukan di otak, hati dan paru-paru (Plumb 2005). Dengan demikian, ikan yang memiliki kandungan lemak yang banyak akan cepat teranastesi sehingga onsetnya menjadi lebih cepat. Dari hasil penelitian diperoleh onset tercepat adalah 26 menit. Pemberian anastesi ketamin secara intramuskular pada kucing memiliki onset sekitar 10 menit. Hal ini berkaitan dengan sifat kerja obat yang dipengaruhi oleh dosis, rute pemberian, dan berat badan. Dengan demikian, pemberian dosis yang besar akan mempercepat onset suatu anastetikum.
4.2. Durasi Ketamin
Durasi suatu anastetikum dilihat mulai dari ikan teranastesi sampai ikan sadar kembali. Proses pulih sadar (recovery) dimulai ketika stadium anastesi berakhir dan konsentrasi anastetikum di otak mulai berkurang. Kejadian ini dapat diamati melalui respons terhadap nyeri dan keaktifan gerak ikan. Hal ini dapat diamati dengan membandingkan ikan yang dalam proses pulih sadar dengan ikan pada kelompok kontrol negatif. Hasil rataan durasi ketamin disajikan pada Tabel 5.
Tabel 5 Hasil rataan durasi ketamin
Perlakuan R1 R2 R3 R4 Rataan ± SD P0 0 0 0 0 0 P1 93,62 172,83 83,50 183,44 133,35 ± 52,01 a P2 101,60 199,11 96,81 158,98 139,12 ± 48,96 a P3 78,75 123,97 82,09 111,34 99,04 ± 22,15 a P4 91,99 120,45 103,35 97,87 103,41 ± 12,27 a P5 103,95 141,33 77,37 74,93 99,39 ± 30,89 a
Keterangan: huruf superskrip yang berbeda pada kolom yang sama menyatakan perbedaan yang nyata (p<0,05)
Hasil penelitian menunjukkan bahwa durasi anastesi dari yang paling cepat sampai yang paling lambat adalah P5 (96,39 menit), P3 (99,04 menit), P4 (103,41 menit), P1 (133,35 menit) dan P2 (139,12 menit). Dengan demikian,
23 terlihat bahwa perlakuan 2 (P2) atau kelompok ikan yang direndam dengan ketamin 20 ppm memiliki durasi anastesi paling lama yaitu 139,12 menit, Sedangkan durasi anastesi paling cepat terlihat pada perlakuan 3 (P3) yang menggunakan dosis 30 ppm yaitu 99,39 menit. Transportasi ikan tentunya memerlukan anastesi yang mimiliki durasi anastesi yang lama, sehingga memungkinkan untuk digunakan pada transportasi jarak jauh. Hasil pengamatan terhadap durasi anastesi bertentangan dengan pernyataan Plumb (2005), bahwa dengan meningkatnya dosis ketamin yang diberikan maka durasi anastesinya juga akan meningkat.Durasi anastesi dipengaruhi oleh daya ikat anastetikum terhadap protein. Semakin tinggi kemampuan ikatan proteinnya, maka semakin lama durasi anastesi yang dihasilkan. Hal ini disebabkan oleh dinding sel saraf yang mengandung kurang lebih 10% protein (Wirjoatmodjo 2000). Selanjutnya Ross dan Ross (2008) menambahkan bahwa anastesi yang dilakukan pada ikan yang mengandung kadar lemak tinggi menyebabkan senyawa anastesi semakin lama dikeluarkan dari cadangan lemak sebagai aksi pembersihan melalui insang, ginjal atau degradasi metabolik.
Berdasarkan perhitungan dengan ANOVA dan uji Duncan, peningkatan dosis ketamin tidak memberikan perbedaan yang nyata terhadap peningkatan durasi anastesi. Dengan demikian, perbedaan dosis ketamin tidak mempengaruhi durasi anastesi. Hal ini kemungkinan disebabkan oleh sifat ketamin yang memiliki margin of safety yang luas. Ikan yang sudah pulih sadar ditandai dengan kembalinya fungsi refleks, keseimbangan, tonus otot dan rasa nyeri. Kembalinya refleks ikan ditandai dengan respons yang diberikan ikan ketika diberi rangsangan, sedangkan pulihnya keseimbangan dan tonus otot ikan ditandai dengan keaktifan ikan dalam bergerak atau berenang dengan seimbang. Semua parameter ini juga dibandingkan dengan kelompok kontrol ketamin.
4.3. Kematian
Kematian karena anastesi dapat terjadi dalam waktu singkat atau dapat pula dalam waktu panjang. Kematian dalam waktu singkat dapat disebabkan oleh pemberian dosis yang berlebihan (overdose), gangguan pernapasan, dan gangguan sirkulasi, sedangkan kematian dalam waktu panjang dapat disebabkan oleh kegagalan fungsi fisiologis hati dan ginjal (Wirjoatmodjo 2000). Hasil rataan
24 persentase kematian yang disebabkan oleh anastesi ketamin disajikan pada Tabel 6.
Tabel 6 Hasil rataan kematian (%)
Perlakuan R1 (%) R2 (%) R3 (%) R4 (%) Rataan ± SD P0 0 0 0 0 0% P1 1,1 1,1 0 0 0,55% ± 0,63 ab P2 0 0 0 0 0 % ± 0 a P3 2,4 0 0,8 0 0,8% ± 1,13 ab P4 1,2 1,2 0,4 0,4 0,8% ± 0,46 ab P5 3,2 2,4 0,8 0,8 1,8% ± 1,2 bc
Keterangan: huruf superskrip yang berbeda pada kolom yang sama menyatakan perbedaan yang nyata (p<0,05)
Hasil penelitian menunjukkan tingkat kematian dari setiap perlakuan adalah P1 (0,55%), P2 (0%), P3 (0,8%), P4 (0,8%), dan P5 (1,8%). Dari data tersebut terlihat bahwa tingkat kematian paling tinggi disebabkan oleh dosis tertinggi yaitu pada kelompok P5 dengan dosis 50 ppm sebesar 1,8% dan tingkat kematian paling rendah terjadi pada kelompok P2 dengan dosis 20 ppm sebesar 0%. Tingkat kematian yang ditimbulkan oleh ketamin dalam penelitian ini sangat rendah yaitu dibawah 20%. Anastetikum yang menimbulkan kematian kurang dari 20% dapat dikatakan aman. Rendahnya tingkat kematian yang ditimbulkan oleh ketamin disebabkan oleh sifat ketamin pada dosis tinggi hanya meningkatkan durasi anastesi, sehingga ketamin memiliki margin of safety yang luas. Dengan demikian risiko terjadinya overdose juga sangat kecil.
Ketamin tidak mendepres pernapasan secara signifikan pada dosis biasa, namun pada dosis yang lebih tinggi dapat menyebabkan frekuensi pernapasan menurun. Menurunnya frekuensi pernapasan mengakibatkan berkurangnya gas transfer sehingga akan menyebabkan hipoksia dan asidosis pernapasan akibat berkurangnya kadar oksigen darah dan kenaikan serentak CO2 darah. Keadaan ini akan berlanjut dengan meningkatnya konsentrasi adrenalin dan kortisol dalam darah. Meningkatnya durasi anastesi akibat peningkatan dosis ketamin menyebabkan terjadinya perpanjangan tahap III anastesi. Pada banyak kasus,
25 perpanjangan anastesi tahap III tanpa irigasi insang akan menyebabkan kematian (Iwama et al. 2010).
Hasil analisis statistik menunjukkan bahwa dari kelima perlakuan terlihat perbedaan yang nyata terhadap peningkatan jumlah kematian antara perlakuan dosis 20 ppm dan 50 ppm, sehingga perbedaan dosis mempengaruhi tingkat kematian. Tingkat kematian yang dihasilkan relatif rendah. Dengan demikian, dapat disimpulkan bahwa ketamin merupakan anastetikum yang aman, dan dosis terbaik untuk meminimalisir tingkat kematian adalah 20 ppm.
4.4. Pembahasan Umum
Anastesi adalah hilangnya sensasi dan kemampuan merasakan sakit. Pembiusan ikan dilakukan untuk berbagai keperluan seperti dalam prosedur pemeriksaan, transportasi, sampling diagnostik dan pembedahan. Menurut Tjay dan Raharja (2007), analgesia yang baik adalah analgesia yang mulai bekerja dengan cepat tanpa efek samping dan tidak merangsang mukosa. Selain itu juga cepat dalam pemulihannya tanpa efek sisa dan juga tidak boleh meningkatkan peredaran kapiler selama pembedahan. Karena tidak ada obat yang memiliki sifat seperti itu sekaligus, biasanya anastetikum dikombinasikan dengan obat-obat pembantu. Obat pembantu digunakan dengan tujuan untuk meniadakan efek samping obat dan dapat juga untuk memperkuat efek anestetik agar anastetikum bekerja lebih dalam sehingga dosisnya dapat diturunkan.
Kemampuan ikan merasakan sakit masih menjadi suatu kontroversi. Hal ini dikarenakan ikan tidak memiliki cerebral cortex terutama neocortex yang berperan dalam persepsi nyeri. Sebagian ikan memang diketahui memiliki cerebral cortex namun sangat kecil (Ross dan Ross 2008). Walaupun demikian, Summerfelt dan Smith (1990) menyebutkan bahwa banyak bukti yang menunjukkan penggunaan obat bius meningkatkan kesejahteraan ikan.
Pada dasarnya anastesi ikan bertujuan untuk membuat ikan tidak bergerak, disamping itu anastesi juga digunakan untuk menurunkan tingkat stres ikan. Hal ini dipertegas oleh Eppard et al. (2003) bahwa, penggunaan agen anastesi telah terbukti mengurangi stres fisiologis dalam tindakan pengambilan sampel darah
26 dan mengurangi angka kematian ketika dihadapkan pada tekanan yang berat dan berulang.
Pada penelitian ini terdapat beberapa parameter yang digunakan untuk mengamati gejala anastesi antara lain kesadaran, keseimbangan, tonus otot, rasa nyeri, dan refleks. Keseimbangan ditentukan dengan mengamati cara berenang ikan, sedangkan tonus otot ditentukan dengan mengamati kemampuan berenang ikan. Selanjutnya, rasa nyeri dan refleks ditentukan dengan respons yang dihasilkan setelah pemberian rangsangan. Secara umum gejala anastesi yang terlihat pada saat penelitian diawali dengan menurunnya keseimbangan ikan, kemudian diikuti dengan berkurangnya respons terhadap refleks dan rasa nyeri. Selanjutnya, kesadaran dan tonus otot mulai berkurang sampai benar-benar hilang yang menandakan ikan sudah teranastesi.
Anastesi yang ideal adalah anastesi yang menimbulkan efek anastesi dengan cepat dengan tingkat stres minimum dan administrasinya mudah. Selain itu juga harus efektif pada dosis rendah serta memiliki margin of safety yang luas. Hal ini mendukung hasil penelitian terhadap ketamin bahwa ketamin bekerja efektif pada dosis rendah yaitu 20 ppm dan memiliki margin of safety yang luas yang ditunjukkan dengan tingkat kematian yang relatif rendah.
Mekanisme kerja ketamin yaitu berinteraksi dengan reseptor N-methyl D-aspartat (NMDA) yang merupakan reseptor glutamat. Pada saat stres glutamat direlease dalam jumlah berlebih yang menyebabkan stimulasi berlebihan terhadap hypotalamus. Akibatnya Corticotropin Releasing Hormone (CRH) diproduksi dalam jumlah berlebihan dan merangsang hypofise anterior untuk memproduksi Adrenocorticotropic Hormone (ACTH) dalam jumlah berlebihan. ACTH akan merangsang kortek adrenal untuk memproduksi kortisol. Produksi ACTH yang tidak terkontrol menyebabkan produksi kortisol secara berlebihan, sehingga kadar kortisol dalam darah akan tinggi. Peran ketamin dalam menghambat stres adalah dengan berkompetisi dengan glutamat untuk menduduki reseptor NMDA sehingga glutamat menjadi tidak aktif. Dengan demikian kadar kortisol dalam darah akan tetap rendah.
V. SIMPULAN DAN SARAN
5.1. Simpulan
Kesimpulan yang dapat diambil dari penelitian ini adalah :
1. Dosis efektif ketamin untuk transportasi benih ikan patin adalah 20 ppm. 2. Ketamin dapat digunakan sebagai alternatif anastetikum yang murah dan
aman untuk transportasi benih ikan patin.
5.2 Saran
Saran yang dapat diberikan dalam penelitian ini adalah :
1. Perlu dilakukan penelitian lebih lanjut tentang dosis letal dan withdrawal time dari ketamin.
2. Perlu dilakukan penelitian dengan dosis yang berbeda, kombinasi anastetikum atau dengan sediaan anastetikum yang berbeda.
3. Perlu dilakukan simulasi transportasi untuk menguji efektivitas sebenarnya.
DAFTAR PUSTAKA
[Anonim]. 2001. Ketamin Nomination. http://ntp.niehs.nih.gov/ntp/htdocs/Chem_ Background/ExSumPdf/Ketamine.pdf. 16Juli 2009
[Anonim]. 2009. Metodologi Perikanan
Adams, HR. 2001. Veterinary Pharmacology and Therapeutics eighth edition. Iowa State Press: United States of America.
Afrianto E, Evi L. 1992. Pengendalian Hama & Penyakit Ikan. Kanisus: Yogyakarta
Bowser PR. 2001. Anesthetic Options for Fish. http://www.ivis.org/ advances/Anesthesia_Glhttp://en.wikipedia.org/wiki/Anesthesia/ eed/ bowser/ivis.pdf16juli2009
Eppard MB, Brown RS, Cooke SJ, Wagner GN. 2003. Methode For Surgical Implantation Of Acoustic Transmitters In Juvenile Salmonids. U.S Army Corps of Engineers.
Harms C. 2009. Anesthesia In Fish.http://www.petplace.com/fish/anesthesia-in-fish
Irianto A. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press: Yogyakarta.
Iwama GK, McGeer JC, Pawluk MP. 1989. The effects of five fish anaesthetics on acid-base balance, hematocrit, cortisol and adrenaline in rainbow trout. Canadian Journal of Zoology 67:2065-2073.
Iwama GK, Ackerman PA, Morgan JD. 2010. Anesthetics. http://www.ccac.ca. Janouskova D, Svobodova Z, Kalab P, Dusek L, Vykusova B, Kolarova J. 1999.
The Effect of Handling and Transportat the Concentration of Glucose and Cortisol in Blood Plasma of Common Carp. Acta Vet.BRNO,(68) : 265-274
Karnila, Rahman, Edison. 2001. Pengaruh suhu dan waktu pembiusan bertahap terhadap ketahanan hidup ikan jambal siam (Pangasius sutchi F) dalam transportasi sistem kering. Jurnal Natur Indonesia III,(2) : 151 – 167. Khairuman. 2007. Budi Daya Patin Super. PT.Agromedia Pustaka: Jakarta
Khairuman, Sudenda D. 2009. Budidaya Patin Secara Intensif. PT.AgromediaPustaka: Jakarta
Merck and Company. 1989. The Merck Index, 11th ed. 1606pp. Rahway, New Jersey: Merck and Company.
29
Plumb DC. 2005. Veterinary Drug Handbook Fift Edition.Blackwell: United State of America
Prihatman K. 2000. Budidaya Ikan Patin. Proyek Pengembangan Ekonomi Masyarakat Pedesaan
Ross LG, Ross B. 2008. Anasthetic and Sedative Techniques for Aquatic Animals. Blackwell: United State of America
Sucipto, A. 2009. Transportasi Ikan Hidup.naksara.net/Aquaculture/Application/ transportasi-ikan-hidup.html
Summerfelt RC, Smith LS .1990. Anesthesia, surgery and related techniques. In: Schreck CB, Moyle PB (eds) methods for fish biology. American Fisheries Society, Bethesda, MD, pp 213–272
Sunarma A. 2007. Panduan Singkat Teknik Pembenihan Ikan Patin. BBPBAT : Sukabumi
Surjandhari WJ. 2005. Perbandingan Dosis Induksi Ketamin 1mg/kgBB dan 2mg/kgBB Terhadap Kadar Glukosa Darah [Karya Akhir]. Semarang. Program spesialis, Universitas Diponegoro.
Susanto H, Khairul A. 1998. Budidaya Ikan Patin. PT. Penebar swadaya: Jakarta. Tidwell JH, Coyle SD, Durborrow RM. 2004. Anesthetics in Aquaculture.
Southern Regional Aquaculture Centre.
Tjay TH, Kirana R. 2007. Obat-obat Penting Kasiat, Penggunaan dan Efek-efek Sampingnya. Alex Media Komputindo: Jakarta
Utomo NBP. 2003. Modul Pemanenan dan Pengangkutan Ikan. Direktorat Pendidikan Menengah Kejuruan
Winarto D. 2009. Pengaruh Pemberian Ketamin Dosis Induksi dan Analgesi Terhadap Kapasitas Fagositosis Makrofag Intra Peritoneal Mencit Bal B/C yang Terpapar Lipopolisakarida [Laporan Akhir Karya Tulis Ilmiah]. Semarang. Program Sarjana, Universitas Diponegoro.
Wirjoatmodjo K. 2000. Anastesiologi dan Reanimasi Modul Dasar Untuk Pendidikan S1 Kedokteran. Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional : Jakarta
30
Lampiran 1 Monitoring tahapan anastesi ikan patin menggunakan ketamin I. Dosis 10 ppm (0,01 ml)
a. Monitoring tahapan anastesi
Waktu Kesadaran Keseimbangan Tonus Otot Rasa Nyeri Reflek Mati Recovery
Keterangan (menit) 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 Pengulangan 1 10 5 5 5 5 5 1 3 3 4 4 5 5 5 5 5 2 5 5 5 5 2 5 5 5 5 20 2 4 5 5 5 0 0 0 1 2 2 4 5 5 5 1 2 3 3 3 1 2 3 3 3 30 0 0 2 2 2 0 0 0 1 2 0 0 2 2 2 0 0 0 2 2 0 0 0 2 2 40 0 0 1 2 0 0 0 0 1 0 0 0 1 2 0 0 0 0 1 0 0 0 0 1 0 50 0 0 1 2 0 0 0 0 0 0 0 0 1 2 0 0 0 0 1 0 0 0 0 1 0 60 0 0 0 2 0 0 0 0 0 0 0 0 0 2 0 0 0 0 0 0 0 0 0 0 0 70 0 0 0 2 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 Pengulangan 2 10 5 5 5 5 5 3 3 2 3 4 5 5 5 5 5 5 4 5 5 5 5 4 5 5 5 20 5 4 4 5 5 3 1 1 2 3 5 4 4 5 5 3 3 3 5 5 3 3 3 5 5 30 5 3 4 5 5 3 1 1 2 2 5 3 4 5 5 2 1 1 4 2 2 1 1 4 2 40 4 3 4 5 4 2 1 1 1 1 4 3 4 5 4 2 0 1 3 2 2 0 1 3 2 50 4 3 4 4 3 1 1 1 1 1 4 3 4 4 3 2 0 1 2 2 2 0 1 2 2 60 3 3 4 1 3 1 1 0 1 1 3 3 4 1 3 2 0 1 1 2 2 0 1 1 2 70 3 3 3 1 2 1 0 0 1 1 3 3 3 1 2 1 0 0 1 1 1 0 0 1 1 80 3 3 3 1 1 0 0 0 1 1 3 3 3 1 1 1 0 0 1 1 1 0 0 1 1 90 3 3 3 1 1 0 0 0 0 1 3 3 3 1 1 1 0 0 0 1 1 0 0 0 1 100 2 1 3 0 1 0 0 0 0 1 2 1 3 0 1 1 0 0 0 1 1 0 0 0 1 110 1 1 3 0 1 0 0 0 0 1 1 1 3 0 1 1 0 0 0 0 1 0 0 0 0 120 1 1 2 0 1 0 0 0 0 0 1 1 2 0 1 0 0 0 0 0 0 0 0 0 0