34
BAB II
CARA PENELITIAN
A. Alat dan Bahan 1. Alat Penelitian
Neraca analitik (BP221S), autoklaf (AC-300AE, Tiyoda Manufacturing Co., Ltd.), Laminar Air Flow cabinet (FARRco), mesin shaker (Thermolyne), ultrasonikator (Nihonseiki Kaisha US5Q dan Ultrasons P Selecta), sentrifugator (Universal 32R), inkubator (Lab Line), seperangkat mikropipet, lampu UV, chamber KLT. Perlengkapan lain berupa: eppendorf, blue tip,
yellow tip, cawan petri, cawan porselin, ose, pinset, corong pisah, corong
kaca, pelubang gabus, bunsen, dan alat-alat gelas.
2. Bahan
a. Bahan utama
Batang dan daun tanaman jinten (Coleus amboinicus Lour.) yang diperoleh dari koleksi Bagian Biologi Farmasi Fakultas Farmasi Universitas Gadjah Mada.
b. Bahan Pendukung
1) Media pertumbuhan fungi endofit: Potato Dextrose Agar (PDA),
Potato Dextrose Broth (PDB).
2) Media pertumbuhan bakteri uji: Nutrient Agar (NA) dan Nutrient
Broth (NB).
35
4) Untuk keperluan isolasi fungi endofit: aquadest steril, etanol 70%, larutan NaOCl 1%.
5) Larutan streptomisin 10 mg/mL sebagai kontrol positif.
6) Larutan BaCl2 1% dan larutan H2SO4 1% untuk pembuatan standar Mc Farland 0,5.
7) Untuk keperluan KLT digunakan berbagai pelarut sebagai fase gerak, plat silika gel 60 F254 sebagai fase diam.
8) Reagen semprot untuk mendeteksi golongan senyawa pada plat KLT: Serium-Asam Sulfat, FeCl3, Vanilin-Asam Sulfat, Dragendorff, DNPH, SbCl3, Sitroborat.
9) Mikroba uji: Escherichia coli, Staphylococcus aureus, Bacillus
subtilis, Pseudomonas aeruginosa, Salmonella typhi, dan Candida albicans.
B. Jalannya Penelitian 1. Determinasi tanaman
Determinasi tanaman dilakukan di Laboratorium Farmakognosi Bagian Biologi Farmasi Fakultas Farmasi Universitas Gadjah Mada Yogyakarta.
2. Isolasi dan pemurnian fungi endofit dari tanaman jinten
Daun dan batang tanaman jinten dibersihkan dari kotoran dan tanah yang menempel kemudian dicuci dengan air mengalir dan deterjen selama 5 menit. Sterilisasi eksplan dilakukan dengan memasukkan bagian batang dan daun ke dalam larutan etanol 70% selama 5 menit, dan larutan NaOCl 1% selama 5
menit. Pembilasan dilakukan dengan akuades steril sebanyak 3 kali masing-masing selama 1, 3 dan 5 menit, lalu dikeringkan dengan tisu steril di atas cawan petri dalam LAF. Kulit terluar bagian batang dibersihkan dan dipotong melintang serta diberi perlukaan secukupnya. Bagian daun dibuang seluruh bagian tepinya dan dipotong kecil-kecil serta diberi perlukaan secukupnya. Tiap potongan diletakkan pada cawan petri berisi media PDA yang telah memadat. Eksplan batang dan daun masing-masing ditanam pada cawan petri yang berbeda. Pengamatan dilakukan setiap hari sampai muncul fungi yang tumbuh. Untuk memperoleh kultur fungi tunggal, perlu dilakukan pemurnian fungi endofit yang telah tumbuh.
Koloni fungi yang tumbuh dari tiap eksplan diamati bentuk morfologinya secara visual mata untuk mempermudah pemurnian. Pemurnian koloni fungi dilakukan dengan mengambil 1 ose hifa fungi lalu diletakkan pada bagian tengah media PDA yang baru. Pengamatan bentuk koloni fungi dilakukan setiap hari. Jika terdapat kontaminasi, koloni fungi direkultur kembali ke media PDA baru hingga diperoleh kultur tunggal. Adanya kontaminasi ditandai dengan tumbuhnya koloni fungi yang berbeda secara morfologi dengan kultur awal dari eksplan.
3. Skrining aktivitas antimikroba fungi endofit dari tanaman jinten
Pengujian aktivitas antimikroba fungi endofit dari tanaman jinten dilakukan dengan metode difusi padat. Kultur fungi yang murni diujikan terhadap bakteri E. coli, P. aeruginosa, S. thypii (Gram negatif); S. aureus, B.
37
mikroba dengan cara memindahkan satu ose mikroba dari media NA ke dalam 1 mL media NB secara aseptis, kemudian diinkubasi pada suhu 37oC selama 18-24 jam. Setelah inkubasi, kultur suspensi bakteri uji disesuaikan jumlah koloninya dengan larutan Mc Farland 0,5 secara visual mata (jumlah sel bakteri dalam kultur sekitar 108 CFU/mL). Sebanyak 100 µL kultur suspensi mikroba uji diinokulasikan ke dalam 10 mL media NA steril dan dituang di cawan petri. Kultur fungi dibuat plug dengan pelubang gabus sebanyak jumlah mikroba uji. Plug kultur fungi dipindahkan ke media NA yang telah memadat dan diinkubasi pada suhu 37oC selama 18-24 jam. Adanya aktivitas antimikroba ditandai dengan terbentuknya zona jernih di sekeliling plug kultur fungi. Koloni fungi yang paling banyak menghasilkan zona jernih terhadap jenis bakteri uji berbeda dipilih sebagai fungi potensial.
4. Produksi metabolit fungi endofit potensial
Produksi metabolit fungi endofit potensial dilakukan dengan metode fermentasi sistem batch dalam media PDB (Potato Dextrose Broth). Sebanyak 5 plug kultur fungi yang cukup tua (umur 14 hari) diinokulasikan ke dalam 200 mL media PDB secara aseptis. Untuk menjaga aerasi, kultur ditempatkan pada shaker. Suhu fermentor dijaga tetap pada suhu ruang. Fermentasi dilakukan selama 14 hari.
Pengambilan metabolit sekunder hasil fermentasi fungi dilakukan dengan menyari media fermentasi yang telah dipisahkan dari massa selnya dengan pelarut etil asetat. Pemisahan massa sel dilakukan dengan cara penyaringan. Penyarian media fermentasi dengan etil asetat menggunakan corong pisah
(perbandingan media:etil asetat = 2:1). Partisi dilakukan sebanyak 3 kali untuk memastikan metabolit sekunder telah tersari dalam etil asetat. Ekstrak larut etil asetat yang diperoleh dikumpulkan dan diuapkan dalam lemari asam sampai semua pelarut menguap. Ekstrak hasil penguapan disimpan dalam flakon dan dicatat bobotnya. Dengan demikian, telah diperoleh ekstrak larut etil asetat metabolit fungi endofit yang siap untuk digunakan uji aktivitas.
5. Pengujian aktivitas antimikroba ekstrak larut etil asetat metabolit fungi endofit potensial
Pengujian aktivitas antimikroba ekstrak larut etil asetat dilakukan dengan metode Disk Diffusion (Kirby-Bauer Test). Mikroba uji yang digunakan disesuaikan dengan hasil skrining aktivitas fungi yang telah dilakukan sebelumnya. Langkah pertama adalah membuat kultur suspensi bakteri uji dan disesuaikan dengan Mc Farland 0,5 secara visual mata. Tahap berikutnya dibuat seri larutan uji ekstrak larut etil asetat konsentrasi 50 µg/µL, 25 µg/µL, 12,5 µg/µL, 6,25 µg/µL, 3,125 µg/µL dengan menggunakan pelarut etanol absolut.
Sebanyak 100 µL mikroba uji diinokulasikan dalam 10 mL media NA dan dituang dalam cawan petri. Paper disk atau piringan (diameter 0,5 cm) ditetesi larutan uji sebanyak 10 µL tiap seri kadar sehingga jumlah fraksi tiap piringan berturut-turut adalah 500 µg, 250 µg, 125 µg, 62,5 µg, dan 31,25 µg. Sebagai kontrol positif digunakan larutan streptomisin 10 mg/mL dan kontrol negatif adalah etanol absolut masing-masing dengan volume 10 µL. Ketujuh
paper disk kemudian ditempelkan pada media NA yang telah memadat.
39
aktivitas antimikroba ditandai dengan terbentuknya zona jernih disekeliling
paper disk (menunjukkan penghambatan pertumbuhan mikroba uji). Besarnya
diameter zona hambat diukur dengan jangka sorong.
6. Penentuan nilai KHM dan KBM
Nilai KHM ditentukan dengan metode makrodilusi. Setiap tabung reaksi dimasukkan 1700 µL media NB steril, 100 µL kultur suspensi mikroba uji (telah disesuaikan kekeruhannya dengan larutan Mc Farland 0,5) dan 200 µL larutan uji dengan berbagai seri kadar. Jika seri kadar larutan uji yang digunakan adalah 50 µg/µL, 25 µg/µL, 12,5 µg/µL, 6,25 µg/µL, 3,125 µg/µL, maka pada setiap tabung reaksi akan diperoleh kadar akhir senyawa uji sebesar 5000 µg/mL, 2500 µg/mL, 1250 µg/mL, 625 µg/mL, 312,5 µg/mL. Sebagai kontrol positif digunakan larutan streptomisin 10 mg/mL dan kontrol negatif digunakan etanol absolut, masing-masing sebanyak 40 µL. Ketujuh tabung yang telah diisi (total volume 2000 µL) diinkubasi pada suhu 37oC selama 18-24 jam. Nilai KHM ditetapkan sebagai kadar terkecil larutan uji yang terlihat jernih tanpa ada pertumbuhan mikroba uji.
Penentuan nilai KBM dilakukan dengan mengambil cairan dari tiap tabung sebanyak 3 µL lalu digoreskan pada media NA steril tanpa penambahan mikroba dan senyawa uji. Goresan pada media NA yang terlihat jernih setelah inkubasi (suhu 37oC selama 18-24 jam) ditetapkan sebagai nilai KBM.
7. Orientasi kombinasi fase gerak sistem KLT
Orientasi fase gerak perlu dilakukan agar memperoleh fase gerak yang sesuai dan dapat menghasilkan pemisahan terbaik. Sejumlah larutan uji kadar
50 µg/µL ditotolkan pada plat KLT sebanyak 1-2 totolan. Kemudian dielusi dengan kombinasi berbagai fase gerak hingga diperoleh hasil pemisahan yang terbaik. Jarak elusi adalah 8 cm dan pengamatan dilakukan dibawah sinar tampak, UV 254 nm dan 365 nm. Dari hasil orientasi diperoleh kombinasi fase gerak optimum adalah n-heksana:etil asetat:metanol = 2:6:1 (v/v/v) dengan penambahan 1 tetes asam asetat glasial.
8. KLT-Bioautografi metabolit aktif dari fungi potensial
Bioautografi yang digunakan adalah bioautografi kontak. Sampel larutan uji ditotolkan pada plat silika gel 60 F254 dan dielusi dengan fase gerak yang diperoleh dari hasil optimasi. Volume penotolan sebanyak 6 µL dan jarak pengembangan 8 cm. Jumlah titik penotolan disesuaikan dengan jumlah bakteri uji (aktif dihambat) dan jumlah pereaksi semprot (7 pereaksi semprot), dengan jarak antar penotolan sekitar 1 cm. Chamber diisi dengan fase gerak kemudian ditunggu sampai jenuh. Plat yang telah ditotolkan larutan uji dimasukkan dalam chamber dan ditunggu sampai proses elusi selesai. Setelah itu, plat dikering-anginkan dan diamati nilai hRf bercak yang terelusi di bawah sinar UV 254 dan 365 nm.
Sebanyak 100 µL kultur suspensi mikroba uji diinokulasikan dalam 10 mL media NA dan ditunggu memadat. Plat KLT dipotong sejumlah bakteri uji dan disterilisasi di bawah sinar UV 254 nm, kemudian plat ditempelkan pada media NA berisi inokulat mikroba uji dan didiamkan selama 30 menit. Setelah itu, plat diangkat dan media NA diinkubasi pada suhu 37oC selama 18-24 jam. Pengamatan dilakukan terhadap adanya zona jernih yang
41
terbentuk di sepanjang bekas penempelan plat KLT. Zona bening yang terbentuk di sekitar bercak migrasi menandakan golongan metabolit yang aktif sebagai antibakteri. Nilai hRf bercak migrasi aktif tersebut dicatat dan diselidiki jenis golongan senyawanya dengan pereaksi semprot.
9. Karakterisasi golongan senyawa aktif antimikroba dari fungi potensial
Karakterisasi golongan senyawa yang aktif sebagai antimikroba dilakukan dengan pengamatan di bawah sinar tampak, sinar UV 254 nm, UV 365 nm dan visualisasi dengan beberapa pereaksi semprot. Pereaksi semprot yang digunakan antara lain: serium-asam sulfat, FeCl3, vanilin-asam sulfat, Dragendorff , DNPH, SbCl3, sitroborat. Setelah perlakuan dengan pereaksi semprot, lakukan pengamatan sebagai berikut: a) pereaksi serium-asam sulfat: setelah disemprot, plat dipanaskan dan diamati di bawah sinar tampak; b) pereaksi vanilin asam sulfat dan DNPH: setelah disemprot, plat dipanaskan pada suhu 105 oC selama 10 menit, amati dibawah sinar tampak; c) pereaksi Dragendorf, FeCl3: setelah disemprot, plat diamati di bawah sinar tampak tanpa pemanasan (Wagner dan Bladt, 1996); d) pereaksi sitroborat: setelah disemprot, plat diamati adanya pendaran di bawah sinar UV 365 nm (Stahl, 1970); e) pereaksi SbCl3: setelah disemprot plat dipanaskan 100oC selama 5-6 menit kemudian diamati di bawah sinar tampak dan UV 365 nm (Sutrisno, 1986). Perubahan warna bercak migrasi pada plat KLT disesuaikan dengan nilai hRf bercak migrasi yang aktif sebagai antibakteri pada uji KLT-bioautografi, sehingga dapat diperoleh golongan senyawa aktif yang bertanggung jawab sebagai antimikroba.
10. Deteksi keberadaan senyawa antimikroba pada tanaman jinten
Uji ini dilakukan untuk memastikan kesamaan senyawa antimikroba dari fungi endofit dan tanaman asal. Sejumlah daun dan batang tanaman jinten diambil dan dibersihkan dari kotoran dan tanah yang menempel. Pencucian dilakukan di bawah air mengalir. Daun dan batang dipisahkan dan dikeringkan dalam oven 50oC selama 24 jam. Penyerbukan dilakukan dengan mortir dan stamper. Serbuk kering dari daun dan batang dimaserasi dengan etil asetat secara terpisah (1 g serbuk dengan 10 mL etil asetat) kemudian divorteks selama kurang lebih 20 menit dan didiamkan semalam. Filtrat dipisahkan dari serbuk dengan cara penyaringan dan diuapkan sampai ditersisa sekitar 1 mL.
Ekstrak larut etil asetat dari daun dan batang kemudian ditotolkan pada plat KLT sebanyak 3 µL, begitu pula dengan ekstrak larut etil asetat dari fungi endofit potensial. Plat dielusi dalam bejana jenuh dengan fase gerak n-heksana-etil asetat-metanol (2:6:1) dengan 1 tetes asam asetat glasial (jarak elusi 8 cm). Pengamatan hasil elusi dilakukan di bawah sinar tampak, UV 254 nm dan 365 nm. Bercak yang terdeteksi dibandingkan antara ekstrak daun, batang dan ekstrak larut etil asetat dari fungi endofit untuk memastikan keberadaan senyawa metabolit aktif pada daun dan batang tanaman asal.
43
Penentuan KHM dan KBM
KLT-Bioautografi Penentuan golongan senyawa aktif
11. Skema penelitian
Determinasi tanaman ↓
Pengumpulan bahan (berupa batang dan daun jinten) ↓
Isolasi dan pemurnian fungi endofit dari daun dan batang jinten ↓
Kultur murni isolat fungi endofit ↓
Skrining aktivitas antimikroba ↓
Fungi potensial penghasil senyawa antimikroba ↓
Fermentasi fungi potensial ↓
Pengambilan metabolit fungi dengan metode partisi cair-cair menggunakan pelarut etil asetat sebanyak 3 kali
↓
Ekstrak larut etil asetat
C. Cara Analisis
Isolasi fungi endofit dilakukan terhadap koloni fungi yang tumbuh dari bagian eksplan, koloni yang tumbuh terpisah dari eksplan diasumsikan bukan fungi endofit dari tanaman jinten.
Suatu zat dikatakan memiliki aktivitas antimikroba jika pada kadar yang diberikan dapat menghambat pertumbuhan mikroba uji pada media yang ditandai dengan adanya zona hambatan di sekitar zat tersebut. Kultur fermentasi yang murni dilihat dari sel yang tumbuh, kekeruhan media, dan baunya. Sel yang tumbuh dalam media fermentasi harus berupa 1 jenis sel saja, kultur tidak berbau, dan media masih jernih. Media yang keruh menandakan kultur terkontaminasi oleh bakteri. Lama fermentasi ditentukan berdasarkan fase pertumbuhan fungi.
KHM dinyatakan sebagai konsentrasi terkecil yang dapat menghambat pertumbuhan mikroba uji yang ditandai dengan media yang jernih setelah inkubasi. Nilai KBM dinyatakan sebagai konsentrasi terkecil pada bekas goresan larutan uji yang tidak menunjukkan adanya pertumbuhan mikroba uji setelah inkubasi. Identifikasi golongan senyawa aktif menggunakan KLT-bioautografi dan berbagai macam pereaksi semprot yang disemprotkan pada plat KLT.
45
BAB III
HASIL PENELITIAN DAN PEMBAHASAN
A. Determinasi Tanaman
Identifikasi tanaman dimaksudkan untuk memastikan kebenaran jenis tanaman yang digunakan dalam penelitian. Tanaman jinten pada penelitian ini dideterminasi di Laboratorium Farmakognosi Bagian Biologi Farmasi Fakultas Farmasi Universitas Gadjah Mada. Hasil determinasi menunjukkan bahwa tanaman yang digunakan dalam penelitian ini adalah Coleus amboinicus Lour. (Lampiran 1).
B. Isolasi dan Pemurnian Fungi Endofit dari Tanaman Jinten
Isolasi fungi endofit dari tanaman jinten dilakukan terhadap bagian batang dan daunnya. Eksplan batang dan daun yang telah disterilisasi ditanam dalam media PDA secara aseptis. Setelah diinkubasi (kurang lebih 1 minggu), diperoleh beberapa koloni fungi endofit yang tumbuh dari kedua eksplan. Fungi endofit yang diperoleh masih bercampur satu sama lain sehingga perlu dilakukan pemurnian. Pemurnian fungi dilakukan berdasarkan penampakan morfologi fungi secara visual mata. Dari hasil pemurnian, diperoleh dua jenis fungi dari eksplan daun (selanjutnya diberi kode DJ1 dan DJ2) (Gambar 5) dan satu jenis fungi dari eksplan batang (selanjutnya diberi kode BJ1) (Gambar 6). Ciri penampakan morfologi dari ketiga fungi dapat dilihat pada Tabel I.
Gambar 5. Kultur murni fungi endofit dari eksplan daun jinten
Gambar 6. Kultur murni fungi endofit dari eksplan batang jinten
Tabel I. Deskripsi bentuk dan warna kultur murni fungi endofit tanaman jinten
No. Kode Sumber
Eksplan Ciri Fisik
1 DJ1 Daun Koloni berwarna putih dengan serabut hifa yang terlihat jelas seperti benang kapas tetapi lebih tipis dari BJ1 2 DJ2 Daun Koloni berwarna putih, hifa terlihat halus dan tipis 3 BJ1 Batang Koloni berwarna putih dengan serabut hifa lebih tebal seperti
benang kapas
Secara makroskopis, terdapat perbedaan diantara fungi-fungi hasil isolasi dari tanaman jinten. Hal ini dapat dijelaskan sebagai bentuk adaptasi fungi endofit terhadap keadaan fisiologis tanaman inang (Rodriguez dkk., 2009). Meskipun dari tanaman yang sama belum tentu akan menghasilkan jenis fungi yang sama dari setiap organnya, seperti pada penelitian ini fungi hasil isolasi dari batang dan daun memiliki ciri morfologi yang berbeda.
47
C. Skrining Aktivitas Antimikroba Fungi Endofit Hasil Isolasi
Skrining aktivitas antimikroba perlu dilakukan untuk mengetahui aktivitas antimikroba tiap fungi terhadap mikroba uji. Pengujian terhadap ketiga isolat fungi dilakukan dengan metode difusi agar yaitu dengan memindahkan 1 plug kultur fungi murni ke media NA yang telah diinokulasikan mikroba uji. Mikroba uji yang digunakan yaitu E. coli, P. aeruginosa, S. thypi, S. aureus, B. subtilis, dan
C. albicans. Bakteri Gram negatif diwakili oleh E. coli, P. aeruginosa dan S. thypi, sedangkan bakteri Gram positif diwakili oleh S. aureus dan B. subtilis. C. albicans mewakili golongan yeast. Parameter aktivitas antimikroba dari isolat
fungi endofit adalah terbentuknya zona hambat pertumbuhan mikroba di sekeliling plug setelah inkubasi pada 37oC selama 18-24 jam.
Hasil skrining aktivitas antimikroba menunjukkan bahwa fungi endofit DJ2 aktif terhadap bakteri P. aeruginosa, B. subtilis, S. aureus dan S. thypi, fungi BJ1 aktif terhadap E. coli dan B. subtilis, sedangkan fungi DJ1 hanya aktif terhadap
Bacillus subtilis Pseudomonas aeruginosa
Salmonella thypi Staphylococcus aureus
Gambar 7. Hasil skrining aktivitas antimikroba fungi endofit kode DJ2 (Ket.: lingkaran merah menunjukkan zona hambatan pertumbuhan mikroba uji)
Bacillus subtilis Escherichia coli
Gambar 8. Hasil skrining aktivitas antimikroba fungi endofit kode BJ1 (Ket.: lingkaran merah menunjukkan zona hambatan pertumbuhan mikroba uji)
49
Escherichia coli
Gambar 9. Hasil skrining aktivitas antimikroba fungi endofit kode DJ1 (Ket.: lingkaran merah menunjukkan zona hambatan pertumbuhan mikroba uji)
Tabel II. Hasil skrining aktivitas antimikroba fungi endofit dari tanaman jinten terhadap enam mikroba uji
No. Kode fungi E. coli P. aeruginosa S. thypi S. aureus B. subtilis C. albicans 1 DJ1 + - - - - - 2 DJ2 - + + + + - 3 BJ1 + - - - + - Ket.:
(+) : ada zona hambatan (-) : tidak ada zona hambatan
Berdasarkan tabel II, terlihat ketiga fungi hanya aktif terhadap beberapa jenis bakteri saja. Perbedaan kemampuan antibakteri dari ketiga fungi disebabkan oleh jenis metabolit sekunder yang dihasilkan berbeda satu sama lain. Prescott (2002) menyatakan bahwa ada antibiotik berspektrum sempit yang hanya efektif terhadap jenis patogen tertentu saja dan ada pula yang efektif terhadap berbagai jenis patogen (spektrum luas). Fungi DJ2 dan BJ1 mungkin menghasilkan antibiotik yang berspektrum luas karena mampu menghambat pertumbuhan bakteri baik Gram positif maupun Gram negatif meskipun tidak aktif terhadap
yeast. Berdasarkan hasil pengujian ini, dipilih fungi DJ2 sebagai fungi potensial
karena mampu menghambat pertumbuhan bakteri yang lebih banyak dibandingkan dengan fungi BJ1 dan DJ1.
D. Produksi Metabolit Fungi Endofit DJ2
Fermentasi fungi DJ2 dilakukan dalam media PDB dan menggunakan sistem batch atau sistem tertutup yang mengandung nutrisi dengan jumlah terbatas karena tidak dilakukan penambahan media (Stanbury dkk., 1995). Penggunaan media PDB untuk fermentasi diharapkan dapat memperpendek fase lag dari kultur fungi karena adanya kesamaan nutrisi dengan media PDA yang digunakan sebelumnya. Fase lag yang lebih pendek memungkinkan fungi untuk memasuki fase logaritmik lebih cepat sehingga diharapkan pembentukan metabolit sekunder pada fase stasioner lebih cepat. Menurut Stanburry dkk. (1995), pembentukan metabolit sekunder oleh kebanyakan mikroorganisme terjadi pada fase stasioner. Kandungan nutrisi yang sama antara kedua media tersebut diharapkan dapat menjamin fungi yang difermentasi akan menghasilkan produk yang sama dengan yang sebelumnya. Selama proses fermentasi, kultur digojog dalam shaking
incubator agar konsentrasi nutrisi dan oksigen dalam fermentor dapat terjaga
homogenitasnya.
Penggunaan media cair untuk fermentasi fungi lebih efektif untuk memproduksi biomassa sel dan senyawa bioaktif dibandingkan fermentasi dalam media padat (Pokhrel dan Ohga, 2007). Hal ini karena pada fermentasi cair dapat dilakukan proses agitasi yang berperan untuk menjaga homogenitas nutrisi dalam media serta mencegah terbentuknya gradien konsentrasi produk atau toksin sehingga absorbsi nutrisi oleh fungi menjadi optimal (Purwanto, 2011). Untuk menghasilkan proses agitasi yang sempurna, perbandingan jumlah media dengan ukuran fermentor sebaiknya 2:5 (Wu dkk., 2004). Oleh karena itu, proses
51
fermentasi pada penelitian ini dilakukan dalam labu erlenmeyer 500 mL yang diisi dengan media PDB sebanyak 200 mL.
Proses fermentasi dilakukan sampai mikroba mencapai fase stasioner dan konsistensi media fermentasi berubah menjadi kental. Media fermentasi yang berubah menjadi keruh tidak digunakan karena dikhawatirkan terkontaminasi dengan bakteri. Awalnya, fermentasi dilakukan selama 10 hari. Namun, karena hasil uji disk diffusion fraksi etil asetatnya tidak memberikan zona hambat seperti hasil uji skrining awal, maka fermentasi diperlama hingga 14 hari dengan harapan semua metabolit sekunder yang dihasilkan fungi telah terbentuk. Media fermentasi DJ2 berwarna kuning jernih dengan massa sel bulat-bulat putih (Gambar 10). Kultur fungi membentuk massa sel seperti pelet sehingga mudah untuk dipisahkan dengan penyaringan. Pelet merupakan kumpulan sel fungi dalam media fermentasi cair dan mulai terlihat dalam waktu 36-48 jam jika inokulum berupa spora, namun bisa lebih cepat jika inokulum berupa mycelia (Calam, 1987). Inokulum yang digunakan pada penelitian ini berupa plug dari koloni fungi dalam media padat sehingga pelet cepat terbentuk.
Kultur hasil fermentasi kemudian dipisahkan dari massa selnya dengan cara penyaringan. Media yang diperoleh selanjutnya diekstraksi menggunakan etil asetat dengan perbandingan media:etil asetat = 2:1 sebanyak 3 kali (Gambar 9). Indeks polaritas etil asetat adalah 4,4 (bersifat semi polar) sehingga dapat melarutkan senyawa-senyawa yang relatif kurang polar. Senyawa antibiotik yang telah diisolasi dari fungi endofit umumnya berupa senyawa alifatik, alkaloid, peptida, fenol, steroid, dan terpenoid yang umumnya bersifat kurang polar (Yu dkk., 2010). Oleh karena itu, penggunaan etil asetat sebagai penyari diharapkan dapat melarutkan semua senyawa yang terdapat dalam media fermentasi. Fraksi etil asetat dikumpulkan dan diuapkan dalam lemari asam hingga diperoleh ekstrak kental. Ekstrak kental dari fungi DJ2 berwarna coklat kemerahan (Gambar 11) dengan rendemen sebesar 0,15 % b/v ± 0,012. Ekstrak kental (selanjutnya disebut ekstrak larut etil asetat) kemudian dibuat larutan stok kadar 50 µg/µL untuk digunakan pada pengujian selanjutnya.
A B C
Gambar 11. Partisi media hasil fermentasi DJ2 (A), ekstrak larut etil asetat metabolit fungi DJ2 (B) dan larutan stok ekstrak metabolit fungi DJ2 (C)
53
E. Pengujian Aktivitas Antimikroba Ekstrak Larut Etil Asetat Fungi DJ2
Pada tahap ini, ekstrak larut etil asetat yang diperoleh diuji kembali aktivitas antimikrobanya untuk memastikan senyawa yang dihasilkan oleh fungi potensial telah berhasil diekstraksi dengan etil asetat. Metode pengujian yang digunakan adalah metode disk diffusion atau disebut juga Kirby-Bauer Test. Metode ini merupakan metode yang sederhana, mudah dilakukan dan relatif murah meskipun data yang dihasilkan sering kali tidak cukup untuk tujuan klinis (Tortora dkk., 2010). Ekstrak larut etil asetat metabolit DJ2diujikan terhadap mikroba uji sesuai hasil skrining sebelumnya.
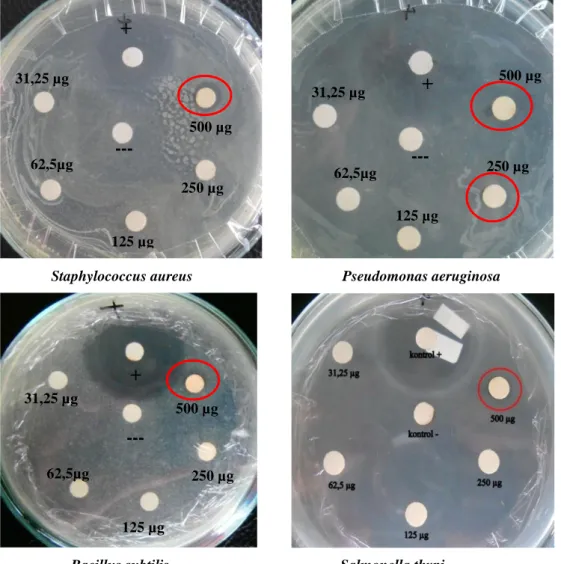
Fungi DJ2 difermentasi hingga 14 hari hingga semua metabolit yang aktif sebagai antimikroba telah diproduksi. Pengujian ekstrak larut etil asetat dari kultur fermentasi umur 14 hari menunjukkan adanya zona hambat pertumbuhan bakteri uji. Besar zona hambat yang terbentuk berbeda-beda untuk setiap bakteri uji. Ekstrak larut etil asetat metabolit fungi DJ2 aktif menghambat S. aureus, B.
subtilis, dan S. thypi masing-masing pada kadar 500 µg, sedangkan terhadap P. aeruginosa pada kadar 500 dan 250 µg (Gambar 12 dan Tabel III).
Staphylococcus aureus Pseudomonas aeruginosa
Bacillus subtilis Salmonella thypi
Gambar 12. Hasil uji aktivitas antimikroba ekstrak larut etil asetat metabolit fungi DJ2
Tabel III. Diameter zona hambat ekstrak larut etil asetat metabolit fungi DJ2
No. Bakteri Uji
Diameter Zona Hambat (mm)
Kontrol + 500 µg 250 µg 125 µg 62,5 µg 31,25 µg Kontrol - 1 S. aureus 20,15 8,82 - - - - - 2 P. aeroginosa 25,43 10,95 7,48 - - - - 3 B. subtilis 24,45 6,53 - - - - - 4 S. thypi 24,13 7,18 - - - - - Ket.: Kontrol + : streptomisin 100 µg Kontrol - : pelarut
+
--- 500 µg 250 µg 125 µg 62,5µg 31,25 µg+
--- 500 µg 250 µg 125 µg 62,5µg 31,25 µg+
--- 500 µg 250 µg 125 µg 62,5µg 31,25 µg55
F. Penentuan Nilai KHM dan KBM
Nilai KHM dan KBM dapat digunakan sebagai tolok ukur potensi agen antimikroba. Penentuan nilai KHM dilakukan dengan metode makrodilusi dengan seri kadar larutan uji berturut-turut 5000 µg/mL, 2500 µg/mL, 1250 µg/mL, 625 µg/mL, dan 312,5 µg/mL. Sebagai kontrol positif digunakan streptomisin dan kontrol negatif digunakan pelarut etanol absolut.
Berdasarkan hasil uji, nilai KHM dari ekstrak larut etil asetat DJ2 tidak dapat ditentukan karena kultur yang berisi media NB dan mikroba uji berubah menjadi keruh setelah penambahan larutan uji sehingga pengamatan sulit untuk dilakukan (Gambar 13). Menurut Pratiwi (2008), nilai KHM didefinisikan sebagai kadar terkecil yang menghasilkan larutan jernih (tidak tampak adanya pertumbuhan mikroba) secara kasat mata. Oleh karena itu, nilai KBM-nya langsung ditentukan dengan cara menggoreskan 3 µL larutan hasil uji KHM ke dalam media NA tanpa penambahan mikroba maupun larutan uji. Nilai KBM ditentukan sebagai kadar terkecil yang masih terlihat jernih (tidak ada pertumbuhan mikroba) setelah diinkubasi selama 18-24 jam (Prescott, 2002). Hasil pengujian KBM dapat dilihat pada Gambar 14.
Pseudomonas aeruginosa
Bacillus subtilis
Staphyllococcus aureus
Salmonella thypi
Gambar 13. Hasil penentuan KHM ekstrak larut etil asetat metabolit fungi DJ2 terhadap bakteri uji
57
A B
C D
Gambar 14. Hasil penentuan KBM ekstrak larut etil asetat metabolit fungi DJ2 terhadap bakteri uji
(Ket.: A= P. aeruginosa; B= B. subtilis; C= S. aureus; D= S. thypi)
Berdasarkan hasil pengujian, nilai KBM ekstrak larut etil asetat metabolit fungi DJ2 terhadap P. aeruginosa, B. subtilis, S. aureus, dan S. thypi berturut-turut adalah 625 µg/mL, lebih dari 5000 µg/mL, 2500 µg/mL, dan 312,5 µg/mL. Pada pengujian terhadap S. aureus dan B. subtilis, kontrol positif (streptomisin 10 mg/mL) tumbuh satu koloni bakteri uji (Gambar 14 B dan C). Awalnya, hal ini diduga karena larutan streptomisin telah terdegradasi sehingga mengalami perubahan aktivitas. Oleh karena itu, dilakukan pengujian ulang dengan menggunakan larutan streptomisin yang baru dibuat. Meskipun begitu, hasil yang diperoleh tetap sama, yaitu terdapat pertumbuhan bakteri S. aureus dan B. subtilis, sedangkan terhadap S. thypi dan P. aeruginosa tidak terdapat pertumbuhan koloni.
Streptomisin memiliki aktivitas antibakteri yang lebih baik terhadap bakteri Gram negatif dibandingkan dengan bakteri Gram positif (Tortora dkk., 2010). S.
aureus dan B. subtilis termasuk bakteri Gram positif, sedangkan S. thypi dan P. aeruginosa termasuk Gram negatif. Oleh karena itu, efek bakterisid dari
streptomisin mungkin tidak muncul terhadap bakteri S. aureus dan B. subtilis tetapi muncul terhadap bakteri S. thypi dan P. aeruginosa. Streptomisin termasuk dalam antibiotik aminoglikosida dengan mekanisme aksi menghambat sintesis protein (Todar, 2012a) yaitu dengan mengubah formasi ribosom unit 30S sehingga tidak bisa lagi berikatan dengan unit 70S. Akibatnya, proses translasi mRNA menjadi terganggu (Tortora dkk., 2010). Proses tranlasi mRNA penting untuk sintesis protein.
Gambar 14A dan 14C terlihat perbedaan jumlah koloni bakteri antara kontrol negatif dan kadar larutan uji terkecil (312,5 µg/mL). Hasil rekultur kontrol negatif menunjukkan pertumbuhan bakteri yang jauh lebih banyak dibanding dengan kadar 312,5 µg/mL dengan menggunakan volume larutan uji yang sama (3 µL). Hal ini menunjukkan bahwa pada kadar tersebut ekstrak metabolit fungi DJ2 mampu menghambat pertumbuhan bakteri P. aeruginosa dan S. aureus, meskipun secara visual larutan uji terlihat keruh ketika penentuan nilai KHM. Begitu pula pada gambar 14B, perbedaan jumlah koloni antara kadar 312,5 µg/mL dan 625 µg/mL terlihat berbeda secara kasat mata sehingga dapat dikatakan pada kadar 625 µg/mL dapat menghambat pertumbuhan B. subtilis.
Rasio KBM:KHM dapat digunakan sebagai tolok ukur penentuan sifat bakteriostatik dan bakterisidal dari suatu antibiotik. Suatu antibiotik termasuk
59
bersifat bakterisidal jika memiliki rasio KBM:KHM ≤ 4, bersifat bakteriostatik jika memiliki rasio KBM:KHM ≥16 (Bartlett, 2013) dan dikatakan toleran jika
memiliki rasio KBM:KHM sebesar 32 (NCCLS, 1999). Rasio KBM:KHM yang cukup besar menunjukkan sifat toleran bakteri uji terhadap agen antibakteri yang diujikan.
Jika nilai KHM dari ekstrak larut etil asetat fungi DJ2 terhadap P.
aeruginosa, B. subtilis, S. thypi, dan S. aureus diasumsikan berdasarkan total
koloni bakteri ketika rekultur pada media padat dan dibandingkan dengan kontrol negatif, maka diperoleh nilai KHM terhadap P. aeruginosa dan S. aureus adalah sebesar 312,5 µg/mL, terhadap B. subtilis sebesar 625 µg/mL, sedangkan terhadap
S. thypi kurang dari 312,5 µg/mL. Nilai KBM dari ekstrak larut etil asetat fungi
DJ2 terhadap P. aeruginosa, S. thypi, dan S. aureus berturut-turut adalah 625 µg/mL, 312,5 µg/mL dan 2500 µg/mL, sedangkan terhadap B. subtilis lebih dari 5000 µg/mL. Berdasarkan hasil ini, ekstrak larut etil asetat metabolit fungi DJ2 dapat dikatakan bersifat bakterisidal terhadap P. aeruginosa dan S. thypi karena memiliki rasio KBM:KHM sebesar ≤ 4, sedangkan terhadap S. aureus dan B.
subtilis mungkin bersifat bakteriostatik.
G. KLT-Bioautografi
Metode KLT-bioautografi banyak digunakan untuk mendeteksi golongan senyawa yang aktif sebagai antimikroba. Sistem KLT yang digunakan pada penelitian ini adalah normal phase dengan fase diam yang lebih polar dari fase gerak. Berikut sistem KLT yang digunakan:
Fase diam : silika gel 60 F254
Fase gerak : n-heksana:etil asetat:metanol (2:6:1 v/v/v) dengan penambahan 1 tetes asam asetat glasial
Jarak pengembangan : 8 cm
Volume penotolan : 6 µL (larutan metabolit DJ2 kadar 50 µg/µL) Jumlah penotolan : 11 buah (4 totolan untuk mikroba uji, 7 totolan
untuk karakterisasi golongan senyawa aktif)
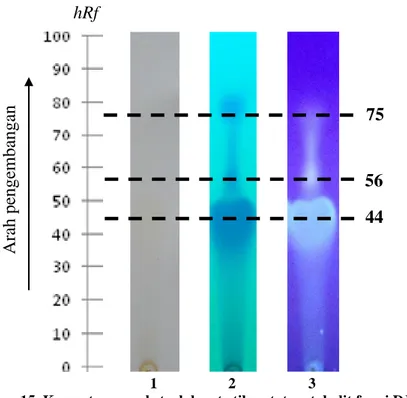
Proses elusi dilakukan dalam bejana yang telah dijenuhkan dengan fase gerak agar proses elusi menjadi lebih optimal. Setelah elusi selesai, plat dikeringkan terlebih dahulu kemudian diamati di bawah sinar tampak, UV 254 nm dan 365 nm. Pengamatan kromatogram di bawah sinar UV 254 nm tampak peredaman pada hRf 44, 56, dan 75. Peredaman di bawah sinar UV 254 nm menunjukkan bahwa senyawa tersebut memiliki minimal 2 ikatan rangkap terkonjugasi. Pengamatan di bawah sinar UV 365 nm tampak fluoresensi kuning kehijauan pada hRf 44 dan 56 dan fluoresensi kuning kehijauan tipis di hRf 75. Fluoresensi di bawah sinar UV 365 nm menunjukkan bahwa senyawa tersebut memiliki ikatang rangkap terkonjugasi yang lebih panjang (kromofor) dan gugus auksokrom pada strukturnya. Plat KLT di bawah sinar tampak bercak berwarna kuning pucat. Kromatogram ekstrak larut etil asetat metabolit fungi DJ2 dapat dilihat pada Gambar 15.
61 Ar ah pe ng embanga n
Gambar 15. Kromatogram ekstrak larut etil asetat metabolit fungi DJ2 Ket.: 1= sinar tampak; 2= sinar UV 254 nm; 3= sinar UV 365 nm
Fase diam = silika gel 60 F254; Fase gerak = n-heksana:etil asetat:metanol (2:6:1 v/v/v)
dengan penambahan 1 tetes asam asetat glasial; Jarak pengembangan = 8 cm
Plat KLT kemudian ditempelkan pada media NA yang telah diinokulasikan bakteri uji (satu cawan petri satu jenis bakteri) dan ditunggu selama 30 menit agar senyawa yang telah terelusi dapat berdifusi ke dalam media. Kecepatan difusi suatu senyawa sangat dipengaruhi oleh bobot molekul (BM) dan kelarutannya dalam media padat. Semakin besar BM senyawa tersebut maka kecepatan difusinya akan semakin berkurang. Tehnik bioautografi lain seperti bioautografi
overlay memiliki sensitivitas yang lebih baik dari pada bioautografi kontak
(Kusumaningtyas dkk., 2008) tetapi memerlukan perlakuan khusus untuk deteksi zona hambatnya yaitu dengan menyemprotkan MTT (Methyl Thiazole
Tetrazolium) pada media kultur bakteri uji. Pada bioautografi kontak, deteksi zona
1 2 3
hRf
75
56 44
hambat pertumbuhan bakteri dapat dilakukan secara langsung setelah inkubasi tanpa penyemprotan MTT.
Hasil KLT ekstrak larut etil asetat metabolit fungi DJ2 terdapat tiga bercak dengan hRf berbeda yang berarti sekurang-kurangnya terdapat 3 senyawa berbeda dalam ekstrak tersebut. Berdasarkan uji bioautografi, terdapat zona hambat pertumbuhan bakteri P. aeruginosa dan S. thypi pada hRf 44, terhadap S. aureus terdapat dua bercak yang aktif menghambat pertumbuhan bakteri yaitu bercak pada hRf 44 dan 32, sedangkan terhadap B. subtilis terdapat 4 zona jernih pada
hRf yang berbeda, yaitu 19, 44, 62, dan 75. Bercak hRf 19, 32, dan 62 belum
terdeteksi di bawah sinar tampak, UV 254 nm dan 365 nm. Berdasarkan hasil uji, dapat disimpulkan bahwa fungi DJ2 menghasilkan beberapa senyawa yang berbeda dengan aktivitas antibakteri yang berbeda terhadap bakteri uji. Hasil bioautografi dari ekstrak larut etil asetat metabolit fungi DJ2 ditunjukkan pada Gambar 16.
63
Pseudomonas aeruginosa Bacillus subtilis
Staphylococcus aureus Salmonella thypi
Gambar 16. Hasil KLT-bioautografi ekstrak larut etil asetat metabolit fungi DJ2
44 44 44 32 44 75 62 19
H. Karakterisasi Golongan Senyawa Aktif Antimikroba
Penentuan golongan senyawa aktif yang memberikan zona hambat pertumbuhan bakteri pada uji KLT-bioautografi dilakukan dengan penyemprotan plat KLT dengan beberapa pereaksi. Kromatogram dan hasil penyemprotan dengan pereaksi semprot dapat dilihat pada Gambar 20. Sebelum dilakukan penyemprotan, hasil elusi tampak 3 bercak (hRf 44, 56, dan 75) yang mengalami peredaman di bawah sinar UV 254 nm dan fluoresensi kuning kehijauan di bawah sinar UV 365 nm, sedangkan di bawah sinar tampak hanya terlihat warna kuning pucat pada bercak hRf 44. Plat silika gel 60 F254 akan berfluorosensi kuning-hijau jika terkena sinar UV 254 nm karena dilapisi oleh senyawa yang dapat berfluoresensi seperti fluorescin. Senyawa yang mempunyai ikatan rangkap terkonjugasi dalam struktur molekulnya akan mengabsorbsi sinar UV sehingga bagian plat yang terdapat bercak senyawa tersebut akan terjadi peredaman. Sementara itu, senyawa yang mampu berfluoresensi dibawah sinar UV 366 nm menunjukkan bahwa senyawa tersebut mempunyai gugus kromofor dan auksokrom (Aprisani dan Astuti, 2005).
Berikut hasil yang diperoleh setelah penyemprotan plat KLT.
1. Pereaksi vanilin-H2SO4 digunakan untuk deteksi senyawa terpenoid, steroid, komponen minyak atsiri seperti senyawa alkohol dan fenol (Wagner dan Bladt, 1996; Sutrisno, 1986). Hasil positif ditunjukkan dengan perubahan warna bercak menjadi biru, hijau, merah atau coklat di bawah sinar tampak setelah pemanasan 110oC selama 10 menit.
65
Sebelum dilakukan penyemprotan dengan vanilin-H2SO4, ketiga bercak (hRf 44, 56, dan 75) pada plat KLT berupa peredaman di bawah sinar UV 254 nm dan fluoresensi kuning-kehijauan di bawah sinar UV 365 nm sehingga dapat dikatakan senyawa pada ketiga bercak tersebut tidak termasuk golongan terpenoid. Hal ini dikarenakan senyawa terpenoid tidak memberikan peredaman dan fluoresensi di bawah sinar UV.
Setelah penyemprotan dengan vanilin-H2SO4, bercak pada hRf 44 berwarna coklat kehijauan sedangkan bercak dengan hRf 75 berwarna merah di bawah sinar tampak (Gambar 20.1a). Berdasarkan hasil ini, bercak pada hRf 44 dan 75 diduga termasuk golongan senyawa fenolik atau turunan fenil propanoid dengan gugus –OH fenolik. Mekanisme aksi vanilin-H2SO4 adalah mengabstraksi atom H pada ikatan C-C senyawa organik sehingga membentuk ikatan rangkap dua (C=C). Ikatan rangkap terkonjugasi akan menjadi lebih panjang dan dapat menyerap sinar pada panjang gelombang visibel.
2. Pereaksi DNPH digunakan untuk mendeteksi senyawa keton dan aldehida (Wagner dan Bladt, 1996). Senyawa DNPH akan bereaksi dengan menyerang gugus karbonil keton dan aldehida sehingga terbentuk senyawa hidrazon yang memiliki ikatan rangkap terkonjugasi yang lebih panjang dari sebelumnya dan terlihat di bawah sinar tampak. Senyawa dengan gugus keton dan aldehid akan menghasilkan warna kuning hingga oranye-kuning di bawah sinar tampak (Jork dkk., 1990). Berikut reaksi antara senyawa keton atau aldehid dengan DNPH.
Gambar 17. Reaksi antara senyawa keton dan aldehida terhadap reagen 2,4-DNPH menghasilkan hidrazon yang mempunyai ikatan rangkap terkonjugasi lebih panjang
(Jork dkk., 1990)
Sebelum dilakukan penyemprotan, hanya bercak pada hRf 44 yang terlihat kuning pucat samar di bawah sinar tampak, setelah dilakukan penyemprotan dan pemanasan pada 100oC selama 5 menit terhadap plat KLT, bercak pada
hRf 44 berwarna oranye-kuning di bawah sinar tampak dan kedua bercak
lainnya (hRf 56 dan 75) tidak menimbulkan perubahan warna (Gambar 20.1b). Bercak pada hRf 44 dapat memberikan tanggapan positif dengan pereaksi DNPH, hal ini berarti senyawa pada bercak tersebut memiliki gugus keton atau aldehida. Bercak pada hRf 56 dan 75 bukan termasuk golongan senyawa yang memiliki gugus keton atau aldehid karena tidak bereaksi positif dengan pereaksi DNPH.
3. FeCl3 merupakan pereaksi khas untuk deteksi senyawa fenolik. Hasil positif ditunjukkan dengan perubahan warna bercak menjadi merah, hijau, ungu, biru atau hitam kuat di bawah sinar tampak (Harborne, 1987). Perubahan warna yang terjadi merupakan akibat dari terbentuknya kompleks ion Fe3+ dengan gugus –OH dari senyawa fenol.
Setelah penyemprotan, bercak pada hRf 44 mengalami perubahan warna dari tidak berwarna menjadi warna merah bata di bawah sinar tampak, sedangkan kedua bercak lainnya (hRf 56 dan 75) tidak mengalami perubahan warna (Gambar 20.1c). Hal ini menunjukkan bercak pada hRf 44 termasuk senyawa
67
dengan gugus fenol. Senyawa fenol merupakan golongan besar senyawa alam yang dapat bereaksi secara khas dengan FeCl3.
4. Komponen utama reagen sitroborat adalah H3BO3 yang dapat membentuk kompleks khelat dengan gugus orto dihidroksi dan orto hidroksi karbonil seperti pada senyawa kumarin, flavonoid dan kuinon (benzokuinon, naftokuinon dan antrakuinon). Hasil positif ditandai dengan terbentuknya fluoresensi bercak di bawah sinar UV 365 nm. Sebagai contoh adalah reaksi yang terjadi pada gugus orto dihidroksi flavonoid di bawah ini.
Gambar 18. Reaksi antara asam borat dengan gugus orto dihidroksi pada flavonoid (Markham dkk., 1988)
Setelah penyemprotan, bercak pada hRf 44 menghasilkan pendaran kuning kehijauan di bawah sinar UV 365 nm yang lebih intens dari sebelumnya (Gambar 20.3d). Hal ini menunjukkan terbentuknya kompleks antara gugus orto dihidroksi atau orto hidroksi karbonil dengan ion borat sehingga intensitas fluoresensi bercak di bawah sinar UV 365 nm menjadi lebih jelas. Berdasarkan hasil ini, bercak pada pada hRf 44 diduga senyawa dengan gugus orto dihidroksi atau orto hidroksi karbonil yang terikat pada cincin aromatik. Senyawa kumarin, flavonoid dan kuinon memiliki cincin aromatik dengan gugus orto dihidroksi atau orto hidroksi karbonil. Senyawa kumarin
merupakan turunan fenil propanoid yang disintesis melalui jalur sikimat (shikimate pathway) (Dewick, 2009), sedangkan senyawa kuinon merupakan turunan dari poliketida yang disintesis melaui jalur biosintesis asam asetat-malonat (Luckner, 1984). Kedua golongan senyawa ini banyak dijumpai sebagai metabolit sekunder pada fungi, sedangkan senyawa flavonoid termasuk jarang diproduksi oleh fungi (Mousa dan Raizada, 2013). Oleh karena itu, bercak pada hRf 44 mungkin termasuk senyawa turunan kumarin atau kuinon dengan gugus orto dihidroksi atau orto hidroksi karbonil.
5. Pereaksi Dragendorff digunakan untuk deteksi senyawa alkaloid dan senyawa nitrogen heterosiklik. Hasil positif ditunjukkan dengan bercak berwarna merah jingga atau coklat jingga dengan latar belakang kelabu pucat atau kuning berdasarkan pembentukan kompleks alkaloid dengan bismuth metalik yang merupakan komponen dari pereaksi (Wagner dan Bladt, 1996).
Sebelum penyemprotan, terlihat bercak kuning pucat pada hRf 44 di bawah sinar tampak, sedangkan di bawah sinar UV 254 nm terlihat pemadaman pada
hRf 44, 56, dan 75, dan di bawah sinar UV 365 nm ketiga bercak terlihat
fluoresensi kuning kehijauan. Setelah penyemprotan, tidak terlihat perubahan warna bercak menjadi merah jingga atau coklat (Gambar 20.1e). Oleh karena itu, dapat disimpulkan metabolit DJ2 tidak termasuk senyawa alkaloid atau nitrogen heterosiklik.
6. Pereaksi serium-asam sulfat digunakan untuk mendeteksi senyawa alkaloid indol (Harborne, 1987), fenolik, steroid alkaloid, steroid sapogenin, dan senyawa organik yang mengandung iodin (Stahl, 1969). Hasil positif
69
ditunjukkan dengan perubahan warna bercak menjadi ungu di bawah sinar tampak setelah plat dipanaskan 100oC selama 5 menit.
Sebelum dilakukan penyemprotan, terlihat bercak kuning pucat pada hRf 44 di bawah sinar tampak. Pengamatan plat di bawah sinar UV 254 nm memperlihatkan pemadaman pada hRf 44, 56, dan 75, sedangkan di bawah sinar UV 365 nm ketiga bercak terlihat fluoresensi kuning kehijauan. Bercak pada hRf 44 menghasilkan pendaran hijau cerah di bawah sinar UV 365 nm setelah penyemprotan dengan serium-asam sulfat (Gambar 20.3f), sedangkan di bawah sinar tampak terjadi perubahan warna yaitu dari kuning pucat menjadi kecoklatan (Gambar 20.1f). Berdasarkan hasil ini, senyawa pada hRf 44 diduga termasuk golongan fenolik.
7. Pereaksi SbCl3 digunakan untuk deteksi senyawa triterpen yaitu saponin dan glikosida jantung (Wagner dan Bladt, 1996), flavonoid, vitamin A, D, karotenoid, steroid, dan derivat terpen (Stahl, 1969). Hasil positif untuk senyawa triterpen, saponin dan glikosida jantung ditunjukkan dengan bercak berwarna merah muda dan ungu di bawah sinar tampak serta merah-ungu, hijau, atau biru di bawah sinar UV 365 nm (Waksmundzka-Hajnos dkk., 2008). Fluoresensi yang muncul disebabkan oleh terbentuknya senyawa kompleks π dengan sistem ikatan rangkap 2 yang ditunjukkan pada gambar
Gambar 19. Reaksi pembentukan kompleks π dengan sistem ikatan rangkap 2 antara SbCl3 dengan ikatan rangkap 2 dalam senyawa (Jork dkk., 1990)
Bercak pada hRf 44, 56 dan 75 mengalami pendaran kuning kehijauan di bawah sinar UV 365 nm sebelum penyemprotan. Setelah dilakukan penyemprotan dengan SbCl3, ketiga bercak tersebut berpendar merah-ungu di bawah sinar UV 365 nm (Gambar 20.3g) dengan bercak hRf 44 yang paling intens. Hal ini menunjukkan kemungkinan senyawa pada bercak pada hRf 44, 56, dan 75 termasuk golongan senyawa yang memiliki ikatan C=C. Bercak pada hRf 32 menghasilkan warna ungu tipis di bawah sinar tampak setelah penyemprotan dengan SbCl3 diikuti pemanasan. Hal ini menunjukkan bercak pada hRf 32 memiliki ikatan rangkap C=C dan termasuk golongan steroid triterpen. Steroid triterpen tidak nampak pada sinar UV 254 dan 365 nm namun dapat bereaksi dengan pereaksi SbCl3 dan menghasilkan warna ungu. Bercak dengan hRf 32, 44 dan 75 memiliki aktivitas sebagai antimikroba pada uji bioautografi.
Berdasarkan hasil analisis di atas, dapat disimpulkan beberapa hal yaitu senyawa aktif antibakteri yang terdapat dalam ekstrak larut etil asetat metabolit fungi DJ2 diduga termasuk golongan senyawa fenolik yang memiliki gugus keton dan gugus orto dihidroksi atau orto hidroksi karbonil serta senyawa steroid triterpen.
71 Ar ah pe ng embanga n Ar ah pe ng embanga n
1. Plat KLT di bawah sinar tampak sebelum (kiri) dan setelah (kanan) penyemprotan
2. Plat KLT di bawah sinar UV 254 nm sebelum (kiri) dan setelah (kanan) penyemprotan
Gambar 20. Kromatogram ekstrak larut etil asetat metabolit fungi DJ2 Ket.: urutan pereaksi semprot dari kiri ke kanan: a = vanilin-H2SO4; b = 2,4-DNPH;
c = FeCl3; d = sitroborat; e = Dragendorff; f = serium(IV) sulfat; g = SbCl3;
Fase diam = silika gel 60 F254; Fase gerak = n-heksana:etil asetat:metanol (2:6:1 v/v/v)
dengan penambahan 1 tetes asam asetat glasial; Jarak pengembangan = 8 cm
a b c d e f g a b c d e f g a b c d e f g a b c d e f g hRf hRf
Ar ah pe ng embanga n
3. Plat KLT di bawah sinar UV 365 nm sebelum (kiri) dan setelah (kanan) penyemprotan
Gambar 20 (lanjutan). Kromatogram ekstrak larut etil asetat metabolit fungi DJ2 Ket.: urutan pereaksi semprot dari kiri ke kanan: a = vanilin-H2SO4; b = 2,4-DNPH;
c = FeCl3; d = sitroborat; e = Dragendorff; f = serium(IV) sulfat; g = SbCl3;
Fase diam = silika gel 60 F254; Fase gerak = n-heksana:etil asetat:metanol (2:6:1 v/v/v)
dengan penambahan 1 tetes asam asetat glasial; Jarak pengembangan = 8 cm
a b c d e f g
73
Tabel IV. Profil kromatogram ekstrak larut etil asetat metabolit fungi endofit DJ2 hasil deteksi dengan sinar UV dan pereaksi semprot
No. hRf Vis UV 254 UV 365
Pereaksi Semprot Bakteri uji Prediksi
Golongan senyawa VAS DNPH FeCl3 Sitro DD Serium
sulfat SbCl3 PA BS SA ST 1 19 - - - -- + -- -- - 2 32 - - - Ungu tipis -- -- + -- Steroid triterpen 3 44 Kuning pucat Peredaman Fluoresensi kuning kehijauan Coklat kehijauan Oranye-kuning Merah bata Pendaran hijau cerah (lebih intens dari sebelum disemprot) - Pendaran hijau cerah (UV365) coklat (visibel) Pendaran merah-ungu + + + + Senyawa dengan gugus keton dan orto dihidroksi atau orto hidroksi karbonil 4 56 - Peredaman Fluoresensi kuning kehijauan - - - Pendaran hijau tipis Pendaran merah-ungu -- -- -- -- - 5 62 - - - -- + -- -- - 6 75 - Peredaman Fluoresensi kuning-hijau tipis Merah - - - Pendaran merah-ungu -- + -- -- -
Ket.: Vis= sinar visibel; VAS= vanilin-H2SO4; DNPH= 2,4-dinitrophenylhydrazin; FeCl3= besi (III) klorida; Sitro= sitroborat; DD= Dragendorff; SbCl3= antimon (III) klorida
PA= Pseudomonas aeruginosa; BS= Bacillus subtilis; SA= Staphylococcus aureus; ST= Salmonella thypi Tanda (+) = ada zona hambat pada uji bioautografi
I. Deteksi Senyawa Antibakteri pada Tanaman Asal
Pembuatan ekstrak larut etil asetat daun jinten dilakukan dengan metode maserasi. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Karena adanya perbedaan konsentrasi antara cairan di dalam dan luar sel, maka larutan dalam sel akan berdifusi keluar membawa zat aktif. Peristiwa ini terjadi secara berulang-ulang sampai tercapai keseimbangan konsentrasi antara larutan di dalam dan luar sel. Filtrat hasil maserasi diuapkan sampai diperoleh 1 mL ekstrak cair.
Ekstrak larut etil asetat daun dan batang jinten dielusi dengan sistem KLT yang sama seperti pada pengujian metabolit fungi DJ2. Penggunaan fase gerak dan fase diam yang sama diharapkan dapat mendeteksi senyawa pada tanaman asal yang memiliki polaritas yang sama dengan metabolit DJ2.
Hasil KLT menunjukkan tidak ada kemiripan kandungan senyawa antara ekstrak larut etil asetat fungi DJ2 dengan ekstrak larut etil asetat daun dan batang tanaman jinten dalam hal nilai hRf bercak dan warna yang muncul di bawah sinar tampak dan UV. Hal ini dapat diamati pada pola kromatogram yang terdeteksi di bawah sinar tampak, UV 254 nm dan 365 nm. Ekstrak metabolit fungi DJ2 menghasilkan 3 bercak (hRf 44, 56, dan 75) yang masing-masing mengalami peredaman di bawah sinar UV 254 nm dan fluoresensi kuning kehijauan di bawah UV 365 nm. Hasil elusi dari ekstrak larut etil asetat daun dan batang jinten tidak muncul bercak yang serupa dengan ketiga bercak pada ekstrak DJ2 (Gambar 21). Oleh karena itu, dapat disimpulkan senyawa yang dihasilkan oleh fungi endofit DJ2 tidak terdeteksi dalam ekstrak larut etil asetat tanaman asalnya.
75 Ar ah pe ng embanga n Sinar tampak UV 254 nm UV 365 nm
Gambar 21. Kromatogram ekstrak larut etil asetat metabolit fungi DJ2, ekstrak larut etil asetat batang dan daun tanaman jinten.
Ket.: A= ekstrak larut etil asetat metabolit fungi DJ2; B= ekstrak larut etil asetat batang jinten; C= ekstrak larut etil asetat daun jinten.
Fase diam = silika gel 60 F254; Fase gerak = n-heksana:etil asetat:metanol (2:6:1 v/v/v)
dengan penambahan 1 tetes asam asetat glasial; Jarak pengembangan = 8 cm.
A B C A B C A B C
76
BAB IV
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Isolasi fungi endofit dari tanaman jinten menghasilkan 3 isolat, isolat yang potensial diberi kode DJ2 dan aktif terhadap bakteri S. aureus, B. subtilis, S.
thypi, dan P. aeruginosa.
2. Nilai KBM ekstrak larut etil asetat metabolit fungi DJ 2 sebesar 625 µg/mL terhadap P. aeruginosa, lebih dari 5000 µg/mL terhadap B. subtilis, 2500 µg/mL terhadap S. aureus, dan 312,5 µg/mL terhadap S. thypi, sedangkan nilai KHM-nya tidak dapat ditentukan.
3. Berdasarkan hasil identifikasi dengan KLT-Bioautografi, senyawa aktif sebagai antibakteri dari metabolit fungi DJ2 terdapat pada hRf 19, 32, 44, 62, dan 75. Namun yang terdeteksi dengan pereaksi semprot hanya bercak pada hRf 32, 44, dan 75. Senyawa metabolit aktif fungi DJ2 diduga termasuk golongan senyawa fenolik yang memiliki gugus keton dan gugus orto dihidroksi atau orto hidroksi karbonil serta senyawa steroid triterpen, serta tidak terdeteksi pada batang dan daun tumbuhan asal.
77
B. Saran
1. Perlu dilakukan penentuan spesies fungi endofit kode DJ2.
2. Perlu dilakukan optimasi proses fermentasi fungi DJ2 meliputi formulasi media, lama fermentasi dan kondisi optimum fermentasi untuk memaksimalkan produksi metabolit.
3. Perlu dilakukan uji antimikroba dari metabolit fungi DJ2 terhadap strain mikroba patogen yang telah resisten terhadap antibiotik.
4. Perlu dilakukan penelitian lebih lanjut untuk memastikan golongan senyawa aktif yang dihasilkan fungi DJ2.