xxiii
Bab II Tinjauan Pustaka
II.1 Reaksi Pergeseran CO Menjadi CO2 dan H2
WGSR adalah reaksi antara CO dan kukus yang menghasilkan CO2 dan
H2. Arti penting proses ini baru diketahui setelah adanya proses sintesis amonia
Haber. Pada proses Haber ini, CO merupakan racun bagi katalis sintesis amonia. Untuk itu, konsentrasi karbon monoksida harus dikurangi hingga level yang serendah mungkin. Selain berkurangnya CO, H2 yang dihasilkan dari reaksi
pergeseran CO ini nantinya dapat digunakan sebagai penyedia H2 (Twigg, 1989).
Reaksi pergeseran CO menjadi CO2 dan H2 pada pabrik amonia modern saat
ini dilangsungkan dalam 2 tahap, yaitu high temperature shift conversion (HTSC) dan low temperature shift conversion (LTSC).
II.1.1 Termodinamika Reaksi Pergeseran CO Menjadi CO2 dan H2
Persamaan reaksi pergeseran CO menjadi CO2 dan H2 dapat dinyatakan
dengan persamaan 2.1 di bawah ini :
CO + H2O
-
CO2 + H2 DH = -41,165 kJ/mol…..(2.1)Reaksi ini merupakan reaksi eksotermik. Untuk reaksi eksotermik, makin tinggi temperatur (T) maka nilai konstanta kesetimbangan (Kp) menjadi lebih kecil. Akibatnya konversi maksimum (konversi kesetimbangan) menjadi lebih rendah. Hubungan konstanta kesetimbangan dan temperatur yang dinyatakan oleh Kolbel dan Rale dapat dilihat pada persamaan 2.2 berikut ini.
Kp = exp [{4577,8/T} – 4,33] ….(2.2)
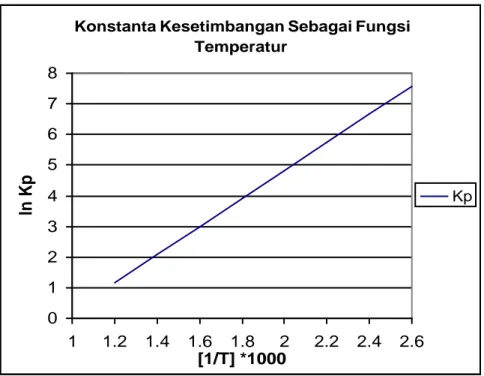
T adalah temperatur dalam Kelvin (Kolbel and Rale, 1980). Profil kesetimbangan reaksi menurut persamaan 2.2 dapat dilihat pada gambar II.1.
xxiv
Konstanta Kesetimbangan Sebagai Fungsi Temperatur 0 1 2 3 4 5 6 7 8 1 1.2 1.4 1.6 1.8 2 2.2 2.4 2.6 [1/T] *1000 ln Kp Kp
Gambar II.1 Konstanta kesetimbangan sebagai fungsi temperatur (Kolbel and Rale, 1980)
Berdasarkan persamaan 2.1, jumlah koefisien stokiometri produk (CO2
dan H2) sama dengan jumlah koefisien stokiometri reaktannya (CO dan H2O).
Dengan kata lain, jumlah mol reaktan dan produk tidak mengalami perubahan selama berlangsungnya reaksi. Oleh karena itu, tekanan tidak berpengaruh terhadap kesetimbangan (Satterfield, 1991).
II.1.2 Deskripsi Proses Reaksi Pergeseran CO Menjadi CO2 dan H2
Dalam upaya mendapatkan konversi reaksi yang tinggi dengan kecepatan reaksi yang lebih tinggi pada pabrik amonia modern, reaksi pergeseran CO menjadi CO2 dan H2 diselenggarakan dalam 2 tahap :
a. high temperature shift conversion (HTSC) b. low temperature shift conversion (LTSC)
xxv
Proses HTSC bertujuan untuk memperoleh kecepatan reaksi yang tinggi. Pengaruh temperatur terhadap kecepatan reaksi dapat dijelaskan dengan menggunakan persamaan Arrhenius.
k = Ao e-Ea/RT ……(2.3)
Dari persamaan ini dapat dijelaskan bahwa semakin tinggi temperatur maka kecepatan reaksi akan semakin tinggi. Temperatur inlet yang digunakan pada proses HTSC yaitu 370–400 oC dan temperatur outlet proses ini adalah sekitar 450 oC (Twigg, 1989). Proses ini diselenggarakan dalam suatu reaktor unggun tetap dengan waktu tinggal dalam reaktor yaitu 3–9 detik, dan VHSV yang diperkirakan 958,08 per jam. Katalis yang digunakan berbasis Fe/Cr (Kirk Othmer, 1992). Proses ini mampu menurunkan kandungan CO dari sekitar 12,9 % pada inlet menjadi kurang lebih 3 % pada outlet (Twigg, 1989).
Gas yang keluar dari reaktor HTSC selanjutnya didinginkan hingga temperaturnya menjadi 240 oC dan diumpankan ke dalam reaktor LTSC. Pada pabrik amonia modern, proses LTSC ini bertujuan untuk mendapatkan konversi kesetimbangan yang lebih tinggi. Pada temperatur yang semakin rendah, konversi kesetimbangan yang dicapai akan semakin tinggi. Proses LTSC diselenggarakan dalam suatu reaktor unggun tetap dengan waktu tinggal 1 detik, dan VHSV yang diperkirakan 5755,39 per jam. Proses ini diselenggarakan pada temperatur 240 oC. Proses LTSC mampu menurunkan kandungan CO dari sekitar 3 % pada
inlet menjadi kurang lebih 0,2 % pada outlet (Twigg, 1989). Katalis yang
digunakan pada proses LTSC adalah katalis Cu/ZnO/Al2O3 (Twigg, 1989). Batas
minimum temperatur operasi LTSC adalah 200 oC. Pada tekanan 13 atm, temperatur air mendidih diperkirakan terjadi pada temperatur 190 oC sehingga t e m p e r a t u r 2 0 0 oC terjadi kondensasi kukus. Kondensasi kukus akan mengakibatkan sintering pada katalis berbasis Cu sehingga umur katalis menjadi lebih pendek. Perbandingan kondisi proses HTSC dan LTSC dapat dilihat pada tabel II.1 berikut ini.
xxvi
Tabel II.1 Perbandingan kondisi proses HTSC dan LTSC (Makertiharta, 2004, Satterfield, 1991, Twigg, 1989).
No. Tinjauan HTSC LTSC
1. Temperatur operasi (oC)
370-400 214-240
2. Tekanan operasi (MPa) 3 1,3
3. Umur katalis (tahun) 3-5 1–2
4. Katalis heterogen Fe-Cr Cu – ZnO – Al2O3
5. Komposisi katalis (%) Fe : 55 Cr : 6 CuO = 32–33 ZnO = 34–53 Al2O3= 15-33 6. Konsentrasi CO di keluaran (%) 3 0,2
7. Bentuk katalis pellet pellet
8. Waktu kontak (s) 3-9 1 9. Penyebab terjadinya deaktivasi Sintering dan peracunan Sintering dan peracunan H2S
10. Panas yang dilepaskan selama reduksi
Fe3O4 + H2 3FeO + H2O
DH = -63,8 kJ/mol
CuO + H2 Cu + H2O
DH = -80,8 kJ/mol 11. Panas yang dilepaskan
selama oksidasi katalis
2Fe3O4 + 1/2O2 3Fe2O3
DH = -464,6 kJ/kg
Cu + 1/2O2 CuO
DH = -647 kJ/kg
II.2 Katalis HTSC
Katalis yang digunakan untuk proses HTSC diperkenalkan pertama kali oleh Bosch dan Wild pada tahun 1912. Kemudian katalis ini mulai digunakan dalam proses industri amonia pada tahun 1915 (Twigg, 1989). Katalis HTSC ini tidak banyak mengalami perubahan dari saat itu. Katalis HTSC yang umumnya digunakan secara komersial berbahan baku Fe2O3 dan Cr2O3.
xxvii
II.2.1 Katalis HTSC berbasis Fe/Cr
Katalis HTSC berbasis Fe/Cr ini memiliki stabilitas termal yang tinggi, tahan terhadap sintering dan peracunan oleh sulfur, serta umur yang lebih panjang (Liu, 2005; Chinchen, 1984). Karena kelebihan yang dimilikinya, maka katalis ini banyak digunakan di industri hingga sekarang. Bahan pembuatan katalis yang berbasis besi dipilih karena murah, banyak tersedia, dan lebih stabil sehingga dapat digunakan pada temperatur tinggi (O’Brien, 2006). Selain itu besi dalam bentuk magnetit (Fe3O4) memiliki aktivitas lebih tinggi pada reaksi yang
menggunakan temperatur tinggi (Twigg, 1989). Penambahan kromium (Cr2O3)
bertujuan untuk meningkatkan aktivitas katalitik dan stabilitas termal (O’Brien, 2006). Selain itu Cr2O3 berperan sebagai promotor struktural (Liu, 2005) untuk
meminimumkan sintering (Satterfield, 1991).
Beberapa peneliti melakukan pembuatan katalis berbasis Fe/Cr dengan menggunakan cara pembuatan, dan komposisi Fe/Cr yang berbeda – beda. Ringkasan hasil penelitian tersebut dapat dilihat pada uraian berikut ini.
Jennings dkk telah mengembangkan katalis HTSC berbasis Fe/Cr. Katalis ini dibuat dengan menggunakan metode kopresipitasi garam nitrat yang terdiri dari Fe(NO3)3.9H2O dan Cr(NO3)3.9H2O dengan garam karbonat yaitu Na2CO3
pada temperatur 60 oC dan pH yang mendekati netral (pH = 7-8,5). Suspensi yang dihasilkan selanjutnya disaring dan dicuci. Presipitat yang dihasilkan dikeringkan dan direduksi dengan menggunakan campuran kukus dan hidrogen pada temperatur 300 oC sebelum digunakan untuk reaksi. Katalis ini memiliki luas permukaan spesifik 120-200 m2/g, Loss on Igniton (LOI) pada 900 oC adalah 15-25 % w/w, radius pori rata – rata 10-100 unit Angstrom, komposisi Fe2O3 ,
Cr2O3 yang digunakan adalah 85,7 % dan 7,71 %. Katalis yang dihasilkan
selanjutnya dihaluskan, dicampur dengan 3 % grafit, dan dibentuk menjadi butiran pellet. Aktifitas yang dihasilkan sama dengan katalis komersial.
Schneider dkk membuat katalis HTSC berbasis Fe/Cr dengan menggunakan komposisi Fe2O3 yaitu 80-90 %, dan 7-11 % komposisi Cr2O3.
Katalis ini dibuat dengan menggunakan metode kopresipitasi larutan garam sulfat yaitu FeSO4.7H2O dan Na2Cr2O7.H2O. Selanjutnya ditambahkan Mg(OH)2 ke
dalam campuran tersebut pada temperatur 50-55 oC. Presipitat yang terbentuk
xxviii
kemudian disaring dan dikeringkan pada temperatur 220 oC selama 15 jam. Presipitat yang telah kering selanjutnya dikalsinasi pada temperatur 480 oC selama 1 jam dan dibentuk menjadi tablet silinder. Katalis ini memiliki luas permukaan 78 m2/g dan menghasilkan konversi CO yaitu 70,1 %.
Selain keunggulan yang dimiliki, katalis Fe/Cr ini juga memiliki kelemahan. Pada perbandingan kukus/gas umpan (S/G) yang rendah, kromium oksida (Cr2O3) yang digunakan berperan sebagai katalis pada reaksi pembentukan
hidrokarbon (CH4) dan senyawa beroksigen (CH3OH) menurut reaksi berikut ini.
CO2 + 4H2 ® CH4 + 2H2O H = -164,9 kJ/mol …(2.4) CO2 + 3H2 Û CH3OH + H2O H = -49,47 kJ/mol …(2.5)
Reaksi – reaksi tersebut mengkonsumsi H2 dan menyebabkan H2 yang
dihasilkan semakin sedikit (Hu, 1999). Untuk mengatasi kelemahan yang dimiliki oleh katalis Fe/Cr ini, di industri digunakan rasio kukus terhadap gas umpan (S/G) = 0,6. Selain itu kelemahan kromium adalah memiliki tingkat racun yang tinggi (IPCS, 1988).
Dengan melihat kelemahan – kelemahan yang dimiliki oleh katalis Fe/Cr, beberapa peneliti melakukan upaya pengembangan katalis dengan menambahkan oksida lain, seperti : Fe-Ce-Cr-O atau mengganti Cr2O3 dengan oksida lain,
seperti : V2O5. Ringkasan hasil penelitian tersebut dapat dilihat pada uraian d i
bawah ini.
II.2.2 Katalis HTSC berbasis Fe/Vanadium
Maria do Carmo Rangel dkk telah mengembangkan katalis berbasis Fe vanadium. Katalis ini dibuat dengan cara kopresipitasi garam amonium metavanadat (NH4VO3) dengan Fe nitrat [Fe{NO3}3] pada pH = 10. Presipitat
yang dihasilkan kemudian disaring, dicuci dengan 5 % amonium asetat (NH4C2H3O2) dan disaring kembali. Pengeringan dilakukan pada temperatur
393 K. Presipitat yang telah dikeringkan selanjutnya dikalsinasi pada temperatur 673 K selama 2 jam. Hasil penelitian menunjukkan bahwa katalis yang menghasilkan aktivitas, stabilitas, dan selektivitas yang tinggi adalah katalis
xxix
dengan perbandingan vanadium dan besi (V/Fe) = 0,1. Katalis ini memiliki luas permukaan 0,28 m2/g, aktivitas katalitik 26,4 x 107 mol gas umpan/g s, dan selektivitas CO2 30 % pada S/G = 0,2.
Penambahan vanadium menyebabkan katalis yang dihasilkan memiliki luas permukaan spesifik yang besar, lebih tahan terhadap sintering, dan memiliki aktivitas serta selektivitas yang tinggi (Rangel, 2004). Selain itu penambahan vanadium akan menyebabkan katalis cenderung lebih stabil dibandingkan dengan penggunaan besi dan kesulitan untuk mereduksi katalis dapat diperkecil, sehingga efisiensi energi dapat tercapai. Kelemahan vanadium adalah memiliki tingkat racun yang tinggi di air 0,67 ± 0,32 µg/liter (IPCS, 1988), harganya yang relatif lebih mahal (Resse, 1999), dan lebih mudah teroksidasi (Satterfield, 1991).
II.2.3 Katalis HTSC berbasis Fe-Ce-Cr-O
Yanping Hu dkk mengembangkan katalis berbasis Fe-Ce-Cr-O. Katalis ini dibuat dengan cara kopresipitasi garam sulfat yang terdiri dari ferri sulfat [Fe2{SO4}3], kromium sulfat [Cr2{SO4}3], dan cerium sulfat [Ce2{SO4}3] yang
direaksikan dengan NH4OH dan dipanaskan pada temperatur 333 K. Proses
presipitasi dilangsungkan pada temperatur ruang selama 2 jam, kemudian dicuci dengan air hingga SO42- tidak ditemukan. Presipitat disaring dan ditambahkan
potassium hidroksida (KOH). Pengeringan dilakukan pada temperatur 383 K. Sampel yang telah dikeringkan selanjutnya dikalsinasi pada temperatur 673 K selama 4 jam.
Katalis ini memiliki aktivitas, selektivitas dan stabilitas yang tinggi (Hu,1999). Penggunaan Fe-Ce-Cr-O sebagai katalis HTSC dapat dipertimbangkan karena katalis ini dapat mengatasi kelemahan katalis Fe/Cr yaitu pada rasio kukus terhadap gas umpan (S/G) yang rendah akan menyebabkan terjadinya reaksi pembentukan hidrokarbon dan senyawa beroksigen yang mengkonsumsi H2. Akan
tetapi katalis HTSC berbasis Fe-Ce-Cr-O i n i belum teruji sebagai katalis komersial dan baru digunakan pada skala laboratorium.
xxx
II.3 Pembuatan Katalis
Metode yang umum digunakan pada pembuatan katalis yaitu presipitasi dan impregnasi.
II.3.1 Metode Impregnasi
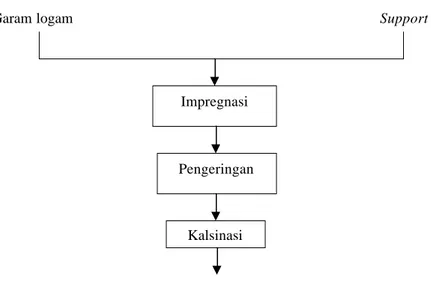
Impregnasi merupakan metode pembuatan katalis yang paling sederhana. Impregnasi dilakukan dengan mengkontakkan support yang poros dengan larutan yang terdiri dari satu atau lebih garam logam yang memiliki konsentrasi tertentu (Satterfield, 1991). Support pada proses ini bertujuan untuk meningkatkan stabilitas katalis yang dihasilkan. Tahapan proses metode impregnasi dapat dilihat pada diagram alir berikut ini.
Gambar II.2 Diagram alir metode impregnasi Impregnasi
Pengeringan
Kalsinasi
Katalis oksida
Garam logam Support
xxxi
II.3.1.1 Tahapan Proses Metode Impregnasi
Proses impregnasi diawali dengan memilih support yang akan digunakan. Beberapa pertimbangan yang dijadikan dasar pada pemilihan support yang akan digunakan adalah sebagai berikut :
1. bersifat inert dan tidak menghasilkan reaksi lain;
2. memiliki sifat – sifat mekanik, termasuk ketahanan secara fisik; 3. stabil;
4. memiliki luas permukaan yang besar; 5. poros dan
6. harganya murah (Satterfield, 1991).
Selanjutnya support dikeringkan terlebih dahulu untuk menghilangkan kelembaban dan impuritis yang ada. Support ditetesi garam logam, diaduk, dan dibiarkan selama 30 menit agar distribusi garam logam menjadi merata. Selanjutnya support yang telah ditetesi garam logam dikeringkan untuk menghilangkan sisa – sisa air. Proses kalsinasi dilakukan untuk mendekomposisi garam logam menjadi oksida. Selain itu kalsinasi juga bertujan untuk meningkatkan stabilitas katalis terhadap perubahan temperatur.
II.3.1.2 Keunggulan dan Kelemahan
Keunggulan metode impregnasi adalah jumlah reaktan yang digunakan lebih kecil daripada jumlah reaktan yang digunakan pada metode presipitasi. Selain itu metode impregnasi tidak memerlukan banyak peralatan karena tidak memerlukan penyaringan dan pencucian. Ukuran dan bentuk katalis yang dihasilkan melalui metode impregnasi sama dengan ukuran dan bentuk support yang digunakan. Selain keunggulan yang dimiliki, metode ini memiliki beberapa kelemahan. Salah satunya adalah garam logam menjadi mudah runtuh karena tidak menyatu dengan support (Twigg, 1989). Selain itu pada metode impregnasi, penentuan konsentrasi garam logam yang akan digunakan untuk membentuk lapisan monolayer sangat sulit dilakukan (Makertiharta, 2007).
xxxii
II.3.2 Metode Presipitasi
Presipitasi merupakan metode yang paling umum digunakan pada proses pembuatan katalis. Tujuan presipitasi adalah untuk mengendapkan campuran garam logam dengan precipitating agent yang dapat berupa amonium hidroksida atau natrium karbonat. Bagian terpenting pada proses presipitasi adalah pemilihan campuran awal yang akan digunakan. Pertimbangan – pertimbangan yang dijadikan sebagai dasar pada pemilihan campuran awal yang digunakan adalah sebagai berikut :
1. tinggi rendahnya kelarutan; 2. murah;
3. tidak bersifat korosif;
4. tidak menyebabkan sintering dan
5. tidak menimbulkan polusi air dan udara.
II.3.2.1 Tinggi Rendahnya Kelarutan
Semakin tinggi kelarutan senyawa dalam air akan menyebabkan konsentrasi senyawa menjadi lebih tinggi. Akibatnya pelarut yang digunakan akan menjadi lebih sedikit sehingga efisiensi energi untuk mengeringkan presipitat dapat tercapai. Contoh garam yang memiliki kelarutan tinggi dalam air adalah nitrat, sulfat, dan klorida.
II.3.2.2 Murah
Penggunaan campuran awal yang mahal akan menyebabkan biaya pembuatan katalis menjadi lebih tinggi. Contoh garam yang berharga mahal adalah format dan oksalat.
II.3.2.3 Tidak Bersifat Korosif
Semakin tinggi sifat korosif garam yang akan digunakan akan menyebabkan proses pembuatan katalis menjadi lebih sulit. Akibatnya biaya proses pembuatan katalis akan semakin tinggi. Selain itu garam yang bersifat korosif akan menghasilkan katalis yang korosif dan menyebabkan kerusakan pada reaktor. Contoh garam yang bersifat korosif adalah klorida, dan halogen lainnya.
xxxiii
II.3.2.4 Tidak Menyebabkan Sintering
Senyawa yang mengandung sodium dapat menyebabkan sintering pada katalis (Satterfield, 1991). Karena itu penggunaan senyawa yang mengandung sodium sebaiknya dihindari. Akan tetapi jika harus menggunakan senyawa yang mengandung sodium maka sebaiknya pencucian presipitat dilakukan berulang kali untuk meminimalkan sisa sodium.
II.3.2.5 Tidak Menimbulkan polusi air dan udara
Pengendalian terhadap polusi air dan udara merupakan faktor yang penting pada pemilihan campuran awal yang akan digunakan. Contoh garam yang menimbulkan polusi air dan udara adalah logam berat, nitrat, sulfat, dan klorida. Senyawa yang mengandung logam berat dapat menyebabkan polusi di dalam air sedangkan senyawa yang mengandung nitrat dapat menyebabkan polusi di udara dalam bentuk NOx.
Berdasarkan kriteria pemilihan tersebut, garam logam nitrat lebih disukai karena memiliki kelarutan yang tinggi dalam air dan murah. Akan tetapi penggunaan garam logam nitrat memerlukan pengendalian terhadap pembentukan NOx yang bersifat racun bagi lingkungan (Satterfield, 1991).
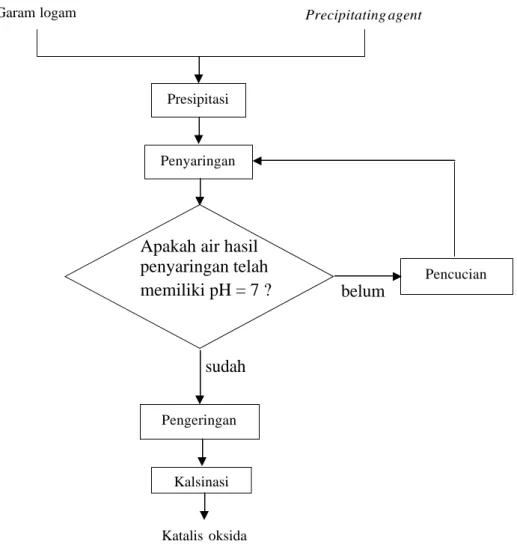
Pada katalis multikomponen, proses presipitasi dikenal sebagai kopresipitasi. Pada proses ini campuran yang terdiri dari dua atau lebih garam logam diendapkan dengan menggunakan precipitating agent. Tahapan proses metode presipitasi dapat dilihat pada diagram alir berikut ini.
xxxiv
Gambar II.3 Diagram alir metode presipitasi
II.3.3 Tahapan Proses Metode Presipitasi
Pada awal proses presipitasi dilakukan pencampuran garam logam dan
precipitating agent. Endapan yang terbentuk dari proses presipitasi selanjutnya
disaring dan dicuci. Kemudian dilakukan pemeriksaan pH. Apabila pH pencucian = 7, maka proses penyaringan dan pencucian dihentikan. Setelah dikeringkan untuk menghilangkan sisa – sisa air, endapan dikalsinasi untuk mendekomposisi senyawa hidroksida menjadi oksida dan meningkatkan ketahanan katalis terhadap perubahan temperatur.
Garam logam Precipitating agent
Presipitasi Penyaringan Pencucian Pengeringan Kalsinasi Katalis oksida
Apakah air hasil penyaringan telah
memiliki pH = 7 ? belum
sudah
xxxv
II.3.3.1 Faktor – Faktor yang Berpengaruh terhadap Metode Presipitasi
Faktor – faktor yang berpengaruh terhadap proses presipitasi adalah sebagai berikut :
1. Temperatur presipitasi 2. pH
3. Pengadukan 4. Aging
II.3.3.1.1 Temperatur Presipitasi
Tujuan pemanasan pada proses presipitasi adalah untuk meningkatkan kelarutan dan laju presipitasi (Vogel, 1989). Semakin tinggi temperatur pemanasan maka kelarutan akan semakin tinggi. Temperatur pemanasan yang tinggi juga akan menyebabkan laju presipitasi menjadi lebih tinggi.
II.3.3.1.2 pH
Tujuan pengendalian pH pada proses presipitasi adalah untuk menghindari terjadinya perubahan pH menjadi asam atau basa yang akan mempengaruhi ukuran presipitat yang dihasilkan. Kebanyakan presipitat menjadi larut pada kondisi terlalu asam atau terlalu basa sehingga akan hilang saat pencucian. Akibatnya tidak ada kandungan komponen yang hilang pada katalis yang dihasilkan. Secara umum, pH yang paling baik digunakan pada proses presipitasi adalah kondisi pH netral (pH = 7) (Twigg, 1989).
II.3.3.1.3 Pengadukan
Tujuan pengadukan adalah untuk mendapatkan campuran yang homogen sehingga campuran dapat terdistribusi secara merata. Pada kasus pembuatan katalis HTSC berbasis Fe/Cr yang menggunakan Na2CO3 sebagai precipitating agent, pengadukan secara perlahan diperlukan untuk melepaskan CO2 yang
terlarut (Jennings, 1984).
xxxvi
II.3.3.1.4 Aging
Tujuan proses aging adalah untuk meningkatkan ukuran kristal presipitat yang dihasilkan. Pada proses aging, endapan dibiarkan terendam dalam larutan induk selama waktu tertentu untuk mengendapkan dan menggumpalkan sehingga menghasilkan presipitat dengan ukuran kristal yang lebih besar (Harijadi, 1993).
II.3.3.2 Keunggulan dan Kelemahan
Keunggulan metode presipitasi adalah distribusi fasa aktif yang seragam pada partikel katalis, pencampuran yang seragam pada skala molekular, dan bentuk serta ukuran yang tidak terbatas (tidak berdasarkan bentuk support) (Satterfield, 1991). Akan tetapi metode ini memiliki kelemahan, diantaranya adalah presipitat yang dihasilkan biasanya berfasa amorf dan lebih mahal karena menggunakan precipitating agent dalam jumlah yang lebih besar.
II.4 Karakterisasi Katalis
Sifat – sifat katalis yang harus diperhatikan pada saat melakukan karakterisasi katalis adalah sifat bulk, partikel, dan permukaan katalis. Sifat – sifat katalis secara lebih jelas diuraikan pada tabel II.2 dan II.3 berikut ini.
xxxvii
Tabel II.2 Sifat – sifat katalis (Richardson, 1989)
Sifat Katalis Kegunaan Metode yang digunakan
Sifat bulk - Komposisi
- Struktur fasa
M e n g e t a h u i k e m u r n i a n komponen yang ditambahkan pada proses pembuatan dan deposisi kontaminasi selama digunakan
Mengetahui variasi komponen dalam katalis berdasarkan s t r u k t u r n y a d a n m e n g i d e n t i f i k a s i s t r u k t u r bahan kristal
Metode Spektroskopi
- Metode XRD
- Metode analisis termal differensial (DTA) Sifat partikel - Densitas - Ukuran partikel - Sifat mekanik - Luas permukaan
Mengukur densitas partikel katalis
Menentukan ukuran partikel katalis
M e n e n t u k a n k e t a h a n a n terhadap stress (Stress
resistance) pada partikel
katalis selama pembuatan dan penggunaan
Menentukan luas permukaan katalis
- Densitas teoritik - Densitas stuktur - Densitas partikel - Densitas packing
Analisa ukuran partikel secara elektronik - Crushing strength - Loss On Attrition - Loss On Ignition Metode BET II-15
xxxviii
Tabel II.3 Sambungan sifat – sifat katalis (Richardson, 1989)
Sifat Katalis Kegunaan Metode yang digunakan
Sifat partikel
- D i s t r i b u s i u k u r a n pori
- Difusivitas
Menentukan distribusi ukuran pori Menentukan difusivitas - Porosimeter - Adsorpsi nitrogen - Metode Wicke-Kallenback - Metode Kromatografi Sifat permukaan - Morfologi - Struktur - Dispersi - Keasaman
Menganalisis bentuk dan ukuran partikel katalis
Identifikasi struktur fasa permukaan
Menentukan dispersi katalis
Menentukan jenis asam, tingkat keasaman, dan distribusi asam - Metode SEM - Metode TEM - Metode XRD - Metode EXAFS - Metode AES - Metode XPS - Metode UPS - Metode SEM - Metode TEM - Metode XRD - Metode XPS - Metode UPS - Metode AES -Chemisorption isotherm - Titrasi reaksi - Titrasi racun - Titrasi non aqua - Base Chemisorption
Berdasarkan keseluruhan sifat – sifat katalis yang harus diperhatikan untuk mengkarakterisasi katalis, hanya analisa luas permukaan dan analisa struktur bahan kristal yang dapat dilakukan. Hal ini disebabkan karena keterbatasan alat dan biaya yang ada.
xxxix
II.4.1 Difraktometer Sinar X (XRD)
Difraktometer sinar x digunakan untuk menganalisa struktur bahan kristal katalis. Urutan kerja analisa ini dimulai dengan mendapatkan pola XRD katalis HTSC ITB. Selanjutnya pola XRD yang dihasilkan dibandingkan dengan pola referensi.
Beberapa peneliti yang melakukan analisa struktur bahan kristal dengan menggunakan metode XRD dapat dilihat pada uraian berikut ini.
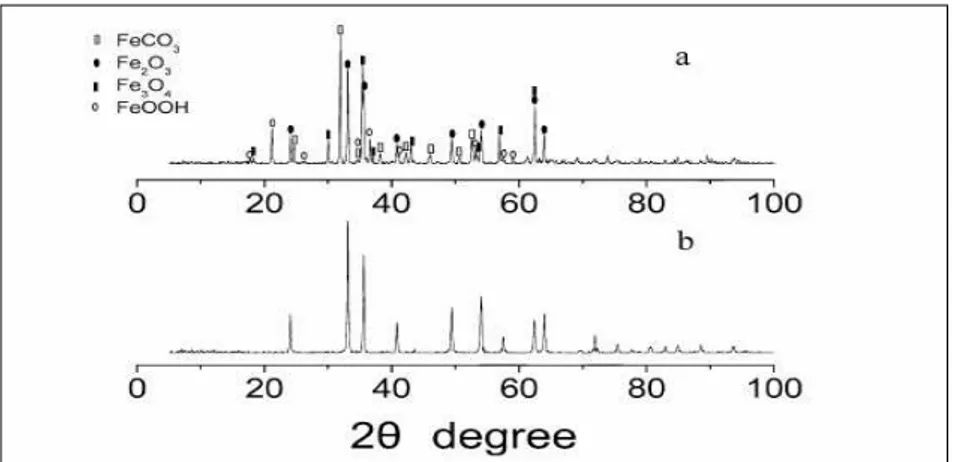
Suoyuan Lian dkk mensintesis magnetit (Fe3O4) melalui proses hidrolisis
FeCl3 dan FeSO4 yang mengandung urea pada temperatur 90-95 oC selama 12
jam. Sintesis magnetit ini dilakukan dengan menggunakan dua metode pembuatan, yaitu metode refluks dan hidrotermal. Pada kondisi refluks, dilakukan proses aging. Pada kondisi hidrotermal, magnetit disintesis hingga diperoleh Fe2O3 yang porous. Hasil analisa XRD menunjukkan bahwa magnetit (Fe3O4)
nanorod memiliki sistem kristal kubik. Difraktogram yang terbentuk dari analisa XRD dapat dilihat pada gambar II.4 berikut ini.
Gambar II.4 Hasil analisa XRD magnetit (Fe3O4) nanorod dan hematit
(Fe2O3) nanorod
Keterangan gambar II.4 :
a = Pola XRD untuk kandungan Fe3O4/Fe2O3/FeCO3/FeOOH
b = Pola XRD hematit (Fe2O3) murni
xl
Pola standar XRD magnetit (Fe3O4) murni dapat dilihat pada gambar II.5
berikut ini.
Gambar II.5 Pola standar XRD magnetit (Fe3O4) murni
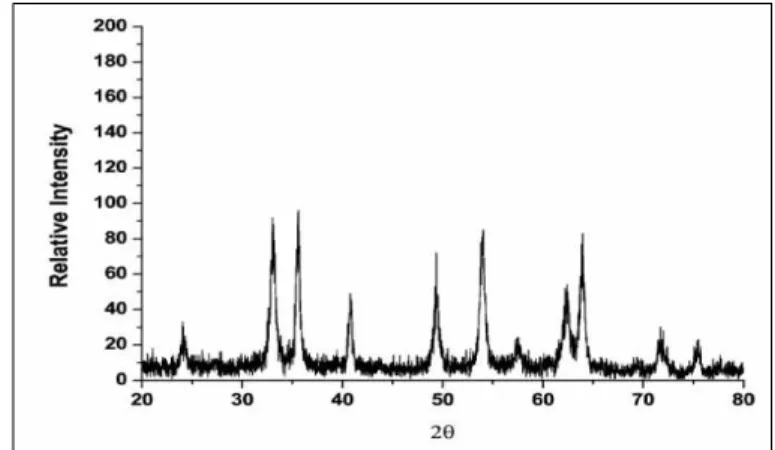
Mathias Jarlbring dkk mengkarakterisasi hematit yang dibuat dengan mencampurkan 200 ml larutan Fe(NO3)3 ke dalam 2500 ml air. Hasil analisa
hematit sintetik tersebut dapat dilihat pada gambar II.6 berikut ini.
Gambar II.6 Difraktogram XRD hematit (Fe2O3) sintetik
II.4.2 Metode Brunauer – Emmet-Teller (BET)
Metode Brunaeur-Emmet-Teller (BET) banyak dipergunakan sebagai metode analisa luas permukaan. Penelitian – penelitian yang menggunakan metode BET untuk menganalisa luas permukaan dapat diuraikan sebagai berikut.
Burton H. Davis memperoleh Fe2O3 murni dengan menggunakan metode
kopresipitasi dan temperatur kalsinasi 350 oC. Hematit yang dihasilkan memiliki luas permukaan 100 m2/g. Untuk proses pembuatan dengan menggunakan
xli
temperatur kalsinasi 400 oC, dihasilkan Fe2O3 murni yang memiliki luas
permukaan 53 m2/g.
Yanping Hu dkk membuat katalis berbasis Fe/Ce yang memiliki luas permukaan 36,6 m2/g dengan metode kopresipitasi. Dengan metode pembuatan yang sama, Fiato dkk menghasilkan katalis berbasis Fe/Co yang memiliki luas permukaan 3 m2/g.
Ward dkk membuat katalis berbasis Fe/Cr yang memiliki luas permukaan 5 m2/g dengan menggunakan metode kopresipitasi sedangkan katalis berbasis Fe/Cr yang dihasilkan oleh Jennings dengan metode yang sama memiliki luas permukaan yang jauh lebih besar yaitu 120-200 m2/g.
Apane Leungnaruemitchai dkk menghasilkan katalis yang berbasis Fe/Au dengan metode kopresipitasi dan deposisi presipitasi. Katalis Fe/Au yang dihasilkan dengan metode kopresipitasi memiliki luas permukaan 345 m2/g sedangkan katalis Fe/Au yang dihasilkan dengan metode deposisi presipitasi memiliki luas permukaan 79,5 m2/g.
II.5 Aktivasi Katalis
Proses aktivasi bertujuan untuk mengaktifkan katalis sebelum digunakan. Aktivasi katalis HTSC dilakukan dengan mereduksi oksida besi haematit (Fe2O3)
menjadi fasa aktif HTSC yaitu magnetit (Fe3O4) dengan gas yang mengandung
H2. Reaksi yang terjadi dapat dilihat pada persamaan 2.6 berikut ini.
3Fe2O3 + H2 à 2Fe3O4 + H2O ∆H = -16,3 kJ mol-1 ...(2.6)
Faktor - faktor yang harus diperhatikan saat melakukan aktivasi katalis adalah temperatur, waktu aktivasi, kemurnian dan konsentrasi gas hidrogen. Temperatur aktivasi sangat berpengaruh terhadap fasa aktif katalis yang dihasilkan. Aktivasi katalis HTSC dilakukan pada temperatur 400 oC selama 4-8 jam (Twigg, 1989).
xlii
Penggunaan temperatur aktivasi di atas 400 oC akan menyebabkan magnetit (Fe3O4) menjadi tidak stabil dan mengalami perubahan fasa menjadi besi
metalik (Fe) mengikuti persamaan berikut ini.
Fe3O4 + 4H2 à 3Fe + 4H2O ∆H = -149,4 kJ mol-1 ...(2.7)
Besi metalik (Fe) ini akan mengkatalisis pembentukan metan, dan bersama – sama dengan hidrokarbon lainnya akan menyebabkan terjadi penguraian CO menjadi karbon dengan reaksi sebagai berikut.
CO + 3H2 à CH4 + H2O ∆H = -206,2 kJ mol-1 ...(2.8)
2CO à C + CO2 ∆H = -172,5 kJ mol-1 ...(2.9)
Pembentukan karbon pada permukaan katalis berupa benang – benang (filamen) yang keluar dari permukaan logam. Lama kelamaan, struktur karbon yang berupa filamen akan memadat dan menutupi pori katalis (Satterfield, 1991).
Selain menyebabkan perubahan fasa, penggunaan temperatur aktivasi di atas 400 oC akan menyebabkan terjadinya sintering. Akan tetapi penggunaan temperatur aktivasi di bawah 400 oC akan menyebabkan proses reduksi katalis menjadi tidak sempurna.
Waktu aktivasi juga memiliki peranan penting untuk mencapai kesempurnaan proses aktivasi. Waktu aktivasi yang terlalu lama akan menyebabkan terjadinya sintering dan waktu aktivasi yang terlalu cepat akan menyebabkan katalis belum tereduksi secara keseluruhan.
Konsentrasi gas hidrogen yang digunakan sebagai reducing agent
memiliki peranan yang tak kalah penting dalam proses aktivasi. Semakin tinggi konsentrasi hidrogen yang digunakan maka konsentrasi produk air yang terbentuk menjadi lebih tinggi (Twigg, 1989). Konsentrasi produk air yang tinggi akan menyebabkan sintering pada oksida dan membentuk permukaan hidroksil yang menyebabkan laju reduksi menjadi lebih rendah (Satterfield, 1991). Umumnya konsentrasi gas hidrogen yang digunakan di industri adalah 4 %.
xliii
II.6 Pengoperasian
Menurut Twigg (1989), pengoperasian katalis HTSC dilakukan pada temperatur 370-400 oC dengan tekanan 3 MPa. Faktor – faktor yang harus diperhatikan pada proses pengoperasian katalis HTSC ini adalah temperatur operasi, rasio kukus terhadap gas umpan, komposisi gas umpan, dan tekanan operasi. Penggunaan temperatur operasi yang tinggi akan menaikkan laju reaksi. Akan tetapi dapat menyebabkan terjadinya sintering bila temperatur operasi yang digunakan lebih besar dari rentang temperatur (370-400 oC). Sebaliknya, bila temperatur operasi yang digunakan lebih rendah dari rentang temperatur (370-400 oC) maka konversi yang dihasilkan menjadi terlalu rendah.
Rasio kukus terhadap gas umpan turut mempengaruhi reaksi pergeseran CO menjadi CO2 dan H2. Rasio kukus terhadap gas umpan yang digunakan harus
tinggi untuk mencegah terjadinya reaksi pembentukan hidrokarbon (CH4) dan
senyawa beroksigen (CH3OH). Hal ini disebabkan karena Cr2O3 merupakan
katalis pembentukan kedua reaksi tersebut pada S/G yang rendah. Selain itu rasio kukus terhadap gas umpan yang rendah akan menyebabkan magnetit (Fe3O4) akan
tereduksi menjadi besi metalik (Fe). Rasio kukus terhadap gas umpan yang lazim digunakan di industri adalah 0,6.
Komposisi gas umpan yang digunakan juga akan mempengaruhi konsumsi kukus, jumlah unggun katalis, dan temperatur operasi yang digunakan. Umumnya komposisi gas umpan HTSC di industri adalah 54 % CO, 12 % CO2, dan 32 % H2.
Tekanan operasi a k a n berpengaruh terhadap ukuran reaktor yang digunakan. Semakin tinggi tekanan total maka tekanan parsial menjadi lebih besar. Tekanan parsial yang besar akan menyebabkan laju reaksi menjadi lebih besar. Akibatnya ukuran reaktor yang digunakan menjadi lebih kecil.
Faktor – faktor yang mempengaruhi reaksi pergeseran CO menjadi CO2
dan H2 penting diketahui pada proses pengoperasian di pabrik dan uji aktivitas di
laboratorium. Beberapa peneliti melakukan uji aktivitas katalis dengan metode yang berbeda – beda. Ringkasan uji aktivitas untuk masing – masing penelitian tersebut dapat dilihat pada uraian berikut ini.
Jenning et al melakukan proses reduksi katalis HTSC berbasis Fe/Cr dengan menggunakan campuran kukus dan hidrogen sebagai pereduksi pada
xliv
temperatur 150-400 oC dalam reaktor fixed bed. Selanjutnya reaksi pergeseran dilakukan pada temperatur 350-500 oC dan menghasilkan aktivitas katalis yang sama dengan katalis komersial HTSC.
Maria do Carmo Rangel dkk melakukan proses reduksi katalis berbasis Fe/vanadium sebanyak 0,35 gr dengan menggunakan campuran 5 % H2 dan N2
pada temperatur 25-1000 oC. Uji aktivitas katalis dilakukan pada kondisi isotermal 370 oC pada tekanan atmosfer dalam mikroreaktor fixed bed yang terdiri dari tabung stainless steel. Gas umpan terdiri dari 10 % CO, 10 % CO2, 60 % H2,
dan 20 % N2 dengan perbandingan S/G = 0,6 dan S/G = 0,2. Perbandingan
S/G = 0,6 digunakan sebagai pendekatan terhadap kondisi proses dalam industri sedangkan S/G = 0,2 digunakan untuk meminimalkan konsumsi kukus.
Gas keluaran selanjutnya dianalisa secara online p a d a Gas Chromatography (GC). Kolom yang digunakan adalah kolom sieve 13X dengan
temperatur 30 oC. Gas carrier yang digunakan adalah gas hidrogen dengan laju alir 30 ml/menit.
Katalis HTSC berbasis Fe/vanadium yang diuji adalah katalis dengan perbandingan V/Fe = 0,03 dan V/Fe = 0,1. Hasil uji aktivitas menunjukkan bahwa katalis yang memiliki aktivitas katalitik yang paling baik pada S/G = 0,6 adalah katalis dengan perbandingan V/Fe = 0,03. Katalis ini memiliki aktivitas katalitik = 17,2 x 10-7 mol/g s. Katalis HTSC berbasis Fe/vanadium yang memiliki aktivitas paling baik dengan perbandingan S/G = 0,2 adalah katalis dengan perbandingan V/Fe = 0,1. Katalis ini memiliki aktivitas katalitik = 26 x 10-7 mol/g s.
Selanjutnya aktivitas katalitik katalis dengan perbandingan V/Fe = 0,03 dibandingkan terhadap aktivitas katalitik katalis HTSC komersial berbasis Fe/Cr. Hasil perbandingan menunjukkan bahwa katalis yang memiliki aktivitas katalitik paling baik dengan perbandingan S/G = 0,6 adalah katalis HTSC berbasis Fe/vanadium dengan perbandingan V/Fe = 0,03. Katalis ini memiliki aktivitas katalitik yang lebih baik dari aktivitas katalitik katalis komersial berbasis Fe/Cr (6,9 x 10-7 mol/g s).
Yanping Hu dkk melakukan proses reduksi katalis HTSC berbasis Fe/Ce dalam reaktor turbular berjenis U-shape-quartz. Katalis sebanyak 0,5 gr
xlv
selanjutnya direduksi menggunakan campuran kukus dan 50 % hidrogen dengan laju alir 25 ml/menit pada temperatur 25-500 oC. Setelah proses reduksi s e l e s a i , d i l a k u k a n purging dengan menggunakan gas nitrogen untuk menghilangkan sisa – sisa kukus dan hidrogen. Selanjutnya reaksi pergeseran CO menjadi CO2 dan H2 dilakukan pada temperatur 350 oC. Akan tetapi Yanping Hu
tidak melaporkan aktivitas katalis yang dihasilkannya.
II.7 Deaktivasi Katalis
Deaktivasi adalah proses yang menyebabkan penurunan aktivitas katalis. Penyebab deaktivasi dapat dikelompokkan menjadi 3 yaitu peristiwa mekanik, termal, dan kimia. Ketiganya tidak dapat dipisahkan karena kaitan satu dengan lainnya. Misalnya, termal akan berpengaruh pada sensitivitas katalis terhadap racun dan sintering. Demikian pula sebaliknya, pengaruh termal dapat dikendalikan melalui interaksi kimia dengan reaktan. Termal dan kimia dapat pula menyebabkan terjadinya kerusakan pada mekanik katalis (Richardson, 1989). Penyebab deaktivasi katalis secara umum dapat dilihat pada tabel II.4 berikut ini.
Tabel II.4 Penyebab deaktivasi katalis (Richardson, 1989)
Jenis Sebab Akibat
Kerusakan partikel Bed channeling dan plugging
Mekanik
Fouling Kehilangan luas permukaan
Volatilisasi senyawa Kehilangan senyawa Perubahan fasa Kehilangan luas permukaan
Pembentukan senyawa baru Kehilangan senyawa dan luas permukaan Termal
Sintering Kehilangan luas permukaan Peracunan Kehilangan fasa aktif Kimia
Coking Kehilangan luas permukaan dan plugging
xlvi
Deaktivasi katalis yang terjadi pada katalis HTSC adalah sintering dan kerusakan partikel katalis (Twigg, 1989). Selain itu deaktivasi katalis HTSC juga disebabkan akibat terjadinya fouling, dan peracunan.
II.7.1 Sintering
Penggunaan temperatur yang tinggi akan menyebabkan terjadinya sintering. Akibat sintering, luas permukaan katalis menjadi lebih rendah.
II.7.2 Kerusakan partikel katalis
Kerusakan partikel katalis HTSC disebabkan karena terjadinya kenaikan
pressure drop. Akibatnya umur katalis menjadi lebih pendek (Twigg, 1989).
II.7.3 Fouling
Fouling adalah pengotoran katalis yang disebabkan oleh deposisi debu,
karat, dan produk korosi lainnya pada partikel katalis (Richardson, 1989). Pada katalis HTSC, fouling terjadi karena kotoran yang terbawa aliran gas proses yang keluar dari secondary reformer.
II.7.4 Peracunan
Katalis HTSC pada pabrik amonia modern tidak memiliki masalah peracunan oleh adanya sulfur. Hidrogen sulfida (H2S) yang ada pada aliran gas
proses dalam jumlah besar tidak mempengaruhi aktivitas katalis HTSC secara permanen. Hal ini disebabkan karena reaksi pembentukan FeS adalah reaksi reversibel (Twigg, 1989).
Fe3O4 + 3H2S + H2 Û 3FeS + 4H2O G = -89,79 kJ/mol ...(2.10)
Pada saat konsentrasi H2S tinggi, reaksi bergeser ke kanan sehingga H2S
akan meracuni katalis HTSC dan membentuk FeS, sedangkan pada saat konsentrasi H2S kembali rendah, reaksi akan bergeser ke kiri dan menyebabkan
katalis kembali aktif.
xlvii
Pada pabrik amonia modern, katalis LTSC-lah yang lebih rentan terhadap peracunan sulfur (Satterfield, 1991). Hal ini dapat dilihat pada reaksi berikut ini.
2Cu + H2S ® Cu2S + H2 G = -52,46 kJ/mol ….(2.11) ZnO + H2S ® ZnS + H2O G = -61,16 kJ/mol ….(2.12)
Reaksi ini irreversibel, sehingga konsentrasi sulfur yang rendah juga akan menyebabkan pembentukan Cu2S dan ZnS secara permanen.
Selain peracunan secara tidak permanen oleh adanya sulfur dalam gas proses, katalis HTSC juga mengalami peracunan lain yang bersifat permanen oleh adanya unsur halida. Kehadiran halida dalam proses disebabkan oleh penggunaan pelarut klorida pada saat pembersihan reaktor. Unsur lainnya yang dapat menyebabkan deaktivasi katalis secara permanen adalah komponen arsen yang terdapat pada unit penyingkiran karbon dioksida melalui kompresi udara atau sistem nitrogen. Komponen lain yang menyebabkan deaktivasi katalis secara permanen adalah posfor dan silika. Komponen ini dapat menyebabkan terjadinya
fouling dan kegagalan pada sistem boiler.