BAB II
TINJAUAN PUSTAKA
II.1. Urea
Urea juga dikenal dengan istilah carbamide. Urea merupakan senyawa kimia
organik yang dihasilkan dari proses metabolisme protein. Urea dapat dibuat dalam
bentuk padat atau cair, dan sering digunakan untuk bahan pembuatan pupuk.
Urea diproduksi menjadi pupuk tanaman. Urea mudah larut dalam air dan
dapat digunakan untuk menyuburkan tanaman. Selain sebagai bahan dasar
kandungan pupuk, urea juga digunakan untuk membuat plastik, pakan ternak, lem,
pembersih toilet, deterjen, pewarna rambut,pestisida, dan fungisida
(hsaidnuraeni./21:03/22;11;2017)
1. Urea dibuat dari hidrolisis parsial cyanamide
H2N-CN + H2O H2N-CO-NH2
2. Urea dihasilkan dari reaksi antara ammonia dengan karbon dioksida
CO2 + NH3 H2N-CO-NH2 + H2O
3. Urea dapat bereaksi dengan formaldehid
NH2-CO-NH2 + HCHO NH2-CO-NH2 + CH2OH
4. Pemanasan ammonia sianat dapat terurai menjadi urea
Gambar 2.1 Struktur Urea
II.2. Adsorpsi
Adsorpsi adalah penyerapan suatu zat pada permukaan zat lain. Fenomena
ini melibatkan interaksi fisik, kimia, dan gaya elektrostatik antara adsorbat dengan
adsorben pada permukaan adsorben. Ada dua macam adsorpsi yaitu adsorpsi
fisika dan adsorpsi kimia. Dalam adsorpsi fisika, molekul-molekul teradsorpsi
pada permukaan dengan ikatan yang lemah (bersifat reversible, dengan cara
menurunkan tekana gas atau konsentrasi zat terlarut). Sedangkan adsorpsi kimia
melibatkan ikatan koordinasi sebagai hasil penggunaan elektron
bersama-sama adsorben dan adsorbat(Osick,1983; Sukardjo,1990). Adsorben adalah zat
yang mengadsorpsi zat lain. yang memiliki ukuran partikel seragam, kepolarannya
sama dengan zat yang akan diserap dan mempunyai berat molekul besar. Adsorbat
adalah zat yang teradsorpsi zat lain. Fakttor-faktor yang mempengaruhi kapasitas
adsorpsi antara lain, luas permukaan adsorben, ukuran pori adsorben, kelarutan zat
terlarut, pH, dan temperatur(Castellan,1982).
II.3. Isoterm Adsorpsi
Isoterm Adsorpsi adalah hubungan yang menunjukkan distribusi adsorben
antara fase teradsorbsi pada permukaan adsorben dengan fase curah
kesetimbangan pada temperatur tertentu. Ada enam jenisjenis hubungan
matematik yang umumnya digunakan untuk menjelaskan isoterm. Isoterm ini
berdasarkan asumsi bahwa adsorben mempunyai permukaan yang heterogen dan
tiap molekul mempunyai potensi penyerapan yang berbeda-beda. Persamaan ini
merupakan persamaan yang dikemukakan oleh Freundlich. Persamaannya adalah :
x/m = k C 1/n
dimana:
m = massa adsorben (mg)
C = konsentrasi adsorben yang sama k,n = konstanta adsorben
Dari isoterm ini, akan diketahui kapasitas adsorben dalam menyerap air.
Isoterm ini akan digunakan dalam penelitian yang akan dilakukan, karena dengan
isoterm ini dapat ditentukan efisisensi dari suatu adsorben (Castellan,1982).
Karbon aktif umumnya mempunyai daya adsorpsi yang rendah dan daya
adsorpsi dapat diperbesar dengan mengaktifkan arang dengan menggunakan uap
atau bahan kimia,aktivitas ini bertujuan memperbesar luas permukaan arang
dengan membuka pori-pori yang tertutup(Kateren,1987).
a.) IUPAC b.) Donohue
Gambar 2.2 Enam tipe isoterm adsorpsi berdsarkan klasifikasi (a) IUPAC dan (b)
Donohue
Bentuk isoterm adsorpsi yang diteliti secara garis besar diklasifikasikan
menjadi 6 (enam) tipe seperti disajikan pada Gambar 7 (Balbuena, 1993). Tipe I
merupakan tipe Langmuir, terjadi pada adsorbent dengan pori mikro (< 2 nm).
Tipe II dan III, terjadi pada adsorben non pori. Tipe II memiliki gaya tarik fluida
dan dinding pori (afinitas) yang kuat sedangkan pada tipe III , gaya tarik fluida
dan dinding bersifat lemah. Tipe IV dan V adalah isoterm untuk adsorben dengan
mesopori ( 2 < dp < 50 nm) dan terjadi kondensasi kapiler. Tipe IV adalah system
adsorpsi dengan gaya tarik fluida dan dinding kuat, sedangkan tipe V , gaya tarik
dinding dan fluida bersifat lemah. Klasifikasi pertama oleh Brauner et al. (1940)
hanya menyampaikan 5 (lima) tipe (Balbuena, 1993). Tipe VI, merupakan tipe
dan dinding relative kuat dan biasanya terjadi pada temperatur mendekati titik
leleh fluida.
II.4. Gelombang Ultasonik
Gelombang ultrasonik merupakan gelombang mekanik longitudinal dengan
frekuensi di atas 20 kHz. Ultrasonik merupakan rambatan energi dan momentum
mekanik sehingga merambat sebagai interaksi dengan molekul dan sifat inersia
medium yang dilaluinya (Bueche, 1986). Karakteristik gelombang ultrasonik yang
melalui medium mengakibatkan getaran partikel dengan medium amplitudo
sejajar dengan arah rambat secara longitudinal. Sehingga menyebabkan partikel
medium membentuk rapatan (strain) dan tegangan (stress). Proses kontinu selama
gelombang ultrasonik melaluinya menyebabkan terjadinya rapatan dan tegangan
di dalam medium disebabkan oleh getaran partikel secara periodik (Resnick dan
Halliday, 1992).
Gelombang ultrasonik mempunyai sifat memantul, diteruskan dan diserap
oleh suatu medium atau jaringan. Apabila gelombang ultrasonik ini mengenai
permukaan medium, maka sebagian dari gelombang ultrasonik ini akan
dipantulkan dan sebagian lagi akan ditransmisikan. Getaran ultrasonik yang
merambat ke dalam jaringan atau zat cair akan mengalami efek kavitasi. Efek
kavitasi terjadi karena tekanan lokal pada gelombang ultrasonik menurun sampai
harga yang cukup rendah.
Gambar 2.3 Evek Kafitasi
p = P – Po dengan : p = tekanan gelombang ultrasonik (N/m2)
P = tekanan lokal/total sesaat (N/m2)
Po = tekanan lokal rata-rata/ keseimbangan (N/m2)
Intensitas gelombang ultrasonik yang merambat akan membawa energi pada
suatu luas permukaan per satuan waktu (Giancoli, 1998). Energi gelombang
ultrasonik tersebut melalui jaringan akan melepaskan energi kalor sehingga terjadi
pemanasan yang mengakibatkan suhu jaringan meningkat yang kemudian
menimbulkan efek kavitasi. Besarnya pemanasan tergantung pada variasi tekanan
gelombang ultrasonik dan kecepatan partikel terhadap energi yang diberikan
(Ackerman, et al., 1988).
Perambatan gelombang ultrasonik dalam suatu medium, maka partikel
akan mengalami perpindahan energi. Besarnya energi gelombang ultrasonik yang
dimiliki partikel medium adalah :
Perhitungan intensitas gelombang ultrasonik perlu mengetahui energi yang
dibawa oleh gelombang ultrasonik. Intensitas gelombang ultrasonik (I) adalah
energi yang melewati luas permukaan medium 1m2/s atau watt/m2.
II.4.1.Pemanfaatan Gelombang Ultrasonik
Peningkatan reaksi kimia dengan ultrasonik telah dikembangkan dan
memiliki aplikasi bermanfaat dalam sintesis fasa campuran, kimia material, dan
biomedis. Studi tentang sonokimia berkaitan dengan pemahaman pengaruh
gelombang suara dan sifat gelombang pada sistem kimia. Bahaya pemaparan
frekuensi dan total pemaparannya. Efek penggunaan gelombang ultrasonik
terhadap substrat dapat disebabkan karena adanya efek termal, kavitasi dan
mekanik. Efek termal merupakan absorpsi energi gelombang ultrasonik yang
menyebabkan suhu atom atau molekul meningkat. Besar absorpsi energi
gelombang tergantung pada viskositas, massa jenis dan impedansi.
Gelombang ultrasonik yang merambat melalui medium mengalami
pengurangan energi, karena sebagian energinya diabsorpsi medium. Hal ini
mengakibatkan kenaikan suhu medium. Kenaikan suhu medium tergantung pada
besar koefisien absorpsi dan intensitas yang melaluinya. Efek kavitasi merupakan
terjadinya gelembung gas di dalam medium karena pemanasan lokal dengan
tekanan yang bervariasi, sehingga di dalam medium terbentuk gelembung gas
mikro. Gas di dalam medium dapat memuai jika diradiasi ultrasonik tinggi,
sehingga terjadi difusi gas yang tidak seimbang.
Efek mekanik yang ditimbulkan gelombang ultrasonik adalah getaran partikel di
dalam medium. Getaran terjadi pada semua intensitas, sehingga dapat
menyebabkan efek mekanik. Efek mekanik akan menimbulkan percepatan
partikel, getaran, tekanan pancaran dan gaya gesek (Sabbagha, 1980). Aplikasi
gelombang ultrasonik pada padat-cair atau suspensi cairan-kristal akan
menghasilkan kecepatan tabrakan antarpartikel yang tinggi. Pengaruh yang
ditimbulkan dapat mengubah morfologi permukaan, komposisi, dan reaktivitas,
sehingga ultrasonikasi dapat digunakan sebagai deaglomerasi dan pengecilan
material berukuran micrometer atau nanometer serta untuk disintegrasi sel atau
pencampuran pereaksi.
Proses ultrasonik dapat meningkatkan reaktivitas kimia dalam sistem
sebanyak jutaan kali, secara efektif bertindak sebagai katalis dengan menarik
model atom dan molekul dari sistem (seperti model vibrasi, rotasi, dan translasi).
Selain itu, dalam reaksi yang menggunakan padatan, ultrasonik memisahkan
kepingan-kepingan padat dan energi yang dilepaskan dari gelembung yang dibuat
oleh kavitasi melalui kepingan padat tersebut. Hal ini memberikan pereaksi padat
dengan area permukaan untuk reaksi yang lebih besar untuk melanjutkan proses
Gambar 2.4 Gamabar ultrasonic Homogenizer (Foto di lab New and renewable
Energy research center)
II.5.Karbon Aktif
Karbon aktif merupakan senyawa karbon amorf dan berpori yang
mengandung 85-95% karbon yang dihasilkan dari bahan-bahan yang mengandung
karbon (batubara, kulit kelapa, dan sebagainya) atau dari karbon yang
diperlakukan dengan cara khusus baik aktivasi kimia maupun fisika untuk
mendapatkan permukaan yang lebih luas. Karbon aktif dapat mengadsorpsi gas
dan senyawa-senyawa kimia tertentu atau sifat adsorpsinya selektif, tergantung
pada besar atau volume pori-pori dan luas permukaan. Struktur pori berhubungan
dengan luas permukaan, semakin kecil pori-pori arang aktif, mengakibatkan luas
permukaan semakin besar. Dengan demikian kecepatan adsorpsi bertambah.
Untuk meningkatkan kecepatan adsorpsi, agar menggunakan arang aktif yang
telah dihaluskan. Sifat arang aktif yang paling penting adalah daya. Dalam hal ini,
ada beberapa faktor yang mempengaruhi daya serap adsorpsi, yaitu:
1. Sifat Serapan
Banyak senyawa yang dapat diadsorpsi oleh arang aktif, tetapi kemampuannya
untuk mengadsorpsi berbeda untuk masing- masing senyawa. Adsorpsi akan
bertambah besar sesuai dengan bertambahnya ukuran molekul serapan dari
gugus fungsi, posisi gugus fungsi, ikatan rangkap, struktur rantai dari senyawa
serapan.
2. Temperatur
Dalam pemakaian arang aktif dianjurkan untuk mengamati temperatur pada saat
berlangsungnya proses. Faktor yang mempengaruhi temperatur proses adsoprsi
adalah viskositas dan stabilitas thermal senyawa serapan. Jika pemanasan tidak
mempengaruhi sifat-sifat senyawa serapan, seperti terjadi perubahan warna
maupun dekomposisi, maka perlakuan dilakukan pada titik didihnya. Untuk
senyawa volatil, adsorpsi dilakukan pada temperatur kamar atau bila
memungkinkan pada temperatur yang lebih rendah.
3. pH (Derajat Keasaman).
Untuk asam-asam organik, adsorpsi akan meningkat bila pH diturunkan, yaitu
dengan penambahan asam-asam mineral. Ini disebabkan karena kemampuan asam
mineral untuk mengurangi ionisasi asam organik tersebut. Sebaliknya bila pH
asam organik dinaikkan yaitu dengan menambahkan alkali, adsorpsi akan
berkurang sebagai akibat terbentuknya garam.
4. Waktu Singgung
Bila arang aktif ditambahkan dalam suatu cairan, dibutuhkan waktu untuk
mencapai kesetimbangan. Waktu yang dibutuhkan berbanding terbalik dengan
jumlah arang yang digunakan. Selisih ditentukan oleh dosis arang aktif,
pengadukan juga mempengaruhi waktu singgung. Pengadukan dimaksudkan
untuk memberi kesempatan pada partikel arang aktif untuk bersinggungan dengan
senyawa serapan. Untuk larutan yang mempunyai viskositas tinggi, dibutuhkan
waktu singgung yang lebih lama(Simanjuntak,2008)
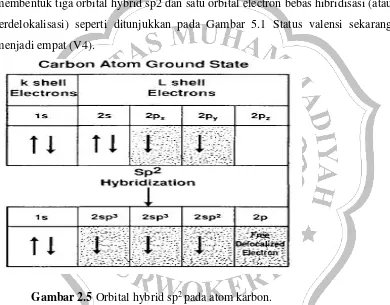
II.5.I IKATAN KARBON TRIGONAL sp2 DAN DIGONAL sp
Selain orbital hibrida tetragonal sp3, dua orbital lainnya melengkapi
rangkaian blok bangunan elektronik dari semua alotrop karbon dan senyawanya:
orbital sp2 dan orbital sp. Orbital sp3 adalah kunci dari senyawa berlian dan
alifatik, sedangkan orbital sp2 (atau trigonal) adalah basis dari semua struktur
grafit dan senyawa aromatik. Mekanisme hibrid isasi sp2 agak berbeda dengan
hibridisasi sp3. Penataan elektron dari kulit L atom dalam keadaan dasar
dimodifikasi karena salah satu elektron dari orbital 2s dipromosikan dan
dikombinasikan dengan dua electron dari orbital 2p (sehingga diberi tanda sp2)
membentuk tiga orbital hybrid sp2 dan satu orbital electron bebas hibridisasi (atau
terdelokalisasi) seperti ditunjukkan pada Gambar 5.1 Status valensi sekarang
menjadi empat (V4).
Gambar 2.5 Orbital hybrid sp2pada atom karbon.
Bagian yang diarsir merupakan valensi. Pada keadaan dasar terdapat dua electron valensi, sedangkan pada keadaan terhibridisasi terdapat empat electron valensi.
Ketiga orbital sp2 identik berada pada bidang yang sama. Orientasi electron pada probabilitas maksimum membentuk sudut 120° satu sama lain seperti ditunjukkan
pada Gambar 5.2. Orbital keempat, yaitu elektron p yang tidak terhibridisasi
terdelokalisasi, diarahkan tegak lurus terhadap bidang orbital tiga sp2 dan tersedia untuk membentuk ikatan pi (π) dengan atom lainnya.
2. Ikatan Karbon Covalent sp2
Seperti ikatan sp3, ikatan sp2 bersifat kovalen. ikatan ini merupakan iktan yang kuat, karena adanya tiga elektron valensi pada orbital sp2 dan ukuran atom yang kecil. Konfigurasi miring dari orbit sp2 memungkinkan tumpang tindih
substansial dengan orbital sp2 lainnya.Seperti orbital sp3, orbital sp2 memiliki arah dan disebut orbital sigma (𝛿), dan ikatannya disebut ikatan sigma.
Gambar 2.7 Bentuk skematis tiga dimensi struktur grafit
Setiap atom karbon yang terhibrida sp2 bergabung dengan dua atom yang
terhibridisasi sp2 lainnya membentuk serangkaian struktur heksagonal, semuanya terletak pada bidang sejajar. Gambar 6. menunjukkan bentuk gabungan karbon
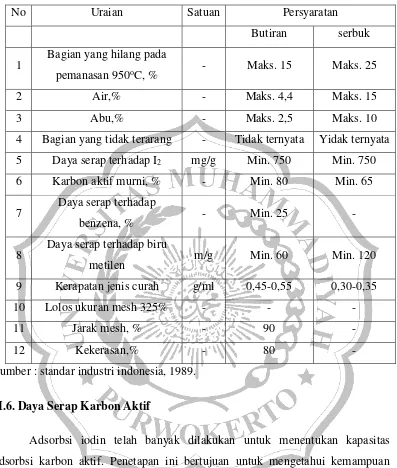
Tabel 2.1. Syarat mutu karbon aktif
No Uraian Satuan Persyaratan
Butiran serbuk
1 Bagian yang hilang pada
pemanasan 950oC, % - Maks. 15 Maks. 25
2 Air,% - Maks. 4,4 Maks. 15
3 Abu,% - Maks. 2,5 Maks. 10
4 Bagian yang tidak terarang - Tidak ternyata Yidak ternyata
5 Daya serap terhadap I2 mg/g Min. 750 Min. 750
Adsorbsi iodin telah banyak dilakukan untuk menentukan kapasitas
adsorbsi karbon aktif. Penetapan ini bertujuan untuk mengetahui kemampuan
arang aktif untuk menyerap larutan berwarna. Angka iodin didefinisikan sebagai
jumlah miligram iodin yang diadsorpsi oleh satu gram karbon aktif. Dimana
konsentrasi filtrat adalah 0,02 N, pada metode ini diasumsikan bahwa iodin berada
dalam kesetimbangan pada konsentrasi 0,02 N yaitu dengan terbentuknya lapisan
tunggal (monolayer) pada permukaan karbon aktif dan inilah yang menjadi alasan
mengapa terdapat hubungan antara bilangan iodium dengan luas permukaan
spesifik karbon aktif (Jankowska et all 1991). Berdasarkan Standart Industri
II.7. Karakteristik Karbon
1. Luas permukaan
1. Surface Area Analyzer (SAA)
Luas permukaan karbon dapat diukur menggunakan instumen SSA. Produk
karbon aktif yang dihasilkan dianalisis luas permukaannya dengan menggunakan
Surface Area Analyzer(SAA). Dengan alat ini, luas permukaan karbon aktif dapat
langsung diketahui. Sebelum dimasukkan ke dalam alat, sampel karbon aktif
harus ditimbang terlebih dahulu untuk mengetahui massanya sehingga nantinya
dapat diketahui luas permukaannya setiap 1 gram karbon aktif ( Rizka,dkk. 2017 )
Gambar 2.8 Alat Surface Area Analyzer (SAA) 2. Bilangan Iod
Karaktersistik karbon aktif dilakukan menggunakan instrument FTIR dan
bilangan iod. Instrumen FTIR menentukan gugus fungsional yang terdapat
pada di permukaan karbon,sedangkan bilangan iod menentukan luas
permukaan karbon aktif (Mianowski P.et al,2007). (Mianowski P.et al,2007)
memperoleh korelasi bilangan iod dengan luas permukaan karbon di sajikan
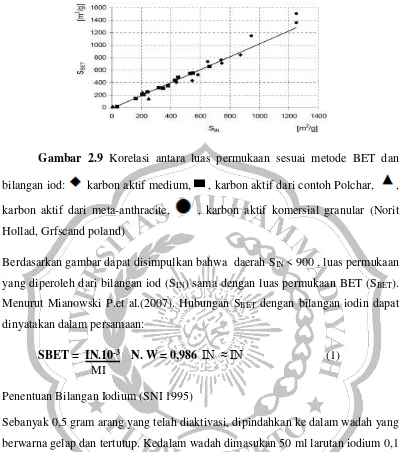
Gambar 2.9 Korelasi antara luas permukaan sesuai metode BET dan
bilangan iod: karbon aktif medium, , karbon aktif dari contoh Polchar, , karbon aktif dari meta-anthracite, , karbon aktif komersial granular (Norit
Hollad, Grfscand poland)
Berdasarkan gambar dapat disimpulkan bahwa daerah SIN < 900 , luas permukaan
yang diperoleh dari bilangan iod (SIN) sama dengan luas permukaan BET (SBET).
Menurut Mianowski P.et al.(2007). Hubungan SBET dengan bilangan iodin dapat
dinyatakan dalam persamaan:
SBET = IN.10-3 N. W = 0,986 IN ≈ IN (1)
MI
Penentuan Bilangan Iodium (SNI 1995)
Sebanyak 0,5 gram arang yang telah diaktivasi, dipindahkan ke dalam wadah yang
berwarna gelap dan tertutup. Kedalam wadah dimasukan 50 ml larutan iodium 0,1
N kemudian dikoncok selama 15 menit lalu disaring. Filtat dipipet sebanyak 10
ml ke dalam erlenmeyer kemudian dititrasi dengan larutan natrium tiosulfat 0,1 N
jika warna kuning larutan hampir hilang, ditambahkan indikator pati 1 %. Titrasi
di lanjut sampai mendapatkan titik akhir (warna biru tepat hilang) (Alfiany et al.
2013).
3. Bilangan BTB
Salah satu cara untuk melihat hubungan produsen dan konsumen dalam
pemakaian dan produksi karbon dalam air dapat dilakukan dengan Uji Bromtimol
dalam larutan basa dan kuning dalam larutan asam. Gas karbondioksida akan
membentuk asam jika dilarutkan dalam air. Perubahan warna pada perlakuan
disebabkan oleh perubahan kandungan karbondioksi-da yang ada dalam air. Kadar
karbondioksida akan berkurang apabila terjadi proses foto-sintesis oleh tumbuhan.
Sebaliknya kadar karbondioksida akan meningkat kalau terjadi proses respirasi.
Waktu yang diperlukan brom timol biru untuk berubah menjadi kuning bervariasi
pada setiap individu. Brom timol biru sering digunakan untuk menguji kandungan
gas kar-bon dioksida. Indikator ini akan berubah warna dari biru menjadi hijau
kemudian menjadi kuning ketika bercampur dengan sejumlah karbon dioksida
yang berbeda. Reaksi yang dihasilkan ini melalui dua tahap. Tahap yang pertama,
karbon dioksida akan bereaksi de-ngan air dalam larutan dan menghasilkan asam
karbonat. Tahap yang kedua, asam ini ter-campur dengan brom timol biru dan
menyebabkan warna birunya berubah menjadi ku-ning. Persamaan reaksinya
adalah sebagai berikut.
CO2 + H2O H2CO3 (Asam karbonat)
Tingkatan dan laju perubahan warna pada indikator menunjukkan banyaknya
kar-bon dioksida yang diembuskan dan laju respirasi. Semakin cepat warna
berubah dan se-makin kuat warna kuningnya menunjukkan semakin kuat
konsentrasi asamnya. Larutan asam yang kuat merupakan petunjuk tingkatan
karbon dioksida yang tinggi dalam air.
2. Pori dan distribusi pori
1. BET(Brunaur,Emmett and Teller)
Pencirian karbon aktif ditentukan dengan adsorpsi N2 pada −196 °C (77K), menggunakan alat model BET Sorptometer- 201APC (Zabihi et al. 2010). BET
berfungsi untuk mendeteksi permukaan area contoh, menggunakan metode
adsorpsi gas N2 pada padatan kemudian data yang diperoleh dihitung
menggunakan teori BET.
Berikut persamaan BET:
1 = 1 + C.1 x P
Keterangan:
Va = volume gas standar keadaan STP (mL)
P = tekanan parsial gas (Pa)
Po = tekanan uap jenuh (Pa)
Vm = volume gas pada lapisan tunggal (mL)
C = tetapan gas
3.Morfologi
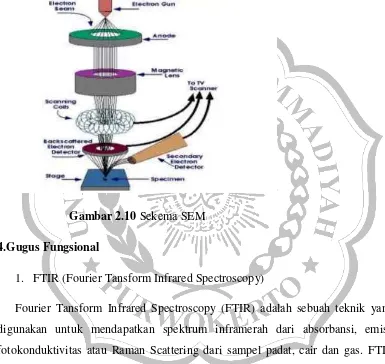
1. Scanning Electron Microscope (SEM)
Scanning Electron Microscope (SEM) adalah Untuk mengetahui morfologi dan
EDX karbon aktif. alat yang digunakan untuk mempelajari morfologi permukaan
objek pada skala yang amat kecil. Prinsip kerja SEM, dengan cara mengalirkan
arus pada kawat filamen dan perlakuan pemanasan, sehingga dihasilkan elektron.
Elektron tersebut dikumpulkan dengan tegangan tinggi dan berkas elektron
difokuskan dengan sederetan lensa elektromagnetik. Ketika berkas elektron
mengenai target, informasi dikumpulkan melalui tabung sinar katoda yang
mengatur intensitasnya. Setiap jumlah sinar yang dihasilkan dari tabung sinar
katoda dihubungkan dengan jumlah target, jika terkena berkas elektron berenergi
tinggi dan menembus permukaaan target, elektron kehilangan energi, karena
terjadi ionisasi atom dari cuplikan padatan. Elektron bebas ini tersebar keluar dari
aliran sinar utama, sehingga terbentuk lebih banyak elektron bebas, dengan
demikian energinya habis lalu melepaskan diri dari target. Elektron ini kemudian
dialirkan ke unit demagnifikasi dan dideteksi oleh 31detektor dan selanjutnya
dicatat sebagai suatu foto (Wagiyo dan Handayani,1997).
Prinsip kerja dari SEM adalah sebagai berikut:
1. Sebuah pistol elektron memproduksi sinar elektron dan dipercepat dengan
anoda.
3. Sinar elektron yang terfokus memindai (scan) keseluruhan sampel dengan
diarahkan oleh koil pemindai.
4. Ketika elektron mengenai sampel maka sampel akan mengeluarkan elektron
baru yang akan diterima oleh detektor dan dikirim ke monitor (CRT).
Secara lengkap skema SEM dijelaskan oleh gambar dibawah ini:
Gambar 2.10 Sekema SEM
4.Gugus Fungsional
1. FTIR (Fourier Tansform Infrared Spectroscopy)
Fourier Tansform Infrared Spectroscopy (FTIR) adalah sebuah teknik yang
digunakan untuk mendapatkan spektrum inframerah dari absorbansi, emisi,
fotokonduktivitas atau Raman Scattering dari sampel padat, cair dan gas. FTIR
digunakan untuk mengamati interaksi molekul dengan menggunakan radiasi
elektromagnetik yang berada pada panjang gelombang 0,75-1000μm atau pada
bilangan gelombang 13.000-10 cm-1. FTIR dapat digunakan untuk menganalisa
senyawa organik dan anorganik. Selain itu, FTIR juga dapat digunakan untuk
analisa kualitatif meliputi analisa gugus fungsi (adanya ‘peak’ dari gugus fungsi
spesifik) beserta polanya dan analisa kuantitatif dengan melihat kekuatan absorbsi
senyawa pada panjang gelombang tertentu. Mekanisme yang terjadi pada alat
diteruskan, dan kemudian akan dipecah oleh pemecah sinar menjadi duabagian
sinar yang saling tegak lurus. Sinar ini kemudian dipantulkan oleh dua cermin
yaitu cermin diam dan cermin bergerak. Sinar hasil pantulan kedua cermin akan
dipantulkan kembali menuju pemecah sinar untuk saling berinteraksi. Dari
pemecah sinar, sebagian sinar akan diarahkan menuju cuplikan dan sebagian
menuju sumber. Gerakan cermin yang maju mundur akan menyebabkan sinar
yang sampai pada detektor akan berfluktuasi. Sinar akan saling menguatkan ketika
kedua cermin memiliki jarak yang sama terhadap detektor, dan akan saling
melemahkan jika kedua cermin memiliki jarak yang berbeda. Fluktuasi sinar yang
sampai pada detektor ini akan menghasilkan sinyal pada detektor yang disebut
interferogram. Interferogram ini akan diubah menjadi spektr IR Jengan bantuan
computer berdasarkan operasi matematika.Tahid,1994)
2. Titrasi Boehm
Titrasi Boehm untuk mengetahui jumlah gugus asam dan basa pada
permukaan karbon aktif. 0,5 gram karbon aktif ditimbang dan masing-masing
dicampur dengan 50 mL 0,05 N larutan NaHCO
3, Na2CO3, NaOH (untuk analisa
sifat asam); dan 50 mL 0,05 N larutan HCl (untuk analisa sifat basa) dalam
erlenmeyer. Campuran didiamkan selama 24 jam kemudian karbon aktif
dipisahkan dari larutan secara dekantasi. 10 mL larutan NaHCO3, Na2CO3, dan
NaOH hasil pemisahan dititrasi balik dengan 0,05 N larutan HCl yang telah
distandarisasi dengan larutan Na2B4
O7. Sedangkan 10 mL larutan HCl hasil
pemisahan dititrasi balik dengan 0,05 N larutan NaOH yang telah distandarisasi
dengan larutan H2C2O4.
II.8. Identifikasi
II.8.1. Spektrofotometri
Spektrofotometer sesuai dengan namanya adalah alat yang terdiri dari
spectrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum
dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas
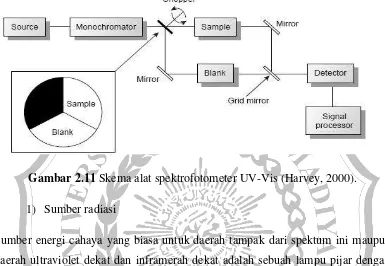
II.9.2. Spektrofotometer UV-VIS
Susunan peralatan spektrofotometer Ultra-Violet dan sinar tampak diperlihatkan
pada gambar instrumentasi utama pada UV-VIS
Gambar 2.11 Skema alat spektrofotometer UV-Vis (Harvey, 2000).
1) Sumber radiasi
Sumber energi cahaya yang biasa untuk daerah tampak dari spektum ini maupun
daerah ultraviolet dekat dan inframerah dekat adalah sebuah lampu pijar dengan
kawat ranbut terbuat dari wolfram. Pada kondisi operasi biasa, keluaran lampu
wolfram ini memadai dari sekitar 235 atau 350 nm ke sekitar 3 µm. Energi yang
dipancarkan olah kawat yang dipanaskan itu beraneka ragam menurut panjang
gelombangnya. Panas dari lampu wolfram dapat merepotkan. Seringkali rumah
lampu itu diselubungi air atau didinginkan dengan suatu penghembus angin untuk
mencegah agar sampel ataupun komponen lain dari instrumen itu menjadi hangat.
2) Wadah sampel (cuvet)
Kebanyakan spektrofotometri melibatkan larutan dan karenanya kebanyakan
wadah sampel adalah sel untuk menaruh cairan kedalam berkas cahaya
spektrofotometrer. Cuvet itu haruslah meneruskan energi cahaya dalam daerah
spektral yang diminati, jadi cuvet kaca melayani daerah tampak.
Dalam instrument, tabung reaksi silindris kadang-kadang digunakan sebagai
salah satu sisi tabung dan tanda itu selalu tetap arahnya tiap kali ditaruh dalam
instrument. Cuvet harus diisi sedemikian rupa sehingga berkas cahaya menembus
larutan, dengan meniscus terletak seluruhnya diatas berkas. Umumnya cuvet
ditahan pada posisinya dengan desain kinematik dari pemegangnya atau dengan
jepitas berpegas yang memastikan bahwa posisi tabung dalam ruang cuvet (dari)
instrument itu reprodusible.
3) Monokromator
Monokromator ini adalah piranti optis untuk memencilkan suara berkas radiasi
dari sumber berkesinambungan, berkas mana mempunyai kemurnian spectral
yang tinggi dengan panjang gelombang yang diinginkan. Radiasi dari
sumberdifokuskan kecelah masuk, kemudian disejajarkan oleh sebuah lensa atau
cermin sehingga suatu berkas sejajar ke unsure pensipersi, yang berupa prisma
atau suatu kisi difraksi. Dengan memutar prisma atau kisi itu secara mekanis,
aneka porsi spectrum yang dihasilkan oleh insur disperse dipusatkan pada celah
keluar, dari situ lewat jalan optis lebih jauh, porsi-porsi itu menjumpai sampel.
4) Detector
Detector dapat memberi respons terhadap radiasi pada berbagai gelombang. Ada
beberapa cara untuk mendeteksi substansi yang telah melewati kolom. Metode
umum yang mudah dipakai untuk menjelaskan yaitu penggunaan serapan
ultra-violet. Banyak senyawa-senyawa organik menyerap sinar UV dari beberapa
panjang gelombang. Jumlah cahaya yang diserap akan bergantung pada jumlah
senyawa tertentu yang melewati melalui berkas pada waktu itu.
5) Rekorder
Didalam rekorder signal tersebut direkam sebagai spektrum yang berbentuk
puncak-puncak. Spektrum adsorpsi merupakan plot natara adsorben sebagai
Gambar 2.12 Alat spektrofometer UV-VIS
II.9.
Surfaktan
Surfaktan atau surface active agent merupakan suatu molekul amphipatic
atau amphiphilic yang mengandung gugus hidrofilik dan lipofilik dalam satu
molekul yang sama. Secara umum kegunaan surfaktan adalah untuk menurunkan
tegangan permukaan, tegangan antarmuka, meningkatkan kestabilan partikel yang
terdispersi dan mengontrol jenis formasi emulsi yaitu misalnya oil in water (O/W)
atau water in oil (W/O).
Surfaktan dibagi menjadi empat bagian penting dan digunakan secara
meluas pada hampir semua sektor industri modern.
a) Surfaktan non ionik adalah surfaktan yang tidak bermuatan atau tidak terjadi
ionisasi molekul.
Contoh : ikatan eter pada gugus terlarut, ester, amida, amin, Alkyl poly
(ethylene oxide), Alkylphenol poly (ethylene oxide), Kopolymers ofpoly
(ethylene oxide) dan poly (propylene oxide) atau Poloxamers / Poloxamines,
Alkyl polyglucosides (Octyl glucoside, Decyl maltoside), Fatty alcohols,
Cetyl alcohol, Oleyl alcohol, Cocamide MEA, cocamide DEA, Polysorbates
Gambar 2.13.a Representasi surfaktan nonionik
b) Surfaktan anionik adalah senyawa yang bermuatan negatif dalam bagian aktif
permukaan (surface active) atau pusat hidrofobiknya.
Contoh : karboksilat, ester sulfat, alkil sulfonat, dan anion lainnya yang
hidrofil. Perfluorooctanoate (PFOA/PFO), Perfluorooctanesulfonate (PFOS),
Sodium dodecyl sulfate (SDS), Ammonium lauryl sulfate, gram alkyl sulfate,
Sodium laureth sulfate atau sodium lauryl ether sulfate (SLES), Alkyl
benzene sulfonate, sabun atau garam asam lemak.
Gambar 2.13.b Contoh surfaktan anionik
c) Surfaktan kationik adalah senyawa yang ditandai dengan adanya muatan
positif
pada gugus antar muka hidrofobik (hydrophobic suface active)
Contoh : senyawa amino, senyawa amonium, alkali tak bernitrogen
dsb). Cetyl trimethylammonium bromide (CTAB) a.k.a. hexadecyl trimethyl
ammonium bromide, dan garam alkyltrimethylammonium, Cetylpyridium
chloride (CPC), Polyethoxylated tallow amine (POEA), Benzalkonium
chloride (BAC), Benzethonium chloride (BZT).
Gambar 2.13.c Contoh surfaktan kationik.
d) Surfaktan amfoterik atau amfolitik adalah surfaktan yang mengandung gugus
anionik dan kationik, dimana muatannya bergantung kepada pH, pada pH
tinggi dapat menunjukan sifat anionik dan pada pH rendah dapat menunjukan
sifat kationik.
Contoh : ikatan amino dan karboksilat, amino dan ester sulfat, amino dan
ester sulfonat, dan ikatan lainnya serta Dodecyl betaine, Cocamidopropyl
betaine, Coco ampho glycinate (Swasono et al. 2012).
Cetylpyridium chloride (CPC) merupakan surfaktan yang umum
digunakan sebagai antiseptik dan disinfektan (Mcdonnell & Russell 1999 dalam
Triwibowo et al. 2016). Cetylpyridium chloride dengan formula kimia C12H38ClN,
Molar massa 339,99 g/mol, dengan bentuk solid, dan melting point 77 oC (171 oF, 350 K)