PEMURNIAN SIRUP GLUKOSA MENGGUNAKAN MEMBRAN ULTRAFITRASI DENGAN BERBAGAI TEKANAN DAN WAKTU OPERASI
SKRIPSI
OLEH :
NUR FITRI ANDIRANI 0833010010
FAKULTAS TEKNOLOGI INDUSTRI JURUSAN TEKNOLOGI PANGAN
UNIVERSITAS PEMBANGUNAN NASIONAL “ VETERAN” JAWA TIMUR SURABAYA
PEMURNIAN SIRUP GLUKOSA MENGGUNAKAN MEMBRAN ULTRAFILTRASI DENGAN BERBAGAI TEKANAN DAN WAKTU OPERASI
Nur Fitri Andriani 0833010010
INTISARI
Permasalahan yang timbul pada pembuatan sirup glukosa pemurnian konvensional adalah DE nya rendah, karena proses pemurniannya itu mungkin belum sempurna sehingga komponen pengkotor masih ada. Proses pemurnian konvensional melalui beberapa tahap yaitu mulai dari karbon aktif untuk menghilangkan bau, warna, kotoran. Proses penukaran ion untuk memisahkan ion-ion logam, dan proses penguapan untuk mendapatkan sirup glukosa dengan kekentalan yang dikehendaki. Tetapi dengan proses oemurnian konvensional ini hasilnya belum efektif. Oleh karena itu salah satu untuk mengatasi kendala tersebut adalah dengan penerapan teknologi membran. Membran yang digunakan dalam penelitian ini adalah dengan membran ultrafiltrasi.
Tujuan dari penelitian ini untuk mengetahui pengaruh berbagai tekanan dan waktu operasi dengan membran ultrafiltrasi. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) pola faktorial yang terdiri dari 2 faktor dengan 2 kali ulangan, faktor I adalah tekanan operasi (2.34, 2,3 dan 2,44 bar) dan faktor II adalah waktu operasi (60, 90 dan 120 menit).
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat ALLAH SWT, karena atas Rahmat dan Hidayah-Nya sehingga penulis dapat menyelesaikan Laporan Skripsi dengan judul “ Pemurnian Sirup Glukosa Menggunakan Membran Utrafiltrasi Dengan Berbagai Tekanan dan Waktu Operasi “.
Tujuan dari penulisan Skripsi ini adalah untuk memenuhi persyaratan akademik dalam meraih gelar Sarjana Teknik (S1) jurusan Teknologi Pangan Fakultas Teknologi Industri Universitas Pembangunan Nasional ‘Veteran” Jawa Timur.
Penulisan Laporan Skripsi ini dapat selesai atas bantuan dan bimbingan dari berbagai pihak. Dalam kesempatan ini penulis ingin menyampaikan ucapan terima kasih kepada :
1. Bapak Ir. Sutiyono MS, selaku Dekan Fakultas Teknologi Industri, Universitas Pembangunan Nasional “Veteran” Jawa Timur.
2. Ibu Ir. Latifah, MS, selaku Ketua Jurusan Teknologi Pangan Fakultas Teknologi Industri, Universitas Pembangunan Nasional “Veteran” Jawa Timur dan Dosen Wali saya.
3. Ibu Ir. Sudaryati, Hp.Mp selaku Dosen Pembimbing Skripsi pada Jurusan Teknologi Pangan Fakultas Teknologi Industri, Universitas Pembangunan Nasional “Veteran” Jawa Timur, atas segala saran dan petunjuk yang diberikan kepada penulis.
4. Ibu Ir. Murtiningsih selaku Dosen Pembimbing Skripsi pada Jurusan Teknologi Pangan Fakultas Teknologi Industri, Universitas Pembangunan Nasional “Veteran” Jawa Timur.
5. Bapak Ir Rudi Nurismanto atas segala saran dan petunjuk yang diberikan kepada penulis.
6. Ibu Dra. Jariyah Mp, atas segala saran dan petunjuk yang diberikan kepada penulis.
7. Bapak dan Ibu dosen di jurusan Teknologi Pangan Fakultas Teknologi Industri UPN “Veteran” Jawa Timur, atas segala saran dan petunjuk yang diberikan kepada penulis.
selalu memberikan doa, dukungan dan restunya guna terselesaikannya Skripsi ini. Makasih
9. Buat papa mama mertua saya Drs Suharno dan Ning Sriyani yang selalu memberikan doa, dukungan dan semangat guna terselesaikan Skripsi ini.
10. Buat suamiku Haris Hariyanto, SE yang sudah menemaniku, dan selalu memberikan support dikala aku terjatuh ataupun bangkit.
11. Teman-temanQ jurusan Teknologi Pangan khususnya mbak Vanda Sang Peramal, mas Agus dosen pembimbing muda, Devi, Nuning, Fafa Goendol, Depe, Lia TingTing, Mas Habibie juragan tempe, Fata, Dhynar, mas Topik juru kunci Lab dan temanku yang lain yang telah membantu dalam terselesaikannya Skripsi ini.
Penulis mengharapkan dengan adanya penulisan ini dapat menambah wawasan dan cakrawala dalam berfikir untuk lebih maju dimasa yang akan datang serta agar bermanfaat bagi yang berkepentingan. Disamping itu juga penulis menyadari bahwa penulisan ini masih jauh dari kesempurnaan sehingga mengharapkan kritik dan saran yang membangun.
Surabaya, Agustus 2012
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN ... ii
HALAMAN PENGESAHAN ... iii
ABSTRAK ... iv
KATA PENGANTAR ... v
DAFTAR ISI ... vi
BAB I PENDAHULUAN ... 1
A. Latar Belakang... 3
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
A. Tinjauan Umum Tanaman Garut ... 4
B. Pati Garut ... 5
C. Enzim ... 7
D. Aktivitas Enzim ... 10
E. Hidrolisis ... 11
F. Hidrolisis Pati Secara Enzimatis ... 12
G. Faktor-faktor Yang Mempengaruhi Hidrolisis ... 14
H. Likuifikasi ... 16
I. Sakarifikasi ... 16
J. Sirup Glukosa ... 17
K. Pemurnian Sirup Glukosa Pati Garut Dengan Membrane Ultrafitrasi ... 21
L. Analisa Kelayakan Finansial ... 28
M. Landasan Teori ... 31
BAB III METODOLOGI PENELITIAN ... 33
A. Tempat Dan Waktu Penelitian ... 33
B. Bahan Yang Digunakan ... 33
C. Peralatan Yang Digunakan ... 33
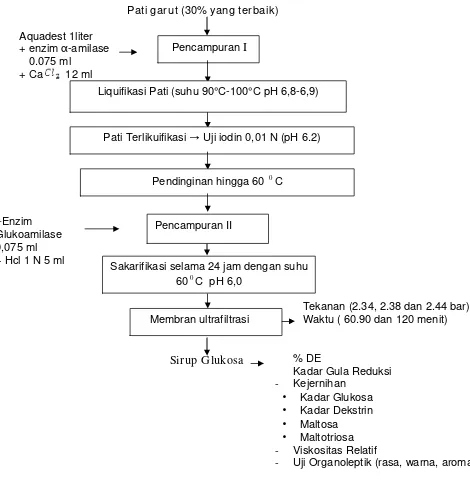
D. Metode Penelitian ... 33
BAB IV HASIL DAN PEMBAHASAN ... 39
A. Hasil Analisis Bahan Baku ... 39
B. Hasil Analisa produk Sirup Glukosa dengan Membran Ultrafiltrasi. . 39
C. Analisa Keputusan ... 50
D. Analisa Finansial... 51
BAB I PENDAHULUAN
A. Latar Belakang
Sirup glukosa adalah produk pengolahan pati, dapat dihasilkan dengan hidrolisa pati dengan enzim, asam atau gabungan antara enzim dan asam (Tjokrodikoesoemo,1986). Sirup glukosa banyak digunakan pada industri permen, biskuit, es krim dan industri farmasi (Mulcom, 1998). Diindonesia produk sirup glukosa mempunyai pasaran yang terbatas dan harga yang lebih tinggi dibanding sukrosa (Epriliati,2002).
Tahapan pembuatan sirup glukosa dengan cara hidrolisis menggunakan enzim yang terdiri dari gelatinisasi, likuifikasi, sakarifikasi, purifikasi, dan evaporasi. Tingkat mutu sirup glukosa yang dihasilkan ditentukan oleh warna sirup, kadar air, dan tingkat konversi pati menjadi komponen-komponen glukosa, maltosa dan dekstrin yang dihitung sebagai nilai ekuivalen dekstrosa (DE).
Hasil penelitian Jariah (2002) menunjukan bahwa perlakuan terbaik diperoleh konsentrasi pati garut (30%) waktu sakarifikasi 18 jam (sirup maltosa). Pada tahap pemurniannya dilakukan dengan penambahan karbon aktif kemudian disaring menggunakan penyaringan vakum selanjutnya dimasukkan pada kolom penukar ion baik penukar anion maupun kation. Pemurnian dengan metode ini membutuhkan waktu yang cukup lama dan biaya yang cukup mahal, sehingga perlu dilakukan alternatif lain untuk pemurnian sirup glukosa yaitu dengan membran ultrafiltrasi.
Hasil penelitian hibah Jariyah (2011), diperoleh konsentrasi 30 % dengan pH sakarifasi 6, konsentrasi glukoamilase 0,075 dengan waktu sakarifasi 24 jam. Hasil penelitian ini belum dilakukan tahap pemurnian. Pada penelitian ini akan dilanjutkan tahap pemurnian dengan membran ultrafiltrasi. Menurut Vivien (2010), pemurnian sirup glukosa dengan menggunakan membran ultrafiltrasi diperoleh perlakuan terbaik pada tekanan 1,02 bar dalam waktu 180 menit.
dalam proses pemurnian nira tebu sendiri sangatlah besar. Semakin tinggi tekanan operasi menyebabkan banyak TSS yang terdorong keluar dari membran, sebaliknya semakin rendah tekanan maka TSS yang ikut keluar aliran permeat cukup sedikit. Begitu pula peranan waktu operasi semakin lama waktu operasi maka kandungan TSS dalam permeat akan semakin sedikit sehingga kondisi optimum yang dicapai adalah pada tekanan operasi 0,37 bar dan waktu operasi 180 menit.
Penelitian ini akan melihat alternatif proses pemurnian dari sirup glukosa dengan cara penyaringan menggunakan membran ultrafiltrasi. Keuntungan dari pemurnian ini adalah proses dapat berlangsung dalam kondisi ruang atau tidak menggunakan pemanasan. Dengan demikian, diharapkan dapat meminimalkan masalah kualitas sirup glukosa. Penelitian ini secara khusus melihat tingkat kemurnian yang diperoleh dari berbagai perlakuan variabel yaitu tekanan dan waktu operasi.
B. Tujuan Penelitian
1. Untuk mengetahui pengaruh tekanan dan waktu operasi pemurnian dengan membran ultrafiltrasi terhadap kualitas sirup glukosa.
2. Untuk memperoleh kemurnian sirup glukosa tertinggi dengan peubah tekanan membran ultrafiltrasi dan waktu operasi
C. Manfaat Penelitian
1. Menambah pemanfaatan lain dari pati garut dan meningkatkan nilai ekonomisnya.
BAB II
TINJAUAN PUSTAKA
A. Tinjauan Umum Tanaman Garut
Tanaman garut (Maranta arudinaceae L.) kadang ditulis West arrowroot untuk membedakan dengan tanaman lain misal Quessland arrowroot (ganyong) dan Brazillian arrowroot (singkong). Tanaman garut berasal dari Amerika Tropis dan sekarang telah tersebar ke negara-negar tropis seperti Brazil, India, Ceylon, Indonesia dan Filipina ( Lingga, Sarwono, dan Rahardi, 1992).
Di indonesia tanaman garut telah dikenal luas diseluruh wilayah Nusantara, nama tanaman garut berbeda-beda tergantung daerahnya, diantaranya ban-ban (Batak karo), sakundawa (Nias), sagu (Palembang), sagu arut (Minangkabau), larut, patat, jelarut, garut, irut, angkrik, dan rarut (Jawa) (Sofwani,2000).
Tanaman garut termasuk famili Marantaceae bentuk tanaman garut seperti rumput-rumputan yang selalu bercabang dua dengan tinggi 60 sampai 180 cm. Daunnya memiliki bentuk meruncing pada bagian ujung, berbatang lunak, dan bunganya berwarna putih (Anonium, 2001). Ciptadi dan Nasution (1981), melaporkan bahwa di Brazil terdapat dua jenis tanaman garut yaitu jenis Creolo dan jenis Banana. Perbedaan kedua jenis tersebut terletak pada kedua bentuk akar, untuk Creolo bentuk akarnya kecil, tebal, dan menembus jauh ke dalam tanah, sedangkan jenis Banana berakar pendek, tumbuh bergerembol, dan tidak beserat (umbi yang teletak pada permukaan tanah mengandung serat yang rendah). Hasil rimpang varietas Banana lebih tinggi, sehingga lebih cocok ditanam dalam pola perkebunan besar (Villamanjor and Jukema,1996).
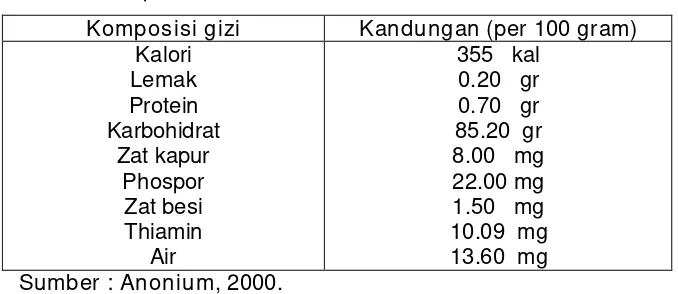
Tabel 1. Komposisi Pati Garut
Komposisi gizi Kandungan (per 100 gram) Kalori
Lemak Protein Karbohidrat
Zat kapur Phospor
Zat besi Thiamin
Air
355 kal 0.20 gr 0.70 gr 85.20 gr 8.00 mg 22.00 mg 1.50 mg 10.09 mg 13.60 mg Sumber : Anonium, 2000.
Wishteler, Bemiller and Paschall (1984), menambahkan bahwa hasil utama garut adalah umbi yang mengandung pati sekitar 19%. Kegunaan garut adalah untuk diambil patinya yang berwarna putih, kegunaan umbi garut dalam kehidupan sehari-hari cukup banya, contohnya untuk bahan makanan (Lingga dkk.1992). Umbi garut yang masih ada dan segar biasanya dapat digunakan untuk makanan kecil dengan cara merebus, mengukus atau membakarnya lebih dulu. Oleh sebab itu umbi yang sudah tua (umur 12 bulan) umumnya diambil patinya atau untuk membuat tepung garut, sedangkan umur tanam 6-7 bulan banyak dimanfaatkan menjadi keripik garut (Anonium,2001).
B. Pati Garut
Pati atau amilum adalah karbohidrat kompleks yang tidak larut dalam air, berwujud bubuk putih, tawar dan tidak berbau. Pati merupakan bahan utama yang dihasilkan oleh tumbuhan untuk menyimpan kelebihan glukosa (sebagai produk fotosintesis) dalam jangka panjang. Sumber pati utama di Indonesia adalah beras disamping itu dijumpai bberapa sumber pati lainnya yaitu jagung, kentang, tapioka, sagu, garut, dan lain-lain (Antarlina, 1997).
Pati garut merupakan salah satu bentuk karbohidrat alami yang
paling murni dan memiliki kekentalan yang tinggi. Kekentalan ini dapat
dipengaruhi oleh
keasamanair yang digunakan dalam proses
pengolahan. Lebih lanjut dikatakan bahwa pati garut memiliki sifat-sifat
sebagai berikut :
1. Mudah larut dan mudah dicerna
(Antarlina, 1997).
Pati yang berasal dari varietas Banana memiliki lebih banyak
butiran berukuran besar dari pada varietas pada varietas Creolo, suhu
awal gelatinisasi 70
oC, untuk keperluan komersial harus memenuhi
syarat kadar air tidak boleh lebih
dari18%, pH 4.5-7, kandungan abu
dan serat rendah (Anonium,2001).
Ditinjau dari rumus kimianya pati merupakan polimer
anhidromonosakarida dengan rumus umum (C
6H
12O
6)n. Pati
mengandung dua komponen utama yaitu amilosa dan amilopektin.
Amilosa umumnya dikatakan sebagai linear dari pati, meskipun
sebenarnya jika dihidrolisis dengan α-amilase pada beberapa jenis pati
tidak diperoleh hasil hidrolisis yang sempurna . α-amilase
menghidrolisis amilosa menjadi unit-unit residu glukosa dengan
memutuskan ikatan α-(1,4) (Banks,1973 dalam Muchtadi,1988).
Kadang-kadang pada amilosa juga terdapat percabangan
molekul tetapi
jumlahnyasangat terbatas, percabangan akan timbul
setelah kurang lebih 500 unit glukosa membentuk rantai lurus.
Amilopektin merupakan fraksi kedua dari pati yang memiliki ikatan
percabangan ά-(1,6)-D-glukosa. Titik percabangan ini terdiri dari
beratus-ratus cabang dan berat molekulnya diperkirakan sekitar 1 juta.
Amilopektin juga dapat membentuk kompleks dengan iodin, walaupun
tidak sereaktif amilosa (Bennion,1980 ; Murwani,1989).
Perbandingan amilosa dan amilopektin pada pati yang
berbeda-beda untuk setiap jenis dan jaringan tanaman sumber pati, tetapi
perbandingan tersebut tetap untuk masing-masing jenis pati yaitu
berkisar pada 15-30% amilosa dan 70-80% amilopektin (Stephan,
Gambar 1. Unit Glukosa dalam Amilopektin (Stephan, 1995)
Gambar 2. Unit Glukosa dalam Amilosa (Stephan, 1995) C. Enzim
Enzim adalah sebuah protein yang mempunyai fungsi khusus. Enzim berperan untuk mengkatalisis proses kimia (biokimia) dalam makhluk hidup atau dalam sistem biologi. Tanpa adanya enzim biasanya reaksi kimia akan berlangsung sangat lambat, bahkan mungkin tidak dapat terjadi. Enzim juga dapat didefinisikan sebagai fermen yang bentuknya tidak teratur, yang dapat bekerja tanpa adanya mikroba dan dapat bekerja diluar mikroba. Definisi ini timbul setelah berbagai teori yang lain yang lebih tua diajukan, diperdebatkan, serta dibandingkan. Bila ragi dan khamir ditambahkan ke dalam larutan glukosa atau gula anggur, ternyata gula diubah menjadi alkohol dan karbondioksida (Winarno, 1995).
Kerja enzim sangat khusus dan spesifik. Artinya, satu enzim hanya menjalankan satu fungsi saja. Kondisi yang mempengaruhi aktifitas enzim
O H
O H
H OH
H OH H CH2O
H
O O
H
O H
H OH
H OH H CH2O
H
O H
O H
H OH
H OH H CH2O
H
O H
O H
H OH
H OH H CH2O
H
OH
n
O H
H OH H C O H
O H
H OH
H OH H CH2OH
O
O H
H OH
H OH H CH2OH
H OH
O H
O H
H OH
H OH H O C
H H
H
HO O
H O H
H OH
H OH H CH2OH
O
O H
H OH
H OH H O C
H H
H HO
diantaranya konsentrasi enzim, konsentrasi substrat, pH, dan suhu (judoamidjojo, 1992).
Pada umumnya terdapat hubungan optimum antara konsentrasi enzim dan substrat bagi aktifitas maksimum. Penyimpanan dari keadaan optimum mengakibatkan berkurangnya aktifitas enzim dengan nyata keragaman pH yang ekstrim bahkan dapat merusak enzim, seperti halnya juga suhu yang tinggi, pendidihan, selama beberapa menit akan mendenaturasikan (menghancurkan) enzim, sedangkan suhu yang sangat rendah dapat menghentikan aktifitas enzim tetapi tidak menghancurkannya (Pelczar,1986).
1. Enzim ά-amilase
Enzim α-Amilase murni dapat diperoleh dari malt (barley), ludah manusia, pankreas, dan isolasi Aspergillus oryzae dan Baccilus subtilis (pada suhu 70°C-90°C dan pH 6) (Winarno, 1995). Enzim α-Amilase (α-4-glukan-4-glukanohidrolase) adalah endoenzim yang kerjanya memutus ikatan α-1,4 secara acak di bagian dalam molekul baik pada amilosa maupun pada amilopektin. Karena pengaruh aktivitasnya, pati terputus-putus menjadi dekstrin dengan rantai sepanjang 6-10 unit glukosa (Tjokroadiekoesoemo,1986).
Enzim ά-amilase mempunyai berat molekul (B.M) sekitar
50.000 dan mengandung ion Ca
2+sebanyak 1 gram ion tiap
molekul. Ion Ca
2+berperan sebagai
penstabil
, ά-amilase
mengandung gugus aktif karboksil dan imidazol (Tarto et al.1997)
Menurut Reed (1975), enzim ini termasuk dalam kelompok
endoamilase karena enzim ini mampu menghidrolisis ikatan ά-1.4
glikosidik dari bagian dalam secara acak baik pada amilasa maupun
amilopektin. Endo-amilase ini dapat dibagi
menjadidua bagian yaitu
thermostabil (tahan panas) dan thermolabil (tidak tahan panas).
Yang tergolong thermostabil antara lain: B.licheniformis amilase dan
B.amyloliquefaciens amilase, sedangkan yang termasuk thermolabil
ádalah Fungal
ά-amilase (A.oryzae) (Belits and Grosh,1987 ; Birch
B.licheniformis dan Bacilus subtilis lebih banyak digunakan dalam
proses hidrolisis (likuifikasi) secara komersial karena tahan terhadap
pemanasan hingá suhu 90
oC – 110
oC, sedangkan endoamilase
yang berasal dari fungi (thermolabil) banyak digunakan untuk proses
sakarifikasi (Schrickx,1995;Gomes,Richard,and Ledward,1998).
Cara kerja
α-amilase pada molekul amilopktin akan
menghasilkan glukosa, maltosa dan berbagai jenis α-limit dekstrin.
Jenis α-limit dekstrin yaitu oligosakarida yang terdiri dari 4 atau lebih
residu glukosa yang semuanya menagnadung ikatan α-1,6. Aktivitas
α-amilase ditentuan dengan mengukur hasil degradasi pati,
biasanya diukur dari penurunan kadar pati yang larut atau dari kadar
amilosa bereaksi dengan iodium akan berwarna merah batu. Selain
itu keaktifan α-amilase dapat dinyatakan denga pengukuran
viskositas dan jumlah pereduksi yang terbentuk. Hidrolisis amilosa
akan lebih cepat dari pada hidrolisis rantai yang bercabang seperti
amilopektin atau glikogen. Laju hidrolisis akan meningkat bila tingkat
polimerisasi menurun, dan laju hidrolisis akan lebih cepat pada
rantai lurus (Winarno, 1995).
Menurut Forgati (1983) enzim ά-amilase pada umumnya
stabil pada kisaran pH 5.5–8.0. Aktivitas optimalnya secara normal
terjadi pada pH 4.8 – 6.5 (Menzi.et.al.1957 yang dikutip oleh
Forgaty,1983). Enzim ά-amilase yang berasal dari bakteri dapat
digunakan untuk mengkatalisasi proses hidrólisis pati pada suhu
yang tinggi, enzim tersebut lebih stabil dengan adanya ion Ca
2+.
Sifat tersebut Sangat berguna pada proses liquifikasi yang
mempunyai suhu gelatinisasi yang tinggi (Berghmans, 1981).
Enzim
ά-amilase akan lebih stabil dengan adanya ion Ca
2+yang berfungsi sebagai kofaktor. Dimana kalsium ini tidak berperan
langsung dalam pembentukan komplek enzim-substrat, tetapi
menjaga molekul enzim pada konfirmasi yang optimum untuk
kalsium yang cukup agar enzim mempunyai aktivitas yang penuh
(Whitaker, 1972). Mekanisme reaksi gugus fungsional karboksil dari
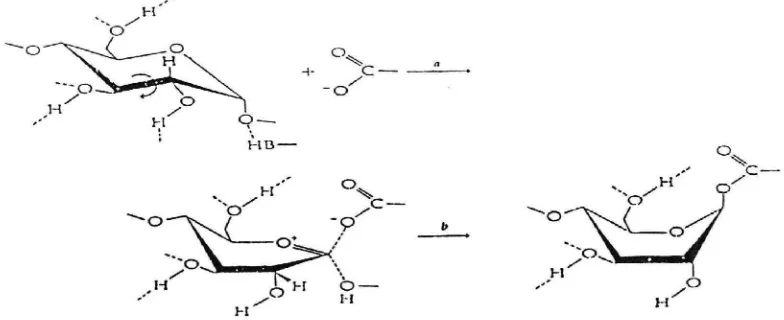
enzim ά-amilase pada pati dapat digambarkan sebagai berikut:
Gambar 3. Mekanisme reaksi gugus fungsional karboksil dari enzim ά-amilase pada pati (Metzler,1977 dalam Kamrudin,2000).
2. Enzim Glukoamilase
Enzim glukoamilase (α-(1,4)-glukan-glukonohidrolase) atau
amiloglukooksidase (AMG) merupakan jenis ekso-enzim yang akan menghidrolisis oligosakarida pada ikatan α-(1,4), α-(1,6), atau α-(1,3) atau disebut juga bersifat ekso-amilase karena dapat memutus rantai pati menjadi molekul-molekul glukosa pada bagian non reduksi dari molekul tersebut. Enzim ini memutuskan rantai molekul maltosa menjadi molekul-molekul glukosa bebas (Fennema, 1996).
Enzim glukoamilase adalah suatu eksoenzim yang menghasilkan β-D-glukosa dari rantai terminal non pereduksi pada amilosa, amilopektin dan glikogen dengan menghidrolisis ikatan ά-1,4-glikosidik secara berurutan (Prescot dan Dunn, 1982 ; Forgaty, 1983). Menurut Pazur et al., (1962), glukoamilase dengan kemurnian yang sangat tinggi menunjukan aktivitas yang nyata pada rantai yang relatif panjang, serta menghidrolisis ikatan ά- (1,6) dan ά-(1.3), meskipun lebih lambat dibanding hidrólisis.
pereduksi polimer pati. Sumber enzim AMG yang berasal dari mikroba diperoleh dari Aspergillus niger, Rhizopus delemar, Cephalosporium carticolalindau, Aspergillus oryzae, Aspergillus awamori, Lipomyces
kononenkoae, Mucor rouxianus, penecillium oxalicum, dan Aspergillus saitoi (Forgaty, 1983).
Tabel 2. Perbandingan enzim komersil dan enzim non komersil
Kondisi Enzim komersil
(SORINI CORPORATION)
Enzim non komersil (Judoamidjojo,1992) Liquifikasi
1. suhu 2. dosis 3. waktu 4. pH Sakarifikasi 1. suhu 2. dosis 3. waktu 4. pH
Liquozyme supra 105 -110 0
C 200 ml/ton 60 – 180 menit
5.1-5.6 Optimax 4060 UHP
60 0 C 0.36 – 0.72 lt/ton
48 jam 4.0-4.2
ά-amilase 90 – 1050
C -120 menit
4.8 – 6.5 Glukoamilae
60 0 C 1.5 lt/ton 40-100 jam
4.5 5.0
D. Aktifitas Enzim
Enzim merupakan molekul protein tak hidup yang dihasilkan oleh setiap sel hidup. Enzim bekerja sebagai biokatalisator dengan efisiensi dan
selektifitas tinggi. Enzim tidak mengubah konstanta keseimbangan reaksi kimia. Kecepatan reaksi enzim dipengaruhi oleh suhu 30ºC, pelarut dan
faktor-faktor lingkungan lainya (Suhartno,1989).
Aktifitas enzim dinyatakan dalam satuan enzim. Menurut komisi enzim
internasional, unit enzim (1) adalah jumlah enzim yang melakukan katalis, sehingga terjadi perubahan 1 µ mol substrat menjadi produk per menit pada kondisi standar. Kondisi standar adalah dimana enzim bekerja secara optimal
yaitu meliputi suhu, pH, konsentarsi substrat, kondisi kofaktor dan koenzim
(Chapin and Bucke,1990).
Suatu enzim dinyatakan pula sebagai katalisator dalam sistem SI
(Standart Internasional) yaitu mol substrat yang dipakai atau produksi yang tebentuk perdetik (Price and Stevens,1989). Katalisator (symbol kat) merupakan aktivitas katalik. Satuan ini diperoleh dari unit SI (Standart
katalis lainnya. (anonymous,2006).Unit SI katal = 1 mol.S−1 pada akhirnya diganti sistem unit IUB ” unit (enzim)”= 1 ά mol.min−1
∞ 16.67 nkat
(Dybkaer.2001).
E. Hidrolisis
Hidrolisis adalah reaksi kimia yang memecah molekul air (H2O)
menjadi kation hidrogen (H+) melalui suatu proses kimia. Proses ini biasanya digunakan untuk memecah polimer tertentu, terutama yang dibuat melalui polimerisasi tumbuh bertahap (step-growth polimerization) (Anonim, 2003).
Menurut Winarno (1982), hidrolisis adalah proses pemecahan suatu substrat menjadi senyawa-senyawa yang lebih sederhana dengan pertolongan air.
Istilah hidrolisis dapat digunakan untuk mendefinisikan penguraian
senyawa kimia yang disebabkan oleh reaksi dengan adanya air, biasanya dengan pembentukan senyawa-senyawa baru oleh penambahan atom dari air ke satu bagian dari senyawa yang terurai oleh penambahan atom yang
lain pada molekul air bagian lain .
Hidrolisis digunakan pada reaksi antara dua zat organik dan
anorganik dimana terjadi penguraian ganda karena pengaruh air dengan senyawa lain, dimana hidrogen mengurai ke salah satu komponen yang
disebut gugus hidroksil.
Lima tipe reaksi hidrolisis, yaitu:
1. Hidrolisis murni dimana hanya menggunakan air
2. Hidrolisis dengan menggunakan asam, baik encer maupun pekat 3. Hidrolisis dengan menggunakan basa, baik encer maupun pekat
4. Alkali fusion dengan sedikit atau tanpa air pada temperatur tinggi 5. Hidrolisis dengan menggunakan enzim.
(Hawley,1994).
Reaksi hidrolisis berjalan sangat lambat, sehingga diperlukan bantuan
katalis untuk memperbesar keaktifan air. Hidrolisis pati dapat dilakukan dengan cara hidrolisis dengan katalis asam, kombinasi asam dengan enzim,
serta kombinasi enzim dengan enzim (Judoamidjojo, 1992).
Proses hidrolisis pati yaitu pengubahan molekul pati menjadi
reaksi tertentu. Pemotongan rantai pati oleh enzim. Hasil pemotongan oleh asam adalah campuran dekstrin, maltosa, dan glukosa, sementara enzim
bekerja secara spesifik sehingga hasil hidrolisis dapat dikendalikan (Trifosa,2007). Hidrolisis pati menggunakan kombinasi enzim dengan enzim menghasilkan sirup dengan nilai ekivalen dekstrosa (DE) sangat tinggi yaitu
lebih dari 95%. Disamping itu, penggunaan katalis enzim dapat mencegah adanya reaksi samping karena sifat katalis enzim sangat spesifik, sehingga
dapat mempertahankan rasa, aroma, bahan dasar jika dibandingkan dengan katalis asam, ataupun kombinasi asam dengan enzim yang hanya
menghasilkan DE 30-35 disamping itu pula diperlukan peralatan yang tahan korosi, juga terjadi rekombinasi produk degadrasi yang dapat mempengaruhi
warna, rasa, bahkan menimbulkan masalah teknis (Muljono, 1992).
F. Hidrolisis Pati Secara Enzimatis
Hidrolisis pati secara enzimatis melibatkan dua proses likufikasi
dan sakarifikasi (Timotius dan Mirna, 1998). Likufikasi merupakan
proses pencairan gel pati dengan menggunakan enzim ά-amilase yang
menghidrolisis pati menjadi molekul-molekul yang lebih kecil dari
oligosakarida atau dekstrin. Dalam proses tersebut granula pati yang
semula tidak larut dipanaskan sampai mengembang dan rusak,
sehingga dapat tersebar dalam larutan. Beberapa faktor yang
mempengaruhi
proses
likufikasi
yaitu:
konsentrasi
substrat,
penggunaan enzim yang stabil pada suhu yang tinggi, pengaturan
suhu, pengaturan pH, serta pemanasan secara tepat dan kontinyu
(Arasatman.1994).
Proses
hidrolisispati secara enzimatis dapat terjadi sebagai
berikut: sebelum substrat dihidrolisis dengan enzim maka pati harus
digelatinisasi terlebih dahulu agar lebih rentan terhadap serangan
enzim (Muchtadi.1992). Proses gelatinisasi ini terjadi karena butir-butir
pati menyerap air dalam jumlah cukup banyak hingga membengkak
luar biasa yang mengakibatkan viskositas larutan meningkat.
yang tadinya berada diluar granula pati dan bebas bergerak sebelum
suspensi dipanaskan, kini berada dalam butir-butir pati dan tidak dapat
bergerak bebas lagi. Pecahnya partekel-pertikel pati membengkak
pada saat suhu gelatinisasi tercapai mengakibatkan larutan menjadi
encer sehingga pengadukan pada proses likufikasi dapat dipenuhi
dengan
menggunakan
inkubator
dan
pengaduk
magneti
(Winarno,1993 ; Achdiyan et al., 1999).Gelatinisasi pati dipengaruhi
oleh beberapa faktor yaitu: jenis dan konsentrasi pati, suhu, waktu dan
pH. Jenis pati yang berbeda menghendaki kondisi gelatinisasi yang
berbeda pula. Makin tinggi konsentrasi pati suhu gelatinisasi makin
lambat tercapai dan gel yang terbentuk semakin kurang kental.
Pembentukan gel yang optimal terjadi pada pH 4-7. Apabila pH
terlalu tinggi pembentukan gel cepat. Pemanasan diteruskan maka
viskositasnya turun kembali (Lii et al.,
1995).
Gelatinisasi ini merupakan salah satu fakor yang harus
diperhatikan dalam proses likufikasi, dimana pelarutan pati harus
sempurna. Bila larutan pati terlalu pekat maka akan sulit tersuspensi
dengan baik sehingga selama proses gelatinisasi terjadi
pengendapanpartikel-partikel pati. Oleh karena itu proses gelatinisasi ini dapat
dilakukan dengan membuat bubur pati dengan konsentrasi antara 25
sampai 40% padatan kering (Godfrey and West, 1996).
Norman et al., (2001), menambahkan bahwa likuifikasi
merupakan kombinasi dari dua proses, pertama yaitu hidrasi /
gelatinisasi dari polimer pati, untuk mempermudah
seranganhidrolitik
yang kedua yaitu: dekstrinisasi sehingga dapat mencegah terjadinya
retrogradasi untuk tahap selanjutnya. Pada tahap likuifikasi ini terjadi
proses pemecahan pati menjadi dekstrin oleh enzim ά-amilase, yang
berfungsi memecah ikatan ά-1,4 glikosidik secara cepat adan acak
pada bagian dalam amilosa dan amilopektin. Terbentuknya dekstrin ini
ditunjukan dengan timbulnya warna coklat saat diuji dengan larutan
Sebelum proses gelatinisasi terlebih dahulu ditambahkan pula
enzim ά-amilase dan kofaktor ion Ca , kemudian dilakukan proses
likufikasi dengan nilai DE berkisar antara
12-15%. Dekstrosa ekuivalen
(DE) merupakan parameter kemurnian sirup glukosa atau maltosa,
yang didefenisikan sebagai presentase perbandingan antar gula
reduksi dengan kadar bahan kering sirup glukosa/ maltosa. Bila nilai
DE = 100%, maka dapat diartikan bahwa seluruh bahan kering pada
sirup merupakan gula reduksi. (McPherson and Seib, 1997 ; Harsini
dkk. 1998).
Sakarifikasi merupakan tahap hidrolis lanjutan dari tahap
likuifikasi, pada proses sakarifikasi ini dekstrin dipecah lagi secara
enzimatik dengan pengaturan berbagai pH (
Mangunwidjajadan Suryani,
1994), dimana larutan suspensi didinginkan sampai suhu kurang lebih
60ºC, dan pH diatur 4,0 – 6,0, hidrolis dilanjutkan dengan
menggunakan katalisator enzim Clarase L yang diisolasi dari sejenis
fungi (Aspergillus oryzae) dan dilakukan sakarifikasi selama 18 jam,
maka akan diperoleh sejenis sirup yang lebih kaya akan maltosa dari
pada sakarida-sakarida lainnya, sirup semacam ini dinamakan sirup
maltosa yang dapat digunakan untuk bahan baku produk lain
(Schwimmer, 1981). Untuk menentukan nilai %DE pada tahap ini ºbrix
yang diperoleh dikonversikan pada tabel hidrolisist maltosa sehingga
didapat nilai % DS (dry solid).
Adapun secara
ringkashidrolis pati dapat digambarkan sebagai
berikut : (Muchtadi, 1992) .
Gambar 3. Hidrolisis pati dengan enzim yang berbeda +
2
Pati α-amilase Dekstrin + maltosa + maltoterosa + glukosa
Pati β-amilase Dekstrin + maltosa + maltotriosa + glukosa
Beberapa keuntungan hidropolis pati secara enzimatis antara
lain lebih spesifik, hasilnya dapat didistribusikan menjadi produk lain,
kondisi hidrolisisnya sangat lembut selain itu produk sampingnya lebih
sedikit, tahap pemurnian (menghilangkan abu) dan pembentukan
warna dapat ditekan seminim mungkin (Sardjoko, 1991).
G. Faktor-faktor yang Mempengaruhi Hidrolisis
1. Pengaruh Suhu
Pada umumnya semakin suhu tinggi, semakin naik laju reaksi kimia, baik yang tidak katalis maupun yang dikatalisis dengan enzim.
Pengaruh suhu terhadap enzim ternyata agak kompleks, misalnya suhu yang terlalu tinggi dapat mempercepat pemecahan atau perusakan enzim, sebaliknya menurut Muchtadi (1992), suhu liquifikasi yang tinggi,
akan mengakibatkan terjadinya kerusakan enzim, tetapi apabila terlalu
rendah akan mengakibatkan gelatinisasi tidak sempurna.
Perbedaan sumber atau asal enzim menyebabkan perbedaan
daya tahan panas. Enzim ά-amilase yang dihasilkan oleh bakteri lebih tahan panas daripada enzim a-amilase yang berasal dari kapang (Winarno,1986). Contohnya enzim ά-amilase yang diisolasi dari Bacillus subtilis amat stabil pada suhu tinggi (Tjokroadikoemo,1986).
2. Pengaruh pH
Menurut Girinda (1988), pH sangat berpengaruh terhadap aktivitas
enzim, karena sifat ionik gugus karboksil dan asam amino mudah dipengaruhi pH. Hal ini menyebabkan konformasi enzim dan fungsi katalitik enzim berubah, sehingga enzim bisa terdenaturasi dan
kehilangan aktivitasnya. Aktivitas enzim tertinggi yang dapat dicapai
umumnya disebut pH optimum. Menurut Muchtadi (1992), enzim
3. Konsentrasi Larutan Pati
Menurut Tjokroadikoesoemo (1986), konsentrasi pati yang telah mengalami hidrolisis pendahuluan dengan enzim ά-amilase yang
optimum adalah sekitar 30-35 % berat bahan kering. Pada tahap awal pelarutan pati harus sempurna, karena pada tahap ini penyebaran granula pati kedalam larutan yang diikuti dengan hidrolisis sebagian oleh
ά-amilse yang tahan panas. Dalam proses tersebut, granula pati yang semula tidak larut dipanaskan sampai mengembang dan rusak sehingga
dapat tersebar kedalam larutan (Muchtadi.1992).
4. Pencampuran
Karena pati kurang larut dalam air, maka diperlukan pengadukan
untuk menyempurnakan campuran. Semakin tinggi kecepatan
pengadukan maka semakin sempurna larutan tersebut sehingga akan
mempercepat reaksi, karena pengadukan mempertinggi jumlah tumbukan antara molekul-molekul pati dan air (Hawley, 1994).
5. Waktu Reaksi ( Lama Hidrolisis )
Lama hidrolisis adalah waktu reaksi yang dibutuhakn oleh suatu
enzim untuk merombak bahan menjadi lebih sederhana. Lama hidrolisis dipengaruhi oleh konsentrasi substrat, enzim yang digunakan dan juga
suhu hidrolisis. Waktu yang diperlukan sekitar 48-96 jam. Konsentarsi pati yang telah mengalami hidrolisis pendahuluan dengan enzim α-amilase yang optimum adalah sekitar 30 – 35 % berat bahan kering (Tjokroadikoesoemo, 1986).
6. Konsentrasi Enzim
Penambahan konsentrasi enzim akan meningkatkan kecepatan reaksi bila substrat tersedia secara berlebih. Kecepatan reaksi dalam
reaksi enzim sebanding dengan konsentrasi enzim, semakin tinggi konsentrasi enzim maka kecepatan reaksi akan semakin tinggi, sehingga padabatas konsentrasi tertentu dimana hasil hidrolisis akan konstan
dengan tinggi konsentrasi enzim yang disebabka penambahan enzim sudah efektif (Martin, 1983). Menurut (Fitroyah, 2007) semakin banyak
jumlah enzim yang di tambahkan pada pati akan mempercepat reaksi hidrolisis.
7. Likuifikasi
Likuifikasi adalah proses pencairan gel pati dengan menggunakan enzim α-amilase. Tahap ini dilakukan sampai mencapai DE sebesar 10 – 20%, atau sampai cairan berwarna coklat kemerahan bila direaksikan dengan larutan iodium. Tujuan proses ini adalah untuk melarutkan pati secara sempurna, mencegah isomerisasi gugus pereduksi dari glukosa dan mempermudah kerja enzim α-amilase untuk menghidrolisis pati (Judoamidjojo, 1992). Enzim ά-amilase adalah endo-enzim yang bekerjanya memutus α-1.4 secara acak dibagian dalam molekul baik pada amilosa maupun amilopektin. Karena pengaruh aktivitasnya, pati terputus-putus menjadi dekstrin dengan rantai sepanjang 6-10 unit glukosa. Jika waktu reaksi diperpanjang, dekstrin tersebut dipotong-potong lagi menjadi campuran antara glukosa,maltosa, maltotriosa, dan ikatan lain yang lebih panjang (Tjokroadiekoesoemo,1986).
pH diatur 5,8 – 6,2, kemudian ditambah dengan kofaktor enzim yaitu CaCl2 (Jariyah, 2002). Fungsi CaCl2 selain sebagai kofaktor juga
sebagai penyedia kalsium guna menjaga aktivitas dan stabilitas enzim, suhu liquifikasi berkisar 95 - 105ºC selama 90 menit (Judoamidjojo,
1992).
H. Sakarifikasi
Pada proses ini, dekstrin sebagai hasil tahap likuifikasi dihidrolisis lebih lanjut menjadi glukosa dengan menggunakan, umumnya digunakan
enzim glukoamilase. Sebelum sakarifikasi dimulai, larutan dekstrin yang dihasilkan pada proses likuifikasi didinginkan sampai 60oC, dan juga
dilakukan pengaturan pH dari 6,0 menjadi 4,5 dengan penambahan HCL 3%. Penambahan enzim glukoamilase (AMG) adalah sebanyak 1,5 liter/ton pati
kering. Selanjutnya dibiarkan pada suhu 60 oC selama 40 – 100 jam, tergantung dari dosis enzim yang diberikan. Sirup glukosa yang dihasilkan dari tahap ini lalu diadakan penyaringan untuk menyisihkan partikel-partikel
kasar , serat, lemak dan protein yang menggumpal selama proses. Dilakukan inaktifasi enzim dengan pemanasan pada suhu 80oC selama 15 menit
(Judoamidjojo, 1992).
Menurut Pazur et al., (1962), glukoamilase dengan kemurnian yang sangat tinggi menunjukan aktivitas yang nyata pada rantai yang relatif panjang, serta menghidrolisis ikatan ά- (1,6) dan ά-(1.3), meskipun lebih
lambat dibanding hidrolisis pada ikatan ά-(1.4). Oleh karena itu, enzim tersebut mampu mengkonversi seluruh pati menjadi glukosa.
I. Sirup Glukosa
Glukosa merupakan monosakarida yang ada di alam sebagai produk fotosintesis. Dalam bentuk bebas, glukosa terdapat didalam buah-buahan, sayur-sayuran, madu, darah dan cairan tubuh. Selain itu glukosa juga dapat
dihasilkan melalui hidrolisis polisakarida atau disakarida baik dengan asam, enzim atau gabungan keduannya.
Sirup glukosa adalah sejenis larutan kental yang dihasilkan melalui hidrolisis pati memakai katalisator enzim, asam atau gabungan antara enzim
berfungsi untuk mencegah terbentuknya kristal sukrosa. Ada beberapa macam proses pembuatan sirup glukosa salah satunya dengan hidrolisis
secara enzimatis. Hidrolisis secara enzimatis lebih efektif karena kerja enzim sangat spesifik (Tjokroadikoesoemo, 1986).
Keuntungan dengan menggunakan enzim antara lain hasilnya (kadar glukosa) lebih tinggi (mencapai 73,18%), praktis dan lebih murni (Rusdiansyah, 2001).
Sirup glukosa yang dibuat dengan hidrolisis enzimatis meliputi proses likuifikasi, sakarifikasi, penjernihan dan penetralan, kemudian diakhiri dengan
evaporasi. Beberapa hal yang perlu diperhatikan dalam proses liquifikasi adalah konsentrasi substrat, penggunaan enzim yang labil pada suhu tinggi,
pengaturan suhu dan lamanya, serta penggunaan pH disesuaikan berdasarkan enzim yang digunakan. Suhu liquifikasi yang terlampau tinggi,
akan mengakibatkan terjadinya kerusakan enzim tetapi apabila terlalu rendah akan mengakibatkan gelatinisasi tidak sempurna (Norman,1981 dan
Muchtadi,1992). Fungsi Ca selain sebagai kofaktor juga sebagai
penyedia kalsium guna menjaga aktivitas dan stabilitas enzim, suhu liquifikasi
berkisar 95-1050
C selama 90 menit (Judomidjojo,1992).
Sifat fisik dan kimia produk hidrolisis yang ditentukan berdasarkan
kelarutan, kemanisan, berat molekul dan sifat-sifat dalam fermetasi (Tjokroadikoesoemo,1986). Jika glukosa dibandingkan dengan sukrosa,
maka pada suhu 60°C kedua senyawa ini memiliki kelarutan yang sama, namun pada suhu diatas 60°C, glukosa akan lebih mudah larut. Dibawah
suhu tersebut glukosa akan stabil dalam bentuk monohidratnya, sedangkan diatas suhu tersebut, lebih stabil pada bentuk anhidridanya. Kelarutan hidrolisis yang rendah tersebut berarti bahwa hidrolisist-hidrolisist pati dengan
kandungan bahan kering yang umum diperdagangkanyaitu sekitar 76-82%
berat kering, harus disimpan pada suhu agak tinggi agar glukosa yang dikandungnya tidak epat mengkristal. Sedangkan kemanisa relatif terhadap
sukrosa dari berbagai kualitas sirup glukosa menigkat sehubungan dengan meningkatnya konsentras larutan. Karena pengaruh sinergisme itulah sirup glukosa akan terasa jauh lebih manis dari pada kemanisan komponen
Selain sifat diatas, glukosa dapat difermentasi dengan mudah memakai ragi yang umum digunakan. Sirup glukosa biasanya digunakan dalam industri
makanan dan minuman, terutama dalam industri permen, selai, dan buah kaleng. Penggunaannya tergantung pada kadar glukosa dan kemurnian
sirupnya (Tjokroadikoesoemo,1986).
Tingkat hidrolisis asam pada pati diukur dengan kemampuan mereduksi tembaga (Cu) dan dinyatakan dalam ”dextrosa ekuivalen” atau
sering disingkat dengan DE. DE mengukur tingkat pemecahan pati ( 0 DE = 100% pati ; 100 DE = 100% dekstrosa. Secara komersial DE merupakan
kandungan gula pereduksi yang dinyatakan sebagai persen dekstrosa terhadap total bahan kering (Kiser,1979 dalam Muchtadi,1992). DE tidak
menyatakan kandungan gula pereduksi dari semua jenis gula yang terdapat dalam produk (Maiden,1970 dalam Muchtadi,1992).
Penggunaan katalis enzim dapat mencegah adanya reaksi sampingan kerena sifat katalis enzim sangat spesifik, sehingga dapat mempertahankan flavour dan aroma bahan dasar (Juadmidjojo,1992).
Likuifikasi dengan menggunakan enzim lebih disukai karena menghasilkan sirup dengan kandungan glukosa rendah dan maltosa tinggi.
Menurut Godfrey and West (1996), dari metode hidrolisis gabungan tersebut dapat dihasilkan sirup dengan komposisi sakarida seperti yang disajikan
pada Tabel 5. Dengan menggunakan α-amilase dari bakteri dihasilkan kadar
glukosa 4%, maltosa 10%, maltotriosa 18% dan dekstrim 68%.
Sakarifikasi merupakan tahap hidrolis lanjutan dari tahap likuifikasi, pada proses sakarifikasi ini dekstrin dipecah lagi secara enzimatik menggunakan enzim Glukoamilase dengan pengaturan berbagai pH
(Mangunwidjaja dan Suryani, 1994), dimana larutan suspensi didinginkan sampai suhu kurang lebih 60ºC, dan pH diatur 4.5 – 5.0, hidrolis dilanjutkan
dengan menggunakan katalisator enzim glukoamilase yang diisolasi dari sejenis fungi (Aspergillus dan Rhizopus) dan dilakukan sakarifikasi selama 18
jam, maka akan diperoleh sejenis sirup yang lebih kaya akan glukosa dari pada sakarida-sakarida lainnya, sirup semacam ini dinamakan sirup glukosa
yang dapat digunakan untuk bahan baku produk lain (Schwimmer, 1981). Menurut De Mann (1997), sirup glukosa adalah cairan gula yang
20% atau lebih. Jika produk yang dihasilkan kurang dari 20% disebut maltodekstrin. DE adalah jumlah gula pereduksi yang dinyatakan sebagai
dekstrosa dan dihitung sebagai prosentase bahan kering. Tabel 3. Tingkat kemanisan beberapa jenis gula
Karbohidrat Tingkat Kemanisan ( % )
Sukrosa Glukosa Fruktosa Galaktosa Maltosa Laktosa Maltitol Manitol Sorbitol Xylitol 100 75-80 175 32 40 20 90 40 60 100 Sumber : Clarke (1997).
Penggunaan α-amilase dari fungi dapat diperoleh kandungan
glukosanya sedikit lebih turun yaitu 3% dibandingkan dengan α-amilase dari
bakteri, akan tetapi maltosanya lebih tinggi sekitar 50%, untuk maltotriosa sebanyak 26%, dan dekstrim 21%. Bila hidrolisis saat sakarifikasi digunakan enzim amiloglukosidase maka dihasilkan sirup dengan kandungan
glukosanya lebih tinggi dibandingkan dengan jenis sakarida lainnya, yaitu sekitar 83%. (Anonim, 1998). Perhatikan tabel 4 dibawah ini :
Tabel 4. Ratio komposisi gula pada sirup glukosa dengan enzim yang berbeda
Sumber : Godfrey and West (1996)
Tabel 5. Syarat Mutu Sirup SNI 01-3544-1994
No Kriteria Uji Satuan Persyaratan
1 Keadaan
1.1 Aroma - Normal
1.2 Rasa - Normal
2
Gula jumlah (dihitung sebagai
sakarosa) % (b/b) Min 65
3 bahan tambahan makanan
Jenis sakarida ά-amilase
3.1 Pemanis buatan - Tidak boleh ada
3.2 Pewarna tambahan
-Sesuai SNI 01-0222-1995
3.3 Pengawet
-Sesuai SNI 01-0222-1995
4 Cemaran Logam mg/kg
4.1 Timah (Pb) mg/kg maks 1.0
4.2 Tembaga (Cu) mg/kg maks 10
4.3 seng (zn) mg/kg maks 25
5 Cemaran Arsen (As) mg/kg maks 0.5
6 Cemaran Mikroba
6.1 Angka lempeng total koloni/ml Maks 5 X 10
6.2 Coliform APM/Ml < 3
6.3 E. Coli APM/Ml negatif
6.4 Salmonela koloni/ml O
6.5 S. aureus koloni/ml
-6.6 Vibrio Cholera koloni/ml negatif
6.7 Kapang koloni/ml maks 50
6.8 Khamir koloni/ml maks 50
Sumber Dewan Standarisasi Nasional (1999).
Tabel 6. Syarat Mutu Glukosa
Komponen Kandungan
Kadar air Kadar abu
Kadar gula reduksi Kadar pati
Logam berat (pb, As, zn) Warna
Maks 20% Maks 1% Min 30% Tidak ada
Negatif
Tidak berwarna, sampai Kekuningan
Sumber SII 0418-81
J. Pemurnian Sirup Glukosa Pati Garut dengan Membran Ultrafiltrasi
1. Membran
Kata membran berasal dari bahasa latin “membrane” yang berarti potongan kain. Saat ini istilah membran didefenisikan sebagai lapisan tipis (film) yang fleksibel, pembatas antara 2 fasa yaitu fasa umpan dan
fasa permeat. Membran dapat tebal atau tipis dengan struktur yang homogen atau heterogen, berupa padatan ataupun enceran. Ditinjau dari
sedangkan bahan kimia adalah bahan yang terbuat dari bahan kimia contohnya polimer (Hartomo, 1992).
Membran berfungsi sebagai agent pemisah yang selektif berdasarkan atas perbedaan koefisien difusifitas, arus listrik atau
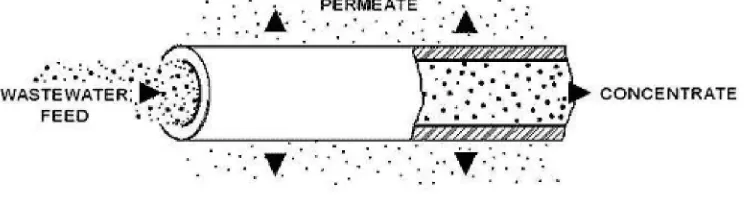
kelarutan,ukuran dan bentuk molekul, menahan komponen dari umpan yang mempunyai pori-pori lebih besar dari pori-pori membran dan melewatkan komponen yang mempunyai ukuran lebih kecil. Larutan yang
mengandung komponen yang tertahan konsetrat dan larutan yang mengalir disebut permeat (Agustina,2008).
Pada kenyataanya membran telah menjadi bagian kehidupan sehari-hari. Semua sel tersusun atas sesuatu yang hidup, termasuk tubuh
kita, dibungkus dengan membran. Membran sel bersifat sangat selektif sehingga hanya zat-zat tertentu saja yang dapat melaluinya (Hartomo,
1992).
2. Macam-macam proses pemisahan membran a. Berdasarkan Perbedaan Tekanan
Menurut (Anonimus,2009), operasi membran menggunakan tekanan sebagai driving force dapat diklasifikasikan sebagai berikut :
• Osmosis balik (RO)
Membran RO digunakan untuk memisahkan zat terlarut yang
memiliki berat molekul yang rendah seperti garam anorganik, glukosa dan sukrosa dari larutannya. Tekanan yang diberikan
pada proses RO berkisar antara 20 – 99 atm (294 -1455,3 psi) jauh lebih tinggi dibandingkan tekanan operasi pada proses
mikrofiltrasi dan ultrafiltrasi.
• Ultrafiltrasi (UF)
Proses ultrafiltarsi berada diantara proses nonultrafiltrasi mikrofiltrasi ukuran pori berkisar antara 1- 100 nm. Ultrafiltrasi dan
mikrofiltrasi merupakan membran porous dimana rejeksi zat terlarut sangat dipengaruhi oleh ukuran dan berat zat terlarut
Membran mikrofiltrasi memiliki ukuran pori antara 0.02 µm. Mikrofiltrasi digunakan pada berbagai macam aplikasi terutama
untuk pemisahan partikel berukuran > 0.1 µm dari larutanntya membran mikrofiltrasi biasanaya beroperasi pada tekanan 0.5 – 5
atm. (7.35 – 73.5 Psi).
• Nanofiltrasi (NF)
Membran nanofiltrasi mempunyai ukuran pori antara 2- 5 nm. Menahan sebagain anion dan melewatkan ion yang kecil dan zat organik dengan BM rendah. Membran ini mempunyai tekanan
operasi 7- 30 atm (102,9 -441 Psi).
Tabel 8. Proses pemisahan membran
Proses membran
Ukuran pori Prinsip
pemisahan
Kegunaan Driving force
(pressure drop) Mikrofiltrasi Ultrafiltrasi Nanofiltrasi Reverse Osmosis
0.02 – 10 µm
1 – 100 nm
2 – 5 nm
< 2 nm
Mekanisme penyaringan Mekanisme penyaringan Pelarutan/ difusi Pelarutan/difusi Sterilisasi kedokteran Farmasi makanan Desalinasi air payau
Desalinasi air laut
7.35 -73.5 Psi
14.7 – 147 Psi
102.9 – 441 Psi
294 -1455,3 Psi
(Hartomo 1992 dan wanten 2001).
b. Berdasarkan Mekanisme Pemisahan
Klasifikasi membran berdasarkan pada mekanisme pemisahan dalam dua golongan yaitu :
• Membran Porous
Pada membran poruus, pori-porinya sangat kecil dengan
menggunakan defenisi ukuran pori dari IUPAC (1985).
- Makropori : > 50 nm
- Mesopori : 2 – 50 nm
Dengan demikian membran untuk mikrofiltrasi, ultrafiltrasi, nanofiltrasi termasuk membran porous. Membran mikrofiltrasi
termasuk makropori dan nanofiltraasi termasuk mikropori.
• Membran Non Porous
Membran ini dikenal sebagai media tebal, dapat digunakan untuk memisahakan molekul dengan ukuran yang sama, baik gas
maupun cairan.
3. Filtrasi Membran
Filtrasi diartikan sebagai pemisahan material dengan mengalirkan umpan melalui suatu membran dimana molekul yang berukuran lebih besar akan tertahan pada permukaan membran (Gutman, 1987).
Teknologi membran telah banyak digunakan dalam berbagai bidang antara lain bioteknologi, farmasi, makanan dan minuman serta
pemisahan keunggulan antara lain :
a. Biaya kapital yang lebih rendah dibandingkan dengan teknologi
pemisahan konvensional.
b. Biaya operasi lebih rendah dibandingkan dengan proses sentrifugasi yang membutuhkan energi tinggi.
c. Dapat scale-up dengan mudah dan dipasang dengan cepat.
d. Merupakan pemisahan yang bersih dan sedikit menimbulkan
kerusakan produk.
4. Jenis Membran
Menurut Merry (1996), bahan material membran untuk proses reserve osmosis, ultrafiltrasi dan mikrofiltrasi menggunakan bahan baku
antara lain terbuat dari polimer, keramik, gelas dan logam. Bahan dari gelas penggunaannya terbatas untuk ultrafiltrasi. Syarat agar suatu bahan dapat digunakan sebagai bahan membran adalah harus mempunyai
syarat bahwa bahan tersebut stabil secara kimia pad kondisi tertentu.ri
keempat jenis bahan
Dari keempat jenis bahan membran, yang paling umum digunakan
politetrafluoroetilen (PTFE). Selulosa asetat memiliki resistensi yang baik terhadap fouling termasuk dengan adnya komponen protein dn lemak.
5. Macam-macam tipe modul membran
Membran tersedia dalam berbagai bentuk yang biasa disebut modul. Menurut merry (1996), modul membran ada empat macam yaitu tubular, spiral wrap, hollow fibre dan plate and frame.
a. Tabular
Modul tabular merupakan membran lurus yang dikelilingi oleh lapisan pendukung berpori (porous sublayer) dan tube penyangga.
Umpan mengalir dibagian dalam sepanjang tube dan permeate melalui membran kedalam lapisan pendukung berpori (porous support
tube) dan lubang-lubang pada porous suport tube. Diameter dalam tube ini berkisar antara 6-40 nm..
Gambar 4. Skema Modul Tubular
Modul ini tidak memerlukan prefiltrasi pada feed dan mudah
dibersihkan serta mudah beradaptasi dengan fluida yang sangat
kental. Kerugian dari pemakian modul ini adalah packing densty-nya rendah sehingga menaikan capital cost.
b. Spiral Wound
Merupakan hasil pengembangan dari modul plate and frame.
Modul ini pertama kali dikembangkan pada pertengahan tahun 1960-an oleh gulf general atomies untuk diaplikasik1960-an pada proses
desalinisasi. Desain modul ini menyerupai susunan sandwich yang terdiri dari dari beberapa membran datar (flate sheet), spacer, dan
sepanjang modul dalam celah yang terbentuk antara specer dan membran atau masuk pada permukaan silidris dari elemen dan keluar
secara aksial.
Gambar 5. Struktur Modul Spiral Wound
Modul spiral wound ini terdiri dari susunan dua membran flat sheet yang dipisahkan oleh plat penyangga berpori, yaitu suatu mesh
permeabel. Membran di segel pada ketiga tepinya sehingga membentuk suatu pocket (kantong) dengan menggunakan epoxy atau polyurethane. Pada tepi satunya lagi (open end) ditempelkan pada
suatu tube central yang berlubang yang digunakan lagi oleh fiberglass
untuk menambah kekuatan mekanik dari membrane
(Anonimus,2009).
c. Hallow Fiber
Merupakan konfigurasi modul yang memiliki packing density
paling tinggi yaitu sekitar 1000 – 10.000 m2/m3.Modul ini terdiri dari susunan serat yang sangat halus disusun menjadi suatu bundel
Gambar 6. Skema Modul Hollow Fiber
Modul hollow fiber dapat dioperasikan dengan aliran umpan kedalam serat (inside-out) atau aliran umpan dari luar serat
(outside-in). Pada umumnya dioperasikan dengan aliran umpan kedalam serat
dengan permeate mengalir secara radikal keluar melalui dinding serat (inside-out), dan hal ini memungkinkan alat untuk dioperasikan pada
tekanan lintas membran yang lebih tinggi karena membran jenis MF dan UF memiliki stabilitas struktural yang tinggi (Anonimus, 2009).
Keuntungan lain dari modul ini ini adalah pada pengolahan air
dengan proses ultrafiltrasi memungkinkan dilakukan backflushing dengan cara mendorong permeate masuk ke dalam membran dengan
tekanan yang lebih besar daripada tekanan feed. Perubahan arah aliran melalui dinding serat akan melepaskan cake partikel yang
tertahan pada permukaan serat, keluar dari modul mengikuti aliran fluida (Malleviale, 1996).
d. Plate dan Frame
Modul ini terdiri atas membran dan plate penyangga (support plate). Membran dan plate disegel dengan menggunakan gasket atau
dapat juga direkatkan langsung dengan heating sel (menggunakan
Gambar 7. Modul Plate and Frame
6. Membran Ultrafiltrasi
Membran ultrafiltrasi adalah teknik pemisahan dengan
menggunakan membran untuk menghilangkan zat terlarut dengan bobot molekul (BM) tinggi, aneka koloid, mikroba sampai padatan tersuspensi
dari air lautan. Membran semipermeabel dipakai untuk memisahkan makromolekul dari larutan. Proses pemisahan menggunakan membran ultrafiltrasi biasanya digunakan di bidang industri dan penelitian untuk
penjernihan air karena ukuran yang dapat diolah adalah air pekat yang mengandung makromolekul yang memiliki berat atom sekitar 103-106 Da
(1 Da = 0,000714 gram) (Malleviale, 1996).
Pengolahan menggunakan ultrafiltrasi pada umumnya
menggunakan membran berukuran 0.001 mikron – 0.01 mikron. Dalam teknologi pemurnian air, membran ultrafiltrasi dengan BM membran 1000-20000 lazim untuk penghilangan pirogen, sedangkan BM membran
80000-100000 untuk penghilangan koloid. Pirogen dengan BM 10000-20000 terkadang dapat dipisahkan dengan membran 80000 karena
adanya membran dinamis. Tekanan sistem ultrafiltrasi biasanya rendah 10-100 psi (70-700 kPa) maka dapat menggunakan pompa sentrifugal
biasa. Membran UF sehubungan dengan pemurnian air dipergunakan untuk menghilangkan koloid (penyebab fouling), mikroba, pirogen, dan
partikel modul higienis (Anonimus, 2009).
Proses membran ultrafiltrasi merupakan upaya pemisahan dengan
membran yang menggunakan gaya dorong. Beda tekanan sangat
Pada ultrafiltrasi ukuran pori membran lebih besar menyebabkan
komponen-komponen yang lebih kecil dapat melewatinya
(Domagola,dkk.2003). Ukuran pori membran berkisar antara 0.5 mm sampai 1 nm (wanten.1999).
Membran ultrafiltrasi pada prinsipnya digunakan untuk menahan koloid dan makromolekul tetapi melewatkan partikel garam dan air (Koch, 2001 dalam Piluharto,2004). Membran ultrafiltrasi merupakan membran
berpori dimana rejeksi ditentukan oleh usuran dan bentuk zat terlarut relatif terhadap ukuran pori dalam membran.Transport pelarut secara
langsung berhubungan dengan besarnya
tekanan
yang diberikan.Membran ultrafiltrasi mempunyai bentuk dan struktur asimetrik dengan lapisan atas lebih padat (usuran pori lebih kecil dan porositas permukaan
lebih rendah) dibanding lapisan bawah akibatnya ketahanan hidrodinamik lebih tinggi (Grunwendel and Whitaker, 1987).
Aplikasi utama membran ultrafiltrasi antara lain: - Dairy (susu, whey, pembuatan keju)
- Pengolahan air
- Pengolahan limbah emulsi minyak
- Pengolahan gandum dalam industri coklat
- Metalurgi (emulsi minyak –air, elektropaint recopvery) (Sumber.I.G.Wanten.2001).
7. Material membran ultrafiltrasi
Ultrafiltrasi menggunakan membran porous dan mempunyai
struktur asimetrik. Membran yang paling banyak digunakan secara
komersial dalam proses ultrafiltrasi dibuat dengan menggunakan proses inversi fasa. Salah satu material membran ultrafiltrasi adalah membran
selulosa acetat.
Bahan mentah sellulosa acetate adalah sellulosa, yang merupakan polisakarida dan didapatkan dari tanaman. Berat molekulnya
bervariasi dari 500.000 s/d 1.500.000 dengan jumlah segmen 3000 s/d 9000.
Ada beberapa keuntungan penggunaan sellulosa asetat material
1. Sifat merejeksi flux dan garam yang tinggi, kombinasi yang jarang ada pada material membran lainnya.
2. Membran sellulosa asetat relatif mudah untuk manufaktur.
3. Bahan mentahnya merupakan sumber yang dapat diperbaharui
(renawable).
Selain itu membran sellulosa asetat juga memiliki kerugian adalah : 1. Sangat sensitif terhadap pH dimana membran selulosa asetat dibatasi
oleh pH antara 2-8. Menurut wenten (2001), membran ini sudah dilaporkan memiliki waktu tinggal 4 tahun pada kondisi normal dengan
pH 4 – 5, waktu tinggal 2 tahun pada pH 6, dan hanya beberapa hari pada pH 1 atau 10. Range pH yang sempit ini merupakan masalah
dalam pengembangan prosedur permbersihan pada membran sellulosa asetat.
2. Sellulosa asetat sangat biodegradabel, sifatnya sangat rentan terhadap mikroba yang terdapat dialam. Dan membran sellulosa asetat relatif tidak tahan lama dalam penyimpanan.
3. Hanya cocok dengan beberapa plastisizer seperti dietil dan dimetil flalat
8. Faktor yang mempegaruhi Ultrafiltrasi
Pada proses ultrafiltrasi, tekanan merupakan faktor penunjang
keberhasilan. Hal ini disebabkan oleh pemakaian membran yang lebih dense (tahan) terhadap hidrodinamik untuk menghasilkan fluks, sama dengan saperti proses mikrofiltrasi (MF) dan osmosi balik (RO). Tekanan
sistem UF biasanya rendah, maka dapat menggunakan pompa diafragma
biasa kebutuhan energinya sesuai desain sistem.
Selain tekanan, waktu operasi juga berpengaruh pada proses
ultrafiltrasi, sebab ketebalan cake terus meningkat terhadap waktu sehingga fluks yang dihasilkan terus-menurun sehingga akan berpengaruh pada performence membran (Wanten, 2000).
9. Fouling dan Konsentrasi Polarisasi
Masalah yang sering timbul dalam proses membran adalah fouling
perfomance proses. Fouling merupakan proses terakumulasinya
komponen – komponen secara permanen akibat filtrasi itu sendiri (Cheryan, 1986). Fouling disebabkan karena tertahannya partikel pada
permukaan membran yang semakin lama semakin menumpuk sehingga
mengakibatkan terjadinya penurunan fluks dan perubahan selektifitas (Henry, 1988).
Secara umum mekanisme fouling dapat diklasifikasikan menjadi
lima jenis yaitu adsorpsi, penyempitan pori, penyumbatan pori, presipitasi dan pembentukan gel. Polarisasi konsentrasi dan fouling dapat
membatasi proses pemisahan dengan membran karena keduanya dapat menyebabkan penurunan fluks permeat sehingga dapat menurunkan
seluruh kinerja membran. Untuk mengatasi hal tersebut, maka perlu dilakukan pencucian terhadp membran pada waktu tertentu, saat
permukaan tidak dapat bekerja lagi secara optimal.
Menurut Cheryan (1986), fouling dapat diminimalkan dengan mengendalikan beberapa faktor antara lain temperatur, tekanan dan
kecepatan crossflow. Selain itu juga perlu dikatakan modifikasi permukaan membran secara kimia untuk menurunkan gaya altractive dan
meningkatkan gaya refulsive antara solute dan membran (Belfort, 1994).
10. Kondisi Proses Membran
Pada proses membran terdapat beberapa faktor yang mempengaruhi nilai fluks. Faktor – faktor tersebut antara lain tekanan transmembran, kecepatan crossflow dan konsentrasi larutan.k terjadi
penurunan fluks
Penentuan tekanan trasmembran optimum bertujuan untuk mengoptimalkan proses sehingga tidak terjadi penurunan fluks. Kondisi saat fluks tidak dipengaruhi tekanan transmembran disebut pressure
independent region. Ian Menurut Cheryan (1986), menyatakan bahwa optimasi tekanan transmembran mampu meminimasi terjadinya fouling.
Pada penelitian yang dilakukan oleh Cappanelli et. al., (1992) dalam proses klarifikasi sari buah jeruk dan lemon, pressure independent region
fluks sudah tidak dipengaruhi oleh tekanan transmembran jika dioperasikan diatas tekanan tersebut.
Kecepatan crossflow merupakan faktor yang amat mempengaruhi
nilai fluks. Semakin tinggi kecepatan crossflow yang digunakana semakin
besar fluks yang dihasilkan, karena semakin banyak partikel dipermukaan membran yang bisa degerakkan oleh aliran umpan (Pritchhard et. al., 1995).
Konsentrasi juga merupakan faktor penting dalam proses membran. Pada penelitian Lo et.al.,1996) tentang pemisahan xantan,
peningkatan konsentrasi akan berpengaruh terhadap penurunan fluks. Dengan mengetahui kondisi optimum proses membran maka fluks
maksimum akan dicapai.
11. Kinerja membran ultrafiltrasi
Kinerja dari membran ditentukan oleh parameter yaitu fluks yang melalui membran. Fluks adalah jumlah volume permeat yang diperoleh
pada operasi membran per satuan waktu dan satuan luas permukaan. Permeabilitas akan menentukan harga fluks yang merupakan volume permeat meliputi tiap satuan luas permukaan membran per satuan waktu.
Fluks dipengaruhi oleh beberapa faktor antara lain konsentrasi umpan, tekanan transmembran, kecepatan crossflow, temperatur umpan
dan waktu. Faktor tersebut memberikan pengaruh yang berbeda-beda bagi fluks (Henry, 1988).
Konsentrasi tekanan fluks yang tinggi menyebabkan penurunan fluks sehingga suatu saat fluks akan bernilai nol. Pada tekanan rendah, fluks akan meningkat secara tidak linear pada peningkatan tekanan
sedangkan pada tekanan tinggi fluks relatif konstant.
Fluks dapat dinyatakan pada persamaan berikut (Wanten,2000): JV = V
A . T
Dimana :
Pada proses filtrasi, terdapat partikel-partikel yang tertahan baik di atas permukaan membran maupun di dalam pori-pori membran. Hal ini
berarti membran memiliki nilai rejeksi terhadap larutan umpan. Nilai atau tingkat rejeksi dihitung dengan mengetahui terlebih dahulu konsentrasi
umpan dan konsentrasi permeat.
Pada proses filtrasi sirup glukosa, diharapkan sirup glukosa memiliki kenaikan konsentrasi karena air dan komponen-komponen lain
yang lolos melalui membran telah terbuang. Pada proses filtrasi ini, sirup glukosa yang memiliki konsentrasi lebih tinggi daripada konsentrasi umpan adalah konsentrasi pada larutan retentate. Retentate adalah
larutan yang komponen-komponennya tertahan di atas permukaan
membran. Pengukuran konsentrasi setelah filtrasi, dilakukan dengan mengukur konsentrasi pada larutan permeat. Permeat berarti larutan
yang komponennya lolos melalui komponen-komponen membran.
12. Aplikasi Proses Membran Dalam Industri
Menurut Roger (1986) proses membran diaplikasikan pada empat bidang
pada skala besar yaitu : a) Bioteknologi
b) Farmasi
c) Makanan dan minuman
d) Pemisahan gas
Proses membran telah banyak diterapkan dibidang makanan dan
minuman. Menurut Gallagher (1996), proses membran biasanya digunakan dalam proses produksi keju dan pemekatan whey, juga
digunakan untuk proses sterilisasi dan stabilitasi pada filtrasi anggur (wine), sari buah dan tangki bir. Pada produk sari buah, proses membran
yang sering digunakan adalah ultrafiltrasi. Penelitian yang dilakukan oleh Capanelli (1992) merupakan proses ultrafiltrasi untuk klarifikasi sari buah
jeruk dan lemo. Proses ini bertujuan untuk memisahkan pilp dan kulit jeruk sehingga didapatkan produk yang murni.
Selain digunakan untuk klarifikasi sari buah, proses membran juga
diinginkan seperti pati, asam amino, komponen warna dan gula pereduksi dapat dihilangkan (Kisihira, 1981).
Membran selulosa asetat pernah digunakan untuk pemekatan air kentang yang merupakan hasil samping dari proses pembuatan pati
kentang. Selain membran tersebut, membran polieter sulfon dapat digunakan untuk pembuatan keju, fraksinasi lignosulfonat dan klarifikasi produk farmasi, sedangkan membran PVDF digunakan untuk klarifikasi
lime juice dan jus buah. Membran keramik ada yang terbuat dari zirconium oxide dan α-alumina. Membran keramik memiliki toleransi lebih tinggi terhadap asam dan alkali dibandingkan membran polimer (Merry, 1986).
K. Analisa Kelayakan Finansial
Analisa kelayakan finansial adalah analisa yang dilanjutkan untuk meneliti suatu proyek layak atau tidak layak untuk proses tersebut harus dikaji, diteliti dari beberapa aspek tertentu sehingga memenuhi syarat untuk dapat berkembang atau tidak. Analisa kelayakan tersebut dibagi menjadi 5 tahap yaitu dengan persiapan, tahap penelitian, tahap penyusunan, tahap evaluasi proyek. Data harga-harga bahan baku dan bahan penunjang lainnya dapat digunakan sebagai dasar perhitungan kelayakan finansial pada produk sirup (Saneto,1994).
Analisa kelayakan finansial dimaksudkan untuk mengetahui apakah perusahan yang direncanakan layak didirikan atau tidak yang bertujuan untuk mengkaji kemungkinan keuntungan yang dapat diperoleh dari suatu perusahan yang didirikan itu (Kadariah,1987).
Metode dan parameter yang dapat digunakan untuk untuk penilaian kelayakan suatu proyek meliputi:
1. Titik impas (BEP/Break Event Point) (Susanto, 1993)
Suatu analisa yang meunjukan hubungan antara keuntungan, volume produksi dan hasil penjualan adalah penentuan Break Event Point
(BEP). BEP adalah suatu keadaan tingkat produksi tertentu yang menyebabkan besarnya biaya produksi keseluruhan sama dengan besar
nilai atau hasil penjualan atau laba. Jadi pada keadaan tertentu tersebut perusahaan tdak dapat keuntungan dan juga tidak mengalami kerugian.
Untuk memperoleh keuntungan maka usaha tersebut harus
ditingkatkan dari pnerimaannya harus berada diatas titik tersebut. Penerimaan dari penjualan dan ditingkatkan melalui 3 cara. Yaitu
menaikkan harga jual per unit, menikkan volume penjualan, dan menaikkan volume penjualan dan menaikkan harga jualnya.
Rumus untuk mencari titik impas adalah sebagai berikut : a. Biaya Titik Impas
b. UnitTitik Impas
Dimana :
Fc : Biaya tetap
Vc : Biaya tidak tetap
S : Harga jual
2. Net Present Value (Tri dan Budi, 1994)
Merupakan selisih antara nilai penerimaan sekarang dengan nilai sekarang. Bila dalam analisa diperoleh NPV lebih besar dari 0 (nol),
berarti proyek layak untuk dilaksanakan, jika dalam perhitungan diperoleh
BEP (Rp) =
Biaya Tetap
1 – (biaya tidak tetap/pendapatan)
BEP (Unit) =
dari NPV lebih kecil dari 0, maka proyek tersebut tidak layak untuk dilaksanakan.
Rumus NPV adalah :
Dimana:
Bt = Penerimaan pada tahun t Ct = biaya pada tahun t
n = umur ekonomi dari suatu proyek i = suku bunga bank.
3. Internal Rate of Return (Susanto dan Saneto, 1994)
Merupakan tingkat mutu bank yang menunjukan persamaan nilai penerimaan kas bersih sekarang dengan jumlah investasi awal dari proyek yang sedang dinilai atau dikerjakan. Dengan perkataan lain IRR
adalah tingkat bunga yang akan menyebabkan NPV = 0. kriteria ini memberikan pedoman bahwa proyek akan dipilih apabila IRR lebih besar
dari suku bunga yang b