BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Penelitian dan Laboratorium Kimia Organik, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara. Penelitian ini dilaksanakan selama lebih kurang 6 bulan.
3.2 BAHAN DAN PERALATAN
3.2.1 Bahan
Pada penelitian ini bahan-bahan yang digunakan antara lain: 1. Biji Pepaya (Carica papaya)
12. Statif dan Klem
3.3.1 Pembuatan Biosorben Biji Pepaya [6]
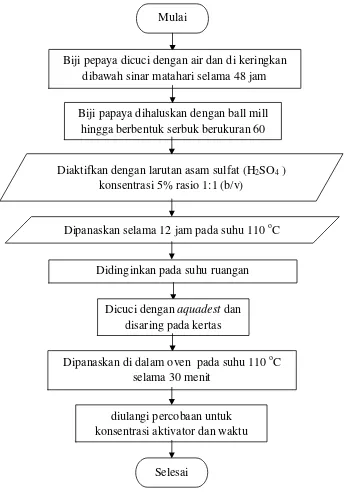
1. Biji pepaya dicuci dengan air lalu dikeringkan di bawah sinar matahari selama 48 jam.
2. Biji pepaya dihaluskan dengan ball mill hingga berbentuk serbuk berukuran 60 mesh.
3. Serbuk biji pepaya diaktifkan dengan larutan asam sulfat (H2SO4) 5% dengan rasio biosorben : asam sulfat (b/v) yaitu 1 : 1 (b/v) dan dipanaskan pada suhu 110 oC selama 12 jam.
4. Setelah dingin, dilanjutkan dengan pencucian beberapa kali menggunakan air untuk menghilangkan pengotor terlarut sampai pH netral.
5. Serbuk biji pepaya disaring dengan kertas whatman No.1, kemudian serbuk biji pepaya dimasukkan ke dalam oven pada suhu 110 oC selama 30 menit.
7. Hasil pengovenan berupa biosorben, dan didinginkan dalam desikator selama 30 menit kemudian dilanjutkan dengan analisis.
8. Prosedur diulangi untuk konsentrasi aktivator 7%, dan 10% serta waktu pemanasan 60 menit, 90 menit, dan 120 menit.
[6].
3.3.2 Prosedur Analisa Penelitian
3.3.2.1 Analisa Bilangan Iodin pada Biosorben [40]
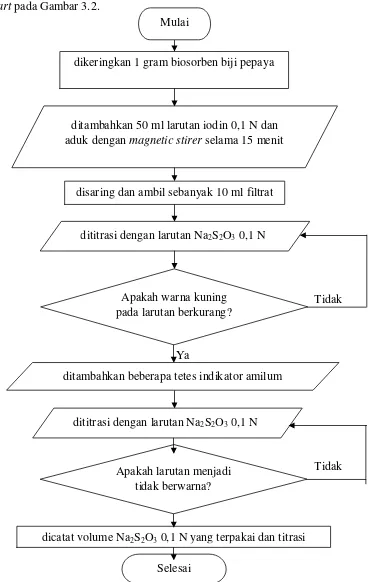
1. Ditimbang 1 gram biosorben biji pepaya yang telah dikeringkan dalam desikator.
2. Selanjutnya tambahkan 50 ml larutan iodin 0,1 N dan diaduk dengan
3. Disaring dan diambil sebanyak 10 ml filtrat. Titrasi dengan larutan Na2S2O3 0,1 N sampai warna kuning berkurang.
4. Selanjutnya tambahkan beberapa tetes indikator amilum 1% dan dititrasi kembali sampai larutan berwarna bening.
5. Catat volume Na2S2O3 0,1 N yang terpakai.
(3.1) Dimana,
V = volume natrium tiosulfat yang diperlukan (ml) N1 = normalitas natrium tiosulfat (N)
N2 = normalitas iodin (0,1 N)
W1 = jumlah iodin untuk setiap 1 ml larutan natrium tiosulfat 0,1 N (12,69 mg/ml)
W2 = massa sampel (g) Fp = faktor pengenceran (5)
3.3.2.2 Analisa Karakteristik Gugus Fungsi Biosorben dengan
Spektrofotometri FTIR [41]
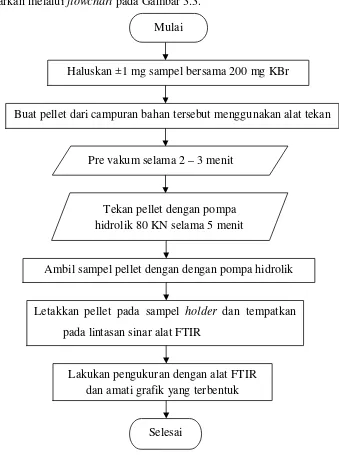
1. Siapkan sampel yang akan diuji dan 200 mg KBr.
2. Ambil ±1 mg sampel haluskan bersama KBr dengan mortar hingga halus. 3. Buat pellet dari campuran bahan tersebut menggunakan alat tekan dan di pre
vakum selama 2–3 menit.
7. Lakukan pengukuran dengan alat FTIR dan amati grafik yang terbentuk. 8. Simpan data yang dihasilkan dan lakukan pembahasan terhadap
3.3.2.3 Penentuan Luas Permukaan Biosorben [11]
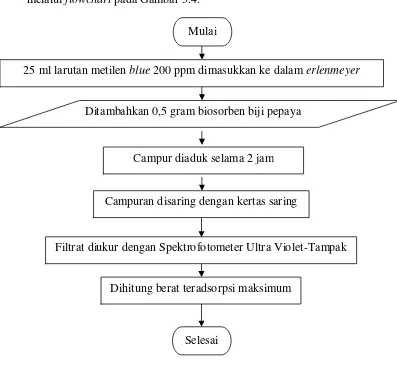
1. Sebanyak 0,5 gram biosorben biji pepaya ditambahkan ke dalam 25 ml larutan metilen biru 200 ppm.
2. Larutan tersebut aduk selama 2 jam dengan kecepatan pengaduk 180 rpm. 3. Hasil pengadukan disaring dengan menggunakan kertas saring.
4. Diukur absorbansi filtratnya dengan menggunakan Spektrofotometer Ultra Violet-Tampak.
5. Hasil pengukuran akan berupa konsentrasi dari filtratnya. 6. Berat teradsorpsi maksimum dimasukkan ke dalam persaman:
(3.2) Keterangan:
S = luas permukaan adsorben (m2/g) N = bilangan Avogrado (6,002 x 10-2mol-1)
Xm = berat adsorbat teradsorpsi (g/g)
3.4 FLOWCHART PENELITIAN
3.4.1 Pembuatan Biosorben Biji Pepaya
Alur proses pembuatan biosorben biji pepaya dapat digambarkan melalui
flowchart pada Gambar 3.1.
Gambar 3.1 Flowchart Pembuatan Biosorben Biji Pepaya
Mulai
Biji pepaya dicuci dengan air dan di keringkan dibawah sinar matahari selama 48 jam
Biji papaya dihaluskan dengan ball mill hingga berbentuk serbuk berukuran 60
Didinginkan pada suhu ruangan
Dicuci dengan aquadest dan
disaring pada kertas
Selesai
Diaktifkan dengan larutan asam sulfat (H2SO4 ) konsentrasi 5% rasio 1:1 (b/v)
Dipanaskan selama 12 jam pada suhu 110 oC
Dipanaskan di dalam oven pada suhu 110 oC selama 30 menit
3.4.2 Analisa Bilangan Iodin pada Biosorben
Alur proses analisa bilangan iodin biosorben dapat digambarkan melalui
flowchart pada Gambar 3.2.
Gambar 3.2 Flowchart Analisa Bilangan Iodin pada Biosorben
Ya
Tidak Mulai
dikeringkan 1 gram biosorben biji pepaya
ditambahkan 50 ml larutan iodin 0,1 N dan aduk dengan magnetic stirer selama 15 menit
dititrasi dengan larutan Na2S2O3 0,1 N
Apakah warna kuning pada larutan berkurang?
dicatat volume Na2S2O3 0,1 N yang terpakai dan titrasi Selesai
disaring dan ambil sebanyak 10 ml filtrat
ditambahkan beberapa tetes indikator amilum
Apakah larutan menjadi tidak berwarna?
3.4.3 Analisa Karakteristik Gugus Fungsi pada Biosorben
Alur proses analisis karakteristik gugus fungsi pada biosorben dapat digambarkan melalui flowchart pada Gambar 3.3.
Gambar 3.3 Flowchart Analisa Karakteristik Gugus Fungsi pada Biosorben
Haluskan ±1 mg sampel bersama 200 mg KBr
Buat pellet dari campuran bahan tersebut menggunakan alat tekan
Pre vakum selama 2 – 3 menit
Tekan pellet dengan pompa hidrolik 80 KN selama 5 menit
Ambil sampel pellet dengan dengan pompa hidrolik
Letakkan pellet pada sampel holder dan tempatkan
pada lintasan sinar alat FTIR
Lakukan pengukuran dengan alat FTIR dan amati grafik yang terbentuk
3.4.4 Flowchart Penentuan Luas Permukaan Biosorben
Alur proses analisis luas permukaan pada biosorben dapat digambarkan melalui flowchart pada Gambar 3.4.
Gambar 3.4 Flowchart Penentuan Luas Permukaan Biosorben 25 ml larutan metilen blue 200 ppm dimasukkan ke dalam erlenmeyer
Campur diaduk selama 2 jam
Campuran disaring dengan kertas saring
Dihitung berat teradsorpsi maksimum
Selesai Mulai
Ditambahkan 0,5 gram biosorben biji pepaya
BAB IV
HASIL DAN PEMBAHASAN
4.1 PEMBUATAN BIOSORBEN DARI LIMBAH BIJI PEPAYA
Pada penelitian ini, biosorben dari bahan baku limbah biji pepaya diaktivasi secara kimia dengan aktivator asam sulfat (H2SO4) pada suhu 110 oC selama 12 jam dan dioptimasi dengan rasio biosorben : asam sulfat (b:v) sebesar 1:1 (b/v), dengan konsentrasi asam sulfat 5%, 7% dan 10%, serta waktu pemanasan di dalam oven sebesar 30 menit, 60 menit, 90 menit, dan 120 menit. Konsentrasi yang digunakan tidak terlalu tinggi karena penambahan asam pada konsentrasi tinggi dapat menyebabkan kerusakan struktur yang diikkuti oleh pemutusan gugus siloksan (Si-O-Si) menjadi silanol (-Si-OH) yang merupakan gugus aktif untuk berinteraksi dengan adsorbat. Asam sulfat digunakan sebagai pengaktif untuk menaktivasi biji papaya dengan tujuan untuk menukar ion yang ada dalam biji papaya menjadi ion H+ dan melarutkan pengkotor – pengkotor yang lainnya. Selain itu asam sulfat sebagai aktivator yang cukup baik. Karena mempunyai ion H+ yang lebih banyak dibandingkan dengan asam-asam yang lainnya dan juga asam sulfat juga memiliki sifat yang higroskopis yang dapat menyerap kandungan air yang terdapat dalam biji pepaya [42]. Sebelum dan setelah diaktivasi, dilakukan analisa bilangan iodin terhadap biosorben (mg I2/g biosorben). Bilangan iodin sebelum diaktivasi adalah 114,21 mg/g.
4.1.1 Pengaruh Waktu Pemanasan dan Konsentrasi Asam Sulfat terhadap Bilangan Iodin Biosorben
Bilangan iodin adalah parameter yang digunakan untuk menentukan kapasitas
adsorpsi biosorben. Bilangan iodin dapat digunakan sebagai pendekatan untuk luas permukaan dan mikropori biosorben dengan presisi yang baik [43].
Penyerapan iodin dengan biosorben berhubungan dengan karakteristik porositas terhadap pengukuran tingkat aksebilitasnya pada molekul. Bilangan iodin
iodin yang rendah dapat diperkirakan struktur pori karbon yang terbentuk lebih
rendah daripada 1,0 nm [44].
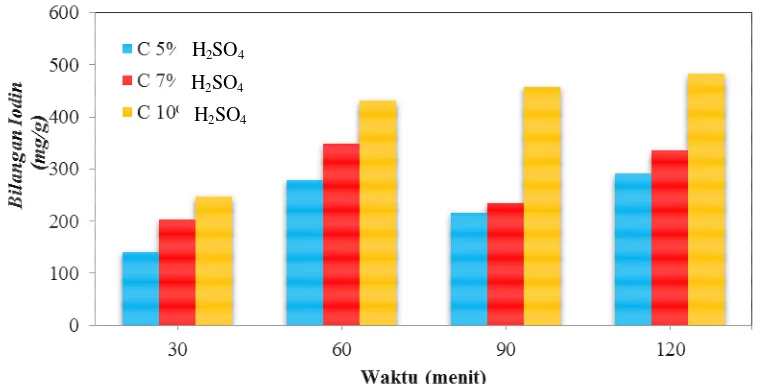
Pada penelitian ini dapat dilihat kapasitas adsorpsi biosorben yang paling baik dari berbagai variasi waktu pemanasan di oven dan rasio konsentrasi aktivator tertentu yang dinyatakan sebagai bilangan iodin (mg/g), yaitu jumlah mg iodin yang dapat diserap oleh setiap 1 gram biosorben, sebagaimana digambarkan melalui grafik pada Gambar 4.1 di bawah ini.
Gambar 4.1 Pengaruh Waktu Pemanasan terhadap Bilangan Iodin Biosorben pada Rasio Konsentrasi Asam sulfat.
Dari grafik pada Gambar 4.1 di atas dapat dilihat bahwa bilangan iodin cenderung meningkat seiring dengan semakin tingginya waktu pemanasan dan konsentrasi aktivator yang tinggi. Bilangan iodin paling besar diperoleh yaitu pada waktu pemanasan 120 menit untuk konsentrasi asam sulfat 10% sebesar 482,22 mg/g.
Pada konsentrasi 5%, 7%, dan 10% asam sulfat (H2SO4) bilangan iodin semakin meningkat seiring dengan bertambahnya waktu pemanasan. Namun pada waktu 90 menit, bilangan iodin kembali menurun untuk masing-masing konsentrasi asam sulfat. Hal ini dapat terjadi karena beberapa kemungkinan. Pertama, perlakuan biosorben pada rasio asam sulfat 5% dan 7% dengan waktu pemanasan 90 menit, pori-pori pada biosorben belum berkembang dengan baik, sehingga belum mampu menyerap iodin dan rusak pada saat pemanasan mencapai nilai tertentu. Kedua,
H2SO4
H2SO4
ketidak merataan biosorben tersebar dalam wadah saat proses aktivasi dilakukan sehingga asam sulfat pada konsentrasi 5% dan 7% pada waktu pemanasan 90 menit tidak efektif dalam memodifikasi biosorben biji pepaya. Ketiga mungkin disebabkan oleh tidak adanya dehidrasi kimia serta kondensasi yang kuat sehingga tidak menghasilkan struktur pori yang besar.
Berdasarkan teori, keunggulan dari aktivasi kimiawi dibandingkan aktivasi fisik yaitu waktu perlakuan yang lebih singkat dan suhu yang lebih rendah diperoleh luas permukaan adsorpsi yang lebih besar dan penambahan mikropori [47]. Waktu modifikasi biosorben yang semakin tinggi akan meningkatkan laju reaksi pengurangan pengotor dan senyawa volatil yang mengisi pori-pori biosorben sehingga mengoptimalkan pembentukan pori aktif. [48]. Semakin meningkatnya waktu pemanasan, pengotor-pengotor yang mulanya terdapat pada bagian pori dan menutup pori ikut terlepas sehingga memperluas permukaan biosorben [39]. Hal ini juga mengakibatkan banyak komponen seperti air dan kandungan volatil keluar dari dalam biosorben. Meningkatnya waktu pengeringan dapat menyebabkan terbukanya mesopori dan mikropori yang meningkatkan ukuran pori biosorben. Besarnya permukaan biosorben yang terjadi ditandai dengan meningkatnya bilangan iodin [37]. Konsentrasi aktivator yang terlalu rendah menyebabkan tidak sempurnanya pembentukan situs aktif, sebaliknya rasio aktivator yang terlalu besar akan menyebabkan rusaknya struktur biosorben [49]. Waktu aktivasi yang semakin lama dapat meningkatkan bilangan iodin suatu adsorben yang dapat ditandai dengan meningkatnya kandungan karbon dalam biosorben tersebut [38].
4.2 KARAKTERISTIK GUGUS FUNGSI PADA BIOSORBEN BIJI PEPAYA DENGAN SPEKTROFOTOMETRI FTIR
(a)
(b)
(c)
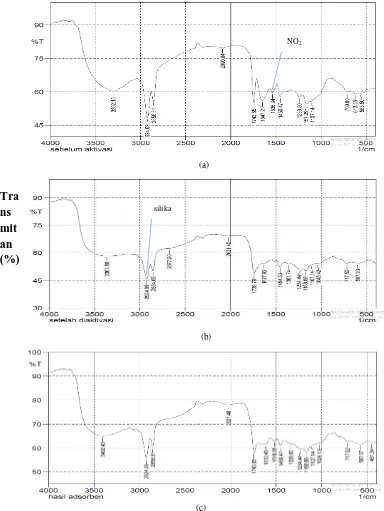
Gambar 4.2 Hasil Spektofotometri FTIR untuk Biosorben Biji Pepaya
(a)sebelum aktivasi, (b) setelah aktivasi, (c) setelah dikontakkan dengan metil biru.
Tra ns mit an (%)
Panjang Gelombang (cm-1) silika
Biosorben sebelum diaktivasi, biosorben yang memiliki bilangan iodin paling besar, serta biosorben yang telah terpakai (spent biosorbent) untuk mengadsorpsi
kandungan zat warna metilen biru selanjutnya dikarakterisasi gugus-gugus fungsinya dengan spektofotometri FTIR. Gugus-gugus yang terdapat pada biosorben dapat disimpulkan dengan membandingkannya dengan literatur, yaitu tabel korelasi IR [39]. Adapun hasil yang diperoleh diberikan pada Gambar 4.2 diatas.
Pada hasil spektofotometri FTIR untuk biosorben biji papaya sebelum diaktivasi terdapat gugus gugus fungsi seperti gugus S-S (senyawa sulfur) dengan panjang gelombang 555, 50 cm-1, gugus C-H (alkena aromatik) dengan panjang gelombang 709,80 cm-1, gugus C=O (karbonil ketonik) dengan panjang gelombang 1743,65 cm-1, gugus C-O (asam karboksilat) dengan panjang gelombang 1157,29 cm -1, gugus O-H (alkohol) dengan panjang gelombang 3302,13 cm-1, gugus NO
Pada hasil spektofotometri FTIR untuk biosorben biji pepaya setelah diaktivasi terdapat gugus gugus fungsi seperti gugus S-S (senyawa sulfur) dengan panjang gelombang 459,05 cm-1, gugus C-H (alkena aromatik) dengan panjang gelombang 717,52 cm-1, gugus C-N (amina) dengan panjang gelombang 1045,45 cm-1, gugus P-O (asenyawa forfor) dengan panjang gelombang 1234,44 cm-1, gugus S=O (sulfonil) dengan panjang 1361,74 cm-1, gugus C-H (alkana) dengan panjang gelombang 2924,09 cm-1, gugus Si-O (senyawa silikat) dengan panjang gelombang 1454,33 cm-1, gugus O-H (alkohol) dengan panjang gelombang 3363,66 cm-1, dan gugus -CO- (aldehid) dengan panjang gelombang 2021,40 cm-1.
(alkena) dengan panjang gelombang 1612,49 cm-1, gugus C=O (karbonil ketonik) dengan panjang gelombang 1743,65 cm-1, gugus -CO- (aldehid) dengan panjang gelombang 2021,40 cm-1, gugus C-H (metil) dengan panjang gelombang 2858,51 cm -1, dan gugus O-H (alkohol) dengan panjang gelombang 3402,43 cm-1.
Dari Gambar 4.2 dapat dibandingkan gugus fungsi yang terdapat pada biosorben, sebelum dan setelah diaktivasi. Dari grafik pada Gambar 4.2 dapat dilihat bahwa proses aktivasi tidak mengubah struktur kerangka dari biosorben biji pepaya, yang ditandai dengan tidak adanya perubahan dari sudut fraksi pada keduanya. Selain itu dapat dilihat bahwa senyawa nitro pada biosorben biji pepaya telah hilang setelah diaktivasi dan digantikan oleh silika (Si-O). Silika memiliki beberapa kelebihan, seperti inert, sifat adsorpsi dan penukar kation yang baik, mudah dimodifikasi dengan senyawa kimia tertentu untuk meningkatkan kinerjanya, kestabilan mekanik dan termal tinggi, serta dapat digunakan menjerap kandungan logam [51]. Senyawa silika merupakan situs aktif yang mampu bertindak sebagai biosorben. Hal ini dikarenakan memiliki atom oksigen yang cukup reaktif, sehingga dengan mudah mengikat atom N+ yang terdapat dalam metilen biru. Sehingga terjadi penyerapan metilen biru oleh senyawa aktif SiO. Silikon oksida memiliki stuktur ikatan kovalen raksasa yang mampu menampung adsorbat yang diserap dengan jumlah banyak [52].
Dari gambar diatas dapat disimpulkan bahwa biosorben yang belum diaktivasi diduga masih ada zat pengkotornya, setelah dilakukan aktivasi, zat pengkotor tadi hilang dan diganti dengan gugus-gugus yang baru yang terdapat dalam biji pepaya tersebut, seperti yang dijelaskan di atas yaitu gugus silika. Dalam biji pepaya terdapat kandungan abu sebesar 15,8 g dalam 100 g biji pepaya. Unsur dari abu yang memiliki efektivitas sebagai senyawa penyerap yaitu senyawa silikon dioksida (SiO2).
merupakan senyawa metil. Pada panjang gelombang 1612,49 cm-1 terdapat ikatan C=C (alkena). Pada panjang gelombang 1743,65 cm-1 terdapat ikatan C=O (karbonil). Pada panjang gelombang 1450,47 cm-1 terdapat ikatan Si-O (silika).
Dari gambar 4.2 dapat dilihat terdapat gugus S=S, C=O, C=C, -CO- dan NO2 gugus ini merupakan gugus kromofor. Gugus kromofor adalah gugus yang menyebabkan molekul menjadi berwarna. Kromofor zat warna reaktif biasanya merupakan sistem azo dan antrakuinon dengan berat molekul relatif kecil. Dengan lepasnya gugus reaktif ini, zat warna menjadi mudah bereaksi [43]. Oleh karena itu, dapat disimpulkan bahwa biosorben dari biji pepaya dapat mengadsorpsi kandungan kromofor yang terdapat dalam zat warna metilen biru.
4.3 PENGARUH WAKTU DAN KONSENTRASI TERHADAP LUAS PERMUKAAN BIOSORBEN.
Luas permukaan biosorben merupakan salah satu karakter fisik yang memiliki peranan penting dimana berhubungan langsung dengan kemampuan adsorpsi biosorben terhadap zat-zat yang dijerap [53]. Luas permukaan diukur dari lapisan monolayer dari standar adsorbat, kemudian nilai numeriknya didapat dari densitas adsorbat dan dimensi molekul [54]. Semakin luas permukaan biosorben, maka memberikan bidang kontak yang lebih besar sehingga semakin banyak adsorbat yang dijerap dan proses adsorpsi semakin efektif [55]. Beberapa karbon aktif memiliki strukur mesopori yang mengadsorpsi ukuran molekul yang medium [56]. Mesopori akan terbentuk seiring dengan terbentuknya mikropori yang dapat meningkatkan kapasitas adsorpsi khususnya adsorbat yang memiliki molekul lebih besar [53].
Penentuan luas permukaan biosorben biji pepaya, pertama-tama dilakukan penentuan panjang gelombang maksimum untuk larutan metilen biru dengan menggunakan spektrofotometer UV-Vis. Pada larutan metilen biru dengan konsentrasi 200 ppm dihasilkan panjang gelombang maksimum pada 664 nm, yaitu pada absorbansi maksimum. Kemudian, kurva standar metilen biru dibuat dengan cara mengukur absorbansi larutan standar metilen biru dengan konsentrasi 20 ppm sampai 200 ppm dengan spektofotometer UV-Vis pada panjang gelombang maksimum. Dari data absorbansi larutan metilen biru pada berbagai konsentrasi dibuat kurva larutan standar metilen biru antara konsentrasi larutan metilen biru terhadap absorbansi berdasarkan hukum Lambert Beer. Grafik konsentrasi larutan
metilen biru terhadap absorbansi dapat dilihat pada gambar 4.3.
Gambar 4.3 Kurva Kalibrasi Larutan Metilen Biru
Persamaan regresi kurva standar metilen biru dinyatakan sebagai y = a + bx, dengan ketentuan y adalah absorbansi dan x adalah konsentrasi larutan metilen biru. Korelasi dinyatakan sempurna jika nilai R2 mendekati 1. Berdasarkan data dan perhitungan didapatkan persamaan regresi linier larutan standar metilen biru adalah y = 0,0103x + 2,729 dengan nilai R2 = 0,9966. Harga R yang diperoleh mendekati 1, maka dapat disimpulkan bahwa nilai koefisien korelasi layak artinya titik-titik pada kurva kalibrasi mendekati lerengnya.
Proses adsorpsi dilakukan secara batch. Dengan menggunakan kurva kalibrasi
Gambar 4.4 Pengaruh Waktu dan Konsentrasi Terhadap Luas Permukaan Biosorben
Pada Gambar 4.4 dapat dilihat pada konsentrasi asam sulfat 5%, 7% dan 10% terhadap waktu 30 menit dengan luas permukaan berturut–turut 9,18715 m2/g; 12,59883 m2/g; dan 14,24785 m2/g. Pada waktu 60 menit dengan luas permukaan berturut–turut 27,23756 m2/g; 23,64525 m2/g; dan 30,54671 m2/g. Pada waktu 90 menit dengan luas permukaan berturut–turut 24,73978 m2/g; 28,88251 m2/g; dan 30,71883 m2/g. Pada waktu 120 menit dengan luas permukaan berturut–turut 26,95477 m2/g; 26,63477; dan 33,43556 m2/g. Pada grafik diatas dapat dilihat pada waktu 60 menit dan 120 menit mengalami fluktuasi pada konsentrasi asam sulfat 5% lebih besar luas permukaan dari pada konsentrasi asam sulfat 7%. Hal ini dapat terjadi atas beberapa kemungkinan. Pertama, pada konsentrasi 7% biosorben membentuk gumpalan-gumpalan yang menyebabkan berkurangnya luas permukaan biosorben [12] dan perpindahan massa yang terjadi saat proses adsorpsi berlangsung menjadi kurang baik. Kedua, penggunaan stirrer yang bersifat magnet menyebabkan
berkumpulnya zat warna metilen biru pada sekitar permukaan stirrer tersebut
sehingga adsorpsi menjadi kurang efisien. Ketiga, pola pengontakan yang kurang sesuai yaitu penuangan biosorben dengan cepat sehingga proses difusi menjadi kurang maksimal.
mencapai titik kesetimbangan, permukaan biosorben semakin meningkat hingga tercapai titik setimbang. Pada saat mencapai titik kesetimbangan biosoroben telah penuh tertutupi oleh metilen biru yang diserap dan biosorben mengalami titik jenuh sehingga biosorben tidak dapat menyerap zat warna lagi [58]. Seiring dengan meningkatnya waktu pemanasan, maka luas permukan akan semakin meningkat dan jika telah mencapai titik optimum maka luas permukaan akan menurun karena pori semakin luas dan dapat merusak dinding antar pori sehingga menurunkan porositasnya [13,41].
Tingginya daya serap zat warna berkaitan dengan efektivitas suatu zat sebagai biosorben. Tingginya daya serap tergantung pada kondisi optimum proses aktivasi yang meliputi konsentrasi zat pengaktivasi, jenis zat pengaktivasi dan lamanya waktu aktivasi [52]. Pengaruh mol asam sulfat sebagai aktivator merupakan salah satu faktor penting yang mempengaruhi kapasitas adsorpsi. Semakin tinggi kandungan mol asam sulfat maka semakin tinggi pula nilai kapasitas adsorpsi dari biosorben tersebut. Nilai kapasitas tukar kation dari masing masing bisorben semakin bertambah dengan kenaikan mol aktivator [59].
Kecepatan adsorpsi awal yang lebih besar pada produksi karbon dengan agen aktivasi konsentrasi yang lebih besar [56]. Mungkin asam sulfat menempati volum yang menghambat penyusutan, sehingga mempermudah pembentukan porositas ketika diekstraksi dengan pencucian. Namun asam sulfat yang berlebihan tidak dapat lebih meningkatkan porositas karena dapat terbentuk lapisan yang terisolasi.
Tarbuoi, et dkk., 2014 uji luas permukaan metilen biru pada algae yang menghasilkan semakin lama waktu pemanasan maka adsorpsi metilen birunya semakin besar [55]. Semakin lama waktu reaksi dapat menyebabkan konversi mikropori menjadi makropori [6]. Jadi, hasil pengukuran luas permukaan adsorben pada berbagai konsentrasi telah sesuai dengan standar luas permukaan adsorben komersial yang ada.
Kapasitas adsorpsi pada biosorben berkaitan pada internal permukaan dan volume pori. Umumnya, area permukaan yang lebih luas spesifik pada biosorben, akan lebih baik performance adsorpsinya. Falahiya(2015) melakukan bahwa aktivasi
keasaaman permukaan serta kemampuan adsropsinya terhadap logam juga meningkat [12].
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Adapun kesimpulan yang dapat diambil dari penelitian ini adalah:
1. Bilangan iodin optimum dari biosorben biji pepaya diperoleh yaitu 482, 22 mg/g pada konsentrasi asam sulfat 10% pada waktu pemanasan 120 menit. 2. Luas permukaan optimum dari biosorben biji pepaya diperoleh yaitu 33,43556
m2/g pada waktu pemanasan 120 menit dengan konsentrasi aktivator asam sulfat 10% .
3. Dari hasil spektofotometri FTIR proses aktivasi tidak mengubah struktur kerangka dari biosorben biji papaya, selain itu proses aktivasi dapat menggantikan senyawa nitro yang ada pada biji papaya menjadi senyawa silika.
5.2 SARAN
Adapun saran yang dapat diberikan kepada peneliti selanjutnya, yaitu:
1. Perlu dilakukan penelitian lebih lanjut untuk mengetahui karakteristik biosorben seperti diameter pori dan porositas untuk menambah informasi tentang karakteristik biosorben dan kesesuaian standar biosorben komersial dan SNI.
2. Dilakukan uji perbandingan dengan biosorben dengan bahan baku, ukuran, rasio, dan waktu yang sama, namun diaktivasi dengan cara karbonisasi untuk mengetahui perbedaan kapasitas adsorpsinya.