2.1. Karsinoma Payudara Invasif 2.1.1. Histologi Payudara
Payudara wanita mayoritas terdiri dari lobules (lobulus/kelenjar yang memproduksi susu), ducts (duktus/pipa yang membawa susu dari lobulus ke puting susu), dan stroma (jaringan lemak dan jaringan ikat yang mengelilingi duktus dan lobulus, pembuluh darah, dan pembuluh limfe). Pada umumnya, karsinoma payudara dimulai di dalam sel yang melapisi duktus. Beberapa dimulai dari sel yang melapisi lobulus, dan sebagian kecil dimulai dari jaringan lainnya.7
Pada wanita, kelenjar payudara adalah organ kulit terspesialisasi yang dikontrol terutama oleh hormon dari sistem reproduksi dan juga oleh plasenta yang merupakan struktur sementara penyedia nutrisi bagi embrio dan fetus.10 Struktur histologi kelenjar payudara bervariasi berdasarkan jenis kelamin, umur, dan status fisiologis.11
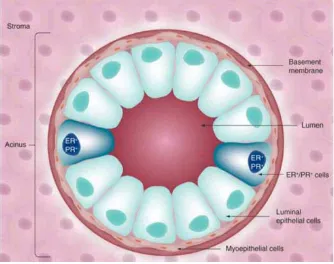
Pada masing-masing sisi, kelenjar payudara berada diatas jaringan subkutan bantalan lemak pectoral didalam kulit dada.10 Satu kumpulan kelenjar payudara menyerupai kelenjar keringat apokrin yang termodifikasi di masing-masing sisi dari dada. Setiap kelenjar dada terdiri dari 15-25 lobus tipe tubuloalveolar dengan fungsi untuk sekresi susu (ASI).11
Setiap lobus, yang dipisahkan satu dengan yang lainnya oleh jaringan ikat padat interlobular dengan banyak jaringan adipose (lemak), mengandung beberapa lobulus kelenjar, dikelilingi oleh duktus interlobular yang lebih besar.10,11,12 Ikatan jaringan ikat padat interlobular, ligamentum suspensorium payudara, berasal dari dermis kulit diatasnya, mengandung pembuluh darah, venul, dan arteriol.10,12
dasar epitel terdapat sel mioepitel kontraktil. Duktus intralobular juga dikelilingi oleh jaringan ikat longgar intralobular yang mengandung fibroblas, limfosit, sel plasma dan eosinofil.10 Kelenjar payudara berdasarkan perbedaan organisasi histologi dibedakan menjadi kelenjar payudara inaktif atau resting dan kelenjar payudara aktif. Kelenjar payudara inaktif lebih didominasi oleh sistem duktus, jaringan ikat dengan jumlah yang sangat banyak, dan hanya sedikit sel kelenjar.10,12 Ukuran dari kelenjar payudara pada wanita yang sedang tidak hamil menunjukkan jumlah jaringan adiposa yang lebih banyak dibandingkan jaringan kelenjarnya. Instrumen sekretori normalnya tidak menyelesaikan perkembangannya kecuali terjadi kehamilan.12
Pada kelenjar payudara aktif (kelenjar tubuloalveolar), terdiri dari pembuluh glandular multiple yang berakhir di alveoli sekretori.12 Selama kehamilan, epitel kelenjar dipersiapkan untuk laktasi. Sel alveolar menjadi sekretori, lalu terjadi pembesaran alveoli dan duktus. Beberapa alveoli mengandung produk sekretori. Namun, sekresi susu oleh kelenjar payudara tidak dimulai hingga partus (melahirkan). Untuk membedakan antara alveoli dan duktus menjadi sulit, dikarenakan duktus ekskretorius intralobular juga mengandung bahan material.10
Dalam persiapan laktasi (sekresi susu), kelenjar payudara melewati perubahan struktural ekstensif. Selama pertengahan pertama kehamilan, duktus intralobularis melewati proliferasi cepat dan membentuk tunas terminal yang berdiferensiasi menjadi alveoli. Pada tahap ini, kebanyakan alveoli kosong dan mirip dengan duktus ekskretorius intralobular kecil. Ketika kehamilan berkembang, jumlah jaringan ikat intralobular menurun sementara jumlah jaringan ikat interlobular bertambah dikarenakan pembesaran dari jaringan glandular.10
Jaringan ikat longgar intralobular mengelilingi alveoli dan duktus. Jaringan ikat yang lebih padat dengan sel adiposa mengelilingi lobulus dan membentuk septum jaringan ikat interlobular. Duktus ekskretorius interlobular yang dilapisi sel kolumnar tinggi, berkumpul di septum jaringan ikat interlobular untuk bergabung dengan duktus laktiferus yang lebih besar, yang biasa dilapisi epitel kolumnar rendah berlapis semu. Duktus eksretorius interlobular terbenam di jaringan ikat yang mengandung sel adiposa.10
Setiap duktus laktiferus mengumpulkan produk sekretori dari lobus dan membawanya ke puting susu.10 Duktus laktiferus memiliki panjang 2-4.5 cm, muncul secara bebas di puting susu, yang memiliki 15-25 bukaan seperti pori dengan diametermasing-masing sekitar 0,5 mm.11
Duktus laktiferus secara bebas muncul dari masing-masing lobus di permukaan puting susu.10
Dekat puting susu, duktus laktiferus akan membesar, membentuk ruangan yang melebar dan meluas yang disebut dengan sinus laktiferus. Biasanya, 15-20 sinus laktiferus terbuka di permukaan masing-masing puting. Lapisan jaringan areolar memisahkan kelompok kelenjar payudara dari otot pektoralis dibawahnya.12
Selama laktasi, kelenjar payudara mengandung banyak jaringan adipose dan mengandung alveoli distensi dalam jumlah banyak. Alveoli yang dipisahkan oleh septum jaringan ikat tipis tersebut berisi hasil sekresi dan vakuola. Beberapa alveoli adalah tunggal, sedangkan yang lainnya bercabang dan menunjukkan pola bercabang ireguler. Septum jaringan ikat interlobular kemudian menurun dikarenakan oleh membesarnya ukuran epitel kelenjar.10
2.1.2. Epidemiologi dan Definisi
Karsinoma payudara adalah penyakit heterogen ekstrim, yang disebabkan oleh interaksi dari kedua faktor risiko yang diturunkan dan lingkungan yang kemudian menjadi akumulasi progresif perubahan sel karsinoma payudara secara genetik dan epigenetik.13
Area dengan risiko yang tinggi adalah populasi Amerika Utara, Eropa, dan Australia di mana 6% wanita mengidap karsinoma payudara invasif sebelum usia 75 tahun. Risiko karsinoma payudara rendah di bagian kurang berkembang seperti Afrika Sub-Sahara, Asia Selatan dan Timur, termasuk Jepang, di mana probabilitas berkembangnya karsinoma payudara pada usia 75 tahun adalah 1/3 negara maju.6
Karsinoma payudara merupakan karsinoma kedua tersering pada wanita dengan persentase insidensi 19-34% dan rata-rata pada umur 47 tahun. Umumnya terjadi pada umur pertengahan, akan tetapi dapat terjadi pada kelompok umur berapapun, setelah 20 tahun.14 Karsinoma payudara adalah keganasan tersering pada wanita dengan 6,6% kasus didiagnosa pada wanita muda dibawah usia 40 tahun.8 Pada 2012, karsinoma payudara didiagnosis pada hampir 1 dalam 200 wanita dibawah usia 40 tahun.15
Sebuah studi oleh Bharat et al16 memperkirakan risiko rekurensi karsinoma payudara untuk wanita yang didiagnosa dibawah 40 tahun 1,53 kali lebih tinggi dibandingkan yang didiagnosa diatas 40 tahun.8 Melihat pada studi yang memeriksa angka risiko karsinoma payudara kontralateral, dapat disimpulkan bahwa usia muda adalah faktor risiko yang kuat.17,18
Karsinoma Duktus Invasif adalah karsinoma paling sering pada wanita yaitu 23% dari semua karsinoma pada wanita secara global dan 27% pada negara maju, lebih dari dua kali lipat keseringan karsinoma di daerah lain.6 Dari seluruh Karsinoma Duktus Invasif, yang memiliki angka insidensi tertinggi merupakan Karsinoma Duktus Invasif tipe non spesial yaitu 70%.14
Karsinoma Duktus Invasif adalah grup tumor heterogen yang tidak memiliki karakteristik cukup untuk diklasifikasikan sebagai tipe histologik. Berbagai istilah telah digunakan untuk mendeskripsikan tumor seperti itu yaitu Schirrhous Carcinoma, Carcinoma Simplex, Spheroidal Cell Carcinoma, Ductal Carcinoma, Carcinoma Not Otherwise Specified (NOS), dan Invasive Carcinoma NST.19
Karsinoma Duktus Tipe Non Spesial adalah grup terbesar dari Karsinoma Payudara Invasif yaitu 55-80%. Seperti semua bentuk karsinoma payudara, Karsinoma Duktus Tipe Non Spesial jarang ditemukan pada pasien dibawah usia 40 tahun.14 Karsinoma Duktus Tipe Non Spesial adalah tipe paling umum dari karsinoma invasif payudara yaitu 40%-75% kasus. Hampir 70-80% Karsinoma Duktus Tipe Non Spesial ditemukan status ER positif dan 15% kasus HER-2 positif.20
Tapi sekarang telah diketahui bahwa asal dari kebanyakan karsinoma payudara adalah duktus terminal unit lobular, di mana sel progenitor payudara dipercaya tinggal. Oleh karena itu, NHSBSP (National Health Service Breast Screening Program) guidelines merekomendasi penggunaan istilah karsinoma invasif tipe non spesial (Invasive Carcinoma NST) dibanding Invasive Ductal Carcinoma.21 2.1.3. Etiologi dan Faktor Risiko
Faktor utama yang mempengaruhi risiko yaitu sebagai seorang wanita dan tua, di mana mayoritas ditemukan pada wanita berusia 50 tahun atau lebih.22 Terdapat 2 jenis faktor risiko yaitu: yang dapat dimodifikasi dan tidak dapat dimodifikasi. Faktor risiko yang dapat dimodifikasi seperti kontrasepsi oral, Indeks Massa Tubuh (IMT) yang rendah dan diet komsumsi tinggi lemak hewani berhubungan dengan peningkatan risiko karsinoma payudara premenopause. Selain itu, penurunan aktivitas fisik dan obesitas meningkatkan risiko pada wanita postmenopause, akan tetapi pada wanita premenopause IMT tinggi berhubungan dengan penurunan risiko karsinoma payudara. Faktor risiko yang tidak dapat dimodifikasi yaitu: riwayat keluarga dan mutasi genetik yang memberi pengaruh pada peningkatan risiko karsinoma payudara pada wanita premenopause.8
Faktor genetika yaitu mutasi dari tumor supresor gen yaitu BRCA1(memiliki risiko 35-45% lebih tinggi dibanding BRCA2) yang terletak pada lengan panjang kromosom 17 dan BRCA2 pada lengan panjang kromosom 13 diperkirakan terlibat dalam risiko tinggi karsinoma payudara.14 Proporsi pasien karsinoma payudara dengan mutasi BRCA1 atau BRCA2 lebih tinggi pada wanita dengan usia dibawah 36 tahun dibandingkan dengan seluruh grup populasi penderita karsinoma payudara.8 Mayoritas dari karsinoma payudara herediter pada Hereditary Breast and Ovarian Cancer (HBOC) disebabkan oleh mutasi pada gen BRCA1 dan BRCA2.15
Penyakit terjadi lebih sering pada wanita dengan menarche yang lebih awal (sebelum usia 12 tahun), tidak pernah melahirkan, atau melahirkan beberapa anak dengan kelahiran pertama pada usia tua (diatas 30 tahun). Selain itu, infertilitas, kurangnya menyusui, menopause terlambat (setelah 55 tahun), aborsi yang diinduksi dan tidak pernah memiliki kehamilan cukup bulan juga meningkatkan risiko penyakit.6,22
mengapa pada pasien muda memiliki presentasi lebih banyak pada tumor agresif adalah tingginya proporsi mutasi BRCA1 dan BRCA2, yang mana diketahui berhubungan dengan tingkat kelas histologi yang lebih tinggi, angka proliferasi lebih tinggi dan negativitas pada ER.8
2.1.4. Diagnosis
Massa yang palpable adalah gejala klinis paling umum dari karsinoma payudara invasif.23 Untuk wanita dibawah 40 tahun, 85% terdeteksi massa yang palpable, sedangkan wanita diatas 40 tahun, 60% terdeteksi lewat skrining.24 Meskipun, biopsi tetap merupakan teknik standar untuk diagnosis baik abnormalitas payudara yang dapat dipalpasi (palpable) dan yang tidak (nonpalpable).19
American Cancer Society memiliki rekomendasi dalam penggunaan MRI tetapi bukan sebagai pengganti melainkan sebagai tambahan daripada mammogram.25 Mammografi adalah metode imaging dasar untuk deteksi karsinoma payudara pada wanita berusia diatas 40 tahun, sedangkan Ultrasound adalah metode pilihan untuk imaging payudara wanita berusia dibawah 40 tahun.23
2.1.5. Penatalaksanaan
Kemoterapi neo-adjuvant diberikan pada pasien setelah diagnosis keganasan telah dibuat tapi diutamakan dari bedah definitif, untuk menurunkan ukuran tumor.26
Secara keseluruhan, hampir 20% dari karsinoma payudara ER+ adalah PR─ di mana tumor ini diketahui memiliki prognosis yang lebih buruk dibanding dengan PR+, akan tetapi tamoxifen memiliki manfaat yang proporsional pada kedua PR+ juga PR─.24
Penatalaksanaan spesifik untuk karsinoma payudara positif HER2 yaitu: Herceptin (trastuzumab), Kadcyla (ado-trastuzumab emtansine) merupakan kombinasi dari Herceptine dan obat kemoterapi Emtansine, Perjeta (Pertuzumab) dan Tykerb (Lapatinib) 27 Terapi positif reseptor hormonal, biasa juga disebut terapi anti estrogen, bekerja dengan menurunkan jumlah estrogen pada tubuh atau memblok menempelnya estrogen ke sel karsinoma payudara. Tipe-tipe terapi hormonal yang dapat dipakai termasuk: SERMs, aromatase inhibitors, ERDs dan LHRHs.25
Bifosfonat memiliki efek yang besar pada osteoklas dan mempengaruhi fungsi sel T, oleh karena itu efektif sebagai pengobatan adjuvant, terutama pada pencegahan atau penghambatan rekurensi dari hasil 10 tahun penyakit tulang.28 2.1.6. Prognosis
Karakteristik prognosis dan manajemen Karsinoma Duktus Invasif Tipe Non Spesial menyerupai atau sedikit lebih buruk, dengan 35-50% 10 tahun kelangsungan hidup, dibandingkan dengan seluruh total kasus karsinoma payudara yaitu sekitar 55% 10 tahun kelangsungan hidup.20
Prognosis dipengaruhi oleh grading histologi, ukuran tumor, status nodus limfe, dan invasi vaskular, juga oleh prediktor respon terapeutik yaitu status ER dan HER-2.20
2.2. Imunohistokimia
membantu pertumbuhan dan fungsi dari sel payudara. Jika sel karsinoma memiliki reseptor hormon, maka obat tersebut dapat membantu memperlambat atau bahkan menghentikan pertumbuhan sel tersebut. Akan tetapi apabila hasilnya negatif terhadap reseptor hormon, maka terapi hormonal tidak akan bekerja.29 Perlu dicatat bahwa beberapa karsinoma payudara yang positif reseptor hormon dapat kehilangan reseptornya pada waktu tertentu, begitu pula sebaliknya, karsinoma payudara negatif reseptor hormon dapat mendapatkan hormon reseptor.30
Terdapat setidaknya 4 subtipe utama karsinoma payudara berdasarkan pola ekspresi gen yang berbeda dan berpengaruh pada prognosis, yaitu Luminal A, Luminal B, tumor over ekspresi HER2 dan tumor triple negative. Yang termasuk dengan Luminal A adalah ER+ dan/atau PR+ dan HER2─ dan biasanya memiliki prognosis yang terbaik. Luminal B adalah ER+ dan/atau PR+ dan HER2+, atau ER+ dan/atau PR+ dan HER2─. Pada tumor over ekspresi yaitu imunohistokimia yang menunjukkan hasil ER─, PR─ dan HER2+ dan tumor triple negative dengan ketiga hasil ER, PR, dan HER2 negatif di mana ketiganya memiliki prognosis yang buruk.8
Studi pada 399 pasien karsinoma payudara dibawah usia 40 tahun oleh Collins et al31 menunjukkan proporsi penyakit Luminal A dibandingkan dengan studi pada populasi karsinoma payudara yaitu 33% dengan 60-70% dan proporsi penyakit Luminal B yaitu 35% dengan 6-22% yang lebih tinggi. 31% dari seluruh tumor menunjukkan over ekspresi HER2, hal ini termasuk presentasi yang tinggi dibandingkan dengan studi pada 1.842 karsinoma payudara di Atlanta oleh Lund et al yaitu 12,6%. Tumor triple negative juga telah ditemukan pada wanita muda dengan karsinoma payudara dengan presentasi mendekati 26%.8
Akan tetapi terdapat beberapa faktor yang dapat mengganggu status reseptor hormon pada karsinoma payudara dan menghasilkan false-negative ER dan/atau false-positive PR seperti fiksasi jaringan yang tidak sesuai, gagalnya ikatan antara antibodi dan ER yang bisa disebabkan mutasi ER sehingga bentuk dari ER berubah atau karena antagonisme kompetitif oleh molekul lain di lingkungan tumor sehingga antibodi tidak dapat berikatan dengan reseptor, anti PR mengalami reaksi silang dengan antigen lainnya, threshold yang berbeda untuk melaporkan immunostaining atau teknik yang kurang sensitif pada imunohistokimia. Oleh karena itulah American Society of Clinical Oncology/College of American Pathologist merekomendasikan tumor dengan ER─/PR+ harus memiliki pengetesan berulang untuk menghilangkan kemungkinan tersebut.32
Gambar 1 Kelenjar Payudara (Progesterone and breast cancer).
2.2.1. Estrogen Receptor (ER)
Telah lama diketahui bahwa produksi ovarian yaitu estrogen sebagai hormon sex steroid mempengaruhi pertumbuhan, diferensiasi, dan fungsi dari kelenjar payudara. Estrogen memediasi efeknya dengan berikatan ke reseptornya yaitu ER.33 ER adalah ligand yang dapat diinduksi oleh faktor transkripsi yang dimiliki oleh nuclear receptor super family, dan bekerja sebagai spesies dimer, selain itu juga merupakan protein spesifik yang bertanggung jawab untuk konsentrasi level fisiologis E2 di jaringan target. Kemudian ditemukan bahwa pasien dengan tumor kaya ER akan memberikan respon terhadap terapi endokrin, di mana pasien dengan tumor ER negatif tidak memberikan respon.34
Estrogen Receptor α berfungsi sebagai ligand yang diaktivasi oleh faktor transkripsi, dengan berinteraksi dengan ERE di regio promoter gen spesifik, modulasi ekspresi gen menghasilkan efek biologis estrogen.33 Di uterus dan kelenjar payudara, ER α adalah reseptor estrogen penting dan lebih banyak muncul dibandingkan ER β. Selain itu, ER α juga terdapat di hati, sementara pada jalur gastrointestinal hanya terdapat ER β.34 Sinyal ekstraseluler juga dapat menstimulasi transkripsi mediasi ER α pada absennya estrogen. Ligand ER α dapat mempengaruhi ekspresi gen dengan cara berasosiasi dengan faktor transkripsi lain tanpa berikatan langsung ke DNA.33
Estrogen Receptor α dan β terutama diregulasi oleh estrogen E2 endogen dan merupakan 2 produk gen yang terpisah. Protein hER α terdiri dari 596 asam amio dengan berat molekul 66 kDa dan berada pada kromosom 6 sementara hER β terdiri dari 530 asam amino residu dengan berat molekul 59 kDa dan berada di kromosom 14.34
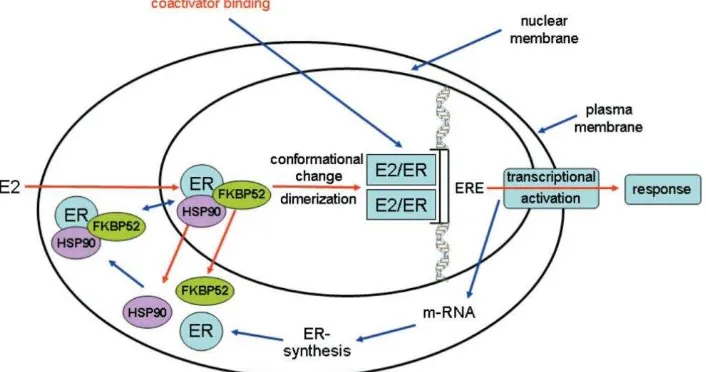
Pada tahap non-aktif, ER muncul sebagai heterokompleks yang terdiri dari HSP90 dan FKBP52. HSP90 berikatan secara langsung ke ER LBD untuk membentuk kompleks yang tidak terlalu stabil lalu distabilkan oleh FKBP52 lewat ikatan langsung ke HSP90 dan interaksi elektrostatikal dengan nuclear localization signal (NLS) di akhir C-terminal dari ER DBD.34
Kompleks inaktif ER terus menerus bergerak bergantian antara nukleus dan sitoplasma dengan lokalisasi nuklear dan urutan eksport nuklear. Estradiol berdifusi melewati membran plasma dan sitoplasma sel kedalam nukleus dimana E2 berikatan dengan ER LBD. Pada saat E2 berikatan ke ER, HSP90 dan FKBP52 berdisosiasi dan reseptor melewati perubahan bentuk menjadi reseptor aktif.34
Setelah bertranslokasi ke nukleus sel target, kompleks dimer reseptor berikatan ke bagian spesifik kromatin yang disebut ERE. Yang menarik adalah sekitar setengah dari target gen ER, yang menghambat siklus sel merupakan pro apoptosis atau adalah sitokin dan faktor pertumbuhan yang berperan dalam menghambat proliferasi, turun regulasinya pada induksi dengan estrogen. Hal ini menunjukkan bahwa estrogen meningkatkan survival sel dengan menurunkan regulasi gen pro apoptosis.35
Ditemukan oleh Jiang S-Y dan Jordan VC bahwa estradiol, tidak menstimulasi tapi menghambat proliferasi sel. Studi berikutnya pada Zajchowski DA et al, Lundholt BK et al dan Lazennec G et al. yang memasukkan ER α ke epitel payudara yang tidak memiliki reseptor, menunjukkan efek inhibitori estradiol pada pertumbuhan sel.33 Walaupun begitu, ekspresi ER α dalam sel karsinoma payudara dengan ER α negatif, terlihat tidak menstimulasi fungsi ER α. Dibandingkan dengan studi lain, Oesterreich et al. mendemonstrasikan ekspresi stabil ER α, di sel karsinoma yang tidak merespon terhadap hormon, menunjukkan kembalinya kontrol estrogen pada proliferasi, walaupun tidak dapat mengembalikan responsivisitas estrogen seperti semula.33
Walaupun begitu pada studi Oesterreich juga ditemukan bahwa sel yang pada awalnya memiliki ekspresi ER α dan telah dibuat kehilangan ekspresinya terlihat tetap bertumbuh, ada kemungkinan bahwa ketika kehilangan ER α tersebut, jalur regulatori pertumbuhan lainnya meningkat misalnya seperti EGF. Reekspresi dari ER α lebih menekan proliferasi, dibandingkan dengan sel yang dihilangkan ekspresi ER α nya, di mana pada sel ini, pertumbuhan tampak lebih cepat dibanding sel ER α positif pada awalnya. ER α tak berligand yang mempengaruhi ekspresi gen, yang terlibat pada proliferasi dan diferensiasi, dan fungsi biologis, menunjukkan bahwa ER α sendiri dapat mempengaruhi sel kanker payudara, bahkan tanpa adanya kehadiran estrogen. 33
Selain itu, hiperaktivasi dari mitogen teraktivasi protein kinase menunjukkan penurunan regulasi ekspresi ER α pada sel karsinoma payudara tapi dengan over ekspresi EGFR. Hal ini sesuai dengan teori tersebut, di mana jalur regulatori lainnya seperti EGFR meningkat regulasinya pada sel dengan ER α negatif sehingga menyediakan stimulus pertumbuhan untuk sistem estrogen dan IGF-I.33
Gambar 2 Mekanisme Aksi Estrogen (Breast Cancer, Estrogen Receptor and Ligands).
2.2.2. Progesterone Receptor (PR)
Progesteron adalah hormon steroid ovarium yang penting untuk perkembangan payudara normal selama pubertas dan dalam persiapan untuk laktasi dan menyusui, secara spesifik meregulasi ekspresi gen target sebagai respon stimulus hormon.36,37 Aksi dari progesteron secara primer dimediasi oleh reseptor berafinitas tingginya, yang melibatkan reseptor klasik progesteron α dan
β, lokasi terdapat pada jaringan yang berbeda, termasuk otak, di mana progesteron
mengontrol kebiasaan dan organ reproduktif juga payudara.36
Isoform PR yaitu ligand teraktivasi oleh faktor transkripsi dan adalah bagian dari reseptor hormon steroid termasuk ER, androgen receptor (AR), glukocorticoid receptor (GR) dan mineralocorticoid receptor yang meregulasi ekspresi gen dengan berikatan langsung atau tidak langsung ke bagian spesifik DNA. Isoform PR secara primer muncul dari respon terhadap ER α dimediasi transkripsi juga dapat terjadi secara independen dari ER.36
koregulator (koaktivator dan korepresor) yang digunakan oleh PR berligand dan tidak berligand, baik untuk meningkatkan atau untuk menekan aktivitas transkripsi, berfungsi untuk modulasi efisien fungsi PR.37
Koaktivator adalah faktor yang dapat berinteraksi dengan reseptor nuklear pada ligand-dependent manner dan meningkatkan aktivitas transkripsionalnya. Korepresor adalah faktor yang dapat berinteraksi dengan reseptor nuklear dan menekan aktivitas transkripsionalnya. Mutasi dari koregulator mungkin akan mempengaruhi fungsi normal PR dan lalu mengganggu perkembangan normal kelenjar payudara yang kemudian menyebabkan karsinoma payudara. Sebagai contoh, mutasi yang diturunkan pada gen BRCA1, yang merupakan salah satu korepresor untuk ER, Androgen Receptor dan PR, akan menyebabkan seluruh jalur ini rusak. Hal ini juga menunjukkan bahwa korepresor dan koaktivator tidak spesifik hanya pada PR karena mereka juga dapat memodulasi transaktivasi reseptor nuklear lainnya.37
Estrogen biasanya juga dibutuhkan untuk menginduksi ekspresi PR dalam sel ER positif. Untuk itu, sulit untuk memisahkan efek progesteron sendiri dari estrogen. Estrogen/ER menyebabkan pertumbuhan dini duktus susu yang menginvasi lemak payudara yang berasal dari puting susu. Sedangkan isoform estrogen/ER dan progesteron/PR bertanggung jawab untuk perkembangan Terminal End-Buds (TEBs) atau asinus yang berlokasi di akhir duktus yang akan menjadi struktur penghasil susu di kelenjar payudara.36 ER meregulasi ekspresi PR, sehingga kehadiran PR biasanya mengindikasikan bahwa jalur ER estrogen berfungsi dan utuh. Pada saat ada ekspresi PR, PR segera teraktivasi oleh hormon progesteron, yang juga menstimulasi pertumbuhan sel tumor. 9 Akan tetapi ekspresi isoform PR tidak dapat diinduksi sebagai respon terhadap estrogen kecuali EGF ada, yang menunjukkan hubungan penting antara reseptor EGF (EGFR) dan/atau HER2 dengan kedua reseptor hormon steroid. 36
rapid signaling tidak diketahui, tapi mungkin sebagai penyedia regulasi positif PR yang mengandung kompleks transkripsi dengan fosforilasi langsung dari PR atau molekul koregulatori. 36
Pada saat progesteron tidak ada, PR adalah kompleks dengan molekul salah satunya adalah HSPs menyebabkan pelipatan protein secara tepat dan penyusunan molekul PR yang stabil yang kompeten untuk mengikat hormon. HSP juga berfungsi untuk mengkoneksikan PR terhadap sistem protein. 36
Progesterone Receptor diaktivasi pada saat berikatan dengan progesteron yang ada secara alami atau via ikatan dengan ligands sintetik seperti progestin. Setelah PR berikatan dengan progesteron, reseptor mengalami perubahan bentuk, disosiasi HSP, dimerisasi, fosforilasi, dan translokasi nuklear, lalu berikatan dengan PRE. Reseptor yang sudah aktif ditahan di nukleus dan berhubungan dengan banyak molekul koregulasi. Reseptor/kompleks koaktivator berikatan langsung ke PREs spesifik dan PRE-like di gen target kemudian menyebabkan peningkatan regulasi transkripsi gen target.36,37 Informasi terbaru mengatakan bahwa sel ER positif /PR positif dapat berproliferasi, akan tetapi ‘ditahan’ dalam tahap nonproliferatif oleh molekul inhibitori seperti TGF β atau level p27 yang tinggi, inhibitor endogen CDKs.36
Kelompok MECs di payudara yang mengekspresikan PR-A dan -B juga akan mengekspresikan ER. PR-B dibutuhkan untuk pengembangan kelenjar payudara normal sedangkan PR-A untuk perkembangan rahim dan fungsi reproduktif. Ada lagi yang dinamakan PR-C yang berguna untuk aktivitas transkripsi, akan tetapi saat diekspresikan dapat meningkatkan aktivitas sel karsinoma payudara atau berfungsi sebagai inhibitor dominan dari PR-B di rahim. 36
dan PR-B mungkin berhubungan dengan perkembangan, progresi atau prognosis karsinoma payudara.37
Seperti juga pada karsinoma dengan ER positif, karsinoma yang memiliki reseptor progesteron maka karsinoma tersebut dikatakan positif reseptor progesteron dan dapat menerima sinyal dari progesteron yang akan meningkatkan pertumbuhan karsinoma tersebut. Secara kasar 2 dari 3 karsinoma payudara adalah positif reseptor hormon.29 Berbeda dengan payudara normal, mayoritas karsinoma payudara mengekspresikan ER dan PR pada waktu diagnosis, walaupun tumor positif reseptor hormon lebih lambat bertumbuh dibandingkan dengan tumor negatif reseptor hormon.36
Sama seperti ER, PR juga berada di nukleus dari 60-70% karsinoma payudara invasif, dengan hasil yang bervariasi dari 0%-100% sel positif. Terdapat korelasi langsung diantara level ekspresi dan respon terhadap terapi hormonal, bahkan
tumor dengan tingkatan yang sangat rendah (≥1% sel positif) memiliki peluang signifikan dalam merespon.9
Sel epitel normal yang berproliferasi adalah reseptor hormon steroid negatif, normalnya pada kelenjar payudara dewasa, ER dan PR ditemukan pada sel epitel luminal minoritas populasi dari sel yang tidak membelah dan berada di sel yang berproliferasi. Sel reseptor steroid positif (ER/PR) muncul hanya mendekati 7-10% populasi sel epitel.36 Penelitian terbaru menunjukkan bahwa sel ER positif/ PR positif dapat bekerja sebagai sel feeder dengan menyediakan substansi yang membantu pertumbuhan.38
2.2.3. Human Epidermal Receptor (HER)
permukaan sel dengan struktur yang terdiri dari LBD ekstraseluler, domain transmembran dan domain tirosin kinase intraseluler. Pengiriman sinyal disini dimediasi oleh setidaknya 12 ligand dan 4 reseptor.39,40
Gen HER-2 berlokasi pada kromosom 17, mengodekan reseptor faktor pertumbuhan pada permukaan sel epitel payudara normal. Ekspresi HER-2 telah dievaluasi pada karsinoma payudara invasif dalam hampir 25 tahun. Studi menunjukkan bahwa gen diperkuat mendekati 15% dari tumor pada pasien dengan karsinoma payudara primer, dan penguatan tersebut sangat berkorelasi dengan ekspresi protein yang meningkat. 9
Gen HER2 yang juga disebut gen ERBB2 (Erb-B2 receptor tyrosine kinase 2), membuat protein HER2 yang merupakan reseptor sel payudara. Normalnya, reseptor HER2 membantu kontrol bagaimana sel payudara sehat tumbuh, membelah, dan memperbaiki dirinya sendiri. Akan tetapi sekitar 25% karsinoma payudara, gen HER2 tidak bekerja dengan baik dan terlalu banyak menggandakan dirinya sendiri (amplifikasi gen HER2). Semua gen ekstra tersebut menyampaikan ke sel payudara untuk membuat terlalu banyak reseptor HER2 (over ekspresi protein HER2) yang menyebabkan sel payudara tumbuh dan membelah secara tidak terkontrol.27
Ketika ligand berikatan dengan domain ekstraseluler, protein HER melewati fase dimerisasi dan transfosforilasi domain intraseluler. Homo/heterodimerisasi menyebabkan autofosforilasi pada residu tirosin didalam domain sitoplasma reseptor dan menginisiasi berbagai jalur sinyal. 41 Homodimerisasi eksperimental dan aktivasi HER2 menyebabkan gangguan tight junction, kehilangan polaritas sel dan proliferasi tak terkontrol pada struktur asinar sel epitel payudara walaupun membran basalis masih utuh dan gambaran invasif tidak diinduksi.40
tipe histologis, dan ER dan PR yang negatif. Bukti membuktikan bahwa amplifikasi HER2 adalah kejadian awal dari pembentukan tumor pada payudara, dan terlihat pada hampir separuh dari seluruh karsinoma duktal in situ tanpa adanya bukti penyakit invasif., tapi status HER2 dipertahankan selama perkembangan ke penyakit invasif, metastasis nodus, dan metastasis.41
Walaupun amplifikasi HER2 terlihat memiliki progresi yang lebih tinggi dan prognosis yang lebih buruk dibandingkan dengan HER2 non-amplifikasi, amplifikasi adalah kejadian awal dan menunjukkan subtipe dari karsinoma payudara bukan stadium dari karsinoma.39
Hubungan antara status HER2 dan hasil klinis itu kompleks dan bervariasi dalam pengaturan. Studi terbaru menunjukkan bahwa HER2 positif pada karsinoma payudara invasif merespon dengan baik pada terapi dengan sasaran protein HER2 (trastuzumab dan lapatinib).9
Tumor dengan HER2 positif adalah tumor yang menunjukkan batas pewarnaan yang kuat (3+ pewarnaan) oleh imunohistokimia pada >30% sel, dan/atau penguatan gen HER2 yang dapat dideteksi dengan in situ hybridization yang di mana tumornya menunjukan pewarnaan membran sirkumferensial yang cukup kuat (2+ pewarnaan). 9
Tumor yang menunjukkan sedikit ekspresi protein atau tanpa ekspresi protein dengan imunohistokimia (0 atau 1+ pewarnaan) hampir selalu memiliki angka normal dari salinan gen HER2 seperti yang dinilai dengan in situ hybridization dan dilaporkan sebagai HER2 negatif. 9